-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNávrh bezpečnostní MR monitorace u pacientů s roztroušenou sklerózou léčených natalizumabem
Proposed MRI Safety Monitoring of Patients with Multiple Sclerosis Treated with Natalizumab
An expert panel of radiologists specialized in MRI monitoring of patients with multiple sclerosis proposes a safety protocol for monitoring of patients with increased risk of progressive multifocal leukoencephalopathy (PML). Patients administered natalizumab for longer than two years in whom anti JC virus antibodies have been detected have a higher risk of developing PML. PML is a rare opportunistic infection that occurs in immunocompromised patients. Over the last decade, PML was reported to be associated with administration of monoclonal antibodies. The disease has high lethality and severe clinical course. There is currently no effective treatment. Early diagnosis, followed by treatment interruption and natalizumab elimination, is the only factor that influences patient prognosis. Regular monitoring with magnetic resonance imaging enables detection of the subclinical stage of the disease, thereby significantly improving patient prognosis. This paper proposes essential MRI safety monitoring (protocol testing, monitoring frequency) and emphasises close cooperation between radiologists and neurologists. It also shows the characteristic MRI features of the disease and discusses published literature summarising early stage findings. The paper seeks to highlight the imaging characteristics that help to distinguish PML from an MS relapse, i.e. the most common differential diagnostic problem.
Key words:
progressive multifocal leukoencephalopathy – magnetic resonance imaging – safety monitoring – natalizumab
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: M. Vaněčková 1; Z. Seidl 1; Pracovní Radiologická Skupina *
Působiště autorů: Oddělení MR, Radiodiagnostická klinika 1. LF UK a VFN v Praze 1
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(6): 663-669
Kategorie: Přehledný referát
* Pracovní radiologická skupina: F. Čáp2, E. Čecháková3, J. Havelka4, M. Keřkovský5, J. Kubále6, J. Lisý7, M. Mrklovský8,9, M. Pažourková10, P. Ryška11, Z. Ryznarová12, R. Tupý13, J. Tesař14 2Radiodiagnostická klinika 3. LF UK a FN Královské Vinohrady, Praha, 3Radiologická klinika LF OU a FN Olomouc, 4Ústav radiodiagnostický, LF OU a FN Ostrava, 5Radiologická klinika LF MU a FN Brno, 6Radiologické oddělení, Nemocnice České Budějovice, a.s., 7Klinika zobrazovacích metod 2. LF UK a FN v Motole, Praha, 8Onkologické a radiologické centrum Multiscan Pardubice, 9Radiodiagnostické oddělení, Nemocnice Pardubického kraje, a.s., 10Klinika zobrazovacích metod LF MU a FN u Sv. Anny v Brně, 11Radiologická klinika LF UK a FN Hradec Králové, 12Pracoviště magnetické rezonance a fokusovaného ultrazvuku, Thomayerova nemocnice, Praha, 13Klinika zobrazovacích metod, LF UK a FN Plzeň, 14Oddělení zobrazovacích metod, Krajská nemocnice T. Bati, a.s., Zlín
Souhrn
Radiologický panel sdružený z radiologů zabývajících se problematikou zobrazení pomocí magnetické rezonance u roztroušené sklerózy navrhuje bezpečnostní monitorační protokol pro sledování pacientů, u nichž je zvýšené riziko výskytu progresivní multifokální leukoencefalopatie. Pacienti, u nichž je natalizumab podáván déle než dva roky a jsou u nich detekovány protilátky proti JC viru, mají vyšší riziko vzniku progresivní multifokální leukoencefalopatie. Jedná se o vzácnou oportunní infekci, která se vyskytuje u pacientů se sníženou imunitou. V posledním desetiletí bylo zaznamenáno toto onemocnění nově v souvislosti s podáváním monoklonálních protilátek. Onemocnění má vysokou letalitu a závažný klinický průběh. V současnosti neexistuje jeho účinná léčba. Jediným faktorem, který ovlivňuje prognózu pacienta, je co nejčasnější diagnóza, následovaná přerušením léčby a zahájením eliminace natalizumabu z organizmu. Magnetická rezonance je schopna detekovat při pravidelné monitoraci toto onemocnění subklinicky, čímž se výrazně zlepšuje prognóza pacienta. Práce předkládá návrh základní bezpečnostní monitorace pomocí magnetické rezonance (protokol vyšetření, frekvence sledování) a klade důraz na úzkou spolupráci radiologů a neurologů. Dále ukazuje charakteristické znaky tohoto onemocnění, diskutuje o dosud publikovaných pracích shrnujících nálezy v časných stadiích a snaží se zdůraznit typické rysy zobrazení, které pomáhají odlišit toto onemocnění od ataky u roztroušené sklerózy, což je nejčastější diferenciálně diagnostický problém.
Klíčová slova:
progresivní multifokální leukoencefalo-patie – magnetická rezonance – bezpečnostní monitorace – natalizumabÚvod
V souvislosti s léčbou monoklonální protilátkou natalizumabem je zvýšené riziko vzniku oportunní infekce – progresivní multifokální leukoencefalopatie (PML). Jedná se o onemocnění způsobené JC virem (název dostal podle jména prvního pacienta, u kterého byl virus izolován – John Cunningham; JCV) patřící k polyoma virům. Onemocnění bylo poprvé popsáno v roce 1958 a do objevení se AIDS šlo o vysoce raritní onemocnění (v období let 1958 – 1984 bylo zaznamenáno celosvětově pouze 230 pacientů) [1,2]. Nyní největší skupinu s onemocněním PML tvoří pacienti s AIDS, kde se vyvine přibližně u 5 % [3]. Další rizikovou skupinou jsou pacienti po transplantacích, chemoterapii, u myeloproliferativního onemocnění a v posledním desetiletí ve zvýšené míře i v souvislosti s léčbou monoklonalními protilátkami (natalizumab, rituximab, efalizumab, alemtuzumab, infliximab aj.) [1,4]. U pacientů s roztroušenou sklerózou (RS) bylo PML popsáno nejen v souvislosti s natalizumabem, ale již byly zaznamenány dva případy při léčbě fingolimodem a čtyři pacienti s léčbou dimetyl-fumarátem [5,6]. K primoinfekci PML dochází nejčastěji v dětství, poté virus perzistuje v ledvinách, kostní dřeni či lymfatické tkáni [7]. Séroprevalence v populaci je udávaná okolo 50 – 60 %. I v dospělosti může docházet k objevení pozitivity protilátek proti JCV (sérokonverze je udávána 1 – 3 % ročně [8,9], novější práce, které sledovaly sérokonverzi u pacientů léčených natalizumabem, uvádějí výskyt až 5 – 10 % [10]). Onemocnění je provázeno velmi vysokou letalitou, což se týká především „klasické PML“. U pacientů léčených natalizumabem je při asymptomatickém záchytu přežití téměř ve 100 %, při diagnóze v symptomatické fázi je letalita 24,6 % [11,12].
Vznik PML je podmíněn několika faktory. Především je to snížená imunita, ať už v důsledku základního onemocnění (AIDS) nebo léčby (chemoterapie, transplantace kostní dřeně, léčba monoklonálními protilátkami). Dalším faktorem je mutace JCV, čímž virus získá neurovirulenci a schopnost vcestovat do centrálního nervového systému, kde se poté nekontrolovaně množí v oligodendrocytech a astrocytech a způsobuje akutní demyelinizaci. Okolnosti této mutace nejsou dosud známy.
U pacientů, kde je PML asociována s podáváním natalizumabu, mohou být klinické příznaky často obtížně odlišitelné od ataky RS. Alarmující jsou především kognitivní poruchy a změny chování. Berger ve své práci uvádí, že nejčastěji jsou přítomny kognitivní poruchy (48 %), motorické příznaky (37 %), poruchy řeči (31 %) a zraku (26 %) [13].
Pro diagnostiku onemocnění jsou v současnosti platná kritéria z roku 2013, která však vycházejí především z diagnostiky „klasické PML“ a neberou zřetel na asymptomatické stadium. Jsou dvě možnosti diagnostiky:
- histopatologický průkaz PML z biopsie v kombinaci s průkazem JCV elektronovým mikroskopem, imunohistochemicky nebo kvantitativní polymerázovou řetězovou reakcí (qPCR);
- možnost již kombinuje zobrazení na magnetické rezonanci (MR) – klinický nález, průkaz JCV DNA v likvoru pomocí PCR a nález na MR vykazující znaky PML.
Mimo definitivní PML jsou v rámci těchto kritérií přípustné dva stupně pravděpodobnosti diagnostiky PML: „PML možná“ při pozitivitě PCR nebo při přítomnosti klinických příznaků a nálezu na MR a „PML pravděpodobná“ při klinickém nálezu a pozitivitě PCR nebo při nálezu na MR a pozitivitě PCR [14 – 16]. Bohužel tato kritéria nezohledňují časnou diagnostiku pomocí MR v asymptomatickém stadiu, kde může být nízký počet kopií DNA, tedy pod detekční schopností daného přístroje, a proto výsledek qPCR může být v této době negativní. V práci Clifforda et al mělo ze souboru 28 pacientů 16 negativní iniciální qPCR z důvodů nízkého počtu kopií ve vztahu k použitému přístroji [17]. Náš poradní radiologický panel prosazuje pro podezření na PML z nálezu na MR používat termín „radiologicky suspektní PML“, který byl popsán v práci Ayzenberga et al a od té doby se začíná mezinárodně prosazovat [18].
Pro pacienta je klíčové, kdy dojde k diagnostice onemocnění. V asymptomatickém stadiu u pacientů léčených monoklonálními protilátkami je téměř 100% přežití a je i výrazně nižší reziduální postižení. Práce Dong Si et al porovnávala z hlediska tíže klinického postižení skupinu pacientů, u nichž bylo onemocnění diagnostikováno subklinicky, s druhou skupinou, u kterých byla diagnóza určena až v symptomatickému stadiu. V případech, kdy došlo k diagnostice onemocnění v asymptomatickém stadiu, bylo průměrné EDSS v době diagnózy 4,1; za 6 měsíců bylo EDSS 4,9. Oproti tomu u pacientů, u kterých bylo PML diagnostikováno již v symptomatické fázi, bylo v době dg EDSS 5,4 a za 6 měsíců vzrostlo na 6,6 [12]. Byl již publikován případ, kde došlo pouze k přechodnému zhoršení klinického stavu [12,19]. Pozitivní znaky předpovídající mírnější průběh onemocnění jsou nižší věk, nižší EDSS v době diagnózy, menší množství kopií JCV DNA v likvoru a rozsah nálezu na MR – drobnější ložisko, unilobární lokalizace.
Rizikové faktory a výskyt PML asociované s terapií natalizumabem
Vysoce riziková je skupina pacientů, u nichž jsou přítomny všechny tři rizikové faktory: pozitivita protilátek proti JCV, předchozí léčba imunosupresivy a délka léčby natalizumabem více než 24 měsíců. Poslední data týkající se stratifikace nebezpečí onemocnění ukazují, že pacienti bez přítomnosti protilátek proti JCV mají riziko 1 : 10 000, oproti tomu nejvyšší riziko (1 : 98) je u pacientů s indexem protilátek vyšším než 1,5 a s délkou léčby 49 – 72 měsíců. Nejnovější doporučení Farmakovigilančního výboru pro posuzování rizik léčivých přípravků (PRAC) při Evropské agentuře pro léčivé přípravky (EMA) k omezení rizik infekce PML z března 2016 se opírá o index protilátek a jeho hodnotu. Současné důkazy ukazují, že u pacientů, kteří nebyli předléčeni imunosupresivy a mají index protilátek nižší než 0,9, je riziko vzniku PML malé, dokonce nižší, než bylo dříve odhadováno. Riziko podstatně stoupá u pacientů s indexem protilátek nad 1,5, kteří byli zároveň léčeni natalizumabem více než dva roky. Při hodnotě indexu ≤ 0,9 je riziko onemocnění stejné jako u pacientů bez přítomnosti protilátek proti JCV (negativních pacientů), posléze sice pomalu stoupá, ale zůstává v jednotkách na 10 000 pacientů. Naproti tomu u pacientů, kde je index > 1,5, se odhaduje nárůst rizika oproti předchozímu algoritmu z 5,3 postupně až na 10/ 1 000 léčených v pátém roce léčby [19].
Celosvětově bylo zaznamenáno od roku 2005, kdy byl popsán první případ natalizumab asociované PML, onemocnění u 614 pacientů. V České republice se do současnosti vyskytlo šest případů, z toho dva byly zachyceny v asymptomatickém stadiu [21].
Nález na MR u pacientů s natalizumab asociovanou PML
Ložiska jsou nejčastěji lokalizována v subkortikální bílé hmotě zahrnující U vlákna, ložisko může zasahovat i do přilehlé šedé hmoty (obr. 1a – c). V práci Wattjese et al, kteří zkoumali MR nálezy v asymptomatickém stadiu, byla nejčastěji postižena bílá i šedá hmota [22]. Oproti tomu práce Hodela et al uvádí, že lokalizace lézí v asymptomatickém stadiu byla pouze subkortikálně (18 ložisek) nebo v oblasti středního mozečkového pedunkulu (čtyři ložiska) [23]. McGulgan et al se ve svém článku zmiňují také o nálezu ložisek subkortikálně, postižení kortexu bylo v 50 % [24]. PML může začínat i v oblasti centrální šedi (přibližně v 5 %) nebo zadní jámy (10 %). V oblasti thalamu může ložisko simulovat lakunární infarkt, což ztěžuje diagnostiku. Nález posléze progreduje a léze se často šíří v průběhu kortikospinálního traktu [16]. Na rozdíl od RS onemocnění PML nepostihuje zrakový nerv a míchu.
Obr. 1. Relaps remitentní forma RS, pacientka léčena natalizumabem od roku 2009, JCV pozitivní, klinicky stabilní. Fig. 1. Female patient with RRMS; treated with natalizumab since 2009, JCV positive, clinically stable. 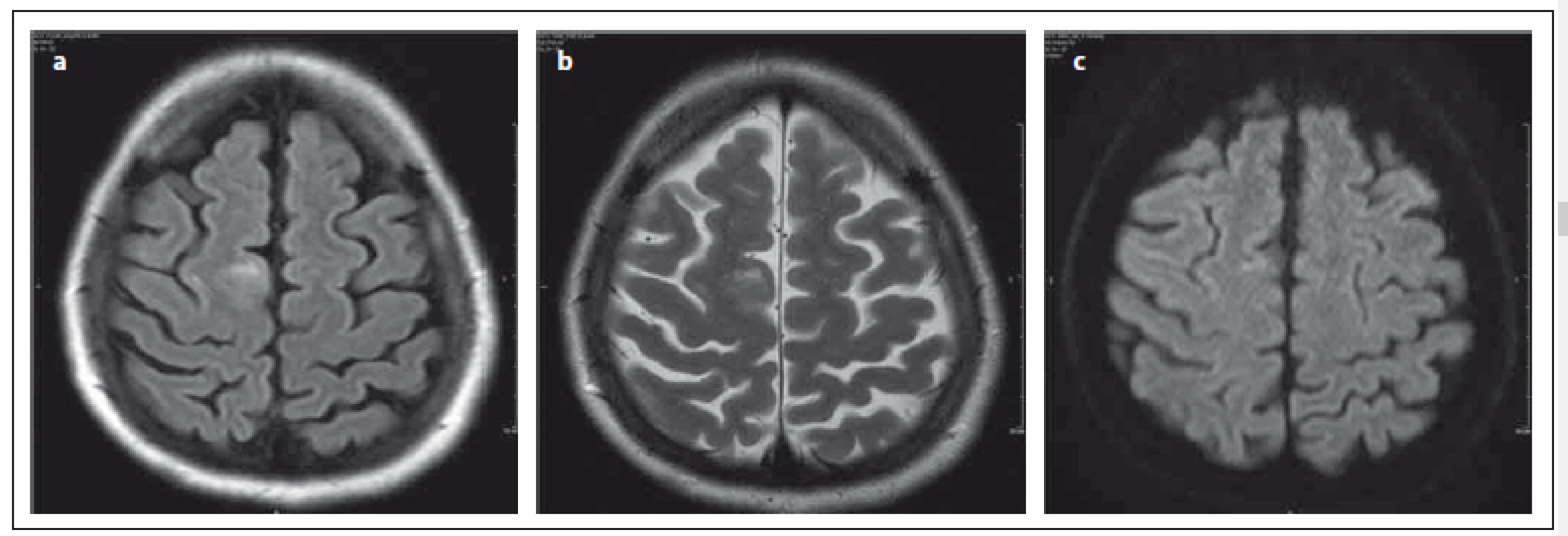
V sekvenci FLAIR i v T2 váženém obraze je patrné neostře ohraničené hypersignální ložisko subkortikálně frontálně l. dx (a, b), na DWI prakticky beze změny signálu (c). Axial FLAIR and T2-weighted image show a discrete hypersignal lesion involving subcortical U-fibres (a,b). The signal is unchanged on DWI (c). Ložiska jsou hypersignální v sekvenci FLAIR (Fluid Attenuated Inversion Recovery), která je i nejvíce senzitivní pro detekci ložisek. V T2 váženém obraze jsou léze hypersignální, sekvence T2 vážený obraz se ukazuje jako optimální pro pro detekci ložisek v centrální šedi a v oblasti zadní jámy, kde především na 2D FLAIR mohou být artefakty. V T2 váženém obraze může být ložisko mikrocystické či v okolí hlavního ložiska se mohou vyskytovat drobné léze. Obraz se připodobňuje k Mléčné dráze, což je typické pro PML, a usnadňuje tak diferenciálně diagnostickou rozvahu (obr. 2a – c). Ložiska u PML jsou nepravidelného tvaru, mohou být difuzní. Léze jsou nepřesně ohraničeny vůči okolní bílé hmotě, nerespektují hranice bílé a šedé hmoty, relativně ostře ohraničeny jsou vůči hmotě šedé. V opozici k výše zmíněnému typickému nálezu u PML jsou ložiska u RS dobře ohraničena vůči okolí, jsou ovoidního tvaru, často lokalizována periventrikulárně, hojná je kalosostriatální orientace. V počáteční fázi PML mohou však být ložiska i drobná, což zhoršuje jejich odlišení od plaky u RS. V T1 váženém obraze mohou být ložiska izosignální na počátku onemocnění, jiné práce uvádějí již od počátku hyposignální korelát [6,16,24].
Obr. 2. Stejný pacient jako na obr. 1., vyšetření za 2,5 měsíce. Fig. 2. The same patient as in Fig. 1, examination 2.5 months later. 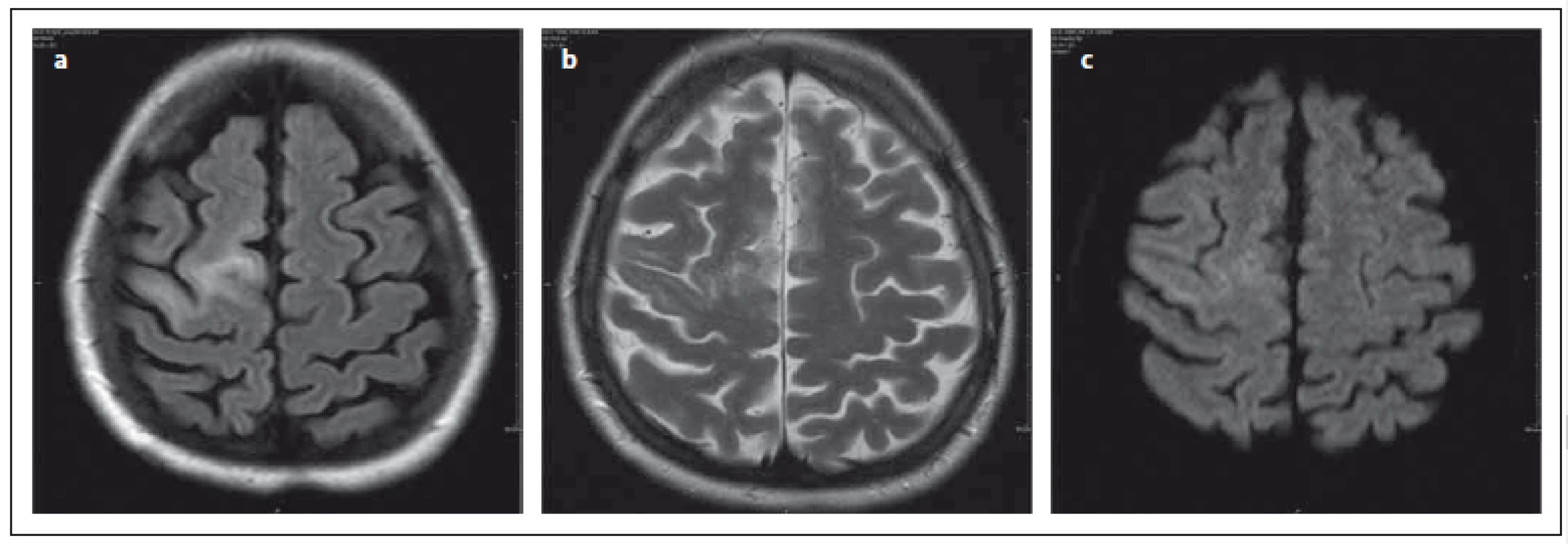
Ložisko se zvětšilo, v okolí ložiska jsou v T2 váženém obraze patrná velmi drobná hypersignální ložiska, která jsou typická pro PML (a, b). Na DWI zcela diskrétní zvýšení signálu (c). Verifikováno pomocí qPCR PML, klinický nález – levostranná hemiparéza. The lesion enlarged, very discrete small hypersignal Milky Way-like lesions nearby, evident on T2-weighted image and typical for PML (a,b). Discrete increase in signal intensity on DWI (c). PML was confirmed with qPCR; clinical finding – left-sided hemiparesis. Lokalizačně je nejčastěji postižen frontální lalok, méně okcipitální a dále parietální, v asymptomatickém stadiu jsou četnosti postižení frontálně > parietálně > okcipitálně [22,23]. Ložiska se nechovají expanzivně. Léze méně často než u RS se sytí po podání kontrastní látky (KL), v časném stadiu až v 30 % (na rozdíl od „klasické PML“, pro kterou je typická nepřítomnost enhancementu) [16]. Některé práce uvádějí patologické sycení po podání KL až ve 40 %, které může být přítomno v časné i v pozdní fázi [24]. Tvar patologického sycení po podání KL může být tečkovitý, pruhovitý, nodulární nebo okrajový, je více nepravidelný než u RS a u PML nemívá tvar neúplného prstence [25]. Okrajové patologické sycení po podání KL mají především rozsáhlejší léze (tab. 1). Práce Hodela et al poukazuje na typické tečkovité patologicky se sytící léze, které autoři pozorovali pouze u PML, nikoliv u RS [23]. Tato ložiska patrná v obraze MR jsou korelátem perivaskulárního zánětu, vyskytují se v hluboké bílé hmotě [16]. Ve své práci Taieb et al uvádějí, že drobné tečkovité patologicky se sytící léze ve frontálním a parietálním laloku a v thalamu mohou předcházet objevení se hypersignálních ložisek v T2 váženém obraze. Pozorovali, že tato drobná patologicky se sytící ložiska po podání KL byla pouze tranzientní, vymizela po šesti týdnech, nová ložiska v T2 váženém obraze se objevila za dva měsíce [26]. Názory na predikci klinického průběhu dle přítomnosti patologického sycení po podání KL se různí. Dle práce Richtera et al sycení nemělo vliv na letalitu. V rozporu s tím je práce Tana et al, kde přítomnost patologického sycení po podání KL v době diagnózy korelovala s nižším přežitím a těžším klinickým postižením [4,27].
Tab. 1. Známky PML na MR. 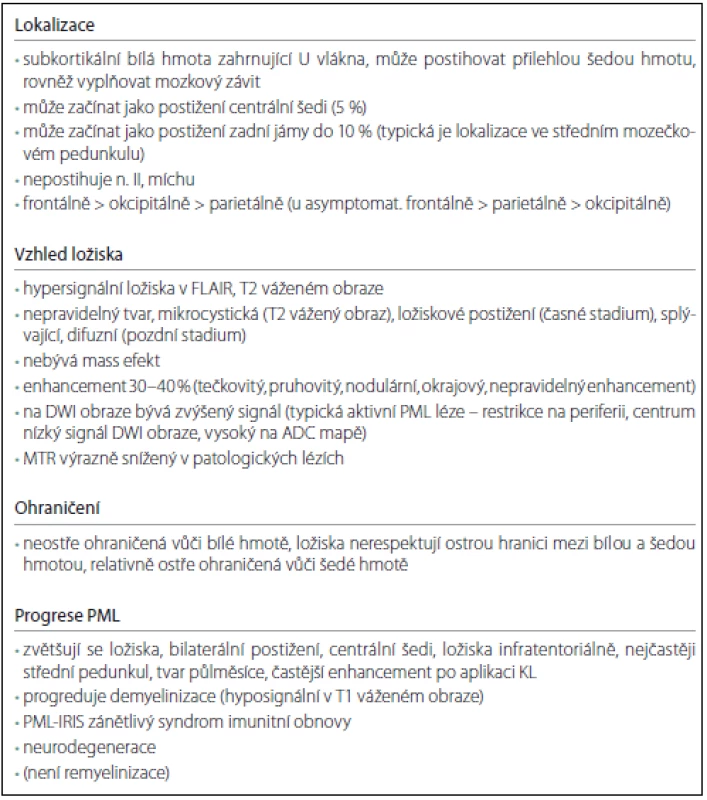
MTR – poměr převodu magnetizace (Magnetization Transfer Ratio). Na difuzně váženém zobrazení (DWI) bývá zvýšený signál. Typické aktivní ložisko má restrikci difuze na periferii ložiska, v oblasti centra je pak nízký signál na DWI a vysoký na Apparent Difusion Coeficient mapě (ADC mapě) [28]. Některá hypersignální ložiska na DWI nemají snížení na ADC mapě, což je dáno efektem prosvítání [16]. V asymptomatickém stadiu nemusí být restrikce difuze přítomna, V práci Wattjese et al bylo 40 % lézí bez restrikce (šest z 15), což mohlo být dáno velikostí a lokalizací ložiska [22,29]. Naproti tomu práce Yousryho et al detekovala v časné fázi onemocnění zvýšený signál na DWI u všech pacientů (15 pacientů) [30]. Většina prací se shoduje, že DWI je velmi senzitivní pro detekci PML postižení, ale není specifická. Může pomáhat ozřejmit PML lézi u chronických splývajících lézí u RS [16,24].
Hodel et al srovnávali vyhodnocení MR nálezů tří nezávislých radiologů, kteří porovnávali zaslepená MR vyšetření u pacientů s PML v asymptomatickém stadiu a u pacientů s RS. Studie zjišťovala, jaké znaky vedly k podezření na PML z obrazu MR. Byla to především hypersignální ložiska na DWI, důležitá byla lokalizace – v oblasti U vláken, špatné ohraničení ložisek vůči bílé hmotě, ostré ohraničení vůči šedé hmotě, drobné tečkovité léze jak v T2 váženém obraze, tak především sytící se po podání KL. Za méně přínosné považovali zasahování do kortexu a snížený signál v T1 váženém obraze [23].
Postupně během týdnů dochází k progresi onemocnění, objem ložisek narůstá kontinuálně, postupně je postiženo více oblastí, ložiska jsou přítomna bilaterálně, často i v centrální šedi a infratentoriálně. Typické pro PML je postižení středního mozečkového pedunkulu, kde má léze tvar půlměsíce; ložisko tohoto tvaru se prakticky nevyskytuje u RS (obr. 3). Jak progreduje demyelinizace, stávají se ložiska hyposignálními v T1 váženém obraze, v pozdních stadiích se objevuje atrofie. U lézí PML na rozdíl od RS nedochází k remyelinizaci.
Obr. 3. Pacientka s chronickou lymfatickou leukemií, karcinomem mammy, léčba rituximabem. Fig. 3. Patient with chronic lymphocytic leukemia, breast cancer; treated with rituximab. 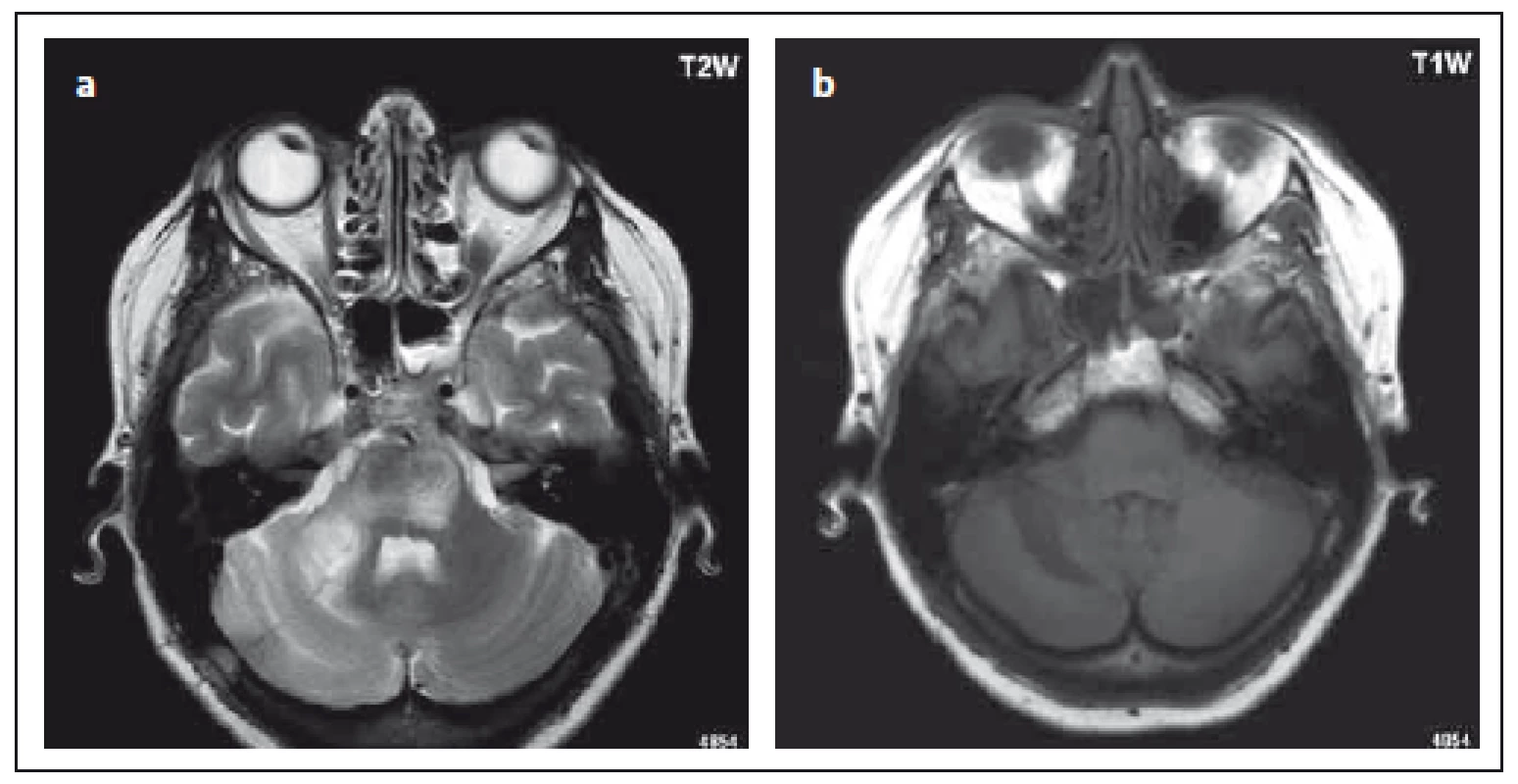
V T2 váženém obraze je patrné typické ložisko tvaru půlměsíce v oblasti středního mozečkového pedunkulu, při tomto vyšetření již pokročilá fáze onemocnění PML, je patrné i rozsáhlé ložisko v oblasti pontu (a). V T1 váženém obraze hyposignální korelát typického půlměsíčního ložiska (b). T2-weighted image shows a typical crescent-shaped lesion in the middle of the cerebellar peduncul; advanced stage of PML; also evident is an extensive lesion in the pons (a). T1-weighted image shows a hyposignal correlate of the typical crescent-shaped lesion (b). Téměř u 100 % pacientů s natalizumab asociovaným PML dojde za několik týdnů po přerušení léčby ke vzniku zánětlivého syndromu imunitní obnovy (Immune Reconstitution Inflammatory Syndrome; IRIS), který je definován jako objevení se nových či zhoršení stávajících klinických symptomů ve spojení s progresí nálezu na MR. Pro IRIS je v obraze MR typické častější a výraznější patologické sycení po podání KL, edém, ložiska se chovají expanzivně, může docházet až k mozkovým herniacím. Práce Wattjese et al hledala retrospektivně časné známky IRISu na MR. Patologické sycení ložisek po aplikaci KL bylo pozorováno v 92,3 %, ostatní typické znaky se nevyskytovaly tak často (mass efekt v 38,9 %, perivaskulární T2 ložiska – v 34,6 %, edém v 26,9 %). Postkontrastní zvýraznění bylo především na okraji ložisek, tečkovitého nebo skvrnitého tvaru [31]. Na druhou stranu je nutné vědět, že ne vždy je IRIS dobře rozpoznatelný z nálezu na MR.
Návrh schématu bezpečnostní MR monitorace
Původní doporučení týkající se bezpečnostní monitorace pacientů léčených natalizumabem byla opakovaně revidována. Zpočátku bylo doporučováno vyšetření na MR v 3 – 6měsíčních intervalech pouze pro pacienty z nejrizikovější skupiny. Poslední doporučení dle SPC zohledňuje míru rizika vzniku PML dle indexu protilátek, délky léčby natalizumabem a předchozí léčby imunosupresivy. Současné doporučení PRAC při EMA zohledňuje míru rizika a u pacientů ve vyšším riziku (tedy se třemi rizikovými faktory nebo u nepředléčených pacientů imunosupresivy, ale s hodnotou indexu nad 1,5 a léčbou delší než dva roky) je doporučeno vyšetření na MR v 3 – 6měsíčních intervalech.
V souladu s literárními údaji a tímto doporučením přijala pracovní radiologická skupina závěr, že každý pacient, který má index protilátek proti JCV vyšší než 1,5, by měl být monitorován v bezpečnostním protokolu v tříměsíčních (max. v šestiměsíčních) intervalech. Vzhledem k možnosti výskytu PML, i když v malému procentu, u všech JCV pozitivních pacientů, doporučuje radiologická pracovní skupina, pokud to provozní možnosti MR oddělení umožní, monitorovat všechny JCV pozitivní pacienty v bezpečnostním protokolu v tříměsíčních intervalech (max. v šestiměsíčních), aby mohlo být PML diagnostikováno co nejčasněji [29,32,33]. Monitorace by měla být prováděna od 24 měsíců trvání léčby (resp. nejlépe již od 18. měsíce – slouží jako výchozí stav pro bezpečnostní MR monitoraci), vzhledem k nutnosti porovnání nálezu na MR a nárůstu rizika vzniku od dvou let léčby. Onemocnění PML se může vyvinout i několik měsíců po ukončení léčby. Proto by měla monitorace probíhat ještě šest měsíců od ukončení léčby [34].
V rámci bezpečnostní monitorace doporučujeme následný protokol vyšetření, který obsahuje v základní variantě tři sekvence FLAIR 2D či 3D (optimálně 3D FLAIR či 2D s tloušťkou řezů max. 3 mm) v transverzální rovině řezu či transverzální rekonstrukci, T2 vážený obraz v transverzální rovině řezu a DWI (tab. 2). Realizace vlastních bezpečnostních MR vyšetření v rámci monitorace jsou plně v kompetenci radiologů, pravidelné objednání pacientů na vyšetření a dodržování monitorovacího časového schématu je v rukou ošetřujících neurologů. Tedy optimální bezpečnostní monitorace závisí na úzké spolupráci jak radiologů, tak klinických lékařů. V žádosti o vyšetření by mělo být uvedeno, že pacient je léčen natalizumabem (či byl léčen do šesti měsíců od ukončení) a že je zvýšené riziko onemocnění PML, resp. informace, zda je pacient JCV pozitivní a jak dlouho je léčen natalizumabem (titr protilátek, event. výskyt klinických příznaků). Radiologická pracovní skupina dále navrhuje všechny pacienty léčené natalizumabem jedenkrát ročně vyšetřit v rozšířeném protokolu, kde bude vyhodnocována aktivita onemocnění, resp. účinnost léčby u daného pacienta [35]. Toto doporučení je ve shodě s PRAC při EMA, kde se doporučuje pacienty s negativními protilátkami či při indexu ≤ 0,9 monitorovat alespoň jedenkrát ročně na MR.
Tab. 2. Bezpečnostní protokol (základní, minimální verze). 
Každé nové ložisko u pacienta s protilátkami proti JCV léčeného dva roky a více, který je na dané léčbě stabilní, je nutno zvažovat jako možné potenciální ložisko PML a v diferenciální diagnostice by měla být diagnóza PML vždy zvažována [16,29]. Tito pacienti by měli být konzultováni s radiologem zabývajícím se RS problematikou na daném pracovišti. Při diagnostických pochybnostech je možnost konzultovat nález se superkonziliárním centrem v České republice (Oddělení MR, Radiodiagnostická klinika 1. LF UK a VFN v Praze) nebo v zahraničí (podpora firmy Biogen). Práce Wattjese et al se zabývala schopností jednotlivých hodnotitelů diagnostikovat PML v časné fázi, určit, zda se na následné MR kontrole vyskytuje nové ložisko a zda toto ložisko je označeno jako plaka u RS či ložisko u PML. Byla nalezena jen střední shoda mezi hodnotiteli. Rozdíly byly především v senzitivitě detekce nových ložisek, specificita byla vyšší u PML ložisek než RS ložisek (senzitivita pro detekci PML ložisek v asymptomatickém stadiu 59,5 %, specificita 91,7 %). Práce ukázala, jak může být v časných fázích obtížné odlišení těchto ložisek [32]. Důležité jsou zkušenosti hodnotících lékařů, rovněž znalost časných známek u asymptomatického PML. Nezbytné je pečlivé srovnání obou vyšetření. Pro rozpoznání diskrétních změn je nutné sledování ve stejném protokolu vyšetření, a pokud to okolnosti umožňují, provádět vyšetření na shodném přístroji, což prosazuje náš radiologický panel.
Při klinickém podezření je třeba provést MR vyšetření co nejdříve (maximálně v řádu dnů), kontrolní vyšetření opakovat přibližně po týdnu a poté každých 14 dní, dokud není suspekce na PML minimalizována. Zvýšená frekvence monitorace při potvrzení PML pokračuje dále, abychom zjistili rozsah postižení a především časně odhalili IRIS. Tabulka 3 ukazuje nejčastější nálezy či typické znaky u PML, jejichž přítomnost budí podezření na PML.
Tab. 3. Kritické znaky – red flags v časném stadiu. 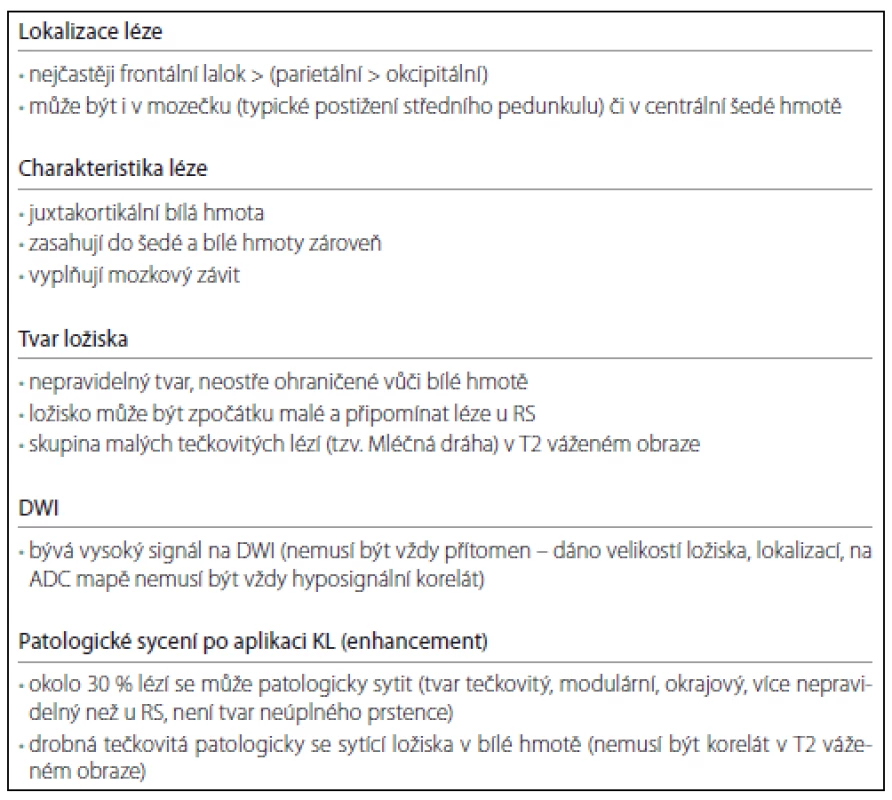
Závěr
Cílem předkládaného návrhu je maximálně urychlit diagnostiku „radiologicky suspektního PML“. Pro toto onemocnění v současnosti neexistuje účinná léčba a jediné, co může pozitivně ovlivnit prognózu pacienta, je co nejrychlejší diagnostika. Včasná diagnostika vede k okamžitému přerušení léčby a zahájení eliminace pomocí plazmaferézy (užití plazmaferézy je v současné době revidováno), což je v současnosti zásadní faktor ovlivňujícím tíži průběhu onemocnění. Pro dosažení tohoto cíle, resp. diagnostiky PML v subklinickém stadiu, je nezbytná úzká spolupráce radiologa a neurologa a dodržování pravidelné MR monitorace.
Seznam použitých zkratek
ADC – zdánlivý difuzní koeficient (Apparent DiffusionCoefficient)
AIDS – syndrom získaného selhání imunity (Acquired Immune Deficiency Syndrome)
DNA – deoxyribonukleová kyselina (Deoxyribonucleic Acid)
DWI – difuzně vážený obraz (Diffusion Weighted Imaging)
EDSS – škála míry klinického postižení (Expanded Disability Status Scale)
EMA – Evropská agentura pro léčivé přípravky (European Medicine Agency)
FLAIR – Fluid Attenuated Inversion Recovery
IRIS – akutní imunitní reakce (Immune Reconstitution Inflammatory Syndrome)
JCV – John Cunningham virus
KL – kontrastní látka
MR – magnetická rezonance
PML – progresivní multifokální leukoencefalopatie
PCR – polymerázová řetězová reakce (PolymeraseChain Reaction)
PRAC – farmakovigilanční výbor pro posuzování rizik léčivých přípravků (Pharmacovigilance Risk Assessment Committee)
RS – roztroušená skleróza
Práci podpořila společnost Biogen a výzkumný záměr RVO VFN 64165.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Manuela Vaněčková, Ph.D.
Oddělení MR
Radiodiagnostická klinika
1. LF UK a VFN v Praze
Kateřinská 30
128 08 Praha
e-mail: man.van@post.cz
Přijato k recenzi: 17. 5. 2016
Přijato do tisku: 13. 7. 2016
Zdroje
1. Keen DL, Legare C, Taylor E, et al. Monoclonal Antibodies and Progressive Multifocal Leukoencephalopathy. Can J Neurol Sci 2011;38(4):565 – 71.
2. Sahraian MA, Radue EW, Eshaghi A, et al. Progressive multifocal leukoencephalopathy: a review of the neuroimaging features and differential diagnosis. Eur J Neurol 2012;19(8):1060 – 9.
3. Tan CS, Koralnik IJ. Progressive multifocal leukoencephalopathy and other disorders by JC virus: clinical features and pathogenesis. Lancet Neurol 2010;9(4):425 – 37. doi: 10.1016/ S1474-4422(10)70040-5.
4. Weissert R. Progressive multifocal leukoencephalopathy. J Neuroimmunol 2011;231(1 – 2):73 – 7. doi: 10.1016/ j.jneuroim.2010.09.021.
5. Honce JM, Nagae L, Nyberg E. Neuroimaging of Natalizumab Complications in Multiple Sclerosis: PML and Other Associated Entities. Mult Scler Int 2015,2015 : 809252. doi: 10.1155/ 2015/ 809252.
6. Rosenkrantz T, Novas M, Terborg C. PML in a patient with lymphocytopenia treated with dimethyl fumarate. N Engl J Med 2015; 372(15):1476 – 8. doi: 10.1056/ NEJMc1415408.
7. Rozsypal H, Jilich D, Hubacek P, et al. Úskalí diagnostiky progresivní multifokální leukoencefalopatie u pacientů infikovaných lidským virem imunodeficience – kazuistiky. Cesk Slov Neurol N 2013;76/ 109(4):501 – 7.
8. Horáková D, Havrdová E. Protilátky proti JC viru a stratifikace rizika progresivní multifokální leukoencefalopatie u pacientů s roztroušenou sklerózou. Doporučení k použití nového testu STRATIFY JCVTM. Neurol Praxi 2011;12(5):364 – 5.
9. Egli A, Infanti L, Dumoulin A, et al. Prevalence of Polyomavirus BK and JC Infection and Replication in 400 Healthy Blood Donors. J Infect Dis 2009;199(6):837 – 46.
10. Trampe AK, Hemmelmann C, Stroet A, et al. Anti-JC virus antibodies in a large German natalizumab-treated multiple sclerosis cohort. Neurology 2012;78(22):1736 – 42. doi: 10.1212/ WNL.0b013e3182583022.
11. Dong-Si T, Richman S, Wattjes MP, et al. Outcome and survival of asymptomatic PML in natalizumab-treated MS patients. Ann Clin Transl Neurol 2014;1(10):755 – 64. doi: 10.1002/ acn3.114.
12. Dong-Si T, Gheuens S, Gangadharan A, et al. Predictors of survival and functional outcomes in natalizumab-associated progressive multifocal leukoencephalopathy. J Neurovirol 2015;21(6):637 – 44. doi: 10.1007/ s13365-015-0316-4.
13. Berger JR. The clinical features of PML. Cleve ClinJ Med2011;78(Suppl 2):S8 – 12.
14. Berger JR, Aksamit AJ, Clifford DB, et al. PML diagnostic criteria: consensus statement from the AAN Neuroinfectious Disease Section. Neurology 2013;80(15):1430 – 8. doi: 10.1212/ WNL.0b013e31828c2fa1.
15. Chalkley JJ, Berger JR. Progressive multifocal leukoencephalopathy in multiple sclerosis. Curr Neurol Neurosci Rep 2013;13(12):408. doi: 10.1007/ s11910-013-0408-6.
16. Wattjes MP, Richert ND, Killestein J, et al. The chameleon of neuroinflammation magnetic resonance paging characteristics of natalizumab – associated progressive multifocal leukoencephalopathy. Mult Scler 2013;19(14):1826 – 40. doi: 10.1177/ 1352458513510224.
17. Clifford DB, DeLucca A, Simpson DM, et al. Natalizumab-associated progresive multifocal leukoencefalopathy in patiens with multiple sclerosis: lessons from 28 cases. Lancet Neurol 2010;9(4):438 – 46. doi: 10.1016/ S1474-4422(10)70028-4.
18. Ayzenberg I, Lukas C, Trampe N, et al. Value of MRI as a surrogate marker for PML in natalizumab long-term therapy. J Neurol 2012;259(8):1732 – 3.
19. Blair NF, Brew BJ, Halpern JP. Natalizumab-associated PML identified in the presymptomatic phase using MRI surveillance. Neurology 2012;78(7):507 – 8. doi: 10.1212/ WNL.0b013e318246d6d8.
20. Plavina T, Subramanyam M, Bloomgren G, et al. Anti-JC virus antibody levels in serum or plasma further define risk of natalizumab-associated progressive multifocal leukoencephalopathy. Ann Neurol 2014;76(6):802 – 12. doi: 10.1002/ ana.24286.
21. Štětkářová I, Medová E, Bučilová V, et al. Progresivní multifokální leukoencefalopatie u nemocné s roztroušenou sklerózou léčenou natalizumabem. Ces Radiol 2013;67(1):35 – 8.
22. Wattjes MP, Vennegoor A, Steenwijk MD, et al. MRI pattern in asymptomatic natalizumab-associated PML. J Neurol Neurosurg Psychiatry 2015;86(7):793 – 8. doi: 10.1136/ jnnp-2014-308630.
23. Hodel J, Outteryck O, Dubron C, et al. Asymptomatic progressive multifocal leukoencephalopathy associated with natalizumab: diagnostic precision with MR imaging. Radiology 2016;278(3):863 – 72. doi: 10.1148/ radiol.2015150673.
24. McGulgan C, Craner M, Guadagno J, et al. Stratification and monitoring of natalizumab-associated progressive multifocal leukoencephalopathy risk: recommendations from an expert group. J Neurol Neurosurg Psychiatry 2016;87(2):117 – 25. doi: 10.1136/ jnnp-2015-311100.
25. Blair NF, Brew BJ, Halpern JP. Natalizumab-associated PML identified in the presymptomatic phase using MRI surveillance. Neurology 2012;78(7):507 – 8. doi: 10.1212/ WNL.0b013e318246d6d8.
26. Taieb G, Renard D, Thouvenont E, et al. Transient punctate enhancing lesions preciding natalizumab-associated progressive multifocal leukoencephalopathy. J Neurol Sci 2014;346(1 – 2):364 – 5. doi: 10.1016/ j.jns.2014.09.007.
27. Richert N, Bloomgren G, Cadavid D. Imaging findings for PML in natalizumab-treated MS patients. Mult Scler 2012;18(Suppl 4):27 – 8.
28. Bergui M, Bradac GB, Oguz KK, et al. Progressive multifocal leukoencephalopathy: diffusion-weighted paging and pathological correlations. Neuroradiology 2004;46(1):22 – 5.
29. Wattjes MP, Steenwijk MD, Stangel M. MRI in the diagnosis and monitoring of multiple sclerosis: an update. Clin Neuroradiol 2015; 25(Suppl 2):157 – 65. doi: 10.1007/ s00062-015-0430-y.
30. Yousry TA, Pelletier D, Cadavid D, et al. Magnetic resonance imaging pattern in natalizumab-associated progressive multifocal leukoencephalopathy. Ann Neurol 2012;72(5):779 – 87. doi: 10.1002/ ana.23676.
31. Wattjes MP, Wijburg MT, Vennegoor A, et al. MRI characteristics of early PML-IRIS after natalizumab treatment in patiens with MR. J Neurol Neurosurg Psychiatry 2015;78(8):879 – 84. doi: 10.1136/ jnnp-2015-311411.
32. Wattjes MP, Wijburg MT, Vennegoor A, et al. Diag-nostic performance of brain MRI in pharmacovigilance of natalizumab-treated MS patiens. Mult Scler 2016;22(9):1174 – 83. doi: 10.1177/ 1352458515615225.
33. Wattjes MP, Vennegoor A, Mostert J, et al. Diag-nosis of asymptomatic natalizumab-associated PML: are we between a rock and a hard place? J Neurol 2014;261(6):1139 – 43. doi: 10.1007/ s00415-014-7336-5.
34. Killestein J, Vennegoor A, van Golde AE, et al. PML-IRIS during Fingolimod Diagnosed after Natalizumab Discontinuation. Case Rep Neurol Med 2014;2014 : 307872. doi: 10.1155/ 2014/ 307872.
35. Vaněčková M, Seidl Z, Krásenský J, et al. Naše zkušenosti s MR monitorací pacientů s roztroušenou sklerózou v klinické praxi Čes Slov Neurol N 2010;73/ 106(6):716 – 20.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2016 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodník
- Deprese u vybraných neurologických onemocnění
- Chirurgická léčba arteriovenózní malformace
- Radiochirurgická léčba arteriovenózní malformace mozku
- Endovaskulární léčba arteriovenózní malformace
- Terapie cerebrálních arteriovenózních malformací – observace
-
Komentář ke kontroverzím
Kontroverze arteriovenózních malformací - Strach související s bolestí u pacientů s chronickou bolestí dolní části zad
- Možnosti transkraniální sonografie na neuropsychiatrickém pomezí
- Úvod do neuromuskulární ultrasonografie
- Návrh bezpečnostní MR monitorace u pacientů s roztroušenou sklerózou léčených natalizumabem
- Netestuj, ale POBAV – písemné záměrné Pojmenování OBrázků A jejich Vybavení jako krátká kognitivní zkouška
- Předoperační výkony v oblasti vizuální paměti jako prediktivní faktor kognitivních změn po hluboké mozkové stimulaci subthalamického jádra u Parkinsonovy nemoci
- Neuropsychologické abnormity v exekutivních funkcích u pacientů s blefarospazmem
- Význam testování termických prahů v detekci neuropatie tenkých vláken u diabetiků 1. typu
- Orbitocelulitida jako komplikace akutní rhinosinusitidy – naše zkušenosti s léčbou u dospělých pacientů
- Případ závažného průběhu HIV-1 meningoencefalitidy a lues secundaria
- Autoimunitní encefalitidy – kazuistiky
- Spinálny gossypibóm 20 rokov po lumbálnej diskektómii – kazuistika
- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
- Webové okénko
-
Analýza dat v neurologii
LX. Analýza trendu ve vztahu kategoriálních znaků - Recenze knih
- Nepodceňujte oportunní infekce při léčbě roztroušené sklerózy
- Jak to bylo na neurochirurgii ve Střešovicích před 50 lety?
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Deprese u vybraných neurologických onemocnění
- Autoimunitní encefalitidy – kazuistiky
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



