-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Možnosti transkraniální sonografie na neuropsychiatrickém pomezí
The Use of Transcranial Sonography at Neuro-psychiatry Interface
The use of neuroimaging methods is one of the pillars of re-convergence of neurology and psychiatry. Transcranial ultrasonography of the brainstem parenchyma is a method widely clinically used in neurology while it has also started to bear first fruit in the field of mental disorders. Sonographic imaging mainly concerns structures of the brainstem. Reduced echogenicity of the brainstem raphe is related to unipolar major depressive disorder, the majority of organic depressive disorders and several anxiety disorders but not bipolar affective disorder. According to initial results, this could be the marker of good efficacy of serotoninergic antidepressants. Hyperechogenicity of substantia nigra, typical for Parkinson’s disease, has also been frequently found in depressive states, and suggests shared etiopathogenic background. In addition, it is related to severity of medication-induced extrapyramidal syndrome in psychiatry. Verification and extension of these findings may provide clinically important markers for discrimination between unipolar and bipolar depression, a more personalized choice of an antidepressant and prediction of the risk of antipsychotic-induced extrapyramidal adverse effects. This article presents a detailed overview of brain sonographic findings when used at the interface between neurology and psychiatric border.
Key words:
transcranial ultrasonography – raphe nuclei – substantia nigra – Parkinson’s disease – mental disorders – depression
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři: P. Šilhán 1,2; D. Školoudík 3,4; M. Jelínková 3,5; MUDr. Martin Hýža 1,2; J. Valečková 6; D. Perničková 1,2; L. Hosák 7
Působiště autorů: Oddělení psychiatrické, FN Ostrava 1; Katedra neurologie a psychiatrie, LF OU v Ostravě 2; Neurologická klinika LF OU a FN Ostrava 3; Ústav ošetřovatelství, FZV UP v Olomouci 4; Neurologické oddělení, Nemocnice s poliklinikou Karviná-Ráj 5; Oddělení lékařské genetiky, FN Ostrava 6; Psychiatrická klinikaLF UK a FN Hradec Králové 7
Vyšlo v časopise: Cesk Slov Neurol N 2016; 79/112(6): 649-654
Kategorie: Přehledný referát
Souhrn
Využívání zobrazovacích metod je jeden z pilířů opětovného sbližování psychiatrie s neurologií. Transkraniální sonografie mozkové tkáně je metoda klinicky využívaná především v neurologii, svá první zjištění však přináší rovněž v oblasti duševních onemocnění. Sonografické nálezy se týkají zvláště struktur mozkového kmene. Snížená echogenita rafeální oblasti je spojena s unipolárními depresivními stavy, většinou organických depresivních poruch a některými úzkostnými poruchami, nevyskytuje se však u bipolární afektivní poruchy. Podle prvních výsledků může být rovněž markerem vyšší účinnosti serotonergních antidepresiv. Také hyperechogenita substantia nigra, typická pro Parkinsonovu chorobu, je zvýšeně nacházena u depresivních stavů a poukazuje na společné etiopatogenetické souvislosti. V psychiatrii navíc souvisí se závažností polékového extrapyramidového syndromu. Ověření a rozšíření těchto nálezů může poskytnout klinicky významné markery pro diskriminaci mezi unipolárními a bipolárními depresivními fázemi, pro cílenější volbu antidepresivní léčby a predikci rizika extrapyramidových nežádoucích účinků antipsychotik. Bližší přehled sonografických nálezů na neuropsychiatrickém pomezí přináší následující článek.
Klíčová slova:
transkraniální sonografie – rafeální jádra – substantia nigra – Parkinsonova choroba – duševní poruchy – depreseÚvod
Transkraniální ultrazvukové zobrazení mozku v B-módu je relativně nová zobrazovací metoda, která je využívána především v neurologii. V posledních 20 letech zaznamenala značný rozvoj a stala se pomocníkem především v diagnostice Parkinsonovy choroby (PCh), ale i dalších pohybových onemocnění. Své první experimentální výsledky přináší také v oblasti duševních poruch. Navazuje zde na poznatky získané při práci s neurologickými pacienty, a nálezy se proto většinou týkají obdobných mozkových struktur. Cílem následujícího článku je přinést přehled neurosonologických nálezů na pomezí psychiatrie s neurologií a podnítit zájem o širší využití této metody u duševních nemocí.
Technika sonografie
Sonografie využívá výrazného odrazu ultrazvuku na rozhraní prostředí s různou akustickou impedancí [1]. Při transkraniální sonografii (TCS) jsou užívány sondy s nosnými frekvencemi 2,0 – 4,0 MHz. Ačkoli rozlišovací schopnost těchto sond je nižší ve srovnání s magnetickou rezonancí (MR), diferenciační možnosti TCS v případě vyšetření určitých specifických mozkových struktur jsou obdobné, protože MR snímky jsou při dlouhodobém snímání narušeny i minimální pohyby, např. spojenými s dýcháním, pohyby hlavou či končetinami. Spolu s odlišným fyzikálním principem je tak TCS cennou komplementární metodou k ostatním standardně užívaným zobrazovacím přístupům [2].
Sonda se přikládá v oblasti temporálního akustického okna preaurikulárně. Vyšetření TCS probíhá ve čtyřech základních standardizovaných rovinách – v rovině mozkového kmene, v thalamické rovině, v rovině těl postranních komor a rovině mozečku [3].
U snímaných struktur je posuzována intenzita echosignálu v porovnání s referenčními strukturami, případně jejich dvojrozměrná velikost, zvláště v případě substantia nigra (SN). Nové možnosti poskytuje počítačová kvantifikace echogenity, která eliminuje problém subjektivity a variability při hodnocení sonografistou a rovněž umožňuje jemnější diferenciaci nálezů. Prvním z takto využívaných programů je B-Mode Assist System, který hodnotí index echogenity v zobrazované oblasti [4].
Poruchy pohybu
Parkinsonova choroba
TCS je v současnosti možným nástrojem časné a pravděpodobně také preklinické detekce PCh [5]. Je založená na detekci hyperechogenity a zvětšení plochy SN, která je markerem nigrostriatálního poškození, vyskytuje se u 90 % pacientů s PCh a s progresí nemoci zůstává stacionární [6]. Jen výrazná menšina z publikovaných studií nalezla korelaci mezi hyperechogenitou SN a stadiem nemoci či její závažností [7]. Ve studii s 50 pacienty trpícími PCh, kteří podstoupili průměrně po 6,4 letech opakované neurosonologické vyšetření, byla zjištěna statisticky významná progrese klinického nálezu, ale nikoliv změny echogenity SN [8].
Podle původní hypotézy byla hyperechogenita SN vysvětlována zvýšenou přítomností železa, která se vyskytuje u PCh. Jiné parkinsonské syndromy spojené se zvýšeným obsahem železa však hyperechogenitu SN nevykazují [5]. Hyperechogenní SN můžeme nalézt také u 8 – 10 % klinicky němých pacientů a u části příbuzných prvního stupně pacientů s PCh, kde je spojena se sníženým vychytáváním 18F-DOPA především v putamen [9,10]. Tyto výsledky naznačují možnou subklinickou alteraci nigrostriatálního systému. U části zdravých dobrovolníků s pozitivním nálezem dochází časem k rozvoji PCh. V longitudinální multicentrické studii bylo na více než 1 500 dobrovolnících starších 50 let bez známek neurodegenerativní choroby zjištěno, že hyperechogenita SN byla spojena s relativním rizikem rozvoje PCh v průběhu tří let 17,4krát vyšším než u osob s normoechogenní SN [11]. Pozitivní nález hyperechogenní SN tak může být považován za predisponující znak PCh a lze jej využít spolu s funkčními zobrazovacími metodami k časné diagnostice PCh, kdy ve standardních zobrazovacích metodách (CT, MR) nenacházíme typické strukturální změny [7]. TCS můžeme rovněž užít v diferenciální diagnostice PCh od atypických a sekundárních parkinsonských syndromů (PS) či ostatních onemocnění pohybového systému [12].
Atypické PS
Mezi atypické PS se řadí neurodegenerativní choroby jiné než PCh, které bývají od časných stadií doprovázeny příznaky nad rámec PS, jako jsou instabilita a pády, apraxie, dystonie, vegetativní dysfunkce, demence aj. Odlišují se rovněž rychlejší progresí, závažnější prognózou a slabou odpovědí na dopaminergní terapii [13].
Multisystémová atrofie a progresivní supranukleární obrna jsou oproti PCh charakterizovány normální či jen mírně zvýšenou echogenitou SN a současně hyperechogenitou nucleus lentiformis a rozšířením třetí komory mozkové [14]. Ve studii srovnávající sonografické nálezy u PCh a demence s Lewyho tělísky (LBD) bylo zjištěno, že obě nemoci se vyznačují hyperechogenitou SN, v případě LBD však významně častěji symetrickou. Pacienti s PCh a současně demencí a pacienti s LBD měli signifikantně častěji rozšířenou třetí komoru mozkovou a frontální roh postranních komor než pacienti s PCh bez demence [15].
Sekundární PS
Sekundární PS zahrnuje příznaky hypokineze, rigidity a tremoru, při nichž jsou postižena bazální ganglia jinými než neurodegenerativními příčinami, např. strukturálními lézemi, metabolickými, toxickými a lékovými vlivy [13]. Ultrasonograficky je možné u některých z nich diferencovat jiné známky onemocnění, jako např. šířku komor v případě normotenzního hydrocefalu [7]. Jindy se takové přídatné nálezy nevyskytují a je nutné se spokojit s absencí hyperechogenity SN. Tak je tomu u PS vaskulárního či posttraumatického původu. U vaskulárního PS se vyskytuje hyperechogenita SN sice významně častěji než u zdravých dobrovolníků, ale méně často než u pacientů s PCh (20 vs. 5 vs. 84 %) [16]. Napomoci diferenciální diagnostice pak může nález známek aterosklerózy při vyšetření intrakraniálního krevního oběhu a magistrálních tepen [7].
Ostatní poruchy pohybu
U pacientů s esenciálním tremorem nacházíme hyperechogenitu SN rovněž častěji než u zdravých dobrovolníků, ale méně často než u PCh (13 – 16 vs. 3 – 10 vs. 75 – 91 %). Nález hyperechogenity SN zde bývá spojen s vyšším výskytem premotorických příznaků PCh a je i zde považován za rizikový faktor rozvoje PCh a možné spojení mezi etiopatogenezí esenciálního tremoru a PCh [17].
Z ostatních pohybových poruch je syndrom neklidných nohou spojen s nálezy častější hypoechogenity SN, ale také hypoechogenity rafeální zóny (RZ) a hyperechogenity nucleus ruber [18]. Ve skupině primárních dystonií byla především u cervikálních forem zjištěna častější hyperechogenita mediální části nucleus lentiformis, u ostatních forem byl nález méně frekventní a jen výjimečný byl u dystonií obličejových [7]. V případě Huntingtonovy chorey byl spojen těžší průběh choroby s nálezem hyperechogenity SN, zhoršení kognitivních funkcí korelovalo s šíří třetí komory mozkové, depresivní syndrom byl spojen s nálezem hypoechogenity RZ [19]. U Wilsonovy choroby bývá popisován nález hyperechogenity nucleus lentiformis [20].
Duševní poruchy
V porovnání s pohybovými poruchami je výzkum u duševních poruch zatím zaměřen převážně na zobrazování rafeální zóny mozkového kmene, resp. středního mozku. Mozkový kmen v oblasti středního mozku se při TCS zobrazuje jako motýlovitý útvar nízké echogenity obklopený vysoce echogenními bazálními cisternami. Jeho nejviditelnějšími součástmi jsou tři echogenní struktury: substantia nigra, nucleus ruber a rafeální zóna. Ta je za fyziologických okolností viditelná jako spojitá linie o shodné echogenitě jako nucleus ruber (obr. 1). Echogenita RZ byla dosud vyhodnocována semikvantitativně, a to třístupňově (normální nález, hypoechogenní zóna či přerušená linie a neviditelná zóna) nebo pouze dvoustupňově (normální nález vs. jakékoliv snížení echogenity) (obr. 2) [21]. Nově je možná rovněž již zmíněná plná kvantifikace za pomoci speciálně vyvinutého softwaru [4].
Obr. 1. Transkraniální zobrazení mozkového kmene v B-módu – normální zobrazení rafeální zóny (označena modrou šipkou). Fig. 1. Transcranial view of the brainstem B-mode – normal view of theraphe zone (blue arrow). 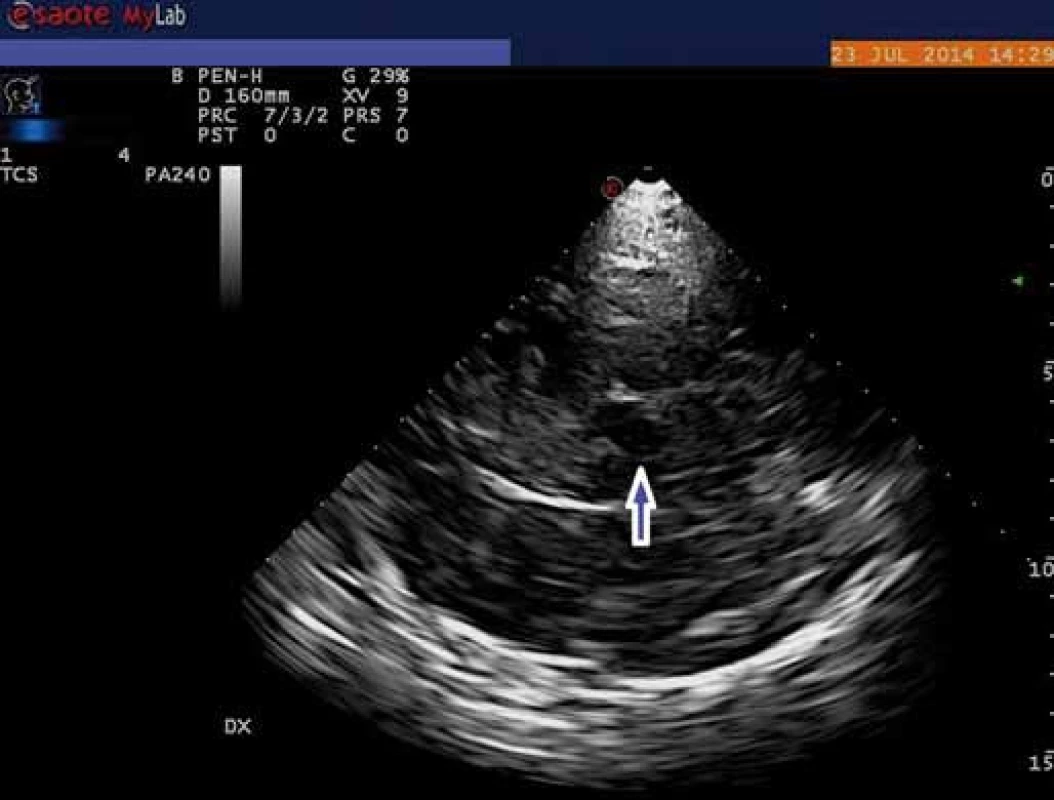
Obr. 2. Transkraniální zobrazení mozkového kmene v B-módu – hypoechogenní rafeální zóna (označena modrou šipkou). Fig. 2. Transcranial view of the brainstem B-mode – hypoechoic raphe zone (blue arrow). 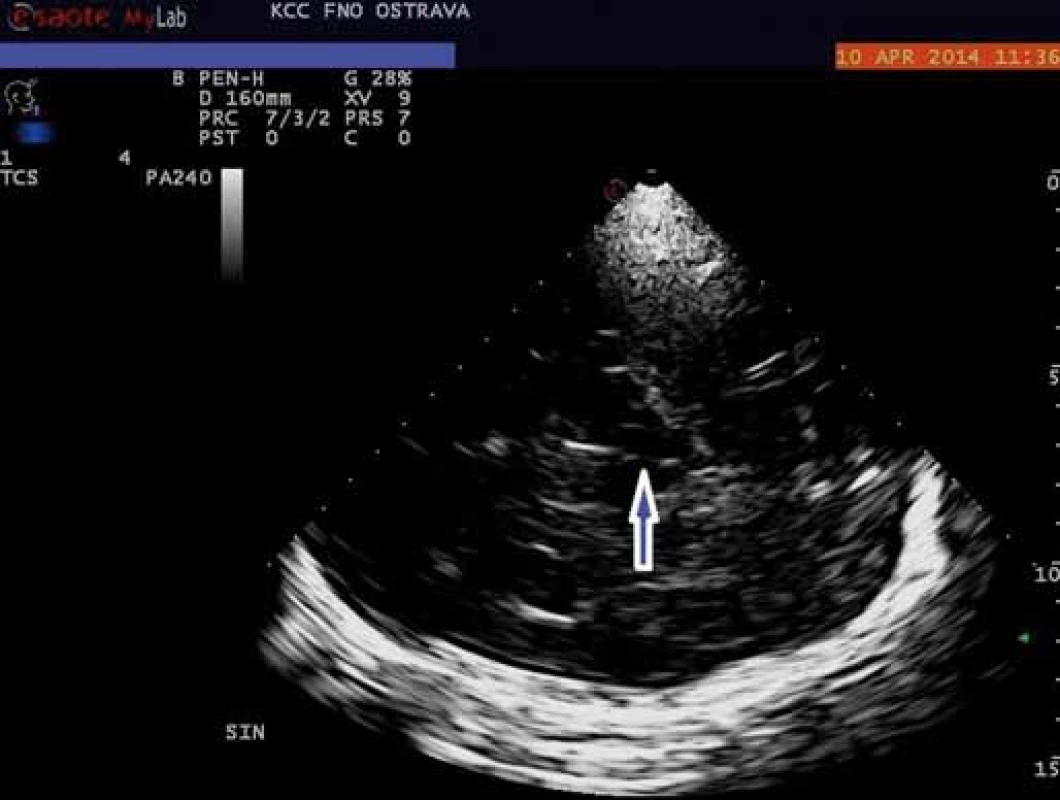
RZ vyšetřované oblasti je tvořena rafeálními jádry (RJ) stejně jako řadou ascendentních a descendentních drah spojujících kmenová a mozečková jádra s podkorovými a korovými oblastmi [22]. Přesnější zobrazení této oblasti je náročné vzhledem k její lokalizaci a struktuře. RJ se skládají z heterogenních skupin buněk podél středové linie kmene, které jsou nevýrazně ohraničeny proti okolní tkáni, což přináší problémy zobrazovacím metodám, ale dokonce i histologickému zobrazení [23]. Změny echogenity RZ mohou být způsobeny poškozením mikroarchitektury této oblasti, které může spočívat ve změnách buněčné hmoty, intersticiální matrix či integrity vláken tvořících ascendentní a descendentní dráhy [22,24]. Dřívější histopatologické nálezy na RJ pacientů s poruchami nálady nepřinášely konzistentní výsledky. Důvodem byly pravděpodobně nízké počty účastníků, rozdílná metodika a také vysoké zastoupení pacientů, kteří dokonali suicidium [25].
Jedno z metodologicky nejúplnějších post-mortem histologických vyšetření dorzálních RJ provedli Matthews s Harrisonem. Na souboru 50 osob, z nichž jen menšina zemřela sebevraždou, stanovili počet všech neuronů, počet serotonergních neuronů a jejich velikost a celkovou plochu dorzálních RJ. U pacientů trpících depresivní fází popsali zmenšenou plochu dorzálních RJ bez změny hustoty či velikosti neuronů. To naznačuje redukci v oblasti neuropilu, který je tvořen zvláště gliovými buňkami, dendrity, axony a cévními elementy. U podskupiny pacientů s bipolární afektivní poruchou bylo zjištěno pouze zmenšení velikosti serotonergních neuronů, u schizofrenie pak žádná ze sledovaných změn [25].
Studie s MR významné změny v RZ u depresivních poruch nálad nezjistily. Postupy založené na oblasti zájmu se na oblast RJ prakticky nezaměřovaly vzhledem k obtížnosti manuálního ohraničení sledované oblasti [26]. Studie využívající voxel-based morfometrie obvykle odlišnosti v oblasti RZ nepopsaly. Výjimkou je studie Lee et al, kteří u depresivních pacientů zjistili oproti zdravým dobrovolníkům mj. sníženou koncentraci šedé kůry mozkové v oblasti dorzálních RJ [26].
Unipolární depresivní stavy
V roce 1994 popsali poprvé Becker et al nález narušené echogenity RZ u 20 pacientů s unipolární depresí [27]. O rok později tento nález verifikovali na větším souboru [28]. Echogenita RZ byla od té doby zjišťována dalšími studiemi a její redukce byla popsána u 37 – 65 % pacientů s unipolární depresivní poruchou [29 – 33], prokázána byla rovněž u depresivní poruchy přizpůsobení [30]. Nálezy echogenity RZ u pacientů s depresivními poruchami shrnuje tab. 1.
Tab. 1. Nálezy studií vyšetřujících echogenitu rafeální zóny u pacientů s unipolárními depresivními stavy. 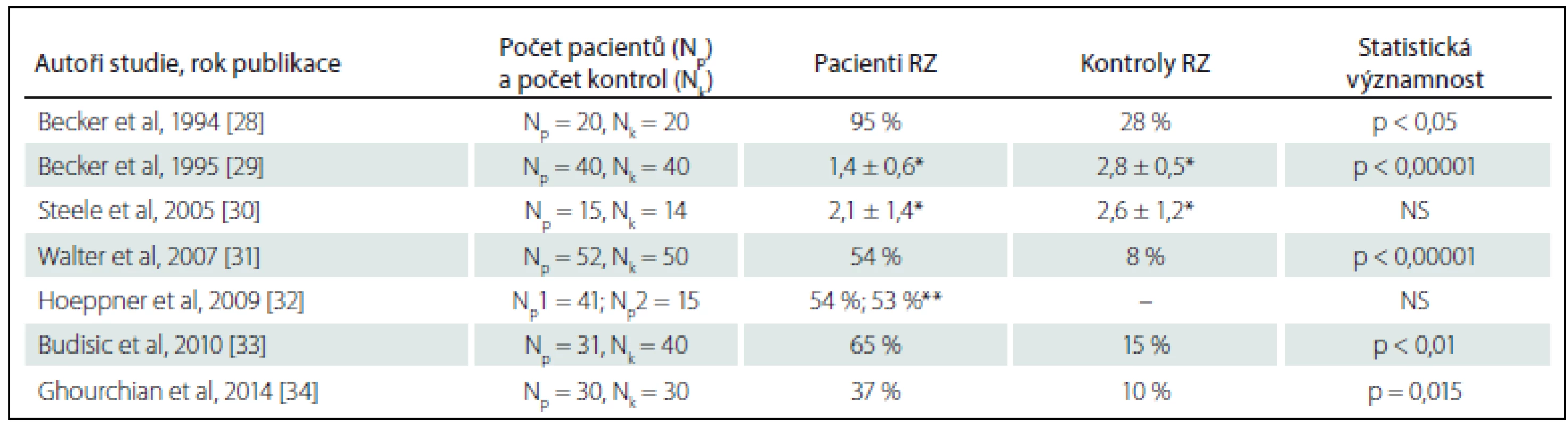
Np – počet pacientů zařazených ve studii, Nk – počet kontrolních subjektů zařazených ve studii, RZ – hypoechogenní rafeální zóna, NS – statististicky nevýznamný rozdíl. *semikvantitativní hodnocení echogenity na čtyřstupňové škále [29]; **studie porovnávající nálezy u pacientů s depresivní epizodou (p1) a depresivní poruchou přizpůsobení (p2). Ve studii Waltera et al na 52 účastnících s depresivní epizodou či depresivní poruchou přizpůsobení byl hodnocen navíc vztah echogenity RZ a odpověď pacientů na léčbu [30]. Pacienti byli léčeni antidepresivy po dobu minimálně tří týdnů při podávání maximální či maximálně tolerované dávky, než byli označeni jako nonrespondéři (rozpětí léčby 3 – 12 týdnů). Pacienti s nálezem normální echogenity RZ byli signifikantně častěji klasifikování jako non-respondéři vůči selektivním inhibitorům vychytávání serotoninu, pacienti s hypoechogenitou RZ jako respondéři.
Jedinou další studií, v níž byla popsána souvislost nálezu hypoechogenity RZ se závažností nemoci či prognózou, realizovali Budisic et al [32]. Mezi pacienty s unipolární depresí zde nález normoechogenity RZ odpovídal mírnějším příznakům deprese a hypoechogenita se vyskytovala významně častěji mezi depresivními pacienty se suicidálními myšlenkami než bez nich (86 vs. 47 %), přičemž u 72 % suicidálních pacientů bylo zjištěno dokonce úplné vymizení RZ. Naprostá většina studií však neodhalila žádnou souvislost s věkem, pohlavím, délkou či závažností nemoci.
Obdobné jsou nálezy rovněž u organických depresivních poruch v rámci PCh. Metaanalyticky se depresivní fáze u PCh vyskytuje s prevalencí 17 %, dystymie 13 % a ostatní depresivní stavy nedosahující hloubky depresivní fáze ve 22 % [34]. V řadě případů depresivní stav předchází manifestaci PCh, takže bývá považován za premotorický příznak PCh či za rizikový faktor pro její pozdější rozvoj [35]. U nedepresivních pacientů s PCh se hypoechogenita RZ nachází u 6 – 27 %, zatímco u depresivních pacientů v 35 – 85 % případů [21]. Na druhou stranu u depresivních pacientů bez PCh se častěji (40 %) než u zdravých dobrovolníků (13 %) vyskytuje hyperechogenita SN [36], která je považována za možný trait marker PCh. U depresivních pacientů bez PCh a současně s nálezem hyperechogenity SN byla prokázána motorická asymetrie a narušená verbální fluence, které jsou rovněž považovány za preklinické známky PCh [31]. Skupina pacientů s depresivní poruchou, nálezem hypoechogenity RZ a současně hyperechogenity SN a/ nebo motorického oblenění tak může představovat skupinu pacientů v riziku rozvoje PCh [37].
Bipolární afektivní porucha
Ultrasonografickým nálezům se u bipolární afektivní poruchy (BAP) věnovaly dosud dvě studie. V první nebyla nalezena hypoechogenita RZ u bipolárních pacientů, resp. byla zjištěna dokonce mírná hyperechogenita při semikvantitativním čtyřstupňovém hodnocení [28]. Ve druhé, novější studii u 36 pacientů s BAP I. typu (14 depresivních, osm manických a 14 euthymních) nebyl zjištěn rozdíl v echogenitě RZ oproti kontrolní skupině (36,1 vs. 20 %), rozdíl nebyl zjištěn ani mezi jednotlivými fázemi onemocnění (42,9 %, 37,5 %, 28,6 %). Stejně tak nebyl prokázán rozdíl v echogenitě SN, která byla hyperechogenní u 16,7 % pacientů s BAP a 8,6 % kontrol. Naopak byla zjištěna statisticky významně větší šířka III. komory mozkové (3,8 vs. 2,7 mm). Opakovaný negativní nález na RZ u BAP naznačuje možnou intaktnost struktur RZ, a tedy i možné odlišné etiopatogenetické souvislosti oproti depresím unipolárním [38].
Panická porucha
Mezi úzkostnými poruchami byla dosud zkoumána echogenita RZ pouze u panické poruchy. Ve studii Šilhána et al [39] byla zkoumána echogenita RZ a SN u26 pacientů s panickou poruchou a 26 kontrolních subjektů. Hodnocení bylo provedeno vizuálně a také digitální analýzou. Při obou způsobech hodnocení byla zjištěna signifikantně častěji hypoechogenita RZ u pacientů s panickou poruchou (68 vs.31 % vizuálně, 52 vs. 12 % digitálně). U žádného z pacientů nebyla diagnostikována depresivní porucha. Pacienti s pozitivním a negativní nálezem se nelišili závažností poruchy ani mírou depresivních příznaků. Digiální index echogenity negativně koreloval s věkem a pozitivně se skórem úzkostných příznaků dle Beckovy škály úzkosti [40], pacienti s vizuálně sníženou echogenitou se vyznačovali kratším trváním nemoci a léčby.
Obsedantně-kompulzivní porucha
V roce 2013 publikovali Mavrogiorgou et al výsledky studie u 31 pacientů s obsedantně-kompulzivní poruchou, u nichž proti zdravým kontrolám zjistili trend k častějšímu nálezu snížené echogenity RZ mozkového kmene (p = 0,073) a signifikantně častější hyperechogenitu nucleus caudatus. Nebyl zjištěn rozdíl v echogenitě substantia nigra a nucleus lentiformis ani v šíři třetí komory mozkové [41].
Polékový parkinsonský syndrom
Berg et al v retrospektivní studii na 93 pacientech léčených antipsychotiky prokázali, že pacienti se středně silným a silným polékovým PS mají vyšší echogenitu (plochu) SN než pacienti se slabým PS či bez něj [42]. V navazující malé prospektivní studii na 11 paientech s první psychotickou epizodou a dříve neléčených antipsychotiky pak zjistili, že závažnost parkinsonských příznaků korelovala se vstupní echogenitou SN při střední délce sledování osm týdnů. V obou výzkumných skupinách také stranová asymetrie parkinsonských příznaků u jednotlivých pacientů korelovala se stranově asymetrickými nálezy na SN. Podle autorů tak může být hyperechogenita SN markerem subklinického poškození nigrostriatálního systému, který se manifestuje po užití antipsychotik.
Kognitivní deficit a demence
Diferenciace mezi časnými fázemi demence a relativně fyziologickým slábnutím kognitivních funkcí je klinicky problematická. Ve studii s více než 300 účastníky, kteří byli poprvé vyšetřeni kognitivně a TCS mezi 50 a 65 lety a opět po pěti letech, bylo zjištěno, že u osob s kognitivním výkonem pod 10. percentilem souboru při druhém vyšetření byla při prvním vyšetření přítomna širší třetí komora mozková. Autoři proto usuzují, že nález rozšířené třetí komory může odrážet klinicky němou neuronovou ztrátu s opožděnou manifestací v kognitivním poklesu v dalších letech [43].
Hyperkinetická porucha
Opakované studie s TCS u dětských pacientů s hyperkinetickou poruchou ukázaly, že u pacientů se nachází častěji než u kontrolního souboru hyperechogenita SN korelující s poruchou pozornosti, hyperaktivitou a impulzivitou [44]. U dětí je fyziologicky přítomna hyperechogenita SN v prvních letech života, s dalším vývojem však postupně ustupuje a po 10. roce je její výskyt srovnatelný s dospělou populací [45]. Ve studii ale nález hyperechogenity SN nekoreloval s věkem, a proto byl považován za známku perzistující alterace dopaminového metabolizmu [44].
Dětský autizmus
Dlouhodobá prospektivní studie s více než 1 000 předčasně narozenými novorozenci zjistila, že rozšíření komor zjištěné pomocí TCS v prvních týdnech života silně koreluje s pravděpodobností rozvoje onemocnění autistického spektra v pozdějším věku [46]. V detailnější studii s TCS za pomoci lineární sondy a užití vyšších frekvencí (7,5 MHz) bylo zjištěno u dětí z autistického spektra v oblasti horního spánkového závitu rozšíření subarachnoidálního prostoru a kortikální dysplazie [47].
Závěr
Poslední dvě desetiletí vývoje na poli neurologie a psychiatrie přinesly opětovné sbližování obou oborů, především v oblasti využívání zobrazovacích metod. TCS je v psychiatrii dosud málo využívaná metoda, která však přináší zajímavé experimentální výsledky. V oboru usilujícím o definici objektivních markerů onemocnění by mohla TCS pomoci zpřesnit jejich diagnostiku, resp. diferenciální diagnostiku, predikovat riziko nežádoucích účinků antipsychotik či pomoci při správné volbě antidepresivní léčby.
Podpořeno MZ ČR-RVO-FNOs/ 2013.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Petr Šilhán, Ph.D.
Oddělení psychiatrické
FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: petr.silhan@fno.cz
Přijato k recenzi: 30. 11. 2015
Přijato do tisku: 22. 4. 2016
Zdroje
1. Viták T, Seidl Z, Burgetová A. Část obecná. In: Seidl Z, Burgetová A, Hoffmannová E, eds. Radiologie pro studium a praxi. 1. vyd. Praha: Grada Publishing 2012 : 21 – 102.
2. Walter U, Kanowski M, Kaufmann J, et al. Contemporary ultrasound systems allow high-resolution transcranial imaging of small echogenic deep intracranial structures similarly as MRI: a phantom study. Neuroimage 2008;40(2):551 – 8. doi: 10.1016/ j.neuroimage.2007.12.019.
3. Huber H. Transcranial Sonography – Anatomy. Int Rev Neurobiol 2010;90 : 35 – 45. doi: 10.1016/ S0074-7742(10)90003-2.
4. Školoudík D, Jelínková M, Blahuta J, et al. Transcranial sonography of the substantia nigra: digital image analysis. AJNR Am J Neuroradiol 2014;35(12):2273 – 8. doi: 10.3174/ ajnr.A4049.
5. Stern MB. Introductory Remarks on the History and Current Applications of TCS. Int Rev Neurobiol 2010;90 : 2 – 5. doi: 10.1016/ S0074-7742(10)90001-9.
6. Berg D, Merz B, Reiners K, et al. Five-year follow-up study of hyperechogenicity of the substantia nigra in Parkinson‘s disease. Mov Disord 2005;20(3):383 – 5.
7. Gaenslen A, Berg D. Early Diagnosis of Parkinson’s Disease. Int Rev Neurobiol 2010;90 : 81 – 92. doi: 10.1016/ S0074-7742(10)90006-8.
8. Behnke S, Runkel A, Kassar HA, et al. Long-term course of substantia nigra hyperechogenicity in Parkinson‘s disease. Mov Disord 2013;28(4):455 – 9. doi: 10.1002/ mds.25193.
9. Berg D, Roggendorf W, Schröder U, et al. Echogenicity of the substantia nigra: association with increased iron content and marker for susceptibility to nigrostriatal injury. Arch Neurol 2002;59(6):999 – 1005.
10. Ruprecht-Dörfler P, Berg D, Tucha O, et al. Echogenicity of the substantia nigra in relatives of patients with sporadic Parkinson‘s disease. Neuroimage 2003;18(2):416 – 22.
11. Berg D, Seppi K, Behnke S, et al. Enlarged substantia nigra hyperechogenicity and risk for Parkinson disease: a 37-month 3-center study of 1,847 older persons. Arch Neurol 2011;68(7):932 – 7. doi: 10.1001/ archneurol.2011.141.
12. Walter U. Transcranial sonography of the cerebral parenchyma: update on clinically relevant applications. Perspect Med 2012;1 : 334 – 43.
13. Růžička E. Neurodegenerativní onemocnění mozku. In: Bednařík J, Ambler Z, Růžička E (eds). Klinická neurologie – část speciální I. 1. vyd. Praha: Triton 2010 : 539 – 707.
14. Bouwmans AEP, Vlaar AM, Srulijes K, et al. Transcranial sonography for the discrimination of idiopathic Parkinson’s disease from the atypical parkinsonian syndromes. Int Rev Neurobiol 2010;90 : 121 – 46. doi: 10.1016/ S0074-7742(10)90009-3.
15. Walter U, Dressler D, Wolters A, et al. Sonographic discrimination of dementia with Lewy bodies and Parkinson‘s disease with dementia. J Neurol 2006;253(4):448 – 54.
16. Tsai CF, Wu RM, Huang YW, et al. Transcranial color-coded sonography helps differentiation between idiopathic Parkinson‘s disease and vascular parkinsonism. J Neurol 2007;254(4):501 – 7.
17. Kim JS, Oh YS, Kim YI, et al. Transcranial sonography (TCS) in Parkinson’s disease (PD) and essential tremor (ET) in relation with putative premotor symptoms of PD. Arch Gerontol Geriatr 2012;54(3):e436 – 9. doi: 10.1016/ j.archger.2012.01.001.
18. Godau J, Sojer M. Transcranial sonography in restless legs syndrome. Int Rev Neurobiol 2010;90 : 199 – 215. doi: 10.1016/ S0074-7742(10)90015-9.
19. Krogias C, Eyding J, Postert T. Transcranial sonography in Huntington‘s disease. Int Rev Neurobiol 2010;90 : 237 – 57. doi: 10.1016/ S0074-7742(10)90017-2.
20. Svetel M, Mijajlović M, Tomić A, et al. Transcranial sonography in Wilson‘s disease. Parkinsonism Relat Disord 2012;18(3):234 – 8. doi: 10.1016/ j.parkreldis.2011.10.007.
21. Mijajlovic MD. Transcranial sonography in depression. Int Rev Neurobiol 2010;90 : 259 – 72. doi: 10.1016/ S0074-7742(10)90018-4.
22. Becker G, Berg D, Lesch KP, et al. Basal limbic system alteration in major depression: a hypothesis supported by transcranial sonography and MRI findings. Int J Neuropsychopharmacol 2001;4(1):21 – 31.
23. Hornung JP. The human raphe nuclei and the serotonergic system. J Chem Neuroanat 2003;26(4):331 – 43.
24. Mijajlovic MD. Transcranial sonography in psychiatric diseases. Perspect Med 2012;1 : 357 – 61.
25. Matthews PR, Harrison PJ. A morphometric, immunohistochemical, and in situ hybridization study of the dorsal raphe nucleus in major depression, bipolar disorder, schizophrenia, and suicide. J Affect Disord 2012;137(1 – 3):125 – 34. doi: 10.1016/ j.jad.2011.10.043.
26. Lee HY, Tae WS, Yoon HK, et al. Demonstration of decreased gray matter concentration in the midbrain encompassing the dorsal raphe nucleus and the limbic subcortical regions in major depressive disorder: an optimized voxel-based morphometry study. J Affect Disord 2011;133(1 – 2):128 – 36. doi: 10.1016/ j.jad.2011.04.006.
27. Becker G, Struck M, Bogdahn U, et al. Echogenicity of the brainstem raphe in patients with major depression. Psychiatry Res 1994;55(2):75 – 84.
28. Becker G, Becker T, Struck M, et al. Reduced echogenicity of brainstem raphe specific to unipolar depression: a transcranial color-coded real-time sonography study. Biol Psychiatry 1995;38(3):180 – 4.
29. Steele JD, Bastin ME, Wardlaw JM, et al. Possible structural abnormality of the brainstem in unipolar depressive illness: a transcranial ultrasound and diffusion tensor magnetic resonance imaging study. J Neurol Neurosurg Psychiatry 2005;76(11):1510 – 5.
30. Walter U, Prudente-Morrissey L, Herpertz SC, et al. Relationship of brainstem raphe echogenicity and clinical findings in depressive states. Psychiatry Res 2007;155(1):67 – 73.
31. Hoeppner J, Prudente-Morrissey L, Herpertz SC, et al. Substantia nigra hyperechogenicity in depressive subjects relates to motor asymmetry and impaired word fluency. Eur Arch Psychiatry Clin Neurosci 2009;259(2):92 – 7. doi: 10.1007/ s00406-008-0840-9.
32. Budisic M, Karlovic D, Trkanjec Z, et al. Brainstem raphe lesion in patients with major depressive disorder and in patients with suicidal ideation recorded on transcranial sonography. Eur Arch Psychiatry Clin Neurosci 2010;260(3):203 – 8. doi: 10.1007/ s00406-009-0043-z.
33. Ghourchian S, Zamani B, Poorkosary K, et al. Raphe nuclei echogenicity changes in major depression. Med J Islam Repub Iran 2014;28 : 9.
34. Reijnders JS, Ehrt U, Weber WE, et al. A systematic review of prevalence studies of depression in Parkinson‘s disease. Mov Disord 2008;23(2):183 – 9.
35. Lieberman A. Depression in Parkinson‘s disease – a review. Acta Neurol Scand 2006;113(1):1 – 8.
36. Walter U, Hoeppner J, Prudente-Morrissey L, et al. Parkinson‘s disease-like midbrain sonography abnormalities are frequent in depressive disorders. Brain 2007;130(7):1799 – 807.
37. Walter U, Školoudík D, Berg D. Transcranial sonography findings related to non-motor features of Parkinson‘s disease. J Neurol Sci 2010;289 : 123 – 7. doi: 10.1016/ j.jns.2009.08.027.
38. Krogias C, Hoffmann K, Eyding J, et al. Evaluation of basal ganglia, brainstem raphe and ventricles in bipolar disorder by transcranial sonography. Psychiatry Res 2011;194(2):190 – 7. doi: 10.1016/ j.pscychresns.2011.04.002.
39. Šilhán P, Jelínková M, Walter U, et al. Transcranial sonography of brainstem structures in panic disorder. Psychiatry Res 2015;234(1):137 – 43. doi: 10.1016/ j.pscychresns.2015.09.010.
40. Beck AT, Epstein N, Brown G, et al. An inventory for measuring clinical anxiety: Psychometric properties. J Consult Clin Psychol 1988;56(6):893 – 7.
41. Mavrogiorgou P, Nalato F, Meves S, et al. Transcranial sonography in obsessive-compulsive disorder. J Psychiatr Res 2013;47(11):1642 – 8. doi: 10.1016/ j.jpsychires.2013.07.020.
42. Berg D, Jabs B, Merschodorf U, et al. Echogenicity of substantia Nigra Determined by Transcranial Ultrasound correlates with severity of parkinsonian symptoms induced by neuroleptic therapy. Biol Psychiatry 2001;50(6):463 – 7.
43. Wollenweber FA, Schomburg R, Probst M, et al. Width of the third ventricle assessed by transcranial sonography can monitor brain atrophy in a time and cost-effective manner – results from a longitudinal study on 500 subjects. Psychiatry Res 2011;191(3):212 – 6. doi: 10.1016/ j.pscychresns.2010.09.010.
44. Krauel K, Feldhaus HC, Simon A, et al. Increased echogenicity of the substantia nigra in children and adolescents with attention-deficit/ hyperactivity disorder. Biol Psychiatry 2010;68(4):352 – 8. doi: 10.1016/ j.biopsych.2010.01.013.
45. Iova A, Garmashov A, Androuchtchenko N, et al. Postnatal decrease in substantia nigra echogenicity. Implications for the pathogenesis of Parkinson‘s disease. J Neurol 2004;251(12):1451 – 4.
46. Movsas TZ, Pinto-Martin JA, Whitaker AH, et al. Autism spectrum disorder is associated with ventricular enlargement in a low birth weight population. J Pediatr 2013;163(1):73 – 8. doi: 10.1016/ j.jpeds.2012.12.084.
47. Bradstreet JJ, Pacini S, Ruggiero M. A New Metho-dology of Viewing Extra-Axial Fluid and CorticalAbnormalities in Children with Autism via Transcranial Ultrasonography. Front Hum Neurosci 2014;7 : 934. doi: 10.3389/ fnhum.2013.00934.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2016 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Úvodník
- Deprese u vybraných neurologických onemocnění
- Chirurgická léčba arteriovenózní malformace
- Radiochirurgická léčba arteriovenózní malformace mozku
- Endovaskulární léčba arteriovenózní malformace
- Terapie cerebrálních arteriovenózních malformací – observace
-
Komentář ke kontroverzím
Kontroverze arteriovenózních malformací - Strach související s bolestí u pacientů s chronickou bolestí dolní části zad
- Možnosti transkraniální sonografie na neuropsychiatrickém pomezí
- Úvod do neuromuskulární ultrasonografie
- Návrh bezpečnostní MR monitorace u pacientů s roztroušenou sklerózou léčených natalizumabem
- Netestuj, ale POBAV – písemné záměrné Pojmenování OBrázků A jejich Vybavení jako krátká kognitivní zkouška
- Předoperační výkony v oblasti vizuální paměti jako prediktivní faktor kognitivních změn po hluboké mozkové stimulaci subthalamického jádra u Parkinsonovy nemoci
- Neuropsychologické abnormity v exekutivních funkcích u pacientů s blefarospazmem
- Význam testování termických prahů v detekci neuropatie tenkých vláken u diabetiků 1. typu
- Orbitocelulitida jako komplikace akutní rhinosinusitidy – naše zkušenosti s léčbou u dospělých pacientů
- Případ závažného průběhu HIV-1 meningoencefalitidy a lues secundaria
- Autoimunitní encefalitidy – kazuistiky
- Spinálny gossypibóm 20 rokov po lumbálnej diskektómii – kazuistika
- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
- Webové okénko
-
Analýza dat v neurologii
LX. Analýza trendu ve vztahu kategoriálních znaků - Recenze knih
- Nepodceňujte oportunní infekce při léčbě roztroušené sklerózy
- Jak to bylo na neurochirurgii ve Střešovicích před 50 lety?
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Deprese u vybraných neurologických onemocnění
- Autoimunitní encefalitidy – kazuistiky
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



