-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómami
The Impact of Surgical Treatment on Prognosis for Adult Patients Harbouring Supratentorial Low-Grade Glioma
Adult supratentorial low-grade glioma (grade II. glioma) tends to malignant dedifferentiation and fatal outcome. In the absence of any prospective randomized study, the role of surgery in low-grade glioma treatment has been discussed for years. However, ethical considerations render comparative study of the matter very difficult to organise. Retrospective studies suffer from intrinsic selection bias, and the authors of early papers were unable to record reliable criteria for assessment of the extent of resection – operative reports and computer tomography. The result of such works were not consistent, so the role of surgical treatment was, and still is, controversial. However, several recent retrospective studies have assessed the extent of resection via reliable criteria – T2 and fluid-attenuated inversion recovery (FLAIR) magnetic resonance sequences. These verified improved prognosis after extensive low-grade glioma resection. Therapeutic strategy must be based on the best evidence available, so nowadays maximal safe surgical resection is recommended as the treatment of choice.
Key words:
low-grade glioma – surgical treatment – prognosis
Autoři: A. Šteňo 1; V. Belan 2; P. Kalina 3; M. Fabian 2; J. Šteňo 1
Působiště autorů: LF UK a UN Bratislava Neurochirurgická klinika 1; LF UK a UN Bratislava Rádiodiagnostická klinika 2; LF UK a UN Bratislava II. Neurologická klinika 3
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(3): 273-278
Kategorie: Přehledný referát
Souhrn
Supratentoriálne low-grade gliómy (gliómy druhého stupňa malignity) dospelých pacientov sú nádory s tendenciou k malígnej transformácii a fatálnemu koncu. O význame resekcie týchto tumorov sa roky viedli diskusie, najmä pre absenciu prospektívnej randomizovanej štúdie skúmajúcej vplyv chirurgickej liečby na prognózu pacientov. Takáto štúdia by však bola z etického hľadiska veľmi problematickou. Retrospektívne štúdie sú zaťažené problémom selekcie, tzv. selection bias, staršie práce navyše hodnotili rozsah resekcie podľa málo spoľahlivých kritérií – operačných nálezov a počítačovej tomografie. Výsledky týchto štúdií navzájom nekorešpondovali. Z týchto dôvodov bol a stále je význam chirurgickej liečby spochybňovaný. V poslednom čase bolo publikovaných niekoľko retrospektívnych štúdií hodnotiacich rozsah resekcie na základe spoľahlivých kritérií – T2 a Fluid-Attenuated Inversion Recovery (FLAIR) sekvencie magnetickej rezonancie. Tieto práce dokladujú zlepšenie prognózy pacientov s low-grade gliómami po rozsiahlej resekcii nádoru. Terapeutickú stratégiu je potrebné prispôsobiť najlepším dôkazom, aké sú k dispozícii, odporúčaným postupom je preto v súčasnosti maximálne možná bezpečná resekcia.
Kľúčové slová:
low-grade glióm – chirurgická liečba – prognózaÚvod
Úloha chirurgickej liečby low-grade gliómov (LGG) bola roky predmetom diskusií a ani v dnešnej dobe nie je jej význam úplne jasný. Spochybňovaný, resp. považovaný za nejasný je najmä prínos včasnej resekcie tumoru u asymptomatických pacientov [1–3]. Nebola realizovaná žiadna prospektívna randomizovaná štúdia, ktorá by skúmala vplyv radikality resekcie LGG na prognózu pacientov, pretože by narazila na závažné etické problémy. Retrospektívnych prác, ktoré sa zaoberali skúmaním korelácie radikality resekcie LGG s prognózou na dostatočne veľkom súbore, bolo publikovaných pomerne málo, zrejme z dôvodu nutnosti dlhej doby sledovania.
Na základe výsledkov starších prác bol považovaný vplyv operačnej liečby LGG na prognózu pacientov za sporný [4,5] a jedným z bežných postupov bola tzv. watch and wait stratégia – teda pravidelné kontroly tumoru magnetickou rezonanciou (MR), s prípadnou aktívnou terapeutickou intervenciou až po anaplastickej transformácii LGG alebo výraznom náraste objemu.
V poslednom čase bolo však publikovaných viacero štúdií dokladujúcich významné miesto chirurgickej liečby v terapii LGG. Hoci kurabilná (biologická) resekcia LGG možná nie je, ukazuje sa, že rádiologicky radikálna (eventuálne subtotálna) resekcia, konštatovaná na základe pooperačného MR vyšetrenia T2 alebo Fluid--Attenuated Inversion Recovery (FLAIR) sekvenciou, signifikantne predlžuje prežívanie pacientov [6–9]. Maximálna možná resekcia LGG je v súčasnosti považovaná za základnú terapeutickú metódu vo všetkých prípadoch, kedy je bezpečne uskutočniteľná [10,11].
Poznámky k terminológii
Názov „low-grade gliómy“ sa často používa spoločne pre gliómy prvého a druhého stupňa malignity podľa gradingu Svetovej zdravotníckej organizácie. Takéto začlenenie do jednej skupiny, resp. používanie spoločného názvu je však značne problematické, pretože ide o skupiny nádorov so značne rozdielnym biologickým správaním. Zatiaľ čo gliové tumory prvého stupňa malignity (napr. pilocytárny astrocytóm) predstavujú chirurgicky potenciálne úplne vyliečiteľné ochorenia [10], gliové tumory druhého stupňa (difúzny astrocytóm, oligodendroglióm a oligoastrocytóm) sú doposiaľ chirurgicky a ani inak nevyliečiteľné infiltratívne rastúce nádory [12]. V súčasnosti sa termín LGG používa z dôvodu zjednotenia terminológie v mnohých novších prácach výhradne pre gliové nádory druhého stupňa malignity, prípadne sa mu snažia autori vyhnúť a používajú iba názov „gliové nádory druhého stupňa“. V tejto práci budeme názov LGG používať výhradne pre gliové nádory druhého stupňa malignity.
Biologické správanie LGG
Rast LGG je difúzny, infiltratívny, pričom nádorové tkanivo často nebýva zrakom odlíšiteľné od zdravého mozgu ani pod operačným mikroskopom. V niektorých prípadoch bývajú LGG pseudoohraničené, avšak aj pri nádoroch vytvárajúcich solídny uzol sa gliómové bunky môžu šíriť aj do vzdialenosti niekoľkých centimetrov od hranice tumoru, čo znemožňuje úplné chirurgické odstránenie týchto nádorov [13].
Difúzny rast LGG spôsobuje prerastanie funkčného mozgového tkaniva nádorovými bunkami, pričom funkčne dôležité (elokventné) mozgové tkanivo sa môže nachádzať i vo vnútri jednoznačne nádorového uzla, v LGG je pritom nález funkčne dôležitých štruktúr dokonca častejší ako v gliómoch tretieho a najvyššieho štvrtého stupňa malignity – high-grade gliómoch (HGG) [14]. LGG navyše častejšie ako de novo glioblastómy rastú v sekundárne elokventných oblastiach (najmä v inzule a supplementary motor area), t.j. v oblastiach bezprostredne susediacich s primárnymi elokventnými oblasťami [15].
Bez onkologickej liečby LGG ako predoperačne, tak i pooperačne postupne pomaly a lineárne rastú [16]. V drvivej väčšine prípadov časom podliehajú dediferenciácii, t.j. zmene HGG s fatálnym koncom. Doba do malígnej transformácie môže predstavovať niekoľko rokov, je však značne variabilná [1,17], pričom v niektorých prípadoch môže byť tento interval kratší ako štyri mesiace [18].
Dĺžka prežívania je približne päť až osem rokov u pacientov s difúznymi astrocytómami, u pacientov s oligodendrogliómami môže byť prežívanie aj vyše 10 rokov [13]. Ako u astrocytómov, tak aj v prípade oligoastrocytómov a oligodendrogliómov je však dĺžka prežívania značne individuálna.
Skúmaním negatívnych prognostických znakov LGG sa zaoberali dve významné publikácie [4,19]. Za dôležité ukazovatele prognózy LGG, negatívne ovplyvňujúce dĺžku prežívania, sú považované predoperačná veľkosť tumoru nad 6 cm [4], resp. nad 4 cm [19], vek nad 40 rokov [4], resp. nad 50 rokov [19], tumor histologizovaný ako astrocytóm [4], lokalizácia tumoru v elokventnej oblasti [19], neurologický deficit pri stanovení diagnózy [4], tumor presahujúci strednú čiaru [4] a Karnofsky Performance Scale skóre 80 % a menej [19]. Za negatívny prognostický znak je považovaná i prítomnosť gemistocytov, tento histologický subtyp má vyššiu tendenciu k včasnej malígnej transformácii [20].
Z genetických markerov je za znak priaznivejšej prognózy považovaná delécia 1p,19q, ktorá je častá najmä u oligodenrogliómov [13], strata heterozygozity na chromozómoch 9p a 10q sa naopak považuje za znak nepriaznivej prognózy [21].
Novšie práce za veľmi dôležitý prognostický ukazovateľ považujú aj rýchlosť rastu LGG. Táto je jedným z najdôležitejších ukazovateľov prognózy LGG [22,23].
Negatívnym prognostickým ukazovateľom dosiahnutia radikálnej resekcie sú difúzne okraje tumoru na MR [19,24,25], s inkompletnou resekciou tumoru taktiež signifikantne korelujú veľkosť tumoru, zasahovanie tumoru do kortikospinálnej dráhy a histologická verifikácia oligodendrogliálneho typu LGG [25].
Zobrazenie tkaniva LGG na magnetickej rezonancii
Na rozdiel od často minimálnych rozdielov medzi vzhľadom tkaniva LGG a tkaniva zdravého mozgu v operačnom mikroskope, bývajú LGG podstatne lepšie viditeľné na magnetickej rezonancii (MR). Sú typicky hypointenzívne v T1 a hyperintezívne v T2 váženom obraze, pričom v oligodendrogliových LGG sa na rozdiel od astrocytových môže pozorovať vychytávanie kontrastnej látky [26]. T1 sekvencia zobrazuje najmä solídny nádorový uzol [27], avšak v niektorých prípadoch nemusí jestvujúci nádor zobraziť takmer vôbec (obr. 1a).
Podstatne lepšie rozsah nádoru zobrazujú T2 a FLAIR sekvencie (obr. 1b), ktoré zobrazujú i veľkú časť infiltrovaného mozgového tkaniva [27], pričom FLAIR sekvencia je na sledovanie LGG vhodnejšia ako T2 [28]. FLAIR sekvencia lepšie zobrazuje napr. rozdiel medzi pooperačným rezíduom LGG a resekčnou dutinou, subependymálnu infiltráciu, ako i šírenie sa LGG do vlákien corpus callosum a capsula interna [28]. Ani T2 a FLAIR sekvencie však nezobrazujú infiltrované mozgové tkanivo v celom rozsahu, platí, že bunky LGG sa nachádzajú aj v okolitom tkanive s úplne normálnym MR signálom [13].
Obr. 1. Oligodendroglióm druhého stupňa malignity v ľavom čelovom laloku. Predoperačné MR v T1 (a) a FLAIR (b) sekvencii; nádorom infiltrovaný parenchým mozgu sa v T1 sekvencii takmer nezobrazil. c) Stav po radikálnej resekcii nádoru zobrazený vo FLAIR sekvencii; tenký hyperintenzívny lem na okraji resekčnej dutiny je pooperačná glióza, nachádza sa mimo miest, kde bolo predoperačne lokalizované hyperintenzívne gliómové tkanivo. 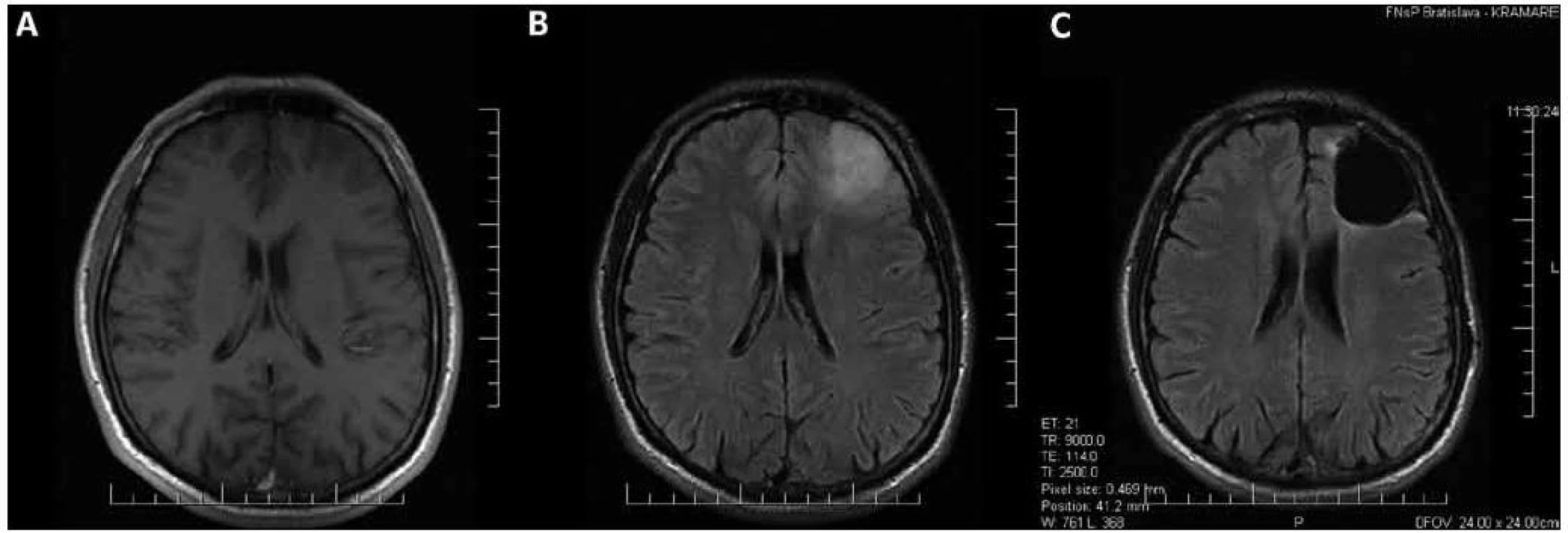
Rozsah infiltrácie tkaniva okolo T2 a FLAIR hyperintezívneho ložiska je možné spresniť MR spektroskopiou [29,30]. Rozšírenie resekcie aj mimo hyperintenzívneho ložiska na základe patologickej MR spektroskopie sa však zatiaľ rutinne nevyužíva, takejto zmene chirurgickej taktiky by museli predchádzať ďalšie klinické štúdie, informujúce najmä o význame takéhoto postupu a bezpečnosti z hľadiska možných pooperačných deficitov.
Spresniť stupeň zhubnosti gliómov, teda s istou pravdepodobnosťou odlíšiť LGG od HGG, je možné doplnením základného MR vyšetrenia s kontrastnou látkou o MR spektroskopiu a perfúznu MR [31].
Odlíšenie LGG od HGG je možné spresniť okrem MR vyšetrenia aj vyšetrením pozitrónovou emisnou tomografiou s využitím 18F-2-fluoro-2-deoxy-D-glukózy (18FDG), kedy je pre LGG charakteristické znížené a pre HGG naopak zvýšené metabolizovanie 18FDG [32].
Možnosti liečby LGG
Účinnosť rádioterapie v terapii LGG bola skúmaná prospektívnou randomizovanou štúdiou EORTC 22845 [33]. Hoci sa rádioterapia ukázala byť účinná v predĺžení času do progresie nádoru, jej úloha v predĺžení priemernej doby prežívania pacientov s LGG nebola dokázaná. Vzhľadom na tento fakt a nezanedbateľné vedľajšie účinky rádioterapie, napr. rozvoj poradiačnej leukoencefalopatie spojenej s poruchami mnohých funkcií centrálnej nervovej sústavy, ktorá môže progredovať i niekoľko rokov po ožiarení [34], je načasovanie rádioterapie v liečbe LGG stále kontroverzné [35]. V súčasnosti je všeobecne uznávaným postupom odložiť rádioterapiu až do času progresie tumoru [10].
Úloha chemoterapie v terapii LGG nie je nateraz presne definovaná [36]. Hoci niekoľko prác dokladovalo čiastočnú účinnosť temozolomidu na kontrolu rastu LGG [3,37–40], chemoterapia ako primárna liečba LGG zatiaľ nie je indikovaná [41,42]. V prípade oligodendrogliómov však niektorí autori odporúčajú liečbu chemoterapiou (primárnu alebo sekundárnu) u každého pacienta [43]. V súčasnosti prebieha niekoľko klinických štúdií skúmajúcich účinok liečby temozolomidom na prognózu LGG, preto je možné, že v budúcnosti význam chemoterapie v procese liečby LGG vzrastie.
Schopnosť LGG prerastať a inkorporovať zdravé mozgové tkanivo spôsobuje náročnosť operácií týchto nádorov rastúcich vo vnútri alebo v kontakte s elokventnými oblasťami mozgu, pri ktorých hrozí poškodenie funkčne dôležitých štruktúr. Technický pokrok v neurochirurgii a moderné neurochirurgické postupy (najmä využitie elektrofyziologického neuromonitoringu, operácií mozgu u pacienta pri vedomí a intraoperačných zobrazovacích metód – ultrasonografie a MR) však v mnohých prípadoch umožňujú bezpečnú resekciu aj takto lokalizovaných LGG [44–52]. Vzhľadom na difúzny, infiltratívny charakter rastu LGG kurabilná resekcia týchto nádorov však možná nie je. Zmyslom operácií LGG je teda najmä cytoredukcia [16] a predpokladané oddialenie času anaplastickej transformácie [6].
O resekcii LGG ako o faktore zlepšujúcom prognózu sa v odbornej literatúre vedú neustále diskusie, najmä pre nejestvujúci dôkaz I. triedy. Aj v niektorých nových prácach je význam chirurgickej liečby najmä u asymtomatických LGG čiastočne spochybňovaný, resp. považovaný za nejasný [2,3]. V poslednom čase však pribudlo viacero retrospektívnych štúdií informujúcich, že radikalita resekcie signifikantne koreluje s prognózou pacientov s LGG [6–9,52].
Stereotaktická biopsia je v súčasnosti odporúčaná v prípadoch, kedy resekcia LGG nie je možná [11], diagnostika, ako i určenie stupňa zhubnosti gliómov z tkaniva získaného stereotaktickou biopsiou sú však zaťažené veľkou mierou nepresnosti [53].
Vplyv radikality resekcie LGG na prognózu pacienta
Bolo publikovaných viacero prác, ktoré skúmali na dostatočne veľkých súboroch (n > 85) vplyv radikality resekcie supratentoriálnych LGG na dĺžku prežívania pacientov [4–9,52,54–60]. V hodnotených súboroch LGG boli zastúpené iba WHO gr. II gliómy alebo boli údaje o pacientoch s WHO gr. I gliómami jasne odlíšiteľné.
Autori hodnotili radikalitu resekcie jednak podľa percentuálneho pomeru objemu reziduálneho tumoru voči predoperačnému objemu nádoru, t.j. ako percentuálny rozsah resekcie [4,56,57,59], podľa percentuálneho pomeru najväčšieho rozmeru reziduálneho tumoru voči predoperačnému najväčšiemu rozmeru tumoru [8,60], podľa absolútneho objemu reziduálneho tumoru [7] alebo podľa toho, či je alebo nie je prítomné akékoľvek reziduálne tkanivo tumoru [52,58]. McGirt et al hodnotili radikalitu resekcie podľa toho, či bolo tkanivo nádoru úplne odstránené, odstránené so zvyškovým lemom na okrajoch resekčnej dutiny do 3 mm, alebo bolo ponechané nodulárne rezíduum [6]. Smith et al hodnotili percentuálny rozsah resekcie, ako aj absolútny objem reziduálneho nádoru [9]. V niektorých prácach údaje o tom, ako bola hodnotená radikalita resekcie, chýbali [5,54,55].
V starších prácach, resp. v prácach retrospektívne skúmajúcich staršie dáta bolo na hodnotenie radikality použité subjektívne zhodnotenie radikality operatérom v operačnom protokole [4,5,54–56], pooperačná počítačová tomografia (CT) [57,58], alebo pooperačné CT a pooperačné MR pre rozdielne časti súboru [59,60]. Prezentované výsledky neboli jednotné. Zatiaľ čo niektoré práce poukazovali na predĺženie prežívania pacientov po rozsiahlej resekcii LGG [54,56–60], iné tento fakt spochybňovali [4,5,55]. Hodnotenie radikality resekcie LGG neurochirurgom po skončení operácie býva však často nepresné [51] a pooperačné CT je vzhľadom na nízku schopnosť zobraziť tkanivo LGG takisto na jej posúdenie málo vhodné. Výpovedná hodnota prác skúmajúcich vplyv resekcie LGG na ich prognózu, v ktorých je radikalita resekcie posudzovaná podľa odhadu chirurga alebo na základe CT by preto z tohto hľadiska mohla byť spochybnená. Ako zaujímavé sa však javí zistenie, že signifikantný vplyv rozsahu resekcie LGG na dĺžku prežívania nezistili práce, ktoré rozsah resekcie hodnotili podľa najmenej spoľahlivého ukazovateľa, t.j. podľa odhadu operatéra [4,5,55]. V prácach, ktoré rozsah resekcie hodnotili podľa CT alebo CT a MR, sa naopak zistila signifikantná korelácia rozsahu resekcie s dĺžkou prežívania ako v jedno-, tak aj vo viacfaktorových analýzach [57–60].
Za objektívnu vyšetrovaciu metódu je v súčasnosti považované pooperačné MR, a to T2 a najmä FLAIR sekvencia [28]. Viacerí autori skúmali vplyv radikality resekcie LGG na dĺžku prežívania, resp. mortalitu na základe pooperačného MR vyšetrenia v T2 alebo FLAIR sekvenciách [6–9,52].
McGirt et al [6], Ahmadi et al [8] a Smith et al [9] pozorovali signifikantnú koreláciu dĺžky prežívania s radikalitou resekcie. Ahmadi et al [8] popisujú signifikantne dlhšie prežívanie u pacientov, u ktorých bol najväčší rozmer reziduálneho tkaniva LGG menší ako 10 % najväčšieho rozmeru pôvodného tumoru (takto definovaná resekcia bola dosiahnutá u 91 zo 130 pacientov). McGirt et al [6] a Smith et al [9] zistili u pacientov s úplne odstráneným predoperačne hyperintenzívnym tkanivom tumoru, t.j. u pacientov, u ktorých bola dosiahnutá rádiologicky radikálna resekcia tzv. gross total removal (obr. 1c) signifikantne dlhšie celkové prežívanie, pričom McGirt et al [6] dosiahli radikálnu resekciu u 65 zo 170 a Smith et al [9] u 75 z 216 pacientov.
Claus et al [52] pozorovali signifikantne vyššiu mortalitu u 100 pacientov s reziduálnym tumorom oproti 56 pacientom s rádiologicky radikálnou resekciou (priemerná doba sledovania tri roky). Pacienti bez rezídua LGG mali 4,9-násobne nižšie riziko úmrtia ako pacienti s ponechaným rezíduom tumoru [52]. Dosiahnutie radikálnej resekcie je taktiež asociované s predĺžením času do malígnej transformácie LGG [6].
U neúplne odstránených tumorov (napr. u tumorov so zavzatými elokventnými štruktúrami) je dôležitý fakt, aké veľké rezíduum nádoru bolo nutné ponechať a aký bol percentuálny rozsah resekcie. Veľkosť rezídua i percentuálny rozsah resekcie korelujú s prognózou pacienta.
Duffau et al [7] pozorovali u pacientov s objemom reziduálneho tumoru menším ako 10 cm3 nižšiu mortalitu v porovnaní s pacientmi, u ktorých bolo ponechané väčšie rezíduum (doba sledovania trvala 77 mesiacov u 100 pacientov operovaných od roku 1985 do roku 1996 a 48 mesiacov u 122 pacientov operovaných od 1996 do roku 2003). Na druhej strane Smith et al pozorovali aj u pacientov s malým rezíduom tumoru (s objemom do 5 cm3) signifikantne kratšie prežívanie ako u pacientov bez pooperačného rezídua [9].
Pacienti s aspoň 90% rozsahom resekcie, t.j. resekciou aspoň 90 % z nádorového tkaniva hyperintezívneho vo FLAIR sekvencii, mali päťročné prežívanie 97 % a osemročné prežívanie 91 %, zatiaľ čo pacienti s menšou resekciou mali päť - a osemročné prežívanie 76 a 60 %; percentuálny rozsah resekcie bol zároveň i signifikantných prediktorom času do malígnej transformácie [9].
Vzhľadom na inkompatibilitu kritérií hodnotenia radikality resekcie používaných autormi jednotlivých vyššie uvedených publikácií, nemožno výsledky prác navzájom plne korelovať. Všetky uvedené práce používajúce na hodnotenie T2 alebo FLAIR sekvenciu však dokázali signifikantnú závislosť dĺžky prežívania [6,8,9], resp. mortality počas doby sledovania [7,52] na radikalite resekcie.
Trvalý novovzniknutý pooperačný deficit zaznamenali Smith et al [9] u menej ako 2 % z 216 pacientov, McGirt et al [6] u 6 % zo 170 operovaných prípadov. Duffau et al [7] zaznamenali trvalý novovzniknutý pooperačný deficit u 17 % zo 100 pacientov operovaných bez priamej elektrickej stimulácie (PES), ale len u 6,5 % zo 122 pacientov operovaných s využitím PES. Ahmadi et al [8] ani Claus et al [52] počet novovzniknutých pooperačných deficitov neuvádzajú.
Načasovaniu operácie, teda otázke, či je potrebné LGG operovať po stanovení diagnózy, alebo až pri jasnej progresii rastu, alebo malígnej transformácii LGG, sa práce hodnotiace vplyv radikality resekcie na dĺžku prežívania LGG na základe v súčasnosti najspoľahlivejších kritérií (MR T2 a FLAIR sekvencií) nevenovali. Vo svetle výsledkov týchto prác je však pri dnešnej úrovni bezpečnosti neurochirurgických operácií odklad operácie resekovateľných LGG len ťažko odôvodniteľný [10], najmä vzhľadom na ich kontinuálny rast [16] a fakt, že menšie tumory sú radikálnejšie resekovateľné [25]. Včasná operačná liečba je opodstatnená aj vzhľadom na riziko malígnej transformácie, ktorú je pravdepodobne možné radikálnou resekciou oddialiť [6,9].
Problém selekcie pacientov
Pri skúmaní úlohy chirurgickej liečby v terapii LGG retrospektívnymi štúdiami je problémom viacerých prác tzv. selection bias – teda vysoký predpoklad, že radikálnejšie sú resekovateľné tumory s predpokladanou lepšou prognózou ( t.j. menšie nádory, lepšie ohraničené tumory, nádory v neelokventných lokalitách a pod.), teda, že prezentované zlepšenie prognózy pacientov s LGG po dosiahnutí radikálnej resekcie by mohlo byť vlastne len vyjadrením toho, že nádory, ktoré majú predpoklad lepšej prognózy (aj bez operačného zákroku), sú aj lepšie resekovateľné [4].
Signifikantná korelácia radikality resekcie bola však zaznamenaná aj u rozsiahlych LGG lokalizovaných v elokventných oblastiach. Duffau et al [7] skúmali dva súbory pacientov operovaných v dvoch rozdielnych časových obdobiach rozličnými operačnými technikami – bez využitia PES (100 pacientov) a s využitím PES (122 pacientov). Subtotálna resekcia bola autormi definovaná ako operácia s ponechaným rezíduom LGG menším ako 10 cm3, radikálna resekcia ako operácia bez ponechania reziduálneho tumoru. Na hodnotenie objemov LGG boli použité mimo T1 sekvencie aj T2 a/alebo FLAIR sekvencia. V súbore s využitím PES bolo dosiahnutých 50,8 % subtotálnych resekcií a 25,4 % radikálnych resekcií, signifikantne viac ako v súbore bez využitia PES (37 % subtotálnych a 6 % radikálnych resekcií). V súbore pacientov operovaných s využitím PES bolo navyše 62 % nádorov lokalizovaných v elokventných oblastiach, signifikantne viac ako bolo elokventne lokalizovaných LGG v súbore bez využitia PES (35 %). Autori teda dokladovali, že PES umožňuje signifikantne radikálnejšiu resekciu LGG, vrátane nádorov lokalizovaných v elokventných oblastiach a umožnila resekovať aj také LGG, aké boli v čase bez jej využitia považované za neresekovateľné. Z onkologického hľadiska bol prezentovaný dôležitý fakt, že v oboch súboroch nastalo po radikálnej, ako aj subtotálnej resekcii LGG signifikantné zlepšenie prognózy (signifikantne nižšie percento úmrtí počas doby sledovania) v porovnaní so súborom pacientov s parciálne resekovanými nádormi. Teda napriek tomu, že v súbore pacientov operovaných s pomocou PES boli zastúpené i tumory, aké boli v predchádzajúcom období považované za inoperabilné (a teda s očakávaním kratšieho prežívania), aj prognóza takýchto tumorov bola pozitívne ovplyvnená dosiahnutím radikálnej, event. subtotálnej resekcie [7].
Napriek dôležitosti publikovaných retrospektívnych štúdií, „selection bias“ naďalej ostáva problémom zahmlievajúcim dôležitosť vplyvu operačnej liečby na prognózu supratentoriálnych LGG u dospelých pacientov. Žiadna prospektívna randomizovaná štúdia, ktorá by tento „selection bias“ odstránila, doteraz nebola, a pravdepodobne ani nikdy nebude, realizovaná, pretože by narazila na závažné etické problémy. Hoci autori jednotlivých retrospektívnych štúdií skúmali validitu nadobudnutých výsledkov vo viacfaktorových analýzach (vzhľadom na vek, predoperačnú veľkosť tumoru, histologický typ atď.), nenašli sme jedinú publikáciu, v ktorej by autori vo viacfaktorovej analýze brali do úvahy aj ohraničenie LGG na MR. Pritom práve morfológia hraníc nádoru na MR je často značne rozdielna aj v rámci jednotlivých histologických typov a je dôležitým faktorom ovplyvňujúcim resekabilitu tumoru [19,24,25].
Záver
Hoci nebol prínos chirurgickej liečby na prognózu LGG verifikovaný prospektívnou randomizovanou štúdiou, stále sa objavujú nové práce založené na kvalitnejších vstupných dátach, ktoré dokladujú zlepšenie prognózy pacientov s LGG po rozsiahlej resekcii nádoru.
Vzhľadom na to, že dôkaz prvého stupňa potvrdzujúci výsledky týchto prác pravdepodobne nikdy nebude možné získať, je potrebné terapeutickú stratégiu prispôsobiť najlepším dôkazom, aké sú k dispozícii. Vzhľadom na výsledky nových prác používajúcich na hodnotenie resekcie T2 alebo FLAIR sekvenciu a vzhľadom na dnešnú úroveň bezpečnosti neurochirurgických operácií, je v súčasnosti maximálna možná resekcia LGG považovaná za základnú terapeutickú metódu vo všetkých prípadoch, kedy je bezpečne uskutočniteľná [10,11].
MUDr. Andrej Šteňo
Neurochirurgická klinika
LF UK a UN Bratislava
Nemocnica ak. L. Dérera
Limbová 5
833 04 Bratislava
e-mail: andrej.steno@gmail.comPrijaté k recenzii: 6. 9. 2010
Prijaté do tlače: 5. 11. 2010
Zdroje
1. Whittle IR. The dilemma of low grade glioma. J Neurol Neurosurg Psychiatry 2004; 75 (Suppl 2): ii31–ii36.
2. Whittle IR. What is the place of conservative management for adult supratentorial low-grade glioma? Adv Tech Stand Neurosurg 2010; 35 : 65–79.
3. Zárubová J. Nízkostupňový gliom (fibrilární astrocytom) a epilepsie. Neurol pro praxi 2009; 10(5): 324–327.
4. Pignatti F, van den Bent M, Curran D, Debruyne C, Sylvester R, Therasse P et al. Prognostic factors for survival in adult patients with cerebral low-grade glioma. J Clin Oncol 2002; 20(8): 2076–2084.
5. Johannesen TB, Langmark F, Lote K. Progress in long-term survival in adult patients with supratentorial low-grade gliomas: a population-based study of 993 patients in whom tumors were diagnosed between 1970 and 1993. J Neurosurg 2003; 99(5): 854–862.
6. McGirt MJ, Chaichana KL, Attenello FJ, Weingart JD, Than K, Burger PC et al. Extent of surgical resection is independently associated with survival in patients with hemispheric infiltrating low-grade gliomas. Neurosurgery 2008; 63(4): 700–707.
7. Duffau H, Lopes M, Arthuis F, Bitar A, Sichez JP, Van Effenterre R et al. Contribution of intraoperative electrical stimulations in surgery of low grade gliomas: a comparative study between two series without (1985–96) and with (1996–2003) functional mapping in the same institution. J Neurol Neurosurg Psychiatry 2005; 76(6): 845–851.
8. Ahmadi R, Dictus C, Hartmann C, Zürn O, Edler L,Hartmann M. Long-term outcome and survival of surgically treated supratentorial low-grade glioma in adult patients. Acta Neurochir (Wien) 2009; 151(11): 1359–1365.
9. Smith JS, Chang EF, Lamborn KR, Chang SM, Prados MD, Cha S et al. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol 2008; 26(8): 1338–1345.
10. Pouratian N, Schiff D. Management of low--grade glioma. Curr Neurol Neurosci Rep 2010; 10(3): 224–231.
11. Soffietti R, Baumert BG, Bello L, von Deimling A, Duffau H, Frénay M et al. Guidelines on management of low-grade gliomas: report of an EFNS-EANO* Task Force. Eur J Neurol 2010; 17(9): 1124–1133.
12. Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery 2008; 62(4): 753–764.
13. Perry A. Pathology of low-grade gliomas: an update of emerging concepts. Neuro Oncol 2003; 5(3): 168–178.
14. Schiffbauer H, Ferrari P, Rowley HA, Berger MS, Roberts TP. Functional activity within brain tumors: a magnetic source imaging study. Neurosurgery 2001; 49(6): 1313–1320.
15. Duffau H, Capelle L. Preferential brain locations of low-grade gliomas. Cancer 2004; 100(12): 2622–2626.
16. Mandonnet E, Pallud J, Fontaine D, Taillandier L, Bauchet L, Peruzzi P et al. Inter - and intrapatients comparison of WHO grade II glioma kinetics before and after surgical resection. Neurosurg Rev 2010; 33(1): 91–96.
17. Afra D, Osztie E, Sipos L, Vitanovics D. Preoperative history and postoperative survival of supratentorial low-grade astrocytomas. Br J Neurosurg 1999; 13(3): 299–305.
18. Frazier JL, Johnson MW, Burger PC, Weingart JD, Quinones-Hinojosa A. Rapid malignant transformation of low-grade astrocytomas: report of 2 cases and review of the literature. World Neurosurg 2010; 73(1): 53–62.
19. Chang EF, Smith JS, Chang SM, Lamborn KR, Prados MD, Butowski N et al. Preoperative prognostic classification system for hemispheric low-grade gliomas in adults. J Neurosurg 2008; 109(5): 817–824.
20. Bartoš R, Sameš M, Julišová I, Derner M, Hladíková M. Supratentoriální gliom WHO grade II. Retrospektivní studie 37 pacientů. Cesk Slov Neurol N 2003; 66/99(5): 355–360.
21. Houillier C, Mokhtari K, Carpentier C, Crinière E, Marie Y, Rousseau A. Chromosome 9p and 10q losses predict unfavorable outcome in low-grade gliomas. Neuro Oncol 2010; 12(1): 2–6.
22. Rees J, Watt H, Jäger HR, Benton C, Tozer D, Tofts Pet al. Volumes and growth rates of untreated adult low-grade gliomas indicate risk of early malignant transformation. Eur J Radiol 2009; 72(1): 54–64.
23. Brasil Caseiras G, Ciccarelli O, Altmann DR, Benton CE, Tozer DJ, Tofts PS et al. Low-grade gliomas: six-month tumor growth predicts patient outcome better than admission tumor volume, relative cerebral blood volume, and apparent diffusion coefficient. Radiology 2009; 253(2): 505–512.
24. Hentschel SJ, Lang FF. Surgical resection of intrinsic insular tumors. Neurosurgery 2005; 57 (Suppl 1): 176–183.
25. Talos IF, Zou KH, Ohno-Machado L, Bhagwat JG, Kikinis R, Black PM. Supratentorial low-grade glioma resectability: statistical predictive analysis based on anatomic MR features and tumor characteristics. Radiology 2006; 239(2): 506–513.
26. Rychlý B, Fabián M. Oligodendrogliové tumory: histologicko-rádiologické korelácie. Lek Obzor 2010; 5(59): 203–204.
27. Kelly PJ, Daumas-Duport C, Kispert DB, Kall BA, Scheithauer BW, Illig JJ. Imaging-based stereotaxic serial biopsies in untreated intracranial glial neoplasms. J Neurosurg 1987; 66(6): 865–874.
28. Bynevelt M, Britton J, Seymour H, MacSweeney E, Thomas N, Sandhu K. FLAIR imaging in the follow-up of low-grade gliomas: time to dispense with the dual-echo? Neuroradiology 2001; 43(2): 129–133.
29. Stadlbauer A, Buchfelder M, Doelken MT, Hammen T, Ganslandt O. Magnetic resonance spectroscopic imaging for visualization of the infiltration zone of glioma. Cen Eur Neurosurg. In press 2010.
30. Ganslandt O, Stadlbauer A, Fahlbusch R, Kamada K, Buslei R, Blumcke I et al. Proton magnetic resonance spectroscopic imaging integrated into image-guided surgery: correlation to standard magnetic resonance imaging and tumor cell density. Neurosurgery 2005; 56 (Suppl 2): 291–298.
31. BelanV, Pružincová Ľ, Srbecký M. MR v diagnostike a liečbe primárnych nádorov mozgu. Onkológia (Bratisl) 2010; 5(3): 138–141.
32. Pročka V, Makaiová I, Šteňo J, Kalina P, Belan V, Pružincová Ľ et al. Skúsenosti s využitím 18FDG PET v diferenciálnej diagnostike low-grade a high-grade gliómov. Onkológia (Bratisl) 2010; 5(3): 156–161.
33. van den Bent MJ, Afra D, de Witte O, Ben Hassel M, Schraub S, Hoang-Xuan K et al. Long-term efficacy of early versus delayed radiotherapy for low--grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet 2005; 366(9490): 985–90.
34. Pružincová L, Šteňo J, Srbecký M, Kalina P, Rychlý B, Bolješíková E et al. MR imaging of late radiation therapy - and chemotherapy-induced injury: a pictorial essay. Eur Radiol 2009; 19(11): 2716–2727.
35. Chorvath M, Boljesikova E, Pruzincova L, Procka V, Rychly B, Novotny M et al. Post-therapeutical changes in the brain: novel trends in imaging and their infuence on external beam radiotherapy. Neoplasma 2009; 56(2): 156–162.
36. Neyns B, Sadones J, Chaskis C, De Ridder M, Keyaerts M, Veld PI at al. The role of chemotherapy in the treatment of low-grade glioma. A review of the literature. Acta Neurol Belg 2005; 105(3): 137–143.
37. Murphy PS, Viviers L, Abson C, Rowland IJ, Brada M, Leach MO et al. Monitoring temozolomide treatment of low-grade glioma with proton magnetic resonance spectroscopy. Br J Cancer 2004; 90(4): 781–786.
38. Kesari S, Schiff D, Drappatz J, LaFrankie D, Doherty L, Macklin EA et al. Phase II study of protracted daily temozolomide for low-grade gliomas in adults. Clin Cancer Res 2009; 15(1): 330–337.
39. Pace A, Vidiri A, Galiè E, Carosi M, Telera S, Cianciulli AM et al. Temozolomide chemotherapy for progressive low-grade glioma: clinical benefits and radiological response. Ann Oncol 2003; 14(12): 1722–1726.
40. Kaloshi G, Benouaich-Amiel A, Diakite F, Taillibert S, Lejeune J, Laigle-Donadey F et al. Temozolomide for low-grade gliomas: predictive impact of 1p/19q loss on response and outcome. Neurology 2007; 68(21): 1831–1836.
41. Brada M, Viviers L, Abson C, Hines F, Britton J, Ashley S et al. Phase II study of primary temozolomide chemotherapy in patients with WHO grade II gliomas. Ann Oncol 2003; 14(12): 1715–1721.
42. Ricard D, Kaloshi G, Amiel-Benouaich A, Lejeune J, Marie Y, Mandonnet E. Dynamic history of low-grade gliomas before and after temozolomide treatment. Ann Neurol 2007; 61(5): 484–490.
43. Mraček J, Choc M, Hes O, Vaněček T. Současná diagnostika a léčba oligodendrogliomú. Cesk Slov Neurol N 2008; 71/104(5): 537–543.
44. Bartoš R, Sameš M, Vachata P, Červenka M, Jech R, Vymazal J et al. Výsledky a tolerance „awake“ resekcí mozkových tumorů. Cesk Slov Neurol N 2005; 68/101(1): 39–45.
45. Bartoš R, Ceé J, Zolal A, Hejčl A, Bolcha M, Prokšová J et al. Extraoperativní mapování pomocí kortikálního gridu před resekcí difuzního oligodendrogliomu v řečově dominantní hemisféře – alternativa „awake kraniotomie“ – kazuistika. Cesk Slov Neurol N 2008; 71/104(6): 718–721.
46. Galanda M, Babicová A, Patráš F, Šulaj J, Béreš A. Peroperačná elektrická stimulácia pri operáciách v centrálnych oblastiach mozgu a v mieche. Cesk Slov Neurol N 2001; 64/97(5): 338–343.
47. Šteňo A, Čík M. Šteňo J. Súčasný technický pokrok v neurochirurgii a jeho vplyv na chirurgickú liečbu gliových nádorov mozgu. Onkológia (Bratisl) 2010; 5(3): 132–137.
48. Filip M, Paleček T, Starý R, Lipina R, Mrůzek M, Školoudík D et al. Ultrazvukový peroperační monitoring glioblastomů v 2D obraze a reálním čase. Cesk Slov Neurol N 2004; 67/100(1): 42–46.
49. Unsgaard G, Ommedal S, Muller T, Gronningsaeter A, Nagelhus Hernes TA. Neuronavigation by intraoperative three-dimensional ultrasound: initial experience during brain tumor resection. Neurosurgery 2002; 50(4): 804–812.
50. Ostrý S., Stejskal L. Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii. Cesk Slov Neurol N 2010; 73/106(1): 8–19.
51. Schneider JP, Schulz T, Schmidt F, Dietrich J, Lieberenz S, Trantakis C et al. Gross-total surgery of supratentorial low-grade gliomas under intraoperative MR guidance. AJNR Am J Neuroradiol 2001; 22(1): 89–98.
52. Claus EB, Horlacher A, Hsu L, Schwartz RB, Dello-Iacono D, Talos F et al. Survival rates in patients with low-grade glioma after intraoperative magnetic resonance image guidance. Cancer 2005; 103(6): 1227–1233.
53. Jackson RJ, Fuller GN, Abi-Said D, Lang FF, Gokaslan ZL, Shi WM et al. Limitations of stereotactic biopsy in the initial management of gliomas. Neuro Oncol 2001; 3(3): 193–200.
54. Philippon JH, Clemenceau SH, Fauchon FH, Foncin JF. Supratentorial low-grade astrocytomas in adults. Neurosurgery 1993; 32(4): 554–559.
55. Rajan B, Pickuth D, Ashley S, Traish D, Monro P, Elyan S et al. The management of histologically unverified presumed cerebral gliomas with radiotherapy. Int J Radiat Oncol Biol Phys 1994; 28(2): 405–413.
56. van Veelen ML, Avezaat CJ, Kros JM, van Putten W, Vecht C. Supratentorial low grade astrocytoma: prognostic factors, dedifferentiation, and the issue of early versus late surgery. J Neurol Neurosurg Psychiatry 1998; 64(5): 581–587.
57. Nakamura M, Konishi N, Tsunoda S, Nakase H, Tsuzuki T, Aoki H. Analysis of prognostic and survival factors related to treatment of low-grade astrocytomas in adults. Oncology 2000; 58(2): 108–116.
58. Yeh SA, Ho JT, Lui CC, Huang YJ, Hsiung CY, Huang EY. Treatment outcomes and prognostic factors in patients with supratentorial low-grade gliomas. Br J Radiol 2005; 78(927): 230–235.
59. Leighton C, Fisher B, Bauman G, Depiero S, Stitt L, MacDonald D et al. Supratentorial low-grade glioma in adults: an analysis of prognostic factors and timing of radiation. J Clin Oncol 1997; 15(4): 1294–1301.
60. Scerrati M, Roselli R, Iacoangeli M, Pompucci A, Rossi GF. Prognostic factors in low grade (WHO grade II) gliomas of the cerebral hemispheres: the role of surgery. J Neurol Neurosurg Psychiatry 1996; 61(3): 291–296.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2011 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Léčba adenomů hypofýzy
- Kognitivní funkce při onemocnění vnitřní krkavice a vliv léčebných intervencí
- Farmakologická sekundární prevence nekardioembolického mozkového infarktu/tranzitorní ischemické ataky – současnost a budoucnost
- Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómami
- Pacient ve vegetativním stavu a jeho rehabilitace
- Hypothalamo-hypofyzární dysfunkce po kraniocerebrálních traumatech a po spontánním subarachnoidálním krvácení
- Vliv funkčního mapování na výsledky operací nízkostupňových gliomů WHO grade II
- Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnie
- Stereotaktické ozáření nízkostupňových gliomů na Leksellově gama noži
- Peroperační měření průtoku likvoru pomocí ultrazvuku při dekompresi cervikokraniálního přechodu u Chiariho malformace typu I
- Peroperační monitoring aktivovaného koagulačního času při karotické endarterektomii
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
- Limbická encefalitida – dvě kazuistiky
- Difuzně vážený obraz a možnost predikce vývoje mozkové žilní trombózy na magnetické rezonanci – dvě kazuistiky
- Jednostranné intravitreální krvácení po předávkování metamfetaminem (pervitinem): varianta Tersonova syndromu u 16letého narkomana – kazuistika
- Uzávěr bazilární tepny disekcí v souvislosti s manipulací krční páteře – kazuistika
- Organizovaný chronický subdurální hematom – kazuistiky
- Chronická žilní cerebrospinální insuficience u roztroušené sklerózy – staronový koncept, nové otázky?
- Webové okénko
-
Analýza dat v neurologii.
XXVII. Hodnocení diagnostických testů – vliv prevalence nemoci - VII. olomoucký workshop cévní neurologie 11. neurosonologické dny – „Pokroky v neurosonologii“
- 15. Jedličkovy neuroimunologické a likvorologické dny
- Atypical Parkinsonian Syndromes – an International Symposium on Neurodegenerative Diseases
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba adenomů hypofýzy
- Limbická encefalitida – dvě kazuistiky
- Pacient ve vegetativním stavu a jeho rehabilitace
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



