-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hypothalamo-hypofyzární dysfunkce po kraniocerebrálních traumatech a po spontánním subarachnoidálním krvácení
Hypothalamo-Pituitary Dysfunction Following Traumatic Brain Injury and Spontaneous Subarachnoid Haemorrhage
The authors provide a review of observed hypothalamo-pituitary dysfunction following traumatic brain injury (TBI) and spontaneous subarachnoid haemorrhage (SAH) based on studies published in peer-reviewed journals. In most of the studies published in the last ten years, neuro-endocrine dysfunction after TBI and SAH appeared more often than previously. Impaired secretion of anterior pituitary hormones was diagnosed after TBI in up to 28.9% of cases and after SAH in up to 56.8%. Diabetes insipidus centralis was observed after TBI in acute phase in 26% and in chronic phase in 6.9%. Some recent studies did not confirm such high frequency. Currently we cannot predict the potential risk of neuro-endocrine sequelae of TBI in the individual patient. Although guidelines for endocrine evaluation of patients after TBI and SAH have been published, it appears that they have not yet become part of routine practice.
Key words:
hypothalamo-pituitary dysfunction – hypopituitarism – diabetes insipidus centralis – traumatic brain injury – subarachnoid haemorrhage
Autoři: M. Kosák; V. Hána
Působiště autorů: III. interní klinika 1. LF UK a VFN v Praze
Vyšlo v časopise: Cesk Slov Neurol N 2011; 74/107(3): 286-291
Kategorie: Přehledný referát
Souhrn
Článek podává přehled o výskytu endokrinních poruch hypothalamo-hypofyzární jednotky po traumatech mozku a spontánním subarachnoidálním krvácení ve studiích publikovaných v recenzovaných časopisech. Poruchy neuroendokrinních funkcí po traumatech mozku (TBI) a po spontánním subarachnoidálním krvácení (SAH) se ve většině publikovaných studií, zejména z posledních deseti let, popisují s podstatně vyšší frekvencí, než se dříve soudilo. Poruchy sekrece adenohypofyzárních hormonů se vyskytují po TBI až v 28,9 % a po SAH až v 56,8 %. Diabetes insipidus centralis je pozorován po TBI v akutní fázi v 26 % a v chronické v 6,9 %. Některé studie z poslední doby tak závažné nálezy nepotvrdily. Zatím nedokážeme jasně určit míru rizika potenciálních neuroendokrinních komplikací u jednotlivých pacientů. Přes publikovaná doporučení, poukazující na možné závažné neuroendokrinní následky TBI a SAH, se zdá, že zatím není těmto možným komplikacím uvedených nitrolebních afekcí věnována v klinické praxi patřičná pozornost.
Klíčová slova:
hypothalamo-hypofyzární dysfunkce – hypopituitarizmus – diabetes insipidus centralis – traumatické poškození mozku – spontánní subarachnoidální krváceníÚvod
Kraniocerebrální traumata (v anglosaské literatuře označovaná „traumatic brain injury“, TBI) představují závažný zdravotní problém. Incidence TBI je v Evropě uváděna 235/100 000 osob za rok [1]. Ohrožují jedince nejen ve fázi akutní, kdy jde o nejčastější příčinu smrti a vážného poškození zdraví v mladém věku, ale i svými dlouhodobými následky. Subarachnoidální krvácení (SAH) z aneuryzmatu se vyskytuje u 6–10 /100 000 osob ročně [2]. Práce z posledních let ukázaly, že u obou stavů je nutné myslet v akutní i chronické fázi na možnost neuroendokrinních dysfunkcí s potenciálně závažnými důsledky [3]. Porucha kortikotropní osy může vyústit až v addisonskou krizi, ale i deficit dalších hypofyzárních hormonů zásadním způsobem ovlivní kvalitu života pacienta a může přispět k časnější mortalitě. Záludnost poruchy hypofyzárních funkcí spočívá v někdy nespecifické nebo minimální symptomatologii, která může být přisuzována posttraumatické stresové poruše – únavnost, nevýkonnost, spavost, ztráta libida a pokles sexuálních funkcí apod. Většina prací z posledních let včetně multicentrických studií a metaanalýz [3] popisuje poměrně častý výskyt neuroendokrinních dysfunkcí po TBI i SAH, avšak práce Klose et al [4] z roku 2010 přináší rozporné nálezy oproti dosud publikovaným. V roce 2005 byla publikována mezinárodní doporučení pro skríning hypopituitarizmu po traumatickém poškození mozku [5] a v ČR existuje doporučený postup České endokrinologické společnosti věnovaný diagnostice a léčbě u dospělých pacientů [6].
Poruchy sekrece hypofyzárních hormonů byly popsány i po operacích mozku vzdálených od hypothalamu a hypofýzy [7]. Předkládáme aktuální přehled z literatury věnované této problematice.
Frekvence výskytu TBI a SAH
Incidence úrazů mozku dětí, adolescentů a mladých dospělých do 25 let je v průměru 1,75/100 za jeden rok a z nich si 1/3 vyžádá hospitalizaci. Středně těžká až těžká poranění tvoří kolem 10 %. Nejčastějšími příčinami jsou ve věku 0–14 let pády a od 15 do 25 let kontaktní sporty a havárie motorových vozidel [8]. Ve Spojeném království Velké Británie a Severního Irska dochází k úrazům hlavy přibližně u 180 dětí na 100 000 obyvatel ročně a z toho u 5,6 dětí má zranění nejtěžší stupeň (Glasgow Coma Scale, GCS, pod 8), vyžadující léčení na jednotce intenzivní péče [9]. Výskyt a etiologii kraniocerebrálních traumat u dětí a adolescentů v České republice popsala Brichtová z FN Brno – nejčastější příčinou bylo sražení dopravním prostředkem (maximum výskytu ve věku 7–10 let), upadnutí (maximum výskytu ve skupině 2–6 let), pád za jízdy, autonehody, pád z výšky [10].
U dospělých je incidence těžkého poranění mozku přibližně 30/100 000 obyvatel (5krát vyšší než u dětí). Incidence lehkých TBI se odhaduje v dospělosti asi na 100–600/100 000 (rozptyl je dán rozdíly v definici) [11]. U dospělých jsou hlavní příčinou TBI pády (28 %, zejména nad 75 let), druhé nejčastější jsou úrazy při autonehodě (20 %). Výskyt, etiologické faktory poranění mozku a komplexní zhodnocení problematiky u dospělých v ČR publikovali Smrčka et al [12].
Spontánní subarachnoidální krvácení nastane každý rok u 6–10 osob ze 100 000 obyvatel [2].
Poruchy sekrece hormonů adenohypofýzy v souvislosti s TBI a SAH
Sekrece adenohypofyzárních hormonů je regulována releasing hormony hypothalamu, a proto hovoříme o tzv. hypothalamo-hypofyzární funkční jednotce. Porucha sekrece hypofyzárních hormonů může nastat na úrovni hypothalamu nebo hypofýzy. Studie ukázaly, že při posuzování endokrinních poruch po TBI a po subarachnoidálním krvácení je nutné brát v úvahu časový faktor. Některé poruchy v akutní fázi jsou do určité míry společné pro stresové stavy obecně a mohou mít charakter tranzitorní funkční poruchy. Poruchy v akutní fázi nemusí tedy vždy přímo signalizovat organické poškození hypothalamo-hypofyzární jednotky.
Akutní fáze
Časně po úrazu stoupá sérový kortizol, který se v průběhu několika dnů normalizuje [13]. Pro aktivaci adrenokortikotropní osy svědčí i chybějící supresibilita kortizolu po podání kortikosteroidů. V některých studiích byla popsána přinejmenším přechodná parciální sekundární adrenokortikální insuficience (definovaná plazmatickým kortizolem pod 15 µg/ dl = 414 nmol/ l) až u 50 % pacientů po středně těžkém až těžkém TBI a tito pacienti měli i nižší TK a potřebovali větší podporu vazopresorickými aminy [14]. U nemocných s vystupňovanou protrahovanou zánětlivou odpovědí je v kritickém stavu popisována relativní parciální kortikosteroidní insuficience vyvolaná sníženou adrenokortikální sekrecí spolu s rezistencí tkání na kortikoidy. Podezření na ni vzniká především u septických pacientů špatně reagujících na podání tekutin a vazopresorických látek (Diagnostická a terapeutická doporučení byla publikována v roce 2008 [15]). V etiologii poruchy se uplatňuje zřejmě více mechanizmů jako inhibiční vliv TNFα na účinek corticotropin releasing faktoru na sekreci ACTH a na působení ACTH a angiotenzinu II na sekreci adrenálních buněk. Dále se zvažuje i možný vliv deficitu substrátu – LDL cholesterolu na sníženou sekreci kortizolu [16]. Vliv podání kortikosteroidů na stav pacientů s TBI zkoumala mezinárodní studie MRC CRASH. Podávání metylprednizolonu v prvých dvou dnech po TBI následky u pacientů však nejen že nezlepšilo, ale naopak mortalita i riziko závažných následků u pacientů stouply proti placebu a studie byla předčasně zastavena [17]. Ve vztahu k sekreci kortikoidů u pacientů s TBI v akutní fázi je nutné upozornit na inhibiční působení anestetika etomidatu na steroidogenezi.
V akutní fázi po úrazu mozku je častý obraz centrálního hypogonadizmu, který se objevuje i při jiných závažných stavech (akutních i v rámci chronických onemocnění). Některé studie nacházely souvislost mezi stupněm závažnosti TBI a mírou poklesu testosteronu [13], jiní autoři však tuto korelaci nepotvrdili [18]. Centrální hypogonadizmus je možné nahlížet jako adaptační reakci, která snížením anabolicky působícího testosteronu redukuje spotřebu energie.
Parametry tyroidálních funkcí v akutní fázi po TBI vykazují velmi rozdílné výsledky. Typické je snížení volného trijodtyroninu (free T3, fT3) v rámci tzv. low T3 syndromu (euthyroid sick syndrome), někdy i volného tyroxinu (free T4, fT4) [19]. Data však nejsou konzistentní a někdy jsou pozorovány fT3 i fT4 v normě či dokonce zvýšené. Stejně nejednoznačné výsledky platí i pro TSH. Podle některých prací je snížení volných hormonů štítné žlázy a TSH negativní prognostický faktor [20].
Vzestup sekrece růstového hormonu a prolaktinu v prvých dnech po TBI byl pozorován ve studii Kinga et al [21]. Prolaktin bývá řazen mezi stresové hormony a je pro něj typické zvýšení nad normu, avšak může být i snížen či v normě. Někteří autoři pozorovali korelaci vzestupu PRL s tíží traumatu [22].
V hojně citované práci Agha et al [23] věnované poruchám hypofýzy v akutní fázi po traumatickém poškození mozku byl hypokortikalizmus zjištěn u 16 % z 50 pacientů (hodnoceno glukagonovým testem). Centrální hypotyreóza se vyskytla u jednoho pacienta, deficit růstového hormonu (hodnocený glukagonovým testem) u devíti pacientů (18 %) a centrální hypogonadizmus byl nalezen u 80 % pacientů. U mužů vyšla pozitivní korelace mezi GCS a hladinou testosteronu. Hyperprolaktinemie se prokázala v 52 % [23].
Poruchy sekrece hormonů adenohypofýzy v delším časovém odstupu od TBI a SAH
Porucha funkce hypothalamo-hypofyzární jednotky se může vyvinout i za řadu měsíců od úrazu či spontánního subarachnoidálního krvácení.
V rekonvalescenci po zejména těžších úrazech mozku bývají někdy nespecifické obtíže, jakými jsou únava, deprese, nevýkonnost, které kromě posttraumatické stresové poruchy mohou být způsobeny poruchou hypofyzárních funkcí. Na možnost neuroendokrinní dysfunkce je třeba myslet a podniknout adekvátní diagnostická i terapeutická opatření. V tab. 1 uvádíme symptomy typické pro poruchy jednotlivých os, laboratorní nálezy a stručný přehled stimulačních testů.
Tab. 1. Klinické projevy poruchy hypofyzárních funkcí a jejich diagnostika. 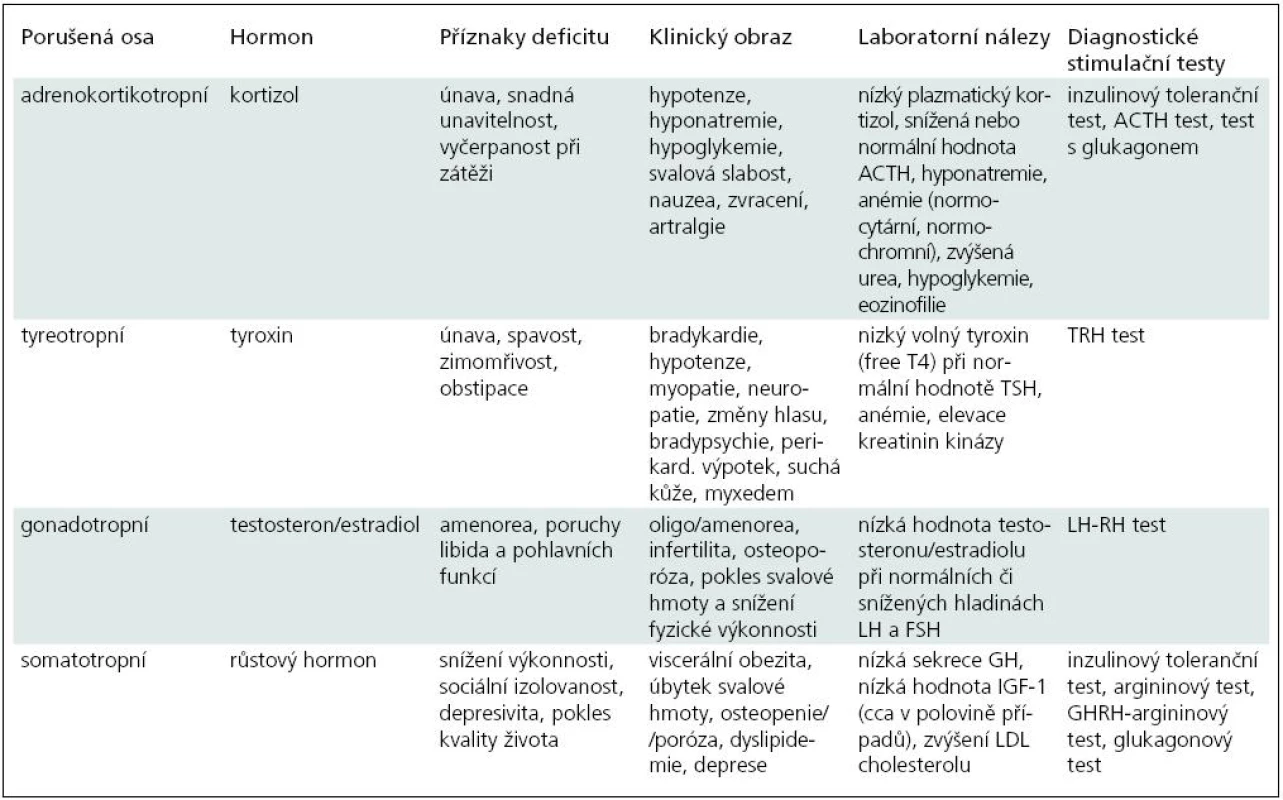
Že se jedná o nezanedbatelný problém, potvrdila analýza studií z let 2000–2007 věnovaná endokrinním poruchám u pacientů po traumatickém poškození mozku a po spontánním subarachnoidálním krvácení. Schneider et al [3] došli k závěru, že riziko rozvoje hypopituitarizmu po TBI je asi 27,5 %, přičemž u SAH dosahuje toto riziko 47 %. Ve většině případů se jednalo o poruchu funkce jedné osy. Obvykle vychází jako nejvulnerabilnější osy somatotropní a gonadotropní, avšak výsledky studií se v otázce četnosti poškození jednotlivých os poměrně značně liší. V často citované studii Agha et al [24] bylo prospektivně vyšetřeno 102 pacientů a porucha alespoň jedné osy byla zjištěna ve 28,4 %. Centrální hypokortikalizmus byl prokázán ve 22,5 %, hypotyreóza v 1 %, centrální hypogonadizmus v 11,8 %, deficit GH v 17,6 % případů. Hyperprolaktinemie se vyskytla u 11,8 % pacientů.
Aimaretti et al [25] vyšetřili soubor pacientů po traumatickém poškození mozku i po spontánním subarachnoidálním krvácení. Celkem bylo vyšetřeno 102 pacientů (70 po TBI, 32 po SAH) Jednalo se o prospektivní studii s vyšetřením v odstupu tří měsíců od úrazu/krvácení a s kontrolou po 12 měsících. Hypopituitarizmus v odstupu 12 měsíců po TBI byl prokázán ve 22,7 % případů (z toho v 5,7 % se jednalo o panhypopituitarizmus), u pacientů se subarachnoidálním krvácením byl parciální hypopituitarizmus po 12 měsících od krvácení zjištěn ve 37,5 %, nikdy se nejednalo o panhypopituitarizmus. V 6,25 % šlo o postižení dvou a více os, v 31,25 % o izolovanou poruchu jedné z os.
Recentně publikovali dánští autoři Klose et al [4] největší studii zaměřenou na prevalenci hypopituitarizmu u 62 pacientů po prodělaném SAH. Endokrinní funkce byly hodnoceny dynamickými testy a podezření na deficit bylo podrobeno konfirmačním testům. V akutní fázi zjistili odchylky u 58 % pacientů (z 26). Kortizol byl snížený pod navrženou hranici u kriticky nemocných 276 nmol/ l u tří pacientů z 26 (12 %) a centrální hypogonadizmus u všech kromě jednoho. Obraz nízkého T3 pozorovali u 35 %, ale volný T4 byl v normě u všech. V chronické fázi neprokázali autoři při takto precizně uspořádané studii hypopituitarizmus u žádného z pacientů. Uvedená studie naznačuje, že dříve publikované relativně časté neuroendokrinní poruchy nemusí být v chronické fázi po SAH tak četné. Jak vysvětlit rozdílné nálezy proti předchozím studiím s výskytem hypopituitarizmu v 38–45% [26–29]? Příčin je zřejmě více – použití rozdílných testů a jiných postupů při testování, rozdílné normy a uplatnění konfirmačních testů při podezření na deficit.
Poruchy funkce adenohypofýzy u dětí
Výsledky studií zaměřených na funkce adenohypofýzy po TBI v dětském věku přinášejí nejednoznačné výsledky. Prospektivní roční studie na 31 dětech se středně těžkým až těžkým traumatem (GCS ≤ 12; průměrně 6) zjistila hormonální dysfunkci v jednom měsíci po traumatu u 15 %, v šesti měsících u 75 % a v jednom roce ve 29 %. V jednom roce z 21 dětí měly tři předčasnou pubertu, dvě hypotyreózu a jedno deficit růstového hormonu. Mnoho z dysfunkcí zjištěných při prvních kontrolách mělo jen lehký a tranzitorní charakter, nevyžadovalo terapeutický zásah a do jednoho roku se upravilo [30]. V jiné, retrospektivní studii [31] na 33 dětech (průměrně 4,3 roky po TBI) autoři nezjistili žádnou klinicky významnou endokrinopatii. K následkům TBI u dětí patří předčasná puberta a její výskyt je vyšší u dívek (54 vs 4,5 % u chlapců) [32]. V ČR zjistili Aleksijevič et al výskyt neuroendokrinní dysfukce jako pozdní následek kraniocerebrálního traumatu u 16,7 % [33]. Přehledně problematiku posttraumatických hormonálních poruch u dětí nedávno publikovali Zapletalová et al [34].
Poruchy sekrece hormonů neurohypofýzy
V retrospektivní analýze 102 pacientů s TBI středně těžkém (9–13/15 GCS) nebo těžkém (GCS 8/15 a méně) prokázali Agha et al [35] diabetes insipidus centralis (DI) ve 21,6 % v akutní posttraumatické fázi a byl přítomen především u pacientů s těžším poškozením a edémem mozku. Syndrom nepřiměřené sekrece vazopresinu (SIADH) se rozvinul u 12,7 % pacientů především v prvním týdnu po traumatu. Hyponatremie způsobená cerebrálním syndromem solné ztráty (CSWS) byla diagnostikována pouze u jednoho pacienta. V chronické fázi (medián 17 měsíců) byl DI přítomen u sedmi (6,9 %) pacientů. U ostatních DI vymizel. Vyšší riziko trvalého DI bylo u pacientů s těžším TBI. V chronické fázi po TBI perzistoval SIADH pouze u jednoho pacienta s obstrukčním hydrocefalem. V jiných, starších studiích [36–39] jsou velké rozdíly ve výskytu SIADH po TBI od 2,3 do 36,6 %, vyplývající z rozdílných diagnostických kritérií a různé délky monitorování. Bondanelli et al v souboru 50 pacientů v chronické fázi po TBI v posledních pěti letech nezjistili u žádného z nich DI [40]. Při hyponatremii v akutní fázi po TBI s podezřením na SIADH je vždy současně nutné vyloučit akutní hypokortikalizmus [41].
U pacientů po SAH v jedné studii Kreitschmann-Andermahr et al neprokázali DI u žádného ze 40 pacientů [27], v jiné Aimaretti et al diagnostikovali DI u 6,25 % pacientů za tři měsíce a u 2,8 % za rok po SAH [25].
Poruchy funkce neurohypofýzy u dětí
V recentně publikované prospektivní studii na 31 dětech se středně těžkým až těžkým poškozením mozku (GCS ≤ 12) byl DI diagnostikován u třech pacientů v akutní fázi a u všech došlo k úpravě do půl roku [30]. V retrospektivní studii 33 pacientů (5,4–21,7 let; medián 13,4 roku) 4,3 roky po TBI nebyl DI popsán u žádného pacienta [31]. Aleksijevič et al pozorovali v akutní posttraumatické fázi tranzitorní DI u třech dětí a SIADH též u třech pacientů z 30 [33]. Lze shrnout, že poruchy sekrece vazopresinu jsou nejvíce vyjádřeny v akutní fázi, a to jak ve smyslu rozvoje DI centralis, tak ve smyslu nepřiměřeně zvýšené sekrece charakteru SIADH. SIADH odezní v časné fázi. Většina případů DI se též upraví během dnů až týdnů, ale některé případy přetrvávají. Na oba tyto stavy i CSWS je nutné v akutní fázi myslet. DI může znamenat závažnou život ohrožující situaci při poruše hypothalamických center signalizujících žízeň anebo při nedostatečném příjmu tekutin s rozvojem těžké dehydratace a rozvratem vnitřního prostředí.
Mechanizmy traumatu a patogeneze poškození hypothalamu a hypofýzy
Na mechanizmy neuroendokrinní dysfunkce po TBI usuzujeme z informací, které máme k dispozici z autopsií, z MR nálezů i z průběhu rozvoje deficitů. Neuropatologické studie popisují poškození hypothalamu a hypofýzy u pacientů zemřelých následkem TBI v 26,4–86 % [42–47]. V autopsiích jsou zjišťovány makro - a mikrohemoragie, infarzace anebo fibrózy v oblasti hypothalamu a hypofýzy. K infarzaci hypofýzy může vést porucha hypothalamo-hypofyzárního portálního oběhu zásobujícího hypofýzu například při zvýšení nitrolebního tlaku. Přímé mechanické přerušení stopky [6,48,49], fraktura baze lební a komprese otokem patří k dalším mechanizmům [50]. Rozsah poškození se pohybuje od ložiskového postižení s destrukcí méně než 10 % tkáně až po nekrózu cca 90 % hypofýzy [47]. Na MR bývá v akutní fázi pozorováno zvětšení hypofýzy oproti kontrolní skupině, ve 30 % s fokálními změnami při krvácení nebo krvácení do ischemie, případně parciální přerušení infundibula [51]. Nedávno publikovaná studie českých autorů [52] našla korelaci mezi hypopituitarizmem a nálezem „empty sella“ na MR v odstupu jednoho roku od traumatu.
Na rozvoji pozdního posttraumatického hypopituitarizmu se zřejmě uplatňuje i spuštění autoimunitního procesu. Tanriverdi et al [53] pozorovali signifikantně vyšší výskyt hypopituitarizmu (46,2 %) u pacientů s autoprotilátkami proti hypofýze (APA) ve srovnání se skupinou APA negativních.
Dosud neexistují práce, které by se systematicky věnovaly patologickým nálezům v hypothalamo-hypofyzární oblasti u pacientů po SAH. Na poškození neuroendokrinních funkcí se mohou podílet přímé poškození krvácením, ischemie a zánět způsobený vazospazmem, vzestup intrakraniálního tlaku, porucha perfuze mozku, lokalizovaný či generalizovaný edém mozku. K častějšímu poškození hypothalamu dochází při ruptuře aneuryzmatu na arteriae communicans anterior a posterior [54].
Rizikové faktory vzniku endokrinních poruch po TBI a SAH
Glasgow Coma Scale (GCS) je nejčastěji používaným kritériem pro posouzení tíže traumatického postižení mozku (v rozsahu 15–13 se trauma mozku hodnotí jako lehké, 12–9 jako středně těžké a 8–3 jako těžké). Dle některých prací existuje asociace mezi stupněm TBI a rizikem vzniku poškození hypothalamo--hypofyzárních funkcí [55], jiné souvislost mezi tíží traumatu a rizikem rozvoje poruchy funkce hypofýzy neshledaly [24]. Další studie nacházejí souvislost mezi zvýšeným intrakraniálním tlakem a rizikem rozvoje hypopituitarizmu [56]. Byla též zjištěna asociace mezi difuzním axonálním poškozením mozku, frakturou baze lební a rizikem vzniku endokrinních poruch [57]. V jedné práci bylo vysledováno zvýšené riziko rozvoje hypopituitarizmu s prodlužující se délkou pobytu na jednotce intenzivní péče [58].
U SAH nebyl dosud žádný prognostický faktor rozvoje neuroendokrinní poruchy identifikován. Nebyla potvrzena souvislost s klinickým stavem (dle Hunt-Hessovy stupnice) ani množstvím krve na CT (skóre dle Fishera) [3,27].
Doporučení pro diagnostiku a terapii neuroendokrinních poruch v souvislosti s TBI a SAH
Z praktického hlediska je u pacientů po středním až vážném traumatu mozku indikováno vyšetření hladiny plazmatického kortizolu v ranních hodinách v odstupu 1–7 dnů po úrazu. Pokud je hladina pod 200 nmol/ l (event. 300 nmol/ l dle některých autorů), je indikována substituční léčba kortikoidy s retestováním v odstupu 3–6 měsíců. Pokud je hladina plazmatického kortizolu v pásmu 200–500 nmol/ l, doporučuje se vybavit pacienta informací o nutnosti zajištění kortikoidy v zátěžových situacích a pacienta retestovat v odstupu 3–6 měsíců [6,27]. Pokud je v akutní fázi významně snížený volný tyroxin (pod 8 pmol/ l), je také indikováno zahájení hormonální substituce. V rámci skríningu funkce neurohypofýzy je v akutní fázi vyšetřena natremie a sledována bilance tekutin.
V roce 2006 byla publikována doporučení České endokrinologické společnosti týkající se dlouhodobého sledování dospělých pacientů po TBI [6]. Kromě zhodnocení v akutní fázi je indikováno vyšetření hypofyzárních funkcí u pacientů po středně těžkém a těžkém traumatu mozku v odstupu 6 a 12 měsíců. Doporučuje se vyšetřit ranní kortizol, natremie, osmolarita séra a moči, diuréza, volný tyroxin, prolaktin, IGF-1, gonadotropiny, u mužů testosteron a u žen estradiol. Samozřejmě platí nutnost bezodkladného vyšetření při rozvoji klinické či laboratorní symptomatologie suspektní z hypopituitarizmu. V případě potvrzení je jednoznačně indikována okamžitá substituční léčba při hypokortikalizmu a hypotyreóze. U zbývajících os je potřeba individuální posouzení.
Závěr
Řada studií prokázala, že trauma mozku nebo subarachnoidální krvácení může vyvolat hypothalamo-hypofyzární dysfunkci, i když jsou rozdíly ve frekvenci výskytu jednotlivých poruch v různých studiích. Porucha může nastat již v akutní fázi, ale také až opožděně v odstupu týdnů až měsíců či let od příhody. Některé poruchy zjištěné v akutní fázi se mohou naopak časem upravit. Dosud nedokážeme přesně identifikovat osoby nejvíce ohrožené neuroendokrinní dysfunkcí. Proto je nutné, aby všichni lékaři, kteří pečují o pacienty po TBI a SAH, měli riziko endokrinních poruch na zřeteli a indikovali potřebná vyšetření a ve spolupráci s endokrinology zahájili včas adekvátní léčbu. Jde o poruchy, které lze léčit, a jejich správná diagnostika a léčba by mohla stav pacientů po TBI a SAH zlepšit.
prof. MUDr. Václav Hána, CSc.
III. interní klinika 1. LF UK a VFN
U nemocnice 1
120 00 Praha 2
E-mail: vhana@lf1.cuni.czPřijato k recenzi: 16. 11. 2010
Přijato do tisku: 10. 1. 2011
Zdroje
1. Tagliaferri F, Compagnone C, Korsic M, Servadei F, Kraus J. A systematic review of brain injury epidemiology in Europe. Acta Neurochir 2006; 148(3): 255–268.
2. van Gijn J, Kerr RS, Rinkel GJ. Subarachnoid haemorrhage. Lancet 2007; 369(9558): 306–318.
3. Schneider HJ, Kreitschmann-Andermahr I, Ghigo E, Stalla GK, Agha A. Hypothalamopituitary dysfunction following traumatic brain injury and aneurysmal subarachnoid hemorrhage: a systematic review. JAMA 2007; 298(12): 1429–1438.
4. Klose M, Brennum J, Poulsgaard L, Kosteljanetz M, Wagner A, Feldt-Rasmussen U. Hypopituitarism is uncommon after aneurysmal subarachnoid haemorrhage. Clin Endocrinol (Oxf) 2010; 73(1): 95–101.
5. Ghigo E, Masel B, Aimaretti G, Léon-Carrión J, Casanueva FF, Dominguez-Morales MR et al. Consensus guidelines on screening for hypopituitarism following traumatic brain injury. Brain Inj 2005; 19(9): 711–724.
6. Čáp J. Hormonální poruchy po úrazu mozku. Vnitř Lék 2006; 52(10): 941–946.
7. De Marinis L, Fusco A, Bianchi A, Aimaretti G, Ambrosio MR, Scaroni C et al. Hypopituitarism findings in patients with primary brain tumors 1 year after neurosurgical treatment: preliminary report. J Endocrinol Invest 2006; 29(6): 516–522.
8. McKinlay A, Grace RC, Horwood LJ, Fergusson DM, Ridder EM, MacFarlane MR. Prevalence of traumatic brain injury among children, adolescents and young adults: prospective evidence from a birth cohort. Brain Inj 2008; 22(2): 175–181.
9. Parslow RC, Morris KP, Tasker RC, Forsyth RJ, Hawley CA; UK Paediatric Traumatic Brain Injury Study Steering Group; Paediatric Intensive Care Society Study Group. Epidemiology of traumatic brain injury in children receiving intensive care in the UK. Arch Dis Child 2005; 90(11): 1182–1187.
10. Brichtová E. Kraniocerebrální poranění v dětském věku. Praha: Triton 2008 : 16–23.
11. Park E, Bell JD, Baker AJ. Traumatic brain injury: can the consequences be stopped? CMAJ 2008; 178(9): 1163–1170.
12. Smrčka M et al. Poranění mozku. Praha: Grada 2001.
13. Cernak I, Savic VJ, Lazarov A, Joksimovic M, Markovic S. Neuroendocrine responses following graded traumatic brain injury in male adults. Brain Inj 1999; 13(12): 1005–1015.
14. Cohan P, Wang C, McArthur DL, Cook SW, Dusick JR, Armin B et al. Acute secondary adrenal insufficiency after traumatic brain injury: a prospective study. Crit Care Med 2005; 33(10): 2358–2366.
15. Marik PE, Pastores SM, Annane D, Meduri GU, Sprung CL, Arlt W et al. Recommendations for the diagnosis and management of corticosteroid insufficiency in critically ill adult patients: consensus statements from an international task force by the American College of Critical Care Medicine. Crit Care Med 2008; 36(6): 1937–1949.
16. Arem R, Ghusn H, Ellerhorst J, Comstock JP. Effect of decreased plasma low-density lipoprotein levels on adrenal and testicular function in man. Clin Biochem 1997; 30(5): 419–424.
17. Roberts I, Yates D, Sandercock P, Farrell B, Wasserberg J, Lomas G et al. Effect of intravenous corticosteroids on death within 14 days in 10008 adults with clinically significant head injury (MRC CRASH trial): randomised placebo-controlled trial. Lancet 2004; 364(9442): 1321–1328.
18. Lee SC, Zasler ND, Kreutzer JS. Male pituitary-gonadal dysfunction following severe traumatic brain injury. Brain Inj 1994; 8(6): 571–577.
19. Fleischer AS, Rudman DR, Payne NS, Tindall GT. Hypothalamic hypothyroidism and hypogonadism in prolonged traumatic coma. J Neurosurg 1978; 49(5): 650–657.
20. Woolf PD, Lee LA, Hamill RW, McDonald JV. Thyroid test abnormalities in traumatic brain injury: correlation with neurologic impairment and sympathetic nervous system activation. Am J Med 1988; 84(2): 201–208.
21. King LR, Knowles HC Jr, McLaurin RL, Brielmaier J, Perisutti G, Piziak VK. Pituitary hormone response to head injury Neurosurgery 1981; 9(3): 229–235.
22. Matsuura H, Nakazawa S, Wakabayashi I. Thyrotropin-releasing hormone provocative release of prolactin and thyrotropin in acute head injury. Neurosurgery 1985; 16(6): 791–795.
23. Agha A, Rogers B, Mylotte D, Taleb F, Tormey W, Phillips J et al. Neuroendocrine dysfunction in the acute phase of traumatic brain injury. Clin Endocrinol (Oxf) 2004; 60(5): 584–591.
24. Agha A, Rogers B, Sherlock M, O’Kelly P, Tormey W, Phillips J et al. Anterior pituitary dysfunction in survivors of traumatic brain injury. J Clin Endocrinol Metab 2004; 89(10): 4929–4936.
25. Aimaretti G, Ambrosio MR, Di Somma C, Gasperi M, Cannavò S, Scaroni C et al. Residual pituitary function after brain injury-induced hypopituitarism: a prospective 12-month study. J Clin Endocrinol Metab 2005; 90(11): 6085–6092.
26. Aimaretti G, Ambrosio MR, Di Somma C, Fusco A, Cannavò S, Gasperi et al. Traumatic brain injury and subarachnoid haemorrhage are conditions at high risk for hypopituitarism: screening study at 3 months after the brain injury. Clin Endocrinol (Oxf) 2004; 61(3): 320–326.
27. Kreitschmann-Andermahr I, Hoff C, Saller B, Niggemeier S, Pruemper S, Hütter BO, et al. Prevalence of pituitary deficiency in patients after aneurysmal subarachnoid hemorrhage. J Clin Endocrinol Metab 2004; 89(10): 4986–4992.
28. Dimopoulou I, Kouyialis AT, Tzanella M, Armaganidis A, Thalassinos N, Sakas DE et al. High incidence of neuroendocrine dysfunction in long-term survivors of aneurysmal subarachnoid hemorrhage. Stroke 2004; 35(12): 2884–2889.
29. Tanriverdi F, Dagli AT, Karaca Z, Unluhizarci K, Selcuklu A, Casanueva FF et al. High risk of pituitary dysfunction due to aneurysmal subarachnoid haemorrhage: a prospective investigation of anterior pituitary function in the acute phase and 12 months after the event. Clin Endocrinol (Oxf) 2007; 67(6): 931–937.
30. Kaulfers AM, Backeljauw PF, Reifschneider K, Blum S, Michaud L, Weiss M et al. Endocrine dysfunction following traumatic brain injury in children. J Pediatr 2010; 157(6): 894–899.
31. Khadr SN, Crofton PM, Jones PA, Wardhaugh B, Roach J, Drake AJ et al. Evaluation of pituitary function after traumatic brain injury in childhood. Clin Endocrinol (Oxf) 2010; 73(5): 637–643.
32. Sockalosky JJ, Kriel RL, Krach LE, Sheehan M. Precocious puberty after traumatic brain injury. J Pediatr 1987; 110(3): 373–377.
33. Aleksijevič D, Zapletalová J, Smolka V, Klásková E, Wiedermann J, Krahulík D et al. Neuroendokrinní dysfunkce u dětí a dospívajících po úrazu mozku. Cesk Slov Neurol N 2010; 73/106(4): 409–414.
34. Zapletalová J, Aleksijevič D, Smolka V, Krahulík D, Fryšák Z. Posttraumatický hypopituitarizmus u dětí a dospívajících. Cesk Slov Neurol N 2010; 73/106(4): 398–401.
35. Agha A, Thornton E, O’Kelly P, Tormey W, Phillips J, Thompson CJ. Posterior pituitary dysfunction after traumatic brain injury. J Clin Endocrinol Metab 2004; 89(12): 5987–5992.
36. Becker RM, Daniel RK. Increased antidiuretic hormone production after trauma to the craniofacial complex. J Trauma 1973; 13(2): 112–115.
37. Twijnstra A, Minderhoud JM. Inappropriate secretion of antidiuretic hormone in patients with head injuries. Clin Neurol Neurosurg 1980; 82(4): 263–268.
38. Dóczi T, Tarjányi J, Huszka E, Kiss J. Syndrome of inappropriate secretion of antidiuretic hormone (SIADH) after head injury. Neurosurgery 1982; 10(6): 685–688.
39. Born JD, Hans P, Smitz S, Legros JJ, Kay S. Syndrome of inappropriate secretion of antidiuretic hormone after severe head injury. Surg Neurol 1985; 23(4): 383–387.
40. Bondanelli M, De Marinis L, Ambrosio MR, Monesi M, Valle D, Zatelli MC et al. Occurrence of pituitary dysfunction following traumatic brain injury. J Neurotrauma 2004; 21(6): 685–696.
41. Agha A, Sherlock M, Thompson CJ. Post-traumatic hyponatraemia due to acute hypopituitarism. QJM 2005; 98(6): 463–464.
42. Ceballos R. Pituitary changes in head trauma (analysis of 102 consecutive cases of head injury). Ala J Med Sci 1966; 3(2): 185–198.
43. Kornblum RN, Fisher RS. Pituitary lesions in craniocerebral injuries. Arch Pathol 1969; 88(3): 242–248.
44. Pierucci G, Gherson G, Tavani M. Pituitary changes especially necrotic-following cranio-cerebra injuries. Pathologica 1971; 63(917): 71–88.
45. Crompton MR. Hypothalamic lesions following closed head injury. Brain 1971; 94(1): 165–172.
46. Harper CG, Doyle D, Adams JH, Graham DI. Analysis of abnormalities in pituitary gland in non-missile head injury: study of 100 consecutive cases. J Clin Pathol 1986; 39(7): 769–773.
47. Salehi F, Kovacs K, Scheithauer BW, Pfeifer EA, Cusimano M. Histologic study of the human pituitary gland in acute traumatic brain injury. Brain Inj 2007; 21(6): 651–656.
48. Yuan XQ, Wade CE. Neuroendocrine abnormalities in patients with traumatic brain injury. Front Neuroendocrinol 1991; 12(3): 209–230.
49. Benvenga S, Campenní A, Ruggeri RM, Trimarchi F. Clinical review 113: hypopituitarism secondary to head trauma. J Clin Endocrinol Metab 2000; 85(4): 1353–1361.
50. Kornblum RN, Fisher RS. Pituitary lesions in craniocerebral injuries. Arch Pathol 1969; 88(3): 242–248.
51. Maiya B, Newcombe V, Nortje J, Bradley P, Bernard F, Chatfield D et. Al. Magnetic resonance imaging changes in the pituitary gland following acute traumatic brain injury. Intensive Care Med 2008; 34(3): 468–475.
52. Krahulik D, Zapletalova J, Frysak Z, Vaverka M. Dysfunction of hypothalamic-hypophysial axis after traumatic brain injury in adults. J Neurosurg 2010; 113(3): 581–584.
53. Tanriverdi F, De Bellis A, Bizzarro A, Sinisi AA, Bellastella G, Pane E et al. Antipituitary antibodies after traumatic brain injury: is head trauma-induced pituitary dysfunction associated with autoimmunity? Eur J Endocrinol 2008; 159(1): 7–13.
54. Jovanovic V, Pekic S, Stojanovic M, Tasic G, Djurovic B, Soldatovic I et al. Neuroendocrine dysfunction in patients recovering from subarachnoid hemorrhage. Hormones (Athens) 2010; 9(3): 235–244.
55. Klose M, Juul A, Struck J, Morgenthaler NG, Kosteljanetz M, Feldt-Rasmussen U. Acute and long-term pituitary insufficiency in traumatic brain injury: a prospective single-centre study. Clin Endocrinol (Oxf) 2007; 67(4): 598–606.
56. Klose M, Juul A, Poulsgaard L, Kosteljanetz M, Brennum J, Feldt-Rasmussen U. Prevalence and predictive factors of post-traumatic hypopituitarism. Clin Endocrinol (Oxf) 2007; 67(2): 193–201.
57. Schneider M, Schneider HJ, Yassouridis A, Saller B, von Rosen F, Stalla GK. Predictors of anterior pituitary insufficiency after traumatic brain injury. Clin Endocrinol (Oxf) 2008; 68(2): 206–212.
58. Herrmann BL, Rehder J, Kahlke S, Wiedemayer H, Doerfler A, Ischebeck W et al. Hypopituitarism following severe traumatic brain injury. Exp Clin Endocrinol Diabetes 2006; 114(6): 316–321.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek Léčba adenomů hypofýzyČlánek Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómamiČlánek Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnieČlánek Webové okénko
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2011 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Léčba adenomů hypofýzy
- Kognitivní funkce při onemocnění vnitřní krkavice a vliv léčebných intervencí
- Farmakologická sekundární prevence nekardioembolického mozkového infarktu/tranzitorní ischemické ataky – současnost a budoucnost
- Vplyv chirurgickej liečby na prognózu dospelých pacientov so supratentoriálnymi low-grade gliómami
- Pacient ve vegetativním stavu a jeho rehabilitace
- Hypothalamo-hypofyzární dysfunkce po kraniocerebrálních traumatech a po spontánním subarachnoidálním krvácení
- Vliv funkčního mapování na výsledky operací nízkostupňových gliomů WHO grade II
- Profit pacientů ze stanovení cerebrovaskulární rezervní kapacity pomocí SPECT mozku a hyperkapnie
- Stereotaktické ozáření nízkostupňových gliomů na Leksellově gama noži
- Peroperační měření průtoku likvoru pomocí ultrazvuku při dekompresi cervikokraniálního přechodu u Chiariho malformace typu I
- Peroperační monitoring aktivovaného koagulačního času při karotické endarterektomii
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
- Limbická encefalitida – dvě kazuistiky
- Difuzně vážený obraz a možnost predikce vývoje mozkové žilní trombózy na magnetické rezonanci – dvě kazuistiky
- Jednostranné intravitreální krvácení po předávkování metamfetaminem (pervitinem): varianta Tersonova syndromu u 16letého narkomana – kazuistika
- Uzávěr bazilární tepny disekcí v souvislosti s manipulací krční páteře – kazuistika
- Organizovaný chronický subdurální hematom – kazuistiky
- Chronická žilní cerebrospinální insuficience u roztroušené sklerózy – staronový koncept, nové otázky?
- Webové okénko
-
Analýza dat v neurologii.
XXVII. Hodnocení diagnostických testů – vliv prevalence nemoci - VII. olomoucký workshop cévní neurologie 11. neurosonologické dny – „Pokroky v neurosonologii“
- 15. Jedličkovy neuroimunologické a likvorologické dny
- Atypical Parkinsonian Syndromes – an International Symposium on Neurodegenerative Diseases
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba adenomů hypofýzy
- Limbická encefalitida – dvě kazuistiky
- Pacient ve vegetativním stavu a jeho rehabilitace
- Lehké mozkové poranění – intrakraniální komplikace a indikační kritéria pro CT vyšetření
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



