-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNaše zkušenosti s MR monitorováním pacientů s roztroušenou sklerózou v klinické praxi
Our Experience with MRI Monitoring of Multiple Sclerosis Patients in Clinical Practice
Objectives:
To document our monitoring of multiple sclerosis (MS) patients with magnetic resonance imaging (MRI) as routine practice and to demonstrate an optimal MRI monitoring protocol that meets the requirements of imaging pathological processes in MS, on standard equipment and in a short acquisition time. Patients and methods: We inspected 1,138 patients with clinically definite MS and patients with clinically isolated syndrome. The MRI consisted of measurement of the lesion load with FLAIR (fluid attenuated inversion recovery) and measurement of brain atrophy (as a baseline, brain parenchymal fraction was determined; percentage brain reduction per year was measured in the controls). A total of 737 patients who had participated in no previous study was monitored, as well as 181 patients within 5 years of the ASA study and 220 patients who had been monitored for the first symptom of CIS in the SET study. Results: At baseline, the lesion load (LL) median was 1.68 cm3, median BPF was 85.62%, and median EDSS (expanded disability status scale) scored 2. Results: After the first year: (n = 271), median LL was 1.77 cm3, brain reduction –0.14; EDSS = 2. After the second year median LL was 1.86, brain reduction –0.20 and EDSS = 2. Conclusions: The MRI procedure chosen for this work (measurement of lesion load and atrophy) appears to be an optimal protocol for monitoring inflammatory and degenerative changes in MS in the course of routine inspection. It is based on conventional MRI, it is simple, reproducible, short and employs fully automatated software, and is therefore suitable for everyday practice.Key words:
multiple sclerosis – magnetic resonance imaging – monitoring – lesion load – atrophy measurement
Autoři: M. Vaněčková 1; Z. Seidl 1,2; J. Krásenský 1; D. Horáková 3
; E. Havrdová 3; J. Němcová 2; J. Daneš 1
Působiště autorů: Oddělení MR, Radiodiagnostická klinika 1. LF UK a VFN v Praze 1; Vysoká škola zdravotnická, Praha 2; Neurologická klinika 1. LF UK a VFN v Praze 3
Vyšlo v časopise: Cesk Slov Neurol N 2010; 73/106(6): 716-720
Kategorie: Krátké sdělení
Souhrn
Cíl:
Zavést monitorování pacientů s roztroušenou sklerózou (RS) pomocí magnetické rezonance (MR) do klinické praxe. Ukázat nejvhodnější MR monitorovací protokol, který by vyhovoval po stránce zobrazení obou patologických dějů probíhajících u RS, vybavení a nízké časové náročnosti. Soubor a metodika: Do současné doby bylo vyhodnoceno MR vyšetření u 1 138 pacientů s RS či klinicky izolovaným syndromem. U pacientů bylo provedeno měření objemu ložisek v sekvenci FLAIR (fluid attenuated inversion recovery) a měření atrofie. Z celkového počtu je 737 pacientů z běžné klinické praxe – nespadají do žádné studie. Jedná se o pilotní projekt, 271 probandů má již vyšetření po roce a 73 probandů po dvou letech, tudíž zde prezentovaná data jsou zatím pouze průřezová. Okrajově jsou zde uvedeny dvě studie, v nichž pacienti měli provedena tato měření – 181 probandů z pětileté ASA studie a 220 pacientů ze studie SET. Výsledky: Střední hodnota vstupního objemu ložisek byla 1,68 cm3, brain parenchymal fraction (BPF) 85,62 a hodnota klinické hodnotící škály (EDSS skóre) byla 2, po prvním roce: střední hodnota objemu ložisek 1,77 cm3, procentuální úbytek parenchymu mozku –0,14 a EDSS skóre 2, po dvou letech: objem ložisek 1,86 cm3, úbytek parenchymu mozku –0,20 % a EDSS skóre 2. Závěr: Zvolené MR monitorování – měření objemu ložisek a atrofie – se ukazuje jako optimální metoda pro zachycení probíhajících zánětlivých a degenerativních procesů u RS. Tím, že protokol vychází z konvenčních MR metod, jeho snadná opakovatelnost, dobrá dostupnost, krátká délka vyšetření, rychlé automatické softwarové zpracování jej předurčuje k rozšíření do běžné klinické praxe.Klíčová slova:
roztroušená skleróza – magnetická rezonance – monitorování – volumometrie ložisek – měření atrofiePráce vznikla za podpory výzkumného záměru MZOVFN2005 a MSM0021620849.
Úvod
Roztroušená skleróza (RS) je chronické zánětlivé onemocnění centrálního nervového systému. Počátek choroby je obvykle mezi 20–40 lety, 2–3krát častěji postihuje ženy a prevalence je v naší zeměpisné šířce přibližně 100–150 nemocných na 100 000 obyvatel [1]. Průběh nemoci je velmi variabilní od benigních až po těžké maligní formy, bez léčby lze nejčastěji (85 % pacientů) očekávat v úvodu střídání atak a remisí (relaps-remitentní – RR – fáze), které během 10–20 let přecházejí do stavu pozvolného zhoršování (sekundární progrese, SP), v němž je závažně invalidizováno více než 50 % pacientů.
Během posledních let došlo k výraznému posunu v našem chápání patogeneze RS. Stále více je uznáván koncept dvoustupňového postižení s dominujícím zánětem v časné fázi onemocnění, který postupně mění svůj charakter, dochází ke generalizaci zánětlivého procesu a převládnutí degenerativních procesů v oblasti mozku [2]. Klíčový je přitom fakt, že naše současné léky umí postihnout pouze zánětlivé procesy, a nemáme zatím žádné léky schopné obnovit zničená nervová vlákna. Maximální úsilí je tedy věnováno časné diagnostice se snahou předpovědět riziko tíže nemoci u individuálního pacienta, včas zahájit terapii a následně pečlivě monitorovat aktivitu choroby a odpověď na léčbu. V případě známek přetrvávající aktivity léčbu upravit.
MR má u onemocnění RS dvě hlavní role:
- podporu klinického podezření na RS a v rámci diferenciální diagnostiky vyloučení jiných onemocnění,
- monitorování průběhu onemocnění a predikci klinického zhoršení.
Tyto dvě role se nesmí zaměňovat, protože na MR mají odlišné protokoly. Při splnění revidovaných McDonaldových kritérií pro klinicky definitivní RS by již tento diagnostický protokol neměl být prováděn, protože nám nepřinese nové informace, a měl by nastoupit monitorovací protokol [3,4]. Oba tyto protokoly (diagnostický a monitorovací) vycházejí z konvenčního MR zobrazení. Třetí typ protokolu, který je experimentální, se zabývá zobrazením různých pochodů u RS (provádí se difuzně vážený obraz, vyšetření s magnetizačním transferem, relaxometrie, funkční magnetická rezonance, spektroskopie). Tyto techniky vycházejí z nekonvenčních metodik MR zobrazení a v současné době se používají jen v rámci výzkumu a nemají zatím širší užití v klinické praxi [5,6].
Cílem naší práce je ukázat užití MR monitorování pacientů v běžné klinické praxi. Práce zahrnuje výsledky dlouhodobého (pětiletého) MR sledování pacientů s RR formou RS v rámci studie ASA (Avonex-Steroid-Azathioprine), v němž jsme otestovali hypotézy pro optimalizaci predikce budoucího klinického stavu pomocí MR [7,8]. Právě výsledky tohoto sledování nás vedly k vytvoření monitorovacího protokolu pro rutinní klinickou praxi [9].
Soubor pacientů a metodika
Do roku 2009 bylo vyhodnoceno MR vyšetření u 1 138 pacientů s klinicky definitivní RS či klinicky izolovaným syndromem (CIS), z toho 737 pacientů je běžně sledováno a léčeno v RS centru 1. LF a VFN v Praze a nespadají do žádné klinické studie. Z běžně sledovaných pacientů mělo 271 pacientů již vyšetření po jednom roce a 72 pacientů po dvou letech. Průměrný věk pacientů byl 26,9 ± 8,6 let, 530 pacientů bylo ženského pohlaví (72 %). Průměrná doba trvání choroby byla 5,0 ± 7,4 let (rozsah 0,1–39,7). Průměrný věk při vyšetření MR byl 33,4 ± 10,3 let (tab. 1). Data jsou zatím pouze krátkodobá, jedná se o průřezovou studii. Dále se zde okrajově zmiňujeme o studii ASA, v jejímž rámci bylo po dobu pěti let na MR monitorováno 181 pacientů, a dále o probíhající studii SET, ve které je zařazeno 220 pacientů s rozdílnou dobou sledování mezi 1–4 roky.
Tab. 1. Charakteristika souboru. 
Všichni pacienti byli vyšetřeni v protokolu FLAIR (fluid attenuated inversion recovery) v transverzální rovině řezu s parametry: repetiční čas (TR) 11 000 ms, čas echa (TE) 140 ms, inverzní čas (IR) 2 600 ms, úhel (FA) 90°, velikost pole (FOV) 256 × 256, tloušťka řezu (THK) 1,5/0 mm a v T1W obraze 3D v transverzální rovině řezu s parametry: TR 25 ms, TE 5,01 ms, FA 30°, FOV 204 × 256, THK 1,0/0 mm. U všech pacientů bylo provedeno měření objemu hypersignálních ložisek v sekvenci FLAIR a měření atrofie.
MR analýza
1. měření objemu ložisek pomocí programu vyvinutého na našem MR pracovišti
Program je v současné době plně automatický. Nejprve byla použita série filtračních, morfologických a segmentačních operací včetně možnosti vyrovnání nehomogenit vyzařovací charakteristiky hlavové cívky. Výsledkem je korigovaný obraz, který zvýrazňuje plaky, takže jejich intenzita signálu je rovna nebo vyšší než 9 000 při arbitrárně zvolené signálové intenzitě bílé hmoty na hodnotu 6 500, na škále stupňů šedi 0–10 000 (obr. 1a–e). Technika měření byla blíže publikována v tomto časopise v roce 2002 [9].
Obr. 1. a–e. Rozfázovaná metodika kvantitativního stanovení objemu ložisek. Nejprve je provedeno plně automatické vyrovnání řezů následujících kontrol na první vyšetření (koregistrace). Poté je vymezena zájmová oblast (a), která je zkopírována na všechny kontroly (b). dále je použita série filtračních a morfologických operací včetně možnosti vyrovnání nehomogenit vyzařovací charakteristiky hlavové cívky (c, d). Výsledkem je korigovaný obraz, který zvýrazňuje plaky tak, že jejich intenzita signálu je rovna nebo vyšší než 9 000 (při arbitrárně zvolené signálové intenzitě bílé hmoty 6 500), na škále stupňů šedi od 0 do 10 000 (e). 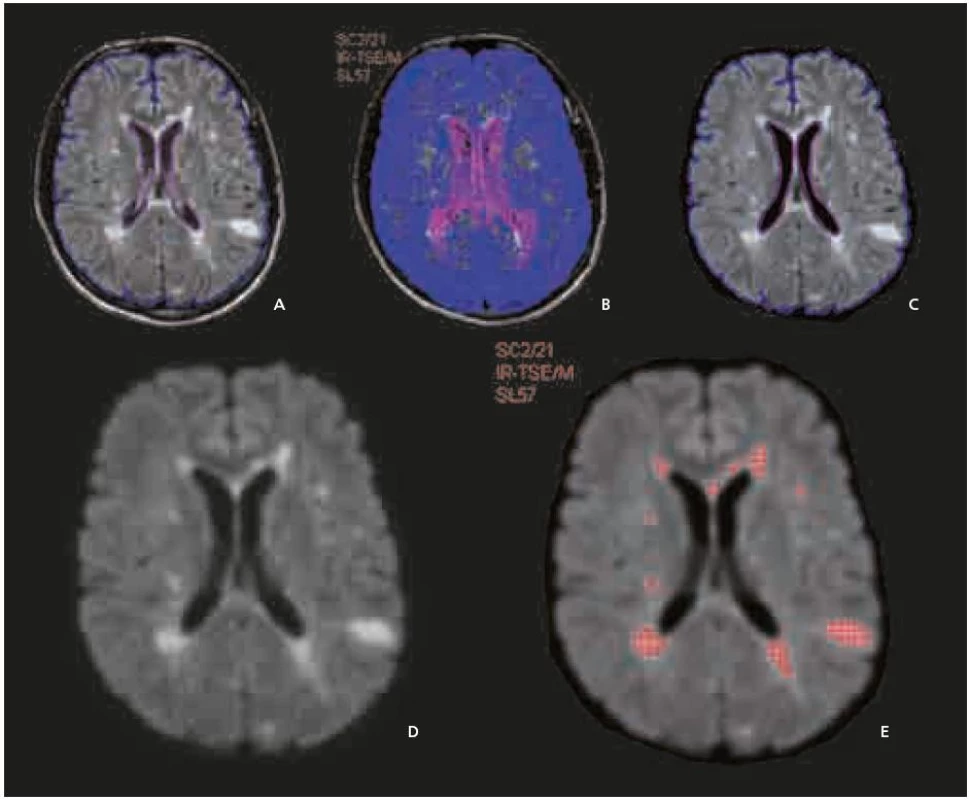
U malých objemů (do 1 cm3) byla chyba měření až 7 %, u velkých objemů klesá pod 1 %.
2. měření atrofie opět pomocí softwaru z našeho MR pracoviště
Při vstupním vyšetření byl určován tzv. brain parenchymal fraction (BPF), což je poměr objemu mozku ku objemu mozku a likvorových prostor. Při dalších kontrolách byl vyčíslen procentuální úbytek mozkové tkáně vztažený k této počáteční hodnotě. První kroky programu jsou shodné s měřením objemu ložisek. Poté je provedeno automatické odstranění skalpu. Objem mozkového parenchymu je definován jako struktura signálové intenzity 3 500 a více (obr. 2a–c). Scan-rescan variabilita je nižší než 0,3 %.
Obr. 2. a–c. Metodika měření atrofie, určována jako brain parenchymal fraction (BPF) – poměr mozkové tkáně k objemu mozku a likvorových prostor. Zpracování obrazu je obdobné jako při měření objemu ložisek. Poté je provedeno automatické odstranění skalpu. Použití morfologických a filtračních operací má za úkol zvýraznit mozkový parenchym, který pak je definován jako oblasti o signálové intenzitě 3 500 nebo vyšší. 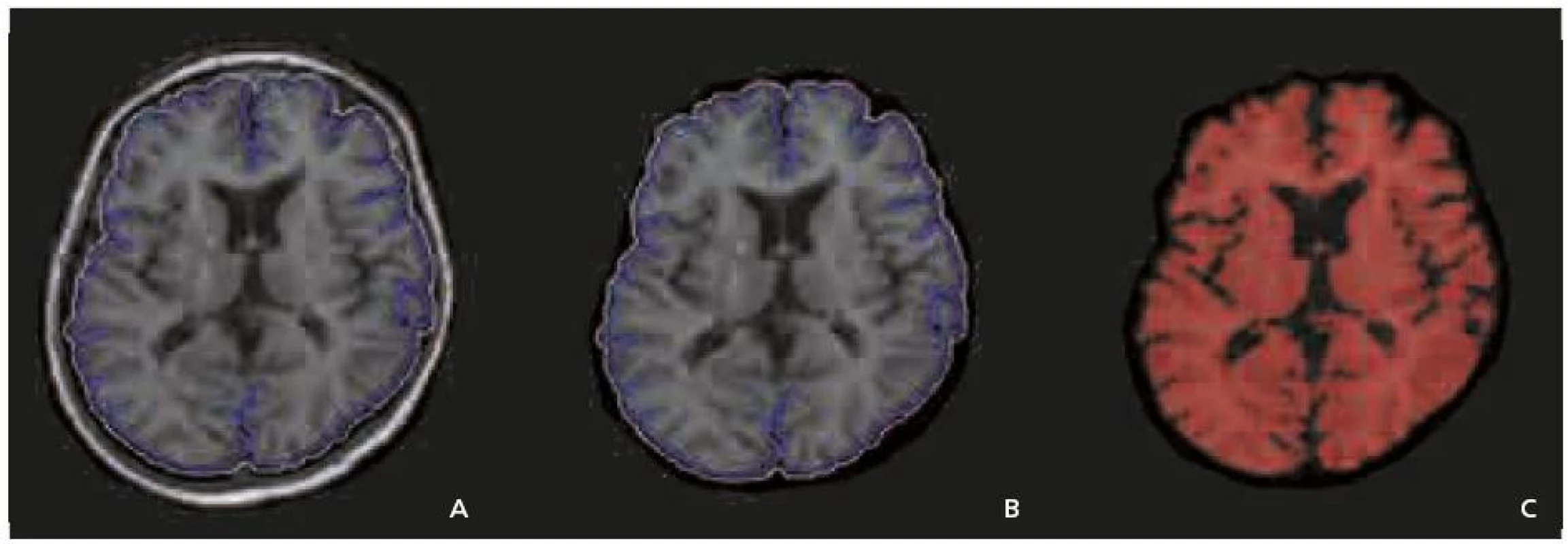
Ve stejnou dobu, kdy bylo provedeno MR vyšetření, byli pacienti klinicky vyšetřeni a byla u nich určena hodnota na rozšířené stupnici míry klinického postižení Expanded disability status scale (EDSS skóre).
Výsledky
Střední hodnota vstupního objemu ložisek (medián) byla 1,68 ± 7,46 cm3, rozsah 0–48,2 cm3, střední hodnota BPF (medián) byla 85, 62 ± 2,28; rozsah 78,62–91,2 a střední hodnota EDSS skóre (medián) byla 2 ± 1,5, rozsah 0–8,5 (n = 737) (tab. 2). Výsledky vyšetření pacientů po prvním roce (n = 271): střední hodnota objemu ložisek (medián) byla 1,77 ± 7,67 cm3 (rozsah 0–52,81 cm3), střední hodnota procentuálního úbytku mozkové tkáně vztaženého ke vstupní hodnotě (medián) byla –0,14 ± 0,46 (rozsah –2,13–0,6) a střední hodnota EDSS skóre (medián) byla 2 ± 1,3 (rozsah 0–7). Vyšetření po dvou letech má zatím 73 pacientů: střední hodnota objemu ložisek (medián) byla 1,86 ± 7,49 cm3; rozsah 0,02–48,5 cm3), střední hodnota procentuálního úbytku mozkové tkáně (medián) byla –0,20 ± 0,48 (rozsah –2,88–0,81) a střední hodnota EDSS skóre (medián) byla 2 ± 1,37 (rozsah 0–7) (tab. 3).
Tab. 3. Hodnoty objemu ložisek, úbytku mozkové tkáně – atrofie, EDSS skóre po prvním a druhém roce. 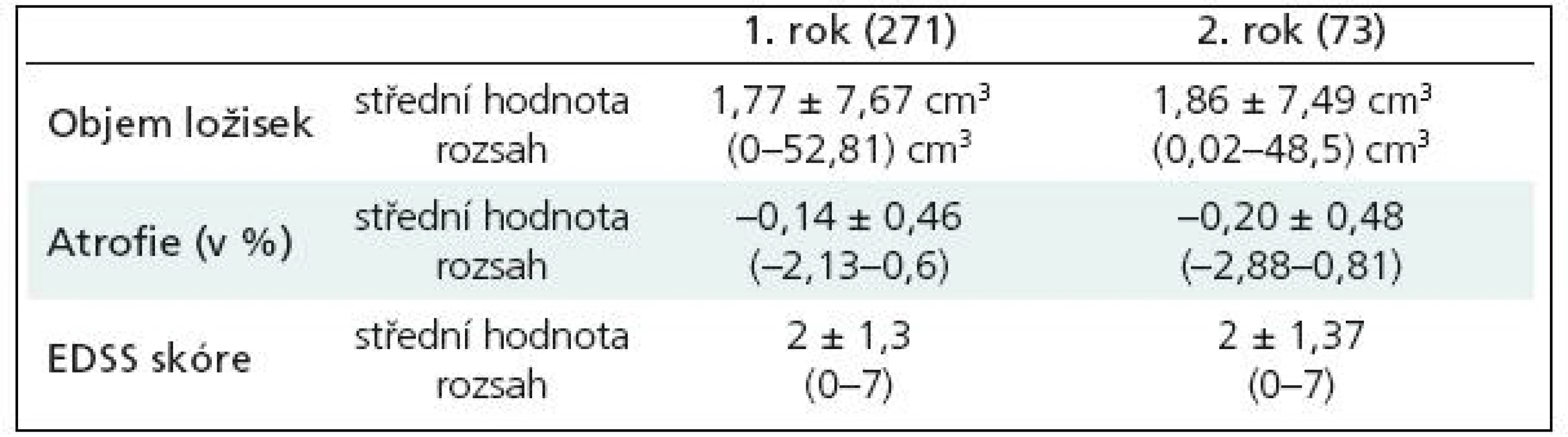
Diskuze
Roztroušená skleróza je onemocnění s výrazně variabilním klinickým průběhem. Jednoznačným trendem současné péče je individualizace léčby dle konkrétní aktivity nemoci. Její nedílnou součástí je pečlivý monitoring pomocí paraklinických vyšetření, mezi kterými má MR zobrazení rozhodující postavení.
Cílem práce je ukázat efektivní monitorovací MR protokol použitelný v široké klinické praxi a naše zkušenosti s monitorováním nejenom pacientů zařazených do studií, ale především MR vyšetření pacientů běžně sledovaných a léčených v RS centru.
Základem pro vytvoření jak MR protokolu, tak i metodiky softwarového měření a určení optimální frekvence vyšetření byla data z dlouhodobé – pětileté – ASA studie. V ní byli pacienti prvé dva roky vyšetřováni každých osm týdnů, následně jednou ročně. Data byla posléze vyhlazena pomocí Gaussova časového filtru [7,8]. Toto časté sledování nám pomohlo optimalizovat softwarové zpracování. Nejprve bylo vyšetření poloautomatické a zpracování, např. objemu ložisek trvalo několik hodin [9]. Nyní je jak měření objemu ložisek, tak i měření atrofie plně automatické s jen minimální chybou měření a celkové softwarové zpracování trvá do 10 min. Vlastní MR vyšetření s užitím výše zmíněného monitorovacího protokolu trvá do 30 min, což je průměrná doba vyšetření, která je na většině MR pracovištích kalkulována na jednoho pacienta, a nebrání tudíž užití tohoto protokolu v široké klinické praxi.
Dle našeho názoru je u pacientů, u nichž je již diagnostikována klinicky definitivní RS, nevhodné provádět diagnostický, případně neúplný diagnostický protokol. Ten nám totiž s výjimkou podezření na aktivitu procesu, kdy podáváme kontrastní látku, nepřinese žádné nové informace. Vizuálně nejsme schopni zachytit počínající atrofii a i určování změny objemu lézí je značně nepřesné a zavádějící. Většina popisů MR tak obsahuje tvrzení, že se jedná o RS (což je však zřejmé, když pacient má klinicky definitivní RS), nález výrazněji nezměněn, což je značně insuficientní pro klinického lékaře, který má podle nálezu měnit léčbu tak, aby byla pro konkrétního pacienta optimální.
Při zpracování ASA studie jsme si z MR hlediska dali za cíl zlepšit individuální predikci budoucího klinického zhoršení pacientů [7], navázali jsme na práce zabývající se rozdělením pacientů podle nálezu na MR [10,11]. Zaměřili jsme se na to, jak nejlépe pacienty rozdělit, abychom s co největší pravděpodobností mohli určit jejich budoucí klinický stav. Naše hypotéza byla, že u pacientů s nízkým objemem plak by jejich budoucí klinický stav měl záviset především na neurodegeneraci (na MR měřena pomocí úbytku mozkové tkáně) a u pacientů s velkým objemem ložisek by hlavním prediktorem měla být změna objemu ložisek. Pro ověření této hypotézy bylo nutné optimálně pacienty rozdělit, stratifikačním kritériem byla vstupní hodnota objemu ložisek na MR. Výsledky této práce ukázaly [7], že správnou stratifikací alespoň pro dvě hraniční skupiny (pacienti s malým objemem ≤ 1 cm3 při vstupním vyšetření a s alespoň řádově větším objemem ≥ 10 cm3) jsme dle změn na MR s relativně velkou jistotou schopni predikovat jejich klinický stav. Dalším zjištěním bylo, že u těchto mezních skupin jejich budoucí klinický stav závisí na jednom parametru (objem ložisek nebo atrofie) a nezávisí na tom druhém. To by mohlo vysvětlit fakt, že ve většině studií zabývajících se MR monitorováním, při nichž nedojde k rozdělení pacientů, je korelace MR nálezu s vývojem klinického stavu pouze nízká nebo maximálně střední [12–15]. Stratifikace pacientů tak alespoň částečně eliminuje klinicko-radiologický paradox, který poprvé ve své práci popsal Barkhoff [16]. U skupiny, kde je určující pro budoucí vývoj choroby právě neurodegenerace a predikce je vztažena ke změně úbytku mozkové tkáně, není již předpověď závislá na výše uvedeném paradoxu.
Zde citovaná ASA studie byla základem pro vytvoření monitorovacího protokolu pro běžnou klinickou praxi, který zde prezentujeme [7–9]. Práce zabývající se stratifikací ukazuje, že zvolená metoda (měření objemu ložisek a atrofie) s vhodně zvoleným rozdělením pacientů by mohla být v budoucnu využita pro časnější úpravu terapie tak, abychom předešli klinickému zhoršení [7]. Výsledky jsou zatím předběžné a bude nutné je dále ověřit sledováním velkého souboru pacientů. Nyní sledujeme 737 pacientů z běžné klinické praxe, u kterých monitorujeme oba parametry – objem ložisek a atrofii. Zatím jsou však data pouze krátkodobá. Zásadní význam bude mít longitudinální sledování s dalším vyhodnocením vztahu rezonančních parametrů k aktivitě nemoci a efektu jednotlivých léků.
Předběžně zatím na našem klinickém pracovišti v současné době testujeme modifikaci léčby podle výsledků MR monitorování u dvou krajních skupin:
- U pacientů klinicky stabilních se stacionárním, malým objemem ložisek a s minimální atrofií (dlouhodoběji stejný procentuální úbytek mozkové tkáně jako u zdravých kontrol) zkoušíme minimalizaci, event. po diskuzi s pacientem i přerušení terapie (nedílnou součástí je ale další, komplexní monitoring pacienta).
- U opačné skupiny s rychle narůstajícím objemem ložisek a atrofizací mozku provádíme rychlou eskalaci léčby.
Význam tohoto pečlivého MR monitoringu (zejména sledování mozkové atrofie) se nepochybně ještě zvýší poté, co budou na trh uvedeny další nové léky, které jsou v současnosti testovány v klinických studiích a u kterých se předpokládá i určitý neuroprotektivní efekt [17–19].
Závěr
Cílem práce je ukázat MR monitorovací protokol a naše zkušenosti s monitoringem pacientů s RS v rutinní lékařské praxi. Tím, že vyšetření je relativně krátké a vyhodnocení plně automatické, nepředstavuje již MR monitorování výraznější ekonomickou či časovou zátěž pro MR oddělení, a tudíž by mohla být u každého nového pacienta s diagnostikovanou RS prováděna.
doc. MUDr. Manuela Vaněčková, Ph.D.
Oddělení MR Radiodiagnostická klinika
1. LF UK a VFN v Praze
Kateřinská 30
128 08 Praha 2
e-mail: man.van@post.czPřijato k recenzi: 15. 2. 2010
Přijato do tisku: 25. 5. 2010
Zdroje
1. Havrdová E. Roztroušená skleróza. Cesk Slov Neurol N 2008; 71/104(2):121–132.
2. Horáková D. Klinicky izolovaný syndrom a prognostické markery u roztroušené sklerózy. Proč léčit včas? Neurol pro praxi 2008; 9(4): 215–217.
3. Polman CH, Reingold SC, Edan G, Filippi M, Hartung HP, Kappos L et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the “McDonald Criteria”. Ann Neurol 2005; 58(6): 840–846.
4. Vaněčková M, Seidl Z, Hřebíková T. Protokol vyšetření magnetickou rezonancí pro diagnostiku roztroušené sklerózy mozkomíšní. Praktická radiologie 2008; 4 : 31–33.
5. Ge Y. Multiple sclerosis: the role of MR imaging. AJNR Am J Neuroradiol 2006; 27(6): 1165–1176.
6. Vaněčková M, Seidl Z. Roztroušená skleróza mozkomíšní a magnetická rezonance: současnost a nové trendy. Cesk Slov Neurol N 2008; 71/104(6): 664–672.
7. Vaneckova M, Seidl Z, Krasensky J, Havrdova E, Horakova D, Dolezal O et al. Patients’ stratification and correlation of brain MRI parameters to disability progression in multiple sclerosis. Eur Neurol 2009; 61(5): 278–284.
8. Havrdova E, Zivadinov R, Krasensky J, Dwyer MG, Novakova I, Dolezal O et al. Randomized study of interferon beta-1a, low-dose azathioprine, and low--dose corticosteroids in multiple sclerosis. Mult Scler 2009; 15(8): 965–976.
9. Vaněčková M, Seidl Z, Krásenský J, Obenberger J, Havrdová E, Viták T et al. Sledování objemu ložisek u roztroušené sklerózy mozkomíšní magnetickou rezonancí. Cesk Slov Neurol N 2002; 65/98(3): 175–179.
10. Bielekova B, Kadom N, Fisher E, Jeffries N, Ohayon J, Richert N et al. MRI as a marker for disease heterogeneity in multiple sclerosis. Neurology 2005; 65(7): 1071–1076.
11. Lucchinetti C, Bruck W, Parisi J, Scheithauer B, Rodrigez M, Lassman H. Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann Neurol 2000; 47(6): 707–717.
12. Fisher E, Rudick RA, Cutter G Cutter G, Baier M, Miller D, Weinstock-Guttman B et al. Relationship between brain atrophy and disability: an 8-year follow-up study of multiple sclerosis patients. Mult Scler 2000; 6(6): 373–377.
13. Ciccarelli O, Brex AP, Thompson AJ, Miller DH. Disability and lesion load in MS: a reassessment with MS functional composite score and 3D fast FLAIR. J Neurol 2002; 249(1): 18–24.
14. Miller DH, Grossman RI, Reingold SC, McFarland HF. The role of magnetic resonance techniques in understanding and managing multiple sclerosis. Brain 1998; 121(1): 3–24.
15. Schreiber K, Sørensen PS, Koch-Henriksen N, Wagner A, Blinkenberg M, Svarer C et al. Correlations of brain MRI parameters to disability in multiple sclerosis. Acta Neurol Scand 2001; 104(1): 24–30.
16. Barkhof F. MRI in multiple sclerosis: correlation with Expanded Disability Status Scale (EDSS). Mult Scler 1999; 5(4): 283–286.
17. Kapoor R. Neuroprotection in multiple sclerosis: therapeutic strategies and clinical trial design. Curr Opin Neurol 2006; 19(3): 255–259.
18. Bechtold DA, Miller SJ, Dawson AC, Sun Y, Kapoor R, Berry D et al. Axonal protection achieved in a model of multiple sclerosis using lamotrigine. J Neurol 2006; 253(12): 1542–1551.
19. Mangas A, Coveñas R, Geffard M. New drug therapies for multiple sclerosis. Curr Opin Neurol 2010; 23(3): 287–292.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2010 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Autizmy
- Mechanizmy neurodegenerácie pri Parkinsonovej chorobe
- Syndrom obstrukční spánkové apnoe a kardiovaskulární komplikace – úloha mezioborové spolupráce
- Poruchy metabolizmu biogenních aminů v dětském věku a možnosti jejich diagnostiky
- Spektrální analýza variability srdeční frekvence – normativní data
- Dotazník Bristolská škála aktivit denního života BADLS-CZ pro hodnocení pacientů s demencí
- Endovaskulární rekanalizace při léčbě akutních uzávěrů mozkových tepen
- Srovnání přínosu lumbálního infuzního testu a lumbální drenáže v indikaci léčby hydrocefalu
- Validita mezinárodní škály pro pacienty s ataxií
- Monitoring ptiO2 a změny frakce kyslíku ve vdechované směsi u pacientů po těžkém subarachnoidálním krvácení
- Léze radiálního nervu a možnosti pozdní rekonstrukce funkce šlachovým transferem
- Kraniálne defekty neurálnej rúry
- Využití kontinuálního monitoringu průtoku krve mozkem po těžkém mozkovém poranění
- Naše zkušenosti s MR monitorováním pacientů s roztroušenou sklerózou v klinické praxi
- Spontánní regrese sekvestru při lumbální herniaci disku – soubor tří kazuistik
- Lymfomatózní neuropatie (neurolymfomatóza) – kazuistika
- Posuzování zdravotního stavu a pracovní schopnosti osob po cévní mozkové příhodě – kazuistiky
- Fibrózní dysplazie žeber a páteře: multioborové řešení – kazuistika
- Novinky ve farmakoterapii neuropatické bolesti a současná doporučení
- Webové okénko
-
Analýza dat v neurologii
XXIV. Vybrané příklady hodnocení kategoriálních dat - Profesor Zdeněk Ambler – 70 let
-
MUDr. Vladimír Přibáň.
Atlas chirurgické léčby mozkové ischemie
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Spontánní regrese sekvestru při lumbální herniaci disku – soubor tří kazuistik
- Posuzování zdravotního stavu a pracovní schopnosti osob po cévní mozkové příhodě – kazuistiky
- Dotazník Bristolská škála aktivit denního života BADLS-CZ pro hodnocení pacientů s demencí
- Autizmy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




