-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dekompresivní kraniotomie u kraniocerebrálních poranění – hodnocení přežití a jeho kvality po jednom roce od úrazu
Decompressive Craniotomy in Craniocerebral Injury – Evaluation of Outcome One Year After Trauma
Aim:
The aim of this study is to evaluate the outcome of patiens treated for craniocerebral trauma by means of decompressive craniotomy.Material and methods:
In the group of 110 patients (83 males, 27 females, age 6–82 years, mean 47 ± 18,27) the influence of different factors to the outcome of patient one year after injury was evaluated. Among the factors in view we included age, clinical status and its worsenig after admission, CT exam, accompanying injuries, time period between injury and operation, finding during operation, intracranial pressure and postoparative complications.Results:
Age is an independent and very significant factor which influences the outcome of patients treated with decompressive craniotomy (p < 0.0001). Level of consciousness during admission (GCS) is in strong relation to the outcome in non-sedated patients (p = 0.0141). When the reactivity and width of pupils were evaluated together, a strong correlation to the outcome was detected (p = 0.0111). In the preoperative CT the significance of midline shift or narrowing of cinsterns to the outcome of all patients was not found. The perioperative measurement of dural gap before the duroplasty is the speciality of this work. The dural gap was significantly bigger in patinets with closed cisterns in the CT (p < 0.0001). It was a strong correlation between the dural gap and the outcome in the soubgroup of patients with closed cisterns on CT (p = 0.0021). After decompressive craniotomy was noted lowering of ICP and increase of CPP in monitored patiens.Conclussion:
Our results indicate, that active approach of the neurosurgeon and the early indication of decompressive craniotomy are helpfull especially for younger patients.Key words:
cerebral injury – decompressive craniotomy – age – outcome – GOS
Autoři: L. Navrátil
Působiště autorů: Neurochirurgické oddělení FN Plzeň
Vyšlo v časopise: Cesk Slov Neurol N 2007; 70/103(3): 294-301
Kategorie: Krátké sdělení
Autor děkuje prof. MUDr.Zdeňku Mračkovi a prim.MUDr.Milanu Chocovi, CSc., za inspirativní a cenné rady a Ing. Stanislavu Kormundovi za statistické zpracování dat.
Souhrn
Cíl:
Cílem naší studie je hodnocení přežití a jeho kvality u pacientů, kteří byli po kraniocerebrálním poranění léčeni dekompresivní kraniotomií.Soubor a metodika:
U souboru 110 pacientů (83 mužů, 27 žen ve věku 6–82 let, průměrně 47 ± 18,27) jsme po 1 roce hodnotili prognostický význam jednotlivých faktorů (věk, klinický stav a jeho horšení po přijetí, CT nález, přidružená poranění, čas od úrazu do operace, operační nález, nitrolebeční tlak a pooperační komplikace).Výsledky:
Věk je nezávislý a významný faktor, který zhoršuje prognózu pacientů na hladině významnosti p < 0,0001. Tíže poruchy vědomí při přijetí (GCS) významně ovlivňuje prognózu nemocných (GOS) ve skupině pacientů, kteří při přijetí nebyli farmakologicky tlumeni (p = 0,0141). Současné hodnocení šíře a reaktivity zornic má též významnou korelaci s prognózou nemocných (p = 0,0111). Při hodnocení CT nálezu jsme neprokázali statisticky významný vztah mezi šíří perimezencefalických cisteren či přetlakem středočárových struktur a prognózou nemocných. Specifikem naší práce je měření defektu tvrdé pleny, který vzniká rozestupem okrajů durotomie nad vyklenujícím se mozkem při operaci. Zjistili jsme větší defekt tvrdé pleny u pacientů s užšími cisternami kolem kmene (p < 0,0001). Větší defekt tvrdé pleny u pacientů, kteří měli na CT před operací cisterny kolem kmene zaniklé, významně zhoršoval prognózu pacientů (p = 0,0021). U pacientů, kteří měli monitorovaný nitrolební tlak (ICP), jsme po dekompresivní kraniotomii zjistili jeho pokles a vzestup mozkového perfuzního tlaku (CPP).Závěr:
Dle zjištěných výsledků naší práce může být ofenzivní přístup neurochirurga s včasnou indikací dekompresivní kraniotomie přínosný pro mladší pacienty.Klíčová slova:
poranění mozku – dekompresivní kraniotomie – věk – GOSCíl
Na vlastním souboru 110 pacientů, kteří byli léčeni dekompresivní kranitomií pro kranicerebrální poranění, chceme zjistit vliv různých faktorů (věk, klinický stav, přidružená poranění, grafický nález, časový interval od úrazu do operace, operační nález, nitrolebeční tlak a pooperační komplikace) na prognózu pacientů po 1 roce od úrazu.
Úvod
Poranění mozku v současné době představuje významný problém pro svou stoupající četnost, medicínskou i ekonomickou závažnost. Úrazy mozku, které vyžadují hospitalizaci, se v ČR vyskytují v četnosti přes 300 případů/100 000 obyvatel / rok, z nichž zemře více než 20 /100 000 obyvatel/rok. Tato četnost se neliší od jiných vyspělých zemí [1]. Poranění mozku způsobují 30 % náhlých úmrtí a ve věkové skupině do 45 let jsou nejčastější příčinou smrti.
Chirurgická léčba je běžně indikována v případech expanzivně se chovajících lézí nitrolebečních. Jsou odstraňovány epidurální, subdurální i intracerebrální hematomy, elevovány impresivní zlomeniny, resekována expanzivně se chovající kontuzní ložiska. V posledních desetiletích se též léčebně užívá zevní komorová drenáž [2] s vypouštěním mozkomíšního moku, která vede ke snížení nitrolebečního tlaku (intracranial pressure - ICP). Další možností chirurgické léčby nitrolebeční hypertenze je zevní dekomprese s odstraněním většinou rozsáhlé části kalvy a plastikou tvrdé pleny nad edematózním mozkem [3-26]. Dekompresivní kraniotomie přes svoji více než stoletou historii dosud není všeobecně užívána.
Technika dekompresivní kraniotomie
Na našem oddělení užíváme rozsáhlou dekompresivní kraniotomii nad celou mozkovou hemisférou (hemikraniektomii), při které se dokonale uvolní temporální lalok, odstraní se tlak na mozkový kmen v oblasti tentoriálního otvoru (tentoriální herniaci). Rozsáhlý přístup také umožní dokonale odstranit subdurální hematom nad celou hemisférou a zastavit případné krvácení z přemosťujících žil. Zpravidla užíváme jednostranný přístup. Většinou volíme kožní řez ve tvaru podkovy nad celou hemisférou. Rozsáhlý fronto-temporo-parieto-okcipitální kostní lalok odklápíme na stopce temporálního svalu. Šupinu spánkové kosti snášíme až k bázi lebeční spolu se zevní částí křídla kosti klínové [14,16,27,28]. Tvrdou plenu široce otvíráme z obloukovitého řezu a odklápíme parasagitálně. Temporálně směrem k bázi vždy provádíme pomocné nářezy, aby došlo k dokonalé dekompresi v temporální oblasti a odstranění tlaku na mozkový kmen. Další postup závisí na rozsahu vyklenování uvolněné hemisféry a možné progresi otoku. Rozsah vyklenování hemisféry jsme u všech pacientů hodnotili změřením defektu tvrdé pleny v temporální oblasti v milimetrech (viz obr. 1). V případě, že defekt je menší než 10-12 mm a nepředpokládáme další nárůst otoku mozku, kostní ploténku ponecháváme na stopce temporálního svalu [28]. Po provedení plastiky tvrdé pleny štěpem z periostu a temporální fascie fixujeme kostní ploténku jen při bázi sešitím spánkového svalu a fascie. Tím je umožněn pohyb ploténky v závislosti na edému mozku. Pokud je defekt tvrdé pleny temporálně větší než 10-12mm nebo když hrozí progrese otoku mozku, kostní ploténku odstraňujeme. Plastiku tvrdé pleny pak šijeme z temporálního svalu a fascie. Kostní ploténku v těchto případech vracíme po několika týdnech po úplném odeznění otoku mozku.
Soubor pacientů a metodika
Do naší studie jsme zařadili pacienty s poraněním mozku, kteří byli v letech 1999-2003 léčeni dekompresivní kraniotomií. Ze 112 pacientů jsme vyřadili 2 nemocné, kteří v krátké době po úrazu zemřeli na následky polytraumatu.
Po přijetí byli všichni pacienti vyšetřeni neurochirurgem a zajištěni intezivistou. Poruchu vědomí jsme hodnotili dle glasgowské škály – (Glasgow Coma Score - GCS) [30]. Po provedení akutního CT vyšetření a zhodnocení klinického a grafického nálezu jsme buď indikovali akutní operační léčbu, nebo konzervativní terapii na jednotce intenzivní péče. Operační léčbu jsme indikovali u pacientů s těžší poruchou vědomí (GCS pod 8), hemiparézou, poruchou reaktivity zornic. Dále při nálezu užších cisteren kolem kmene a přesunu středočárových struktur na CT (kolem 10 mm), u kontuzí a otoku mozku. A také u plošně rozsáhlejších subdurálních hematomů tloušťky nad 8 mm.
Následné CT vyšetření provádíme do 24 hodin. Další CT vyšetření indikujeme po zhodnocení klinického stavu, přidružených poranění, či změn ICP. U části monitorovaných konzervativně léčených pacientů došlo ke zhoršení neurologického nálezu, stavu vědomí, reaktivity zornic, CT nálezu nebo k nekontrolovatelnému vzestupu ICP. V takových případech jsme akutně indikovali operační léčbu i u těchto pacientů.
Náš soubor zahrnuje 110 pacientů s kraniocerebrálním poraněním, které jsme ve sledovaném období léčili dekompresivní kraniotomií. Zjišťovali jsme úmrtnost během 1 roku a výsledný stav po jednom roce jsme hodnotili dle škály Glasgow Outcome Scale - GOS [31]. Hodnotili jsme vliv řady faktorů na výsledek (outcome). Sledovali jsme věk, pohlaví, mechanizmus úrazu, opilost, hypoxii, hypotenzi, přidružená poranění, GCS při přijetí a jeho následné horšení, dále šíři a reaktivitu zornic před operací a časové faktory (dobu od úrazu k přijetí a od přijetí do operace). Na předoperačním CT jsme hodnotili přetlak střední čáry v úrovni foramen Monroe a šíři cisteren kolem kmene. U operační léčby jsme brali ohled na to, zda byla při dekompresivní kraniotomii kostní ploténka ponechána, či dočasně vyňata a zda byl odstraněn významný objem intrakraniálně (hematom, kontuzní ložisko). Dále jsme hodnotili rané komplikace, celkové infekce, provedení tracheotomie, další intrakraniální operace a také rozvoj hydrocefalu, jenž byl důvodem zavedení ventrikuloperitoneální (VP) drenáže. U monitorovaných pacientů jsme sledovali nitrolebeční tlak před operací a po ní. U skupiny pacientů se subdurálním hematomem jsme kromě výše uvedených parametrů sledovali ještě tloušťku hematomu.
Zjištěné parametry byly poté statisticky zpracovány. Na porovnání distribucí jednotlivých parametrů v různých skupinách a podskupinách byly vzhledem k distribucím těchto proměnných použity neparametrické testy: Kruskalův-Wallisův test a Wilcoxonův test. Pro zjištění závislostí zkoumaných znaků, vzhledem k negaussovskému rozdělení těchto proměnných, byl použit Spearmanův koeficient korelace. Pro porovnání shody četností zkoumaných kategorických proměnných byl užit tzv. χ2 test dobré shody. Párová data byla, vzhledem k nesymetričnosti těchto proměnných, zkoumána znaménkovým neparametrickým párovým testem. Vliv jednotlivých proměnných na délku přežití byl zkoumán užitím Kaplanovy-Maierovy metody odhadu distribuční funkce přežití. Pro zjištění vlivu daných proměnných na délku přežití byl u kategorických proměnných použit Log-rank test a Wilcoxonův test.
Výsledky
V našem souboru (n = 110) zemřelo do 1 roku 69 pacientů (62,73 %), závislých na péči okolí (GOS 3) bylo 9 (8,18 %) pacientů. V dobrém stavu (GOS 4-5) přežívalo 32 nemocných (29,09 %). Po 1 roce nebyl žádný pacient ve vigilním komatu (GOS 2).
Zjistili jsme, že věk je nezávislý a vysoce významný faktor, který zhoršuje prognózu pacientů našeho souboru na hladině významnosti p < 0,0001. Přežití a jeho kvalitu podle věkových skupin shrnuje tab. 1 a graf 1.
Tab. 1. Přežití a jeho kvalita po 1 roce (podle věkových skupin). 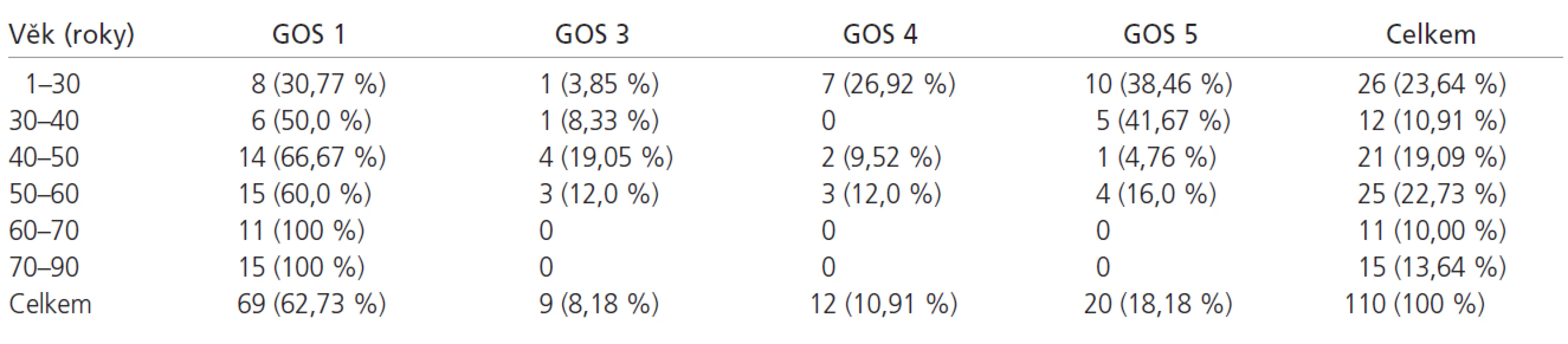
Graf 1. Roční přežití dle věkových skupin. 
Časové faktory u našich nemocných shrnuje tab. 2. Při užití pořadové korelace nebyl zjištěn žádný významnější vztah mezi časovými hodnotami a výsledkem (GOS). Pacienty s iniciálně těžkým nálezem jsme operovali do 6 hodin po úrazu (58 ze 110). U ostatních, kteří byli léčeni konzervativně, jsme dekompresi indikovali při zhoršení stavu. Statisticky jsme korelaci mezi časovými údaji a prognózou nezjistili. Výjimkou je skupina pacientů, u nichž byla indikována dekompresivní kraniotomie jako samostatná operace bez odstranění významnějšího intrakraniálního objemu. V této skupině měli lepší prognózu pacienti, kteří byli přijati dříve po úrazu (p = 0,018), a také ti, kteří byli operování až s odstupem po přijetí (p = 0,0394).
Tíže poruchy vědomí při přijetí (GCS) měla přímý vztah k prognóze nemocných (GOS) ve skupině pacientů, kteří při přijetí nebyli farmakologicky tlumeni (p = 0,0141). U 18 ze 110 pacientů došlo po přijetí ke zhoršení stavu vědomí, proto jsme provedli dekompresivní kraniotomii. Nezjistili jsme, že by toto zhoršení stavu vědomí (pokles GCS) mělo vliv na prognózu nemocných.
Při současném hodnocení šíře a reaktivity zornic jsme v celém souboru (n = 110) zjistili vysokou korelaci k prognóze nemocných (GOS), a to na hladině významnosti p = 0,0111. Pacienti s fyziologicky reagujícími zornicemi přežili 1 rok v 60 %, pacienti s oboustranně nereagujícími mydriatickými zornicemi jen v 18,42 %.
Na CT mozku jsme sledovali přesun střední čáry v úrovni foramen Monroe, šíři cisteren kolem kmene a tloušťku subdurálního hematomu. V celém souboru (n = 110) jsme neprokázali významnou korelaci mezi šíří cisteren kolem kmene či přesunem středočárových struktur na CT a prognózou nemocných. U 10 pacientů došlo po přijetí na naše oddělení ke zhoršení CT nálezu (zúžení perimezencefalických cisteren a zvýraznění přesunu střední čáry), který nás vedl k indikaci dekompresivní kraniotomie u těchto nemocných. Neprokázali jsme, že by progrese CT nálezu zhoršovala prognózu nemocných. U pacientů se subdurálním hematomem (n = 63) jsme prokázali, že s tloušťkou subdurálního hematomu se prognóza zhoršuje (p = 0,025). Při silnějším subdurálním hematomu byl též větší přesun střední čáry na CT (p = 0,0001). U pacientů vyššího věku jsme zjistili větší přesun střední čáry na CT i větší tloušťku subdurálního hematomu (p = 0,0021) než u mladších nemocných. Zároveň byl při operaci starších pacientů menší defekt tvrdé pleny, který měříme těsně před šitím plastiky (viz níže). Tuto korelaci můžeme objasnit větším objemem subdurálního hematomu a menším edémem atrofického mozku u starých nemocných.
U většiny pacientů byl kromě zevní dekompresivní kraniotomie či kraniektomie odstraněn určitý objem hematomu či byla resekována pohmožděná mozková tkáň (tab. 3). Lepší výsledek byl dosažen u pacientů, u nichž jsme kromě zevní dekomprese odstranili epidurální hematom či resekovali kontuzní ložisko. Tato korelace je statisticky významná (p = 0,0162).
Tab. 3. Podíl vnitřní dekomprese (odstranění hematomu, kontuze). 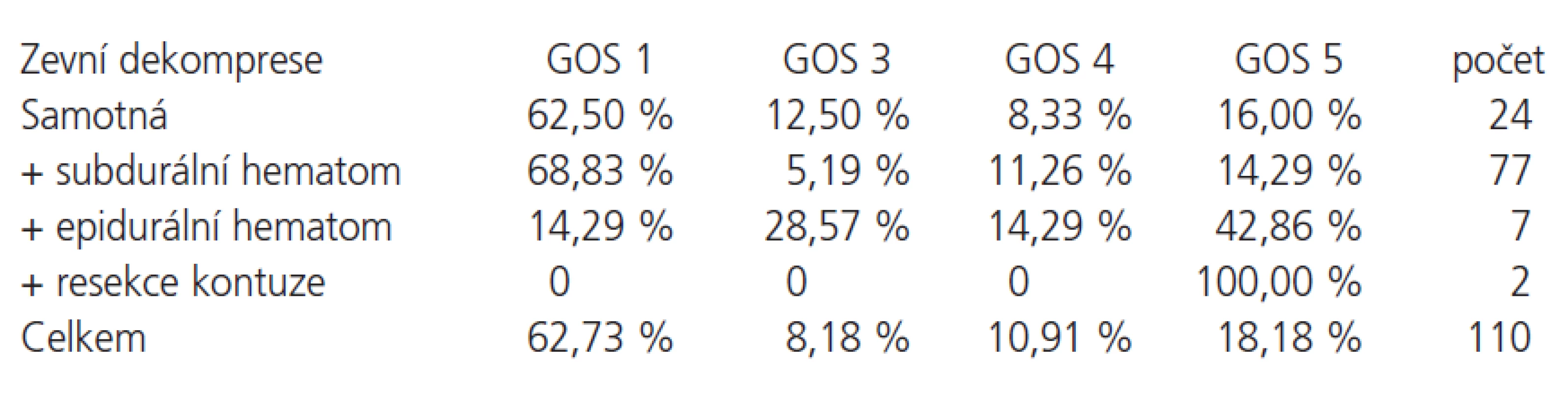
Osteoplastickou dekompresivní kraniotomii (s ponecháním kostní ploténky) jsme provedli v 31 případech, osteoplastickou dekompresivní kraniektomii (s odstraněním kostní ploténky) v 75 případech. Vliv typu operace na prognózu pacientů nebyl statisticky významný. U 4 pacientů jsme indikovali oboustrannou dekompresivní operaci.
Při měření nitrolebečního tlaku u 13 nemocných jsme zjistili významný pokles po provedení dekompresivní kraniotomie (graf 2). Mozkový perfuzní tlak (cerebral perfusion pressure - CPP) po operaci stoupl (graf 3). Tyto změny neměly prokazatelný vztah k prognóze nemocných.
Graf 2. Měření ICP – hodnoty před operací a po dekompresi. 
Graf 3. Měření CPP – hodnoty před operací a po operaci. 
Přínosem monitorace ICP je včasné zachycení nitrolebečních komplikací a sledování efektu léčby nitrolebeční hypertenze.
Měření defektu tvrdé pleny při operaci
Při dekompresivní kraniotomii jsme u našich pacientů měřili defekt tvrdé pleny před šitím plastiky (podrobněji kapitola Technika dekompresivní kraniotomie, obr. 1). Defekt tvrdé pleny při operaci kolísal v rozmezí 0-60 mm. Statisticky významný vztah mezi defektem tvrdé pleny a prognózou nemocných jsme u celého souboru nezjistili. U starších pacientů se subdurálním hematomem byl významně menší defekt tvrdé pleny při operaci (p = 0,026). Prokázali jsme, že defekt tvrdé pleny byl větší při užších cisternách kolem kmene (p = 0,0004, při hodnocení celého souboru, resp. p < 0,0001 u pacientů se subdurálním hematomem). U podskupiny pacientů, kteří měli na CT cisterny zaniklé nebo vyplněné krví, znamenal větší rozestup (defekt) tvrdé pleny horší prognózu (p = 0,0004). Totéž platí i pro pacienty se subdurálním hematomem ( p = 0,0021).
Sledovali jsme též další parametry jako pohlaví (75,5 % mužů), mechanizmus úrazu, opilost (34,5 %), přidružená poranění (16 %), polytraumata (7 %), komplikace v operační ráně (8 %), celkové infekce (23 %), provedení tracheotomie (58 %), další intrakraniální operace (9 %) či rozvoj hydrocefalu, jenž byl důvodem zavedení VP drenáže (8 %). U žádného z uvedených faktorů jsme nezjistili statisticky významný vztah k prognóze zraněných.
Epizoda hypoxie byla dokumentována u 8 nemocných, z nichž 7 zemřelo (GOS 1), 1 pacientka přežila v dobrém stavu (GOS 4). Jednalo se o 26letou pacientku s akutním subdurálním hematomem po autonehodě. Hypotenze pod 80 torr byla zaznamenána u 2 nemocných, oba do 1 roku zemřeli (GOS 1). Kombinace hypoxie a hypotenze byla zjištěna u 3 pacientů, všichni zemřeli do 1 týdne po úrazu. Vzhledem k nízkému počtu nemocných s prokázanou hypoxií či hypotenzí nelze v našem souboru jejich vliv hodnotit statistickými metodami.
Diskuse
Tab. 4 shrnuje přežití a jeho kvalitu u sestav pacientů po kraniocerebrálním poranění, kteří byli léčeni dekompresivní kraniotomií [3,4,6,8,9,18,20,23,24,26]. Jedná se o práce publikované od roku 1997, u nichž jsme ještě uvedli průměrný věk pacientů a dobu, za kterou bylo hodnoceno přežití a jeho kvalita. Na posledním řádku uvádíme naši skupinu pacientů.
Tab. 4. Přežití a jeho kvalita u pacientů, kteří byli léčení dekompresivní kraniotomií. 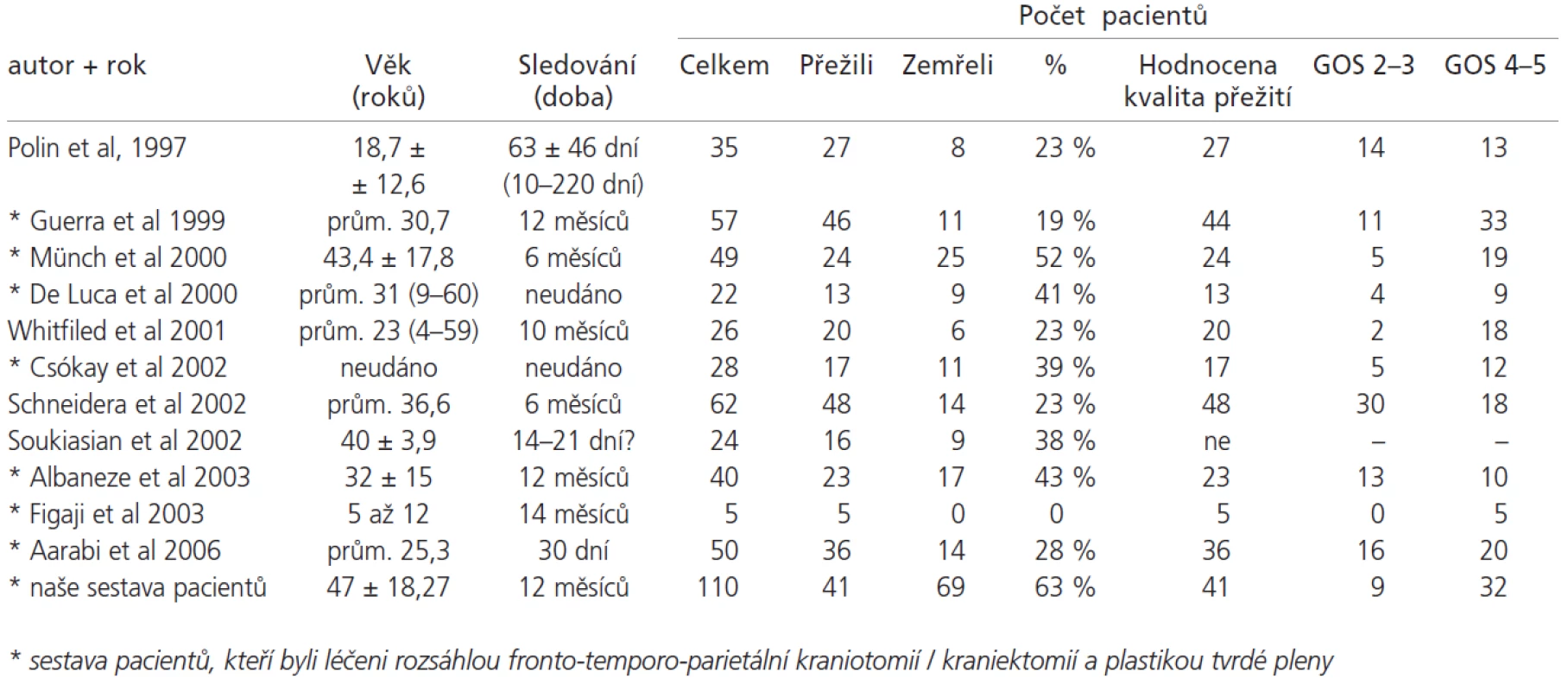
Skupiny pacientů jsou zpravidla malé, přežití pacientů v dobrém stavu kolísá od 25 % do 100 %, také úmrtnost kolísá od 0 % do 52 %. Hodnocení stavu pacienta je nestandardní - je prováděno v širokém rozmezí od 2-3 týdnů do 14 měsíců. Věkové spektrum pacientů u jednotlivých autorů je též variabilní, většinou se jedná jen o velmi mladé pacienty. Někteří užívají dekompresivní kraniotomii akutně, jiní až po nekontrolovatelném vzestupu nitrolebečního tlaku. Též způsob zevní dekomprese se výrazně liší. Přístupy jsou jedno - či oboustranné, v různých místech (bifrontálně, bitemporálně, fronto-temporo-parietálně). Většina autorů provádí plastiku tvrdé pleny, někteří odstraňují jen část kalvy a tvrdou plenu neotvírají.
Výsledek u traumat mozku by měl být standardně hodnocen po 1 roce [4,32,33]. Při kratším sledování je počet přežívajících nadhodnocen. Počet přežívajících v dobrém stavu je při sledování kratším než 1 rok podhodnocen zejména u mladých nemocných [33].
V našem souboru zemřelo do 1 roku 63 % pacientů, závislých (GOS 3) bylo 8 % pacientů a v dobrém stavu (GOS 4-5) přežívalo 29 % pacientů. Vyšší úmrtnost je v našem souboru způsobena zejména vyšším věkovým průměrem našich pacientů a delší dobou sledování oproti většině publikovaných prací.
Věk jako faktor, který významně ovlivňuje prognózu pacientů po těžkém kraniocerebrálním poranění, uvádí řada autorů [34,35,36,37,38]. Vyšší věk hodnotili jako nepříznivý faktor nezávislý na přidružených komplikacích.
V našem souboru pacientů jsme též prokázali, že věk je nezávislý faktor, který významně ovlivňuje prognózu (p < 0,0001). Shodně s prací Cosznyky et al [39] jsme zjistili významnou korelaci mezi věkem a příjmovým GCS - čím vyšší je věk, tím lepší je stav při přijetí, tj. vyšší GCS. Dále jsme zjistili významnou korelaci s přesunem střední čáry na CT – čím je vyšší věk, tím vyšší je přetlak, což je ve shodě s prací Goméze et al [33]. Subdurální hematom měl u starších nemocných větší tloušťku.
Poruchy reaktivity zornic jsou známkou dysfunkce mozkového kmene a jsou spojeny s horší prognózou zraněných. Levin [36] shrnuje vliv reaktivity zornic na přežití nemocných po těžkém kraniocerebrálním traumatu u různých sestav pacientů. U jednoho souboru uvádí 29% půlroční mortalitu u pacientů s oboustranně reagujícími zornicemi ve srovnání s 90-92% mortalitou u pacientů s oboustranně nereagujícími zornicemi. U jiného souboru nemocných udává celkovou 1roční mortalitu 43 %, ale u pacientů s nereagujícími zornicemi 73 %. V našem souboru jsme neprokázali statisticky významný vliv šíře či reaktivity zornic na prognózu pacientů. Při současném hodnocení šíře i reaktivity zornic již byl vztah k prognóze významný. Proti pacientům se širokými nereagujícími zornicemi měli prokazatelně lepší výsledek pacienti se středně širokými izokorickými reagujícími zornicemi. Roční mortalita byla u pacientů se středně širokými reagujícími zornicemi 40 %, u pacientů s mydriatickými nereagujícími zornicemi 81,58 %.
Hodnocení iniciální tíže poruchy vědomí (GCS) má úzký vztah k přežití a prognóze nemocných [20,36,40]. Prakticky u všech prací, které hodnotí léčbu kraniocerebrálních traumat, je vliv příjmového GCS na prognózu nemocných prokazován. S rozvojem intenzivistických postupů se zvyšují počty pacientů, kteří jsou již před přijetím do nemocnice řízeně ventilováni a tlumeni. Proto jsme v naší práci, kromě hodnocení celého souboru, zvlášť hodnotili pacienty farmakologicky netlumené. U celého souboru (n = 110) byla korelace mezi tíží poruchy vědomí a prognózou nemocných na hranici statistické významnosti. Pacienti s nižší hodnotou GCS při přijetí měli prognózu horší. U skupiny netlumených pacientů byla korelace stavu při přijetí a prognózy nemocných vysoce významná (p = 0,0141).
Známý negativní vliv hypoxie a hypotenze na prognózu pacientů po kraniocerebrálním poranění [33,41,42] se v našem souboru nepodařilo prokázat. Předpokládaný výskyt hypotenze či hypoxie je asi 30 % [41], v našem souboru 11,8%. Případy poklesu TK či hypoxie na místě nehody nebyly vždy záchrannou službou do dokumentace zaznamenány. Též nebyly dostupné údaje při sekundárním transportu zraněných. Tím je zřejmě frekvence těchto komplikujících faktorů podhodnocena.
V literatuře jsme nenašli práci, která by se zabývala měřením defektu tvrdé pleny při operaci.
V databázi Cochrane [43] je provedena analýza prací, které hodnotily užití dekompresivní kraniotomie při léčbě refrakterní nitrolebeční hypertenze u traumatického poranění mozku. Autoři nalezli jedinou práci, která splňuje kritéria kvalitní kontrolované studie [44] , která se týká pouze pediatrických pacientů. V uvedené práci autoři sledovali 27 pacientů po těžkém kraniocerebrálním poranění ve věku do 18 let. Všechny děti byly léčeny dle standardního léčebného protokolu. Pacienti s narůstajícím ICP byli randomizováni na ty, kteří byli léčeni jen konzervativně (n = 14), a na ty, kterým byla kromě běžné léčby ještě provedena dekompresivní operace (n = 15). Jako dekompresi autoři užili oboustrannou resekci části kalvy temporálně (o průměru 3-4 cm). Tvrdá plena nebyla otevřena. Po 48 hodinách hodnotili ICP. Zjistili signifikantně významnější průměrný pokles ICP ve skupině pacientů s dekompresí (o 8,98 torru). U pacientů bez dekomprese byl průměrný pokles o 3,69 torru. Ze 14 dětí z kontrolní skupiny mělo po půl roce dobrý výsledek (GOS 4 - 5) 14 % (2 děti). Z 15 dětí, u nichž byla provedena dekomprese, byl dobrý výsledek (GOS 4-5) v 54 % (7 dětí). Studie podporuje názor, že včasná dekomprese u dětských pacientů s poraněním mozku může zlepšit přežití i tíži neurologického postižení. Jedná se však o jedinou hodnotnější studii na velmi malé skupině pacientů. Příznivý efekt dekompresivní kraniotomie je třeba potvrdit v dalších studiích.
Závěr
Poranění mozku tvoří heterogenní skupinu se složitou patofyziologií. Na prognózu nemocných má vliv řada faktorů. Kromě námi analyzovaných parametrů je prognosticky významné i sledování kognitivních evokovaných potenciálů, hodnocení krevního průtoku pomocí TCD či perfuzního CT. Tyto metody jsme použili jen u malé části našich nemocných, a proto jsme nemohli jejich význam statisticky zhodnotit.
U našeho souboru pacientů s kraniocerebrálním poraněním, kteří byli léčeni dekompresivní kraniotomií, patří mezi nejdůležitější prognostické faktory věk pacientů, iniciální tíže poruchy vědomí a reaktivita zornic. Prokázali jsme výrazný pokles ICP a vzestup CPP po rozsáhlé dekompresivní kraniotomii. Přímý vliv snížení nitrolebečního tlaku na prognózu nemocných se nepodařilo prokázat. Díky jednotnému způsobu provedení rozsáhlé dekompresivní kraniotomie nad celou hemisférou lze měřit defekt tvrdé pleny v temporální oblasti před šitím plastiky (obr. 1). V naší práci jsme prokázali, že u pacientů, kteří měli na předoperačním CT perimezencefalické cisterny zaniklé či vyplněné krví, je větší šíře defektu tvrdé pleny spojena s horší prognózou. Proto měření defektu tvrdé pleny považujeme za významný parametr, který by měl být sledován u nemocných léčených dekompresivní kraniotomií. K jednoznačnému důkazu přínosu dekompresivní kraniotomie pro nemocné jsou nutné další multicentrické a randomizované studie.
Přijato k recenzi: 14. 11. 2006
Přijato do tisku: 14. 5. 2007
MUDr. Luděk Navrátil
Neurochirurgické oddělení
Fakultní nemocnice
Alej Svobody 80,
304 60 Plzeň
e-mail: navratil@fnplzen.cz
Zdroje
1. Hutchinson PJ, Menon DK, Kirkpatrick PJ. Decompressive craniectomy in traumatic brain injury - time for randomised trials? Acta Neurochir 2005; 147 : 1-3.
2. Kerr ME, Weber BB, Sereika SM, Wilberger J, Marion DW. Dose response to cerebrospinal fluid drainage on cerebral perfusion in traumatic brain - injured adulds. Neurosurg Focus 2001; 11(4): 1-7.
3. Aarabi B., Hesdorffer DC, Ahn ES, Aresco C, Scalera TM, Eisenberg HM. Outcome following decompressive craniectomy for malignant swelling due to severe head injury. J Neurosurg 2006; 104(4) 469-479.
4. Albanèse J, Leone M, Alliez J-R, Kaya J-M, Antoni F, Alliez B et al. Decompressive craniectomy for severe traumatic brain injury: Evaluation of the effects at one year. Crit Care Med 2003; 31(10): 2535-2538.
5. Coplin WM, Cullen NK, Polichera PN, Vinas FC, Wilseck JM, Zafonte RD et al. Safety and Feasibility of Craniectomy with Duraplasty as the Initial Surgical Intervention for Severe Traumatic Brain Injury. J Trauma 2001; 50 : 1050-1059.
6. Csókay A, Pataki G, Nagy L, Belán K. Vascular tunnel construction in the treatment of severe brain swelling caused by trauma and SAH. (Evidence based on intra-operative blood flow measure). Neurol Res 2002; 24 : 157-160.
7. Dickerman RD, Morgan JT, Mittler MA. Decompressive craniectomy for traumatic brain injury: when is too late? Childs Nerv Syst 2005; 21 : 1014-1015.
8. Figaji AA, Fieggen AG, Peter JC. Early decompressive craniotomy in children with severe traumatic brain injury. Childs Nerv Syst 2003; 19 : 666-673.
9. Guerra WKW, Gaab MR, Dietz H, Muller J-U, Pieck J, Fritsch MJ. Surgical decompression for traumatic brain swelling: indications and results. J Neurosurg 1999; 90 : 187-196.
10. Hejazi N, Witzmann A, Fae P. Unilateral decompressive craniectomy for children with severe brain injury. Report of seven cases and review of the relevant literature. Eur J Pediatr 161 : 99-104, 2002
11. Hutchinson PJ, Kirkpatrick PJ. Decompressive craniectomy in head injury. Curr Opin Crit Care 2004;10 : 101-104.
12. Kontopoulos V, Foroglou N, Patsalas J, Magras J, Foroglou G,Yannakou-Pephtoulidou M et al. Decompressive Craniectomy for the Management of Patients with Refractory Hypertension: Should it be Reconsidered? Acta Neurochir 2002; 144 : 791-796.
13. De Luca GP, Volpin L, Fornezza U, Cervellini P, Zanusso M, Casentini P et al. The Role of Decompressive Craniecomy in the Treatment of Uncontrollable Post-Traumatic Intracranial Hypertension. Acta Neurochir Suppl 2000; 76 : 401-404.
14. Meier U, Gräwe A. The importance of decomressive craniectomy for the management of severe head injuries. Acta Neurochir Suppl 2003; 86 : 367-371.
15. Messing –Jünger AM, Marzog J, Wöbker G, Sabel M, Bock WJ. Decompressive Craniectomy in Severe Brain Injury. Zentralbl Neurochir 2003; 64 : 171-177.
16. Mraček Z. Význam veliké dekompresivní kraniotomie při edému mozku u těžkých kraniocerebrálních poranění. Rozhl Chir 1977; 56 : 597-605.
17. Mraček Z. Intrakraniální hypertenze a nitrolebeční expanze: historické pojmy a jejich konsekvence v současné neurochirurgii. Plzeň Lék Sborn Suppl 1996; 70 : 147-150.
18. Münch E, Horn P, Schürer L, Piepgras A , Torsten P,Schmiedek P. Management of Severe Traumatic Brain Injury by Decompressive Craniectomy. Neurosuregery 2000; 47(2): 315-323.
19. Piek J. Decompressive surgery in the treatment of traumatic brain injury Current Opinion in Critical Care 2002; 8(2): 134-138.
20. Polin RS, Shaffrey ME, Bogaev ChA, Tisdale N, Germanson T, Bocchicio B et al. Decompressive bifrontal craniectomy in the treatment of severe refractory pasttraumatic cerebral edema. Neurosurgery 1997; 41 : 84-94.
21. Reithmeier T, Löhr M, Pakos P, Ketter G, Ernestus R-I. Relevance of ICP and ptiO2 for indication and timing of decompressive craniectomy in patients with malignant brain edema. Acta Neurochir 2005; 147 : 947-952.
22 Reithmeier T, Speder B, Pakos P, Brinker G, Löhr M, Klug N et al. Delayed bilateral craniectomy for treatment of traumatic brain swelling in children: case report and review of the literature. Childs Nerv Syst 2005; 21 : 249-253.
23. Schneider G-H, Bardt T, Lanksch WR, Unterberg A. Decompressive Craniectomy Following Traumatic Brain Injury: ICP, CPP and Neurological Outcome. Acta Neurochir Suppl 2002; 81 : 77-79.
24. Soukiasian HJ, Hui T, Avital I, Eby J, Thomson R, Kleisli T et al. Decompressive Craniectomy in Trauma Patients with Severe Brain Injury. Amer Surgeon 2002; 68 : 1066-1071.
25. Weiwei H, Yu Y, Weiguo L. Decompressive craniectomy as treatment for a rat model of “malignant” middle cerebral artery infarction. Cesk Slov Neurol N (v tisku).
26. Whitfield PC, Patel H, Hutchinson PJA, Czosnyka M, Parry D, Menon D et al. Bifrontal decompressive craniectomy in the management of posttraumatic intracranial hypertension. Br J Neurosurg. 2001; 15 (6): 500-507.
27. Mraček Z. Idea dekompresivní kraniotomie. Plzeň Lék Sborn Suppl 2000; 74 : 195-199.
28. Mraček Z. Kraniocerebrální poranění. Praha: Avicenum 1988.
29. Choc M., Mraček Z. Dynamika tlaku likvoru v pooperačním období u různých patologických stavů intrakraniálního prostoru. Rozhl Chir 1980; 59 : 747-756.
30. Teasdale G, Jennett B. Assesment of Coma and Impaired Consciousness: A Practical Scale. Lancet 1974; 2 : 81-4.
31. Jennett B, Bond M. Assessment of outcome after severe brain damage. Lancet 1975; 1(7905): 480-484, 1975.
32. Miller KJ, Schwab KA, Warden DL. Predictive value of an early Glasgow Outcome Scale score: 15-month score changes. J Neurosurg 2005; 103 : 239-245.
33. Multi Society Task Force on PVS (1994b). Medical aspects of the persistent vegetative state. N Engl J Med 1994; 330 : 1572-1579.
34. Gómez PA, Lobato DR, Boto GR, Lama A, Gonzáles PJ, Cruz J. Age and Outcome After Severe Head Injury. Acta Neurochir 2000; 142 : 373-381.
35. Hukkelhoven ChWPM, Steyerberg EW, Rampen AJJ, Farace E, Habbema JDF, Marshall LF et al. Patient age and outcome following severe traumatic brain injury: an analysis of 5600 patients. J Neurosurg 2003; 99 : 666-673.
36. Levin HS, Hamilton WJ, Grossman RG. Outcome after head injury. Handbook of Clinical Neurology 1990; 13 (57): 367-395,
37. Teasdale G, Skene A, Parker L, Jennet B. Age and outcome of severe head injury. Acta Neurochir Suppl 1979; 28 : 140-143.
38. Vollmer DG, Torner JS, Jane JA, Sadovnic B et al. Age and outcome following traumatic coma: why do older patients fare worse? J Neurosurg 1991; 75(Suppl): S37-S49.
39. Czosnyka M, Balestreri M, Steiner L, Smielewski P, Hutchinson PJ, Matta B,Pickard JD. Age, intracranial pressure, autoregulation, and outcome after brain trauma. J Neurosurg 2005; 102 : 450-454.
40. Maas AlR, Dearden M, Teasdale GM, Braakman R, Cohadou F, Iannotti F et al. EBIC-Guidelines for Management of Severe Head Injury in Adults. European Brain Injury Consortium. Acta Neurochir 1997; 139 : 286-294.
41. Brain Trauma Foundation, American Association of Neurological Surgeons, Joint Section on Neurotrauma and Critical Care. Guidelines for the management of severe head injury. J Neurotrauma 1996; 17 : 641-734.
42. Costeff H, Groswasser Z, Goldstein R. Long-term follow-up review of 31 children with severe closed head trauma. J Neurosurg 1990; 73 : 684.
43. Sahuquillo J, Arikan F. Cochrane Database of Systematic Reviews 2006; 2.
44. Taylor A, Butt W, Rosenfeld J, Shann F, Ditchfield M, Lewis E et al. A randomized trial of very early decompressive craniectomy in children with traumatic brain injury and sustained intracranial hypertension. Childs Nerv Syst 2001; 17 : 154-162.
Štítky
Dětská neurologie Neurochirurgie Neurologie
Článek vyšel v časopiseČeská a slovenská neurologie a neurochirurgie
Nejčtenější tento týden
2007 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
- Zolpidem může mít širší spektrum účinků, než jsme se doposud domnívali, a mnohdy i překvapivé
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Variace mozkového průtoku v zobrazovacích metodách
- Účinnost sonotrombotripse a sonotrombolýzy v akceleraci rekanalizace střední mozkové tepny u pacientů s akutní mozkovu ischemií
- Efekt 1- a 2segmentové krční diskektomie s mezitělovou náhradou: prospektivní 1roční studie
- Změny hladin IgE protilátek v séru u těžkého poranění mozku
- MRI zobrazení mozku u pacientů s myotonickou dystrofií DM 1
- Přínos existence iktové jednotky ke zlepšení diagnostiky u pacientů s cévními mozkovými příhodami
-
Komentář ke článku Brát R et al.
Srdeční myxomy jako příčina embolizace do CNS: desetileté zkušenosti - Srdeční myxomy jako příčina embolizace do centrálního nervového systému: desetileté zkušenosti
- Hydrocefalus po subarachnoidálním krvácení – vliv modality léčby aneuryzmatu
- Osteoplastická dekompresivní kraniotomie
- Dekompresivní kraniotomie u kraniocerebrálních poranění – hodnocení přežití a jeho kvality po jednom roce od úrazu
-
Komentář ke článku Sova M et al.
Chiariho malformace - Chiariho malformace – vlastní zkušenosti
- Ozáření kraniospinální osy u dětí s meduloblastomy v supinační poloze - dlouhodobé výsledky
- Epileptochirurgické řešení kavernózního hemangiomu asociovaného s fokální kortikální dysplazií při sekundární temporální epilepsii: kazuistika
- Osmotický demyelinizační syndrom – diagnostika magnetickou rezonancí: kazuistika
- Pozdní manifestace Wilsonovy choroby: kazuistika
- Metastáza velkobuněčného neuroendokrinního karcinomu tymu do mozku
- Akutní choreatický syndrom – kazuistika
- Měření nitrolebečního tlaku a Pascalův zákon
- Webové okénko
-
Analýza dat v neurologii III.
Nebojme se mediánu a robustních statistik - Prof. MUDr. Josef Vymazal, DrSc. osmdesátiletý
- Profesor MUDr. Karel Urbánek, CSc., sedmdesátiletý
- Recenze
- Česká a slovenská neurologie a neurochirurgie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chiariho malformace – vlastní zkušenosti
- Osmotický demyelinizační syndrom – diagnostika magnetickou rezonancí: kazuistika
- MRI zobrazení mozku u pacientů s myotonickou dystrofií DM 1
- Osteoplastická dekompresivní kraniotomie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




