-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Odporúčania Pracovnej skupiny pre IBD Slovenskej gastroenterologickej spoločnosti pre liečbu ulceróznej kolitídy
Guidelines of the IBD working group of the Slovak Gastroenterology Society on the management of ulcerative colitis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Autoři: Society On The Management Of Ulcerative Colitis; T. Hlavatý 1
; A. Krajčovičová 1; M. Zakuciová 2; M. Greguš 1; I. Šturdík 1; T. Koller 1; J. Baláž 3; M. Huorka 1; Pracovná Skupina Pre Ibd Sgs
Působiště autorů: Gastroenterologické a hepatologické oddelenie, V. interná klinika LF UK a UN Bratislava 1; I. interná klinika LF UPJŠ a UN L. Pasteura, Košice 2; Hepatologicko-gastroenterologicko-transplantačné oddelenie, II. interná klinika SZU a FNsP F. D. Roosevelta Banská Bystrica 3
Vyšlo v časopise: Gastroent Hepatol 2017; 71(3): 229-240
Kategorie: IBD: doporučené postupy
doi: https://doi.org/10.14735/amgh2017csgh.info05*Za skupinu členov Pracovnej skupiny pre IBD SGS: M. Bátovský, J. Malík, I. Bunganič, I. Čierna, L. Gombošová, M. Hlísta, M. Horáková, J. Janík, B. Kadlečková, P. Lietava, L. Lukáč, J. Tóth, J. Ušák, B. Valach, I. Valachová, E. Veselíny, J. Záň, Z. Zelinková
Souhrn
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Úvod
Nešpecifické črevné zápalové ochorenia (IBD – inflammatory bowel disease) sú chronické zápalové ochorenia tráviaceho traktu, ktoré zahŕňajú Crohnovu chorobu (CD – Crohn’s disease), ulceróznu kolitídu (UC) a indeterminovanú (neklasifikovanú) kolitídu. IBD majú stúpajúci incidenciu, postihujú prevažne mladých ľudí, sú sprevádzané rozvojom závažných komplikácií a sú spojené s vysokou mierou práceneschopnosti, hospitalizácií, operácií a potenciálne invalidizáciou pacienta. Navyše liečba je medicínsky aj ekonomicky náročná, čo prispieva k rastúcim nákladom na starostlivosť o týchto pacientov.
V minulosti sa problematike racionálnej liečby chronických nešpecifických zápalových ochorení venovali tri slovenské odporúčania vo forme metodických listov [1–3]. Od ich poslednej aktualizácie v roku 2012 boli publikované mnohé nové klinické štúdie, do praxe prišli nové lieky a pribudli nové vedecké poznatky o optimalizácii už existujúcich foriem liečby. Uvedené skutočnosti si preto vyžiadali aktualizáciu publikovaných odporúčaní.
Cieľom predkladaných odporúčaní je definovať štandardné terapeutické postupy, minimalizovať potenciálne riziká terapie a zabezpečiť racionálne využitie obmedzených ekonomických zdrojov pri liečbe UC. Výsledkom uplatnenia odporúčaní v klinickej praxi by malo byť zlepšenie výsledkov starostlivosti o pacientov s UC.
Metodika prípravy odporúčaní
Predkladané odporúčania nadväzujú na predchádzajúce odporúčania publikované v rokoch 2002, 2007 a 2012 [1–3]. Pri ich príprave boli použité medzinárodne akceptované štandardy prijímania konsenzuálnych odporúčaní expertov podľa metodiky Delphi [4,5].
Postup prípravy predkladaných odporúčaní zahŕňal niekoľko krokov. Pracovná skupina pre IBD Slovenskej gastroenterologickej spoločnosti (SGS) ustanovila na svojom stretnutí v apríli 2016 Komisiu na prípravu odporúčaní. Komisia pripravila štruktúru odporúčaní, proces ich prijímania a rozdelila prípravu jednotlivých oblastí medzi expertov pracovnej skupiny. Experti pripravili zoznam odporúčaní na základe prehľadu medzinárodnej literatúry, svojich znalostí a skúseností. Sila jednotlivých odporúčaní bola ohodnotená na základe úrovne medicínskych dôkazov podľa Oxfordského centra pre evidence based medicine, ktorá je uvedená v tab. 1 [6,7].
Tab. 1. Úroveň dôkazov podľa Oxfordského centra pre evidence-based medicine pre hodnotenie efektu liečby. Tab. 1. Oxford Centre for Evidence-based medicine Levels of Evidence for the evaluation of treatment efficacy. 
*Úroveň dôkazov môže byť znížená podľa kvality štúdií, inkonzistencie medzi štúdiami alebo ak je výsledok liečby (effect size) príliš malý. Úroveň dôkazov môže byť zvýšená ak je výsledok liečby (effect size) výrazný. Takto spracovaný návrh bol rozposlaný všetkým členom Pracovnej skupiny pre IBD na pripomienkovanie. Následne sa 8. decembra 2016 stretla prípravná komisia, ktorá zapracovala pripomienky do upraveného návrhu odporúčaní. Takto pripravené odporúčania boli predložené na rokovanie Pracovnej skupiny pre IBD, ktoré sa uskutočnilo 10. februára 2017. O každom z odporúčaní sa na stretnutí hlasovalo osobitne. Odporúčanie bolo prijaté, ak zaňho hlasovalo min. 70 % prítomných expertov. Ak nebolo odporúčanie v prvom kole prijaté, pripravilo sa upravené znenie odporúčania v zmysle diskusie a opätovne sa hlasovalo. Odporúčania, ktoré nezískali ani v druhom kole súhlas min. 70 % väčšiny expertov, neboli prijaté. Záverečné znenie odporúčaní spracovali a pripravili pre publikáciu Tibor Hlavatý a Anna Krajčovičová.
1. Hodnotenie aktivity UC
Odporúčanie
UC 1.1.
Klinická aktivita UC by sa mala monitorovať pomocou Mayo skóre alebo parciálneho Mayo skóre (pMayo) a v prípade ťažkej kolitídy podľa Truelove-Wittsovej klasifikácie (EL5).Odôvodnenie
Klasifikácia podľa Truelovea a Wittsa zostáva naďalej základnou klasifikáciou pre diagnózu akútnej ťažkej ulceróznej kolitídy (ASUC – acute severe ulcerative colitis) (tab. 2) [8,9].
Tab. 2. Aktivita ulceróznej kolitídy podľa Truelove-Wittsa [29]. Tab. 2. Activity of ulcerative colitis according to Truelove and Witts’ criteria [29]. ![Aktivita ulceróznej kolitídy podľa Truelove-Wittsa [29].
Tab. 2. Activity of ulcerative colitis according to Truelove and Witts’ criteria [29].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/9a78c8ad255210c056681448688d229e.png)
*Akútna ťažká ulcerózna kolitída je závažný stav. Definuje sa pomocou Truelove-Wittsových kritérií ako prítomnosť ≥ 6 krvavých stolíc denne a aspoň jedného z nasledovných znakov: tachykardia > 90 pulzov/min, horúčka > 37,8 °C, hemoglobín < 105 g/l, alebo FW > 30 mm/hod. FW – sedimentácia erytrocytov Pre mierne a stredne závažné formy je menej praktická a v praxi sa používa najmä jednoznačnejší skórovací systém podľa Sutherlanda, tzv. Mayo skóre alebo jeho jednoduchšia varianta pMayo [10,11]. Mayo skóre hodnotí štyri parametre aktivity UC: frekvencia stolíc za deň, prítomnosť krvácania, hodnotenie stavu choroby lekárom a endoskopický nález pri rektosigmoidoskopii (tab. 3). pMayo hodnotí iba prvé tri klinické parametre a nevyžaduje endoskopický nález (tab. 4).,
Tab. 3. Mayo skóre na hodnotenie aktivity ulceróznej kolitídy [31]. Tab. 3. Mayo Score for assessment of ulcerative colitis activity [31]. ![Mayo skóre na hodnotenie aktivity ulceróznej kolitídy [31].
Tab. 3. Mayo Score for assessment of ulcerative colitis activity [31].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/627b9a9520a8bf1c4996d6be47d0a174.png)
Tab. 4. Hodnotenie výsledku Mayo skóre. Tab.4. Evaluation of the Mayo Score results. 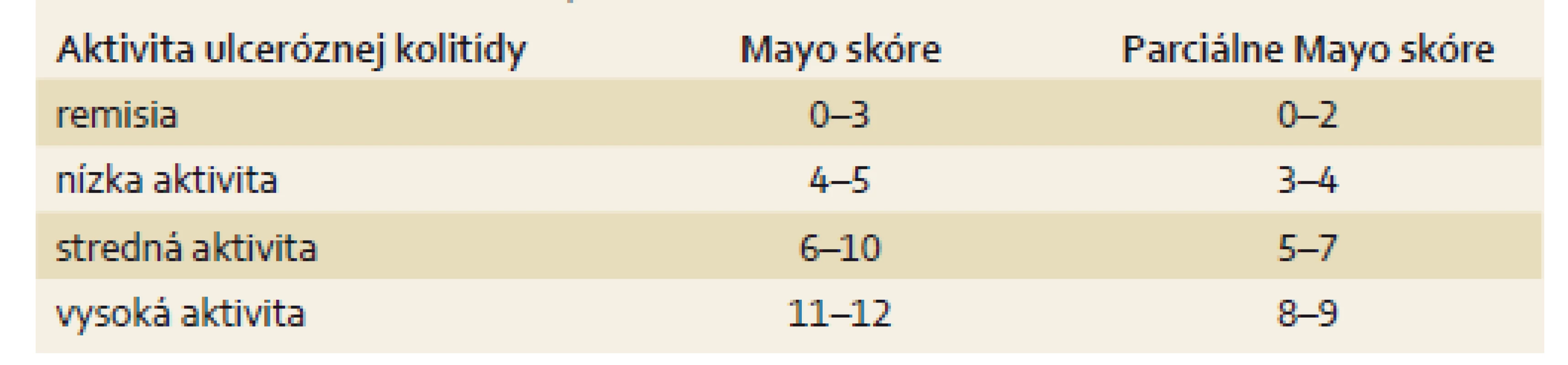
Významné medzinárodné organizácie ako je ECCO (Európska organizácia pre CD a UC) odporučujú inkorporovať niektorý z jednoduchých klinických a/alebo endoskopických skórovacích systémov do bežnej klinickej praxe [12].
Liečba UC
Liečba UC závisí predovšetkým od stupňa klinickej aktivity a rozsahu postihnutia čreva zápalom. Z hľadiska rozsahu postihnutia sa podľa Montrealskej klasifikácie rozlišuje proktitída, ľavostranná kolitída a extenzívna kolitída (pankolitída) [13]. Z hľadiska aktivity rozlišujeme UC s nízkou klinickou aktivitou (Mayo skóre 4–5, pMayo 3–4), strednou aktivitou (Mayo 6–10, pMayo 5–7) a vysokou aktivitou (Mayo 11–12, pMayo 8–9). Pokiaľ má pacient vysokú aktivitu ochorenia sprevádzanú známkami systémovej zápalovej odpovede, viď kritériá Truelovea a Wittsa, hovoríme o ASUC.
2. Liečba proktitídy
Odporúčanie
- UC 2.1.
Topický mesalazín je prvolíniovou liečbou pri proktitíde. Dosahuje vyššiu koncentráciu účinnej látky na sliznici rekta ako perorálne podávaný mesalazín (EL1). - UC 2.2.
Dávka 1 g denne vo forme čapíkov alebo klyziem je dostatočne účinná a jej zvyšovanie neprináša zvýšenie efektivity lokálnej liečby (EL1). - UC 2.3.
Topický mesalazín preparát je viac efektívny ako topický kortikosteroid pri indukcii remisie (EL2). - UC 2.4.
Pridanie orálneho aminosalicylátu alebo topického kortikosteroidu je výhodné pri neuspokojivej odpovedi, alebo intolerancii topického mesalazínu podávaného samostatne (EL2). - UC 2.5.
U pacientov, ktorí neodpovedajú na liečbu aminosalicylátmi, topickými kortikosteroidmi aminosalicylátmi, topickými kortikosteroidmi alebo pri ich kontraindikácii je indikovaná liečba celkovými kortikosteroidmi, tiopurínmi alebo biologická liečba niektorým z registrovaných preparátov anti-TNF-α (infliximab, adalimumab, golimumab) (EL1) alebo vedolizumabom (EL1).
Odvôvodnenie
Proktitída (E1) postihuje v čase stanovania diagnózy do 50 % pacientov. Prvou liečebnou voľbou pri aktívnej proktitíde je použitie topickej liečby. Základným liečebným pilierom je použitie lokálnych preparátov mesalazínu s čapíkovou úvodnou aplikačnou formou. V praxi však táto zásada zlyháva, cca len asi 25 % pacientov s proktitídou dostáva topickú terapiu [14]. ECCO odporučenie uvádza 1 g mesalazínu v čapíku raz denne. Čapíky sú lepšie tolerované a efektívnejšie ako klyzmy. Po 4 hod od aplikácie u pacientov s proktitídou vo forme klyzmy sa zvyšky liečebnej látky našli len u 40 % pacientov s penovou klyzmou a u 10 % s klasickou tekutou klyzmou. Pri použití vyšších dávok topického mesalazínu nad 1 g neboli dokázané lepšie liečebné výsledky. Jednorázová dávka topického mesalazínu je rovnako efektívna ako rozdelené dávky a nespornou výhodou takto podávaného preparátu je zvýšenie miery adherencie pacienta k liečbe. Topický mesalazín je viac účinnejší ako systémový pri liečbe UC lokalizovanej výlučne na rektum [15].
Pri porovnaní topického mesalazínu a kortikosteroidu je dosiahnutie symptomatickej (odds ratio – OR 2,42; 95% CI 1,72–3,41) a endoskopickej (OR 1,86; 95% CI 1,29–2,76) remisie lepšie. Z toho dôvodu je použitie topických kortikosteroidov rezervované pre pacientov s intoleranciou lokálne pôsobiaceho mesalazínu [16–18].
Pri nedostatočnej terapeutickej odpovedi je indikovaná kombinovaná liečba topického (1 g denne) a systémového aminosalicylátu v dávke vyššej ako 2 g denne [19]. Pri zlyhaní tejto kombinácie je ešte možné striedanie topických kortikosteroidov s topickým mesalazínom [20].
Udržiavacia dávka lokálne podávanej liečby sa pohybuje okolo 3 g týždenne, v závislosti na tolerancii a efektivite sa môže individuálne upraviť. Kombinácia orálneho a rektálneho aminosalicylátu sa môže použiť ako druhá línia v udržiavacej terapii, pričom minimálna dávka perorálneho preparátu aminosalicylátu je 1,2 g za deň [21–23]. Ukončenie dlhodobej udržiavacej liečby aminosalicylátmi je individuálne a spočíva v rešpektovaní priebehu ochorenia, odpovedi na liečbu, prítomnosti komplikácií, adherencii k liečbe a zohľadnení preferencií pacienta. Všeobecne u nekomplikovaných pacientov s nízkymi rizikom relapsu je možné po 1–2ročnom trvaní udržiavacej terapie nízkymi dávkami aminosalicylátov (pod 2 g denne) uvažovať o ukončení liečby [20].
3. Liečba ľavostrannej a extenzívnej kolitídy
3A Indukčná liečba ľavostrannej až extenzívnej UC s nízkou klinickou aktivitou
Odporúčanie
- UC 3.1.
Ľavostranná a extenzívna UC s miernou aktivitou sa odporúča liečiť perorálnymi a/alebo topickými preparátmi aminosalicylátov (napr. mesalazín alebo sulfasalazín) (EL1) alebo budezonidom s predĺženým uvoľňovaním multi-matrix (MMX) (EL2). - UC 3.2.
Perorálna liečba aminosalicylátmi by mala byť v dávke ≥ 2 g denne (EL1). Topická liečba mesalazínom sa odporúča v dávke 1 g denne (EL1).
Odôvodnenie
Ľavostranná, tiež distálna kolitída je definovaná ako zápal, ktorý postihuje hrubé črevo po lienálnu flexúru (E2) [24]. Približne u 2/3 pacientov sa prezentuje táto forma kolitídy. Progresia z distálnej formy do extenzívnej hrozí 10 % pacientov počas 10 rokov. Okolo 20 % pacientov počas 25 rokov podstúpi kolektómiu. Rizikové faktory predstavuje mladý vek v začiatku ochorenia, prezencia extraintestinálnych príznakov, nefajčiari a viac ako tri relapsy za rok [23,25].
Iniciálna terapia ľavostrannej kolitídy spočíva v podávaní perorálneho mesalazínu v dávke najmenej 2 g denne v kombinácii s lokálnym mesalazínom pri dávke 1 g denne. Kombinovaná liečba je efektívnejšia než lokálna alebo systémová monoterapia. Táto stratégia je založená na štúdii so 60 pacientmi, pri liečbe ktorých sa kombinovaná terapia ukázala efektívnejšia ako monoterapia [26]. Jej potvrdenie je podporené aj extrapoláciou v štúdii s použitím kombinovanej mesalazínovej liečby [27].
Kombinácia orálneho a lokálneho mesalazínu redukuje čas rektálneho krvácania v porovnaní s orálnou liečbou samotnou [27].
Subanalýza randomizovanej štúdie dokázala vyššiu účinnosť granulátu mesalazínu podávaného v dávke 3 g 1× denne oproti dávke 3 × 1 g [28]. Účinnosť mesalazínu je daná dávkou. V metaanalýze sledujúcej efekt mesalazínu v závislosti od dávky sa potvrdila skutočnosť, že dávky 5-ASA > 2 g denne boli účinnejšie v navodení remisie ako dávka < 2 g denne (RR 0,91; 95% CI 0,85–0,98) [29]. Ak krvácanie presahuje dobu 10–14 dní alebo úľava od príznakov po 40dňovej kúre mesalazínom sa nedostavuje, mala by sa zvážiť liečba kortikoidmi.
3B Udržiavacia liečba ľavostrannej a extenzívnej kolitídy s nízkou aktivitou
Odporúčanie
- UC 3.3.
Udržiavacia terapia aminosalicylátmi je liečbou prvej voľby u pacientov s UC, u ktorých bola navodená remisia orálnym alebo lokálnym preparátom aminosalicylátov (EL1). - UC 3.4.
Účinná perorálna dávka udržiavacej liečby pomocou preparátov aminosalicylátov je 1,2–4,8 g denne (EL1). - UC 3.5.
Perorálna liečba aminosalicylátmi môže byť v odôvodnených prípadoch doplnená topickými formami (EL2). - UC 3.6.
Probiotický preparát E. coli Nissle 1917 je vhodnou alternatívou pre udržiavaciu liečbu UC. Môže byť užívaný samostatne alebo s inými protizápalovými liekmi v dávke 200 mg denne (EL1).
Odôvodnenie
Kombinovaná liečba orálnym a topickým preparátom aminosalicylátov sa ukazuje efektívnejšia pri udržiavacej terapii oproti perorálnej liečbe samotnej. V dvoch randomizovaných kontrolných štúdiách sa dosiahol vyšší počet remisií pri kombinačnej liečbe v porovnaní s liečbou len perorálnym mesalazínom [30,31]. Minimálna efektívna dávka orálneho mesalazínu v udržiavacej liečbe je 1,2 g za deň a optimálna dávka lokálneho preparátu mesalazínu je 3 g za týždeň. Všetky dostupné orálne preparáty aminosalicylátov sú rovnako účinné a nie je jednoznačný dôkaz o ich prípadnej superiorite [22]. O ukončení udržiavacej liečby pri ľavostrannej miernej kolitíde platia tie isté zásady ako pri proktitíde.
Extenzívna kolitída je definovaná ako zápalové postihnutie hrubého čreva s extenziou nad lienálnu flexúru. Pacienti s týmto typom kolitídy majú vyššie riziko relapsov, kortikoidnej liečby, kolektómie a vzniku kolorektálneho karcinómu [32].
Indukčná liečba extenzívnej miernej UC sa v základných princípoch nelíši od liečby ľavostrannej kolitídy. Základom je kombinovaná liečba orálnym aminosalicylátom v dávke > 2 g denne (optimálne rozpätie je 2–4 g denne) a lokálnym preparátom mesalazínom v dávke 1 g denne. Liečba orálnym mesalazínom v dávke 4 g denne po dobu 2 mesiacov v kombinácii s lokálnou terapiou mesalazínom 1 g denne v štúdii PINCE potvrdila vyššie percento remisie u 64 % pacientov s nízkou a strednou aktivitou UC oproti 43 % pacientov liečených len orálnym mesalazínom [33].
V prípade, že sa klinický stav pri liečbe preparátmi aminosalicylátov do 2 týždňov nezlepší, malo by sa pristúpiť k terapii kortikoidmi alebo k biologickej liečbe.
Princípy udržiavacej liečby extenzívnej formy sa riadia odporúčaniami ako pri ľavostrannej kolitíde. Celkom 80 % pacientov však preferuje len samostatnú orálnu administráciu [34].
V etiopatogenéze IBD sa uplatňujú epiteliálno-slizničné imúnne interakcie, ktorých vznik, priebeh a dôsledky vo veľkej miere závisia od črevnej bakteriálnej flóry. Logickým vyústením v terapeutických postupoch sa tak javí administrácia probiotík. Racionalita ich použitia pri IBD sa sleduje už vyše 20 rokov a výsledky niektorých klinických štúdií sa odrazili aj v liečebných schémach s vysokým stupňom odporúčania. Z epidemiologického hľadiska je zaujímavé, že viac ako 43 % pacientov s IBD v Nemecku užíva probiotikum (indikované lekárom alebo nasadené samým pacientom).
Praktické použitie probiotík pri UC je v súčasnosti obmedzené na dve situácie: 1. udržanie remisie, 2. zápal v ileálnom vaku (pauč) u pacientov s UC a ileo-paučanálnou anastomózou [35]. Pri metanalýze 13 randomizovaných kontrolovaných štúdiách sa sledovalo skóre remisií a rekurenčných epizód. Skupiny s administráciou probiotík sa porovnávali s placebom. Metaanalýza ukázala, že probiotická terapia bola efektívnejšia ako placebo v udržaní remisie pri UC [36]. Niektoré štúdie dokazujú zlepšenie extraintestinálnych (najmä kĺbnych a očných) príznakov pri užívaní probiotík s produkciou kyseliny mliečnej [37]. Metaanalýza štúdií (1948–2009), v ktorých sa použili probiotiká pri UC, ukázala, že E. coli Nissle 1917 má rovnaké účinky pri udržaní remisie ako mesalazín [38].
3C Indukčná liečba ľavostrannej až extenzívnej UC so strednou až vysokou klinickou aktivitou
Odporúčanie
- UC 3.7.
UC so strednou aktivitou sa odporúča liečiť preparátmi aminosalicylátov v dávke ≥ 2g/den (EL1) a/alebo systémovými kortikosteroidmi v dávke 0,5–1 mg/kg (EL1) a/alebo budezonidom s predĺženým uvoľňovaním MMX (EL2). - UC 3.8.
UC s vysokou aktivitou sa odporúča liečiť systémovými kortikosteroidmi (EL1). - UC 3.9.
Kombinovaná perorálna a topická liečba zvyšuje účinnosť liečby preparátmi aminosalicylátov (EL2). - UC 3.10.
Dávkovanie aminosalicylátov 1× denne je rovnako účinné ako viackrát denne (EL1). - UC 3.11.
Liečba kortikosteroidmi by sa mala začať po 1–2 týždňoch znižovať a postupne v priebehu 2–3 mesiacov vysadzovať (EL4). - UC 3.12.
U pacientov rezistentných na liečbu kortikoidmi alebo pri ich kontraindikácii je indikovaná biologická liečba infliximabom, adalimumabom, golimumabom alebo vedolizumabom (EL1).
Odôvodnenie
UC so strednou klinickou aktivitou môže byť liečená podľa individuálnych okolností stavu pacienta buď preparátmi aminosalicylátov alebo kortikosteroidmi. Viaceré nezávislé metaanalýzy preukázali účinnosť aminosalicylátov na dosiahnutie a udržanie remisie u pacientov s miernou až stredne aktívnou UC [39,40]. Účinnosť aminosalicylátov pri UC dosahuje asi 55 %, je dávkovo dependentná a postačuje dávkovanie 1× denne [39,41]. Kombinovaná topická a perorálna forma liečby v porovnaní s perorálnou formou podávania zvýšila mieru dosiahnutia klinickej remisie zo 43 na 63 % [27].
Účinnosť perorálnych kortikosteroidov na indukciu remisie UC dosahuje okolo 80 % [42]. Experti doporučujú začať liečbu dennou dávkou 40 mg (alebo 0,5 mg/kg) a po 1–2 týždňoch znižovať dennú dávku každý týždeň o 5 mg [43].
Pri zlyhaní prvolíniovej indukčnej liečby alebo jej kontraindikácii je indikovaná biologická liečba preparátmi anti-TNF-α (infliximab, adalimumab, golimumab) alebo vedolizumabom 300 mg [44–48]. Infliximab sa podáva i.v. v dávke 5 mg/kg hmotnosti v 0., 2. a 6. týždni. Adalimumab sa aplikuje subkutánne v dávkovacom režime 160 mg v úvodnej dávke a 80 mg v 2. týždni [49]. Golimumab sa podáva subkutánne v úvodnej dávke 200 mg a 100 mg na 2. týždeň [47]. Vedolizumab sa aplikuje i.v. v dávke 300 mg v 0., 2. a 6. týždni [48]. Efektivita a bezpečnosť liečby jednotlivými biologikami bola v klinických štúdiách porovnateľná. V nedávnych štúdiách sa rovnako potvrdila porovnateľná účinnosť a bezpečnosť biosimilárneho infliximabu CT-P13 a originálneho infliximabu [50]. Priame porovnávacie štúdie dostupných biologík zatiaľ neboli publikované. Výber konkrétneho biologického lieku na indukciu remisie tak závisí od individuálneho zváženia benefitu, rizík a kontraindikácií pre konkrétneho pacienta a liek.
3D Udržiavacia liečba ľavostrannej a extenzívnej kolitídy so strednou až vysokou aktivitou
Odporúčanie
- UC 3.13.
Cieľom udržiavacej liečby UC je klinická remisia a slizničné zhojenie bez kortikosteroidov (EL2). - UC 3.14.
Udržiavacia liečba by sa mala podávať u každého pacienta a dlhodobo. Prerušenie liečby vedie k vysokej miere relapsov (EL1). - UC 3.15.
Po dosiahnutí remisie pomocou aminosalicylátov je indikovaná udržiavacia liečba aminosalicylátmi v minimálnej dennej dávke 1,2 g/deň (EL1). - UC 3.16.
Pri dosiahnutí remisie pomocou kortikosteroidov je indikovaná udržiavacia liečba aminosalicylátmi. Ak dôjde k relapsu na tejto liečbe, odporúča sa udržiavacia liečba pomocou biologickej liečby (infliximab, adalimumab, golimumab alebo vedolizumab) alebo tiopurínov (EL1). - UC 3.17.
Udržiavacia liečba pomocou probiotika E. coli Nissle 1917 je podobne účinná ako aminosalicylátmi (EL2). - UC 3.18.
Pri dosiahnutí remisie pomocou biologickej liečby (infliximab, adalimumab, golimumab alebo vedolizumab) je indikovaná dlhodobá udržiavacia liečba pomocou liečiva, ktorým sa remisia navodila (EL1). - UC 3.19.
Kombinovaná liečba infliximabom a azatioprínom dosahuje lepšie výsledky v udržaní remisie ako liečba jednotlivými preparátmi samostatne (EL2).
Odôvodnenie
Vzhľadom na vysokú mieru relapsov UC je udržiavacia liečba indikovaná u väčšiny pacientov, a to dlhodobo [43,51]. Dlhodobá liečba kortikosteroidmi je spojená s vysokou mierou závažných nežiaducich účinkov a nemala by sa podávať.
Účinnosť aminosalicylátových preparátov na udržanie dlhodobej remisie u pacientov s UC potvrdili výsledky mnohých štúdií aj veľká Cochrane metaanalýza [52,53]. Po 1 roku predstavovala úspešnosť na udržanie remisie 59 %, odds ratio vs. placebo 0,47 (95% CI 0,36–0,62). Nebol pritom rozdiel medzi dávkovaním 1x alebo 3× denne, ani medzi jednotlivými preparátmi [53]. Efekt liečby sa zdá byť závislý od celkovej dennej dávky, pričom najlepšie výsledky sa pozorovali v štúdiách s udržiavacou dennou dávkou nad 2 g. Kombinovaná perorálna a topická liečba dosahuje lepšie výsledky, pacienti ju však horšie tolerujú [54].
Podľa nedávnej metaanalýzy šestich menších klinických štúdií je udržiavacia liečba E. coli Nissle 1917 porovnateľne účinná ako liečba preparátmi 5-ASA [55].
Účinnosť tiopurínov v udržiavacej liečbe UC bola potvrdená metaanalýzou siedmich štúdií [56]. Celková úspešnosť po roku liečby dosahovala 56 %.
Účinnosť všetkých biologických preparátov (infliximab, adalimumab, golimumab, vedolizumab) na udržanie remisie u pacientov s UC bola potvrdená v jednoročných klinických štúdiách [44,46,48,57]. Podobne ako pri CD dosahuje kombinovaná liečba infliximabom a tiopurínmi vyššiu mieru klinickej remisie (40 %), resp. slizničného zhojenia (63 %) ako monoterapia infliximabom (22, resp. 55 %) alebo azatioprínom (24, resp. 37 %) [58].
Výber medikamentóznej liečby na udržanie remisie u pacientov s UC závisí od spôsobu, akým bola remisia dosiahnutá, účinnosti a tolerancie liekov v minulosti a od individuálneho zváženia benefitu, rizík a kontraindikácií pre konkrétneho pacienta a liek.
4. Akútna ťažká ulcerózna kolitída
ASUC, označovaná aj ako fulminantná kolitída, predstavuje závažný klinický stav [59,60]. Jej mortalita dosahuje 1,1–2,9 % a u značnej časti pacientov (~30 %) je nevyhnutná urgentná alebo elektívna kolektómia [59–61].
4A Definícia a hospitalizácia
Odporúčanie
- UC 4.1.
ASUC je závažný stav. Definuje sa pomocou Truelove-Wittsových kritérií ako prítomnosť ≥ 6 krvavých stolíc denne a ≥ 1 z nasledovných znakov: tachykardia > 90 pulzov/min, horúčka > 38 °C, hemoglobín < 105 g/L, alebo sedimentácia >30 mm/hod. - UC 4.2.
Pacienti s ťažkou kolitídou by mali byť hospitalizovaní. Starostlivosť by mala prebiehať v centre, kde je k dispozícii kvalifikovaný gastroenterológ a chirurg so skúsenosťami s liečbou ťažkej kolitídy. Inak by mal byť pacient preložený do 24 hod do centra, ktoré tieto podmienky spĺňa (EL5). - UC 4.3.
Počas hospitalizácie by mali byť denne monitorované minimálne nasledovné parametre: počet stolíc, vitálne funkcie, krvný obraz, urea, kreatinín, elektrolyty, C reaktívny protein (CRP) až do dosiahnutia klinického zlepšenia (EL5). - UC 4.4.
Natívna RTG snímka brucha a/alebo CT brucha by mali byť vyšetrené u každého pacienta pri príjme a následne podľa klinického stavu (EL5). - UC 4.5.
V rámci diferenciálnej diagnostiky by sa malo u každého pacienta urobiť kultivačné a mikroskopické vyšetrenie stolice na vylúčenie infekcie, stanoviť toxín Clostridium difficile a vylúčiť infekciu cytomegaloviru z bioptických vzoriek sliznice hrubého čreva (EL5).
Odôvodnenie
Pacienti s ASUC by mali byť hospitalizovaní, pretože vyžadujú monitorovanie klinického stavu a laboratórnych parametrov, intenzívnu starostlivosť a intravenóznu liečbu.
Hoci ASUC nie je možné spoľahlivo klinicky odlíšiť od infekčnej kolitídy, s liečbou sa nemá čakať na výsledky vyšetrenia stolice. Paušálna liečba antibiotikami sa neodporúča. V odôvodnených prípadoch je vhodné do liečby pridať antibiotiká zamerané na suspektné patogény.
4B Liečba akútnej ťažkej ulceróznej kolitídy
Odporúčanie
- UC 4.6.
Pacienti s ASUC by mali byť v 1. línii liečení intravenózne podávanými kortikosteroidmi (40–60 mg metylprednizolónu alebo 400 mg hydrokortizónu denne), pokiaľ nie sú prítomné závažné kontraindikácie pre ich podávanie (EL1). - UC 4.7.
Odpoveď na liečbu kortikosteroidmi je potrebné zhodnotiť do 72 hod po zahájení liečby (EL2). - UC 4.8.
Pacienti hospitalizovaní pre ASUC by mali dostávať komplexnú podpornú liečbu včítane intravenóznej rehydratácie, korekcie parametrov vnútorného prostredia (ako je hypokalémia a hypomagnezémia) a korekcie ťažkej anémie pomocou krvných transfúzií (EL5). - UC 4.9.
U všetkých hospitalizovaných pacientov sa odporúča profylaxia tromboembolických komplikácií (EL4). - UC 4.10.
Antibiotická liečba je indikovaná iba v prípade podozrenia na infekciu (EL2). - UC 4.11.
Parenterálna výživa by sa mala podávať iba v indikovaných prípadoch (EL5).
Odôvodnenie
Kortikosteroidy predstavujú aj naďalej základ liečby ASUC. Turner et al publikovali metaanalýzu 32 publikovaných klinických štúdií, ktoré skúmali účinnosť a bezpečnosť intravenóznych kortikosteroidov v liečbe ASUC [59]. V jednotlivých štúdiách sa podával i.v. prednizon v dávke 0,75–1,5 mg/kg hmotnosti pacienta alebo v dávke 40–100 mg bez ohľadu na hmotnosť alebo i.v. hydrokortizon v dávke 200–400 mg. Priemerná štandardizovaná denná dávka predstavovala 68 ± 13 mg prednizonu. Úspešnosť liečby dosiahla 67 % (95% CI 65–69 %) a zvýšenie dennej dávky nad 60 mg prednizonu neviedlo k lepším výsledkom liečby. Celková miera kolektómií dosiahla podľa analýzy 29 % a mortalita 1,1 %. Miera kolektómie nekorelovala s dávkou podávaných kortikosteroidov.
Nakoľko pri zlyhaní medikamentóznej liečby u pacientov s ASUC je nutná kolektómia, miera kolektómií sa používa ako hlavný parameter zlyhania liečby v klinických štúdiách. Viacero štúdií skúmalo prediktory nutnosti kolektómie u pacientov s ASUC. Travis et al zistili, že prítomnosť > 8 stolíc denne alebo 3–8 stolíc spolu s CRP > 45 mg/l na 7. deň po zahájení liečby predikovalo nutnosť kolektómie v 85 % prípadov [62]. Lindgren vyvinul index fulminantnej kolitídy na predikciu zlyhania medikamentóznej liečby ASUC [63]. Index sa vypočíta ako počet stolíc/deň × 0,14 CRP (mg/l) a hodnotí sa na 3. deň. Hodnota nad 8 dosahuje 72% pozitívnu prediktívnu hodnotu na určenie nutnosti kolektómie do 30 dní od hospitalizácie. Index bol validovaný aj v ďalšej štúdii s infliximabom [64]. Na základe retrospektívnych dát kohorty 167 pacientov s ASUC vyvinuli Ho et al predikčný index zlyhania medikamentóznej liečby založený na odlišných klinických parametroch [65]. Index zahŕňa počet stolíc (0–4 body), prítomnosť dilatácie kolon > 4 cm na RTG snímke (0 alebo 4 body) a hypoalbuminémiu < 30 g/l (0–1 bod). Hodnota indexu ≥ 4 na 3. deň po príjme predikovala kolektómiu so senzitivitou 85 % a špecificitou 75 %.
Odporúčania pre podpornú liečbu ASUC sa zväčša zakladajú na skúsenostiach a názoroch expertov [43]. Vo väčšine prípadov je nutné monitorovať parametre vnútorného prostredia a infúzne korigovať hypokalémiu a prípadne aj hypomagnezémiu, nakoľko obe zvyšujú riziko rozvoja toxického megakolon.
Profylaktickú liečbu tromboembólie subkutánnym nízkomolekulovým heparínom odporúča väčšina medzinárodných odborných spoločností [43,66–68]. Nedávna metaanalýza 33 štúdií potvrdila zvýšené riziko venóznej trombózy u pacientov s IBD (RR 1,96; 95% CI 1,67–2,30) [69]. V retrospektívnej analýze farmakologická profylaxia počas hospitalizácie pacientov s IBD znížila riziko venózneho tromboembolizmu (hazard ratio – HR 0,46; 95% CI 0,22–0,97) [70].
Paušálna antibiotická liečba ASUC sa neodporúča. Viaceré randomizované kontrolované klinické štúdie preukázali, že antibiotiká (i.v. metronidazol, tobramycín, ciprofloxacín alebo vankomycín) neprinášajú žiaden dodatočný liečebný benefit v liečbe ASUC [71–73]. Antibiotická liečba sa má podávať iba v indikovaných prípadoch, ako sú napr. prvý atak ťažkej kolitídy, pozitívna epidemiologická anamnéza kontaktu s infekciou, návrat z endemických oblastí výskytu amebiázy alebo pred plánovanou kolektómiou.
4C Zlyhanie kortikosteroidnej liečby
Odporúčanie
- UC 4.12.
V prípade nedostatočnej odpovede alebo zhoršenia pri liečbe i.v. kortikosteroidmi alebo pri závažných kontraindikáciách kortikosteroidov je indikovaná záchranná liečba ASUC (EL1). - UC 4.13.
U pacientov, ktorí ešte neboli liečení tiopurínmi, je indikovaná liečba infliximabom alebo cyklosporínom i.v. (EL2). - UC 4.14.
Pacienti, u ktorých bola v minulosti liečba triopurínmi neúčinná alebo ju netolerovali, je indikovaná liečba infliximabom (EL2). - UC 4.15.
Liečba infliximabom pri ASUC môže vyžadovať intenzifikovaný dávkovací režim (EL4).
Odôvodnenie
Hoci kortikosteroidy sú účinnou liečbou ASUC, časť pacientov na liečbu nedopovedá a časť pacientov má vážne kontraindikácie, ako sú zle kontrolovaný diabetes mellitus, hypertenzia, osteoporóza, katarakta alebo anamnéza steroidnej psychózy [43,59]. U týchto pacientov je indikovaná záchranná liečba infliximabom alebo cyklosporínom [43,74]. Podľa metaanalýzy 16 štúdií je krátkodobá bezpečnosť a účinnosť liečby infliximabom a cyklosporínom porovnateľná, nerandomizované štúdie naznačujú vyššiu účinnosť infliximabu v dlhodobej liečbe [74,75]. Výber záchrannej terapie ASUC závisí jednak od dostupnosti liečby a jednak od perspektívy udržiavacej terapie po dosiahnutí remisie.
Vzhľadom na úzky terapeutický index a vysokú mieru toxicity je cyklosporín indikovaný na indukciu remisie iba u tiopurín naivných pacientov, kedy slúži ako premostenie do nástupu ich účinku. V indukcii remisie sa podáva dávka cyklosporínu 2 mg/kg i.v., ktorá sa ukázala rovnako účinná ako vyššie dávky (83% odpoveď) [76]. Medzi kontraindikácie liečby cyklosporínom patrí renálna insuficiencia, hypomagnezémia < 0,45 mmol/l a hypocholesterolémia < 3 mmol/l. Tieto parametre je potrebné kontrolovať pred liečbou a počas nej. Po 7 dňoch sa prechádza na perorálne podávanie v dávke 5 (2–10) mg/kg, ktorá sa upravuje podľa plazmatickej hladiny cyklosporínu. Po dosiahnutí remisie je nutné začať s udržiavacou liečbou tiopurínmi.
Infliximab je rovnako účinnou alternatívou liečby ASUC [64,74,77]. Výsledky nedávneho výskumu ukazujú, že pacienti s ASUC majú zvýšený klírens infliximabu do lumenu čreva a potrebujú vyššie dávky. Akcelerované podávanie infliximabu v intervale tri infúzie za 3 týždne bolo v retrospektívnej štúdii asociované so signifikantne menšou mierou kolektómie (6,7 %) v porovnaní so štandardným dávkovaním (40 %) [78]. U pacientov, ktorí liečbu tiopurínmi netolerovali alebo nebola účinná, je infliximab liekom voľby.
Vzhľadom na vysokú mieru imunosupresie a vysoký výskyt závažných najmä infekčných komplikácií sa v súčasnosti neodporúča sekvenčná lie?by cyklospor?nom a infliximabom v akomko?vek porad? (3. l?nčby cyklosporínom a infliximabom v akomkoľvek poradí (3. línia). Pokiaľ pacient neodpovedá na záchrannú liečbu, je indikovaná kolektómia [43].
5. Indikácia na kolektómiu pri UC
Odporúčanie
- UC 5.1.
Pri zlyhaní medikamentóznej liečby ASUC do 7–10 dní od jej zahájenia by sa mala zvážiť urgentná kolektómia (a to bez ohľadu na rozvoj toxického megakolon) (EL1). - UC 5.2.
U pacientov podstupujúcich urgentnú kolektómiu je metódou voľby totálna alebo subtotálna kolektómia s ileostómiou a následnou elektívnou proktokolektómiou so zvážením vytvorenia ileo-análneho pauča alebo permanentnej ileostómie v ďalších sedeniach (EL5). - UC 5.3.
Medzi indikáce na elektívnu kolektómiu patrí chronická aktívna kolitída refraktérna na dostupnú medikamentóznu liečbu, nález kolorektálneho karcinómu alebo high-grade intraepiteliálnej neoplázie (EL5). - UC 5.4.
U pacientov podstupujúcich elektívnu kolektómiu je metódou voľby viacetapová totálna proktokolektómia s vytvorením ileo-análneho pauča alebo permanentnej ileostómie (EL5). - UC 5.5.
Totálna proktokolektómia s vytvorením ileo-análneho pauča by sa mala vykonávať v špecializovaných centrách, ktoré majú s liečbou skúsenosti (EL5).
Odôvodnenie
Urgentná kolektómia pre ASUC je asociovaná so zreteľahodnou mortalitou (5–8 %) a pooperačnou morbiditou (27–51 %). Medzi hlavné rizikové faktory zvýšenej mortality/morbidity patrí dĺžka hospitalizácie pred operáciou a perforácia čreva [79–81]. Nárast morbidity bol pozorovaný u pacientov hospitalizovaných pred operáciou viac ako 7–8 dní. Navyše predlžovanie medikamentóznej liečby nad 7 dní neprispieva ku zlepšeniu jej výsledkov [59]. Konzervatívna liečba sa preto nemá predlžovať, pokiaľ nie je zrejmý efekt do 7–10 dní.
Voľba operačnej stratégie a prístupu závisí od individuálneho stavu pacienta a lokálnych postupov a skúseností. Laparoskopický prístup je náročnejší, je však rovnako bezpečný a skracuje dobu hospitalizácie aj mieru včasných pooperačných komplikácií [79].
Výsledky operačnej liečby sú signifikantne lepšie u chirurgov, ktorí vykonávajú ročne viac operácií (high volume centers, tj. > 8 procedúr) [82,83]. Totálnu proktokolektómiu s vytvorením ileo-análneho pauča by mali vykonávať v centrách, ktoré majú skúsenosti a ročne operujú najmenej 4–10 pacientov [89].
6. Liečba paučitídy
Odporúčanie
- UC 6.1.
Akútna paučitída sa odporúča liečiť antibiotikami. Liekom voľby je metronidazol alebo ciprofloxacín (EL2). - UC 6.2.
Paučitída refraktérna na antibiotickú terapiu sa odporúča liečiť kombináciou antibiotík (EL2) alebo perorálnym budezonidom (EL2) alebo infliximabom (EL3). - UC 6.3.
Pri recidivujúcich paučitídach je indikovaná preventívna liečba probiotikom VSL#3 (EL2). - UC 6.4.
Pri zlyhaní medikamentóznej liečby a/alebo rekurentnej septickej paučitíde by sa malo zvážiť chirurgické odstránenie pauču.
Odôvodnenie
Antibiotická terapia predstavuje prvú líniu lie?by ak?tnej pčby akútnej paučitídy. Výsledky malej štúdie s kohortou 16 pacientov, kde 100 % (7 z 7) pacientov s liečbou ciprofloxacinom (1 000 mg/deň) po dobu 2 týždňov dosiahlo remisiu v porovnaní s 33 % (3 z 9) pacientov s liečbou metronidazolom (20 mg/kg/deň), naznačujú vyššiu efektivitu ciprofloxacínu v porovnaní s metronidazolom [84]. Rozdiel v počte nežiaducich účinkov nebol v danej štúdii pozorovaný (RR 0,18; 95% CI 0,01–2,98).
Randomizovaná štúdia s kohortou 26 pacientov porovnala budezonidové klyzmy (2 mg/100 ml) a perorálne podávaný metronidazol [85]. Efekt liečby bol v oboch skupinách porovnateľný. Alternatívu k fluorochinolónom alebo metronidazolu predstavujú amoxicilin-kyselina klavulánová, tetracyklíny a erytromycin. Na základe nekontrolovanej randomizovanej štúdie Isaacsa et al sa zdá byť v porovnaní s placebom efektívnou liečbou aj rifaximín [86]. V liečbe pau?it?dy s n?zkčitídy s nízkou aktivitou bol v nekontrolovanej nerandomizovanej otvorenej štúdii pozorovaný aj efekt probiotika VSL#3 (6 g/deň) [87].
Približne 10–15 % pacientov s akútnou paučitídou prejde do chronického štádia. Doposiaľ tri publikované štúdie naznačujú účinnosť kombinácie antibiotickej terapie. Efekt kombinácie antibiotickej terapie preukázala nemecká štúdia s kohortou 44 pacientov s refraktérnou paučitídou, ktorí boli liečení metronidazolom (800–1 000 mg/deň) a ciprofloxacinom (1 g/deň) [88]. Celkom 82 % pacientov dosiahlo po 28 dňoch liečby remisiu. V dvoch štúdiách na kohorte 18 a 8 pacientov neodpovedajúcich na liečbu metronidazolom, ciprofloxacinom alebo amoxicilin/kyselinou klavulánovou bola pozorovaná účinnosť kombinácie rifaximinu (2 g/deň) a ciprofloxacinu (1 g/deň) u 89 % pacientov po 15 dňoch liečby [89,90].
Alternatívu by mohla predstavovať liečba orálnym budezonidom v dávke 9 mg/deň po dobu 8 týždňov, pri ktorej dosiahlo remisiu 75 % (15 z 20) pacientov predtým neodpovedajúcich na liečbu metronidazolom alebo ciprofloxacinom [91]. Celkom 28 pacientov s refraktérnou paučitídou, 25 s paučitídou/pauč-ileitídou a/alebo 7 s pauč-fistulou dosiahlo v 88 % klinickú odpoveď po 10 týždňoch terapie infliximabom, v 82 % v kombinácii s iným imunosupresívom [92]. Efekt infliximabu bol potvrdený aj v štúdii s kohortou 10 pacientov s chronickou refraktérnou paučitídou, kedy 9 z 10 pacientov dosiahlo pri liečbe klinickú remisiu a 8 z 10 malo endoskopicky potvrdené úplné mukozálne vyhojenie do 6 mesiacov sledovania [93]. Možnou alternatívou k infliximabu sa zdá byť adalimumab, pri lie?be ktor?m dosčbe ktorým dosiahlo klinickú remisiu 50 % pacientov [94].
Pozitívne výsledky v prevencii paučitídy priniesla štúdia s VSL#3, ktorý sa podával počas 1 roku [95]. Paučitída sa objavila len u 10 % pacientov s probiotikom a až u 40 % v placebovej skupine. Efektivitu probiotika VSL#3 pri udržaní remisie pri paučitíde sledovali tri štúdie s uspokojivým výsledkom [95–97]. Z hľadiska prevencie paučitídy sa sledoval v otvorenej štúdii kmeň L. rhamnosus GG po dobu 3 rokov, incidencia paučitídy v tejto skupine bola len 7 % oproti kontrolnej s výskytom 29 % (p = 0,011) [98].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Datum schválení výborem Pracovnej skupiny pre IBD SGS: 10. 2. 2017.
doc. MUDr. Tibor Hlavatý, PhD.
Gastroenterologické a hepatologické oddelenie
1.interná klinika LF UK a UN Bratislava
Ružinovská 6
826 06 Bratislava
Slovenská republika
tibor.hlavaty2@gmail.com
Zdroje
1. Bátovský M, Jurgoš Ľ, Bielik J. Racionálna liečba chronických zápalov čreva. Metodický list racionálnej farmakoterapie 2002; 26 (2): 1–4.
2. Greguš M, Huorka M, Lukáč Ľ. Racionálna liečba chronických nešpecifických zápalov čreva. Metodický list racionálnej farmakoterapie 2007; 11 (5–6): 1–8.
3. Kužela L, Zakuciová M. Racionálna liečba chronických nešpecifických zápalov čreva. Štandardný diagnostický a terapeutický postup 2012; 15 (5–7): 1–12.
4. Brown BB. Delphi Process: a methodology used for the elicitation of opinions of experts. Santa Monica: The RAND Corporation 1968 : 15.
5. Calvet X, Panés J, Alfaro N et al. Delphi consensus statement: quality indicators for inflammatory bowel disease comprehensive care units. J Crohns Colitis 2014; 8 (3): 240–251. doi: 10.1016/j.crohns.2013.10.010.
6. OCEBM Levels of Evidence Working Group. The Oxford levels of evidence 2 [online]. Available from: www.cebm.net/index.aspx?o=5653.
7. Howick J, Chalmers I, Glasziou P et al. The 2011 Oxford CEBM levels of evidence (introductory document). [online]. Available from: www.cebm.net/index.aspx?o= 5653.
8. Truelove ES, Witts LJ. Cortisone in ulcerative colitis; final report on a therapeutic trial. Br Med J 1955; 2 (4947): 1041–1048.
9. Vilela EG, Torres HO, Martins FP et al. Evaluation of inflammatory activity in Crohn’s disease and ulcerative colitis. World J Gastroenterol 2012; 18 (9): 872–881. doi: 10.3748/wjg.v18.i9.872.
10. Sutherland LR, Martin F, Greer S et al. 5-aminosalicylic acid enema in the treatment of distal ulcerative colitis, proctosigmoiditis, and proctitis. Gastroenterology 1987; 92 (6): 1894–1898.
11. Rizzello F, Gionchetti P, Venturi A et al. Review article: monitoring activity in ulcerative colitis. Aliment Pharmacol Ther 2002; 16 (Suppl 4): 3–6.
12. Annese V, Daperno M, Rutter MD et al. European evidence based consensus for endoscopy in inflammatory bowel disease. J Crohns Colitis 2013; 7 (12): 982–1018. doi: 10.1016/j.crohns.2013.09.016.
13. Silverberg MS, Satsangi J, Ahmad T et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005; 19 (Suppl A): 5A–36A.
14. Seibold F, Fournier N, Beglinger C et al. Topical therapy is underused in patients with ulcerative colitis. J Crohns Colitis 2014; 8 (1): 56–63. doi: 10.1016/j.crohns.2013.03.005.
15. Gionchetti P, Rizzello F, Venturi A et al. Comparison of oral with rectal mesalazine in the treatment of ulcerative proctitis. Dis Colon Rectum 1998; 41 (1): 93–97.
16. Munkholm P, Michetti P, Probert CS et al. Best practice in the management of mild-to-moderately active ulcerative colitis and achieving maintenance of remission using mesalazine. Eur J Gastroenterol Hepatol 2010; 22 (8): 912–916.
17. Marshall J, Irvine E. Rectal corticosteroids versus alternative treatments in ulcerative colitis: a meta-analysis. Gut 1997; 40 (6): 775–781.
18. Regueiro M, Loftus EV, Steinhart AH et al. Medical management of left-sided ulcerative colitis and ulcerative proctitis: critical evaluation of therapeutic trials. Inflammatory bowel diseases 2006; 12 (10): 979–994.
19. Ng SC. Management of ulcerative colitis. In: Hart AL, Ng SC (eds). Inflammatory bowel disease: an evidence-based practical guide. Malta: Gutenberg Press Ltd 2012 : 5–12.
20. Prokopová L, Ďuricová D, Bortlík M et al. Doporučené postupy pro podávání aminosalicylátů u nemocných s idiopatickými střevními záněty. Gastroent Hepatol 2012; 66 (5): 391–400.
21. Travis S, Stange E, Lémann M et al. European evidence-based consensus on the management of ulcerative colitis: current management. J Crohns Colitis 2008; 2 (1): 24–62. doi: 10.1016/j.crohns.2007.11. 002.
22. Dignass A, Lindsay JO, Sturm A et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: current management. J Crohns Colitis 2012; 6 (10): 991–1030. doi: 10.1016/j.crohns.2012.09.002.
23. Meucci G, Vecchi M, Astegiano M et al. The natural history of ulcerative proctitis: a multicenter, retrospective study. Am J Gastroenterol 2000; 95 (2): 469–473.
24. Ruel J PS. Management of ulcerative colitis. In: Hart AL, Ng SC (eds). Inflammatory bowel disease: an evidence-based practical guide. Malta: Gutenberg Press Ltd 2012 : 13–26.
25. Langholz E, Munkholm P, Davidsen M et al. Changes in extent of ulcerative colitis a study on the course and prognostic factors. Scand J Gastroenterol 1996; 31 (3): 260–266.
26. Safdi M, DeMicco M, Sninsky C et al. A double-blind comparison of oral versus rectal mesalamine versus combination therapy in the treatment of distal ulcerative colitis. Am J Gastroenterol 1997; 92 (10): 1867–1871.
27. Marteau P, Probert C, Lindgren S et al. Combined oral and enema treatment with Pentasa (mesalazine) is superior to oral therapy alone in patients with extensive mild/moderate active ulcerative colitis: a randomised, double blind, placebo controlled study. Gut 2005; 54 (7): 960–965.
28. Kruis W, Kiudelis G, Racz I et al. Once daily versus three times daily mesalazine granules in active ulcerative colitis: a double-blind, double-dummy, randomised, non-inferiority trial. Gut 2009; 58 (2): 233–240. doi: 10.1136/gut.2008.154 302.
29. Ford AC, Achkar J-P, Khan KJ et al. Efficacy of 5-aminosalicylates in ulcerative colitis: systematic review and meta-analysis. Am J Gastroenterol 2011; 106 (4): 601–616. doi: 10.1038/ajg.2011. 67.
30. d‘Albasio G, Pacini F, Camarri E et al. Combined therapy with 5-aminosalicylic acid tablets and enemas for maintaining remission in ulcerative colitis: a randomized double-blind study. Am J Gastroenterol 1997; 92 (7): 1143–1147.
31. Yokoyama H, Takagi S, Kuriyama S et al. Effect of weekend 5-aminosalicylic acid (mesalazine) enema as maintenance therapy for ulcerative colitis: results from a randomized controlled study. Inflamm Bowel Dis 2007; 13 (9): 1115–1120.
32. Ho GT. Management of ulcerative colitis. In: Inflammatory bowel disease: an evidence-based practical guide. Malta: Gutenberg Press Ltd 2012 : 27–36.
33. Probert CS, Dignass AU, Lindgren S et al. Combined oral and rectal mesalazine for the treatment of mild-to-moderately active ulcerative colitis: rapid symptom resolution and improvements in quality of life. J Crohns Colitis 2014; 8 (3): 200–207. doi: 10.1016/j.crohns.2013.08. 007.
34. Moody GA, Eaden JA, Helyes Z et al. Oral or rectal administration of drugs in IBD? Aliment Pharmacol Ther 1997; 11 (5): 999–1000.
35. Verna EC, Lucak S. Use of probiotics in gastrointestinal disorders: what to recommend? Therap Adv Gastroenterol 2010; 3 (5): 307–319. doi: 10.1177/ 1756283X10373814.
36. Sang L-X, Chang B, Zhang W-L et al. Remission induction and maintenance effect of probiotics on ulcerative colitis: a meta-analysis. World J Gastroenterol 2010; 16 (15): 1908–1915.
37. Cain AM, Karpa KD. Clinical utility of probiotics in inflammatory bowel disease. Altern Ther Health Med 2011; 17 (1): 72–79.
38. Do VT, Baird BG, Kockler DR. Probiotics for maintaining remission of ulcerative colitis in adults. Ann Pharmacother 2010; 44 (3): 565–571. doi: 10.1345/aph.1M 498.
39. Wang Y, Parker CE, Bhanji T et al. Oral 5-aminosalicylic acid for induction of remission in ulcerative colitis. Cochrane Database Syst Rev 2016; 4: CD000 543. doi: 10.1002/14651858.CD000543. pub4.
40. Ford AC, Kane SV, Khan KJ et al. Efficacy of 5-aminosalicylates in Crohn’s disease: systematic review and meta-analysis. Am J Gastroenterol 2011; 106 (4): 617–629. doi: 10.1038/ajg. 2011.71.
41. Lichtenstein GR, Ramsey D, Rubin DT. Randomised clinical trial: delayed-release oral mesalazine 4.8 g/day vs. 2.4 g/day in endoscopic mucosal healing – ASCEND I and II combined analysis. Aliment Pharmacol Ther 2011; 33 (6): 672–678. doi: 10.1111/j.1365-2036.2010.04 575.x.
42. Truelove SC, Watkinson G, Draper G. Comparison of corticosteroid and sulphasalazine therapy in ulcerative colitis. Br Med J 1962; 2 (5321): 1708–1711.
43. Dignass A, Lindsay JO, Sturm A et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2: current management. J Crohns Colitis 2012; 6 (10): 991–1030. doi: 10.1016/j.crohns.2012.09. 002.
44. Rutgeerts P, Sandborn WJ, Feagan BG et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353 (23): 2462–2476.
45. Reinisch W, Sandborn WJ, Hommes DW et al. Adalimumab for induction of clinical remission in moderately to severely active ulcerative colitis: results of a randomised controlled trial. Gut 2011; 60 (6): 780–787. doi: 10.1136/gut.2010.221 127.
46. Sandborn WJ, van Assche G, Rein-isch Wet al. Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2012; 142 (2): 257–265. doi: 10.1053/j.gastro.2011.10. 032.
47. Sandborn WJ, Feagan BG, Marano C et al. Subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014; 146 (1): 85–95. doi: 10.1053/j.gastro.2013.05.048.
48. Feagan BG, Rutgeerts P, Sands BE et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013; 369 (8): 699–710. doi: 10.1056/NEJMoa1215734.
49. Chen X, Hou J, Yuan Y et al. Adalimumab for moderately to severely active ulcerative colitis: a systematic review and meta-analysis. BioDrugs 2016; 30 (3): 207–217. doi: 10.1007/s40259-016-0173-6.
50. Ben-Horin S, Casteele NV, Schreiber S et al. Biosimilars in inflammatory bowel disease: facts and fears of extrapolation. Clinical Gastroenterol Hepatol 2016; 14 (12): 1685–1696. doi: 10.1016/j.cgh.2016.05.023.
51. Gisbert JP, Marin AC, Chaparro M. The risk of relapse after anti-TNF discontinuation in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2016; 111 (5): 632–647. doi: 10.1038/ajg.2016.54.
52. Sutherland L, Macdonald JK. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2006; 2: CD000 544.
53. Feagan BG, Macdonald JK. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2012; 10: CD000544. doi: 10.1002/14651858.CD000544. pub3.
54. d‘Albasio G, Pacini F, Camarri E et al. Combined therapy with 5-aminosalicylic acid tablets and enemas for maintaining remission in ulcerative colitis: a randomized double-blind study. Am J Gastroenterol 1997; 92 (7): 1143–1147.
55. Losurdo G, Iannone A, Contaldo A et al. Escherichia coli Nissle 1917 in Ulcerative colitis treatment: systematic review and meta-analysis. J Gastrointestin Liver Dis 2015; 24 (4): 499–505. doi: 10.15403/ jgld.2014.1121.244.ecn.
56. Timmer A, Patton PH, Chande N et al. Azathioprine and 6-mercaptopurine for maintenance of remission in ulcerative colitis. Cochrane Database Syst Rev 2016; 5: CD000478. doi: 10.1002/14651858.CD000 478.pub4.
57. Sandborn WJ, Feagan BG, Marano C et al. Subcutaneous golimumab maintains clinical response in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014; 146 (1): 96–109. doi: 10.1053/j.gastro.2013.06.010.
58. Panaccione R, Ghosh S, Middleton S et al. Combination therapy with infliximab and azathioprine is superior to monotherapy with either agent in ulcerative colitis. Gastroenterology 2014; 146 (2): 392–400.
59. Turner D, Walsh CM, Steinhart AH et al. Response to corticosteroids in severe ulcerative colitis: a systematic review of the literature and a meta-regression. Clinical Gastroenterol Hepatol 2007; 5 (1): 103–110.
60. Bernstein CN, Ng SC, Lakatos PL et al. A review of mortality and surgery in ulcerative colitis: milestones of the seriousness of the disease. Inflamm Bowel Dis 2013; 19 (9): 2001–2010. doi: 10.1097/ MIB.0b013e318281f3bb.
61. Arnott ID, Leiper K, Down C et al. Outcome of acute severe ulcerative colitis: data from the UK National IBD Audit. Gut 2009; 58: A33.
62. Travis SP, Farrant JM, Ricketts C et al. Predicting outcome in severe ulcerative colitis. Gut 1996; 38 (6): 905–910.
63. Lindgren SC, Flood LM, Kilander AF et al. Early predictors of glucocorticosteroid treatment failure in severe and moderately severe attacks of ulcerative colitis. Eur J Gastroenterol Hepatol 1998; 10 (10): 831–835.
64. Järnerot G, Hertervig E, Friis-Liby I et al. Infliximab as rescue therapy in severe to moderately severe ulcerative colitis: a randomized, placebo-controlled study. Gastroenterology 2005; 128 (7): 1805–1811.
65. Ho GT, Mowat C, Goddard CJ et al. Predicting the outcome of severe ulcerative colitis: development of a novel risk score to aid early selection of patients for second-line medical therapy or surgery. Aliment Pharmacol Ther 2004; 19 (10): 1079–1087.
66. Mowat C, Cole A, Windsor A et al. Guidelines for the management of inflammatory bowel disease in adults. Gut 2011; 60 (5): 571–607. doi: 10.1136/gut.2010.224 154.
67. van Assche G, Dignass A, Bokemeyer B et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis Part 3: Special situations. J Crohns Colitis. 2013; 7 (1): 1–33. doi: 10.1016/j.crohns.2012.09. 005.
68. Harbord M, Annese V, Vavricka SR et al. The First european evidence-based consensus on extra-intestinal manifestations in inflammatory bowel disease. J Crohns Colitis 2016; 10 (3): 239–254. doi: 10.1093/ecco-jcc/jjv213.
69. Fumery M, Xiaocang C, Dauchet L et al. Thromboembolic events and cardiovascular mortality in inflammatory bowel diseases: a meta-analysis of observational studies. J Crohns Colitis 2014; 8 (6): 469–479. doi: 10.1016/j.crohns.2013.09. 021.
70. Ananthakrishnan AN, Cagan A, Gainer VS et al. Thromboprophylaxis is associated with reduced post-hospitalization venous thromboembolic events in patients with inflammatory bowel diseases. Clin Gastroenterol Hepatol 2014; 12 (11): 1905–1910. doi: 10.1016/j.cgh.2014.02. 034.
71. Mantzaris GJ, Hatzis A, Kontogiannis P et al. Intravenous tobramycin and metronidazole as an adjunct to corticosteroids in acute, severe ulcerative colitis. Am J Gastroenterol 1994; 89 (1): 43–46.
72. Chapman RW, Selby WS, Jewell DP. Controlled trial of intravenous metronidazole as an adjunct to corticosteroids in severe ulcerative colitis. Gut 1986; 27 (10): 1210–1212.
73. Mantzaris GJ, Petraki K, Archavlis E et al. A prospective randomized controlled trial of intravenous ciprofloxacin as an adjunct to corticosteroids in acute, severe ulcerative colitis. Scand J Gastroenterol 2001; 36 (9): 971–974.
74. Laharie D, Bourreille A, Branche J et al. Ciclosporin versus infliximab in patients with severe ulcerative colitis refractory to intravenous steroids: a parallel, open-label randomised controlled trial. Lancet 2012; 380 (9857): 1909–1915. doi: 10.1016/S0140-6736 (12) 61084-8.
75. Narula N, Marshall JK, Colombel JF et al. Systematic review and meta-analysis: infliximab or cyclosporine as rescue therapy in patients with severe ulcerative colitis refractory to steroids. Am J Gastroenterol 2016; 111 (4): 477–491. doi: 10.1038/ajg.2016.7.
76. Van Assche G, D‘Haens G, Noman M et al. Randomized, double-blind comparison of 4 mg/kg versus 2 mg/kg intravenous cyclosporine in severe ulcerative colitis. Gastroenterology 2003; 125 (4): 1025–1031.
77. Monterubbianesi R, Aratari A, Armuzzi A et al. Infliximab three-dose induction regimen in severe corticosteroid-refractory ulcerative colitis: early and late outcome and predictors of colectomy. J Crohns Colitis 2014; 8 (8): 852–858. doi: 10.1016/j.crohns.2014.01.006.
78. Gibson DJ, Heetun ZS, Redmond CE et al. An accelerated infliximab induction regimen reduces the need for early colectomy in patients with acute severe ulcerative colitis. Clin Gastroenterol Hepatol 2015; 13 (2): 330–335. doi: 10.1016/j.cgh.2014.07.041.
79. Øresland T, Bemelman WA, Sampietro GM et al. European evidence based consensus on surgery for ulcerative colitis. J Crohns Colitis 2015; 9 (1): 4–25. doi: 10.1016/j.crohns.2014.08.012.
80. Randall J, Singh B, Warren BF et al. Delayed surgery for acute severe colitis is associated with increased risk of postoperative complications. Br J Surg 2010; 97 (3): 404–409. doi: 10.1002/bjs. 6874.
81. Coakley BA, Telem D, Nguyen S et al. Prolonged preoperative hospitalization correlates with worse outcomes after colectomy for acute fulminant ulcerative colitis. Surgery 2013; 153 (2): 242–248. doi: 10.1016/j.surg.2012.08.002.
82. Chowdhury MM, Dagash H, Pierro A. A systematic review of the impact of volume of surgery and specialization on patient outcome. Br J Surg 2007; 94 (2): 145–161.
83. Burns EM, Bottle A, Aylin P et al. Volume analysis of outcome following restorative proctocolectomy. Br J Surg 2011; 98 (3): 408–417. doi: 10.1002/bjs. 7312.
84. Shen B, Achkar JP, Lashner BA et al. A randomized clinical trial of ciprofloxacin and metronidazole to treat acute pouchitis. Inflamm Bowel Dis 2001; 7 (4): 301–305.
85. Sambuelli A, Boerr L, Negreira S et al. Budesonide enema in pouchitis – a double-blind, double-dummy, controlled trial. Aliment Pharmacol Ther 2002; 16 (1): 27–34.
86. Isaacs KL, Sandler RS, Abreu M et al. Rifaximin for the treatment of active pouchitis: a randomized, double-blind, placebo-controlled pilot study. Inflamm Bowel Dis 2007; 13 (10): 1250–1255.
87. Gionchetti P, Rizzello F, Morselli C et al. High-dose probiotics for the treatment of active pouchitis. Dis Colon Rectum 2007; 50 (12): 2075–2082.
88. Mimura T, Rizzello F, Helwig U et al. Four-week open-label trial of metronidazole and ciprofloxacin for the treatment of recurrent or refractory pouchitis. Aliment Pharmacol Ther 2002; 16 (5): 909–917.
89. Gionchetti P, Rizzello F, Venturi A et al. Antibiotic combination therapy in patients with chronic, treatment-resistant pouchitis. Aliment Pharmacol Ther 1999; 13 (6): 713–718.
90. Abdelrazeq A, Kelly S, Lund J et al. Rifaximin-ciprofloxacin combination therapy is effective in chronic active refractory pouchitis. Colorectal Dis 2005; 7 (2): 182–186.
91. Gionchetti P, Rizzello F, Poggioli G et al. Oral budesonide in the treatment of chronic refractory pouchitis. Aliment Pharmacol Ther 2007; 25 (10): 1231–1236.
92. Ferrante M, D‘Haens G, Dewit O et al. Efficacy of infliximab in refractory pouchitis and Crohn‘s disease-related complications of the pouch: a Belgian case series. Inflamm Bowel Dis 2010; 16 (2): 243–249. doi: 10.1002/ibd.21037.
93. Calabrese C, Gionchetti P, Rizzello F et al. Short-term treatment with infliximab in chronic refractory pouchitis and ileitis. Aliment Pharmacol Ther 2008; 27 (9): 759–764. doi: 10.1111/j.1365-2036. 2008.03656.x.
94. Barreiro-de Acosta M, García-Bosch O, Gordillo J et al. Efficacy of adalimumab rescue therapy in patients with chronic refractory pouchitis previously treated with infliximab: a case series. Eur J Gastroenterol Hepatol 2012; 24 (7): 756–758. doi: 10.1097/MEG.0b013e3283 525a7b.
95. Gionchetti P, Rizzello F, Helwig U et al. Prophylaxis of pouchitis onset with probiot-ic therapy: a double-blind, placebo-controlled trial. Gastroenterology 2003; 124 (5): 1202–1209.
96. Gionchetti P, Rizzello F, Venturi A et al. Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: a double-blind, placebo-controlled trial. Gastroenterology 2000; 119 (2): 305–309.
97. Mimura T, Rizzello F, Helwig U et al. Once daily high dose probiotic therapy (VSL# 3) for maintaining remission in recurrent or refractory pouchitis. Gut 2004; 53 (1): 108–114.
98. Gosselink MP, Schouten WR, van Lieshout LM et al. Delay of the first onset of pouchitis by oral intake of the probiotic strain Lactobacillus rhamnosus GG. Dis Colon Rectum 2004; 47 (6): 876–884.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Digestivní endoskopieČlánek Spánková endoskopie – cílená endoskopická diagnostika u pacientů s obstrukční spánkovou apnoíČlánek Význam nutričního poradenství při léčbě obézních pacientů endoskopickými restrikčními metodamiČlánek XXI. hradecké gastroenterologické a hepatologické dny a XI. mezinárodní endoskopický workshopČlánek Správná odpověď na kvízČlánek Rifaximin
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2017 Číslo 3- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Digestivní endoskopie
- Jaká byla příčina masivní enteroragie?
- Spánková endoskopie – cílená endoskopická diagnostika u pacientů s obstrukční spánkovou apnoí
- Endoskopická drenáž pankreatických tekutinových kolekcií – 6-ročná skúsenosť v terciárnom gastroenterologickom centre v období rokov 2006–2012
- Transanální minimálně invazivní resekce rekta s totální mezorektální excizí po endoskopické mukózní resekci
- Kolonické dekomprese v běžné praxi
- Prvé skúsenosti s katétrovou konfokálnou laserovou endomikroskopiou (pCLE) v biliodigestívnej endoskopii
- Granulárnobunkový tumor pažeráka – kazuistika a prehľad
- Odporúčania Pracovnej skupiny pre IBD Slovenskej gastroenterologickej spoločnosti pre liečbu ulceróznej kolitídy
- Problematická diagnostika a závažné biliárne komplikácie echinokokózy pečene
- Význam nutričního poradenství při léčbě obézních pacientů endoskopickými restrikčními metodami
- Problematika tuberkulózy a latentní tuberkulózní infekce u pacientů s idiopatickými střevními záněty léčenými biologickou léčbou
- Výměna koeditorů na pozici zástupce šéfredaktora pro Slovenskou republiku
- 21st Days of Gastroenterology and Hepatology and 11th International Endoscopic Workshop in Hradec Králové
- Report of the 16th Slovak-Czech IBD day in Nitra
-
Novel developments in pancreatic disorders
Peter Layer Lecture – Gastro Update Europe 2016, Prague - Výběr z mezinárodních časopisů
- Správná odpověď na kvíz
- Vyhlášení soutěže o dvě nejlepší původní práce 2016
- Kreditovaný autodidaktický test: digestivní endoskopie
- Rifaximin
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rifaximin
- Kolonické dekomprese v běžné praxi
- Odporúčania Pracovnej skupiny pre IBD Slovenskej gastroenterologickej spoločnosti pre liečbu ulceróznej kolitídy
- Problematická diagnostika a závažné biliárne komplikácie echinokokózy pečene
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



