-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Warfarín – jeho syntéza a vlastnosti v dvadsaťročnej retrospektíve*
Warfarin – its synthesis and properties in a twenty-year retrospective*
The review paper deals with some aspects of warfarin history and its use, at the beginning as a rodenticide and later as an anticoagulant. It describes its principal physical-chemical properties and it analyzes schematically the possibilities of its preparation by both selective and non-selective synthesis from coumarin derivatives. A survey of syntheses and its results are tabulated, including the literary references, and the paper is concluded with an evaluation of the prospects of this agent in comparison with alternative anticoagulants and its advantages, disadvantages and prospects.
Keywords:
warfarin • anticoagulants • coumarins • review of syntheses
Autoři: Eva Milatová; Viktor Milata
Působiště autorů: Slovenská technická univerzita ; Limbová 5, 833 05 Bratislava, Slovenská republika ; Oddelenie organickej chémie, Ústav organickej chémie, katalýzy a petrochémie, Fakulta chemickej a potravinárskej technológie ; I. Interná klinika SZÚ
Vyšlo v časopise: Čes. slov. Farm., 2013; 62, 111-119
Kategorie: Přehledy a odborná sdělení
*Táto práca je venovaná prof. RNDr. Jozefovi Čižmárikovi, PhD. pri príležitosti jeho životného jubilea.
Souhrn
Prehľadný článok sa zaoberá niektorými aspektami histórie warfarínu a jeho použitia spočiatku ako rodenticídu a neskôr ako antikoagulancia. Sú popísané jeho základné fyzikálno-chemické vlastnosti a schematicky rozobrané možnosti prípravy selektívnou i neselektívnou syntézou z derivátov kumarínu. Je uvedený tabuľkový prehľad syntéz a ich výsledkov s literárnymi odkazmi a záver článku tvorí zhodnotenie perspektív tohto liečiva s porovnaním s alternatívnymi antikoagulanciami a zhodnotené sú ich výhody, nevýhody a perspektívy.
Kľúčové slová:
warfarín • antikoagulanciá • kumaríny • prehľad syntézÚvod
Kardiovaskulárne choroby patria k najčastejším príčinám úmrtí. V súvislosti s týmto faktom úzko rezonuje potreba ovplyvnenia fyzikálnych vlastností krvi a ciev, kde k najdôležitejším patrí krvná zrážanlivosť. V dôsledku protrombotického stavu dochádza k vzniku trombózy, ktorá sa klinicky manifestuje cievnou mozgovou príhodou, hlbokou žilovou trombózou alebo pľúcnou embolizáciou. Etiopatogeneticky sa na vzniku protrombotického stavu môže podielať jedna z troch nasledujúcich príčin opísaných prvý krát Rudolfom Virchowom v roku 18561): poškodenie endotelu, stáza krvi, resp. zmeny v zložení krvi. Klinický význam ovplyvnenia hemokoagulácie antikoagulanciami spočíva v zabránení vzniku protrombotického stavu, a tým prevencii tromboembolizmu. Mechanizmus účinku spočíva v inhibícii syntézy koagulačných faktorov, resp. v ich priamej alebo nepriamej inhibícii (prostredníctvom väzby na antitrombín)2). Priame antikoagulanciá zaraďujeme do skupiny tzv. nových antikoagulancií s viacerými výhodami oproti klasickým antikoagulanciám vyplývajúcich zo selektivity ich účinku. Medzi najväčšie výhody patrí predvídateľnosť efektu, podávanie vo fixných dávkach, nízke množstvo liekových a potravinových interakcií, bez nutnosti laboratórneho monitoringu v porovnaní s klasickými antikoagulanciami. Pre tieto vlastnosti sú postupne zavádzané do širšej klinickej praxe3).
V klinickej praxi sa antikoagulanciá využívajú v primárnej a sekundárnej prevencii, resp. liečbe tromboembolizmu2). Ku klasickým antikoagulanciám zaraďujeme kumarínový derivát warfarín s dokázanou účinnosťou v zmysle redukcie tromboembolických príhod potvrdenou vo viacerých klinických štúdiách. Warfarín pôsobí nepriamo prostredníctvom inhibície tvorby koagulačných faktorov dependentných od vitamínu K v pečeni. Vzhľadom na úzke terapeutické okno a z toho vyplývajúce riziko nežiadúcich účinkov v zmysle pre - alebo poddávkovania klinicky sa manifestujúcich krvácaním, resp. trombózou, je nutné efekt antikoagulácie prísne monitorovať. V laboratórnych podmienkach sa sleduje medzinárodný normalizovaný pomer, ktorý vyjadruje pomer medzi protrombínovým časom pacienta a kontroly; optimálne v rozmedzí 2–3 v závislosti od indikačného kritéria4).
Pri nastavovaní na antikoaulačnú liečbu zohrávajú významnú úlohu okrem genetických faktorov zodpovedných až za 45–60 % interindividuálnej variability aj faktory negenetické (50% variability), k akým patria vek, pohlavie, BMI, aktuálny obsah vitamínu K v potrave, compliance pacienta, celkový stav katabolizmu a anabolizmu a i. Genetické faktory zahŕňajú viac než 30 génov s tisíckami popísaných polymorfizmov, pričom zásadný vplyv sa pripisuje len dvom z nich – génu CYP2C9 zo systému cytochrómu P 450 a génu pre vitamín k-epoxid reduktázy VKORC1 podieľajúcich sa na metabolizácii warfarínu vedúcej k variabilite v odpovedi na warfarín5).
Pacienti indikovaní na liečbu kumarínmi sú pacienti rizikoví z hľadiska vývoja trombózy, najčastejšie sú to však pacienti s fibriláciou predsiení pre jej vysokú prevalenciu v populácii – 1–6 %6), pacienti s prekonanou hlbokou žilovou trombózou, pĺúcnou embolizáciou, alebo po náhrade srdcových chlopní.
Samotný warfarín (I) bol zavedený do klinickej praxe v roku 1955, aj keď jeho objav sa pripisuje Stahmannovi a kol. v roku 19477). Meno WARFARIN vzniklo z prvých písmen Wisconsin Alumni Research Foundation. Koncovka –ARIN naznačuje, že sa jedná o zlúčeninu patriacu medzi kumaríny. Je všeobecne známe, že bol vynájdený ako jed na potkany – rodenticíd, ale vďaka rôznym náhodám sa zistilo, že jeho protizrážanlivý efekt možno využiť v medicíne pri farmakoterapii8). Dokonca aj americký prezident Dwight D. Eisenhower bol jedným z prvých pacientov liečených warfarínom (obr. 1). Dnes je warfarin celosvetovo najrozšírenejšie používané antikoagulačné liečivo. Býva predpisovaný pacientom trpiacim žilovými trombózami a fibriláciami predsiení. Aj keď je toto liečivo využívané v medicíne už viac ako 50 rokov, stále sú s ním spojené určité komplikácie. Tieto sú spôsobené tým, že toto liečivo vykazuje širokú interindividuálnu variabilitu v dávke, má úzke terapeutické rozmedzie a vyskytujú sa rôzne interakcie s inými liekmi alebo potravinami.
Heslo „warfarin“ dáva v komerčných databázach (Web of Knowledge®, Sciencedirect®, Reaxys®, SciFinder®, Scopus® a i.) neprehľadné množstvo odpovedí na rôznych úrovniach a preto tento článok si neberie za úlohu vyčerpávajúco spracovať problematiku warfarínu, ale sústredíme sa na prehľad prípravy tohto rodenticídu – antikoagulátora. Napr. v ScienceDirect je v nadpise publikácií slovo warfarin použité v 25 440krát. Tento prehľadný článok sa zaoberá novšími prístupmi k syntéze warfarinu datovanými najmä po roku 1990.
Vlastnosti warfarínu
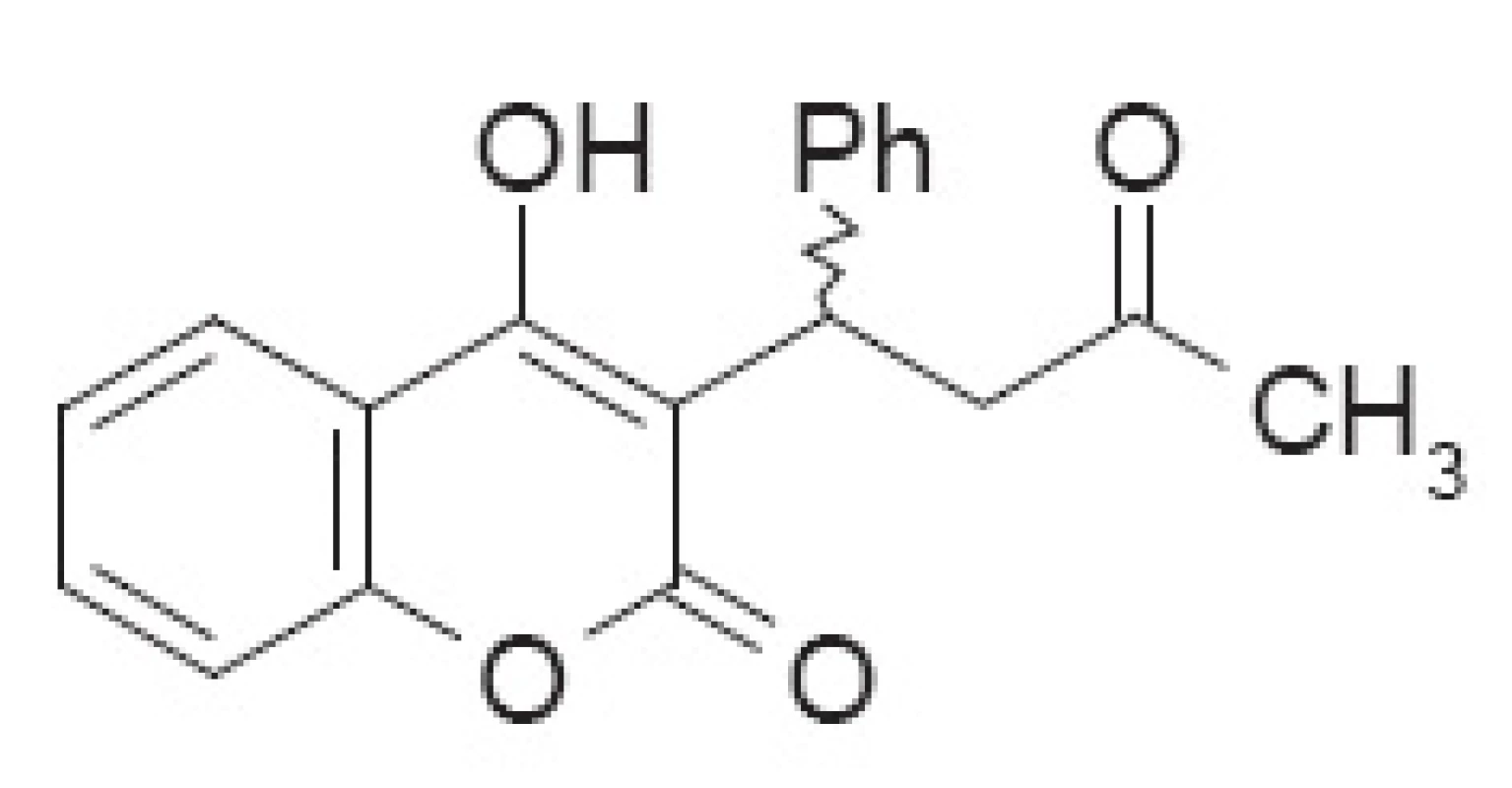
Warfarín (I, CAS 81-81-2) derivát kumarínu (4-hydroxy-3-(3-oxo-1-phenylbutyl)-2H-1-benzopyrán-2-ón) alebo tiež 3-(α-acetonylbenzyl)-4-hydroxykumarín či 1-(4′′-hydroxy-3′′-coumarinyl)-1-fenyl-3-butanón alebo 3-α-fenyl-β-acetyletyl-4-hydroxykumarín. Molekulová hmotnosť pre sumárny vzorec C19H16O4 je 308.33 a vypočítaná elementálna analýza je C 74.01 %, H 5.23 %, O 20.76 %, je kryštalická zlúčenina s teplotou topenia 161 °C (etanol), rozpustná v acetóne a dioxáne, čiastočne v metanole, etanole, izopropanole a niektorých olejoch. Výborne sa rozpúšťa v alkalických roztokoch za vzniku rozpustných solí (napr. sodná, CAS 129-06-6). Prakticky je nerozpustný vo vode, benzéne, cyklohexáne, Skellysolv-och A a B (pentán, hexán). Kyslý enolický hydroxyl dáva soli, acetát (t.t. 11–118 °C), oxoforma oxím (t.t. 182–183 °C) a dinitrofenylhydrazón (t.t. 215–215 °C). RTG štrukúrnu analýzu vykonal Bravic9)
Warfarín je antikoagulans kumarínového typu. Aplikuje sa obvykle ako racemát (avšak S(-−)-enantiomér (CAS 5543-57-7) je viac účinný) pod viacerými názvami, napr. WARF compound 42™; Rodex™ (Hacco); Sakarat X™ (Killgerm); Warfotox™ (Aimco), sodná soľ ako Coumadin™(BMS); Marevan™ (Goldshield); Warfilone™ (Merck & Co.) a mnohé ďalšie. Ich prehľad podáva F. Dentali10).
Enantiomérne rozlíšenie a určenie absolútnej konfigurácie sa ako prvému podarilo Westovi11); konformácie v roztoku študoval Valente12). Stereošpecifické HPLC stanovenie v plazme opísali autori13). β-Cyklodedextríny14) a ich 6-monoureido-6-monodeoxypermetylované deriváty v TEAP buferi boli taktiež použité na analýzu racemickej zmesi warfarínu15) podobne ako aj ich 6-O - -(hydroxypropyltrimetylamóniové étery16). Úspešné bolo aj použitie imobilizovanej celulázy (CBH I) ako stacionárnej fázy pre priame rozlíšenie enantioméreov17).
Štúdiá toxicity warfarínu opísali autori v lit.18, 19). Vplyv warfarínu na metabolizmus K vitamínu podrobne opísal Bell20); rodenticídny mechanizmus pôsobenia a rezistencia je študovaný autormi21). Ľudský metabolizmus warfarínu je študovaný Lewisom22). Antimetastatický efekt pri rakovine pľúc popisuje23, 61), u adenokarcinómu potkanov Neulauer24). Komplexný popis warfarínu vykonal Babhair25), zatiaľ čo jeho farmakológia a terapeutické pôsobenie je popísaná v26); farmakokinetika a efekt na genetické odchýlky študovali v práci27). Klinické porovnanie s aspirínom v sledovaní výskytu infarktu myokardu vykonal Hurlen28).
Príprava warfarínu
Syntéza warfarínu je popísaná v databáze SciFinder® 24 odkazmi, v databáze Reaxys® 47 odkazmi. Z toho v SciFinderi® je uvedených 13 enantioselektívnych syntéz a 11 popisuje výlučne prípravu racemátu, ktorý je predávaný a klinicky akceptovaný. Racemického warfarínu sa v databáze SciFinder® (CAS No. 81-81-2) týka 6794 odkazov, sodnej soli (CAS No. 129-06-6) 725 odkazov, draselnej soli (CAS No. 2610-86-8) 54 odkazov, S-enantioméru (CAS No. 5543-57-7) 750 odkazov a R-enantioméru (CAS No. 5543-58-8) 659 odkazov. Boli pripravené trítiom29) ako aj izotopom 13C značené molekuly warfarínu30).
Syntéza warfarínu (obr. 2A) nie je v podstate zložitá a vychádza najčastejšie zo 4-hydroxykumarínu B31), ľahko dostupného napr. z kyseliny salicylovej a jej derivátov. Regioselektívna Michaelova adícia na benzalacetón C (či jeho syntetické ekvivalenty) alebo vedie k racemickému warfarínu, pričom reakcia môže byť uskutočnená jednostupňovo alebo viacstupňovo (v tabuľke 1 v stĺpci Reakčné podmienky odpovedá počet riadkov počtu reakčných štupňov). Stereoselektivitu tejto reakcie je možné modifikovať prídavkom organokatalyzátora, rozpúšťadla, Lewisovej kyseliny, pričom sa používa hlavne E-benzalacetón (4-fenyl-but-3-én-2-ón). Alternatívou je separácia enantiomérov cez chirálne 1,3-dioxolány pripravené reakciou s diastereomérnymi 2,3-butándiolmi32) následne po metylácii trimetylsilyldiazometánom alebo enantioselektívna hydrogenácia E-dehydrowarfarínu (4-hydroxy-3-(3-oxo-1-phenylbut-1enyl)-2H-1-benzopyrán-2-ón).
Obr. 2. Schéma syntézy warfarínu 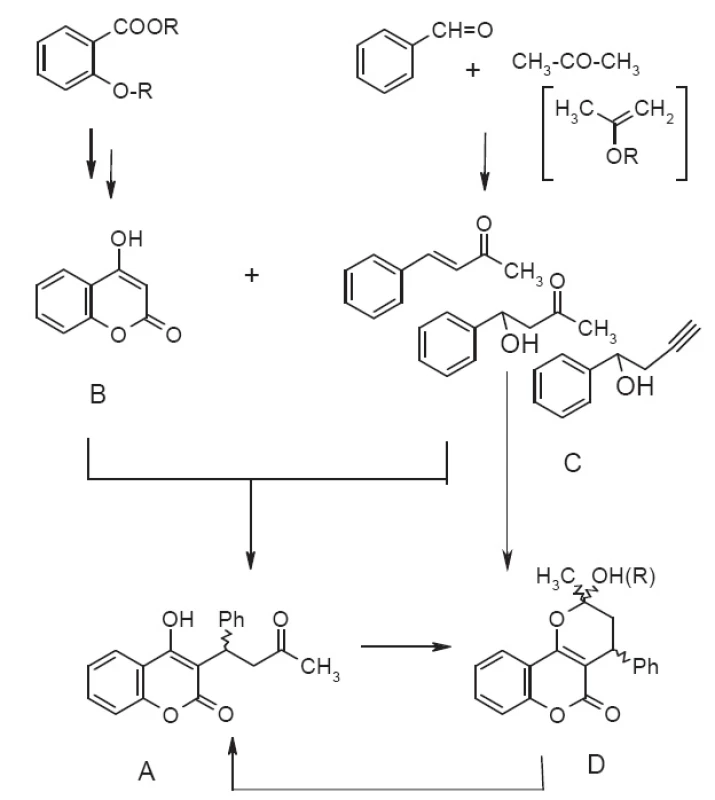
Tab. 1. Prehľad novších syntéz warfarínu zoradených od najnovších 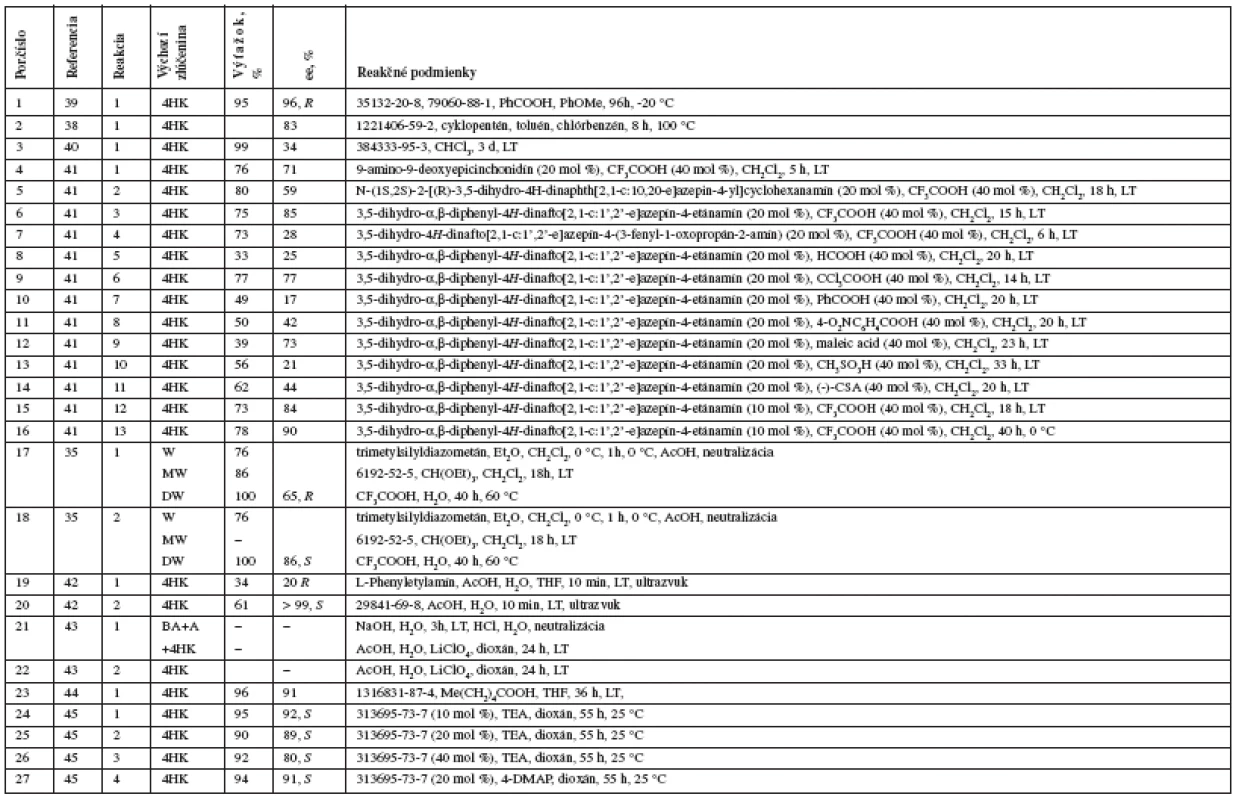

ee – entiomeric excess (enentiomerny prebytok), 4HK – 4-hydroxykumarín, W – warfarín, 3BrW – 3-brómfenylwarfarín, 4MW – 4-metylwarfarín, DHW – 3,4-dehydrowarfarín, BA – benzaldehyd, MP – 2-metoxypropén, MtP – 2-metyloxypropén, CW – cyklowarfarín (hemi/metyl/etylacetál) Warfarín je možné pripraviť aj otvorením metyl/etyl/poloacetálu D vzniknutého atakom 4-hydroxyskupiny na karbonylovú skupinu acetylu33, 34), vznikajúceho pri kyslokatalyzovanej Michaelovej adícii alebo z warfarínu cyklizáciou trialkylortoesterom35) či butanónom36). Miesto benzalacetónu je možné použiť 2-metoxypropén, resp. chirálny 2-mentyloxypropén34) alebo 4-fenyl-4-hydroxybutan-2-ón37) či 4-fenyl-4-hydroxypropín38).
Prehľad syntetických prístupov v syntéze warfarínu zobrazuje obrázok 2 a podrobne rozoberá aj s odkazmi na pôvodnú literatúru tabuľka 1.
Perspektívy warfarínu a antikoagulačnej liečby
Napriek mnohým všeobecne známym nevýhodám zohrávajú kumarínové deriváty neustále nezastupiteľnú úlohu v klinickej praxi pre dlhodobý efekt zníženia výskytu tromboembolizmu v primárnej, ako aj sekundárnej prevencii. Perspektívnu alternatívu predstavujú nové antikoagulanciá charakterizované vysokou selektivitou účinku. Patria sem priame inhibítory faktora Xa – rivaroxaban (Xarelto®) a IIa trombínu – dabigatran (Pradaxa®). Poskytujú mnohé z výhod ideálneho antitrombotika: predvídateľnosť efektu, možnosť perorálnej aplikácie vo fixných dávkach, bez nutnosti monitoringu, bez prítomnosti liekových, či potravinových interakcií, ako aj bez rizika vývoja heparínom indukovanej trombocytopénie ako častej komplikácie pri podávaní nízkomolekulárnych heparínov. Pre tieto vlastnosti sa javia perspektívnou alternatívou v prevencii a liečbe tromboembolizmu, čo potvrdzujú aj výsledky viacerých klinických štúdií. V súčasnosti sa používajú predominantne v chirurgických odboroch v prevencii tromboembolizmu u pacientov po náhrade bedrového resp. kolenného kĺbu. Registrácia v krajinách EÚ prebehla v roku 2008 na základe výsledkov štúdií RE-NOVATE, RE-MODEL, RE-MOBILIZE a RECORD1-461, 62). V rokoch 2010–2011 boli na základe výsledkov štúdií RELY a ROCKET AF schválené v prevencii tromboembolizmu a cievnych mozgových príhod u pacientov s nevalvulárnou fibriláciou predsiení63, 64). Navyše, v rokoch 2011-2012 bol rivaroxaban schválený Americkou FDA v liečbe a sekundárnej prevencii hlbokej žilovej trombózy a pľúcnej embólie na základe výsledkov štúdií EINSTEIN a EINSTEIN extension65).
K nevýhodám okrem vyššieho výskytu slizničných krvácaní a vyššej ceny najväčšou ostáva absencia antidóta. S tým súvisí nemožnosť zrušenia antikoagulačného účinku v urgentných situáciách s rizikom vývoja život ohrozujúcej hemorágie. V tejto súvislosti vedecký tím Steva Stilesa vedie v Kalifornii 2.fázu klinického výskumu zameranú na nové univerzálne antidótum inhibítorov faktora Xa, ktorý nesie názov PRT4445 a predstavoval by ťažisko v managemente život ohrozujúcich krvácaní u pacientov antikoagulovaných inhibítormi faktora Xa, resp. u pacientov podstupujúcich urgentný chirurgický výkon. Ukončenie štúdie sa predpokladá v roku 201366).
Stret záujmov: žiadny.
Táto publikácia bola vytvorená v rámci projektu „Centrum pre priemyselný výskum optimálneho spôsobu syntézy vysoko účinných liečiv“ ITMS 26240220061 na základe podpory operačného programu Výskum a vývoj financovaného z Európskeho fondu regionálneho rozvoja.
Došlo 5. apríla 2013 / Přijato 24. apríla 2013
E. Milatová
I. Interná klinika SZÚ
Limbová 5, 833 05 Bratislava, Slovenská republika
prof. Ing. Viktor Milata, DrSc. (∗)
Oddelenie organickej chémie, Ústav organickej chémie, katalýzy a petrochémie, Fakulta chemickej a potravinárskej technológie
Slovenská technická univerzita
Radlinského 9, 812 37 Bratislava, Slovenská republika
e-mail: viktor.milata@stuba.sk
Zdroje
1. Mazúch J., Čalkovská A., Dobrotová M., Kubisz P., Lindner J., Mištuna D., Mayzlík J., Musil D., Pullmann R., Radoňák J., Staško J., Tatár M. Tromboembolická choroba venózneho pôvodu. Martin: Osveta 2008.
2. Bátorová A. Nové antikoagulanciá - súčasnosť a perspektívy ďalšieho rozvoja. Kardiol prax 2008; 6, 45–50.
3. Bátorová A. Profylaxia a liečba venózneho tromboembolizmu. Abstrakty. Satelitné sympózium. Ortopedický kongres s medzinárodnou účasťou. Bratislava 2009; 1.
4. Guyatt G. H., Akl E. A., Crowther M., Gutterman H. J. Executive summary: antithrombotic therapy and prevention of thrombosis, 9th ed: american college of chest physicians evidence-based clinical practice guidelines. Chest 2012; 141, 7S–47S.
5. Tomek A., Maťoška V., Kumstýřová T., Táborský L. Využití farmakogenetiky při léčbě warfarinem. Vnitř Lék 2009; 55, 565–569.
6. Lukl J., Bulava A., Benešová M., Neužil P., Černý Š. Fibrilace síní. Praha: Grada Publishing 2009.
7. Stahmann M. A., Ikawa M., Link K. P. 3-substituted 4-hydroxycoumarin and process of making it. U.S. 2427578, 1947 pre Wisconsin Alumni Research Found.
8. Wardrop D., Keeling D. The Story of the discovery of heparin and warfarin. British J. Haematology 2008; 141, 757-776, DOI:10.1111/j.1365-2141.2008.07119.x3.
9. Bravic G., Gaultier J., Hauw C. Structure cristalline d´une antivitamine K: la warfarine. Comptes Rendus des Seances de l’Academie des Sciences, Serie C: Sciences Chimiques, 1973; 277, 1215–1218.
10. Dentali F., Donadini M. P., Nathan C., Clark N., Crowther M. A., Garcia D., Hylek E., Witt D. M., Ageno W. Warfarin Associated Research Projects and Other Endeavors (WARPED) Consortium. Brand name versus generic warfarin: a systematic review of the literature. Pharmacotherapy 2011; 31, 386–393.
11. West B. D., Preis S., Schroeder C. H., Link K. P. Studies on the 4-Hydroxycoumarins. XVII. The resolution and absolute configuration of warfarin. J. Am. Chem. Soc. 1961; 83, 2676–2679.
12. Valente E. J., Lingafelter E. C., Porter W. R., Trager W. F. Structure of warfarin in solution. J. Med. Chem. 1977; 20, 1489–1493.
13. Ring P. R., Bostick J. M. Validation of a method for the determination of (R)-warfarin and (S)-warfarin in human plasma using LC with UV detection. J. Pharm. Biomed. Anal. 2000; 22, 573–581.
14. Sato Y., Suzuki Y. Optical resolution of drugs by cyclodextrin complexation. Chem. Pharm. Bull. 1985; 33, 4606–4609.
15. Varga G., Tarkanyi G., Nemeth K., Ivanyi R., Jicsinszky L., Toke O., Visy J., Szente L., Szeman J., Simoni M. Chiral separation by a monofunctionalized cyclodextrin derivative: From selector to permethyl-ββ-cyclodextrin bonded stationary phase. J. Pharm. Biomed. Anal. 2010; 51(1), 84–89.
16. Zhao M. G., Hao A. Y., Li J., Lin X.-L. ββ-cyclodextrin with low degree of 6-O-(Hydroxypropyltrimethylammonia)-substitution: convenient preparation and its application as a chiral selector in capillary electrophoresis. Chin. Chem. Lett. 2006; 17, 407–410.
17. Erlandsson P., Marle I., Hansson L., Isaksson R., Pettersson G., Pettersson C. immobilized cellulase (CBH I) as a chiral stationary phase for direct resolution direct resolution of enantiomers. J. Am. Chem. Soc. 1990; 112, 4573–4574.
18. Hagan E. C., Radomski J. L. The toxicity of 3-(acetonyl benzyl)-4-hydroxycoumarin (warfarin) to laboratory animals. J. Am. Pharm. Assoc. Sci. Ed. 1953; 42, 379–382.
19. Back N., Steger R., Glassman J. M. Comparative acute oral toxicity of sodium warfarin and microcrystalline warfarin in the Sprague-Dawley rat. Pharmacol. Res. Commun. 1978; 10, 445–452.
20. Bell R. G., Sadowski J. A., Matschiner J. T. Mechanism of action of warfarin. Warfarin and antimetabolite of vitamine K1. Biochemistry 1972; 11, 1959–1966.
21. Thijssen H. H. W. Warfarin-based rodenticides: mode of action and mechanism of resistance. Pestic. Sci. 1975; 43, 73–78.
22. Lewis R. J., Tragger W. F. The metabolic fate of warfarin: studies on the metabolites in plasma. Ann. N.Y. Acad. Sci. 1971; 179, 205–212.
23. Zacharski L. R., Henderson W. G., Rickles F. R., Forman W. B., Cornell C. J. Jr., Forcier R. J., Edwards R. L., Headley E., Kim S.-H., O’Donnell J. F., O’Dell R., Tornyos K., Kwaan H. C. Effect of warfarin anticoagulation on survival in carcinoma of the lung, colon, head and neck, and prostate. Final report of VA Cooperative Study #75. Cancer 1984; 53, 2046-2052. DOI: 10.1002/1097-0142(19840515).
24. Neulauer B. L., Bemis K. G., Best K. L., Goode R. L., Hoover D. M., Smith G. F., Tanzer L. R., Merriman R. L. Inhibitory effect of warfarin on the metastasis of the PAIII prostatic adenocarcinoma in the rat. J. Urol. 1986; 135, 163–166.
25. Babhair S. A., Tariq M., Al-Badr A. A. Warfarin. In: Analytical profiles of drug substances. Ed. Florey K. New York: Academic Press 1985; 14, 423–452.
26. Hirsh J., Dalen J. E., Deykin D., Poller L. Oral anticoagulants. Mechanism of action, clinical effectiveness, and optimal therapeutic range. Chest 1992; 102(4 Suppl), 312–326.
27. Takahashi H., Echizen H. Pharmacogenetics of warfarin elimination and its clinical implications. Clin. Pharmacokinet. 2001; 40, 587–603.
28. Hurlen M., Abdelnoor M., Smith P., Erikssen J., Arnesen H. Warfarin, aspirin, or both after myocardial infarction. N. Engl. J. Med. 2002; 347, 969–974.
29. Cook C. E., Ray Tallent C., Ballentine N. H., Taylor G. F., Kepler J. A. Synthesis of High Specific Activity R - and S-Warfarin – 3H. J. Label. Compd. Radiopharm. 1981; XVI, 623–631.
30. Savell Jr. V. H., Valente E. J., Eggleston D.S. Synthesis of 13C warfarin labelled at the hemiketal carbon, and its resolution. J. Label. Compd. Radiopharm. 1989; XXVII (6), 641–645.
31. Jung J.-C., Park O.-S. Synthetic approaches and biological activities of 4-hydroxycoumarin derivatives. Molecules 2009; 14, 4790-4803. DOI:10.3390/molecules14114790.
32. Peltier-Pain P., Timmons S. C., Grandemange A., Benoit E., Thorson J. S. Warfarin Glycosylation invokes a switch from anticoagulant to anticancer activity. ChemMedChem 2011; 6, 1347–1350. DOI: 10.1002/cmdc.201100178.
33. Shen D.-S., Liu X.-F., Yang G.-Z. Synthesis of coumarin anticoagulant and its analogues. Yingyong Huaxue 2005; 22, 1158–1160. DOI10.3969/j.issn.1000-0518.2005.10.027.
34. Cravotto G., Nano G. M., Palmisano G., Tagliapietra S. An asymmetric approach to coumarin anticoagulants via hetero-diels-alder cycloaddition. Tetrahedron Asymmetry 2001; 12, 707–709.
35. Peltier-Pain P., Timmons S. C., Grandemange A., Benoit E., Thorson J. S. Warfarin Glycosylation invokes a switch from anticoagulant to anticancer activity. ChemMedChem 2011; 6, 1347–1350. DOI: 10.1002/cmdc.201100178.
36. Bercovici S., Evron Y., Fuxman O., Jakoel M., Sasson S., Ulanenko K. Process for Synthesis of Pure Warfarin Acid, Warfarin Alkali Metal Salts and Corresponding Clathrates.U. S. Pat. Appl. 20020120155, 29. 8. 2002.
37. Lee D.-H., Kwon K.-H., Yi C. S. Dehydrative C−H alkylation and alkenylation of phenols with alcohols: expedient synthesis for substituted phenols and benzofurans. J. Am. Chem. Soc. 2012; 134, 7325–7328.
38. Reisch J. Die darstellung von antikoagulantien vom typ des warfarin® durch kondensation von alkinolen mit 4-hydroxycumarin. Arch. Pharm. Ber. Deutsch. Pharm. Ges. 1966; 299, 806–808.
39. Liu Y., Liu X., Wang M., He P., Lin L., Feng X. Enantioselective synthesis of 3,4-dihydropyran derivatives via organocatalytic michael reaction of αβ-unsaturated enones. J. Org. Chem. 2012; 77, 4136–4142.
40. Ma S., Wu L., Liu M., Wang Y. C2-symmetric proline-derived tetraamine as highly effective catalyst for direct asymmetric Michael addition of ketones to chalcones. Org. Biomol. Chem. 2012; 10, 3721–3729. DOI: 10.1039/c2ob06897d.
41. Lim Y. J., Kim D. Y. Enantioselective Conjugate Addition of 4-Hydroxycoumarin to Enones Catalyzed by Binaphthyl-Modified Primary Amine Organocatalyst. Bull. Korean Chem. Soc. 2012; 33, 1825–1826.
42. Rogozinska M., Adamkiewicz A., Mlynarski J. Efficient “on water” organocatalytic protocol for the synthesis of optically pure warfarin anticoagulant. Green Chem. 2011; 13, 1155–1157. DOI: 10.1039/c1gc15118e.
43. Xu L., Yang H., Jiang J., Lai G. Preparation method of chiral warfarin and chiral warfarin derivatives. Faming Zhuanli Shenqing, 102167689, 31. 8. 2011.
44. Xi Z., Lin A., Shi Y., Guo J., Zhu C., Cheng Y. Enantioselective synthesis of polycyclic coumarin derivatives catalyzed by an in situ formed primary amine-imine catalyst. Org. Lett. 2011; 13, 4382–4385.
45. Mei R.-Q., Xu X.-Y., Li Y.-C., Fu J.-Y., Huang Q.-C., Wang L.-X. Highly effective and enantioselective Michael addition of 4-hydroxycoumarin to α,β-unsaturated ketones promoted by simple chiral primary amine thiourea bifunctional catalysts. Tetrahedron Lett. 2011; 52, 1566–1568.
46. Yang H.-M., Li L., Jiang K.-Z., Jiang J.-X., Lai G.-Q., Xu L.-W. Highly enantioselective synthesis of warfarin and its analogs by means of cooperative LiClO4/DPEN-catalyzed Michael reaction: enantioselectivity enhancement and mechanism. Tetrahedron 2010; 66 (51), 9708–9713.
47. Yang H.-M., Gao Y.H., Li L., Jiang Z.-Y., Lai G.-Q., Xia C.-G., Xu L.-W. Iron-catalyzed Michael reactions revisited: a synthetically useful process for the preparation of tri-carbonyl compounds and chiral warfarin. Tetrahedron 2010; 51, 3836–3839.
48. Dong Z., Wang L., Chen X., Liu X., Lin L., Feng X. Organocatalytic enantioselective michael addition of 4-hydroxycoumarin to α,β-unsaturated ketones: A simple synthesis of warfarin. Eur. J. Org. Chem. 2009; 30, 5192–5197. DOI: 10.1002/ejoc.200900831.
49. Kristensen T. E., Vestli K., Hansen F. K., Hansen T. New phenylglycine-derived primary amine organocatalysts for the preparation of optically active warfarin. Eur. J. Org. Chem. 2009; 30, 5185–5191. DOI: 10.1002/ejoc.200900664.
50. Jadhav M. R., Shinde D. B. Indian Pat. Appl. 2007MU00052, 19. 9. 2008.
51. Jadhav M. R., Shinde D. B. Synthesis and biological activity of 4-hydroxy-3-(1,5-diaryl-3-oxo-pent-4-enyl)chromen-2-ones. Chin. J. Chem. 2010; 28, 555–560. DOI: 10.1002/cjoc.201090111
52. Kischel J., Michalik D., Zapf A., Beller M. FeCl3-catalyzed addition of 1,3-dicarbonyl compounds to aromatic olefins. Chem. Asian J. 2007; 2, 909–914. DOI: 10.1002/asia.200700055.
53. Xie J.-W., Yue L., Chen W., Du W., Zhu J., Deng J.-G., Chen Y.-C. Highly enantioselective michael addition of cyclic 1,3-dicarbonyl compounds to α,β-unsaturated ketones. org. lett. 2007; 9, 413–415.
54. Kim H., Yen C., Preston P., Chin J. Substrate-directed stereoselectivity in vicinal diamine-catalyzed synthesis of warfarin. Org. Lett. 2006; 8, 5239–5242.
55. Tsuchiya Y., Hamashima Y., Sodeoka M. A New Entry to Pd-H Chemistry: catalytic asymmetric conjugate reduction of enones with EtOH and a highly enantioselective synthesis of warfarin. Org. Lett. 2006; 8, 4851–4854.
56. Halland N., Hansen T., Jorgensen K. A. Organocatalytic asymmetric michael reaction of cyclic 1,3-dicarbonyl compounds and α,β-unsaturated ketones – a highly atom-economic catalytic one-step formation of optically active warfarin anticoagulant. Angew. Chem. Int. Ed. Eng. 2003; 42, 4955–4957.
57. Mashraqui S. H., Karnik M. A. New application of 1,4-dihydropyridine system: Michael reactions mediated by 1,4-dihydropyridine-enolate adduct in micellar medium. Chem. Lett. 2003, 32(11), 1064–1065.
58. Li H.-Y., Robinson A. J. A novel asymmetric synthesis of R - and S-warfarin and its analogs. PCT Int. Appl. WO 9703062, 30. 1. 1997.
59. Manolov I., Karaivanova M. Synthesis and antimetastatic properties of 4-hydroxy-3-(3-oxo-1-phenylbutyl)-2H-1-benzopyran-2-one (Warfarin). Farmatsiya (Sofia, Bulgaria) 1990; 40, 1–6.
60. I., Manolov I., Alexandrova L. New Efficient Catalyst in the Synthesis of Warfarin and Acenocoumarol. Arch. Pharm. 1990; 323, 521–522.
61. Garcia D., Libby E., Crowther M. A. The New Oral Anticoagulants. Blood 2010; 115, 15–20.
62. Weitz J. I., Hirsch J., Samama M. M. New Antithrombotic Drugs: American College of Chest Physicians Evidence – Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133, 234S–256S.
63. Connolly S. J., Ezekowitz M. D., Salim Y., Eikelboom J., Oldgren J., Parekh A., Pogue J., Reilly P. A., Themeles E., Varrone J., Wang S., Alings M., Xavier D., Zhu J., Diaz R., Lewis B. S., Darius H., Diener H.-C., Joyner C. D., Wallentin L., the RE-LY Steering Committee and Investigators: Dabigatran versus Warfarin in Patients with Atrial Fibrillation. N Engl. J. Med. 2009; 361, 1139–1151.
64. Patel M. R., Mahaffey K. W., Garg J., Pan G., Singer D. E., Hacke W., Breithardt G., Halperin J. L., Hankey G. J., Piccini J. P., Becker R. C., Nessel C. C., Paolini J. F., Berkowitz S. D., Fox K. A. A., Califf R. M., the ROCKET AF Steering Committee, for the ROCKET AF Investigators: Rivaroxaban versus Warfarin in Nonvalvular Atrial Fibrillation. N. Engl. J. Med. 2011; 365, 883S–891S.
65. Garcia D., Libby E., Crowther M. A. The new oral anticoagulants. Blood 2010; 115, 15–20.
66. http://www.theheart.org/article/1484969.do#bib_1
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2013 Číslo 3- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Warfarín – jeho syntéza a vlastnosti v dvadsaťročnej retrospektíve*
- Vliv formulačních a procesních parametrů na vlastnosti PLGA mikročástic s řízeným uvolňováním léčiva
- Studium nového směsného suchého pojiva na bázi sprejově sušené laktosy a mikrokrystalické celulosy
-
Štúdium lokálnych anestetík: Časť 201*
Stanovenie kritickej micelovej koncentrácie pentakaíniumchloridu pomocou merania UV absorpcie pyrénu v metanolovom prostredí - HPLC stanovenie sacharidov po predkolónovej derivatizácií vo vzorkách medu
- Využívání humánních léčivých přípravků ve veterinární medicíně
- Analýza spotřeby sedativ a hypnotik v Jemenu a v České republice
- Prof. RNDr. Milan Melník, DrSc. – 75-ročný
- Štátne vyznamenanie – Dr.h.c., prof. RNDr. Jozefovi Čižmárikovi, PhD.
- Nové knihy
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Warfarín – jeho syntéza a vlastnosti v dvadsaťročnej retrospektíve*
- Využívání humánních léčivých přípravků ve veterinární medicíně
- Vliv formulačních a procesních parametrů na vlastnosti PLGA mikročástic s řízeným uvolňováním léčiva
- HPLC stanovenie sacharidov po predkolónovej derivatizácií vo vzorkách medu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání