-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť III. cytochróm P450 2C19
Clinical significance of cytochrome P450 genetic polymorphism – part III. cytochrome P450 2C19
Cytochrome P450 2C19 is the important cause for great differences in the pharmacokinetics of a number of clinically used drugs. Several studies have demonstrated that the CYP2C19 polymorphism is important for several drugs and may be associated with the occurrence of clinically relevant side effects. The third part of this paper focuses on the influence of genetic polymorphism of cytochrome P450 2C19 on drug effect.
Key words:
cytochrome P450 – genetic polymorphism – CYP2C19
Autoři: Jana Ďuricová; Milan Grundmann
Působiště autorů: Ústav klinické farmakologie Lékařské fakulty OU a FN Ostrava
Vyšlo v časopise: Čes. slov. Farm., 2011; 60, 211-218
Kategorie: Přehledy a odborná sdělení
Souhrn
Enzým cytochróm P450 2C19 je jedným z hlavných faktorov farmakokinetickej variability bežne užívaných liečiv. Niekoľko štúdií poukázalo na významný vplyv polymorfizmu enzýmu CYP2C19 s možným výskytom klinicky závažných nežiadúcich účinkov. Cieľom tretej časti tohoto článku je popísať vplyv genetického polymorfizmu cytochrómu P450 2C19 na účinok liečiv.
Kľúčové slová:
cytochróm P450 – genetický polymorfizmus – CYP2C19CYP2C19
Enzým CYP2C19 je známy tiež ako S-mephenytoin 4’-hydroxyláza 1). Napriek tomu, že CYP2C19 zdieľa > 90% homológiu aminokyselin s CYP2C9, oba tieto enzýmy majú rozličné substráty 2). Doteraz bolo objavených niekoľko variantných aliel kódujúcich defektný enzým (tab. 1). Najčastejšie vyskytujúcimi sa alelami zodpovednými za pomalý metabolizmus sú variantné alely CYP2C19*2 a *3. Výskyt variantnej alely CYP2C19*3 je u belošskej populácie zriedkavý, nachádza sa hlavne u ázijskej populácie. Frekvencia výskytu pomalých metabolizátorov sa medzi etnikami líši. Najvyššie zastúpenie je u ázijskej populácie (12–23 %), u belošskej, podobne ako u černošskej populácie je zastúpenie nižšie (okolo 1–8 %) 3, 4). Alela CYP2C19*17 je naopak spojovaná so vznikom ultrarýchleho metabolizmu, jej zastúpenie v belošskej populácii je relatívne časté – výskyt v 18 % u Švédov 5).
Tab. 1. Aktivita variantných aliel CYP2C19 in vivo a výskyt v populácii <sup>3–5)</sup> 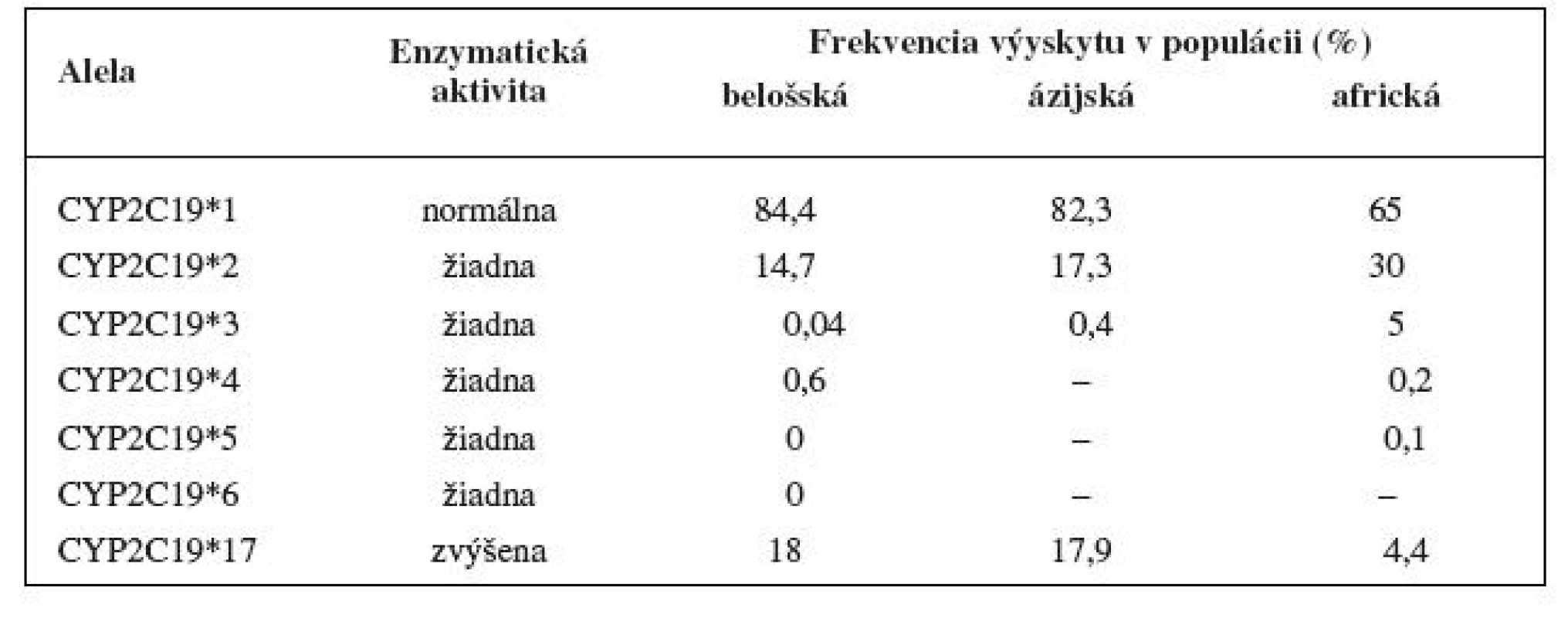
Inhibítory protónovej pumpy
CYP2C19 je hlavným enzýmom v metabolizme inhibítorov protónovej pumpy (PPi), hlavne omeprazolu, lansoprazolu a pantoprazolu. Jedinci majúci variantnú alelu v heterozygotnom či homozygotnom stave mali vyššie hladiny PPi 5–10), a tým dlhotrvajúcejšiu supresiu tvorby žalúdočnej kyseliny 11–14). CYP2C19 má menší vplyv na metabolizmus esomeprazolu a rabeprazolu v porovnaní napríklad s omeprazolom, niektoré práce preto u nich neprikladajú veľký význam CYP2C19 genotypu 15–17). Výsledný terapeutický účinok ochorení gastrointestinálneho traktu, na ktorých sa významne podieľa acidita zívisí na genotype. Furuta a kol. ako prvý popísal vplyv CYP2C19 genotypu na liečbu duodenálnych a žalúdočných vredov u Helicobacter pylori pozitivných pacientov v súvislosti s užívaním PPi (omeprazolu). Ku 100% zhojeniu došlo v skupine pacientov, ktorí boli homozygotmi pre 2 variantné alely 18). Závislosť terapeutického efektu eradikácie Helicobacter pylori na CYPC19 genotypu bola nájdená i u lansoprazolu a rabeprazolu 19–22), kdežto v iných prácach nemal genotyp na efekt eradikácie u týchto PPi vplyv 22–24). Pacienti užívajúci pantoprazol, ktorí boli homozygoti pre defektnú alelu CYP2C19*2, mali vyšší úspech v eradikácii Helicobacter pylori v porovnaní s *1/*1 homozygotmi. U nositeľov variantnej alely CYP2C19*17 nebol rozdiel v efekte liečby pozorovaný 25, 26). Efekt genotypu u PPi bol sledovaný i v liečbe gastroezofageálej refluxnej choroby (GERD), pre ktorú je udržanie požadovaného pH v žalúdku dôležité pre úspech terapie. Liečebný účinok lanzoprazolu bol u „wild type“ homozygotov, heterozygotov a homozygotov pre variantnú alelu po 8 týždňoch terapie 46, 68 a 85%, účinok klesal s poklesom koncentrácie lanzoprazolu 27). Vplyv CYP2C19 genotypu na výsledok liečby PPi u GERD bol popísaný i v ďalšej práci 28). Mnohé štúdie zaoberajúce sa genotypom a PPi boli uskutočnené na ázijských jedincoch, u ktorých je prevalencia pomalých metabolizátorov vyššia než u európskej populácie. Okrem terapeutickej stránky by mohol mať genotyp vplyv i na výskyt nežiadúcich účinkov spojených s užívaním PPi. U pacientov s prítomnosťou mutovanej alely, ktorí boli na dlhodobej terapii omeprazolom, bol totiž pozorovaný pokles hladiny vitamínu B12, u nositeľov „wild type“ alely nebol pokles vitamínu zaznamenaný 29). Rozvoj megaloblastové anémie bol popísaný u jedného pacienta s GERD užívajúceho 40–60 mg omeprazolu denne po dobu 4 ro kov 30). U pacientov heterozygotov pre variantnú alelu boli pozorované vyššie hladiny gastrinu a plazmatického chromograninu A v porovnaní s pacientmi bez tejto alely, tieto vyššie hladiny by mohli viesť k určitým morfologickým zmenám na sliznici žalúdka 31).
Klopidogrel
Antiagregans klopidogrel je proliečivo, ktorý sa v dvoch fázach oxiduje na svoj aktívny metabolit, zodpovedný za antiagregačný účinok. Enzým CYP2C19 sa podieľa významne v oboch krokoch aktivácie klopidogrelu (v 45% v prvom a v 21% v druhom kroku) 32). Odpoveď doštičiek pri užívaní klopidogrelu je u pacientov značne variabilná 33) a pretrvávajúca vysoká aktivita trombocytov i napriek užívaniu klopidogrelu je spojená s vysokým rizikom kardiovaskulárnych príhod 34). Odpoveď na klopidogrel je podľa jednej štúdie približne zo 70 % dedičná a CYP2C19*2 genotyp sa podieľa len z 12 % na variabilite účinku klopidogrelu 35). Konverzia klopidogrelu na aktívny metabolit bola výrazne znížená u pacientov s trombózou stentu v porovnaní s kontrolami 36). Štúdia na zdravých dobrovoľníkoch potvrdila, že CYP2C19*2 variantná alela je spojená so zníženou odpoveďou doštičiek na podanie klopidogrelu 37). Následné štúdie sledujúce vplyv CYP2C19*2 variantnej alely u pacientoch s arteriálnym koronárnym ochorením, ktorí podstúpili perkutánnu koronárnu intervenciu (PCI) a nasadením klopidogrelu do terapie zaznamenali negatívny dopad variantnej alely na doštičkovú odpoveď 38–40). Pacienti s CYP2C19*2 variantnou alelou mali približne 3-násobne vyššie riziko trombózy stentu po dobu sledovania 30 dní od zavedenia stentu v porovnaní s homozygotmi pre „wild type“ alelu CYP2C19*1 41). Pacienti s CYP2C19*2 genotypom užívajúci klopidogrel mali vyššie riziko kardiovaskulárnej príhody (smrť, infarkt myokradu, cievna mozgová príhoda) počas sledovaného obdobia 35, 42–44). Trenk a kol. vo svojej práci naopak nezaznamenal rozdiel vo výskyte kardiovaskulárnych príhod podľa genotypu 45). CYP2C19*17 alela býva spojována s ultrarýchlym metabolizmom CYP2C19 substrátov. Pacienti s 2 týmito alelami vykazovali najnižšiu doštičkovú aktivitu pri užívaní klopidogrelu, na výskyte trombózy stentu sa tento účinok neprejavil, zato mali týto pacienti približne 4-násobne vyššie riziko krvácania 46).
Antidepresíva
Enzým CYP2C19 sa v určitej miere podieľa i na metabolizme tricyklických antidepresív (TCA) a u niektorých antidepresív zo skupiny selektívnych inhibítorov spätného vychytávania serotonínu (SSRI). TCA amitriptylín, podlieha v pečeni premene niekoľkými metabolickými cestami, z nich hlavná je N-demetylácia na aktívny metabolit nortriptylín sprostredkovaná CYP2C19. AUC amitriptylínu bolo signifikantne vyššie u CYP2C19 PMs v porovnaní s EMs v štúdii na zdravých dobrovoľníkoch po jednorázovom užití amitriptylínu, opačný trend bol pozorovaný u metabolitu nortriptylínu 47). Vyššie koncentrácie amitriptylínu a nižšie koncentrácie metabolitu nortriptylínu u heterozygotov pre CYP2C19 defektnú alelu v porovnaní s pacientmi bez defektnej alely boli pozorované i v ďalšej štúdii u depresívnych pacientov, u ktorých bol amitriptylín nasadzovaný za hospitalizácie 48). Jedna z hlavných ciest metabolizmu ďalšieho TCA antidepresíva imipramínu je N-demetylácia na aktívny metabolit desipramín, ktorá sčasti prebieha prostredníctvom enzýmu CYP2C19 49). Metabolický pomer desipramín/imipramín (demetylačný index) bol signifikantne nižší u depresívnych pacientov užívajúcich imipramín s genotypom CYP2C19 pomalého metabolizátora v porovnaní s EMs 50). Priemerná koncentrácia imipramínu vztiahnutá na dávku bola približne o 30 % nižšia u pacientov s CYP2C19*17/*17 genotypom v porovnaní s normálnymi metabolizátormi (*1/*1), pomer medzi imipramínom/desipramínom sa však významne medzi skupinami nelíšil 51). Pacienti s genotypom pomalého metabolizátora pre CYP2C19 mali tiež signifikantne vyššie hladiny antidepresíva klomipramínu vztiahnuté na dávku a hmotnosť v porovnaní s extenzívnymi metabolizátormi 52). Taktiež farmakokinetické štúdie s antidepresívami zo skupiny SSRI pozorovali rozdielny metabolizmus medzi CYP2C19 genotypovými skupinami. Enzým CYP2C19 sa sčasti podieľa na demetylácii citalopramu na metabolit desmethylcitalopram, ktorý sa následne demetyluje na didesmethylcitalopram prostredníctvom CYP2D6. Táto metabolická cesta podlieha genotypovej kontrole 53). V práci na zdravých dobrovoľníkoch mali jedinci s genotypom pomalého metabolizátora CYP2C19 významné rozdiely vo farmakokinetických parametroch v porovnaní s extenzívnymi metabolizátormi 54, 55). AUC citalopramu bola o 44 % a 118 % vyššia u nositeľov jednej (*1/*2) a dvoch (*2/*2) defektných aliel v porovnaní s normálnymi metabolizátormi (*1/*1) po jednorázovom užití antidepresíva 56). Podiel CYP2C19 genotypu na variabilnom metabolizme escitalopramu (aktívneho enantioméru citalopramu) bol popísaný v nasledujúcich prácach 57–59). V jednej práci bol siedmim pacientom, ktorí neodpovedali na terapiu citalopramom, pridané antidepresívum fluvoxamín, inhibítor enzýmu CYP2C19 a CYP2D6. Všetci pacienti okrem jedného boli extenzívnymi metabolizátormi pre oba enzýmy. Pridanie fluvoxamínu spôsobilo významné zvýšenie hladiny citalopramu, predovšetkým S-enantioméru patrného zo vzostupu pomeru S/R citalopramu z 0,48 na 0,84. Zvýšenie hladiny viedlo u šiestich pacientov ku klinickému zlepšeniu stavu 60). U jedinca s fenotypom pomalého metabolizátora enzýmu CYP2C19 a CYP2D6 sa druhý deň užívania citalopramu objavili nežiadúce účinky, odhadovaný poločas citalopramu bol extrémne dlhý okolo 95 hodín 55). Jedná štúdia testovala vplyv 15 polymorfizmov 5 génov kódujúcich metabolické enzýmy vrátane CYP2C19 na odpoveď a toleranciu u veľkého súboru pacientov užívajúcich citalopram. Žiaden z testovaných polymorfizmov nebol významne spojený so sledovanými cieľmi 61). Metabolizmus ďalšieho antidepresíva zo skupiny SSRI sertralínu prebieha sčasti prostredníctvom enzýmu CYP2C19 62). AUC sertralínu bolo 1,4-násobne vyššie po podání 1-rázovej dávky zdravým dobrovoľníkom v skupine pomalých metabolizátorov v porovnaní s hetero - a homozygotnými extenzivnými metabolizátormi 63). Výraznejšie rozdiely boli pozorované v štúdii na pacientoch, kde pomalí metabolizátori mali 3.2-násobne vyššie hladiny sertralínu vztiahnuté na dávku a 4.5-násobne vyššie hladiny jeho metabolitu N-desmetylsertralínu v porovnaní s CYP2C19*1/*1 extenzívnymi metabolizátormi 64). Pomalí metabolizátori mali významne vyššie koncentrácie a AUC ďalšieho antidepresíva zo skupiny SSRI fluoxetínu v porovnaní s extenzívnymi metabolizátormi, opačný trend bol pozorovaný v prípade aktívneho metabolitu norfluoxetínu 65). V inej práci sa plazmatické koncentrácie enantiomérov fluoxetínu významne nelíšili medzi CYP2C19 genotypovými skupinami pacientov 66).
Benzodiazepíny
Diazepam je asi najlepšie študovaným benzodiazepínom s ohľadom na CYP2C19 polymorpfizmus. Pomalí metabolizátori CYP2C19 mali nižšiu clearance a dlhší eliminačný poločas diazepamu tak i jeho aktívneho metabolitu desmetyldiazepamu v porovnaní extenzívnymi metabolizátormi 67–69). Inomata a kol. sledovali vplyv CYP2C19 genotypu na farmakokinetiku diazepamu a jeho efekt u pacientov, ktorým bol diazepam premedikován pred celkovou anestéziou so sevofluranom. Pomalí metabolizátori mali významne dlhší čas do opätovného nadobudnutia vedomia (medián 18 min versus medián 10 min) než extenzívni metabolizátori 70). Klobazam sa metabolizuje prevážne na svoj hlavný aktívny metabolit N-desmetylklobazam prostredníctvom CYP2C19 a CYP3A4, hydroxylácia aktívneho metabolitu je ďalej sprostredkovaná CYP2C19. Tento metabolit má dlhší biologický poločas a vyššie hladiny v krvi v porovnaní s materskou látkou 71). Epileptický pacienti majúci jednu alebo dve defektné alely CYP2C19 mali významne vyššie plazmatické koncetrácie aktívneho metabolitu vztiahnuté na dávku a vyšší pomer metabolit/materská látka v porovnaní s pacientmi bez defektnej alely 71–73), vyššie hladiny aktívneho metabolitu mali i vplyv na vyššiu účinnosť klobazamu u epileptických pacientov 74).
Fenytoín
Význam enzýmu CYP2C19 v metabolizme antiepileptika fenytoínu vzrastá so vzostupom sérových koncentrácií fenytoínu 75). V štúdii na zdravých dobrovoľníkoch nebol pozorovaný významný vplyv CYP2C19 genotypu na metabolizmus fenytoínu po užití jednorázovej dávky 76). V štúdii Lee a kol. sledovali vplyv CYP2C polymorpfizmu u epileptických pacientov užívajúcich fenytoín. U pacientov na monoterapii fenytoínom bol patrný pokles Vmax s rastúcim počtom CYP2C19 defektných aliel 77). Mierny pokles Vmax u fenytoínu bol pozorovaný i v ďalšej práci u epileptických pacientov, ktorí boli heterozygoti pre defektnú alelu v porovnaní s pacientmi bez defektnej alely. Význam CYP2C19 polymorfizmu bol väčší pri vyšších dávkách fenytoinu 78).
Polymorfizmus CYP2C19 bol študovaný i v súvislosti s metabolizmom talidomidu. Talidomid potrebuje metabolickú aktiváciu pre svoj antiangiogénny 79) a antimyelomový 80) účinok. Enzým CYP2C19 sa podieľa na tvorbe dvoch metabolitov, 5-hydroxytalidomidu a jeho cis formy 81). Li a kol. sledovali vo svojej práci vplyv CYP2C19 genotypu na účinok talidomidu v terapii mnohočetného myelomu. Celková odpoveď na terapiu talidomidom bola významne vyššia u pacientov s genotypom extentívneho metabolizátora (62,6 % versus 33,3 %, p < 0,05) v porovnaní s pomalými metabolizátormi, hladiny metabolitov však neboli u pacientov stanovené 82).
Imunomodulačné látky
Cytostatikum cyklofosfamid sa aktivuje enzýmami cytochrómu P450 na metabolity, ktoré sú zodpovedné za účinok i toxicitu. Enzým CYP2C19 sa významnou mierou podieľa na metabolizme cyklofosfamidu 83, 84). V práci Takadu a kol. sa zaoberali vplyvom genetického polymorfizmu enzýmov cytochrómu P450 na toxicitu a klinickú odpoveď cyklofosfamidu u pacientov s lupus nefritis. Pacientky s defektnou alelou v heterozygotnom či homozygotnom stave mali významne nižšie riziko rozvoja ovariálnej dysfunkcie (RR 0,10, 95% CI 0,020 – 0,0521), ktorá patrí medzi nežiadúce účinky spojená s dlhodobým užívaním cyklofosfamidu. Homozygotný stav pre defektnú alelu CYP2C19*2 a CYP2B6*5 vykazoval avšak vyššiu pravdepodobnosť zhoršenia renálnych funkcií 85). Prítomnosť CYP2C19*1/*1 genotypu bola spojována s vyšším rizikom ovariálnej toxicity i v ďalších štúdiách u pacientiek užívajúcich cyklofosfamid 86, 87).
Antimykotiká
Zdá sa, že CYP2C19 polymorfizmus má vplyv i na farmakokinetiku azolového antimykotika vorikonazolu. Vorikonazol je extenzívne metabolizovaný prostredníctvom enzýmov CYP2C19 a CYP3A4 88, 89). Pomalí metabolizátori mali približne 3-násobne vyššiu expozíciu antimykotikom v provnaní s extenzivnými metabolizátormi 90–92). Naopak prítomnosť CYP2C19*17 alely viedla k poklesu AUC vorikonazolu na približne polovicu v porovnaní s extenzivnými metabolizátormi 92). Weiss a kol. vo svojej práci uvádzajú, že CYP2C19 polymorfimzus sa podieľa zo 49 % na variabilite orálnej clearance vorikonazolu 93). Nositelia CYP2C19 defektnej alely by mali dostávať nižšie úvodné dávky vorikonazolu v porovnaní extenzívnymi metabolizátormi z dôvodu zníženia rizika hepatotoxicity 94). V retrospektívnej práci autori sledovali výskyt hepatoxicity v závislosti na polymorfizme enzýmov cytochrómu P450 u pacientov užívajúcich vorikonazol. Nenašli však žiaden vťah medzi genotypom a zvýšením hladiny jaterních enzýmov 95).
Antivirotiká
Nelfinavir, antivirotikum zo skupiny inhibítora HIV-proteázy, sa metabolizuje enzýmom CYP2C19 na svoj aktívny metabolit nelfinavir M8 96). Jedinci homozygoti či heterozygoti pre CYP2C19 defektú alelu mali významne nižšie hladiny metabolitu M8 v porovnaní s extenzivnými metabolizátormi a významne vyššiu expozíciu nelfinavirom 97–99). I napriek tomu, že nelfinavir i jeho metabolit M8 majú porovnateľnú aktivitu, výsledky prác poukazujú, že prítomnosť CYP2C19 defektnej alely by mohla byť spojená s lepšou virologickou odpoveďou u HIV pacientov 100, 101).
Tab. 2. Príklady substrátov, inhibítorov a induktorov enzýmu CYP2C19 <sup>102-104)</sup> 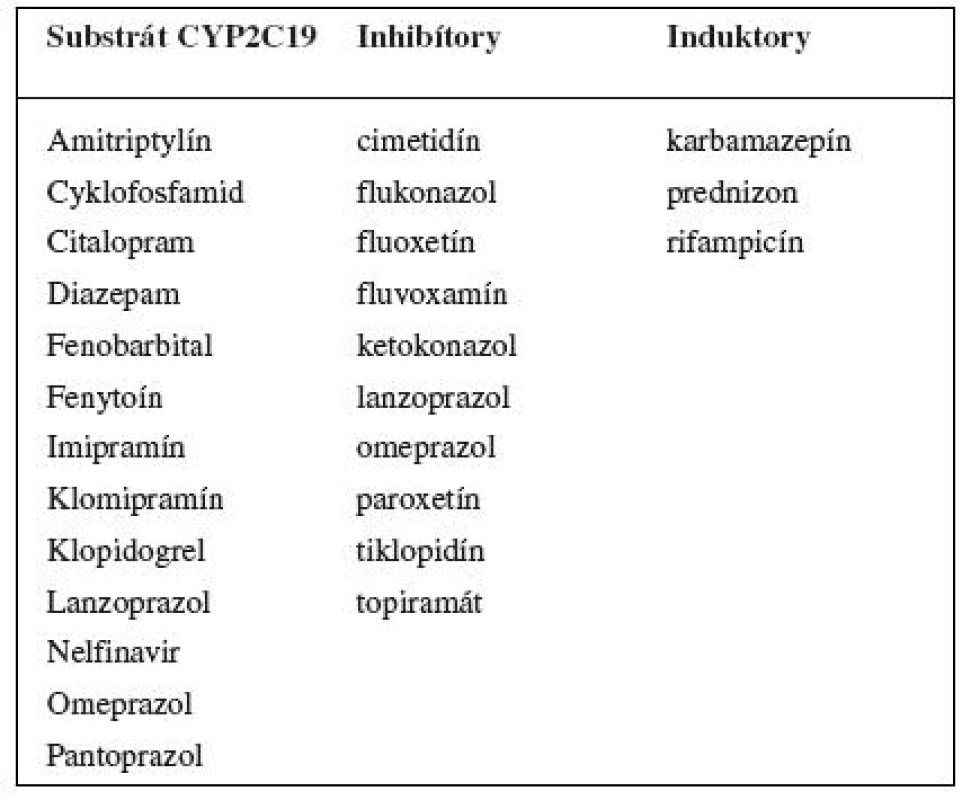
ZÁVER
Enzým CYP2C19 sa významnou mierou podieľa na biotransformácii klinicky užívaných liečiv. U niektorých liečiv sú farmakokinetické rozdiely medzi jednotlivými genotypovými skupinami pomerne značné, u úzkej skupiny liečiv bolo publikovaných i niekoľko prác zaoberajúcich sa vplyvom polymorfizmu na účinok liečiv. U mnohých liečiv však presvedčivé údaje o dopade polymorfizmu enzýmu CYP2C19 na farmakodynamiku liečiv chýbajú.
Adresa pro korespondenci:
Mgr. Jana Ďuricová
Ústav klinické farmakologie LF OU
17. listopadu 1790, 708 52 Ostrava
e-mail: jana.duricova@fno. cz
Došlo 31. ledna 2011 / Přijato 11. dubna 2011
Zdroje
1. Tamminga, W. J., Wemer, J., Oosterhuis, B., Wieling, J., Touw, D. J., de Zeeuw, R. A., de Leij, L. F., Jonkman, J. H.: Mephenytoin as a robe for CYP2C19 phenotyping: effect of sample storage, intra–individual reproducibility and occurrence of adverse events. Br. J. Clin. Pharmacol. 2001; 51, 471–474.
2. Gardiner, S. J., Begg, E. J.: Pharmacogenetics, drug-metabolizing enzymes, and clinical practice. Pharmacol. Rev. 2006; 58, 521–590.
3. Wedlund, P. J. The CYP2C19 enzyme polymorphism. Pharmacology 2000; 61, 174–183.
4. Desta, Z., Zhao, X., Shin, J. G., Flockhart, D. A.: Clinical significance of the cytochrome P450 2C19 genetic polymorphism. Clin. Pharmacokinet. 2002; 12, 913–958.
5. Sim, S. C., Risinger, C., Dahl, M. L., Aklillu, E., Christensen, M., Bertilsson, L., Ingelman-Sundberg, M.: A ommon novel CYP2C19 gene variant causes ultrarapid drug metabolism relevant for the drug response to proton pump inhibitors and antidepressants. Clin. Pharmacol. Ther. 2006; 79, 103–113.
6. Sagar, M., Seensalu, R., Tybring, G., Dahl, M. L., Bertilsson, L.: CYP2C19 genotype and phenotype determined with omeprazole in patients with acid-related disorders with and without Helicobacter pylori infection. Scand. J. Gastroenterol. 1998; 33, 1034–1038.
7. Uno, T., Niioka, T., Hayakari, M., Yasui-Furukori, N., Sugawara, K., Tateishi, T.: Absolute bioavailability and metabolism of omeprazole in relation to CYP2C19 genotypes following single intravenous and oral administrations. Eur. J. Clin. Pharmacol. 2007; 63, 143–149.
8. Baldwin, R. M., Ohlsson, S., Pedersen, R. S., Mwinyi, J., Ingelman-Sundberg, M., Eliasson, E., Bertilsson, L.: Increased omeprazole metabolism in carriers of the CYP2C19*17 allele, a harmacokinetic study in healthy volunteers. Br. J. Clin. Pharmacol. 2008; 65, 767–774.
9. Miura, M., Tada, H., Yasui-Furukori, N., Uno, T., Sugawara, K., Tateishi, T., Suzuki, T.: Pharmacokinetic differences between the enantiomers of lansoprazole and its metabolite, 5-hydroxylansoprazole, in relation to CYP2C19 genotypes. Eur. J. Clin. Pharmacol. 2004; 60, 623–628.
10. Miura, M., Kagaya, H., Tada, H., Uno, T., Yasui-Furukori, N., Tateishi, T., Suzuki, T.: Enantioselective disposition of rabeprazole in relation to CYP2C19 genotypes. Br. J. Clin. Pharmacol. 2005; 61, 315–320.
11. Hunfeld, N. G., Mathot, R. A., Touw, D. J., van Schaik, R. H., Mulder, P. G., Franck, P. F., Kuipers, E. J., Geus W. P.: Effect of CYP2C19*2 and *17 mutations on pharmacodynamics and kinetics of proton pump inhibitors in Caucasians. Br. J. Clin. Pharmacol. 2008; 65, 752–760.
12. Wang, Y., Zhang, H., Meng, L., Wang, M., Yuan, H., Ou, N., Zhang, H., Li, Z., Shi, R.: Influence of CYP2C19 on the relationship between pharmacokinetics and intragastric pH of omeprazole administered by successive intravenous infusions in Chinese healthy volunteers. Eur. J. Clin. Pharmacol. 2010; 66, 563–569.
13. Furuta, T., Shirai, N., Sugimoto, M., Nakamura, A., Okudaira, K., Kajimura, M., Hishida, A.: Effect of concomitant dosing of famotidine with lansoprazole on gastric acid secretion in relation to CYP2C19 genotype status. Aliment. Pharmacol. Ther. 2005; 22, 67–74.
14. Horai, Y., Kimura, K., Furuie, H., Matsuguma, K., Irie, S., Koga, Y., Nagahama, T., Murakami, M., Matsui, T., Yao, T., Urae, A., Ishizaki, T.: Pharmacodynamic effects and kinetic disposition of rabeprazole in relation to CYP2C19 genotypes. Aliment. Pharmacol. Ther. 2001; 15, 793–803.
15. Shirai, N., Furuta, T., Moriyama, Y., Okochi, H., Kobayashi, K., Takashima, M., Xiao, F., Kosuge, K., Nakagawa, K., Hanai, H., Chiba, K., Ohashi, K., Ishizaki, T.: Effects of CYP2C19 genotypic differences in the metabolism of omeprazole and rabeprazole on intragastric pH. Aliment. Pharmacol. Ther. 2001; 15, 1929–1937
16. Lou, H. Y., Chang, C. C., Sheu, M. T., Chen, Y. C., Ho, H. O.: Optimal dose regimens of esomeprazole for gastric acid suppresion with minimal influence of the CYP2C19 polymoprhism. Eur. J. Clin. Pharmacol. 2009; 65, 55–64.
17. Klotz, U.: Impact of CYP2C19 polymorphisms on the clinical action of proton pump inhibitors (PPIs). Eur. J. Clin. Pharmacol. 2009; 65, 1–2.
18. Furuta, T., Ohashi, K., Kamata, T., Takashima, M., Kosuge, K., Kawasaki, T., Hanai, H., Kubota, T., Ishizaki, T., Kaneko, E.: Effect of genetic differences in omeprazole metabolism on cure rates for Helicobacter pylori infection and peptic ulcer. Ann. Intern. Med. 1998; 129, 1027–1030.
19. Özdil, B., Akkiz, H., Bayram, S., Bekar, A., Akgöllü, E., Sandikci, M.: Influence of Cyp2C19 functional polymorphism on Helicobacter pylori eradication. Turk. J. Gastroenterol. 2010; 21, 23–28.
20. Schwab, M., Schaeffeler, E., Klotz, U., Treiber, G.: CYP2C19 polymorphism is predictor of treatment failure in white patients by use of lansoprazole-based quadruple therapy for eradication of Helicbacter pylori. Clin. Pharmacol. Ther. 2004; 76, 201–209.
21. Lay, C. S., Lin, C. J.: Correlation of CYP2C19 genetic polymorphisms with helicobacter pylori eradication in patients with cirrhosis and peptic ulcer. J. Chin. Med. Assoc. 2010; 73, 188–193.
22. Zhao, F., Wang, J., Yang, Y., Wang, X., Shi, R., Xu, Z., Huang, Z., Zhang, G.: Effect of CYP2C19 genetic polymorphisms on the efficacy of proton pump inhibitor-based triple therapy for Helicobacter pylori eradication: A eta-analysis. Helicobacter 2008; 13, 532–541.
23. Padol, S., Yuan, Y., Thabane, M., Padol, I. T., Hunt, R. H.: The effect of CYP2C19 polymorphisms on H. pylori eradication rate in dual and triple first-line PPI therapies: a eta–analysis. Am. J. Gastroenterol. 2006; 101, 1467–1475.
24. Lee, J. H., Jung, H. Y., Choi, K. D., Song, H. J., Lee, G. H., Kim, J. H.: The influence of CYP2C19 polymorphism on eradication of Helicobacter pylori: A rospective randomized study of lansoprazole and rabeprazole. Gut. Liver. 2010; 4, 201–206.
25. Kurzawski, M., Gawrońska-Szklarz, B., Wrześniewska, J., Siuda, A., Starzyńska, T., Droździk, M.: Effect of CYP2C19*17 gene variant on Helicobacter pylori eradication in peptic ulcer patients. Eur. J. Clin. Pharmacol. 2006; 62, 877–880.
26. Gawrońska-Szklarz, B., Siuda, A., Kurzawski, M., Bielicki, D., Marlicz, W., Droździk, M.: Effects of CYP2C19, MDR1, and interleukin 1-B gene variants on the eradication rate of Helicobacter pylori infection by triple therapy with pantoprazole, amoxicillin, and metronidazole. Eur. J. Clin. Pharmacol. 2010; 66, 681–687.
27. Furuta, T., Shirai, N., Watanabe, F., Honda, S., Takeuchi, K., Iida, T., Sato, Y., Kajimura, M., Futami, H., Takayanagi, S., Yamada, M., Ohashi, K., Ishizaki, T., Hanai, H.: Effect of cytochrome P4502C19 genotypic differences on cure rates for gastroesophageal reflux disease by lansoprazole. Clin. Pharmacol. Ther. 2002; 72, 453–460.
28. Kawamura, M., Ohara, S., Koike, T., Iijima, K., Suzuki, J., Kayaba, S., Noguchi, K., Hamada, S., Noguchi, M., Shimosegawa, T.: he effects of lansoprazole on erosive reflux oesophagitis are influenced by CYP2C19 polymorphism. Aliment. Pharmacol. Ther. 2003; 17, 965–973.
29. Sagar, M., Janczewska, I., Ljungdahl, A.: Effect of CYP2C19 polymorphism on serum levels of vitamin B12 in patients on long-term omeprazole treatment. Aliment. Pharmacol. Ther. 1999; 13, 453–458.
30. Bellou, A., Aimone–Gastin, I., De Korwin, J. D., Bronowicki, J. P., Moneret–Vautri,n A., Nicolas, J. P., Bigard, M. A., Guéant J. L.: Cobalamin deficiency with megaloblastic anaemia in one patient under long-term omeprazole therapy. J. Intern. Med. 1996; 240, 161–164.
31. Sagar, M., Bertilsson, L., Stridsberg, M., Kjellins, A., MĆrdh, S., Seensalu, R.: Omeprazole nad CYP2C19 polymorphism: effects of long-term treatment on gastrin, pepsinogen I, and chromogranin A n patients with acid related disorders. Aliment. Pharmacol. Ther. 2000; 14, 1495–1502.
32. Steinhubl, S. R.: Genotyping, clopidogrel metabolism, and the search for the therapeutic window of thienopyridines. Circulation 2010; 121, 481–483.
33. Serebruany, V. L., Steinhubl, S. R., Berger, P. B., Malinin, A. I., Bhatt, D. L., Topol, E. J.: Variability in platelet responsiveness to clopidogrel among 544 individuals. J. Am. Coll. Cardiol. 2005; 45, 246–251.
34. Price, M. J., Endemann, S., Gollapudi, R. R., Valencia, R., Stinis, C. T., Levisay, J. P., Ernst, A., Sawhney, N. S., Schatz, R. A., Teirstein, P. S.: Prognostic significance of post-clopidogrel platelet reactivity assessed by a point-of-care assay on thrombotic events after drug-eluting stent implantation. Eur. Heart. J. 2008; 29, 992–1000.
35. Shuldiner, A. R., O‘Connell, J. R., Bliden, K. P., Gandhi, A., Ryan, K., Horenstein, R. B., Damcott, C. M., Pakyz, R., Tantry, U. S., Gibson, Q., Pollin, T. I., Post, W., Parsa, A., Mitchell, B. D., Faraday, N., Herzog, W., Gurbel, P. A.: Association of cytochrome P450 2C19 genotype with the antiplatelet effect and clinical efficacy of clopidogrel therapy. JAMA 2009; 302, 849–857.
36. Sibbing, D., Taubert, D., Schömig, A., Kastrati, A., Von Beckerath, N.: Pharmacokinetics of clopidogrel in patients with stent thrombosis. J. Thromb. Haemost. 2008; 6, 1230–1232.
37. Hulot, J. S., Bura, A., Villard, E., Azizi, M., Remones, V., Goyenvalle, C., Aiach, M., Lechat, P., Gaussem, P.: Cytochrome P450 2C19 loss-of-function polymorphism is a major determinant of clopidogrel responsiveness in healthy subjects. Blood 2006; 108, 2244–2247.
38. Varenhorst, C., James, S., Erlinge, D., Brandt, J. T., Braun, O. O., Man, M., Siegbahn, A., Walker, J., Wallentin, L., Winters, K. J., Close, S. L.: Genetic variation of CYP2C19 affects both pharmacokinetic and pharmacodynamic responses to clopidogrel but not prasugrel in aspirin–treated patients with coronary artery disease. Eur. Heart. J. 2009; 30, 1744–1752.
39. Gladding, P., Webster, M., Zeng, I., Farrell, H., Stewart, J., Ruygrok, P., Ormiston, J., El-Jack, S., Armstrong, G., Kay, P., Scott, D., Gunes, A., Dahl, M. L.: The pharmacogenetics and pharmacodynamics of clopidogrel response: an analysis from the PRINC (Plavix Response in Coronary Intervention) trial. JACC Cardiovasc. Interv. 2008; 1, 620–627.
40. Frere, C., Cuisset, T., Morange, P. E., Quilici, J., Camoin-Jau, L., Saut, N., Faille, D., Lambert, M., Juhan-Vague, I., Bonnet, J. L., Alessi, M. C.: Effect of cytochrome p450 polymorphisms on platelet reactivity after treatment with clopidogrel in acute coronary syndrome. Am. J. Cardiol. 2008; 101, 1088–1093.
41. Sibbing, D., Stegherr, J., Latz, W., Koch, W., Mehilli, J., Dörrler, K., Morath, T., Schömig, A., Kastrati, A., von Beckerath, N.: Cytochrome P450 2C19 loss-of-function polymorphism and stent thrombosis following percutaneous coronary intervention. Eur. Heart. J. 2009; 30, 916–922.
42. Mega, J. L., Close, S. L., Wiviott, S. D., Shen, L., Hockett, R. D., Brandt, J. T., Walker, J. R., Antman, E. M., Macias, W., Braunwald, E., Sabatine, M. S.: Cytochrome p-450 polymorphisms and response to clopidogrel. N. Engl. J. Med. 2009; 360, 354–362.
43. Collet, J. P., Hulot, J. S., Pena, A., Villard, E., Esteve, J. B., Silvain, J., Payot, L., Brugier, D., Cayla, G., Beygui, F., Bensimon, G., Funck-Brentano, C., Montalescot, G.: Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction: a cohort study. Lancet 2009; 373, 309–317.
44. Hulot, J. S., Collet, J. P., Silvain, J., Pena, A., Bellemain-Appaix, A., Barthélémy, O., Cayla, G., Beygui, F., Montalescot, G.: Cardiovascular risk in clopidogrel-treated patients according to cytochrome P450 2C19*2 loss-of-function allele or proton pump inhibitor coadministration: a systematic meta-analysis. J. Am. Coll. Cardiol. 2010; 56, 134–143.
45. Trenk, D., Hochholzer, W., Fromm, M. F., Chialda, L. E., Pahl, A., Valina, C. M., Stratz, C., Schmiebusch, P., Bestehorn, H. P., Büttner, H. J., Neumann, F. J.: Cytochrome P450 2C19 681G>A polymorphism and high on-clopidogrel platelet reactivity associated with adverse 1-year clinical outcome of elective percutaneous coronary intervention with drug-eluting or bare-metal stents. J. Am. Coll. Cardiol. 2008; 51, 1925–1934.
46. Sibbing, D., Koch, W., Gebhard, D., Schuster, T., Braun, S., Stegherr, J., Morath, T., Schömig, A., von Beckerath, N., Kastrati, A.: Cytochrome 2C19*17 allelic variant, platelet aggregation, bleeding events, and stent thrombosis in clopidogrel-treated patients with coronary stent placement. Circulation. 2010; 121, 512–518.
47. Jiang, Z. P., Shu, Y., Chen, X. P., Huang, S. L., Zhu, R. H., Wang, W., He N., Zhou, H. H.: The role of CYP2C19 in amitriptyline N-demethylation in Chinese subjects. Eur J Clin Pharmacol 2002; 58, 109–113.
48. Steimer, W., Zöpf, K., von Amelunxen, S., Pfeiffer, H., Bachofer, J., Popp, J., Messner, B., Kissling, W., Leucht, S.: Allele-specific change of concentration and functional gene dose for the prediction of steady-state serum concentrations of amitriptyline and nortriptyline in CYP2C19 and CYP2D6 extensive and intermediate metabolizers. Clin. Chem. 2004; 50, 1623–1633.
49. Madsen, H., Nielsen, K. K., BrŅsen, K.: Imipramine metabolism in relation to the sparteine and mephenytoin oxidation polymorphisms – a population study. Br. J. Clin. Pharmac. 1995; 39, 433–439.
50. Koyama, E., Tanaka, T., Chiba, K., Kawakatsu, S., Morinobu, S., Totsuka, S., Ishizaki, T.: Steady – state plasma concentrations of imipramine and desipramine in relation to mephenytoin 4’-Hydroxylation status in Japanese depressive patients. J. Clin. Psychopharmacol. 1996; 16, 286–293.
51. Schenk, P. W., van Vliet, M., Mathot, R. A., van Gelder, T., Vulto, A. G., van Fessem, M. A., Verploegh-Van Rij, S., Lindemans, J., Bruijn, J. A., van Schaik R. H.: The CYP2C19*17 genotype is associated with lower imipramine plasma concentrations in a large group of depressed patients. Pharmacogenomics. J. 2010; 10, 219–225.
52. Yokono, A., Morita, S., Someya, T., Hirokane, G., Okawa, M., Shimoda, K.: The effect of CYP2C19 and CYP2D6 genotypes on the metabolism of clomipramine in Japanese psychiatric patients. J. Clin. Psychopharmacol. 2001; 21, 549–555.
53. Sindrup, S. H., BrŅsen, K., Hansen, M. G., Aaes-JŅrgensen, T., OverŅ, K. F., Gra,m L. F.: Pharmacokinetics of citalopram in relation to the sparteine and the mephenytoin oxidation polymorphisms. Ther. Drug. Monit. 1993; 15, 11–17.
54. Yu, B. N., Chen, G. L., He, N., Ouyang, D. S., Chen, X. P., Liu, Z. Q., Zhou, H. H.: Pharmacokinetics of citalopram in relation to genetic polymorphism of CYP2C19. Drug. Metab. Dispos. 2003; 31, 1255–1259.
55. Herrlin, K., Yasui-Furukori, N., Tybring, G., Widén, J., Gustafsson, L. L., Bertilsson, L.: Metabolism of citalopram enantiomers in CYP2C19/CYP2D6 phenotyped panels of healthy Swedes. Br. J. Clin. Pharmacol. 2003; 56, 415–421.
56. Fudio, S., Borobia, A. M., PiĖana, E., Ramírez, E, Tabarés, B, Guerra, P, Carcas, A, Frías, J.: Evaluation of the influence of sex and CYP2C19 and CYP2D6 polymorphisms in the disposition of citalopram. Eur. J. Pharmacol. 2010; 626, 200–204.
57. Rudberg, I., Hendset, M., Uthus, L. H., Molden, E., Refsum, H.: Heterozygous mutation in CYP2C19 significantly increases the concentration/dose ratio of racemic citalopram and escitalopram (S-citalopram). Ther. Drug. Monit. 2006; 28, 102–105.
58. Ohlsson Rosenborg, S., Mwinyi, J., Andersson, M., Baldwin, R. M., Pedersen, R. S., Sim, S. C., Bertilsson, L., Ingelman-Sundberg, M., Eliasson, E.: Kinetics of omeprazole and escitalopram in relation to the CYP2C19*17 allele in healthy subjects. Eur. J. Clin. Pharmacol. 2008; 64, 1175–1179
59. Noehr-Jensen, L., Zwisler, S. T., Larsen, F., Sindrup, S. H., Damkier, P., Nielsen, F., Brosen, K.: Impact of CYP2C19 phenotypes on escitalopram metabolism and an evaluation of pupillometry as a serotonergic biomarker. Eur. J. Clin. Pharmacol. 2009; 65, 887–894
60. Bondolfi, G., Chautems, C., Rochat, B., Bertschy, G., Baumann, P.: Non-response to citalopram in depressive patients: pharmacokinetic and clinical consequences of a fluvoxamine augmentation. Psychopharmacology 1996; 128, 421–425
61. Peters, E. J., Slager, S. L., Kraft, J. B., Jenkins, G. D., Reinalda, M. S., McGrath, P. J., Hamilton, S. P.: Pharmacokinetic genes do not influence response or tolerance to citalopram in the STAR*D sample. PloS. One. 2008; 3, e1872
62. Xu, Z. H., Wang, W., Zhao, X. J., Huang, S. L., Zhu, B., He, N., Shu, Y., Liu, Z. Q., Zhou, H. H.: Evidence for involvement of polymorphic CYP2C19 and 2C9 in the N-demethylation of sertraline in human liver microsomes. Br. J. Clin. Pharmacol. 1999; 48, 416–423.
63. Wang, J. H., Liu, Z. Q., Wang, W., Chen, X. P., Shu, Y., He, N., Zhou, H. H.: Pharmacokinetics of sertraline in relation to genetic polymorphism of CYP2C19. Clin. Pharmacol. Ther. 2001; 70, 42–47.
64. Rudberg, I., Hermann, M., Refsum, H., Molden, E.: Serum concentrations of sertraline and N-desmethyl sertraline in relation to CYP2C19 genotype in psychiatric patients. Eur. J. Clin. Pharmacol. 2008; 64, 1181–1188.
65. Liu, Z. Q., Cheng, Z. N., Huang, S. L., Chen, X. P., Ou-Yang, D. S., Jiang, C. H., Zhou, H. H.: Effect of the CYP2C19 oxidation polymorphism on fluoxetine metabolism in Chinese healthy subjects. Br. J. Clin. Pharmacol. 2001; 52, 96–99.
66. Scordo, M. G., Spina, E., Dahl, M. L., Gatti, G., Perucca, E.: Influence of CYP2C9, 2C19 and 2D6 genetic polymorphisms on the steady-state plasma concentrations of the enantiomers of fluoxetine and norfluoxetine. Basic. Clin. Pharmacol. Toxicol. 2005; 97, 296–301.
67. Bertilsson, L., Henthorn, T. K., Sanz, E., Tybring, G., Säwe, J., Villén, T.: Importance of genetic factors in the regulation of diazepam metabolism: relationship to S–mephenytoin, but not debrisoquin, hydroxylation phenotype. Clin. Pharmacol. Ther. 1989; 45, 348–355.
68. Shon, D. R., Kusaka, M., Ishizaki, T., Shin, S. G., Jang, I. J., Shin, J. G., Chiba, K.: Incidence of S-mephenytoin hydroxylation deficiency in a Korean population and the interphenotypic differences in diazepam pharmacokinetics. Clin. Pharmacol. Ther. 1992; 52, 160–169.
69. Qin, X. P., Xie, H. G., Wang, W., He, N., Huang, S. L., Xu, Z. H., Ou-Yang, D. S., Wang, Y. J., Zhou, H. H.: Effect of the gene dosage of CgammaP2C19 on diazepam metabolism in Chinese subjects. Clin. Pharmacol. Ther. 1999; 66, 642–646.
70. Inomata, S., Nagashima, A., Itagaki, F., Homma, M., Nishimura, M., Osaka, Y., Okuyama, K., Tanaka, E., Nakamura, T., Kohda, Y., Naito, S., Miyabe, M., Toyooka, H.: CYP2C19 genotype affects diazepam pharmacokinetics and emergence from general anesthesia. Clin. Pharmacol. Ther. 2005; 78, 647–655.
71. Giraud, C., Tran, A., Rey, E., Vincent, J., Tréluyer, J. M., Pons, G.: In vitro characterization of clobazam metabolism by recombinant cytochrome P450 enzymes: importance of CYP2C19. Drug. Metab. Dispos. 2004; 32, 1279–1286.
72. Contin, M., Sangiorgi, S., Riva, R., Parmeggiani, A., Albani, F., Baruzzi, A.: Evidence of polymorphic CYP2C19 involvement in the human metabolism of N-desmethylclobazam. Ther. Drug. Monit. 2002; 24, 737–741.
73. Kosaki, K., Tamura, K., Sato, R., Samejima, H., Tanigawara, Y., Takahashi, T.: A major influence of CYP2C19 genotype on the steady-state concentration of N-desmethylclobazam. Brain. Dev. 2004; 26, 530–534.
74. Seo, T., Nagata, R., Ishitsu, T., Murata, T., Takaishi, C., Hori, M., Nakagawa, K.: Impact of CYP2C19 polymorphisms on the efficacy of clobazam therapy. Pharmacogenomics. 2008; 9, 527–537.
75. Bajpai, M., Roskos, L. K., Shen, D. D., Levy, R. H.: Roles of cytochrome P4502C9 and cytochrome P4502C19 in the stereoselective metabolism of phenytoin to its major metabolite. Drug. Metab. Dispos. 1996; 24, 1401–1403.
76. Schellens, J. H., van der Wart, J. H., Breimer, D. D.: Relationship between mephenytoin oxidation polymorphism and phenytoin, methylphenytoin and phenobarbitone hydroxylation assessed in a phenotyped panel of healthy subjects. Br. J. Clin. Pharmacol. 1990; 29, 665–671.
77. Lee, S. Y., Lee, S. T., Kim, J. W.: Contributions of CYP2C9/CYP2C19 genotypes and drug interaction to the phenytoin treatment in the Korean epileptic patients in the clinical setting. J. Biochem. Mol. Biol. 2007; 40, 448–452.
78. Yukawa, E., Mamiya, K.: Effect of CYP2C19 genetic polymorphism on pharmacokinetics of phenytoin and phenobarbital in Japanese epileptic patients using Non–linear Mixed Effects Model approach. J. Clin. Pharm. Ther. 2006; 31, 275–282.
79. Bauer, K. S., Dixon, S. C., Figg, W. D.: Inhibition of angiogenesis by thalidomide requires metabolic activation, which is species-dependent. Biochem. Pharmacol. 1998; 55, 1827–1834.
80. Yaccoby, S., Johnson, C. L., Mahaffey, S. C., Wezeman, M. J., Barlogie, B., Epstei,n J.: Antimyeloma efficacy of thalidomide in the SCID-hu model. Blood. 2002; 100, 4162–4168.
81. Ando, Y., Fuse, E., Figg, W. D.: Thalidomide metabolism by the CYP2C subfamily. Clin. Cancer. Res. 2002; 8, 1964–1973.
82. Li, Y., Hou, J., Jiang, H., Wang, D., Fu, W., Yuan, Z., Chen, Y., Zhou, L.: Polymorphisms of CYP2C19 gene are associated with the efficacy of thalidomide based regimens in multiple myeloma. Haematologica 2007; 92, 1246–1249.
83. Griskevicius, L., Yasar, U., Sandberg, M., Hidestrand, M., Eliasson, E., Tybring, G., Hassan, M., Dahl, M. L.: Bioactivation of cyclophosphamide: the role of polymorphic CYP2C enzymes. Eur. J. Clin. Pharmacol. 2003; 59, 103–109.
84. Timm, R., Kaiser, R., Lötsch, J., Heider, U., Sezer, O., Weisz, K., Montemurro, M., Roots, I., Cascorbi, I.: Association of cyclophosphamide pharmacokinetics to polymorphic cytochrome P450 2C19. Pharmacogenomics. J. 2005; 5, 365–373.
85. Takada, K., Arefayene, M., Desta, Z., Yarboro, C. H., Boumpas, D. T., Balow, J. E., Flockhart, D. A., Illei, G. G.: Cytochrome P450 pharmacogenetics as a predictor of toxicity and clinical response to pulse cyclophosphamide in lupus nephritis. Arthritis. Rheum. 2004; 50, 2202–2210.
86. Singh, G., Saxena, N., Aggarwal, A., Misra, R.: Cytochrome P450 polymorphism as a predictor of ovarian toxicity to pulse cyclophosphamide in systemic lupus erythematosus. J. Rheumatol. 2007; 34, 731–733.
87. Ngamjanyaporn, P., Thakkinstian, A., Verasertniyom, O., Chatchaipun, P., Vanichapuntu, M., Nantiruj, K., Totemchokchyakarn, K., Attia, J., Janwityanujit, S.: Pharmacogenetics of cyclophosphamide and CYP2C19 polymorphism in Thai systemic lupus erythematosus. Rheumatol. Int. 2010 [Epub ahead of print]
88. Hyland, R., Jones, B. C., Smith, D. A.: Identification of the cytochrome P450 enzymes involved in the N-oxidation of voriconazole. Drug. Metab. Dispos. 2003; 31, 540–547.
89. Murayama, N., Imai, N., Nakane, T., Shimizu, M., Yamazaki, H.: Roles of CYP3A4 and CYP2C19 in methyl hydroxylated and N-oxidized metabolite formation from voriconazole, a new anti-fungal agent, in human liver microsomes. Biochem. Pharmacol. 2007; 73, 2020–2026.
90. Scholz, I., Oberwittler, H., Riedel, K. D., Burhenne, J., Weiss, J., Haefeli, W. E., Mikus, G.: Pharmacokinetics, metabolism and bioavailability of the triazole antifungal agent voriconazole in relation to CYP2C19 genotype. Br. J. Clin. Pharmacol. 2009; 68, 906–915.
91. Shi, H. Y., Yan, J., Zhu, W. H., Yang, G. P., Tan, Z. R., Wu, W. H., Zhou, G., Chen, X. P., Ouyang, D. S.: Effects of erythromycin on voriconazole pharmacokinetics and association with CYP2C19 polymorphism. Eur. J. Clin. Pharmacol. 2010; 66, 1131–1136.
92. Wang, G., Lei, H. P., Li, Z., Tan, Z. R., Guo, D., Fan, L., Chen, Y., Hu, D. L., Wang, D., Zhou, H. H.: The CYP2C19 ultra-rapid metabolizer genotype influences the pharmacokinetics of voriconazole in healthy male volunteers. Eur. J. Clin. Pharmacol. 2009; 65, 281–285.
93. Weiss, J., Ten Hoevel, M. M., Burhenne, J., Walter-Sack, I., Hoffmann, M. M., Rengelshausen, J., Haefeli, W. E., Mikus, G.: CYP2C19 genotype is a major factor contributing to the highly variable pharmacokinetics of voriconazole. J. Clin. Pharmacol. 2009; 49, 196–204
94. Matsumoto, K., Ikawa, K., Abematsu, K., Fukunaga, N., Nishida, K., Fukamizu, T., Shimodozono, Y., Morikawa, N., Takeda, Y., Yamada, K.: Correlation between voriconazole trough plasma concentration and hepatotoxicity in patients with different CYP2C19 genotypes. Int. J. Antimicrob. Agents. 2009; 34, 91–94.
95. Levin, M. D., den Hollander, J. G., van der Holt, B., Rijnders, B. .J, van Vliet, .M, Sonneveld, .P, van Schaik, R. H.: Hepatotoxicity of oral and intravenous voriconazole in relation to cytochrome P450 polymorphisms. J. Antimicrob. Chemother. 2007; 60, 1104–1107.
96. Hirani, V. N., Raucy, J. L., Lasker ,J. M.: Conversion of the HIV protease inhibitor nelfinavir to a bioactive metabolite by human liver CYP2C19. Drug. Metab. Dispos. 2004; 32, 1462–1467.
97. Burger, D. M., Schwietert, H. R., Colbers, E. P., Becker, M.: The effect of the CYP2C19*2 heterozygote genotype on the pharmacokinetics of nelfinavir. Br. J. Clin. Pharmacol. 2006; 62, 250–252.
98. Hirt, D., Mentré, F., Tran, A., Rey, E., Auleley, S., Salmon, D., Duval, X., Tréluyer, J. M.: Effect of CYP2C19 polymorphism on nelfinavir to M8 biotransformation in HIV patients. Br. J. Clin. Pharmacol. 2008; 65, 548–557.
99. Damle, B. D., Uderman, H., Biswas, P., Crownover, P., Lin, C., Glue, P.: Influence of CYP2C19 polymorphism on the pharmacokinetics of nelfinavir and its active metabolite. Br. J. Clin. Pharmacol. 2009; 68, 682–689.
100. Haas, D. W., Smeaton, L. M., Shafer, R. W., Robbins, G. K., Morse, G. D., Labbe, L., Wilkinson, G. R., Clifford, D. B., D‘Aquila, R. T., De Gruttola, V., Pollard, R. B., Merigan, T. C., Hirsch, M. S., George, A. L. Jr, Donahue, J. P., Kim, R. B.: Pharmacogenetics of long-term responses to antiretroviral regimens containing Efavirenz and/or Nelfinavir: an Adult Aids Clinical Trials Group Study. J. Infect. Dis. 2005; 192, 1931–1942.
101. Saitoh, A., Capparelli, E., Aweeka, F., Sarles, E., Singh, K. K., Kovacs, A., Burchett S. K., Wiznia, A., Nachman, S., Fenton, T., Spector, S. A.: CYP2C19 genetic variants affect nelfinavir pharmacokinetics and virologic response in HIV-1-infected children receiving highly active antiretroviral therapy. J. Acquir. Immune. Defic. Syndr. 2010; 54, 285–289.
102. P450 Drug Interaction Table. http://medicine.iupui.edu/ clinpharm/ddis/table.aspx (17. 5. 2011)
103. Suchopár, J., Buršík, J., Mach, R., Prokeš, M.: Kompendium lékových interakcí. 1. vyd. InfoPharm 2005.
104. Baxter, K., Davis, M., Driver, S. (eds.) Stockley’s drug interactions, 8th ed. Suffolk, Pharmaceuticals Press 2008.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2011 Číslo 5- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť III. cytochróm P450 2C19
- Alzheimerova demence: aspekty současné farmakologické léčby
- Rhus hirta (L.) Sudw. – fytochemická charakteristika nejčastěji kultivovaného zástupce Anacardiaceae v České republice
- Efekt troch rôznych elicitorov na produkciu sanguinarínu suspenznými kultúrami nízko-morfínovej odrody maku siateho (Papaver somniferum L.)
- Měření viskozity a konzistence dle ČL 2009
- Cena České farmaceutické společnosti
-
Naše léčivé přípravky na konci 18. století
I. část – úvod a tekuté lékové formy - Prof. RNDr. Viliam Foltán, Csc., jubiluje
- Za doc. DrPh. PhMr. Ladislavom Kňažkom, CSc.
- Farmaceuti rokovali na Donovaloch
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Alzheimerova demence: aspekty současné farmakologické léčby
-
Naše léčivé přípravky na konci 18. století
I. část – úvod a tekuté lékové formy - Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť III. cytochróm P450 2C19
- Měření viskozity a konzistence dle ČL 2009
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



