-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaRhus hirta (L.) Sudw. – fytochemická charakteristika nejčastěji kultivovaného zástupce Anacardiaceae v České republice
Rhus hirta (L.) Sudw. – Phytochemical characteristics of the most widely cultivated representative of the Anacardiaceae in the Czech Republic
The family Anacardiaceae Lindl. (cashew family, sumac family) is one of the nine families of the order Sapindales Dumortier. It consists of about 600 species classified in 70 genera. Members of the family are shrubs, trees and lianas with pantropical distribution; however, a few species occur in the North Temperate Zone. Some species are used for the production of fruit (mango, mombin), some species are cultivated for edible seeds (pistachio, cashew nuts). Many species are of toxicological importance, especially members of the genus Toxicodendron P. Mill., other species are widely used in folk medicines. This review introduces the most widely cultivated species of the Anacardiaceae family in the Czech Republic and concurrently invasive plant Staghorn Sumac – Rhus hirta (L.) Sudw. The secondary metabolites, their pharmacological properties and pharmaceutical importance of the species are discussed.
Key words:
Rhus hirta – Anacardiaceae – gallotanins – essential oil – folk medicine
Autoři: Petr Babula 1; Anna Korvasová 1; Vojtech Adam 1; René Kizek 1
Působiště autorů: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav přírodních léčiv 1
Vyšlo v časopise: Čes. slov. Farm., 2011; 60, 229-236
Kategorie: Přehledy a odborná sdělení
Souhrn
Čeleď Anacardiaceae Lindl. (ledviníkovité) je jednou z devíti čeledí řádu Sapindales Dumortier (mýdelníkotvaré). Obsahuje 600 druhů řazených do 70 rodů. Jedná se zejména o keře, stromy nebo liány rozšířené pantropicky, řada druhů však zasahuje i do mírného pásu severní polokoule. Řada zástupců je zemědělsky využívána pro produkci plodů (mango, mombin), u jiných se sbírají, upravují a konzumují semena (pistácie, kešu oříšky). Řada druhů, zejména však zástupci rodu Toxicodendron P. Mill. (jedovatec), má význam toxikologický, další druhy jsou široce využívány v lidovém léčitelství. V předloženém souhrnu je představen nejčastěji kultivovaný zástupce Anacardiaceae v České republice a současně také invazivní druh škumpa orobincová – Rhus hirta (L.) Sudw. Diskutovány jsou sekundární metabolity, jejich farmakologické vlastnosti a farmaceutický význam druhu.
Klíčová slova:
Rhus hirta – Anacardiaceae – gallotaniny – silice – tradiční medicínaBotanická charakteristika Rhus hirta (L.) Sudw.
Škumpa orobincová – Rhus hirta (L.) Sudw. – je zástupcem čeledi Anacardiaceae Lindl., která je řazena do řádu Sapindales Dumortier. Samotná čeleď zahrnuje přibližně 600 druhů řazených do 70 rodů, z nichž mnohé byly a stále jsou předmětem zájmu fytochemiků vzhledem k přítomným sekundárním metabolitům 1). Mnohé druhy však mají i význam toxikologický. Jedním z rodů čeledi je i rod Rhus L. – škumpa – s asi 250 druhy rozšířenými v tropech a subtropech zejména Severní Ameriky a Afriky, ale také Asie 1). Škumpa orobincová je až 10 metrů vysoký dvoudomý opadavý keř s korunou kulovitého až deštníkovitého tvaru. Mladé větve jsou silné, silně sametově chlupaté. Listy jsou střídavé, přisedlé, až 50 cm dlouhé, lichozpeřené, mnohojařmé s 5–15 jařmy, s 9–31 lístky. Lístky jsou podlouhle kopinaté, na konci dlouze zašpičatělé a na bázi zaoblené, mají pilovitý okraj a jsou 5–12 cm dlouhé (obr. 1). Svrchní strana lístků je tmavě zelená a hladká, spodní strana je šedozelená, jemně ochlupená. Na podzim se listy barví do červenooranžova. Řapík je hustě pokrytý jemnými trichomy 2).
Obr. 1. Habitus Rhus hirta (L.) Sudw. A – samičí rostlina s čerstvě dozrálými i loňskými plodenstvími, B – samčí rostlina s málo kompaktními odkvétajícími květenstvími; morfologická stavba listu – složený, lichozpeřený, mnohojařmý list, C – zbarvení listu v létě (červenec), D – zbarvení listu na podzim (říjen) (foto autoři) 
Květy jsou uspořádány v palicovitých hustých koncových latách, jejichž délka dosahuje 10–20 cm a šířka 4–6 cm u báze. Samčí květenství jsou větší a méně kompaktní než květenství samičí. Samčí květy jsou pravidelné, pětičetné, se žlutavě zelenými korunními lístky, zelenými kališními lístky, pěti tyčinkami a zakrnělým sterilním pestíkem. Stavba samičích květů je obdobná, barva korunních lístků je však často načervenalá. Semeník je svrchní, synkarpní, sestávající ze tří srostlých plodolistů obsahujících po jednom vajíčku. V květech samičích jsou patrné zakrnělé sterilní tyčinky. U obou typů květů se na bázi nachází nektariový disk 3). Nektária samičích květů produkují větší množství koncentrovanějšího nektaru než je tomu u květů samčích 4, 5). Samčí i samičí rostliny vykvétají od června do července. Plodem jsou karmínově ochlupené kulaté peckovice, které v průměru měří asi 4 mm a obsahují po jednom semeni. Peckovice jsou sdružené v hustá, palicovitá, dlouho vytrvávající plodenství 2) (obr. 2).
Obr. 2. A – morfologická stavba samčího květu: odkvétající méně kompaktní samčí květenství s viditelnými tyčinkami, B – morfologická stavba samičího květu: kompaktnější samičí květenství se zřetelným narůžovělým nektariovým diskem na bázi pestíku. Morfologická stavba plodenství: hustá palicovitá plodenství tvořená kulatými ochlupenými peckovicemi. C – zrající plodenství (červenec), D – zralé plodenství (říjen), které na rostlině vytrvává celou zimu (foto autoři) 
Současný latinský název škumpy orobincové je Rhus hirta (L.) Sudw., který vychází ze dvou dříve používaných názvů Datisca hirta L. a Rhus typhina L. 6). Anglický název „Staghorn Sumac“ vychází z větvení připomínajícího jemně ochlupené parohy jelena 7).
Škumpa orobincová má původ ve východní části Severní Ameriky 2). První zmínka o výskytu škumpy orobincové na území České republiky pochází z roku 1835, kdy byla dovezena za účelem vysazení v Královské zahradě v Praze 8). Od roku 1900 se vyskytuje i ve volné přírodě 9). Jedná se o invazivní rostlinu, která se intenzivně rozmnožuje generativním, ale hlavně vegetativním způsobem, a to prostřednictvím četných kořenových výmladků, které činí rostliny prakticky nevymýtitelné 10 13). Roli v invazivním šíření hraje zcela jistě také selekce klonů adaptovaných k daným podmínkám 14). Druh se šíří nejen ve volné přírodě, ale také ve městech a ve výstavbě obecně, představuje tedy pionýrský druh 15 18). Rozmnožování generativní, prostřednictvím semen, s sebou nese některá úskalí, zejména pak nutnost překonání fyziologické dormance, která má původ ve specifické stavbě části oplodí - endokarpu - a osemení 19, 20). Teprve po překonání dormance (působením abiotických faktorů, roli hrají také příležitostné požáry) semena klíčí 21). Bylo zjištěno, že mladé rostliny škumpy orobincové snáší velmi dobře široké rozpětí světelných podmínek, což ji zvýhodňuje oproti ostatním rostlinám a činí z druhu druh invazivní 22, 23). Za ekologické zvýhodnění zodpovídají také sekundární metabolity škumpy rozpustné ve vodě - bylo zjištěno, že vodné extrakty inhibují růst jiných rostlin a mají tedy allelopatický potenciál 24). Za invazivnost druhu nejsou pravděpodobně zodpovědné jen výše uvedené faktory, ale i specifická stavba pletiv. Byl zkoumán vztah mezi vysokou pórovitostí sekundárního xylému kořenů a odolností a možným invazivním šířením škumpy, definitivní závěry však stále učiněny nebyly 25).
Pěstovány jsou také tři kultivary škumpy orobincové. R. hirta cv. Dissecta má lístky hluboce peřenosečné, R. hirta cv. Laciniata má lístky stejné jako cv. Dissecta, ale mělčeji vykrajované, a vyznačuje se květenstvím s početnými peřenosečně zastřihovanými listeny. R. hirta cv. Tiger Eyes vznikl jako mutace R. hirta „Laciniata“, má růžové řapíky a hluboce vykrajované žlutozelené lístky, na podzim oranžové 26).
Sekundární metabolity Rhus hirta (L.) Sudw.
Gallotaniny
Nejvýznamnějšími a nejvíce prostudovanými obsahovými látkami škumpy orobincové jsou hydrolyzovatelné třísloviny gallotaninového typu, které mohou být definovány jako estery kyseliny gallové s polyolem, nejčastěji ß-D-glukopyranosou. Nejjednodušším gallotaninem je 1-O-galloyl-ß-D-glukopyranosa (ß-glukogallin). Následné substituce tohoto monoesteru vedou ke vzniku až 1,2,3,4,6-penta-O-galloyl-ß-D-glukopyranosy (obr. 3) 27, 28).
Obr. 3. Prekurzory hydrolyzovatelných tříslovin 1 – kyselina gallová, 2 – 1-O-galloyl-ß-D-glukopyranosa (ß-glukogallin), 3 – 1,2,3,4,6-penta-O-galloyl-ß-D-glukopyranosa 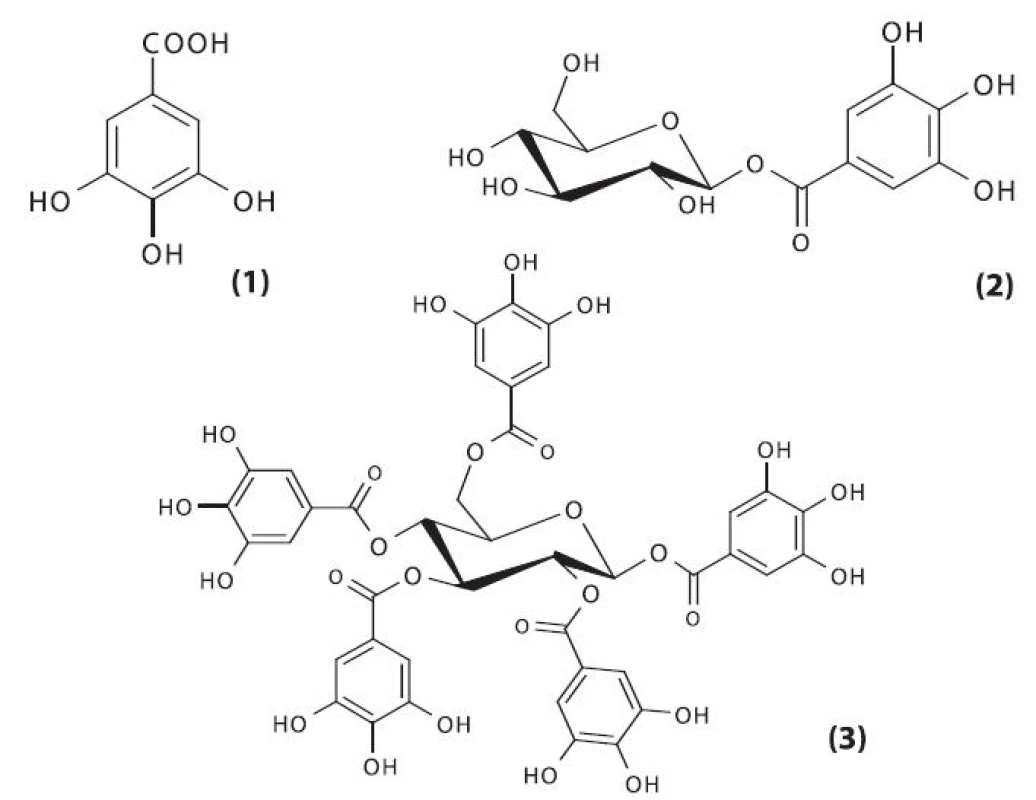
Biosyntéza gallotaninů vychází z kyseliny gallové (obr. 4) 29, 30). Bylo prokázáno, že původ kyseliny gallové je v erythrosa 4-fosfátu a v následném produktu 5 dehydrošikimátu, protokatechová kyselina nebyla v případě Rhus hirta identifikována jako prekurzor biosyntézy kyseliny gallové 31). Molekula glukosy v podobě UDP-glukosy je esterifikována kyselinou gallovou v poloze C1 za vzniku ß-glukogallinu. Molekula kyseliny gallové pro následující reakci je přinášena v podobě ß-glukogallinu, který tak funguje jako akceptor acylu a zároveň jako donor acylu, což znamená, že jde o energeticky bohatou aktivovanou molekulu 32). Tatáž reakce probíhá až po syntézu pentagalloylglukosy. Substituce hydroxylů glukosy vykazuje extrémní specifitu a probíhá vždy v pořadí: ß-glukogallin → 1,6-digalloylglukosa → 1,2,6-trigalloylglukosa → 1,2,3,6-tetragalloylglukosa → 1,2,3,4,6-pentagalloylglukosa 33–37).
Obr. 4. Biosyntéza gallotaninů I 1 – kyselina gallová, 2 – 1-O-galloyl-ß-D-glukopyranosa (ß-glukogallin), 3 – 1,2,3,4,6-penta-O-galloyl-ß-D-glukopyranosa, 4 – 1,6-di-O-galloyl-ß-D-glukopyranosa, 5 – 1,2,6-tri-O-galloyl-ß-D-glukopyranosa, 6 – 1,2,3,6-tetra-O-galloyl-ß-D-glukopyranosa, G – galloyl 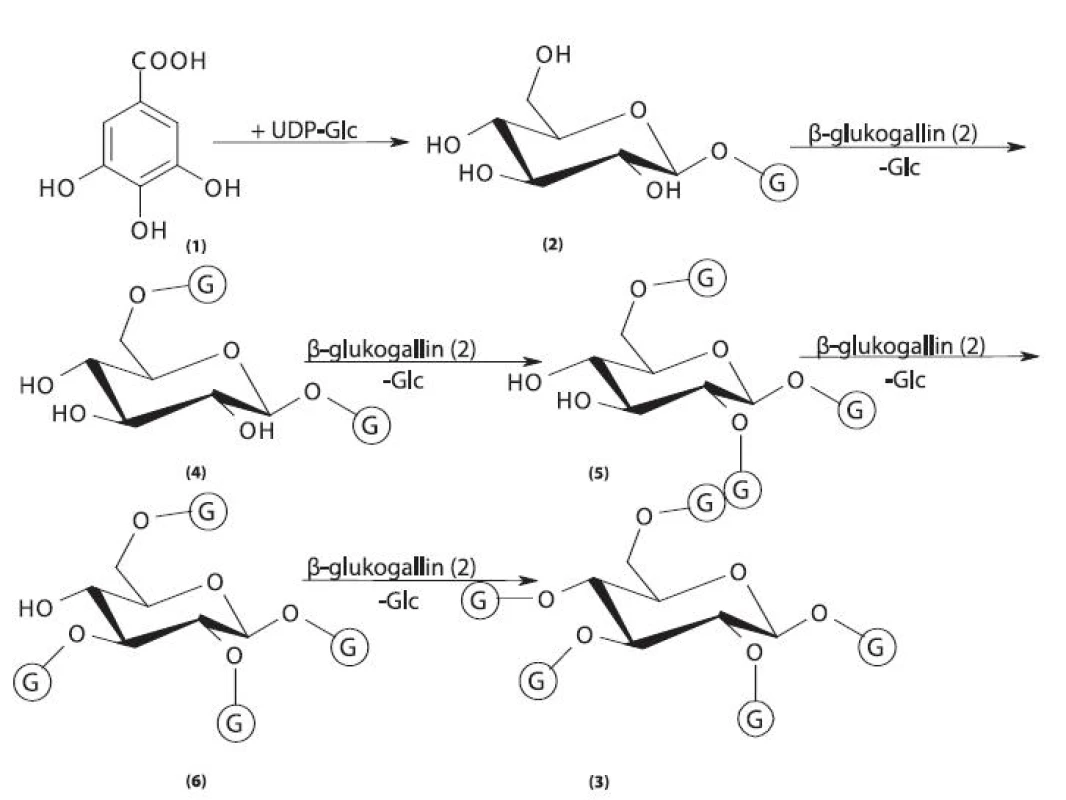
Jednotlivé mono - až penta-substituované estery jsou označovány jako „jednoduché“ galloylglukosy lišící se od „komplexních“ galloylglukos a gallotaninů jako takových. Komplexní gallotaniny vznikají připojováním dalších zbytků kyseliny gallové na pentagalloylglukosové jádro, čímž vznikají vysokomolekulární struktury obsahující až 10, výjimečně i více, zbytků kyseliny gallové. Reakce vedoucí k tvorbě komplexních gallotaninů probíhají stejným mechanismem, tj. prostřednictvím ß-glukogallinu jako prekurzoru, ačkoliv aromatické hydroxylové skupiny galloylů se svými chemickými vlastnostmi značně liší od alifatických hydroxylů glukosy. Zbytky kyseliny gallové se na galloyly 1,2,3,4,6-penta-O-galloyl-ß-D--glukopyranosy váží v poloze meta, a vytvářejí tak charakteristická meta-depsidická seskupení 38). Reakce jsou katalyzovány několika enzymy (galloyltransferasy A–E) s různou afinitou k penta-, hexa - a heptagalloylglukopyranosovým substrátům (obr. 5) 39–41).
Obr. 5. Biosyntéza gallotaninů II 3 – 1,2,3,4,6-penta-O-galloyl-ß-D-glukopyranosa, G – galloyl, A, B, C, D, E – galloyltransferasy A–E. Hlavní cesty biosyntézy jsou vyznačeny šipkami, převažující enzymové aktivity písmeny A–E. 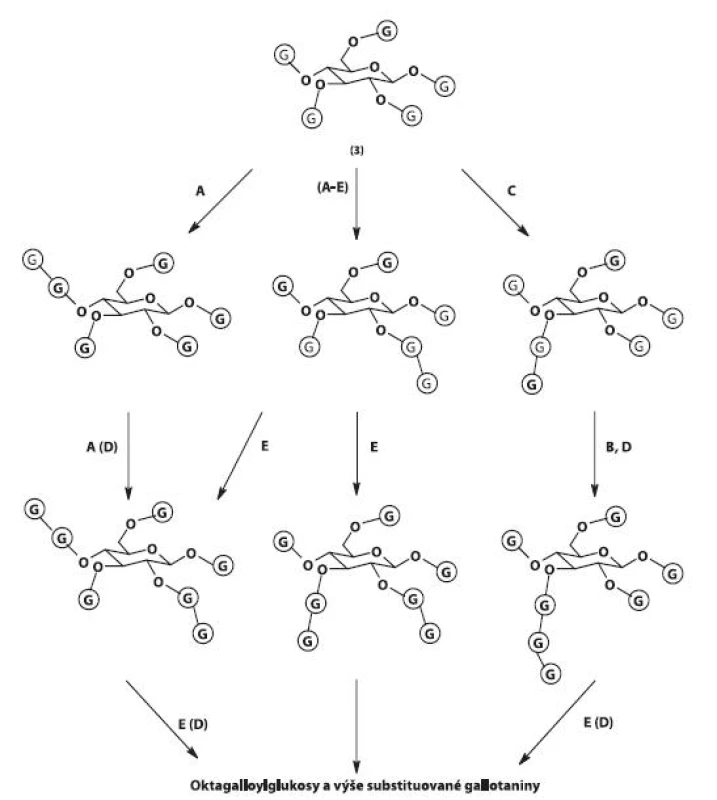
Výsledné produkty biosyntézy jsou deponovány v buněčných stěnách, ale také v intercelulárních prostorech a chloroplastech 42). Výše uvedené biosyntetické cesty gallotaninů byly objasněny za použití Rhus typhina jako modelové rostliny, která se pro tyto účely používala již od šedesátých let 20. století 43, 44).
V listech škumpy orobincové je nejhojnějším zástupcem gallotaninů 3,6-bis-O-digalloyl-l,2,4-tri-O-galloyl-ß-D-glukopyranosa 45). Odvozeny byly i explantátové kultury, u kterých byla zkoumána schopnost produkce gallotaninů 46).
Další obsahové látky
Mezi další obsahové látky patří triterpeny s hemiketalovým můstkem v kruhu A (3α,20-dihydroxy-3ß,25-epoxylupan, izolován z květů), fytosteroly a cynarin 47, 48). Ve dřevě byly nalezeny flavonoidy 3’,4‘,6-trihydroxyauron (sulfuretin), fustin a kvercitrin, stejně jako v ostatních částech rostliny 49–51). Fenolické a další látky, s výjimkou výše uvedených gallotaninů, patří u škumpy mezi ty nejméně prozkoumané 52–54). Je jen málo prací, které se jimi zabývají. Z dalších prací stojí za zmínku práce zabývající se purifikací enzymů ze skupiny laktas, které hrají významnou roli v biosyntéze ligninu 55).
V listech je obsažena silice, u které byl potvrzen insekticidní účinek. Za tento účinek jsou zodpovědné zejména alkoholy a karboxylové kyseliny fytol, linalool, tetradekanol, dokosanol, tetradekanová a hexadekanová kyselina. Kromě těchto složek obsahuje silice řadu dalších látek. Patří mezi ně monoterpenické alkoholy (obr. 6), konkrétně p-menthadien-7-ol, linalool, terpineol, geraniol, seskviterpenické uhlovodíky, a to karyofylen, δ-kadinen, γ-kadinen, α muurolen, humulen, α-kopaen, α-trans-ß-bergamoten a pět dalších, jejichž struktura nebyla identifikována, seskviterpenické kyslíkaté sloučeniny, např. torreyol, ze skupiny diterpenů je obsažen fytol a hexahydroxyfarnesylaceton – oxidační produkt fytolu. V silici byly dále identifikovány mastné kyseliny (dodekanová, tetradekanová, pentadekanová, hexadekanová a oktadekanová), n-uhlovodíky od heptanu po triakontan, nasycené aldehydy s dlouhým řetězcem (od n-nonanalu po oktakosanal), α,ß-nenasycené aldehydy s dlouhým řetězcem (2-oktenal, 2 nonenal, 2 decenal, 2-undecenal). Dále byly v silici identifikovány furfural, hex-3-en-1-ol, oktan-1-ol, tetradekan-1-ol, hexadekan-1-ol, oktadekan-1-ol, eikosan-1-ol, dokosan-1-ol a benzylsalicylát 56). Nenasycené mastné kyseliny byly nalezeny v plodech 57, 58).
Obr. 6. Monoterpenické alkoholy obsažené v silici listů R. hirta (A) 1 – p-menthadien-7-ol, 2 – linalool, 3 – terpineol, 4 – geraniol Seskviterpenické sloučeniny obsažené v silici listů R. hirta (B) Seskviterpenické uhlovodíky (sloučeniny 1–7): 1 – karyofylen, γ –∂δ-kadinen, 3 – δ-kadinen, 4 – α-muurolen, 5 – α-humulen, 6 – α-kopaen, 7 – α-trans-ß-bergamoten Seskviterpenické alkoholy: 8 – torreyol 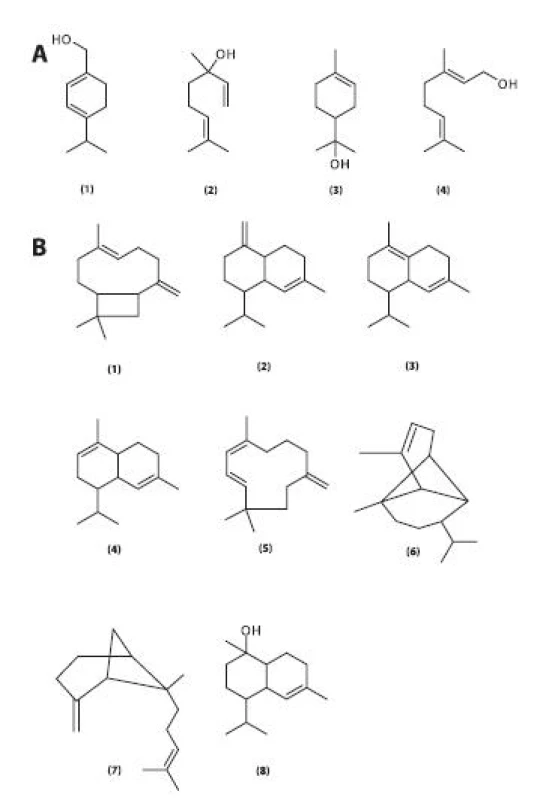
Stejně jako u jiných zástupců byly i u škumpy orobincové identifikovány fenolické lipidy, konkrétně m-tridecenylfenol, m-tridecylfenol a m-pentadecenylfenol (obr. 7) 56).
Obr. 7. Fenolické lipidy (m-alkylfenoly, m-alkenylfenoly) obsažené v silici listů R. hirta 1 – m-tridecenylfenol, 2 – m-tridecylfenol, 3 – m-pentadecenylfenol 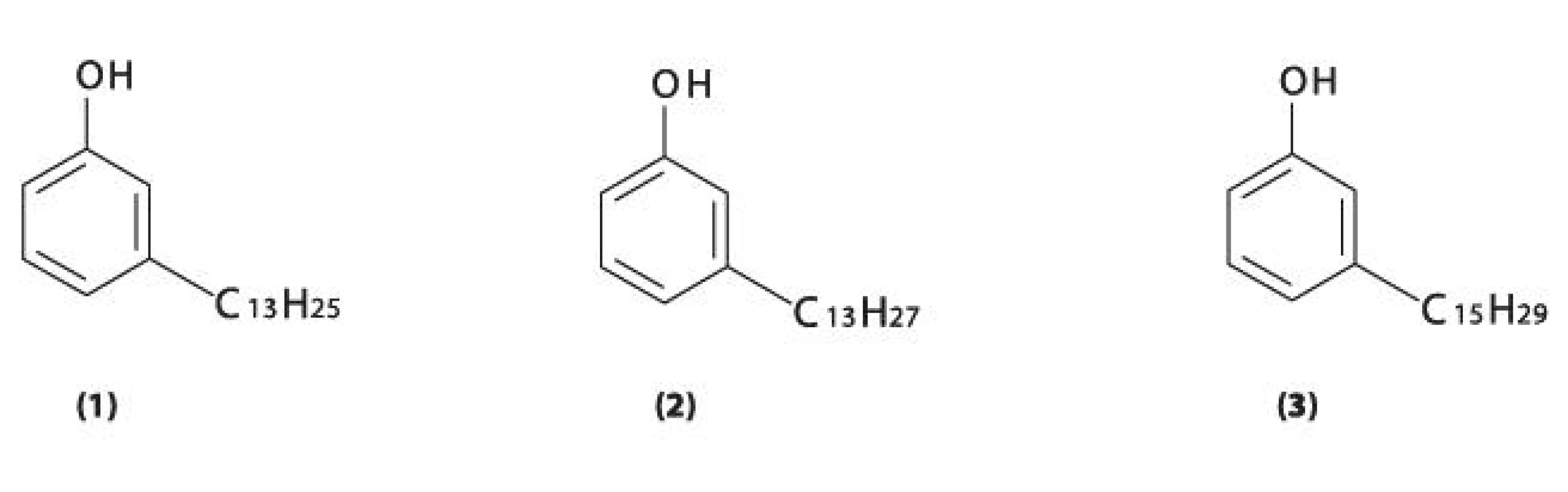
Biologické účinky extraktů a sekundárních metabolitů RHUS hirta (L.) Sudw.
Zástupci rodu Rhus jsou poměrně intenzivně zkoumáni, a to nejen z pohledu jejich sekundárních metabolitů, ale také jejich účinku. Extrakty různých částí různých druhů rodu prokázaly účinky antifungální, protizánětlivé, antimikrobiální, antivirální, cytotoxické, antimalarické, hypoglykemické a mnohé další 59, 60). Celá řada druhů rodu byla a je dávána do souvislosti s kontaktními alergiemi a dermatitidami, nicméně Rhus hirta mezi tyto druhy nepatří 61). Bohužel, škumpa orobincová patří stále k těm pouze málo prozkoumaným druhům. Bylo prokázáno, že methanolický extrakt z plodů škumpy orobincové má antioxidační účinky 62). V případě superoxidových radikálů vykázal podobnou aktivitu jako extrakt ze zeleného čaje, v případě peroxidových radikálů dokonce vyšší aktivitu v porovnání s extrakty zeleného čaje nebo kyselinou askorbovou 63). U methanolického extraktu byla prokázána inhibice proteas. Extrakt inhiboval trypsin s inhibiční koncentrací IC50 = 1,2 μg/ml a trombin při minimální inhibiční koncentraci MIC = 20,5 μg/ml. Methanolické extrakty různých částí Rhus hirta inhibovaly nejen výše uvedené proteáz, ale také urokinázu a serin proteázy 64). Ethanolický extrakt z plodů prokázal rovněž protimikrobní aktivitu vůči gram-pozitivním i gram-negativním bakteriím a antifungální aktivitu proti kvasinkám. V experimentech byly nejvíce citlivé Bacillus cereus a Helicobacter pylori (MIC = 0,10 % vztažená ke koncentraci extraktu – w/v). Kvasinky byly citlivé méně (MIC = 0,60–0,75 % vztažená ke koncentraci extraktu – w/v) 65.
V listech nejhojněji obsažený gallotanin 3,6-bis-O-digalloyl-l,2,4-tri-O-galloyl-ß-D-glukopyranosa vykazuje protinádorovou a interferon indukující aktivitu 45). V této souvislosti je zkoumán také sulfuretin a jeho cytotoxické účinky 66). Gallotaniny izolované z jiného druhu rodu, Rhus verniciflua, prokázaly cytotoxicity na různých buněčných liniích, jedná se tedy o sekundární metabolity spolu s fenolickými lipidy zodpovědné za cytotoxické vlastnosti zjištěné i u jiných druhů rodu 67, 68). Prekurzor gallotaninů – 1,2,3,4,6-penta-O-galloyl-ß-D-glukopyranosa – prokázal schopnost snižovat glykémii u diabetických a obézních zvířat. Mechanismus účinku je stále zkoumán, předpokládá se interakce s inzulinovými receptory. Autoři studie předpokládají, že je možnost od této molekuly odvíjet nové látky pro léčbu diabetu a metabolického syndromu 69).
Extrakt z listů škumpy byl zkoumán ve vztahu k produkci methanu přežvýkavci, což představuje, míněno řadou vědců, závažný problém vzhledem ke globálnímu oteplování. Gallotaniny byly identifikovány jako látky zodpovědné za inhibici methanogeneze přežvýkavci 70). Díky možnému uplatnění gallotaninů byla zkoumána jejich stabilita. Bylo zjištěno, že během sušení nedochází ke snížení jejich biologické aktivity 71). Faktem zůstává, že gallotaniny přestavují látky stále intenzivně zkoumané, a to nejen z pohledu farmakologického, ale také z pohledu analytického 72).
Využití druhu RHUS hirta (L.) Sudw.
V Severní Americe byla škumpa orobincová dříve využívána domorodým obyvatelstvem pro své léčivé účinky. Nálevy a odvary z různých orgánů byly využívány jednotlivými indiánskými kmeny při rozličných onemocněních. Používaly se zejména plody, a to při nechutenství, nočním pomočování, jako antiemetikum, antidiarhoikum a anthelmintikum 73, 74). Kůra se využívala pro zvýšení laktace a také k oddálení předčasného porodu a jako dermatologikum. Kořen byl využíván pro léčbu pohlavních chorob a jako dermatologikum a hemostatikum. Květy se používaly proti bolestem břicha 73, 75). Listy infikované hálkami byly používány jako adstringens. Různé rostlinné orgány se využívaly v kombinaci s dalšími rostlinami při revmatismu, horečce, dále při kašli, tuberkulóze a různých plicních onemocněních 76). Domorodé kmeny Algonkinů, Delavarů, Irokézů, Malecitů využívaly extrakty z plodů k mírnění symptomů diabetu 75). Některé indiánské kmeny kouřily listy škumpy spolu s tabákem 75).
Vzhledem k vysokému obsahu tříslovin se listy a kůra používaly k výrobě přírodních barviv a mořidel 77). Dřevo je díky svému zajímavému oranžově červenému zbarvení atraktivním materiálem pro řezbářství 74).
Ve Spojených státech se dodnes připravuje nápoj známý pod názvem „indiánská limonáda“ nebo „škumpová limonáda“, anglicky „Sumac lemonade“, krátce „sumacade“ 78). Z rozdrcených plodů se připravuje macerát, přičemž se z trichomů peckovic vyextrahuje kyselina jablečná, která nápoji dodává natrpklou chuť. Při přípravě odvaru dochází také k vyluhování hořce chutnajících tříslovin. Limonáda se po oslazení cukrem nebo medem, popř. dochucení hřebíčkem nebo skořicí podává horká nebo studená. Plody byly rovněž konzumovány americkými indiány, nebo se z nich připravovalo želé 75, 78).
V Evropě je škumpa orobincová využívána zejména jako okrasná dřevina, oblíbená pro kulovitý až deštníkovitý tvar koruny a na podzim sytě oranžově až červeně zbarvené listy. Dekorativního vzhledu nabývá škumpa také po opadu listů díky setrvávajícím plodenstvím a zajímavému větvení větví 8).
Adresa pro korespondenci:
doc. PharmDr. Petr Babula, Ph.D.
Ústav přírodních léčiv FaF VFU
Palackého 1–3, 612 42 Brno
e-mail: petr-babula@email.cz
Došlo 23. června 2011 / Přijato 21. července 2011
Zdroje
1. Judd, W. S., Campbell, C. S., Kellogg, E. A., Stevens, P. F., Donoghue, M. J.: Plant systematics – a phylogenetic approach. 2nd ed. Sunderland: Sinauer Associates, Inc. 2002; 576 s.
2. Kubát, R., Hrouda, L., Chrtek, J., Kaplan, Z., Kirschner, J., Stěpánek, J.: Klíč ke květeně České republiky. 1. vyd. Praha: Academia 2002; 928 s.
3. Bachelier, J. B., Endress, P. K.: Comparative floral morphology and anatomy of Anacardiaceae and Burseraceae (Sapindales), with a special focus on gynoecium structure and evolution. Bot. J. Linnean Soc. 2009; 159, 499–571.
4. Greco, C. F., Holland, D., Kevan, P. G.: Foraging behaviour of honey bees (Apis mellifera L) on staghorn sumac (Rhus hirta Sudworth (ex-typhina L.)): Differences and dioecy. Can. Entomol. 1996; 128, 355–366.
5. Gallant, J. B., Kemp, J. R., Lacroix, C. R.: Floral development of dioecious staghorn sumac, Rhus hirta (Anacardiaceae). Int. J. Plant Sci. 1998; 159, 539–549.
6. Reveal, J. L.: Rhus-Hirta (L) Sudworth, a newly revived correct name for Rhus-Typhina L. (Anacardiaceae). Taxon 1991; 40, 489–492.
7. Grandtner, M. M.: Elsevier’s dictionary of trees. 1st ed. Radarweg: Elsevier:, B.V. 2005; 1493 s.
8. Pilát, A.: Listnaté stromy a keře našich zahrad a parků. 1. vyd. Praha: Statní zemědělské nakladatelství 1953; 1100 s.
9. Mollerova, J.: Notes on invasive and expansive trees and shrubs. J. For. Sci. 2005; 51, 19–23.
10. Werner, P. A., Harbeck, A. L.: The pattern of tree seedling establishment relative to staghorn sumac cover in Michigan old fields (Rhus typhina). Am. Midl. Nat. 1982; 108, 124–132.
11. Doust, J. L., Doust, L. L.: Modules of production and reproduction in a dioecious clonal shrub, Rhus-Typhina. Ecology 1988; 69, 741–750.
12. Meilleur, A., Veronneau, H., Bouchard, A.: Shrub communities as inhibitors of plant succession in southern Quebec. Environ. Manage. 1994; 18, 907–921.
13. Fan, P., Marston, A.: How can phytochemists benefit from invasive plants? Nat. Prod. Commun. 2009; 4, 1407–1416.
14. Luken, J. O.: Gradual and episodic changes in the structure of Rhus–Typhina clones. Bull. Torrey Bot. Club. 1990; 117, 221–225.
15. Peterson, C. J., Facelli, J. M.: Contrasting germination and seedling growth of Betula-Alleghaniensis and Rhus–Typhina subjected to various amounts and types of plant litter. Am. J. Bot. 1992; 79, 1209–1216.
16. Wang, G. M., Jiang, G. M., Yu, S. L., Li, Y. H., Liu, H.: Invasion possibility and potential effects of Rhus typhina on beijing municipality. J. Integr. Plant Biol. 2008; 50, 522–530.
17. Del Tredici, P.: Spontaneous urban vegetation: reflections of change in a globalized world. Nat. Cult. 2010; 5, 299–315.
18. Zhang, C. H., Zheng, Y. Q., Li, J. L., Yan, H. P., Wang, L.: Dispersal of staghorn sumac in Beijing areas. Acta Ecol. Sin. 2005; 25, 978–985.
19. Li, X. J., Baskin, J. M., Baskin, C. C.: Seed morphology and physical dormancy of several North American Rhus species (Anacardiaceae). Seed Sci. Res. 1999; 9, 247–258.
20. Li, X. J., Baskin, J. M., Baskin, C. C.: Physiological dormancy and germination requirements of seeds of several North American Rhus species (Anacardiaceae). Seed Sci. Res. 1999; 9, 237–245.
21. Marks, P. L.: Apparent fire-stimulated germination of Rhus-typhina seeds. Bull. Torrey Bot. Club. 1979; 106, 41–42.
22. Lafleur, P. M., Farnsworth, A. G.: Light interception and canopy radiation balance of staghorn sumac (Rhus typhina). Can. J. For. Res.-Rev. Can. Rech. For. 2008; 38, 1695–1700.
23. Zhang, Z. J., Jiang, C. D., Zhang, J. Z., Zhang, H. J., Shi, L.: Ecophysiological evaluation of the potential invasiveness of Rhus typhina in its non-native habitats. Tree Physiol. 2009; 29, 1307–1316.
24. Sun, T. X., Lu, F. D., Zheng, Y. Q., Zhang, C. H., Li, B. J., Wang, L., Yang, X. Y.: Allelopathic activity of exotic tree Rhus typhina. For. Res. 2010; 23, 195–201.
25. Jaquish, L. L., Ewers, F. W.: Seasonal conductivity and embolism in the roots and stems of two clonal ring-porous trees, Sassafras albidum (Lauraceae) and Rhus typhina (Anacardiaceae). Am. J. Bot. 2001; 88, 206–212.
26. Nelson, W. R.: Planting design: a manual of theory and practice. 2nd ed. Champaign: Stipes Publishing, Llc. 1979; 271 s.
27. Denzel, K., Gross, G. G.: Biosynthesis of gallotannins – enzymatic disproportionation of 1,6-digalloylglucose to 1,2,6-trigalloylglucose and 6-galloylglucose by an acyltransferase from leaves of Rhus-typhina L. Planta. 1991; 184, 285–289.
28. Gross, G. G., Denzel, K.: Biosynthesis of gallotannins – beta-glucogallin-dependent galloylation of 1,6-digalloylglucose to 1,2,6-trigalloylglucose. Zeitschrift fur Naturforschung C. J. Biosci. 1991; 46, 389–394.
29. Werner, I., Bacher, A., Eisenreich, W.: Retrobiosynthetic NMR studies with C-13-labeled glucose – Formation of gallic acid in plants and fungi. J. Biol. Chem. 1997; 272, 25474–25482.
30. Guzik, U., Wojcieszynska, D., Jaroszek, P.: Biosynthesis of gallic acid and its application. Biotechnologia 2010; 1, 119–131.
31. Werner, R. A., Rossmann, A., Schwarz, C., Bacher, A., Schmidt, H. L., Eisenreich, W.: Biosynthesis of gallic acid in Rhus typhina: discrimination between alternative pathways from natural oxygen isotope abundance. Phytochemistry. 2004; 65, 2809–2813.
32. Grundhofer, P., Niemetz, R., Schilling, G., Gross, G. G.: Biosynthesis and subcellular distribution of hydrolyzable tannins. Phytochemistry 2001; 57, 915–927.
33. Denzel, K., Schilling, G., Gross, G. G.: Biosynthesis of gallotannins. Enzymatic conversion of 1,6-digalloylglucose to 1,2,6-trigalloylglucose. Planta 1988; 176, 135–137.
34. Grundhofer, P., Gross, G. G.: Purification of tetragalloylglucose 4-O-galloyltransferase and preparation of antibodies against this key enzyme in the biosynthesis of hydrolyzable tannins. Z. Naturforsch. (C). Biosci. 2000; 55, 582–587.
35. Hagenah, S., Gross, G. G.: Biosynthesis of 1,2,3,6-tetra-o-galloyl-beta-d-glucose. Phytochemistry 1993; 32, 637–641.
36. Rausch, H., Gross, G. G.: Preparation of [C-14]-labelled 1,2,3,4,6-penta-O-galloyl-beta-D-glucose and related gallotannins. Z. Naturforsch. (C). 1996; 51, 473–476.
37. Niemetz, R., Gross, G. G.: Enzymology of gallotannin and ellagitannin biosynthesis. Phytochemistry. 2005; 66, 2001–2011.
38. Niemetz, R., Gross, G. G.: Gallotannin biosynthesis: beta-glucogallin: hexagalloyl 3-O-galloyltransferase from Rhus typhina leaves. Phytochemistry. 2001; 58, 657–661.
39. Niemetz, R., Gross, G. G.: Gallotannin biosynthesis: Purification of beta-glucogallin: 1,2,3,4,6-pentagalloyl-beta-D-glucose galloyltransferase from sumac leaves. Phytochemistry 1998; 49, 327–332.
40. Niemetz, R., Gross, G. G.: Gallotannin biosynthesis: A new beta-glucogallin-dependent galloyltransferase from sumac leaves acylating gallotannins at positions 2 and 4. J. Plant Physiol. 1999; 155, 441–446.
41. Frohlich, B., Niemetz, R., Gross, G. G.: Gallotannin biosynthesis: two new galloyltransferases from Rhus typhina leaves preferentially acylating hexa - and heptagalloylglucoses. Planta 2002; 216, 168–172.
42. Grundhofer, P., Gross, G. G.: Immunocytochemical studies on the origin and deposition sites of hydrolyzable tannins. Plant Sci. 2001; 160, 987–995.
43. Cornthwaite, D., Haslam, E.: Gallotannins 9. Biosynthesis of Gallic Acid in Rhus Typhina. J. Chem. Soc. 1965; 89, 3008–3011.
44. Schilling, N., Ferguson, J. A., Kandler, O.: Rapidly Synthesized Tannin in Leaves of Rhus-Typhina. Phytochemistry. 1972; 11, 873.
45. Islambekov, S. Y., Mavlyanov, S. M., Kamaev, F. G., Ismailov, A. I.: Phenolic compounds of sumac. Chem. Nat. Compounds. 1994; 30, 37–39.
46. Poma, K.: Production of tannins in suspension-cultures of Rhus-Typhina L. Acta Bot. Neerl. 1987; 36, 309–309.
47. Schmidt, J., Porzel, A., Adam, G.: 3 alpha,20-dihydroxy-3 beta,25-epoxylupane, a triterpene from Rhus typhina. Phytochemistry 1998; 49, 2049–2051.
48. Connolly, J. D., Hill, R. A.: Triterpenoids. Nat. Prod. Rep. 2001; 18, 131–147.
49. Kossah, R., Nsabimana, C., Zhang, H., Chen, W.: Optimization of extraction of polyphenols from syrian sumac (Rhus Coriaria L.) and chinese sumac (Rhus Typhina L.) fruits. Res. J. Phytochem. 2010; 4, 146–153.
50. Buziashvili, I. S., Komissarenko, N. F., Kolesnikov, D, G.: Phenolic Compounds of Rhus typhina and R. aromatica. Khimiya Prir. Soedin. 1973, 555–556.
51. Correia, S. D. J., David, J. P., David, J. M.: Secondary metabolites from species of Anacardiaceae. Quim. Nova. 2006; 29, 1287–1300.
52. Buziashvili, I. S., Komissarenko, N. F., Kolesnikov, D. G.: Phenolic compounds of Rhus typhina and R. aromatica. Chem. Nat. Compounds. 1975; 9, 524.
53. Pislarasu, N., Mircea, C.: Contributions to the pharmacognostic study of Rhus typhina L. flowers and fruit (Rumanian). Farmacia 1975; 23, 183–190.
54. Carr, M. E., Roth, W. B., Bagby, M. O.: Potential resource materials from Ohio plants. Econ. Bot. 1986; 40, 434–441.
55. Udagama-Randeniya, P., Savidge, R.: Electrophoretic analysis of coniferyl alcohol oxidase and related laccases. Electrophoresis 1994; 15, 1072–1077.
56. Bestmann, H.-J., Classen, B., Kobold, U., Vostrowsky, O., Klingauf, F., Stein, U.: Steam volatile constituents from leaves of Rhus typhina. Phytochemistry 1988; 27, 85–90.
57. Tischer, J.: On some ingredients of the fruits of staghorn sumac (Rhus typhina L.). Die Pharmazie 1960; 15, 83–89.
58. Kossah, R., Nsabimana, C., Zhao, J., Chen, H., Tian, F., Zhang, H., Chen, W.: Comparative study on the chemical composition of Syrian sumac (Rhus coriaria L.) and Chinese sumac (Rhus typhina L.) fruits. Pak. J. Nutr. 2009; 8, 1570–1574.
59. Rayne, S., Mazza, G.: Biological activities of extracts of sumac (Rhus spp.): a review. Plant Foods Hum. Nutr. 2007; 62, 165–175.
60. Chaiyasut, C., Kusirisin, W., Lailerd, N., Larttrakarnnon, L., Suttajit, M., Srichairatanakool, S.: Effect of Phenolic Compounds of Thai Indigenous Plants on Oxidative stress in Streptozocin-Induced Diabetic Rats. Evid. Compl. Alt. Med. 2011; in press.
61. Ippen, H.: Contact allergy to anacardiaceae. A review and case studies of poison ivy allergy in Central Europe. Derm. Ber. Umw. 1983; 31, 140–148.
62. Borchardt, J. R., Wyse, D. L., Sheaffer, C. C., Kauppi, K. L., Fulcher, R. G., Ehlke, N. J., Biesboer, D. D., Bey, R. F.: Antioxidant and antimicrobial activity of seed from plants of the Mississippi river basin. J. Med. Plants Res. 2009; 3, 707–718.
63. McCune, L. M., Johns, T.: Antioxidant activity in medicinal plants associated with the symptoms of diabetes mellitus used by the Indigenous Peoples of the North American boreal forest. J. Ethnopharmacol. 2002; 82, 197–205.
64. Jedinak, A., Valachova, M., Maliar, T., Sturdik, E.: Antiprotease activity of selected Slovak medicinal plants. Pharmazie. 2010; 65, 137–140.
65. Kossah, R., Zhang, H., Chen, W.: Antimicrobial and antioxidant activities of Chinese sumac (Rhus typhina L.) fruit extract. Food Control. 2011; 22, 128–132.
66. Song, M. Y., Jeong, G. S., Kwon, K. B., Ka, S. O., Jang, H. Y., Park, J. W., Kim, Y. C., Park, B. H.: Sulfuretin protects against cytokine-induced beta-cell damage and prevents streptozotocin-induced diabetes. Exp. Mol. Med. 2010; 42, 628–638.
67. Lee, J. C., Kim, J., Lim, K. T., Yang, M. S., Jang, Y. S.: Ethanol fluted extract of Rhus verniciflua Stokes showed both antioxidant and cytotoxic effects on mouse thymocytes depending on the dose and time of the treatment. J. Biochem. Mol. Biol. 2001; 34, 250–258.
68. Kim, J. H., Jung, C. H., Jang, B. H., Go, H. Y., Park, J. H., Choi, Y. K., Il Hong, S., Shin, Y. C., Ko, S. G.: Selective cytotoxic effects on human cancer cell lines of phenolic-rich ethyl-acetate fraction from Rhus verniciflua Stokes. Am. J. Chin. Med. 2009; 37, 609–620.
69. Li, Y., Kim, J., Li, J., Liu, X., Himmeldrik, K., Ren, Y., Wagner, T. E., Chen, X.: Natural anti-diabetic compound 1,2,3,4,6-penta-O-galloyl-D-glucopyranose binds to insulin receptor and activates insulin-mediated glucose transport signaling pathway. Biochem. Biophys. Res. Commun. 2005; 336, 430–437.
70. Jayanegara, A., Togtokhbayar, N., Makkar, H. P. S., Becker, K.: Tannins determined by various methods as predictors of methane production reduction potential of plants by an in vitro rumen fermentation system. Anim. Feed Sci. Technol. 2009; 150, 230–237.
71. Muetzel, S., Becker, K.: Extractability and biological activity of tannins from various tree leaves determined by chemical and biological assays as affected by drying procedure. Anim. Feed Sci. Technol. 2006; 125, 139–149.
72. Takemoto, J. K., Davies, N. M.: Method development for beta-glucogallin and gallic acid analysis: Application to urinary pharmacokinetic studies. J. Pharm. Biomed. Anal. 2011; 54, 812–816.
73. Erichsen-Brown, C.: Medicinal and other uses of North American plants: a historical survey with special reference to the Eastern Indian tribes. 1st ed. Toronto: Breezy Creeks Press 1989; 512 s.
74. Harper-Lore, B., Wilson, M.: Roadside use of native plants. 1st ed. Washington, D. C.: Island Press 1999; 665 s.
75. Moerman, D. E.: Native American Ethnobotany, 5th ed. Portland: Timber Press., Inc., USA 2004; 933 s.
76. McCune, L. M., Johns, T.: Antioxidant activity relates to plant part, life form and growing condition in some diabetes remedies. J. Ethnopharmacol. 2007; 112, 461–469.
77. Ligor, M., Buszewski, B.: Application of TLC and OPLC in the determination of pigments from natural products. J Planar Chromatogr. – Modern TLC. 2001; 14, 334–337.
78. Moerman, D. E.: Native American Food Plants: An Ethnobotanical Dictionary. 1st ed. Portland: Timber Press, Inc. 2010; 455 s.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2011 Číslo 5- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť III. cytochróm P450 2C19
- Alzheimerova demence: aspekty současné farmakologické léčby
- Rhus hirta (L.) Sudw. – fytochemická charakteristika nejčastěji kultivovaného zástupce Anacardiaceae v České republice
- Efekt troch rôznych elicitorov na produkciu sanguinarínu suspenznými kultúrami nízko-morfínovej odrody maku siateho (Papaver somniferum L.)
- Měření viskozity a konzistence dle ČL 2009
- Cena České farmaceutické společnosti
-
Naše léčivé přípravky na konci 18. století
I. část – úvod a tekuté lékové formy - Prof. RNDr. Viliam Foltán, Csc., jubiluje
- Za doc. DrPh. PhMr. Ladislavom Kňažkom, CSc.
- Farmaceuti rokovali na Donovaloch
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Alzheimerova demence: aspekty současné farmakologické léčby
-
Naše léčivé přípravky na konci 18. století
I. část – úvod a tekuté lékové formy - Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť III. cytochróm P450 2C19
- Měření viskozity a konzistence dle ČL 2009
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



