-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVýznam kalprotektinu v patogenezi revmatoidní artritidy a jeho využití jako biomarkeru
The role of calprotectin in the pathogenesis of rheumatoid arthritis and its use as a biomarker
Rheumatoid arthritis is a chronic inflammatory autoimmune disease typically affecting the synovial membrane, leading to pannus formation due to interaction among stromal and inflammatory cells and angiogenesis. Calprotectin is an S100A8/S100A9 heterodimer produced by activated neutrophils, monocytes, and macrophages in inflammatory tissue and circulation. In patients with RA, it is mainly produced locally in affected joints promoting inflammation, cartilage destruction, and bone resorption. Calprotectin can be detected in the circulation and used as a soluble biomarker. It appears to be a better marker of disease activity than typically used acute phase reactants; moreover, it can be used as a predictive marker of radiographic progression, therapeutic response, and disease flare.
Keywords:
disease activity – Pathogenesis – rheumatoid arthritis – calprotectin – biomarker
Autoři: N. Petrovská; M. Filková
Působiště autorů: Revmatologická klinika 1. LF UK, Praha ; Revmatologický ústav Praha
Vyšlo v časopise: Čes. Revmatol., 29, 2021, No. 3, p. 144-149.
Kategorie: Přehledový článek
Souhrn
Revmatoidní artritida (RA) je chronické zánětlivé autoimunitní onemocnění, jehož typickým patogenetickým znakem je synovitida s tvorbou pannu vznikající na podkladě interakce mezi stromálními a zánětlivými buňkami a angiogeneze. Kalprotektin je heterodimer S100A8 a S100A9 proteinů, který je produkován zejména aktivovanými neutrofily, monocyty a makrofágy v zánětlivé tkáni a cirkulaci. U RA je tvořen hlavně v postiženém kloubu, kde podporuje zánětlivý proces, destrukci chrupavky a kostní resorpci, čím se účastní na patogenezi onemocnění. V cirkulaci může být detekován a využit jako solubilní biomarker. Jeví se jako lepší ukazatel klinické aktivity než klasicky využívané reaktanty akutní fáze a také může být použit jako prediktivní marker radiografického postižení, rentgenové progrese, terapeutické odpovědi a relapsu onemocnění.
ÚVOD
Revmatoidní artritida je nejčastější chronické zánětlivé autoimunitní onemocnění, obvykle se projevující symetrickou polyartritidou postihující zejména drobné klouby rukou a nohou. I když přesná patogeneze RA není zcela objasněna, víme, že její vznik je několikastupňový proces. Typickým klinickým příznakům artritidy předchází tzv. preklinická fáze RA (pre-RA). Té predisponují genetické faktory a předcházejí environmentální rizikové inzulty s následnou tvorbou autoprotilátek, např. revmatoidních faktorů (RF) či protilátek proti citrulinovým proteinům (ACPA) a manifestací příznaků, jako je únava, bolest a ztuhlost kloubů (1, 2). Synoviální výstelku zdravého kloubu tvoří z velké části synoviální fibroblasty (SF) označované také jako synovialocyty typu B, tvořící dvě až tři vrstvy, společně se synoviálními makrofágy a synovialocyty typu A. U RA dochází v kloubu postiženém zánětem k hyperproliferaci aktivovaných SF, k infiltraci makrofágy a dalšími zánětlivými buňkami a neoangiogenezi a tím tvorbě pannu, který proniká do kloubní chrupavky a subchondrální kosti s následnou tvorbou erozí a v konečné fázi až k ankylóze kloubu (3). Kalprotektin (KLP) je S100A8/S100A9 heterodimer patřící mezi kalcium-vázající proteiny rodiny S100 proteinů. Je produkován zejména aktivovanými neutrofily, monocyty a makrofágy a může být detekován v krvi i synoviální tekutině (4). Kalprotektin má u RA několik funkcí zprostředkovaných přes Toll-like receptor 4 (TLR4), jakými jsou regulace cytoskeletu a buněčná migrace, řízení produkce prozánětlivých cytokinů, buněčná diferenciace a apoptóza (5–8). U pacientů s RA byly nalezeny zvýšené hladiny sérového kalprotektinu ve srovnání se zdravými kontrolami (6, 9–11). Jeho hladina byla asociována s laboratorní i klinickou aktivitou onemocnění, ultrasonograficky detekovanou synovitidou, radiografickou progresí a s terapeutickou odpovědí (12–14). Cílem tohoto přehledového článku je shrnutí poznatků o roli kalprotektinu v patogenezi RA a jeho možném využití jako biomarkeru.
ÚLOHA KALPROTEKTINU V PATOGENEZI REVMATOIDNÍ ARTRITIDY
V zánětlivém pannu u pacientů s RA dochází k abnormální akumulaci a aktivaci zánětlivého infiltrátu s vysokou produkcí zánětlivých mediátorů, včetně kalprotektinu (15). Proteiny S100A8 a S100A9 patří do rodiny S100 proteinů. Každý z nich může vázat dva ionty Ca2+ a další dvojmocné ionty kovů, jako například Zn2+. Můžeme je nalézt ve formě homodimerů, heterodimerů a heterotetramerů. Heterodimer S100A8/S100A9, nazývaný kalprotektin, je nejstabilnější formou a je zodpovědný za většinu biologických interakcí. Kalprotektin je typicky produkován granulocyty, monocyty a makrofágy, ale za specifických podmínek může být vylučován i dalšími buňkami (4, 16). U RA je kalprotektin secernován zejména v zánětem postiženém kloubu, a to jak aktivovanými fagocyty, tak i osteoklasty, chondrocyty a SF a z kloubní dutiny zřejmě proniká difuzí do cirkulace, pro co svědčí jeho vyšší koncentrace v kloubní dutině než v krvi (10). Jeho nejvyšší produkce se zdá být na rozhraní chrupavka-pannus (17). Ve skutečnosti patří S100A8 a S100A9 mezi proteiny s nejvíce zvýšenou tvorbou v synoviální tekutině pacientů s RA, kde podporují zánětlivý proces, zvyšují množství neutrofilů a monocytů, účastní se na destrukci chrupavky a kostní resorpci (obr. 1) (5, 6, 18). Za prvé – kalprotektin stimuluje produkci zánětlivých faktorů TNF-α (tumor necrosis factor-α), interleukinů (IL): IL-1β, IL-6, IL-8), fagocyty (6). Za druhé – kalprotektin zvyšuje expresi povrchového integrinového receptoru CD11b/CD18 na polymorfonukleárních buňkách a monocytech, což vede k jejich transendoteliální migraci a akumulaci v kloubu (5, 19). Endogenní ligandy TLR stimulují vylučování IL-22, který je zodpovědný za podporu proliferace SF a stimulaci vylučování matrixové metaloproteinázy-1 (MMP-1), i kalprotektinu. Vzhledem k tomu, že kalprotektin je také endogenním ligandem TLR, dalo by se předpokládat, že se tak vytváří pozitivní smyčka mezi IL-22 a kalprotektinem podporujícího zánět v kloubu (20). Aktivované chondrocyty také produkují kalprotektin, což vede ke katabolickému efektu na tyto buňky přes signální cestu TLR4 a aktivaci nukleárního faktoru kappa B (NF-kB). Tato aktivace vede k depleci proteoglykanů, zabraňuje tvorbě nové chrupavky a tím vede ke smrti chondrocytů (8). Kalprotektin dále způsobuje degranulaci polymorfonukleárů a uvolnění MMP a kolagenáz a tím degradaci chrupavky. S100A8 stimuluje diferenciaci osteoklastů přes TLR4, což vede ke kostní resorpci (21).
Obr. 1. Efekt kalprotektinu na buňky účastnící se na patogenezi revmatoidní artritidy 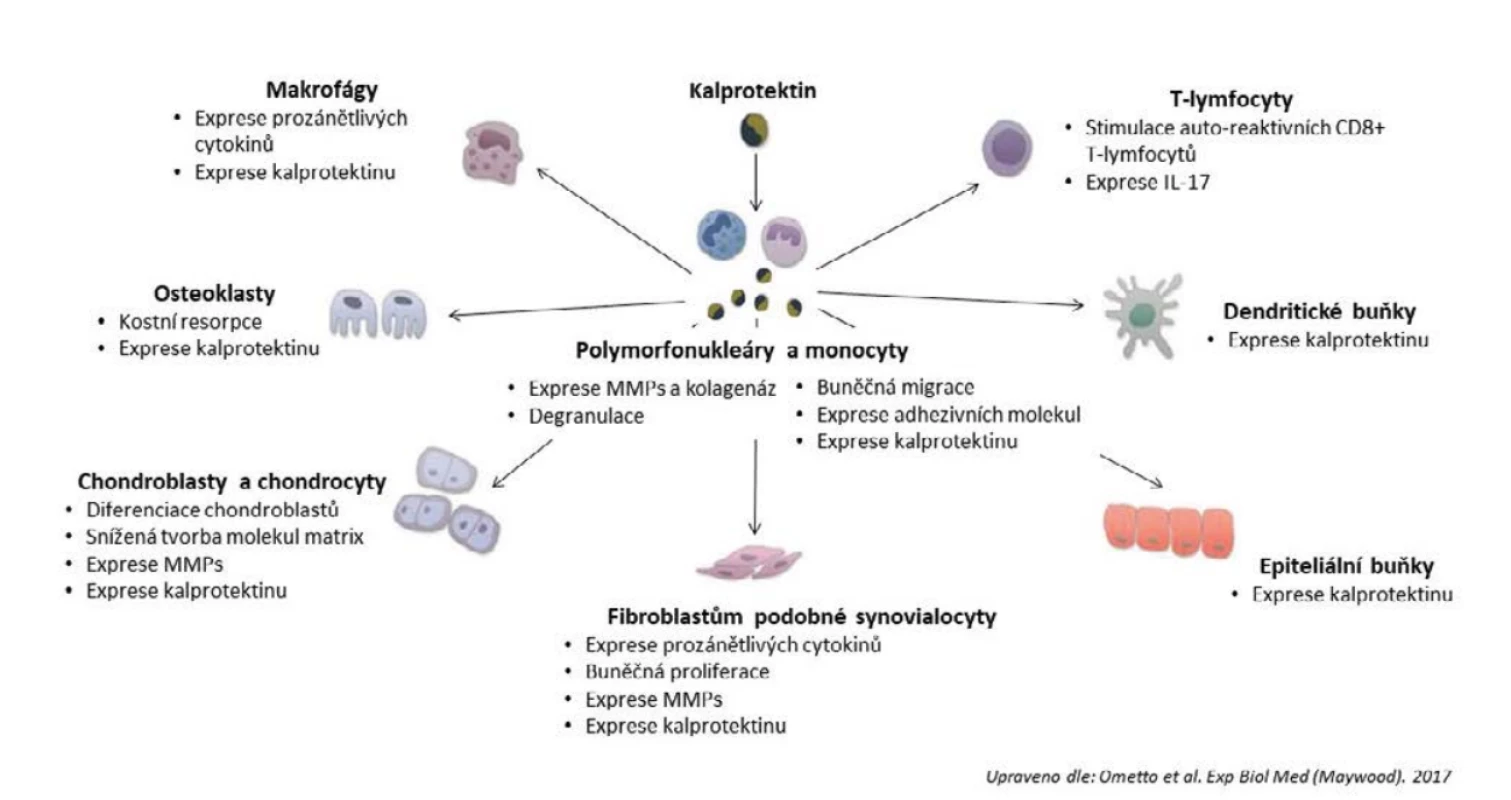
Kalprotektin je produkovaný zejména aktivovanými polymorfonukleáry a monocyty, ale i dalšími buňkami. Řídí produkci prozánětlivých cytokinů a chemokinů, buněčnou aktivaci a apoptózu. Kalprotektin stimuluje produkci dalšího kalprotektinu a tím vytváří pozitivní smyčku (41). IL-17 – interleukin-17, MMPs – matrixové metaloproteinázy VYUŽITÍ KALPROTEKTINU JAKO BIOMARKERU U REVMATOIDNÍ ARTRITIDY
Několik studií ukázalo, že hladina kalprotektinu je vyšší u pacientů s RA ve srovnání se zdravými kontrolami, pacienty s osteoartrózou (OA), psoriatickou artritidou (PsA), spondyloartritidou (SpA) či dnavou artritidou (11, 22). Průměrná koncentrace kalprotektinu v synoviální tekutině RA pacientů byla více než 100násobně vyšší jako u pacientů s OA a více než dvojnásobně vyšší jako u pacientů s jiným zánětlivým onemocněním kloubů (PsA, SpA, dna). Také hladina kalprotektinu v plazmě u RA pacientů byla téměř 10násobně vyšší ve srovnání s hladinou u pacientů s OA a více než dvojnásobně vyšší než u PsA, SpA či dny (22). Hladiny sérového kalprotektinu významně korelují s klinickými příznaky, laboratorními parametry zánětu i aktivitou onemocnění. Z klinických příznaků byla pozorována pozitivní asociace mezi kalprotektinem a počtem oteklých kloubů (r = 0,2 až 0,5; p < 0,001) i počtem palpačně bolestivých kloubů v několika studiích (10, 12, 22). Dále pak byla popsána korelace mezi hladinou kalprotektinu a sílou stisku ruky (r = –0,22; p < 0,05) (23) (tab. 1). Z laboratorních parametrů hladina kalprotektinu pozitivně koreluje s C-reaktivním proteinem (CRP) (r = 0,6–0,8; p < 0,001), sedimentací erytrocytů (FW) (r = 0,5–0,7; p < 0,001) (10, 12, 24). Z těchto údajů vyplývá, že hladina kalprotektinu je asociována s aktivitou onemocnění, což podporuje i pozitivní korelace s indexem aktivity onemocnění Disease Activity Score-28 (DAS-28 FW/CRP) (r = 0,3–0,6; p < 0,001), s indexem klinické aktivity onemocnění Clinical Disease Activity Index (CDAI) (r = 0,3; p < 0,001) a zjednodušeným indexem klinické aktivity Simplified Disease Activity Index (SDAI) (r = 0,3; p < 0,001) (10, 12, 22, 24). Dokonce bylo popsáno, že kalprotektin koreluje lépe s aktivitou onemocnění než s CRP či FW (12, 25–27). U pacientů se střední až vysokou aktivitou onemocnění a nízkým CRP byla hladina kalprotektinu signifikantně vyšší než u pacientů v remisi a nízkým CRP (28). Korelace kalprotektinu s klinickými a laboratorními parametry aktivity RA je shrnuta v tabulce 1. Dále je pozorován vztah k autoprotilátkám typickým pro RA. Pozitivní korelace s RF (r = 0,2–0,6; p < 0,05–0,001) je potvrzena několika studiemi (9, 12, 29), avšak vztah mezi hladinami kalprotektinu a ACPA není jednoznačný (9, 12, 30). Mimo jiné hladina kalprotektinu koreluje i s ultrasonograficky (US) detekovanou synovitidou, radiografickým postižením a radiografickou progresí kloubů. Ultrasonograficky detekovaná synovitida je obvykle hodnocena semikvantitativně (0 až 3) na šedé škále (grey scale – GS) i na škále Dopplerovského mapování (power Doppler – PD). Pozitivní korelace mezi kalprotektinem a GS (r = 0,4–0,5; p < 0,05–0,001) i PD (r = 0,4–0,5; p < 0,05–0,001) byla opět doložena několika studiemi (12, 30, 31). Bylo dokonce prokázáno, že kalprotektin lépe koreluje se synovitidou v PD módu než CRP. Další dvě studie srovnávaly míru korelace mezi markery zánětu (kalprotektin, CRP, FW, sérový amyloid A, S100A12, IL-6, vascular endothelial growth factor (VEGF)) a US-synovitidou (GS, PD). Z uvedených markerů zánětu nejlépe koreluje kalprotektin s GS i PD synovitidou (26, 32). Pomocí kalprotektinu lze rozlišit pacienty v klinické (DAS-28 < 2,6; SDAI ≤ 3,3; CDAI ≤ 2,8) a US-definované remisi (GS 0 ± 1 and PD 0) od pacientů v klinické remisi s přetrvávající subklinickou aktivitou dle US (33). Poškození kloubů můžeme hodnotit na základě klinického skóre poškození kloubů u RA, RA Articular Damage score (RAAD) nebo radiograficky pomocí Sharpova skóre modifikovaného podle van der Heijdové (34, 35). U RAAD skóre se hodnotí 35 kloubů, které jsou známkované od 0 do 2 (0 – bez známek nevratného poškození; 1 – částečné poškození; 2 – závažné poškození, ankylóza, kloubní náhrada) (35). Radiografické postižení hodnocené pomocí modifikovaného Sharpova skóre je součet erozí a zúžení kloubních štěrbin, které dosahuje hodnot 0 až 280 (34). Kalprotektin dosahuje vysoce signifikantní korelace s RAAD skóre (r = 0,4; p < 0,001) i modifikovaným Sharpovým skóre (r = 0,4; p < 0,001). Hladiny CRP ani FW dle této studie neukázaly signifikantní vztah ke skóre poškození kloubů (13). V další studii byla hodnocena radiografická progrese po 2 letech pomocí modifikovaného Sharpova skóre. Radiografická progrese byla definovaná jako změna v skóre ≥ dvě jednotky za 2 roky. Vysoké hladiny kalprotektinu (odds ratio; OR = 6,1), CRP (OR = 2,9) a FW (OR = 3,7) předpověděly progresi radiografického poškození, avšak jediný kalprotektin byl nezávislým prediktorem radiografické progrese (OR = 3,7) v analýze zahrnující CRP, FW, ACPA a demografické parametry (24). V podobné studii se hodnotila radiografická progrese po 10 letech, kde byl kalprotektin opět nezávislým prediktorem radiografické progrese (29). V neposlední řadě některé práce ukázaly, že hladina sérového kalprotektinu může být prediktivní k terapeutické odpovědi (hodnoceno dle kritérií odpovědi European League Against Rheumatism – EULAR) a změna hladiny kalprotektinu může být dále využita i k monitorování odpovědi na léčbu (14, 36). Do studie s methotrexátem byli zahrnuti pacienti s aktivní RA (DAS-28 > 3,2), naivní na léčbu chorobou modifikujícími antirevmatickými léky (Disease-modifying antirheumatic drugs – DMARDs). Vstupní hladina sérového kalprotektinu byla u pacientů s odpovědí na léčbu signifikantně vyšší ve srovnání s pacienty bez odpovědi (24 µg/ml vs. 9,6 µg/ml; p = 0,003) (37). Další práce hodnotily prediktivní hodnotu kalprotektinu k odpovědi na léčbu biologickými DMARDs (bDMARDs). Choi ve své studii ukázal kalprotektin jako velmi slibný prediktivní biomarker. Vstupně před zahájením léčby měli pacienti s dobrou odpovědí na terapii adalimumabem (1,1 µg/ml vs. 0,7 µg/ml; p = 0,01), infliximabem (2,7 µg/ml vs. 1,2 µg/ml; p = 0,001) a rituximabem (2,8 µg/ml vs. 1,1 µg/ml; p < 0,001) signifikantně vyšší hladinu sérového kalprotektinu ve srovnání s pacienty bez odpovědi na léčbu (14). V jiné studii s bDMARDs (adalimumab, infliximab, etanercept, rituximab, golimumab, certolizumab, abatacept, tocilizumab) se hodnotila prediktivní hodnota biomarkerů (KLP, CRP, FW, S100A12, IL-6, VEGF) k odpovědi na léčbu. Jediný kalprotektin měl vstupně signifikantně vyšší sérovou hodnotu u pacientů s dobrou odpovědí ve srovnání s pacienty bez odpovědi (p = 0,03), navíc pokles hladiny kalprotektinu po 1 měsíci předpověděl odpověď na terapii po 3, 6 i 12 měsících (p < 0,001) (26). K poklesu hladiny sérového kalprotektinu dochází v odpovědi na terapii konvenčními i biologickými DMARDs (10, 27). Dokonce bylo popsáno, že kalprotektin je lepší v monitorování odpovědi na léčbu než CRP, FW či SAA (32) a je nezávislým prediktivním markerem relapsu u pacientů s RA a PsA (HO = 2,4; p = 0,002). U pacientů v remisi či s nízkou aktivitou onemocnění, u kterých později došlo k relapsu, byla hladina kalprotektinu před zahájením léčby vyšší ve srovnání s pacienty, kteří byli nadále v remisi (38). Na rozdíl od fekálního kalprotektinu, který se v dnešní době běžně využívá v diagnostice a monitoraci aktivity idiopatických střevních zánětů, se stanovení hladiny sérového kalprotektinu u revmatických onemocnění v běžné klinické praxi zatím nevyužívá (39). I když jedna práce navrhla mezní hodnotu sérového kalprotektinu 900 ng/ml k odlišení pacientů se zánětlivou artritidou (RA, PsA, SpA) od pacientů s nezánětlivou artropatií se senzitivitou 95 % a specificitou 82 % (40), je nutná validace těchto hodnot ve velkých kohortách pacientů se zánětlivými nemocemi odlišného původu i nezánětlivými onemocněními včetně zdravých kontrol.
Tab. 1. Korelace sérové hladiny kalprotektinu a aktivity onemocnění 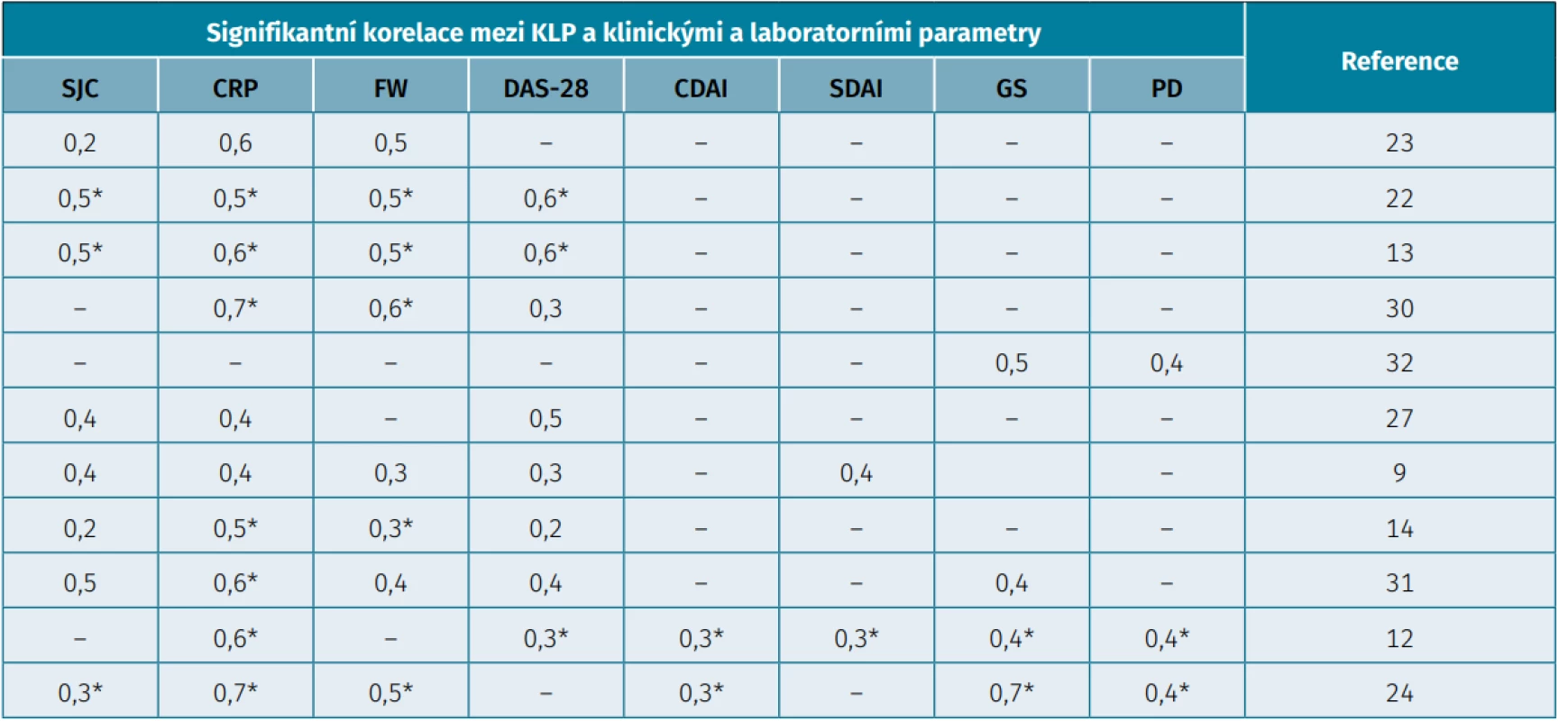
*p < 0,001 CDAI – index klinické aktivity onemocnění (Clinical Disease Activity Index), CRP – C-reaktivní protein, DAS-28 – index aktivity onemocnění (Disease Activity Score-28), FW – sedimentace erytrocytů, GS – šedá škála (grey scale), KLP – kalprotektin, PD – power Doppler, SDAI – zjednodušený index klinické aktivity (Simplified Disease Activity Index), SJC – počet palpačně oteklých kloubů (swollen joint count) ZÁVĚR
Kalprotektin je u pacientů s RA produkován zejména lokálně v místě zánětu v postiženém kloubu, kde se podílí na patogenezi onemocnění, a difuzí je pak uvolňován do cirkulace, kde může být detekován a využit jako solubilní biomarker. Kalprotektin se jeví jako lepší ukazatel klinické aktivity RA než klasicky využívané reaktanty akutní fáze, umožňuje detekovat pacienty s přetrvávající subklinickou aktivitou, je prediktivním faktorem radio rafického postižení a rentgenové progrese, terapeutické odpovědi a relapsu onemocnění. Jeho sérové hladiny u pacientů s RA jsou vyšší než u jiných zánětlivých revmatických onemocnění s potenciálním využitím v diferenciální diagnostice a v běžné klinické praxi jako je tomu u jiných zánětlivých onemocnění.
Adresa pro korespondenci:
MUDr. Nora Petrovská
Revmatologický ústav
Na Slupi 4
128 50
Praha
e-mail: petrovska@revma.cz
Autorky prohlašují, že nejsou v konfliktu zájmů.
Zdroje
- Gerlag DM, Raza K, van Baarsen LG, Brouwer E, Buckley CD, Burmester GR, et al. EULAR recommendations for terminology and research in individuals at risk of rheumatoid arthritis: report from the Study Group for Risk Factors for Rheumatoid Arthritis. Ann Rheum Dis 2012; 71(5): 638–641.
- Petrovska N, Prajzlerova K, Vencovsky J, Senolt L, Filkova M. The pre-clinical phase of rheumatoid arthritis: From risk factors to prevention of arthritis. Autoimmun Rev 2021; 20(5): 102797.
- Bustamante MF, Garcia-Carbonell R, Whisenant KD, Guma M. Fibroblast-like synoviocyte metabolism in the pathogenesis of rheumatoid arthritis. Arthritis Res Ther 2017; 19(1): 110.
- Foell D, Roth J. Proinflammatory S100 proteins in arthritis and autoimmune disease. Arthritis Rheum 2004; 50(12): 3762–3771.
- Eue I, Pietz B, Storck J, Klempt M, Sorg C. Transendothelial mi[1]gration of 27E10+ human monocytes. Int Immunol 2000; 12(11): 1593–1604.
- Sunahori K, Yamamura M, Yamana J, Takasugi K, Kawashima M, Yamamoto H, et al. The S100A8/A9 heterodimer amplifies proin[1]flammatory cytokine production by macrophages via activation of nuclear factor kappa B and p38 mitogen-activated protein ki[1]nase in rheumatoid arthritis. Arthritis Res Ther 2006; 8(3): R69.
- van Lent PL, Grevers L, Blom AB, Sloetjes A, Mort JS, Vogl T, et al. Myeloid-related proteins S100A8/S100A9 regulate joint inflammation and cartilage destruction during antigen-induced arthritis. Ann Rheum Dis 2008; 67(12): 1750–1758.
- Malemud CJ. Myeloid-related protein activity in rheumatoid arthritis. Int J Inflam 2011; 2011 : 580295.
- Garcia-Arias M, Pascual-Salcedo D, Ramiro S, Ueberschlag ME, Jermann TM, Cara C, et al. Calprotectin in rheumatoid arthritis: association with disease activity in a cross-sectional and a longi[1]tudinal cohort. Mol Diagn Ther 2013; 17(1): 49–56.
- Abildtrup M, Kingsley GH, Scott DL. Calprotectin as a biomar[1]ker for rheumatoid arthritis: a systematic review. J Rheumatol 2015; 42(5): 760–770.
- Mansour HE, Abdullrhman MA, Mobasher SA, El Mallah R, Abaza N, Hamed F, et al. Serum Calprotectin in Rheumatoid Arthritis: A Promising Diagnostic Marker, How Far Is It Related to Activity and Sonographic Findings? J Med Ultrasound 2017; 25(1): 40–46.
- Hurnakova J, Hulejova H, Zavada J, Hanova P, Komarc M, Mann H, et al. Relationship between serum calprotectin (S100A8/9) and clinical, laboratory and ultrasound parameters of disease activity in rheumatoid arthritis: A large cohort study. PLoS One 2017; 12(8): e0183420.
- Hammer HB, Odegard S, Fagerhol MK, Landewe R, van der Heijde D, Uhlig T, et al. Calprotectin (a major leucocyte protein) is strongly and independently correlated with joint inflammation and damage in rheumatoid arthritis. Ann Rheum Dis 2007; 66(8): 1093–1097.
- Choi IY, Gerlag DM, Herenius MJ, Thurlings RM, Wijbrandts CA, Foell D, et al. MRP8/14 serum levels as a strong predictor of response to biological treatments in patients with rheumatoid arthritis. Ann Rheum Dis 2015; 74(3): 499–505.
- Asif Amin M, Fox DA, Ruth JH. Synovial cellular and molecu[1]lar markers in rheumatoid arthritis. Semin Immunopathol 2017; 39(4): 385–393.
- Korndorfer IP, Brueckner F, Skerra A. The crystal structure of the human (S100A8/S100A9)2 heterotetramer, calprotectin, illustrates how conformational changes of interacting alpha-heli[1]ces can determine specific association of two EF-hand proteins. J Mol Biol 2007; 370(5): 887–898.
- Youssef P, Roth J, Frosch M, Costello P, Fitzgerald O, Sorg C, et al. Expression of myeloid related proteins (MRP) 8 and 14 and the MRP8/14 heterodimer in rheumatoid arthritis synovial membra[1]ne. J Rheumatol 1999; 26(12): 2523–2528.
- Baillet A, Trocme C, Berthier S, Arlotto M, Grange L, Chenau J, et al. Synovial fluid proteomic fingerprint: S100A8, S100A9 and S100A12 proteins discriminate rheumatoid arthritis from other inflammatory joint diseases. Rheumatology (Oxford) 2010; 49(4): 671–682.
- Newton RA, Hogg N. The human S100 protein MRP-14 is a novel activator of the beta 2 integrin Mac-1 on neutrophils. J Immunol 1998; 160(3): 1427–1435.
- Carrion M, Juarranz Y, Martinez C, Gonzalez-Alvaro I, Pablos JL, Gutierrez-Canas I, et al. IL-22/IL-22R1 axis and S100A8/A9 alar[1]mins in human osteoarthritic and rheumatoid arthritis synovial fibroblasts. Rheumatology (Oxford) 2013; 52(12): 2177–2186.
- Grevers LC, de Vries TJ, Vogl T, Abdollahi-Roodsaz S, Sloetjes AW, Leenen PJ, et al. S100A8 enhances osteoclastic bone resorp[1]tion in vitro through activation of Toll-like receptor 4: implica[1]tions for bone destruction in murine antigen-induced arthritis. Arthritis Rheum 2011; 63(5): 1365–1375.
- Drynda S, Ringel B, Kekow M, Kuhne C, Drynda A, Glocker MO, et al. Proteome analysis reveals disease-associated marker pro[1]teins to differentiate RA patients from other inflammatory joint diseases with the potential to monitor anti-TNF-alpha therapy. Pathol Res Pract 2004; 200(2): 165–171.
- Brun JG, Haga HJ, Boe E, Kallay I, Lekven C, Berntzen HB, et al. Calprotectin in patients with rheumatoid arthritis: relation to clinical and laboratory variables of disease activity. J Rheumatol 1992; 19(6): 859–862.
- Jonsson MK, Sundlisaeter NP, Nordal HH, Hammer HB, Aga AB, Olsen IC, et al. Calprotectin as a marker of inflammation in pati[1]ents with early rheumatoid arthritis. Ann Rheum Dis 2017; 76(12): 2031–2037.
- Inciarte-Mundo J, Ruiz-Esquide V, Hernandez MV, Canete JD, Cabrera-Villalba SR, Ramirez J, et al. Calprotectin more accurately discriminates the disease status of rheumatoid arthritis patients receiving tocilizumab than acute phase reactants. Rheumatology (Oxford) 2015; 54(12): 2239–2243.
- Nordal HH, Brokstad KA, Solheim M, Halse AK, Kvien TK, Hammer HB. Calprotectin (S100A8/A9) has the strongest associa[1]tion with ultrasound-detected synovitis and predicts response to biologic treatment: results from a longitudinal study of patients with established rheumatoid arthritis. Arthritis Res Ther 2017; 19(1): 3.
- Andres Cerezo L, Mann H, Pecha O, Plestilova L, Pavelka K, Vencovsky J, et al. Decreases in serum levels of S100A8/9 (calpro[1]tectin) correlate with improvements in total swollen joint count in patients with recent-onset rheumatoid arthritis. Arthritis Res Ther 2011; 13(4): R122.
- Hurnakova J, Hulejova H, Zavada J, Komarc M, Cerezo LA, Mann H, et al. Serum calprotectin may reflect inflammatory activity in patients with active rheumatoid arthritis despite normal to low C-reactive protein. Clin Rheumatol 2018; 37(8): 2055–2062.
- Hammer HB, Odegard S, Syversen SW, Landewe R, van der Heijde D, Uhlig T, et al. Calprotectin (a major S100 leucocyte pro[1]tein) predicts 10-year radiographic progression in patients with rheumatoid arthritis. Ann Rheum Dis 2010; 69(1): 150–154.
- Hammer HB, Haavardsholm EA, Kvien TK. Calprotectin (a ma[1]jor leucocyte protein) is associated with the levels of anti-CCP and rheumatoid factor in a longitudinal study of patients with very early rheumatoid arthritis. Scand J Rheumatol 2008; 37(3): 179–182.
- Hurnakova J, Zavada J, Hanova P, Hulejova H, Klein M, Mann H, et al. Serum calprotectin (S100A8/9): an independent predictor of ultrasound synovitis in patients with rheumatoid arthritis. Arthritis Res Ther 2015; 17 : 252.
- Hammer HB, Fagerhol MK, Wien TN, Kvien TK. The soluble bio[1]marker calprotectin (an S100 protein) is associated to ultraso[1]nographic synovitis scores and is sensitive to change in patients with rheumatoid arthritis treated with adalimumab. Arthritis Res Ther 2011; 13(5): R178.
- Hurnakova J, Hulejova H, Zavada J, Komarc M, Hanova P, Klein M, et al. Serum Calprotectin Discriminates Subclinical Disease Activity from Ultrasound-Defined Remission in Patients with Rheumatoid Arthritis in Clinical Remission. PLoS One 2016; 11(11): e0165498.
- van der Heijde D. How to read radiographs according to the Sharp/van der Heijde method. J Rheumatol 2000; 27(1): 261–263.
- Zijlstra TR, Bernelot Moens HJ, Bukhari MA. The rheumatoid arthritis articular damage score: first steps in developing a clini[1]cal index of long term damage in RA. Ann Rheum Dis 2002; 61(1): 20–23.
- van Gestel AM, Anderson JJ, van Riel PL, Boers M, Haagsma CJ, Rich B, et al. ACR and EULAR improvement criteria have comparable validity in rheumatoid arthritis trials. American College of Rheumatology European League of Associations for Rheumatology. J Rheumatol 1999; 26(3): 705–711.
- Patro PS, Singh A, Misra R, Aggarwal A. Myeloid-related Protein 8/14 Levels in Rheumatoid Arthritis: Marker of Disease Activity and Response to Methotrexate. J Rheumatol 2016; 43(4): 731 – 737.
- Inciarte-Mundo J, Ramirez J, Hernandez MV, Ruiz-Esquide V, Cuervo A, Cabrera-Villalba SR, et al. Calprotectin strongly and independently predicts relapse in rheumatoid arthritis and polyarticular psoriatic arthritis patients treated with tumor necrosis factor inhibitors: a 1-year prospective cohort study. Arthritis Res Ther 2018; 20(1): 275.
- Ricciuto A, Griffiths AM. Clinical value of fecal calprotectin. Crit Rev Clin Lab Sci 2019; 56(5): 307–320.
- Grossi V, Infantino M, Manfredi M, Meacci F, Bellio E, Bellio V, et al. A Proposed Serum Calprotectin IgG Cut-Off Level for Diagnosing Inflammatory Arthritis. Curr Rheumatol Rev 2017; 13(2): 93–97.
- Ometto F, Friso L, Astorri D, Botsios C, Raffeiner B, Punzi L, et al. Calprotectin in rheumatic diseases. Exp Biol Med (Maywood) 2017; 242(8): 859–873
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2021 Číslo 3- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Kterým pacientům se SLE nasadit biologickou léčbu?
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Baricitinib v léčbě revmatoidní artritidy v běžné klinické praxi – výsledky z Českého národního registru ATTRA
- Význam kalprotektinu v patogenezi revmatoidní artritidy a jeho využití jako biomarkeru
- Nemoc z ukládání krystalů kalcium pyrofosfátu (CPPD disease)
- Ošetřovatelský manuál pro perioperační péči pacienta se zánětlivými revmatickými nemocemi
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nemoc z ukládání krystalů kalcium pyrofosfátu (CPPD disease)
- Význam kalprotektinu v patogenezi revmatoidní artritidy a jeho využití jako biomarkeru
- Baricitinib v léčbě revmatoidní artritidy v běžné klinické praxi – výsledky z Českého národního registru ATTRA
- Ošetřovatelský manuál pro perioperační péči pacienta se zánětlivými revmatickými nemocemi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



