-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Baricitinib v léčbě revmatoidní artritidy v běžné klinické praxi – výsledky z Českého národního registru ATTRA
Baricitinib in the treatment of rheumatoid arthritis in routine clinical practice – results from the Czech National ATTRA Registry
Baricitinib is a new immunosuppressive drug for the treatment of rheumatoid arthritis (RA). It is a small molecule, specifically a JAK inhibitor, which intracellularly inhibits signal transduction and activation of proinflammatory cytokines. The authors conducted an open, retrospective study in the national ATTRA registry to obtain data from routine clinical practice with this drug in the Czech Republic. The study included 243 patients with a mean age of 44 years and a disease duration of 13 years. The initial activity was high with the mean CRP of 19.1 mg/L, the number of swollen joints of 8, and the DAS 28 of 5.6. After one year of treatment, there was a significant decrease in all indicators of activity. Remission was achieved in about 39.3% of patients and low activity (assessed by DAS 28) in about 68.8% of patients. Retention on treatment was 71.8% after 12 months. All components of quality of life have improved significantly. Furthermore, some predictive factors of achieving a state of low activity or remission were evaluated. Patients receiving baricitinib as the third biological or targeted synthetic DMARD have been shown to have a worse response than patients with earlier use of baricitinib. Specifically, a statistically significant difference was found compared to the first line. There was also worse retention on the drug. Another predictive factor for remission evaluated at the start of treatment was concomitant MTX treatment, which was not predictive of remission or persistence in remission. Another predictive factor for remission and low activity at the beginning of treatment was the initial level of disease activity. Patients with moderate activity had a significantly lower DAS 28 after three months of treatment than patients with high activity at baseline, but after 12 months, this difference was no longer significant. In conclusion, baricitinib is an effective tsDMARD in the treatment of RA in monotherapy and in combination with MTX. There is a better chance of achieving remission after the failure of MTX and two bDMARDs; after the failure of the third and other bDMARDs the chance of achieving remission is lower.
Keywords:
rheumatoid arthritis – biological treatment – baricitinib
Autoři: K. Pavelka 1; Z. Křístková 2; L. Nekvindová 2,3
Působiště autorů: Revmatologický ústav, Praha 1; Institut biostatistiky a analýz, s. r. o. 2; 1. lékařská fakulta Univerzity Karlovy, Praha 3
Vyšlo v časopise: Čes. Revmatol., 29, 2021, No. 3, p. 133-143.
Kategorie: Originální práce
Souhrn
Baricitinib je nový imunosupresivní lék pro léčbu revmatoidní artritidy (RA). Jde o malou molekulu, konkrétně inhibitor JAK, který intracelulárně inhibuje signální transdukci a aktivaci prozánětlivých cytokinů. Autoři provedli otevřenou, retrospektivní studii v národním registru ATTRA, aby získali data z běžné klinické praxe s tímto lékem v České republice. Ve studii bylo zařazeno 243 pacientů s průměrným věkem 44 let a trváním nemoci 13 let. Iniciální aktivita byla vysoká, když průměrné CRP bylo 19,1 mg/l, počet oteklých kloubů 8 a DAS 28 5,6. Po roce léčby došlo k signifikantnímu poklesu všech ukazatelů aktivity. Remise bylo docíleno asi u 39,3 % pacientů a stavu nízké aktivity (hodnoceno DAS 28) asi u 68,8 % pacientů. Retence na léčbě byla 71,8 % po 12 měsících. Výrazně se zlepšily všechny komponenty kvality života. Dále byly vyhodnoceny některé prediktivní faktory dosažení stavu nízké aktivity nebo remise. Bylo prokázáno, že u pacientů, kteří dostávají baricitinib jako třetí biologický či cílený DMARD, dochází k horší odpovědi než u pacientů s dřívějším nasazením. Statisticky významný rozdíl byl nalezen oproti první linii konkrétně. Rovněž tak byla horší retence na léku. Dalším vyhodnoceným prediktivním faktorem na začátku léčby k dosažení remise byla současná léčba MTX, která neměla prediktivní význam pro dosažení remise, ani pro setrvání na léčbě. Dalším hodnoceným prediktivním faktorem remise a stavu nízké aktivity na začátku léčby byla iniciální výška aktivity. Pacienti se střední aktivitou měli po 3 měsících léčby signifikantně nižší DAS 28 než pacienti s vysokou aktivitou na začátku, ale po 12 měsících již tento rozdíl nebyl signifikantní. Závěrem lze říci, že baricitinib je účinným bDMARD v léčbě RA v monoterapii i v kombinaci s MTX. Větší šanci na dosažení remise je po selhání MTX a dvou bDMARDs, při selhání třetího a dalších bDMARDs je již šance nižší.
Klíčová slova:
biologická léčba – revmatoidní artritida – baricitinib
ÚVOD
Biologické chorobu modifikující léky revmatoidní artritidy (bDMARD) přinesly před 20 lety revoluční změnu do léčby revmatoidní artritidy (RA). Velmi efektivně potlačují zánětlivou aktivitu, snižují počet oteklých a citlivých kloubů, zmírňují symptomy nemoci, zlepšují nebo alespoň udržují funkční schopnosti a kvalitu života a zpomalují strukturální progresi RA (1). Paralelně se zavedením bDMARD byly navrženy a validizovány ukazatele aktivity a odpovědi na léčbu, které jednak umožnily objektivnější a přesnější hodnocení aktivity RA a jednak vznik strategií a algoritmů léčby, z nichž nejdůležitější je princip léčba k cíli (treat-to-target T2T) (2). Základním principem konceptu T2T je dosažení remise nebo alespoň stavu nízké aktivity (low disease activity – LDA) u každého pacienta s RA. Užitečnost principu T2T byla ověřena v četných klinických studiích i observačních kohortových studiích, nicméně diskuze o nejvhodnější definici remise a LDA a proveditelnosti a adherenci k T2T v běžné klinické praxi přetrvávají. Dále se ukazuje, že v běžné klinické praxi v registrech biologické léčby docílí trvalé remise pouze 30–50 % pacientů, což ukazuje určité limity dostupné účinnosti v současné době registrovaných bDMARD a oprávněnosti hledání nových DMARD i s jiným mechanismem účinku. Dalšími limity bDMARD je jejich imunogenicita, tzn. vznik protilátek proti léku, které může snižovat účinné hladiny léku a být příčinou nežádoucích účinků. Další nevýhodou bDMARD je nutnost parenterální aplikace a riziko lokálních i systémových nežádoucích reakcí. Kromě ryze medicínských limitů biologické léčby existuje i problém ekonomický, protože bDMARD jsou i po snížení ceny a nástupu biosimilárních léků stále i vzhledem ke své vyšší výrobní ceně nákladné. Zcela novou třídu DMARD představují malé molekuly, které nejsou biologického původu, ale vznikají chemickou syntézou. Dostaly proto název cílené syntetické DMARD (targeted synthetic DMARD – tsDMARD). Registraci pro klinickou praxi získaly v současné době inhibitory Janusových kináz (JAK) nazývané JAK inhibitory nebo také Jakiniby (3). JAK jsou cytosolové enzymy z rodiny tyrosinkináz, které mají celou řadu biologických funkcí včetně aktivace zánětlivé kaskády v imunitních buňkách. V současné době je pro klinické použití schváleno pět JAK inhibitorů, a to tofacitinib, baricitinib, upadacitinib, filgotinib a peficitinib (4). V klinických studiích prokázaly lepší účinnost a srovnatelnou bezpečnost nebo dokonce lepší než TNF-inhibitory (5–7). JAK inhibitory jsou také účinné, když se podávají v monoterapii (8). V současných Doporučeních pro léčbu RA jsou JAK inhibitory uvedeny jak pro léčbu závažné, refrakterní RA, tak v první linii u pacientů s nepříznivými prognostickými faktory (9). Baricitinib je JAK inhibitor 1. generace, který inhibuje JAK1, JAK2 a slabě TYK2 (10). Baricitinib byl komplexně zkoušen ve fázi III. klinického zkoušení u celého spektra pacientů s RA. Jednalo se o studie MTX naivních (11), MTX selhávajících (6), csDMARD selhávajících (12) a TNF selhávajících (13, 14). Baricitinib byl zkoušen jak v monoterapii (11), tak v kombinaci s MTX (6), tak s csDMARD (12). Baricitinib prokázal robustní a rychlý účinek při ovlivnění symptomů RA, a zvláště při ovlivnění bolestivosti (14). Docházelo také ke zpomalení rentgenové progrese RA. Ve studii RA BEAM byl baricitinib v kombinaci s MTX účinnější než adalimumab v kombinaci s MTX (6). Zatím není dostatek zkušeností s hodnocením účinnosti a bezpečnosti baricitinibu v běžné klinické praxi. Důležitá data lze především získat z registrů biologické léčby. Český národní registr biologické léčby byl založen v roce 2002 a v současné době je do něj zařazeno více než 6071 pacientů s RA, a další větve registru zařazují pacienty s axiální spondyloartritidou (ax-SpA), psoriatickou artritidou a juvenilní idiopatickou artritidou. Cílem naší studie bylo dlouhodobé ověření setrvání na léčbě, klinické účinnosti a bezpečnosti baricitinibu v neselektované populaci národního registru.
METODOLOGIE
Do studie byli zařazeni pacienti s RA, kteří splňovali kritéria ČRS pro léčbu RA (15), tzn., kteří selhali na léčbě alespoň jedním csDMARD a byli stále aktivní. Prahová hodnota (úhradová) pro jejich aplikaci se v průběhu se v průběhu času měnila. Většinou byla DAS28 více než 5,1, ale za určitých podmínek i 3,2. Podávaná dávka byly 4 mg baricitinibu denně. Kromě obvyklých demografických a anamnestických ukazatelů kohorty pacientů byly hodnoceny následující ukazatele aktivity, funkce a kvality života: CRP, FW, DAS28, odpověď na léčbu dle EULAR, dosažení remise a LDA, přežívání na léčbě, HAQ, SF 36. Dále byly provedeny analýzy prediktivních faktorů účinnosti léčby, konkrétně porovnání účinnosti v jednotlivých liniích léčby, porovnání podle iniciální aktivity a podle komedikace. Linie léčby byly definovány jako první v případě tsDMARD a bDMARD naivní, dvě linie po selhání 1 bDMARD, tři linie po selhání 2 bDMARD a čtyři linie po selhání 3 a více bDMARD. Hodnocení bylo prováděno v tříměsíčních intervalech. Do studie byli zařazováni pacienti z národního registru ATTRA po podepsání informovaného souhlasu. Aktivita RA byla definována jako střední – MDA (DAS 28 3,2–5,1) a vysoká – HDA (DAS 28 > 5,1).
STATISTICKÉ VYHODNOCENÍ
Charakteristiky pacientů byly sumarizovány pomocí průměrů se směrodatnými odchylkami a mediánů s 5. a 95. percentilem v rámci spojitých parametrů. Kategoriální proměnné byly sumarizovány pomocí absolutních a relativních četností (tj. procent). Velikosti změn ve spojitých parametrech po 12 měsících od zahájení léčby byly testovány párovým Wilcoxonovým testem. Podskupiny pacientů byly v rámci spojitých proměnných porovnávány pomocí neparametrického Mannova-Whitneyho testu (v případě dvou skupin) či Kruskalova-Wallisova testu (v případě tří a více skupin). V rámci hodnocení tří a více skupin bylo následně provedeno párové porovnání pomocí Mannova-Whitneyho testu s Bonferroniho korekcí na mnohonásobné testování. Kategoriální proměnné byly mezi skupinami testovány pomocí Pearsonova chí-kvadrát testu (příp. Fisherova exaktního testu při nesplnění předpokladů). Retence na léčbě byla hodnocena pomocí Kaplanovy-Meierovy metody odhadu. Rozdíly v pravděpodobnosti setrvání na léčbě mezi porovnávanými skupinami pacientů byly testovány Log-rank testem. Poměr rizika na ukončení léčby byl odhadnut v rámci Coxova regresního modelu. Hladina statistické významnosti byla zvolena 5 %. Statistická analýza byla provedena v IBM SPSS Statistics 25.0 a R (verze 3.5.3).
VÝSLEDKY
Do studie bylo zařazeno celkem 274 pacientů, z nichž jako validních bylo hodnoceno 243 dospělých pacientů, kteří nebyli před vstupem do ATTRy léčeni a kteří měli vyplněné požadované parametry. Jednalo se o 202 žen a 41 mužů, průměrného věku při diagnóze 44 ± 12 let, trvání nemoci 13 ± 9 let, 77,8 % bylo RF pozitivních a 77,0 % anti-CCP pozitivních. V anamnéze užívalo v minulosti MTX 92,2 %, glukokortikoidy 91,8 % (tab. 1). Aktivita před zahájením léčby byla vysoká, když průměrné CRP bylo 19,1 ± 24,5 mg/l, FW 31,0 ± 23,5 mm/hod., počet oteklých kloubů 7,9 ± 4,9, citlivých kloubů 11,9 ± 6,0, globální hodnocení pacientem 63,9 ± 22,4 (škála 0 až 100) a DAS28 (5,6 ± 1,2). Jako současnou léčbu při zahájení léčby baricitinibem mělo jakékoliv csDMARD 62,1 % a 37,9 % bylo na monoterapii baricitinibem. Methotrexát mělo 47,7 %, leflunomid 10,3 % a sulfasalazin 3,3 %, glukokortikoidy 54,3 %. V první linii mělo baricitinib 25,1 %, ve druhé linii 22,2 %, ve třetí linii 20,2 % a ve čtvrté linii 32,5 % pacientů. Při hodnocení celé kohorty pacientů na baricitinibu byla retence na léku po 12 měsících odhadem 71,8 %. Důvodem přerušení léčby bylo v 31,8 % primární selhání, v 24,2 % sekundární selhání, v 18,2 % nežádoucí účinky, v 6,1 % smrt pacienta (obr. 1). Průměrný DAS28 poklesl z iniciální průměrné hodnoty 5,6 ± 1,2 na 3,0 ± 1,2 (p < 0,001) po 12 měsících léčby, remise (DAS28 < 2,6) bylo docíleno u 39,3 % a stavu nízké aktivity (DAS 28 < 3,2) v 68,8 % (obr. 2). Dobrá odpověď dle EULAR byla po 12 měsících léčby docílena v 67,2 %, střední ve 23,0 % a žádná v 9,8 %. Průměrné HAQ pokleslo z 1,6 ± 0,6 na 1,1 ± 0,7 (p < 0,001) (obr. 3). Došlo také k signifikantnímu zlepšení všech komponent kvality života hodnocených pomocí SF 36 (obr. 4). Dále byla provedena analýza, zda byl rozdíl v účinnosti baricitinibu podle linie, ve které byl aplikován. Po 12 měsících léčby nebyl signifikantní rozdíl v hodnotě DAS28 mezi 1,2 a 3 a linií, ale značně vyšší byla hodnota DAS28 u 4. linie (p = 0,039), nicméně v párovém porovnání po Bonferroniho korekci nevyšel statisticky významný rozdíl mezi žádnou dvojicí linií. Což může být ale zapříčiněno malým počtem pacientů ve sledování po 12 měsících léčby (obr. 5). Retence na léku byla také výrazně horší, pokud byl baricitinib podáván ve 4. linii (p < 0,001). Další analýza se soustředila na fakt, jakým způsobem predikuje aktivita na začátku léčby účinnost. V této studii byla stejná retence na léčbě mezi MDA a HDA (obr. 6), rovněž tak v poklesu DAS28. Hodnoty DAS 28 byly signifikantně nižší u pacientů s MDA než s HDA po 3 měsících léčby (p = 0,003), ale na konci sledování ve 12 měsících se již nelišily (p = 0,19) (obr. 7). Třetí subanalýza řešila otázku, jakým způsobem ovlivňuje účinnost komedikace methotrexátem. Nebyl zjištěn žádný rozdíl v účinnosti baricitinibu v monoterapii oproti kombinaci s MTX, a to v poklesu DAS28 (p = 0,560), EULAR odpovědi (p = 1,000), docílení remise a stavu nízké aktivity (p = 0,093) (obr. 8). Nebyl pozorován rozdíl v retenci na léku (p = 0,636) (obr. 9).
Tab. 1. Charakteristika pacientů na začátku biologické léčby (N = 274, zahrnuto 243) 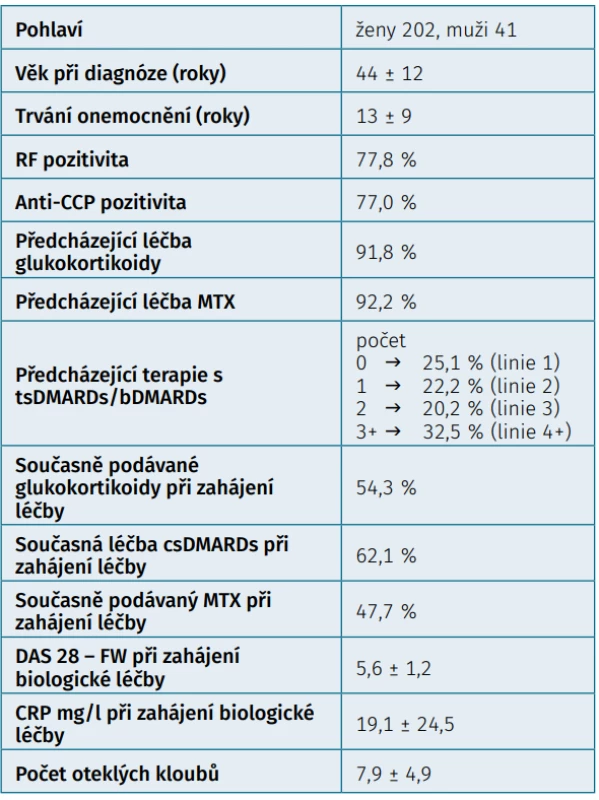
Obr. 1. Účinnost baricitinibu (Olumiant®): setrvání na léčbě a důvody k přerušení léčby 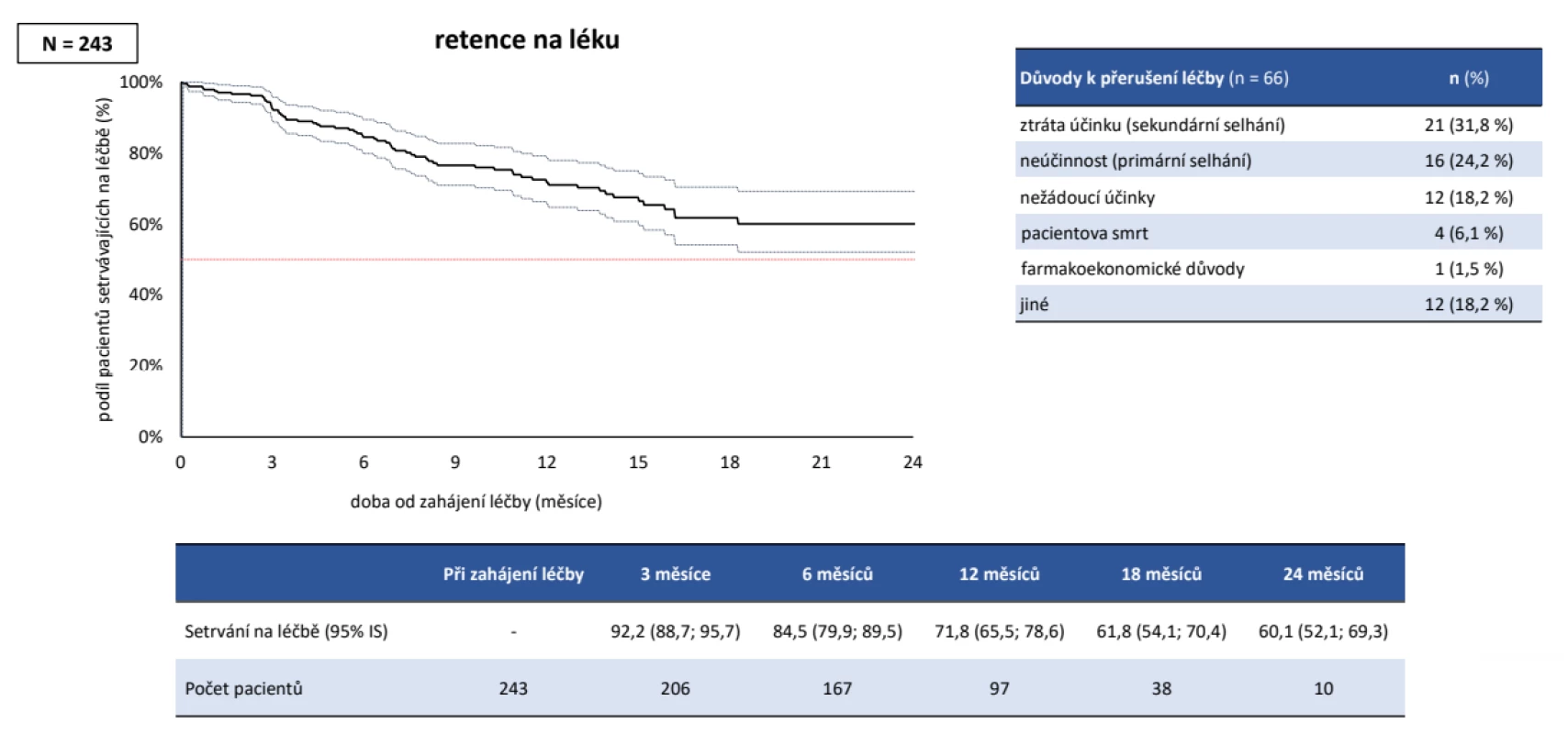
Obr. 2. Docílení remise nebo stavu nízké aktivity při léčbě Olumiantem v registru ATTRA 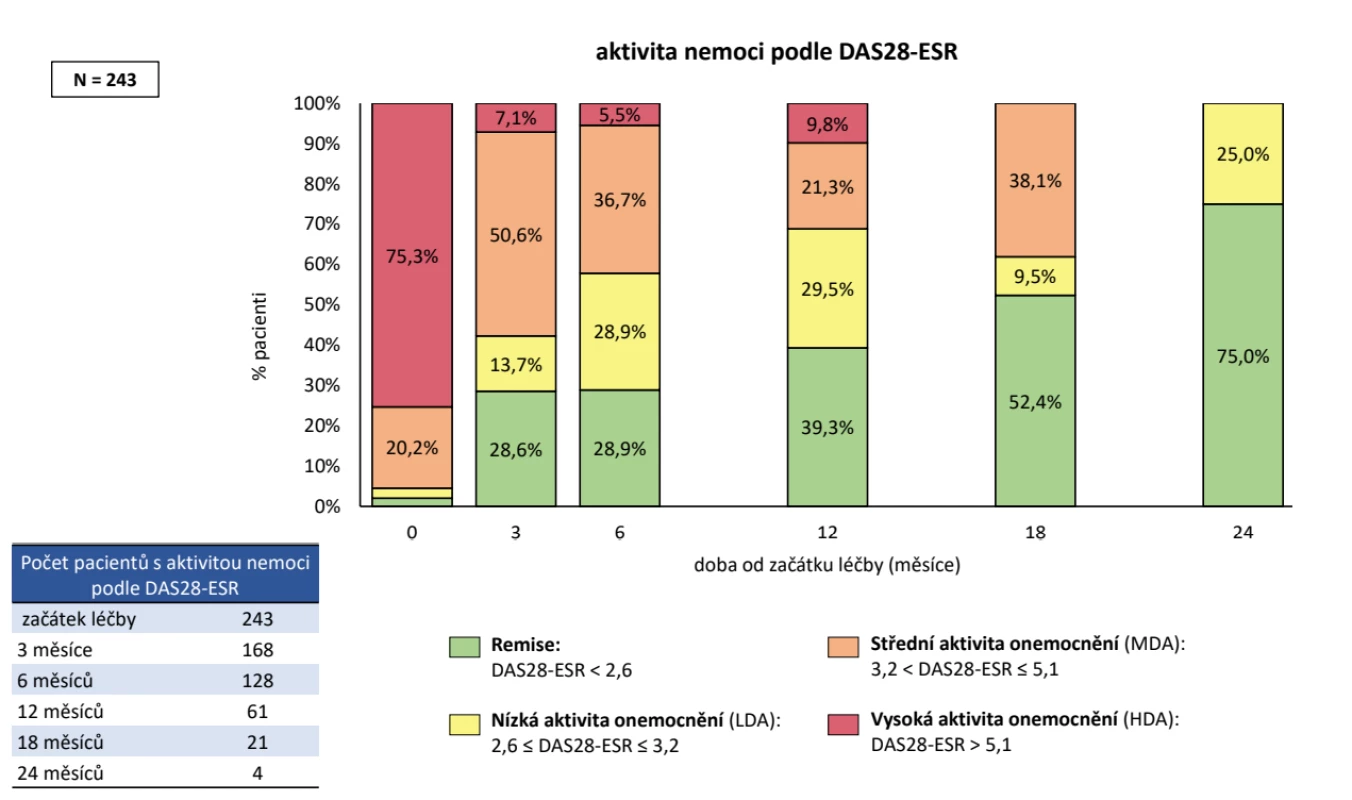
Obr. 3. Účinnost léčby baricitinibem (Olumiant®): hodnocení funkce (HAQ) 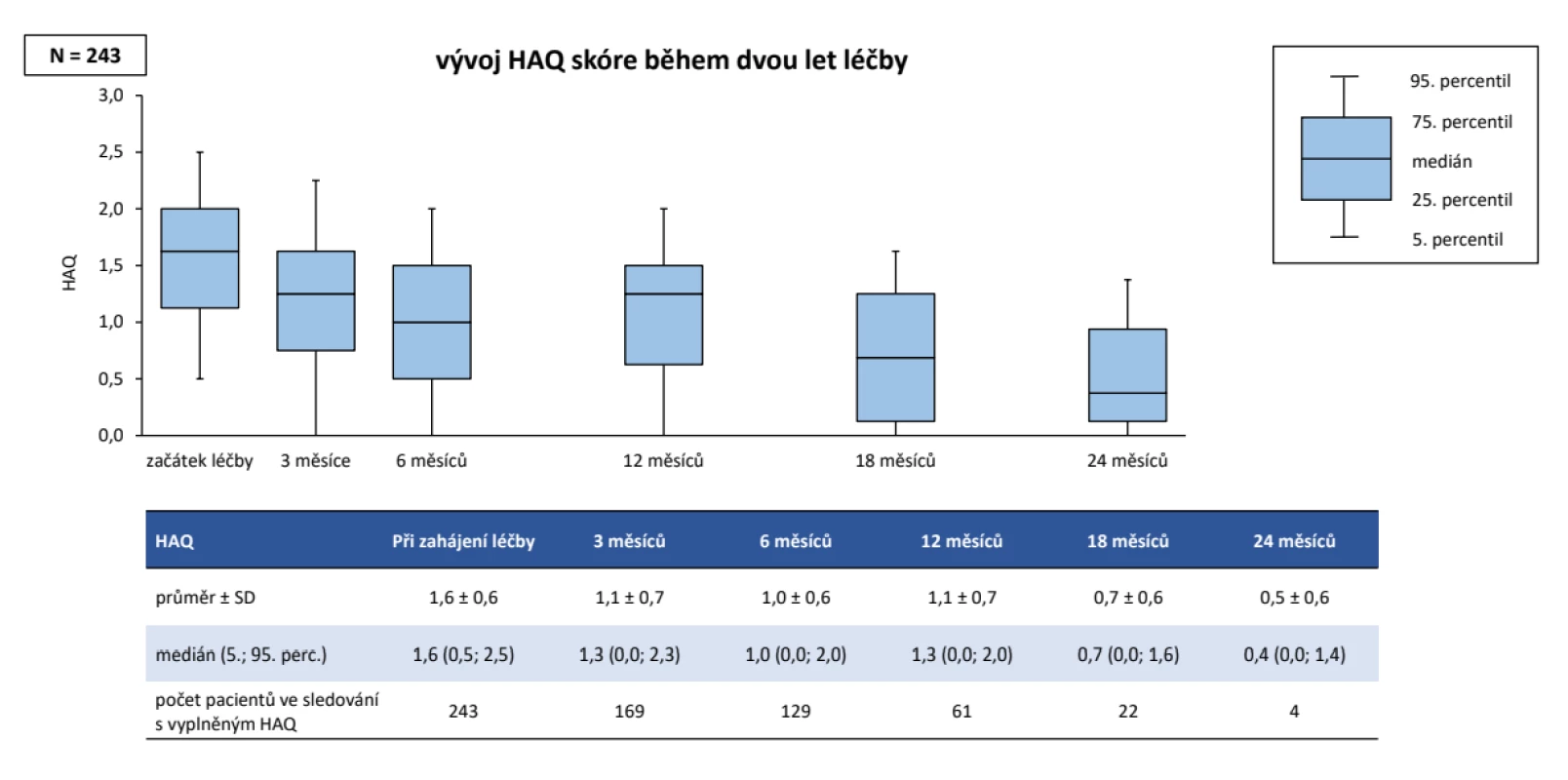
Obr. 4. Účinnost baricitinibu (Olumiant®): zlepšení kvality života (SF-36) během 2 let léčby 
Obr. 5. Účinnost baricitinibu (Olumiant®) podle linie léčby: pokles DAS28-ESR v průběhu 1. roku léčby 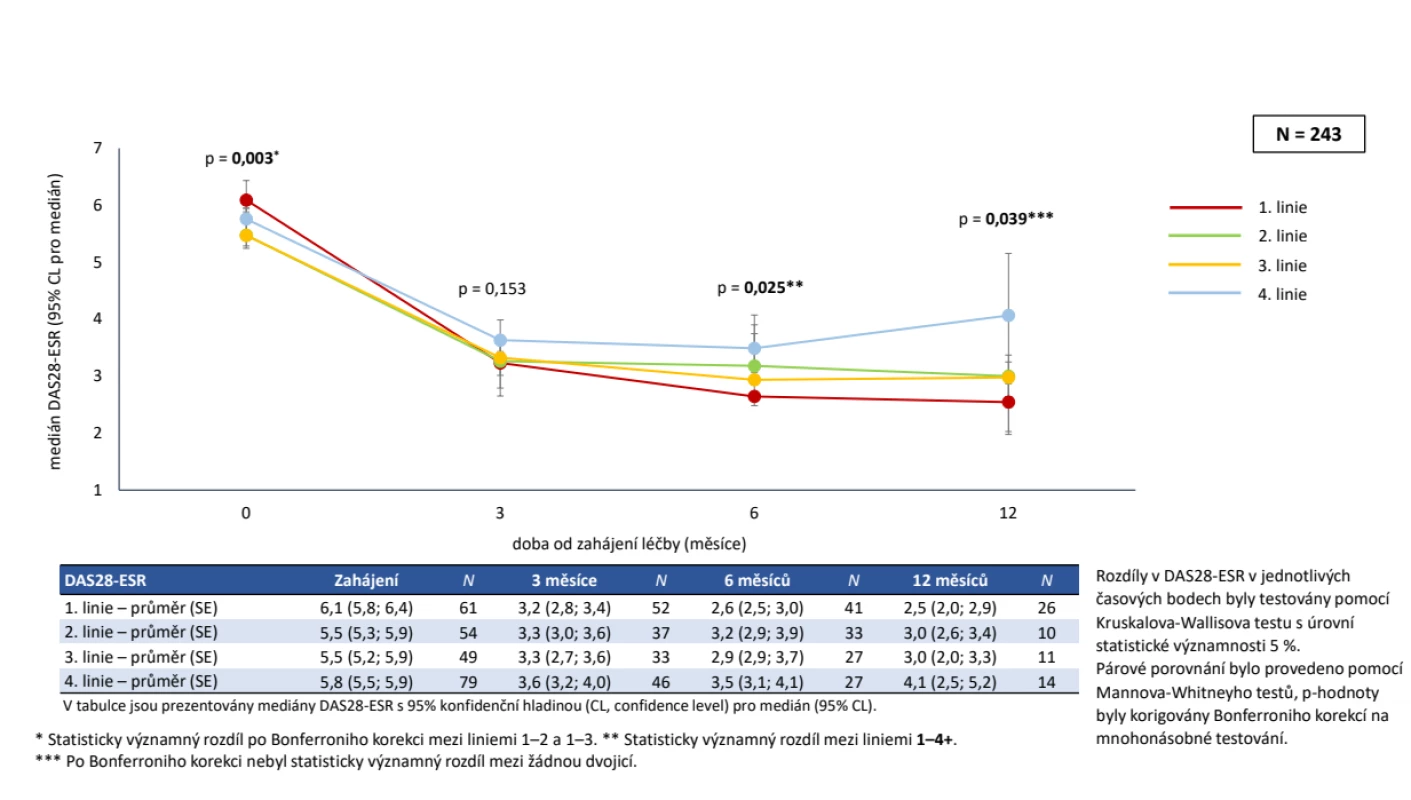
Obr. 6. Účinnost baricitinibu (Olumiant®) dle aktivity při zahájení léčby: setrvání na léčbě a důvody ukončení 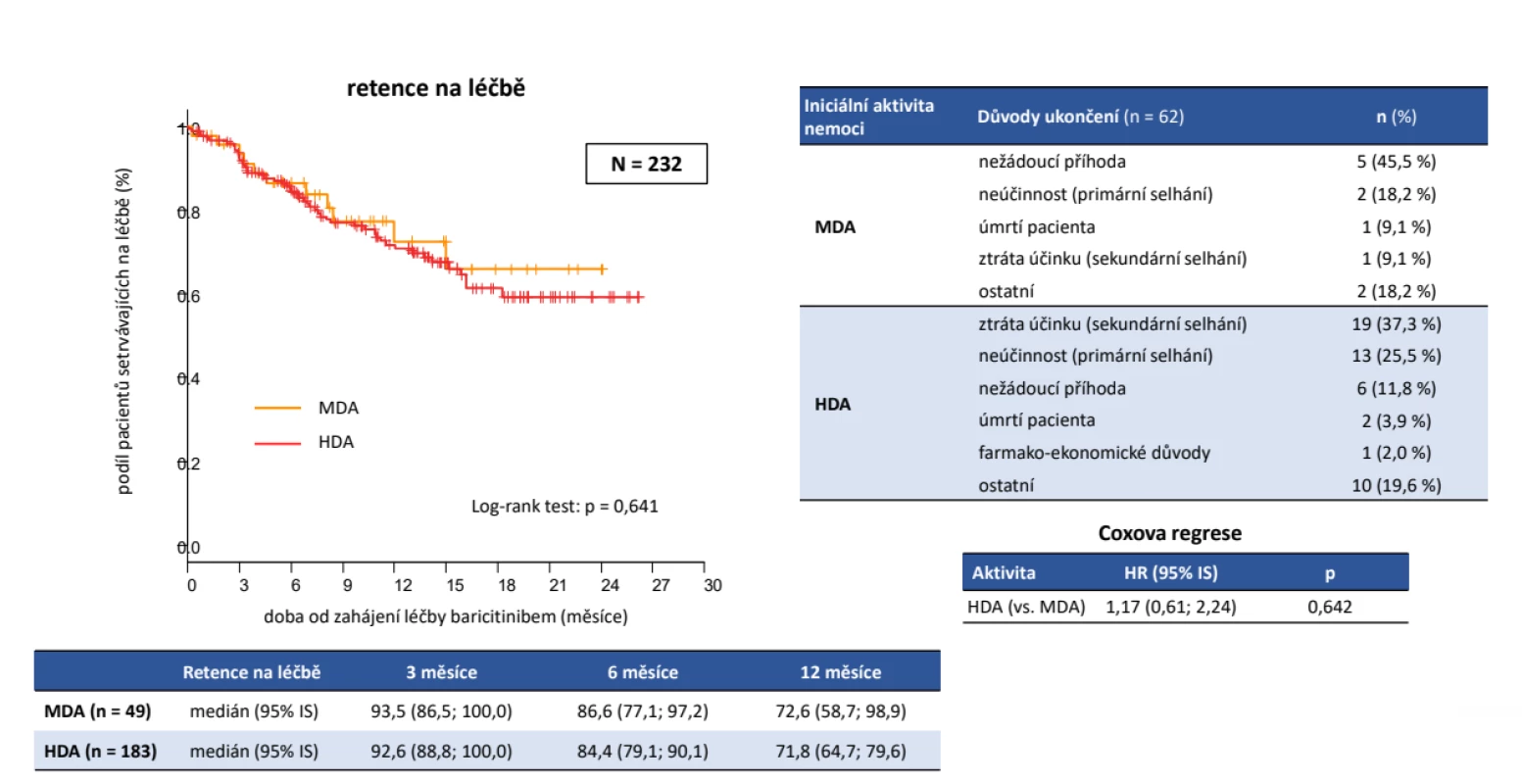
Obr. 7. Účinnost baricitinibu (Olumiant®) podle aktivity na začátku léčby: pokles DAS28-ESR během 1 roku léčby 
Obr. 8. Účinnost léčby baricitinibem (Olumiant®) podle komedikace MTX: dosažení remise a nízké aktivity onemocnění 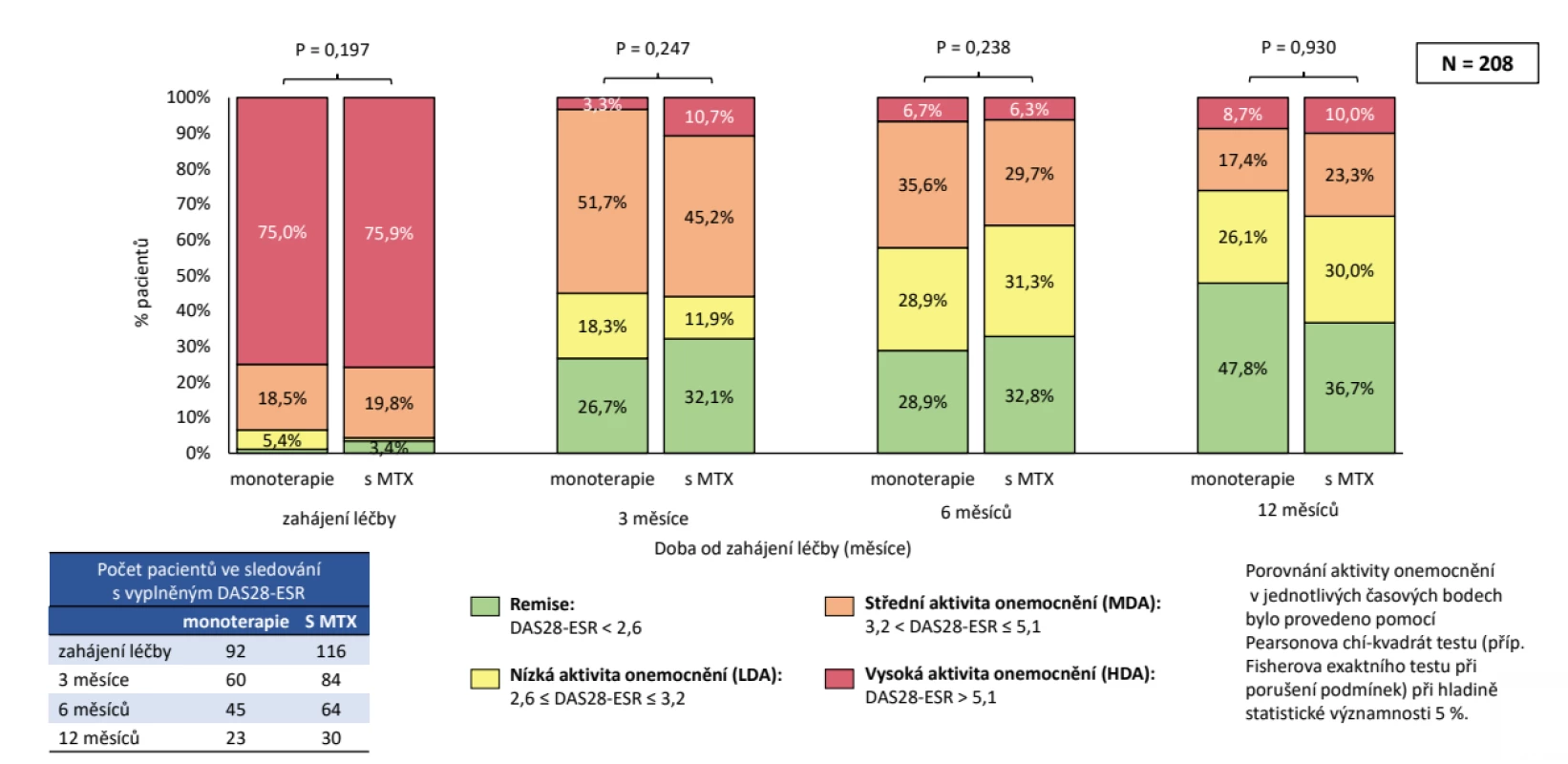
Obr. 9. Účinnost léčby baricitinibem (Olumiant®): setrvání na léčbě podle komedikace MTX 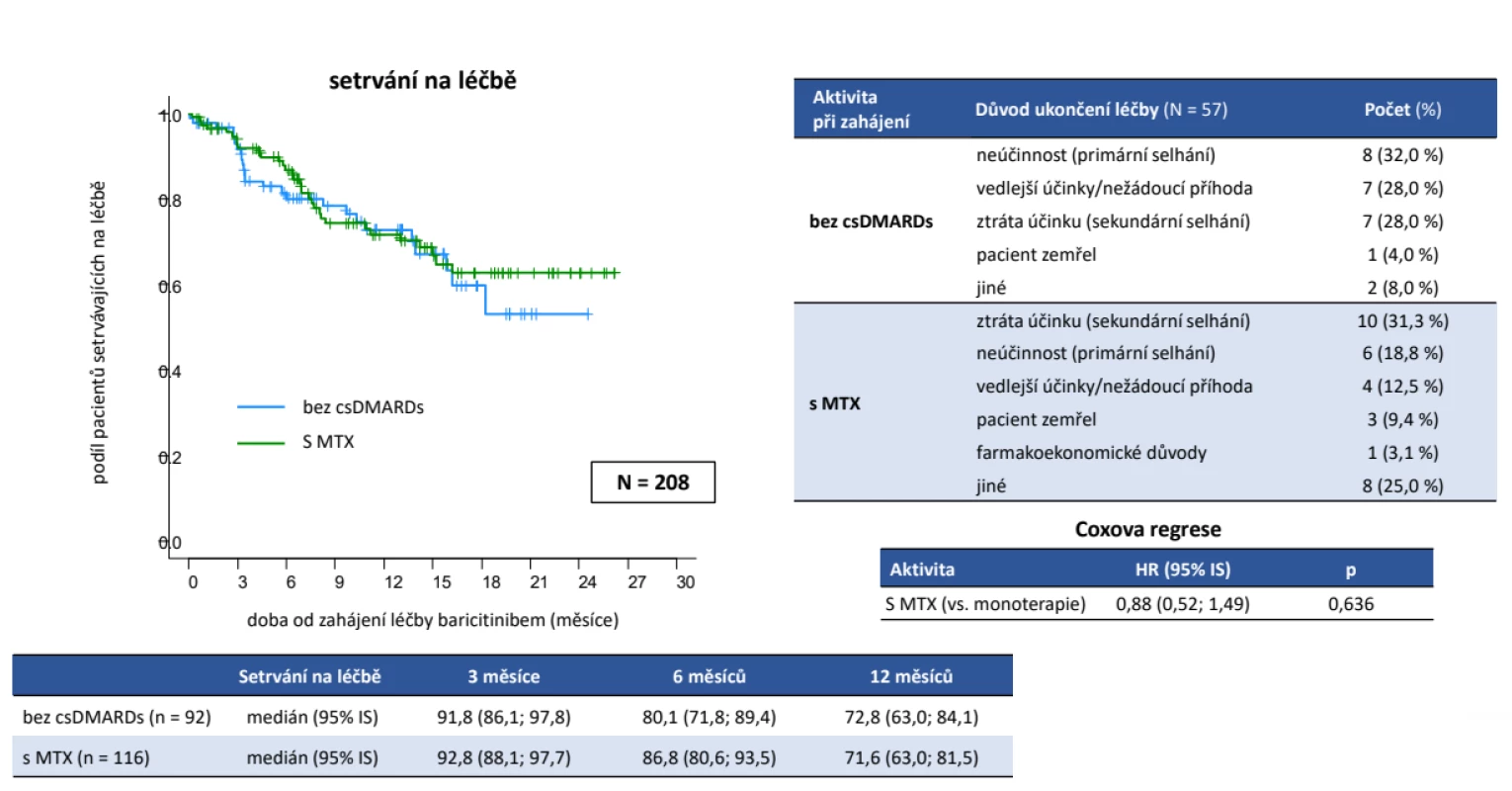
BEZPEČNOST LÉČBY
Sledováno bylo 243 pacientů, medián sledování byl 9,7 měsíců a celkem bylo hodnoceno 210 paciento-roků (tab. 2). Nejčastějšími nežádoucími účinky byly infekce. Vyskytlo se jedenáct závažných nežádoucích účinků, což dělá 5,2 na 100 paciento-roků. Jednalo se o tři kardiovaskulární nežádoucí účinky, dva nádory a jednu závažnou infekci. Celkově byla tolerance léčby dobrá a nevyskytly se žádné neočekávané nežádoucí účinky. V průběhu léčby čtyři pacienti zemřeli, přičemž žádné úmrtí nebylo dáváno do kauzální souvislosti s užíváním baricitinibu. DISKUZE V první části provedené analýzy byla hodnocena celá skupina na léčbě baricitinibem. Jako důležitý výsledek komplexního účinku léčby se u registrů uvádí retence na léčbě (někdy také nazývaná adherence k léčbě). Je to komplexní ukazatel obsahující jak vliv účinnosti, tak toxicity. V registru ATTRA byla retence na baricitinibu po 6 měsících 84,5 %, což je obdobné jako v japonské kohortové studii (86,5 %) (16). Po 12 měsících klesla retence na léčbu na 71,8 %. Lze to do jisté míry vysvětlit i skladbou populace. Šlo o pacienty s průměrným trváním nemoci 12 let a 53 % pacientů již mělo před zahájením léčby selhání 2 a více bDMARD a přirozeně také csDMARD. Při konceptu T2T je nejdůležitějším ukazatelem dosažení cíle léčby, tzn. buď remise, nebo alespoň stavu nízké aktivity (2). Při použití baricitinibu v naší studii bylo po 12 měsících dosaženo remise dle DAS28 FW ve 39,3 % pacientů a stavu LDA u necelých 68,8 % pacientů, což lze považovat vzhledem k charakteristikám sledované kohorty za velmi dobrý výsledek. Stavu LDA bylo dosaženo ve 42,3 % po 3 měsících a 57,8 % po 6 měsících. Toto nepřímo podporuje koncept T2T, který doporučuje ve 3 měsících hodnotit pouze odpověď, ale dosažení cíle a potenciální adjustace léčby až po 6 měsících. Na druhé straně je pravda, že po 6 měsících dosáhlo stavu nízké aktivity 57,8 % léčených pacientů, takže podle konceptu T2T a úhradových pravidel SÚKLu by pacientům, kteří nedocílili stavu LDA, měla být léčba adjustována, eventuálně pacienti switchovaní na jiný preparát, ale bohužel reálně praxet toto neukazuje. Ve druhé části analýzy byla provedena subanalýza podle několika ukazatelů. Je známo, že účinnost bDMARD i tsDMARD je nejlepší i na tuto léčbu naivních pacientů. Po selhání prvního bDMARD/tsDMARD je obvykle pacient switchován na druhý lék této kategorie. Efekt druhého bDMARD/tsDMARD je dobrý, ale horší než u prvního. To stejné lze říci o switchi z druhého na třetí bDMARD/tsDMARD. Řada studií však potvrdila, že účinnost po třetím a vyšším počtu bDMARD je již podstatně nižší. Setrvání na léčbě baricitinibem po 12 měsících léčby bylo signifikantně kratší ve čtvrté a vyšší linii než nižších liniích, např. ve srovnání s první linií jde o rozdíl výrazně signifikantní 50,7 % vs. 85,7 %, HR = 3,6 (1,8; 7,2). Pacienti ve čtvrté a vyšší linii léčby mají tedy 3,6krát vyšší riziko přerušení léčby než pacienti v linii první. Dle nových konceptů lze tyto pacienty zařadit určitě do skupiny pacientů označovaných jako obtížně léčitelných (difficult - -to-treat) (17). Druhá subanalýza se zabývala problematikou srovnání účinnosti baricitinibu v monoterapii a baricitinibu v kombinaci s MTX. V žádném ze sledovaných parametrů (setrvání na léčbě, pokles DAS28, odpověď dle EULAR, docílení remise a stavu nízké aktivity) nebyly zjištěny statistické rozdíly. Baricitinib byl v klinických studiích zkoušen jak v monoterapii (11), tak v kombinaci s MTX a csDMARD (6, 12). Má také indikaci pro léčbu středně těžké a těžké RA v monoterapii a v kombinaci s csDMARD. Dobrá účinnost v monoterapii může být také jednou z komparativních výhod celé skupiny JAK inhibitorů. Nicméně některá data ze studií s JAK inhibitory naznačují lepší účinnost kombinace JAK inhibitoru v kombinaci s MTX. V Doporučeních EULAR je také uvedeno, že pokud je pacient na léčbě MTX, kterou toleruje, ale má suboptimální efekt, doporučuje se léčbu MTX neukončovat, ale JAK inhibitor přidat (9). Třetí subanalýza se zabývala problematikou prahové hodnoty pro zahájení biologické a/nebo cílené léčby u revmatoidní artritidy. Podle Doporučení ČRS by měla být léčba biologickými či cílenými léky zahájena v případě selhání csDMARD (DAS28 > 3,2–5,1 střední aktivita MDA). V naší studii jsme potvrdili stejnou účinnost baricitinibu u stavu střední aktivity (MDA) jako u vysoké aktivity (HDA). Aplikace biologické cílené léčby je u stavu střední aktivity plně oprávněná, protože je prokázané, že pacienti ve stavu střední aktivity nadále rentgenově progredují a zhoršují se jejich funkční schopnosti. ZÁVĚR První observační studie s baricitinibem z registru ATTRA prokázala dobrý poměr účinnost/bezpečnost v běžné klinické praxi v České republice. Retence na léčbě byla po 12 měsících 71,8 % a dosažení stavu nízké aktivity (DAS 28 < 3,2) v 68,8 %. Bezpečnost léčby byla srovnatelná s výsledky s baricitinibem v randomizovaných studiích a neobjevily se žádné nové bezpečnostní signály. Současná aplikace MTX s baricitinibem nebyla v registru účinnější než monoterapie baricitinibem, což je v určitém rozporu s Doporučeními EULAR (9).
Tab. 2. Bezpečnost baricitinibu (Olumiant®): výskyt nežádoucích účinků (N = 243; medián follow-up (měsíce): 9,7; paciento-roky: 210,1) 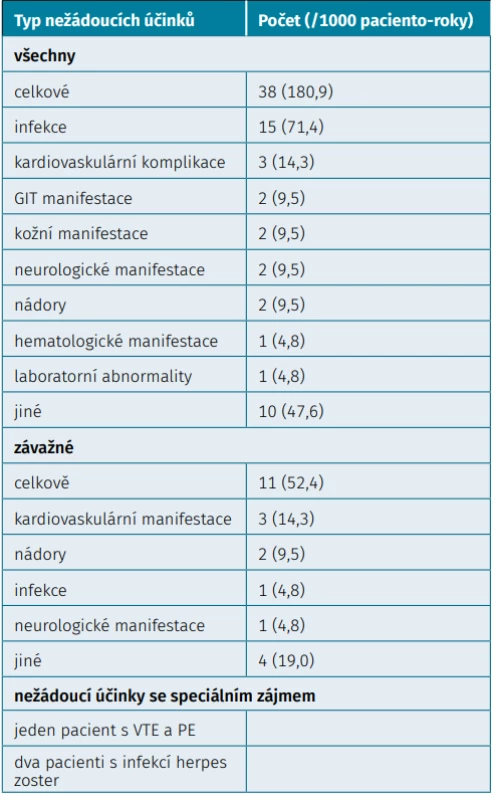
Adresa pro korespondenci:
prof. MUDr. Karel Pavelka,
DrSc. Revmatologický ústav Na Slupi 4 128 00 Praha 2
e-mail: pavelka@revma.cz
Autoři prohlašují, že nejsou v konfliktu zájmů.
Poděkování: Práce byla podpořena projektem koncepčního rozvoje Ministerstva zdravotnictví České republiky výzkumné organizace 00023728 Revmatologický ústav.
Zdroje
- Smolen J, Aletaha D, McInnes IB. Rheumatoid arthritis. Lancet 2016; 388/100055/2023_2038 http.doi.org/10.1016/ S0140_6736/16/301173-8
- Smolen JS, Aletaha D, Bijlsma JW, et al. Treating rheumatoid arthritis to target: Recommendation of an international task force. Ann Rheum Dis 2010; 69(4): 631–637.
- Yamaoka K. Janus kinase inhibitors for rheumatoid arthritis. Curr Opin Chem Biol 2016; 32 : 29–33.
- Angelini J, Tallota R, Roncato R, et al. JAK – Inhibitors for the treatment of rheumatoid arthritis: A focus on the present and an outlook on the future Biomolecules 2020; 10 : 1002. doi:10.3390/biom10071002
- Fleischmann R, Mysler E, Hall S, et al. Efficacy and safe[1]ty of tofacitinib monotherapy, tofacitinib with methotrexate and adalimumab with methotrexate in patients with rheuma[1]toid arthritis (ORAL STRATEGY): a phase 3b/4 double blind, head to head, randomised, controlled trial. Lancet 2017; 390 : 457–468.
- Taylor PC, Keystone EC, van der Heijde D, et al. Baricitinib versus placebo or adalimumab in rheumatoid arthritis. N Engl J Med 2017; 376 : 652–662.
- Fleischmann R, Pangan AL, Song IH, et al. Upadacitinib Versus Placebo or Adalimumab in Patients With Rheumatoid Arthritis and an Inadequate Response to Methotrexate: Results of a Phase III, Double-Blind, Randomized Controlled Trial. Arthritis Rheumatol 2019; 71(11): 1788–1800. doi:10.1002/art.41032 [Epub 2019 Aug 28].
- Taylor P. Clinical efficacy of a lunched JAK inhibitors in rheu[1]matoid arthritis. Rheumatology 2019; 58: i17–i26.
- Smolen J, Landewe RBM, Bijlsma JWK, et al. EULAR recommen[1]dations for the management of rheumatoid arthritis with synthetic and biological disease – modifying antirheumatic drugs, 2019 update. Ann Rheum Dis 2015. doi:10.1136/an[1]nrheumdis. 2019-216655
- Jamilloux Y, Jammal T, Vuiton L, et al. JAK inhibitors for the treatment of autoimmune and inflammatory diseases. Autoimmunity Reviews 2019; 18 : 102390. https://doi.or[1]g/10.1016/j.autrev.2019-102390
- Fleischmann R, Schiff M, van der Heijde D, et al. Baricitinib, methotrexate, or combination in patients with rheumatoid arthritis and no or limited prior disease-modifying antirheuma[1]tic drug treatment. Arthritis Rheum 2017; 69 : 506–517.
- Genovese MC, Kremer J, Zamani O, et al. Baricitinib in pa[1]tients with refractory rheumatoid arthritis. N Engl J Med 2016; 374 : 1243–1252.
- Dougados M, van der Heijde D, Chen YC, et al. Baricitinib in patients with inadequate response or intolerance to conventional synthetic DMARDs: results from the RA-BUILD study. Ann Rheum Dis 2017; 76 : 88–95.
- Smolen JS, Kremer JM, Gaich CL, et al. Patient-reported out[1]comes from a randomised phase III study of baricitinib in pa[1]tients with rheumatoid arthritis and an inadequate response to biological agents (RA-BEACON). Ann Rheum Dis 2017; 76 : 694–700.
- Šenolt L, Mann H, Závada J, Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro farmakote[1]rapii revmatoidní artritidy 2017. Čes. Revmatol. 2017; 1 : 8–24.
- Takahashi N, Asai S, Kobayakawa T, et al. Predictors for clinical effectiveness of baricitinib in rheumatoid arthritis pa[1]tients in routine clinical practice: data from a Japanese mul[1]ticenter registry. 2020. https://doi.org/10.1038/s41598-020 - 78925-8
- Nagy G, Rodenwijs MT, Welsing PM, et al. EULAR definition of difficult to treat rheumatoid arthritis. Ann Rheum Dis 2021; 80 : 31–35
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2021 Číslo 3- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Baricitinib v léčbě revmatoidní artritidy v běžné klinické praxi – výsledky z Českého národního registru ATTRA
- Význam kalprotektinu v patogenezi revmatoidní artritidy a jeho využití jako biomarkeru
- Nemoc z ukládání krystalů kalcium pyrofosfátu (CPPD disease)
- Ošetřovatelský manuál pro perioperační péči pacienta se zánětlivými revmatickými nemocemi
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nemoc z ukládání krystalů kalcium pyrofosfátu (CPPD disease)
- Význam kalprotektinu v patogenezi revmatoidní artritidy a jeho využití jako biomarkeru
- Baricitinib v léčbě revmatoidní artritidy v běžné klinické praxi – výsledky z Českého národního registru ATTRA
- Ošetřovatelský manuál pro perioperační péči pacienta se zánětlivými revmatickými nemocemi
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



