-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kloubní zánět a mikrobi na škále od mikrobiomu po septickou artritidu
Joint inflammation and microbes in scale from microbiome to septic arthritis
Essential relation of arthritis to microbial agent is not identical to usual conception of microbial infection, because abnormal microbiome may participate in pathway of joint pathology. Normal mucosal microbiome of digestive system (i. e. especially oral and intestinal) is a symbiotic part of „superorganism“ with host system, but sequential analysis of microbiotic DNA demonstrated oral/intestinal dysbiosis, important in pathway of autoimmunity, especially as „gut-joint“ axis in rheumatoid arthritis and celiac disease. On the contrary, dysbiosis should not be always a pathogenic phenomenon. For example, using a special manipulation with P. histocoli in humanized HLA DQ8+ mice model, the risk of arthritis was suppressed, and possibility of novel strategy in prophylaxis/therapy was proposed. This observation should be important in rheumatoid arthritis, because preclinical and early phases are „hot spots“ of this disease. In relation to reactive arthritis is actual, that especially enteropathic form is associated to HLA B27+ Ag, i. e. a typical biomarker of spondyloarthritis family. It appears in this connection, that namely Y. enterocolitica related reactive arthritis is actual in daily practice. Native (non-gonococcal) septic arthritis is persistently a serious emergency in rheumatology with ~ 30 % mortality in case of comorbid arthropathy; augmented frequency of this disorder in gout (acute gouty attacks, periarticular urate deposits, ect.) is accentuated. The most important predictors of fatal prognosis in native (non-gonococcal) septic arthritis may be defined as a triade: age over 65 y., polyarticular manifestation, and especially confusional presentation. In precise at time diagnosis, the rheumatologist is specialist of first line; the review should be a help also in this responsible task..
Keywords:
Oral/intestinal microbiome, dysbiosis and autoimmunity, gut-joint axis, rheumatoid arthritis, reactive arthritis, septic arthritis
Autoři: Z. Hrnčíř
Působiště autorů: II. interní gastroenterologická klinika, Lékařská fakulta Univerzity Karlovy a Fakultní nemocnice, Hradec Králové
Vyšlo v časopise: Čes. Revmatol., 25, 2017, No. 4, p. 164-171.
Kategorie: Přehledový článek
Souhrn
Relace kloubního zánětu k mikrobiálním agens není esenciálně identická s obvyklým konceptem mikrobiálního infektu, protože abnormální mikrobiom se může podílet na mechanismech artritidy. Normální slizniční mikrobiom trávicího ústrojí (tj. hlavně dutiny ústní a střeva) je sice symbiotickou součástí „superorganismu“ hostitele, ale sekvenční analýzou mikrobiotické DNA byla prokázána orální/intestinální dysbióza, významná v mechanismech autoimunity, zvl. jako osa „střevo-kloub“ u revmatoidní artritidy a celiakie. Dysbióza nemusí být vždy jenom patogenním fenoménem. Speciální manipulace P. histocoli u modelu humanizovaných HLA DQ8+ myší vedla k supresi rizika kloubního zánětu, což poukázalo na možnost nové strategie v profylaxi a terapii, jmenovitě u preklinické a časné fáze revmatoidní artritidy. Ve vztahu k reaktivní artritidě je významné, že zejména enteropatická forma je spjata s HLA B27+ Ag, tj. typickým biomarkerem spondyloartritid. Z hlediska běžné klinické praxe se v tomto kontextu jeví jako aktuální reaktivní artritida po infektu Y. enterocolitica. Nativní (negonokoková) septická artritida je setrvale prognosticky závažnou akutní příhodou v revmatologii, která má při komorbidní artropatii 30% mortalitu; z těchto komorbidit se klade důraz na její zvýšené riziko u dny (akutní dnavá ataka, periartikulární urátová depozita aj.). Nejzávažnější prediktory fatální prognózy lze definovat u nativní (negonokokové) septické artritidy jako triádu: věk nad 65 let, polyartikulární manifestace a zejména nepřesné rozpoznávání. Nelze než zdůraznit, že včasná a precizní diagnoza této akutní příhody je odpovědností revmatologa v pozici specialisty první linie; předkládaný přehled by měl být pomocí i při tomto náročném úkolu.
Klíčová slova:
Orální/intestinální mikrobiom, dysbióza a autoimunita, osa střevo-kloub, revmatoidní artritida, reaktivní artritida, septická artritidaÚvod
V klinice kloubního zánětu a jeho experimentálních modelů se uplatňují mikrobi v podstatě trojím způsobem: /1/ v imunopatologii, vč. mechanismů autoimunity při dysbióze mikrobiomu trávicího ústrojí (TÚ), /2/ jako induktory (postinfekční) reaktivní artritidy (ReA) a /3/ přímým infektem kloubu u negonokokové/gonokokové nativní nebo protetické formy septické artritidy (SA), samozřejmě s vědomím široké škály dalších kloubních zánětů od běžných viróz po sporadická/endemická agens (1). Vztah mikrobiální aktivity a kloubního zánětu se ovšem překrývá se systematikou infekčních artritid jen z části, protože fyziologický mikrobiom TÚ není infektem, ale součástí biosystému hostitele, a v tomto smyslu se nepodílí v patogeneze jakéhokoliv zánětu. V přehledovém přístupu bylo proto zapotřebí téma ohraničit na: 1. vztah bakteriální agens – kloubní zánět; 2. princip „propter hoc“ v klinické i modelové rovině a 3. selektivní přístup k nabídce těchto „horkých míst“ současné revmatologie.
Dysbióza mikrobiomu trávicího ústrojí
Analýza mikroorganismů TÚ byla vždy odvislá od technologických možností mikrobiologie. Už tvůrce prvního mikroskopu, Antony van Leeuwenkoek (1632–1721), pozoroval velké množství „animalcules“ ve hlenu ze stěru z vlastní dásně (2). Dlouhodobě byla zásadní překážkou hlubšího poznání mikrobiálních agens TÚ skutečnost, že úspěšně je lze kultivovat zhruba jenom ve 20 % (3). Přelomové poznatky umožnila teprve aplikace sekvenční analýzy mikrobiální DNA TÚ, nové informace o mechanismech slizniční imunity a rovněž o změnách v permeabilitě střevní stěny (4). Ukázalo se, že dysbióza TÚ významně narušuje homeostázu „superorganismu“ buněk a jejich genomů, zahrnující makroorganismus hostitele, mikrobiom TU a také dalších sliznic a kůže. Dysbióza TÚ je dominantně charakterizována narušením víceúrovňového systému ochranných mechanismů sliznice střeva (obr. 1) (5). Významnou složkou tohoto souboru je glykokalyx, tj. ubikvitární protein-polysacharidový mediátor (bakteriální) adherence k povrchům, který má svůj fyziologický ekvivalent i na vnitřním povrchu normální kloubní synovialis (6). Jedním z důsledků takto vzniklé dysbalance je exprese mechanismů systémové autoimunity. Ze systémových revmatických chorob byla takto zatím zkoumána hlavně revmatoidní artritida (RA) a v případě nemocí s minoritní klinickou manifestací na pohybovém aparátu celiakie (CE). Mikrobiota TÚ s proinflamatorním potenciálem, tj. autoimunitu podporující, se označují jako pathobionti, mikrobiota TÚ s antiinflamatorní schopností jako symbionti (7).
Obr. 1. Obranná strategie trávicího systému. Upraveno podle J. Krejska et al. (5). 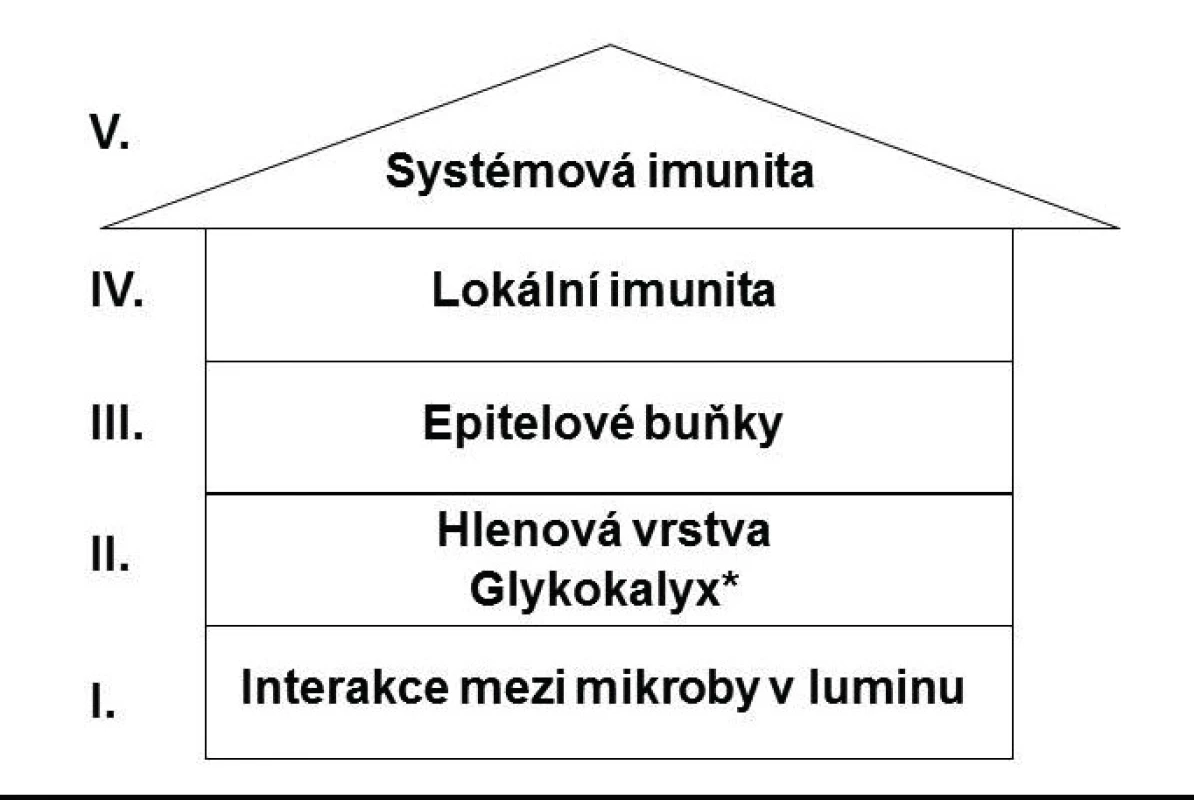
Ve vztahu k RA, respektive „RA-like“ modelům jsou z pathobiontů aktuálně diskutovány hlavně poznatky o významu bakterií Porphyromonas – Prevotella-Bacteroides. U Prevotella (P.) copri se zjistilo, že v observačních studiích je dominantním fekálním mikrobiotem u časné RA, ale také u modelové artritidy pokusného kmene myší, chovaných v bezmikrobním prostředí (7, 8). Antagonistický vztah byl naopak pozorován mezi P. copri a skupinou bacteroides (B), např. B. fragilis, který indukuje produkci anti-inflamatorního IL-10. O Porphyromonas (P) gingivalis je známo, že představuje dominantní patogen periodontitidy (9). Ve vztahu k autoimunitě RA je významné to, že disponuje aktivitou peptidyl-arginin-deiminázy (PAD), tj. citrulinační enzymovou aktivitou. U citrulinace jde o post-translační modifikaci argininu vázaného na proteiny, spočívající v jeho konverzi na nestandardní aminokyselinu citrulin, jež je katalyzována PAD enzymy za přítomnosti Ca++ jontů; nutno dodat, že tato konverze via P. gingivalis není funkčně zcela identická s tkáňovou citrulinací. Patogeneticky významnou aktivitou, jednotící tkáňovou a mikrobiální citrulinací je to, že na obou úrovních může vést ke vzniku imunogenních neoepitopů (10).
Na ose „střevo-kloub“ (obr. 2) je modelem systémové autoimunity komparativní analýza RA a CE (obr. 3). Obě tato onemocnění mají rozdílnou dominantní klinickou syndromologii, ale – na druhé straně – řadu podobností; nejvýznamnější z nich lze shrnout do tří okruhů. 1. Demograficky to je obdobná prevalence v evropské populaci vč. asymetrie podle pohlaví. 2. Geneticky jde o multifaktoriální asociaci k HLA třídy II., u CE DQ2,5 a DQ8, u RA k DRB1, obs. sdílený epitop (10). Komparativní multicentrická studie evropské populace s analýzou 12.361 CE a 13.819 RA potvrdila 19 už dříve identifikovaných lokusů a objevila dalších pět nových (11). 3. V imunopatologii je to prostor pro tvorbu neoepitopů (obr. 3) (12): v této souvislosti je zajímavou skutečností identifikace rozšiřujícího se spektra autoprotilátek proti post-translačně modifikovaným proteinům mimo ACPA, např. proti karbamylovaným proteinům (anti-CarP), které mají – podobně jako ACPA – prediktivní význam u artralgií, a to vč. u ACPA negativních jedinců (13). Odlišným přístupem k problému je narušení centrální kontroly nad potenciálně autoreaktivními buňkami, doložené genovými mutacemi autoimunitního regulátoru: důsledkem je ztráta tolerance k enterickým alfa-defensinům s rizikem kaskády směrem k dysbióze a také k autoimunitě (14). Překryv genotypu a zvl. imunopatologie RA a CE lze rámcově shrnout do teze „podobné mechanismy, rozdílné antigeny“ (10). Rozšiřující se poznatky o RA asociované dysbióze vytváření postupně předpoklady pro formování prediktivního statusu s charakteristikou redukce diversity a s expanzí neobvyklé rodiny intestinálních mikrobů (15).
Obr. 2. Patogenní dráhy na ose střevo – kloub. Upraveno podle A. Lernera a T. Matthiase (12) 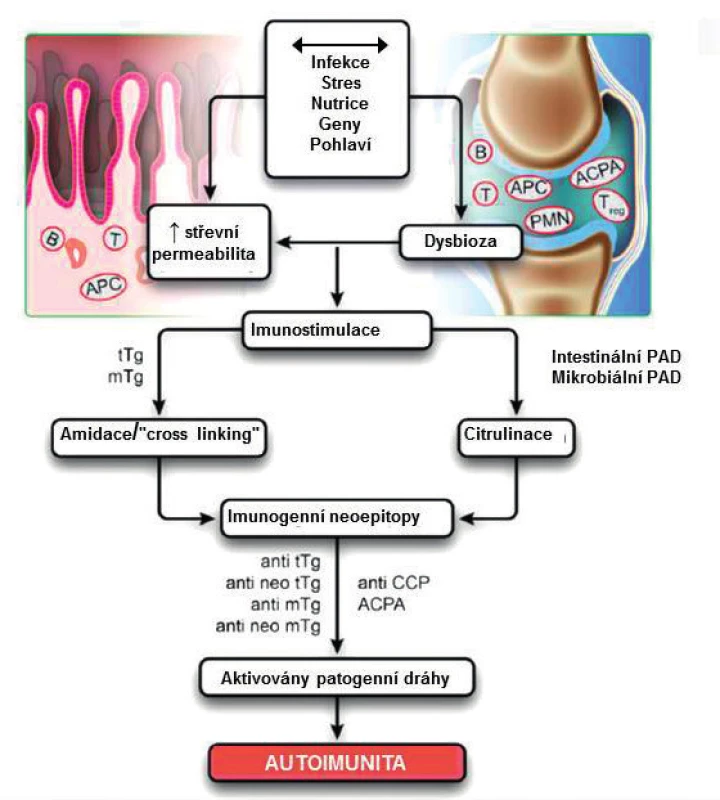
PAD: Peptidyl Arginin Deimináza, tTg/mTg: tkáňová/mikrobiální Transglutamináza, CCP: Cyklický Citrulinový Peptid, ACPA: Anti-Citrulin-Peptidové Autoprotilátky Obr. 3. Patogenní dráhy na ose revmatoidní artritida – celiakie. Upraveno podle A. Lernara a T. Mathiase (12). 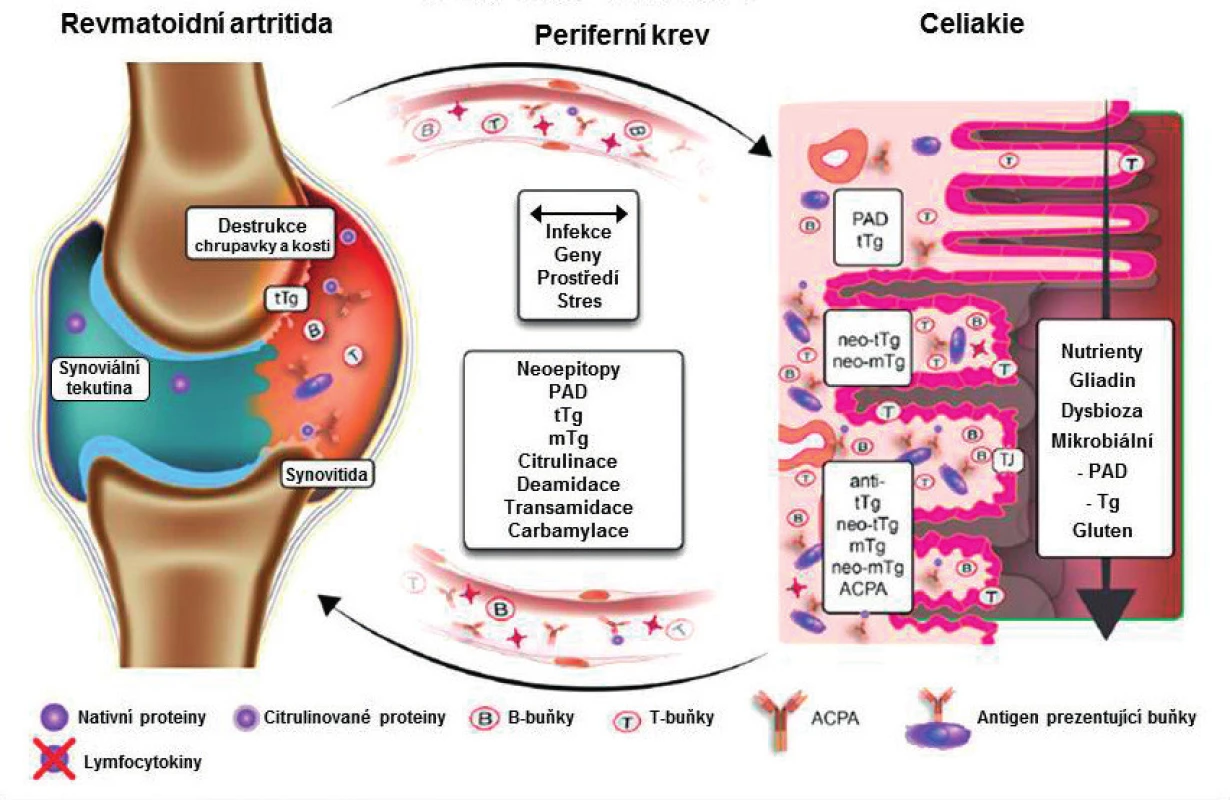
PAD: Peptidyl Arginin Deimináza, tTg/mTg: tkáňová/mikrobiální Transglutamináza, CCP –Cyklický Citrulinový Peptid, ACPA: Anti-Citrulin Peptidové Autoprotilátky. Některá modelová pozorování nasvědčují o tom, že mikrobiom TÚ se může vychýlit i pozitivním směrem. U modelové RA-like artritidy humanizovaných HLA-DQ8+ myší byl prokázán protektivní vliv symbionta P. histocoli. Další výzkum symbiontů TÚ možná otevře úplně nové, nejspíše nerizikové, aspekty v prevenci/terapii u „hrozící“ a časné RA (16); analýza preklinické fáze RA (tab. 1) je vysoce aktuální téma (17). Pro běžnou klinickou praxi je třeba upozornit na možnost překryvu CE a difuzních nemocí pojiva: vzhledem k obdobné prevalenci není překvapením ve vztahu k RA, ale byl zjištěn i ve vztahu k Sjögrenovu syndromu, psoriatrické artritidě, juvenilní idiopatické artritidě (18, 19) a zvl. v kohortě nediferencovaných difuzních nemocí pojiva (20). Na druhé straně, u RFs/ACPA seronegativních epizodických artralgií/artritid může být příčinou (nerozpoznaná) CE a výzvou vyšetřit protilátky proti transglutamináze a proti deamidovanému gliadinu, popř. zkusit bezlepkovou stravu jako nerizikovou „terapii na slepo“.
Tab. 1. Preklinická revmatoidní artritida na schematické škále. 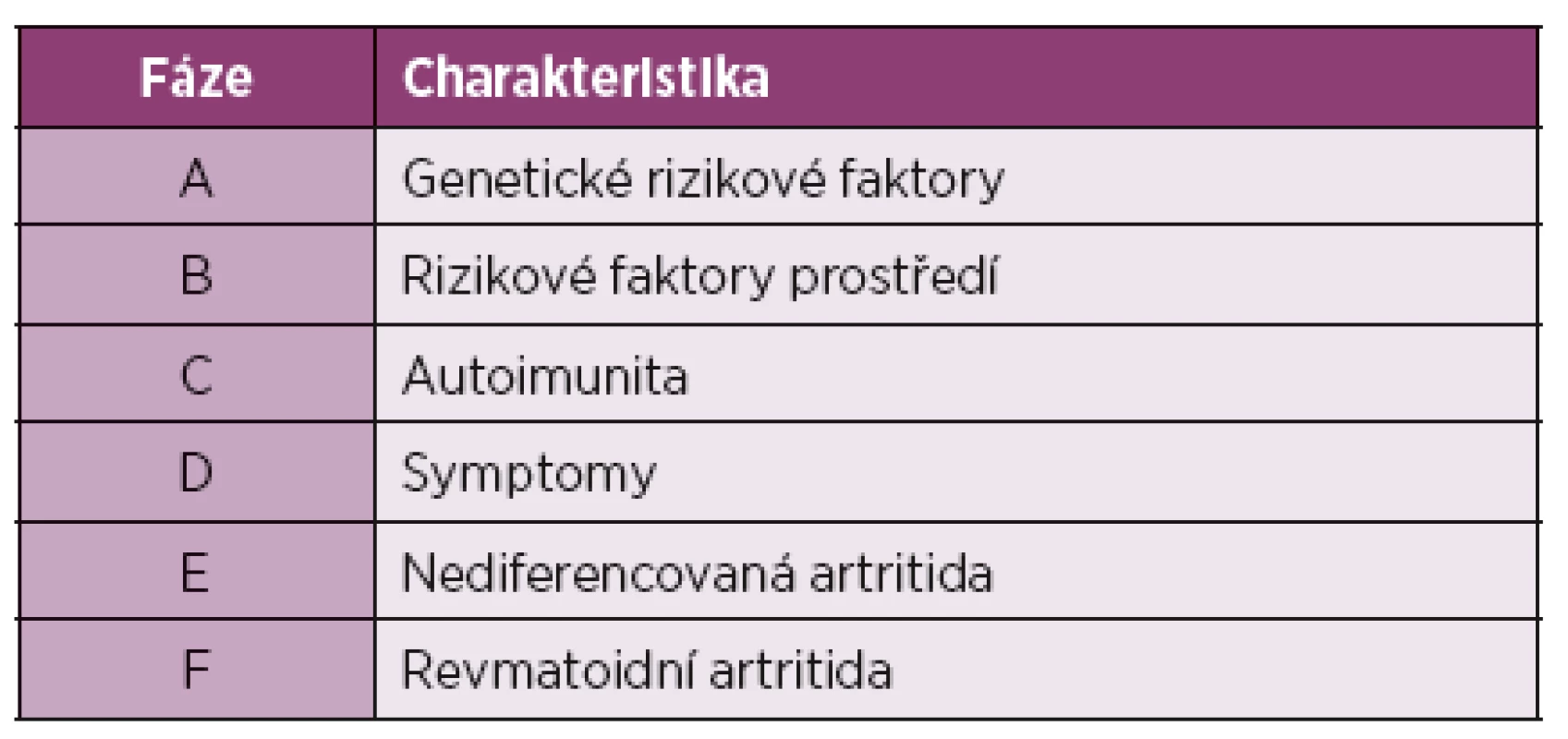
Upraveno podle H. W. van Steenbergenové et al. (17) Reaktivní artritida
Systematika syndromů (post-infekční) ReA je k dispozici v aktuálním přehledu (21) a v referenčních učebnicích. V kontextu s dysbiózou TÚ se jeví jako inspirativní studium relace s enteropatickými ReA, které jsou navíc pozoruhodné pozitivní asociací k HLA B27 Ag, jež u non-enteropatických ReA většinou chybí (tab. 2 a 3). Enteropatická ReA může být diagnostickou výzvou, pokud představuje komorbidní mimikry i jiného intestinálního onemocnění (22). Aktuální zkušenost z vlastního pracoviště s yersiniovou ReA (tab. 4) je podnětem k úvaze nad tím, zda na ReA pomýšlíme v každodenní praxi s adekvátní naléhavostí a sledujeme její dynamiku i na protilátkové úrovni; ústup zánětlivého kloubního syndromu nemusí být vždy provázen regresí mimokloubní post-infekční reaktivity.
Tab. 2. Enteropatické reaktivní artritidy. 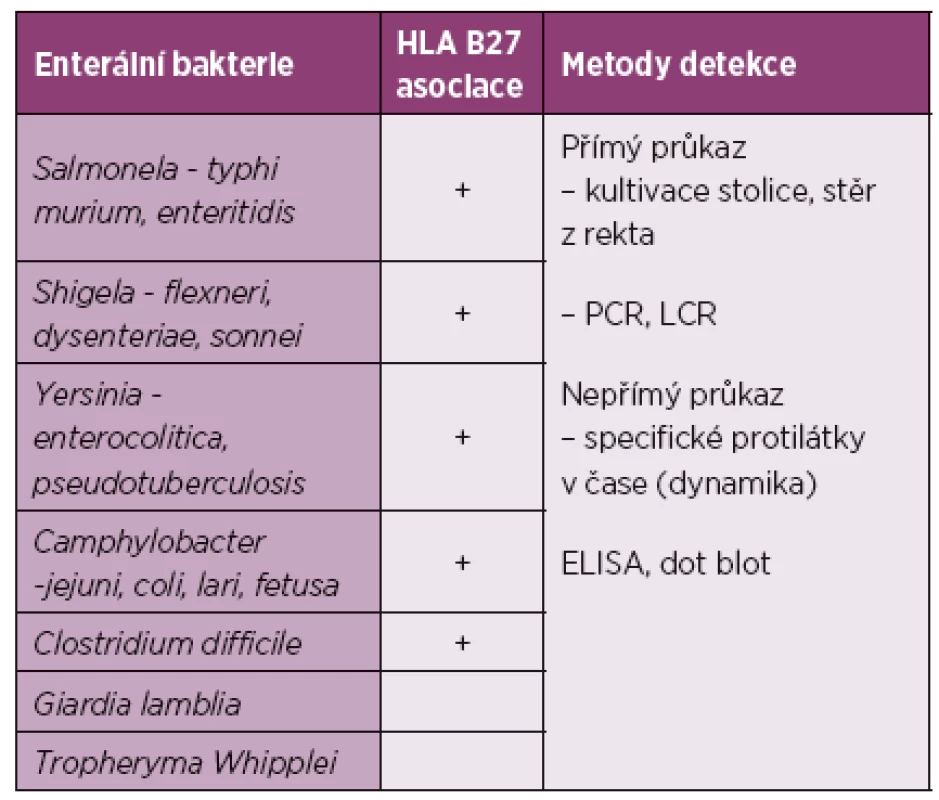
PCR – Polymerázová řetězcová reakce, LCR – Ligázová řetězcová reakce Upraveno dle: AJ Mathew, V Ravindran (1) Tab. 3. Non-enteropatické reaktivní artritidy. 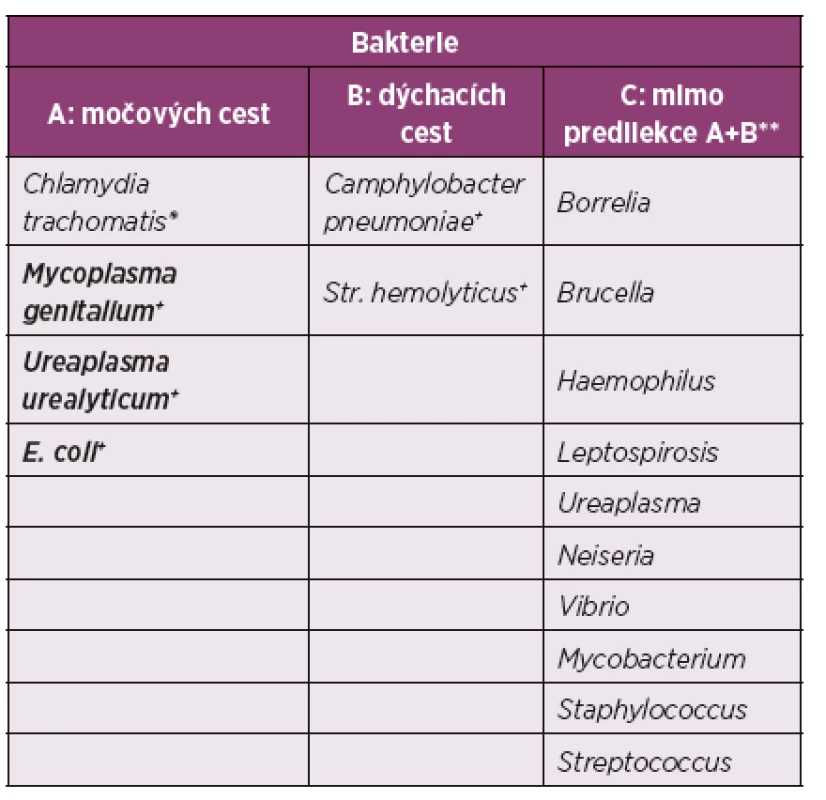
* asociace k HLA B27, ** bez asociace k HLA B27, + predilekce k HLA B27 neuvedena. Upraveno dle: AJ Mathew, V Ravindran (1) Tab. 4. Protilátky Y. enterocolitica v séru z revmatologické indikace (II. interní GE klinika FN Hradec Králové: 9. 5. 2012 – 9. 5. 2017). 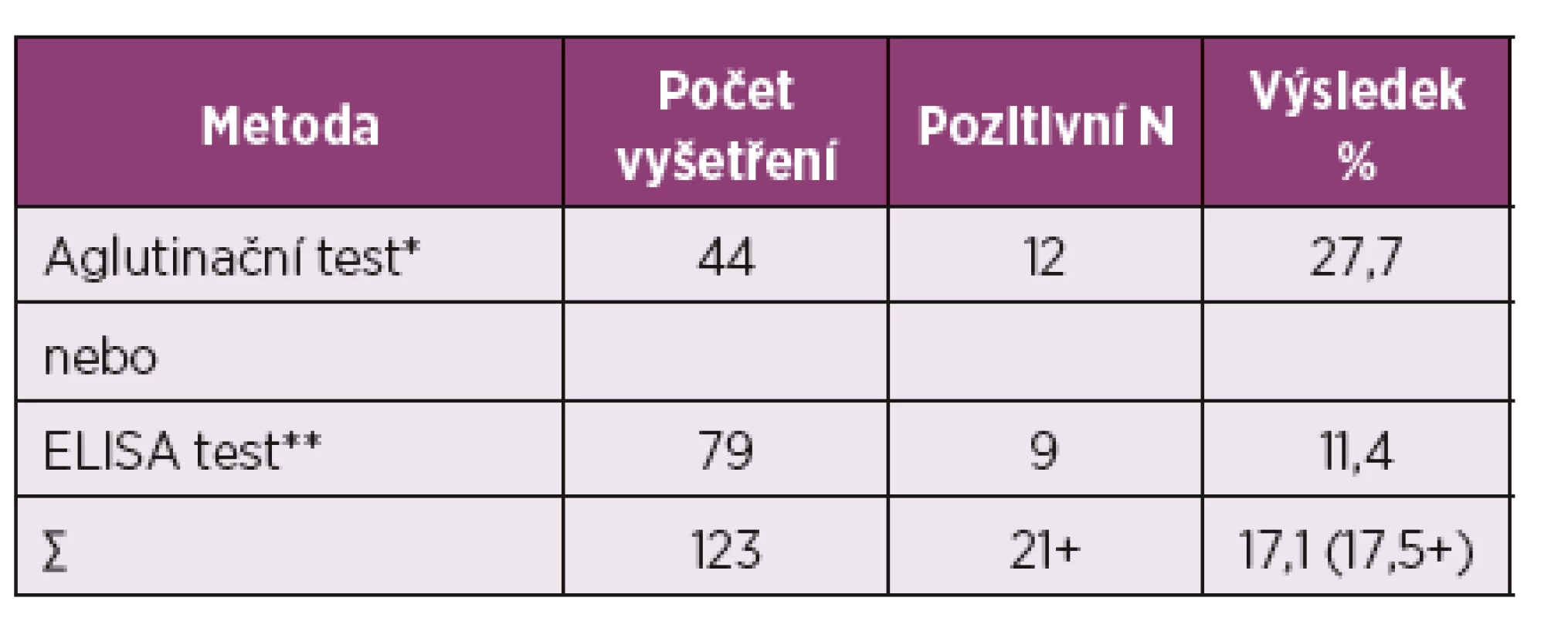
+ 18 pacientů, 6x reaktivní artritida * cut-off: 1:80, ** cut-off: 22 RU/ml Vstupní data: Ústav klinické imunologie a alergologie FN Hradec Králové (laskavostí RNDr. M. Drahošové) Septická artritida
Nativní SA je způsobena přímou invazí patogenních mikrobů do kloubu s rychlou proliferací v synoviální tekutině (ST) a tkáni. Fagocytóza těchto patogenů indukuje mohutnou aktivaci mediátorů zánětu: důsledkem je edém synovialní a periartikulární tkáně, zmnožení ST, vzestup nitrokloubního tlaku a rychlá devastace chrupavky a dalších struktur. Negonokoková nativní SA u dospělých je definována průkazem jednoho z deskriptorů modifikovaných Newmanových kritérií (tab. 5). Incidence takto vymezené SA v evropské populaci je udávána v rozmezí 4–10/100 000 personálních roků s poukazem na zvýšené riziko u seniorů, komorbidit (RA, salmonelová SA u SLE, osteoartróza, dna, cukrovka aj.), imunokompromitovaných osob (imunosupresivní terapie, IV toxikomanie, HIV infekce aj.), nitrokloubních zlomenin a zákroků (punkce, artroskopie, endoprotézy); např. riziko post-artroskopické (stafylokokové) SA má prevalenci < 1 % všech výkonů (23). V epidemiologii revmatického komorbidního rizika byla recentně provedena cílená analýza vztahu SA a dnavé artritidy. V rozsáhlé kohortové komparativní studii praktických lékařů UK (databáze „Health Improvement Network“ 1995–2013) bylo zjištěno 2,6x větší riziko SA u dny v době prvního záchvatu vč. podskupin podle věku a pohlaví (24); nutno dodat, že hlavně u multimorbidních seniorů se rizikové faktory SA obvykle kombinují. Narůstající frekvence kloubních endoprotéz vedla k vymezení termínu protetické SA, což má opodstatnění v poněkud odlišných klinických charakteristikách, laboratorním doprovodu i v péči o tyto nemocné: u nativní SA je specialistou prvního sledu revmatolog, u protetické SA dominantně ortoped.
Tab. 5. Modifikovaná Newmanova kritéria septické artritidy (SA). 
Upraveno podle Mathew AJ Rivandran V (1) Klinickou manifestací nativní SA je typicky monoartritida kolene ( 50 %) nebo kyčelního kloubu (~ 20 %) s plně vyjádřeným klinickým obrazem pentády akutního kloubního zánětu, tj. zvláště u kolene (popř. i dalších končetinových kloubů) se zarudnutím nad kloubem (obr. 4), s horečkou a dalšími septickými projevy SIRS (Systemic Inflammatory Response Syndrome). Paralelou k SA může být další infekt v jakékoliv mimokloubní lokalizaci, např. jako infekční endokarditida. U psychicky alterovaných nebo imunokompromitovaných lze očekávat alteraci v percepci bolesti, absenci zarudnutí kůže nad kloubem a celkovou modifikaci ve smyslu ztráty bouřlivě vyjádřeného klinického syndromu a jeho průběhu, což je spojeno s rizikem opožděné diagnózy SA nebo vede dokonce k nerozpoznání tohoto stavu. Zvláštní pozornost vyžaduje topografie SA kyčelního kloubu, která se manifestuje intenzivní a setrvalou bolestí hýždě s propagací do stehna, ovšem bez lokálního otoku nebo barevných změn na kůži. Jde o akutní indikaci USG k průkazu tekutinové kolekce a k vyznačení vhodného místa pro aspirační punkci; totéž platí i pro jiné, zpravidla méně časté alokace SA (obr. 5) a pro polyartikulární SA.
Obr. 4. Plošné zarudnutí kůže nad kolenním kloubem u septické artritidy. Archiv II. interní GE kliniky, Fakultní nemocnice, Hradec Králové (vlastní pozorování). 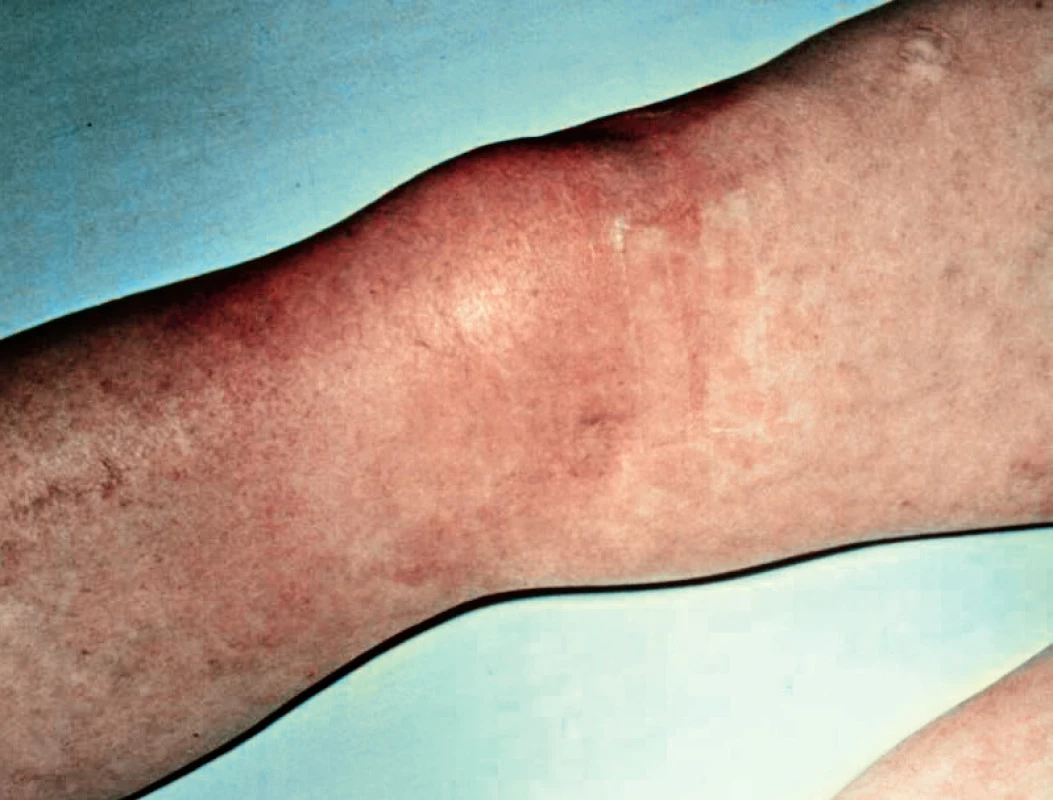
Obr. 5. USG průkaz tekutinové náplně kloubu. 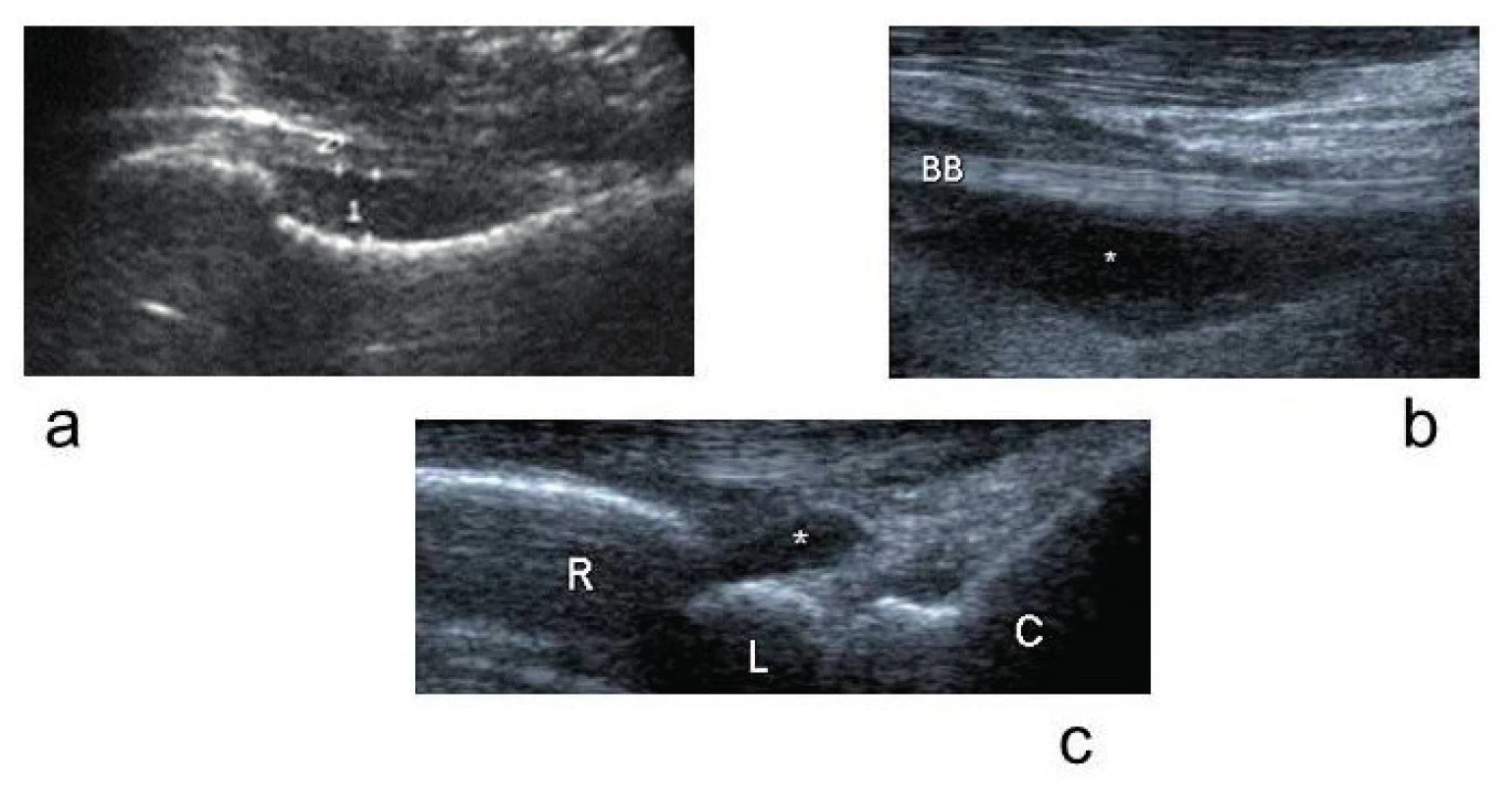
(a) Náplň kyčelního kloubu na krčku femoru (1) (b) Náplň glenohumerálního kloubu (*) v recesu kolem šlachy m.biceps brachii (BB) (c) Náplň radio-karpálního kloubu (*) v recesu mezi radiem (R) a os lunatum (L) Archiv Radiologické kliniky Fakultní nemocnice, Hradec Králové (laskavostí MUDr. J. Brtkové) Klinické podezření na SA je akutní indikací pro aspirační punkci k laboratorním analýzám synoviální tekutiny (ST), a následně pro včasný start ATB terapie. Při současné trombocytopenii pod 50x109/l je indikován trombocytový náplav. Warfarinizace v terapeutickém rozmezí INR (International Normalized Ratio) se považuje za bezpečný režim (25, 26); při DOAC (Direct Oral Anticoagulants) nebyla u 1050 pacientů Mayo kliniky (10. 2010–10. 2016) zaznamenána krvácivá komplikace (27). NSA jsou ovšem riziková nejenom interakcí s warfarinem, ale také s dabigatranem, který se z 80 % vylučuje močí.
Podle doporučení BSR (British Society for Rheumatology) a kooperujících odborných společností (26) vyžaduje získaný vzorek ST vyšetřit kultivací, barvením podle Grama (obr. 6) a polarizační mikroskopií. Při pozitivní kultivaci jde nejčastěji o stafylokoky (50–60 %), vč. vysoce rizikového infektu MRSA (Methicilin Resistentní Staphylococcus Aureus) (29), vzácněji jde o streptokoky, Gram negativní bacily nebo anerobní infekt. Neobvyklé agens lze očekávat při cestovní anamnéze do oblastí s endemickou Lymeskou chorobou nebo fungálním infektem. U RA s TNFi terapií byla opakovaně popsána salmonelová SA (30, 31). BSR memorandum vyžaduje paralelní kultivaci krve a zdůrazňuje, že negativní kultivace a barvení podle Grama nevylučují SA. Z dalších ukazatelů je požadováno vyšetřit a sledovat leukocyty, SE, CRP, elektrolyty, jaterní biochemie a biomarkery renálních funkcí. Cytomorfologii ST lze u nativní SA přikládat jenom podpůrný význam. Např. v souboru 20 vzorků ST byla zjištěna leukocytóza ≥ 100 000/ul a PMR ≥ 94 % 10x u SA (77 %), ale také 3x u akutní dnavé artritidy (32). Protetická SA byla zjištěna u 34/134 vzorků ST s podstatně menší leukocytózou ≥ 17 000/ul a PMR ≥ 65 % (33). Při podezření na protetickou SA je přínosnou zkušeností pozitivní alfa-defensinový test v ST (34): buňky ST reagují produkcí tohoto antimikrobiálního peptidu na patogenní agens „e principe“. Cílené vyšetřovací postupy zahrnují kultivaci na čokoládovém agaru při podezření na gonokokovou SA, PCR u boreliové a gonokokové SA (35) a v experimentálním výhledu také analýzu infračervenou spektroskopií (36). Akutní diferenciální diagnostika „horkého kloubu“ vyžaduje rychle vyřešit vztah SA versus/plus akutní dnavá artritida, tj. mimikry nebo (~ 5 %) souběh. Za určitých předpokladů je akutně zanícený kloub oboustrannou predispozicí k provalení se periartikulárních urátových depozit do SA i naopak periartikulární (hnisavé) burzitidy aj. infektů do akutního dnavého kloubního zánětu (37) Subklinická periartikulární urátová depozita lze detekovat sofistikovanými zobrazovacími metodami, popř. jejich kombinací, tj. via MRI, DECT (Dual Energy Computer Tomography) (38) a dvoudimenzní USG. Zdrojem urátových krystalů v ST u SA mohou být i mikrotofy synoviální tkáně (Gordonův-Pavelkův fenomén) (39).
Obr. 6. Gram pozitivní koky (šipka) v synoviální tekutině u septické artritidy komplikující revmatoidní artritidu. Archiv II. interní GE kliniky, Fakultní nemocnice Hradec Králové (28). 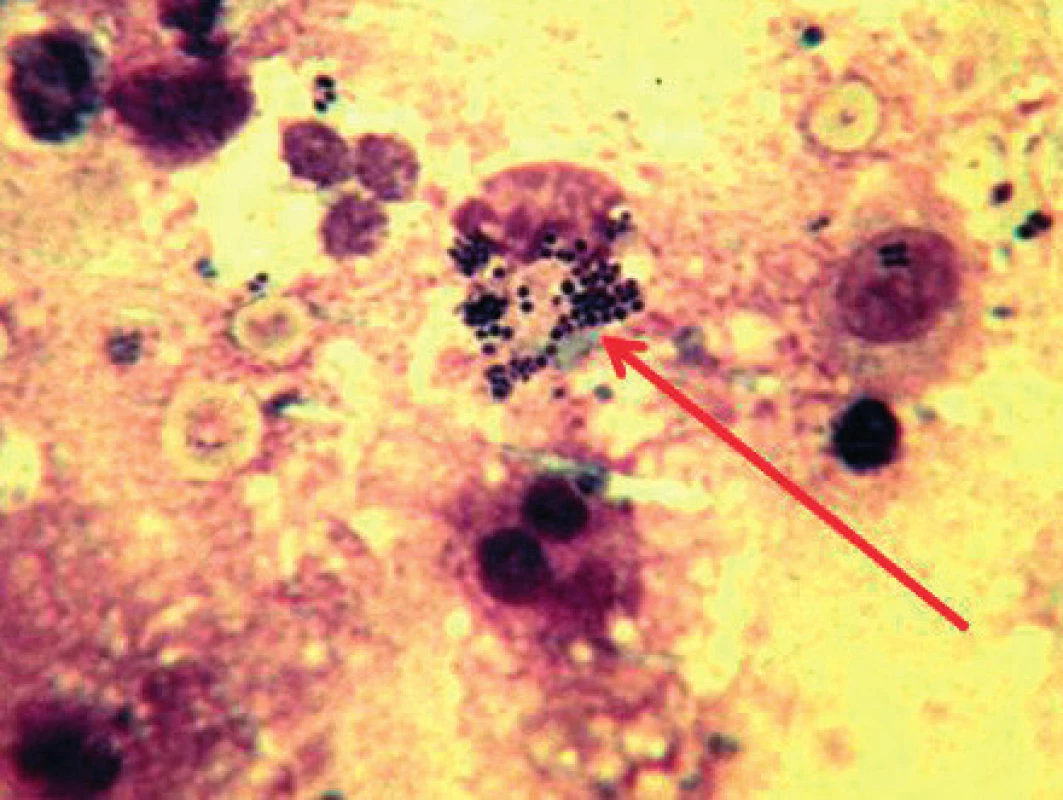
SA je prognosticky závažnou akutní příhodou v revmatologii. V monocentrické retrospektivní studii (Nottingham, UK) bylo vyhodnoceno 243 SA s 11,5 %,ale u kloubních komorbidit s 31,6 % mortalitou a multifaktoriální analýzou byly vyčleněny jako faktory fatální prognózy: konfuzní prezentace, věk nad 65 let a polyartikulární forma (40). Nepřesná prezentace je rizikem opožděného startu ATB a další terapie; eliminace tohoto nebezpečí je nezastupitelným úkolem akutní revmatologické diagnostiky. Vlastní terapie SA (IV ATB, drenáž aj.) je odpovědností septické části lůžkových oddělení ortopedie, popř. chirurgie a minimalizace následného funkčního deficitu předmětem péče rehabilitačních zařízení.
Závěr
Přehledová výseč obsáhlé problematiky variabilních relací v rovině „mikrobiální agens – kloubní zánět“ představuje nejenom výběrový nástin rychle gradujících informací: je také podnětem k zamyšlení nad současným trendem určité části klinické a experimentální revmatologie. Ve vztahu k mikrobům se vše odvíjí od metodologického pokroku v mikrobiologii, v patofyziologii kloubního zánětu navíc v sofistikované síti mechanismů přirozené a adaptivní imunity, a na klinické úrovni v dovednosti exploatace této a další doplňující informatiky (zvl. zobrazovacích metod) u konkrétních nemocných. Nic z rozšiřující se nabídky komplementu neumenšuje význam kliniky revmatologického vyšetření a péče, založené na schopnosti umět se ptát, pozorovat a hodnotit na principech algoritmického myšlení; SA je toho naléhavým příkladem. Experimentální revmatologie, přinejmenším v některých svých částech, je předobrazem její kliniky v budoucnosti. Nelze vyloučit, že např. manipulace s mikrobioty trávicího ústrojí vyústí do netoxické profylaxe a terapie některých forem kloubního zánětu; v každém případě je na co se těšit.
Poděkování: Podpořeno výzkumným projektem Univerzity Karlovy PROGRES Q40-15.
adresa pro korespondenci:
Prof. MUDr. Zbyněk Hrnčíř, DrSc.
II. interní gastroenterologická klinika
Lékařské fakulty UK a Fakultní nemocnice
500 05 Hradec Králové
e-mail: zbynek.hrncir@fnhk.cz
Zdroje
1. Mathew AJ, Ravindran V. Infections and arthritis. Best Pract Res Clin Rheumatol 2014; 28 : 935–959.
2. Lederberg J. Infectious history. Science 2000; 288 : 287–293.
3. Kohoutová D, Rejchrt S, Drahošová M, Förstl M, Morávková M, Šmajs D, et al. Střevní mikrobiota u idiopatických střevních zánětů a kolorektálních neoplázií. Nucleus HK, vyd. 1, Hradec Králové, 2013, s. 126.
4. Scher JU, Littman DR, Abramson SB. Microbiome in inflamatory arthritis and human rheumatic diseases. Arthritis Rheum 2016; 60 : 35–45.
5. Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Garamon, vyd. 1, Hradec Králové, 2016, s. 496.
6. Simkin PA. The human knee: A window on the microvasculature. Tissue Barriers 2015; 3: e9700465-1-5. www.Iandesbioscience.com
7. Kim D, Kim WU. Can Prevotella copri be a causative pathobiont in rheumatoid arthritis? Arthritis Rheum 2016; 68 : 2565–2567.
8. Santegoets KMC, Wenink MH, Braga FAV, Cossu M, Lambers-Karnebeek FBG, van Riel PLCM, et al. Impaired Pophyromonas gingivalis-induced Tumor Necrosis Factor production by dentritic cells typifies patients with rheumatoid arthritis. Arthritis Rheum 2016; 68 : 795–804.
9. Valesini G, Gerardi MC, Iannuccelli C, Paducci VA, Pendolino M, Shoenfeld Y. Citrullination and autoimmunity. Autoimmunity Rew 2015; 14 : 490–497.
10. Koning F, Thomas R, Rossjohn J, Toes RE. Coeliac disease and rheumatoid arthritis: similar mechanisms, different antigens. Nat Rev Rheumatol 2015;11 : 450–461.
11. Gutierrez-Achury J, Zorro MM, Ricaňo-Ponte I, Zhermakova DV. Coeliac Disease Immunoship Consortium, RACI Consortium, et al. Functional implications of disease-specific variants in loci jointly associated with coeliac disease and rheumatoid arthritis. Human Mol Genetics 2016; 25 : 180–190.
12. Lerner A, Matthias T. Rheumatoid arthritis-celiac disease relationship: joints get that gut feeling. Autoimmunity Rev 2018; 14 : 1038–1047.
13. Toes REM, Huizinga TJW. Update on autoantibodies to modified proteins. Curr Opin Rheumatol 2015; 27 : 262–267.
14. Dobeš J. Nové regulační mechanismy imunitní tolerance a homeostázy ve střevě. Imunol zpravodaj 2016; 31 : 42–54.
15. Chen J, Wright K, Davis JM, Jeraldo P, Marietta EV, Murray J et al. An expansion of rare lineage intestinal microbes characterized rheumatoid arthritis. Genome Med 2016; 8 : 43. DOI 10.1186/sl3037-016-0299-7.
16. Marietta EV, Murray JA, Luckey DH, Jenaldo PR, Lambda A, Patel R, et al. Suppression of inflammatory arthritis by human gut-derived Prevotella histicola in humanized mice. Arthritis Rheum 2016; 68 : 2878–2888.
17. van Steenbergen HW, Huizinga TWJ, van der Helm-van Mil AHM. The preclinical phase of rheumatoid arthritis. Arthritis Rheum 2013; 65 : 2219–2232.
18. Koszarny A, Majdan M, Suszek D, Dryglewska M, Tabarkiewich J. Autoantibodies against gliadin in rheumatoid arthritis and primary Sjögren´s syndrome patients. Wiad Lek 2015; 68 : 242–247.
19. Scher JU, Ubeda C, Artacho A, Attur M, Isaac S, Redy SM, et al. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis resembling dysbiosis in inflammatory bowel disease. Arthritis Rheum 2015; 67 : 128–139.
20. Conti V, Leone MC, Casato M, Nicoli M, Granata G, Carlesimo M. High prevalence of gluten sensitivity in a cohort of patients with undifferentiated connective tissue disease. Eur Ann Allergy Clin Immunol 2015; 47 : 54–57.
21. Žurek M, Horák P. Reaktivní artritidy. Čes Revmatol 2017; 25 : 91–98.
22. Tradulo D, Mangualde J, Cremers I, Oliviera APOD. Reactive arthritis mimicking inflammatory bowel disease arthritis: a challenging diagnosis. Acta Rheumatol Port 2014; 39 : 188–192.
23. Bauer T, Boisrenoult P, Jenny JY: Post-arthroscopy septic arthritis: current data and practical recommendations. Orthop Traumatol Surg Res 2015;01 (Suppl 8): S347-350.
24. Sian Yik Lim, Na Lu, Hyon K Choi. Septic arthritis in gouty patients: a population-based cohort study. Rheumatology 2015; 54 : 2095–2099.
25. Ahmed I, Gertner E. Safety of arthrocentesis and joint injection in patients receiving anticoagulation at therapeutic levels. Amer J Med 2012; 125 : 265–269.
26. Coakley G, Mathews C, Field M, Jones A, Kingsley G, Walker D, et al. BSR, BHPR, BOA, RCGP and BSAC guidelines for management of the hot swollen joint in adults. Rheumatology 20016; 45 : 1039–1041.
27. Yui JC, Preskill C, Greenlund LS. Arthrocentesis and joint injection in patients receiving direct oral anticoagulants. Mayo Clin Procc 2017; 92 : 1223–1226.
28. Bureš J, Řehulová E, Kalinová M, Hrnčíř Z. Stafylokoková sepse s purulentní artritidou jako fatální komplikace progresivní polyartritidy. Lék zprávy (Hradec Králové) 1982; 27 : 13–21.
29. Vardakas KZ, Kontopidis I, Gkegkes ID, Rafailidis PI, Falagas ME. Incidence, characteristics, and outcomes of patients with bone and joint infections due to community-associated methicilin-resistant Staphylococcus aureus: a systematic review. Eur J Clin Microbiol Infect Dis 2013; 32 : 711–721.
30. Sky K, Arroyo RA, Collamer AN. Salmonella septic arthritis in a patient receiving etanecerpt: case report and review of the literature. Mil Med 2013; 178 : 384–387.
31. Bubonja-Sonje M, Rubinic D, Anic F, Novak S, Vuckovic D, Abram M. Salmonella enterica arthritis in a patient with rheumatoids arthritis receiving anti-tumor necrosis factor therapy. West Indian Med J 2013; 62 : 270–272.
32. Coutlakis PJ, Robets WN, Wise ChM. Another look at synovial fluid leukocytosis and infection. J Clin Rheumatol 2002; 8 : 67–71.
33. Trampuz A, Hanssen AD, Osmon DR, Mandrekar J, Steckelberg JM, Patel R. Synovial fluid leukocyte count and differential for the diagnosis of prosthetic knee infection. Amer J Med 2004; 117 : 556–562.
34. Deirmengian C, Kardos K, Kilmartin P, Gulati S, Citrano P, Booth Jr RE. The alpha-defensin test for periprosthetic joint infection responds to a wide spectrum of organisms. Clin Orthop Relat Res 2015; 473 : 2229–2235.
35. Mathews CJ, Kingsley G, Field M, Jones A, Weston VC, Phillips M, et al. Management of septic arthritis: a systematic review. Ann Rheum Dis 2007; 66 : 440–445.
36. Albert JD, Monbet V, Jilivet-Gougeon A, Fatih N, Le Corvec M, et al. A novel method for a fast diagnosis of septic arthritis using mid infrared and deported spectroscopy. J Bone Spine 2016; 83 : 318–323.
37. Yu KH, Luo SF, Liou LB, Wu JJ, Tsai WP, Chen JY, et al. Concomitant sepsic and gouty arthritis – an analysis of 30 cases. Rheumatology 2003; 42 : 1062–1066.
38. Huppertz A, Hermann KGA, Dietkhoff T, Wagner M, Hamm B, Schmidt WA. Systemic staging for urate crystal deposits with dual-energy CT and ultrasound in patients with suspected gout. Rheumatol Int 2014; 34 : 763–771.
39. Gordon TP, Bertouch JV, Walsh BR, Brooks PM. Monosodium urate crystals in asymptomatic knee joints. J. Rheumatol 1982; 9 : 967–969.
40. Weston VC, Jones AC, Bradbury N, Fawthrop F, Doherty M. Clinical freatures and outcome of septic arthritis in a single UK health district. Ann Rheum Dis 1999; 58 : 214–219.
Štítky
Dermatologie Dětská revmatologie Fyzioterapie Interní lékařství Kardiologie Ortopedie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2017 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Revmatologický ústav oslavil 65 let od svého založení
- Kloubní zánět a mikrobi na škále od mikrobiomu po septickou artritidu
- Ateroskleróza a kardiovaskulární riziko u pacientů se systémovou sklerodermií
- Riziko jaterního poškození při léčbě antagonisty tumor nekrotizujícího faktoru
- Překryv projevů trombotické trombocytopenické purpury a antifosfolipidového syndromu u pacientky s juvenilním systémovým lupus erythematodes
- Zpráva z kongresu American College of Rheumatology 2017
- Přehled akcí, které pořádá Česká revmatologická společnost v roce 2018 nebo na kterých se spolupodílí
- Obsah ročníku časopisu Česká revmatologie 25/2017
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Kloubní zánět a mikrobi na škále od mikrobiomu po septickou artritidu
- Ateroskleróza a kardiovaskulární riziko u pacientů se systémovou sklerodermií
- Revmatologický ústav oslavil 65 let od svého založení
- Riziko jaterního poškození při léčbě antagonisty tumor nekrotizujícího faktoru
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



