-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Interleukin 6 u revmatických onemocnění
Interleukin 6 in rheumatic diseases
Interleukin 6 is a pleiotropic cytokine, which has an impact on various cell lines through a unique mechanism of signal transmission and significantly participates in the regulation of immune response. IL-6 has an important role in the etiopathogenesis of inflammatory rheumatic diseases. The IL-6 blocking via tocilizumab – a humanized monoclonal antibody against IL-6R – has proved its efficacy in the treatment of rheumatoid arthritis and juvenile idiopathic arthritis with systemic onset.
Key words:
Interleukin 6, signal transmission, tocilizumab, rheumatoid arthritis, SOJIA
Autoři: H. Mann
Působiště autorů: Revmatologický ústav, Praha
Vyšlo v časopise: Čes. Revmatol., 17, 2009, No. 1, p. 30-35.
Kategorie: Přehledné referáty
Souhrn
Interleukin 6 je pleiotropní cytokin, který díky unikátnímu mechanismu přenosu signálu ovlivňuje různé buněčné řady a významným způsobem se podílí na regulaci imunitní odpovědi. IL-6 hraje důležitou roli v etiopatogenezi zánětlivých revmatických onemocnění. Blokáda IL-6 pomocí tocilizumabu – humanizované monoklonální protilátky proti IL-6R – se osvědčila v léčbě revmatoidní artritidy a juvenilní idiopatické artritidy se systémovým nástupem.
Klíčová slova:
interleukin 6, transsignalizace, tocilizumab, revmatoidní artritida, SOJIAÚvod
Koncem 60. let 20. století bylo experimentálně zjištěno, že k navození tvorby protilátek u myší po thymektomii je nezbytná přítomnost T lymfocytů. Předpokládaným prostředníkem mezibuněčné komunikace byly malé molekuly produkované T lymfocyty se schopností stimulovat B lymfocyty. V supernatantu buněčné kultury stimulovaných mononukleárních buněk periferní krve byly skutečně zjištěny látky, které indukovaly proliferaci a diferenciaci B lymfocytů. Tyto látky, původně označovány jako růstové a diferenciační faktory B lymfocytů, byly postupně určeny jako interleukiny 4, 5 a 6 (1). Interleukin 6 (IL-6), potentní induktor terminální fáze diferenciace plazmatických buněk, byl proto původně označován jako stimulační faktor B lymfocytů 2 (B cell stimulatory factor 2; BSF-2) (2). BSF -2 byl zpočátku považován za nový interferon a nazýván interferon β 2, ovšem při dalším zkoumání u něj nebyla prokázána antivirová aktivita a nebyla zjištěna strukturální ani funkční podobnost s interferonem β (3). IL - 6 byl nezávisle popsán i dalšími skupinami vědců, kteří jej pojmenovali podle zjištěné funkce jako: 26kDa protein fibroblastů, růstový faktor hybridomu/plazmocytomu a faktor stimulující hepatocyty. Po zjištění, že se ve všech případech jedná o produkt stejného genu lokalizovaného na chromozomu 7, se pro tento cytokin začal užívat jednotný název interleukin 6 (1).
Interleukin 6
IL-6 je glykopeptid o molekulové hmotnosti 26 kDa s helikální strukturou produkovaný především mononukleáry, fibroblasty a endoteliálními buňkami. Tvorba IL-6 je stimulována interleukinem 1 a 2, tumor nekrotizujícím faktorem α (TNF α) a interferony. Receptory pro IL-6 (IL-6R) označované také jako CD126, na svém povrchu exprimují T lymfocyty, aktivované B lymfocyty a hepatocyty, ovšem účinek IL-6 není zdaleka omezen pouze na tyto buňky. Samotné navázání IL-6 na transmembránový receptor IL-6R nestačí k transdukci signálu. K té je nutné spojení komplexu IL-6/IL-6R s další molekulou přítomnou na povrchu buňky, která je označována jako transducer signálu gp130. Vytvoření hexameru složeného ze dvou komplexů IL-6/IL-6R a dvou molekul gp130 vede k fosforylaci šesti molekul tyrozinu přítomných v intracelulární části gp130 za účasti cytoplazmatických JAK tyrozin kináz (Janus family tyrosine kinases) a následně k dimerizaci STAT3 (signal transducer and activator of transcription), které se translokují do jádra a aktivují přepis patřičných genů (1).
Molekula gp130 je přítomna ubikviterně na povrchu buněk a je využívána i dalšími cytokiny z rodiny IL-6, mezi něž patří např. interleukin 11, interleukin 27, ciliární neurotrofický faktor, kardiotrofin 1 a onkostatin M. Kromě transmembránové formy se IL-6R vyskytuje i v solubilní formě (sIL-6R). sIL-6R vznikají proteolytickým odštěpením transmembránových IL-6R z povrchu aktivovaných buněk (4) nebo translací mRNA vzniklé alternativním sestřihem (5). Na rozdíl od receptorů jiných cytokinů vytváří solubilní IL-6R vazbou s IL-6 stimulační komplex schopný aktivovat gp130 i na povrchu buněk, které transmembránové IL-6R neexprimují. Tento proces se označuje jako trans-signalizace (6) (obr. 1).
Obr. 1. Aktivační komplex vzniklý vazbou IL-6 na membránově vázaný nebo solubilní receptor se váže na molekulu gp130 ubikviterně přítomnou na buněčné membráně. IL-6: Interleukin 6 mIL-6R: membránový receptor pro IL-6 gp130: transducer signálu gp130 
IL-6 upreguluje proteiny SOCS (suppressors of cytokine signalling), které inhibují přenos signálu pomocí molekul STAT3 a zajišťují tak zpětnou vazbu tlumící přenos signálu IL-6 (1) (obr. 2).
Obr. 2. Vazba komplexu IL-6, IL-6R a gp130 aktivuje signalizační cestu JAK/STAT, která je inhibována zpětnou vazbou za účasti SOCS. JAK, Janus kináza; SHP2,SH2-domain-containing tyrosine phosphatase; STAT, signal transducer and activator of transcription; SOCS 3, supressor of cytokine signalling 3 Podle: 1 Heinrich PC et al. Biochem J 2003; 374:1–20 2 Heinrich PC et al. Biochem J 1998; 334: 297–314 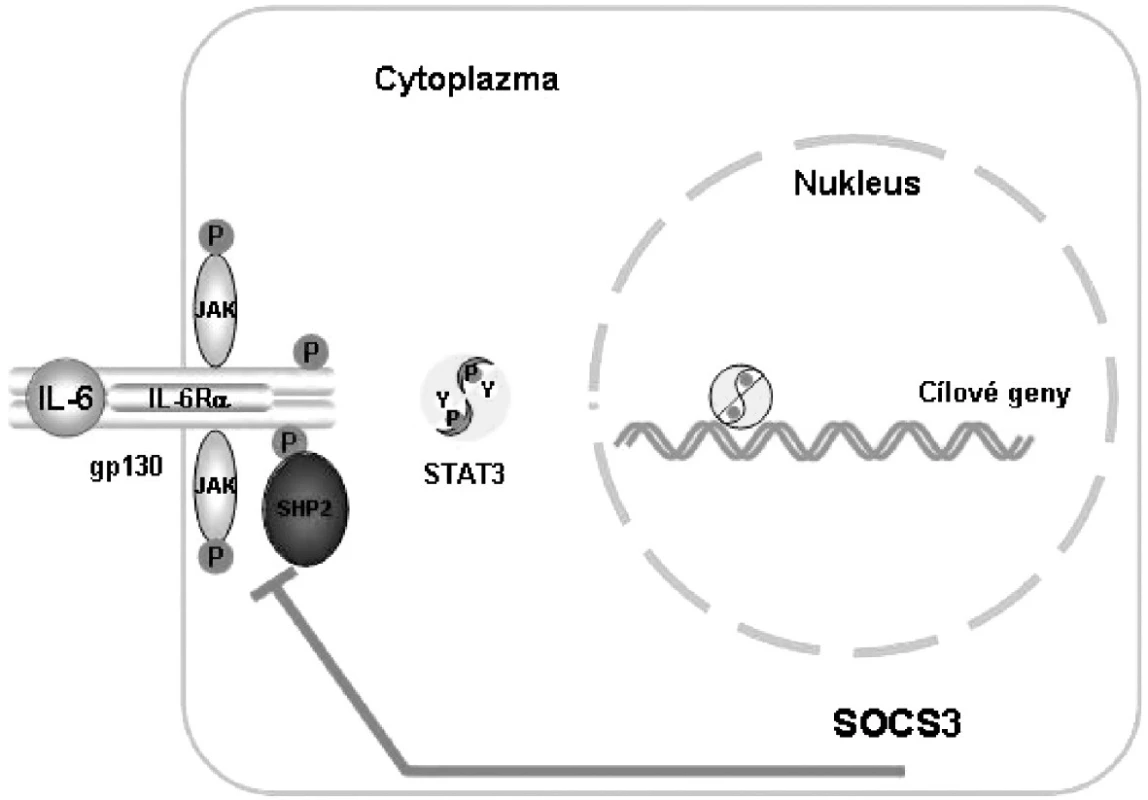
Při akutním zánětu IL-6 vyvolává horečku a stimuluje v hepatocytech tvorbu reaktantů akutní fáze včetně fibrinogenu, C reaktivního proteinu, sérového amyloidového proteinu A a hepcidinu. IL-6 také aktivuje buňky endotelu, které exprimují adhezivní molekuly a prostřednictvím chemokinů IL-8 a MCP-1 (monocyte chemoat - tractant protein) vyvolávají migraci neutrofilů do místa zánětu (7). IL-6 však zároveň působí protizánětlivě indukcí tvorby antagonisty receptoru IL-1 (8) a tak reguluje rozsah lokální a systémové zánětlivé odpovědi.
Při chronickém zánětlivém procesu dochází k přesunu monocytů do místa zánětu a k apoptóze polymorfonukleárních neutrofilů. Nahromaděné monocyty se diferencují na dendritické buňky a makrofágy, které fagocytují vyvolávající agens a apoptotické neutrofily. Makrofágy a dendritické buňky prezentují antigeny T lymfocytům, tím působí jejich aktivaci a diferenciaci. B lymfocyty dozrávají a produkují protilátky. IL-6 se na přechodu od nespecifické k adaptivní formě imunitní odpovědi podílí významným způsobem. Jak již bylo zmíněno, první objevenou funkcí IL-6 je podpora diferenciace B lymfocytů na plazmatické buňky. IL-6 dále působí růst a diferenciaci cytotoxických T lymfocytů, stimuluje angiogenezi a tvorbu destiček z megakaryocytů (obr. 3).
Obr. 3. Pleiotropní charakter interleukinu 6. Podle: Naka T et al. Arthritis Res 2002;4:S233–S242. 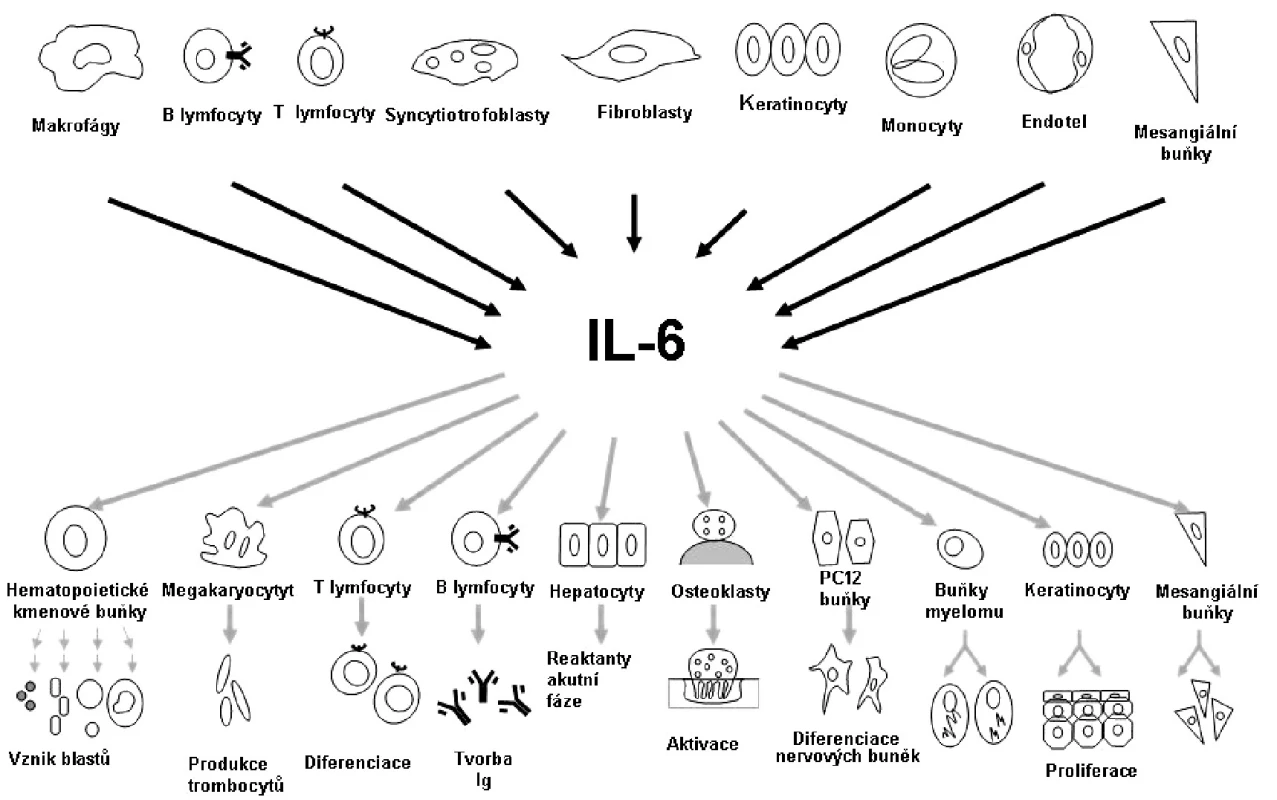
IL-6 u revmatických onemocnění
IL-6 hraje důležitou roli v patogenezi řady autoimunitních a nádorových onemocnění. U nemocných s revmatoidní artritidou (RA) byly zjištěny zvýšené hladiny IL-6 v séru i v synoviální tekutině a byla prokázána korelace hladiny IL-6 s klinickými a laboratorními ukazateli aktivity onemocnění. Hladina IL-6 klesá u nemocných úspěšně léčených chorobu modifikujícími léky.
Účinek IL-6 na B lymfocyty vyvolává hypergamaglobulinemii a produkci autoprotilátek včetně revmatoidních faktorů. Ve zvířecím modelu IL-6 spolu s TGF-β (transforming growth factor) stimuluje diferenciaci naivních prekurzorových buněk na patogenní Th17 a zároveň tlumí vznik regulačních T lymfocytů (9). V lidské imunologii je nově IL-6 spolu s IL-1 a IL-23 obviňován z pomoci T lymfocytům v jejich diferenciaci směrem k Th17 linii. Th17 lymfocyty jsou charakterizované produkcí IL-17, který hraje významnou roli v indukci prozánětlivých genů v řadě buněk. IL-6 pravděpodobně také u lidí brání správnému vývoji T regulačních buněk, které tlumí indukci imunitní odpovědi, a tím i probíhající zánětlivé procesy (10). Ovlivněním B a T lymfocytů se IL-6 podílí na rozvoji dysregulace imunitního systému zodpovědné za chronický zánět typický pro RA. Na lokální úrovni IL-6 působí chemotaxi leukocytů do místa zánětu, zvýšením produkce VEGF (vascular endothelial growth factor) podporuje angiogenezi a stimuluje proliferaci fibroblastů – tímto mechanismem vzniká pannus. Aktivace osteoklastů vede k rozvoji kostních erozí a osteoporózy. Z mimokloubních projevů RA IL-6 vyvolává horečku a únavu. Zvýšené hladiny reaktantu akutní fáze hepcidinu (označovaného také jako liver-expressed antimicrobial peptide, LEAP-1), který je indukován IL-6, snižují vstřebávání železa ve střevě a zároveň inhibují jeho uvolňování z makrofágů, což se podílí na rozvoji anémie chronických onemocnění. Nadprodukce IL-6 má pravděpodobně také vztah ke zvýšené kardiovaskulární morbiditě spojené s RA (11). U nemocných s juvenilní idiopatickou artritidou se systémovým nástupem (SOJIA) byla prokázána korelace sérové hladiny IL-6 s rozsahem a závažností kloubního postižení, s přítomností horečky a trombocytózy, s retardací růstu a osteoporózou (12). U systémového lupusu erythematodes (SLE) byla zjištěna zvýšená sérová hladina IL-6, která v některých studiích korelovala s aktivitou onemocnění a s hladinou anti-dsDNA protilátek. Koncentrace IL-6 v moči u pacientů s mezangiálně proliferativní glomerulonefritidou korelovala s rozsahem mezangiální proliferace. Vyšší hladiny v moči byly také zjištěny v průběhu akutní lupusové nefritidy, po léčbě cyklofosfamidem došlo k jejich poklesu. IL-6 má proliferativní efekt na mezangiální buňky a hraje roli v patogenezi mezangiálně proliferativní glomerulonefritidy a IgA nefropatie. V myších modelech byl prokázán příznivý vliv blokády IL-6 na rozvoj nefropatie (13).
Blokáda IL-6
Blokáda IL-6 se vzhledem k předpokládané roli tohoto cytokinu v patogenezi řady chronických onemocnění stala lákavým terapeutickým cílem. Přímá blokáda IL-6 monoklonální protilátkou u pacientů s maligními nádory spojenými s nadprodukcí IL-6 vedla k prodloužení jeho biologického poločasu, zvýšení sérové hladiny a ke tvorbě imunokomplexů (14). Aplikace myší protilátky proti IL-6 u nemocných s RA vedla ke zmírnění příznaků a ke zlepšení laboratorních parametrů, ale byla vysoce imunogenní (15). Nahrazení jedné monoklonální protilátky směsí několika zaměřených proti různým epitopům IL-6 mělo u myší dobrý efekt (16). Tvorbu polyklonálních protilátek lze také navodit imunizací modifikovanou molekulou IL-6. Tato metoda byla úspěšná u transgenních myší s ektopickou produkcí lidského IL-6 (17). Zajímavou možnost zásahu do procesu IL-6 signalizace umožňuje fúzní protein obsahující extracelulární část molekuly gp130 navázané na Fc část lidského IgG. Tato molekula se váže na komplex IL-6/sIL-6R a tím selektivně inhibuje proces transsignalizace bez ovlivnění přenosu signálu prostřednictvím membránově vázaného IL-6R (18). Zatím nejvíce zkušeností je s monoklonální protilátkou zaměřenou proti IL-6R. Humanizovaná anti IL-6R protilátka nazvaná tocilizumab se již osvědčila v klinických studiích při léčbě RA a SOJIA (viz dále). Nedávno byl popsán nový protein nazvaný S7, který se specificky váže na IL-6R a inhibuje účinky IL-6 (19).
Tocilizumab
Tocilizumab je humanizovaná monoklonální protilátka proti receptoru IL-6, která se váže s vysokou afinitou na transmembránovou i solubilní formu IL-6R. Vazba zabraňuje vzniku komplexu IL-6/IL-6R a tím blokuje signalizaci IL-6. Tocilizumab je podáván ve formě intravenózních infuzí. Biologický poločas je závislý na dávce: při podání 4 mg/kg je 1,8–11,4 dní a při podání 8 mg/kg se prodlužuje na 3,8–12,9 dní. Tocilizumab je stejně jako endogenní IgG katabolizován buňkami retikuloendoteliálního systému (20). V současné době je tocilizumab registrován pouze v Japonsku k léčbě Castelmanovy choroby, juvenilní idiopatické artritidy a RA.
V posledním roce byly zveřejněny výsledky pěti souběžně provedených klinických hodnocení III. fáze s obdobným designem, která prokázala účinnost tocilizumabu u různých skupin nemocných. Do studie OPTION (TOcilizumab Pivotal Trial in Methotrexate Inadequate respONders) bylo zařazeno celkem 623 nemocných s nedostatečnou odpovědí na léčbu MTX (21). Nemocní ke své zavedené léčbě MTX ve stabilní dávce 10–25 mg/týdně dostávali navíc tocilizumab v dávce 8 mg/kg (n = 205), 4 mg/kg (214) nebo placebo (n = 204). Odpovědi ACR20 ve 24. týdnu léčby dosáhlo 120 (59 %) nemocných léčených tocilizumabem v dávce 8 mg/kg, 102 (48 %) nemocných léčených tocilizumabem v dávce 4 mg/kg a 54 (26 %) nemocných z kontrolní skupiny (OR 4,0 95 % CI 2,6-6,1 P < 0,0001 pro tocilizumab 8 mg versus placebo). Odpovědi ACR 70 a remise podle DAS 28 kritérií dosáhlo ve skupině 8 mg/kg 45 (22 %) a 47 (27 %) nemocných, ve skupině 4 mg/kg 26 (12 %) a 21 (13 %) nemocných a ve skupině kontrolní 4 (2 %) a 1 (0,8 %) pacient (P < 0,0001). Ve studii TOWARD (Tocilizumab in cOmbination With traditional DMARD therapy) bylo celkem 1220 nemocných s RA po selhání léčby různými DMARDs randomizováno v poměru 2 : 1 k léčbě tocilizumabem v dávce 8 mg/kg nebo placebem po dobu 24 týdnů (22). V týdnu 24 dosáhlo odpovědi ACR 20 61% nemocných léčených tocilizumabem a 25 % nemocných v kontrolní skupině. ACR 50 a 70 dosáhlo 38 % a 21% nemocných léčených tocilizumabem ve srovnání s 9 % a 3 % pacientů v kontrolní skupině (P < 0,0001). Cílem klinického hodnocení RADIATE (RheumAtoiD Arthritis Study in Anti-TNF FailurEs) bylo prokázat účinnost tocilizumabu po selhání léčby anti TNFα (23). Celkem 499 nemocných s aktivní chronickou RA trvající průměrně 11–13 let, u nichž selhala léčba jedním nebo více inhibitory TNFα, bylo randomizováno k léčbě tocilizumabem v dávce 4 mg/kg, 8 mg/kg nebo i.v. placebem v kombinaci s MTX (průměrná dávka 16 mg týdně). Odpovědi ACR 20 dosáhlo ve 24. týdnu 50 % nemocných na dávce 8 mg/kg, 30,4 % nemocných na 4 mg/kg a 10,1 % nemocných v kontrolní skupině. Nebyl zjištěn žádný vztah mezi odpovědí a celkovým počtem nebo posledním podávaným TNF blokátorem. Zlatým standardem v léčbě RA i v současné době zůstává metotrexát. V klinickém hodnocení AMBITION (The Actemra versus Methotrexate double-Blind Investigative Trial In mONotherapy) byla u 572 nemocných srovnávána účinnost monoterapie tocilizumabem v dávce 8 mg/kg s monoterapií MTX v dávce 20 mg týdně (24). Ve 24. týdnu dosáhlo odpovědi ACR20, ACR50 a ACR70 70 %, 44 % a 28 % nemocných léčených tocilizumabem ve srovnání s 53 %, 34 % a 15 % nemocných na MTX. Remise RA podle kritérií DAS 28 dosáhlo 34 % nemocných na tocilizumabu a 12 % nemocných v kontrolní skupině. Toto klinické hodnocení je první, které prokázalo při léčbě RA vyšší účinnost biologického léčiva v porovnání s MTX. Cílem poslední z pětice studií fáze III – LITHE (TociLIzumab safety and THE prevention of structural joint damage trial) bylo zjistit vliv tocilizumabu na rentgenovou progresi u nemocných s RA (25). Při hodnocení rentgenové progrese onemocnění pomocí Genantovy modifikace Sharpova skóre v týdnu 52 byla progrese nemocných léčených tocilizumabem statisticky významně menší než u nemocných v kontrolní skupině (0,3, 0,3 a 1,1; P < 0,0001). Po roce sledování bylo bez rentgenové progrese 85 % nemocných léčených dávkou 8 mg/kg, 81 % léčených 4 mg/kg a 67 % nemocných v kontrolní skupině. Účinnost tocilizumabu v klinických hodnoceních III. fáze je graficky znázorněna na obrázku 4.
Obr. 4. Podíl nemocných v jednotlivých klinických hodnoceních III. fáze klinického zkoušení, kteří dosáhli klinické odpovědi ACR20. TCZ tocilizumab MTX metotrexát DMARDs chorobu modifikující léky 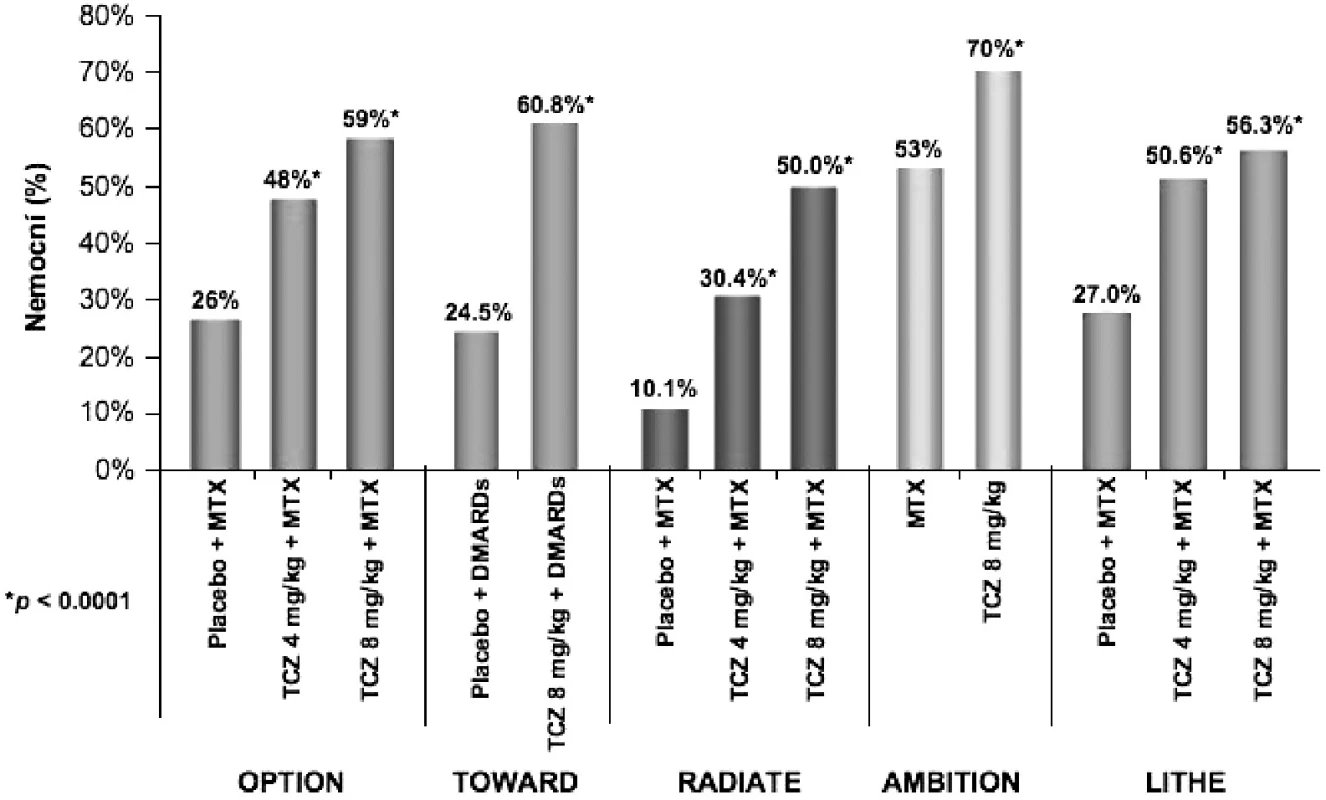
Účinnost tocilizumabu při léčbě SOJIA byla ověřena ve dvou studiích II. fáze klinického hodnocení a v jedné dvojitě slepé, placebem kontrolované studii. Jednorázové podání tocilizumabu v dávce 2, 4 nebo 8 mg/kg skupině 18 dětí vedlo k výraznému snížení aktivity onemocnění, které v závislosti na dávce trvalo až 8 týdnů po aplikaci (26). Opakovaná aplikace tocilizumabu v intervalu 2 týdny u skupiny 11 japonských dětí se SOJIA rezistentní na standardní léčbu vedla u deseti z nich ke zlepšení o 50 % podle JIA DOI a u sedmi ke zlepšení o 70 % (27). Na základě těchto slibných výsledků byla provedena studie III. fáze klinického hodnocení (28). Po 6 týdnech otevřené úvodní fáze bylo 44 dětí randomizováno k tříměsíční léčbě tocilizumabem v dávce 8 mg/kg v intervalu 2 týdny nebo placebem. Po úvodní fázi dosáhlo 91 % dětí ACR Pedi30, 86 % dosáhlo ACR Pedi 50 a 68 % dosáhlo ACR Pedi 70. V průběhu zaslepené fáze si ACR Pedi 30 udrželo 80 % dětí léčených tocilizumabem ve srovnání se 17% v kontrolní skupině. Kazuistická sdělení svědčí pro účinnost tocilizumabu v léčbě Stillovy choroby v dospělosti (29, 30).
K poklesu CRP a klinické aktivity onemocnění docházelo u nemocných s RA i SOJIA již po podání první infuze.
Léčba tocilizumabem je spojena se zvýšenou incidencí infekcí, která byla v průběhu otevřených pokračování klinických hodnocení u nemocných s RA průměrně 3,8 případu na 100 pacientoroků. IL-6 se na rozdíl od TNFα nepodílí na tvorbě granulomů in vivo, a proto nebylo při léčbě tocilizumabem zjištěno riziko infekce TBC. Dostupná data nesvědčí pro zvýšenou incidenci maligních onemocnění.
Tocilizumab může vyvolávat elevaci transamináz, která je obvykle přechodná. Nebyly zaznamenány případy závažného postižení jater. Již v průběhu prvních klinických hodnocení s tocilizumabem byla u některých nemocných zjištěna elevace celkového cholesterolu, které obvykle není spojeno se změnami aterogenního indexu. Vliv těchto změn na riziko kardiovaskulárních onemocnění zatím není jasný. Tocilizumab měl příznivý vliv na anemii a zároveň nezpůsoboval vzestup hodnot hemoglobinu nad normu. U části nemocných může léčba vyvolávat neutropenii, která je většinou mírná a odezní i při pokračování léčby (31). Předpokládaným mechanismem vzniku neutropenie je útlum demarginace a uvolňování neutrofilů z kostní dřeně. U nemocných léčených tocilizumabem nebyl prokázán vztah mezi neutropenií a rizikem infekcí. Při léčbě tocilizumabem je třeba věnovat zvýšenou pozornost riziku perforací gastrointestinálního traktu, zvláště u nemocných s divertikulózou. Riziko vzácných idiosynkratických reakcí, ovlivnění kardiovaskulární morbidity/mortality a riziko maligních onemocnění bude možné určit až na základě dlouhodobého sledování velkých skupin nemocných.
Závěr
Interleukin 6 je pleiotropní cytokin, který hraje důležitou roli při regulaci imunitní odpovědi. IL-6 je zodpovědný za řadu lokálních i celkových projevů revmatických onemocnění, mezi něž patří revmatoidní artritida, JIA se systémovým nástupem a systémový lupus erythematodes. Poznání mechanismu přenosu signálu IL-6 umožnilo vyvinout různé cesty blokády prozánětlivých účinků tohoto cytokinu. Dosud největším úspěchem byla syntéza humanizované mono - klonální protilátky proti IL-6R – tocilizumabu, který prokázal svou účinnost při léčbě RA u nemocných s nedostatečnou odpovědí na MTX, tradiční DMARDs i po selhání anti TNFα léčby a u pacientů s SOJIA.
MUDr. Heřman Mann
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: mann@revma.cz
Zdroje
1. Kishimoto T. Interleukin-6: discovery of a pleiotropic cytokine. Arthritis Res Ther. 2006;8 Suppl 2: S2.
2. Muraguchi A, Kishimoto T, Miki T, et al. T cell-replacing factor (TRF)-induced IgG secretion in human B blastoid cell line and demonstration of acceptors for TRF. J Immunol 1981; 127 : 412–416.
3. Hirano T, Matsuda T, Hosoi K, et al. Absence of antiviral activity in recombinant B cell stimulatory factor 2 (BSF-2). Immunol Lett 1988; 17 : 41–45.
4. Müllberg J, Schooltink H, Stoyan T, et al. The soluble interleukin-6 receptor is generated by shedding. Eur J Immunol 1993; 23 : 794–800.
5. Horiuchi S, Koyanagi Y, Zhou Y, et al. Soluble interleukin-6 receptors released from T cell of granulocyte/macrophage cell lines and human peripheral blood mononuclear cells are generated through an alternative splicing mechanism. Eur J Immunol 1994; 24 : 1945–1948.
6. Peters M, Müller A, Rose-John S. Interleukin-6 and soluble interleukin-6 receptor: direct stimulation of gp130 and hematopoesis. Blood 1998; 92 : 3495–3504.
7. Romano M, Sironi M, Toniatti C, et al. Role of IL-6 and its soluble receptor in induction of chemokines and leukocyte recruitment. Immunity 1997; 6 : 315–325.
8. Gabay C, Smith MF, Eidlen D, et al. Interleukin 1 receptor antagonist (IL-1Ra) is an acute-phase protein J Clin Invest 1997; 99 : 2930–2940.
9. Bettelli E, Carrier Y, Gao W, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature 2006; 441 : 235–238.
10. Kattah MG, Wong MT, Yocum MD, et al. Cytokines secreted in response to Toll-like receptor ligand stimulation modulate differentiation of human Th17 cells.Arthritis Rheum 2008; 58 : 1619–29.
11. Nishimoto N. Interleukin-6 in rheumatoid arthritis. Curr Opin Rheumatol 2006; 18 : 277–281.
12. de Benedetti F, Martini A. Targeting the interleukin-6 receptor: a new treatment for systemic juvenile idiopathic arthritis? Arthritis Rheum 2005; 52 : 687–93.
13. Tackey E, Lipsky PE, Illei GG. Rationale for interleukin-6 blockade in systemic lupus erythematosus. Lupus 2004; 13 : 339–43.
14. Lu ZY, Brailly H, Wijdenes J, et al. Measurement of whole body interleukin-6 (IL-6) production: prediction of the efficacy of anti-IL-6 treatments. Blood 1995; 86 : 3123–31.
15. Wendling D, Racadot E, Wijdenes J. Treatment of severe rheumatoid arthritis by anti-interleukin 6 monoclonal antibody. J Rheumatol 1993; 20 : 259–62.
16. Montero-Julian FA, Klein B, Gautherot E, et al. Pharmacokinetic study of anti-interleukin-6 (IL-6) therapy with monoclonal antibodies: enhancement of IL-6 clearance by cocktails of anti-IL-6 antibodies. Blood 1995; 85 : 917–24.
17. De Benedetti F, Vivarelli M, Pignatti P, et al. In vivo neutralization of human IL-6 (hIL-6) achieved by immunization of hIL-6-transgenic mice with a hIL-6 receptor antagonist. J Immunol 2001; 166 : 4334–40.
18. Rose-John S, Waetzig GH, Scheller J, et al. The IL-6/sIL-6R complex as a novel target for therapeutic approaches. Expert Opin Ther Targets. 2007; 11 : 613–24.
19. Su JL, Lai KP, Chen CA, et al. A novel peptide specifically binding to interleukin-6 receptor (gp80) inhibits angiogenesis and tumor growth. Cancer Res 2005; 65 : 4827–35.
20. www.fda.gov/ohrms/dockets/ac/acmenu.htm
21. Smolen JS, Beaulieu A, Rubbert-Roth A, et al. Effect of interleukin-6 receptor inhibition with tocilizumab in patients with rheumatoid arthritis: a double-blind, placebo-controlled, randomised trial. Lancet 2008; 371 : 987–97.
22. Genovese MC, McKay JD, Nasonov EL, et al. Interleukin-6 receptor inhibition with tocilizumab reduces disease activity in rheumatoid arthritis with inadequate response to disease-modifying antirheumatic drugs: the tocilizumab in combination with traditional disease-modifying antirheumatic drug therapy study. Arthritis Rheum 2008; 58 : 2968–80.
23. Emery P, Keystone E, Tony HP, et al. IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti-tumour necrosis factor biologicals: results from a 24-week multicentre randomised placebo-controlled trial. Ann Rheum Dis 2008; 67 : 1516–23.
24. Jones G, Gu JR, Lowenstein M, et al. Tocilizumab Monotherapy is Superior to Methotrexate Monotherapy in Reducing Disease Activity in Patients with Rheumatoid Arthritis. Ann Rheum Dis 2008; 67 : 89.
25. Kremer JM, Fleischmann RM, Halland AM. Tocilizumab Inhibits Structural Joint Damage in Rheumatoid Arthritis Patients with an Inadequate Response to Methotrexate. Abstract L14 ACR 2008.
26. Woo P, et al. Open label phase II trial of single, ascending doses of MRA in Caucasian children with severe systemic juvenile idiopathic arthritis: proof of principle of the efficacy of IL-6 receptor blockade in this type of arthritis and demonstration of prolonged clinical improvement. Arthritis Res Ther 2005; 7 : 1281–8.
27. Yokota S, et al. Therapeutic efficacy of humanized recombinant anti-interleukin-6 receptor antibody in children with systemic-onset juvenile idiopathic arthritis. Arthritis Rheum 2005; 52 : 818–25.
28. Yokota S, et al. Efficacy and safety of tocilizumab in patients with systemic-onset juvenile idiopathic arthritis: a randomised, double-blind, placebo-controlled, withdrawal phase III trial. Lancet 2008; 371 : 998–1006.
29. Iwamoto M, et al. Humanized monoclonal anti-interleukin-6 receptor antibody for treatment of intractable adult-onset Still‘s disease. Arthritis Rheum 2002; 46 : 3388–3389
30. Nakahara H, et al..A case report of a patient with refractory adult-onset Still‘s disease who was successfully treated with tocilizumab over 6 years. Mod Rheumatol 2008 E pub ahead of print
31. Smolen JS, Beaulieu AD, Dikranian A, et al. Safety of Tocilizumab in Patients with Rheumatoid Arthritis: Pooled Analysis of Five Phase 3 Clinical Trials Arthritis Rheum 2008; 58: S784.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2009 Číslo 1- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Doporučení České revmatologické společnosti pro monitorování bezpečnosti nesteroidních antirevmatik při léčbě revmatoidní artritidy
- Předoperační příprava pacienta s revmatoidní artritidou
- Vliv modifikace implantátů pro náhrady osteochondrálních defektů na genovou expresi chondrocytů
- Degradační produkty kolagenu a elastinu jako možné ukazatele aktivity sklerodermie
- Interleukin 6 u revmatických onemocnění
- Novinky v biologické terapii revmatoidní artritidy a výhled do budoucna
- Doporučení České revmatologické společnosti pro monitorování bezpečnosti léčby revmatoidní artritidy
- Rituximab v terapii Wegenerovy granulomatózy refrakterní na standardní léčbu
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Interleukin 6 u revmatických onemocnění
- Novinky v biologické terapii revmatoidní artritidy a výhled do budoucna
- Rituximab v terapii Wegenerovy granulomatózy refrakterní na standardní léčbu
- Degradační produkty kolagenu a elastinu jako možné ukazatele aktivity sklerodermie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



