-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Fekální bakterioterapie v léčbě recidivující střevní infekce bakterií Clostridioides difficile – 10leté zkušenosti gastroenterologického pracoviště
Faecal microbiota transplantation in the treatment of recurrent intestinal Clostridioides difficile infection – a ten-year single-center experience
Clostridioides difficile (Clostridium difficile in older taxonomy) is a gram-positive anaerobic and bacteria enabled by endospores. Clostridioides difficile is currently the main cause of nosocomial infections in developed countries. Due to the high probability of developing bacterial resistance to treatment and the numerous recurrences in multiple chronic conditions in older adults of our society it causes a widespread medical problem. Faecal microbiota transplantation (FMT) is a highly effective method for treating recurrent intestinal Clostridioides difficile infections (CDI). With this method the potential mechanism of effect is the transmission of a complex intestinal ecosystem, including vital microorganisms, from the donor to the recipient.
Presenting the results of monocentric prospective monitoring: Primary aim of the study was to evaluate long-term remission (the continued absence of clinical manifestations of CDI 3 months after FMT administration). The secondary aim of the study was to monitor the short-term remission in the 7 days after FMT administration.
Demographic data, information about CDI and the details of therapy were obtained and completed by the treating physician of each patient or by targeted questioning of the patient or their family. We used clinical monitoring to determine the effect of the treatment. The examinations of stool donors and the preparation for a faecal microbiota transplantation were performed according to the currently valid guidelines of the Czech Society of Infectious Diseases for the treatment of the recurrent bacterial infection Clostridioides difficile with faecal microbiota transplantation.
The follow-ups took place from February 2011 to July 2021 in the gastroenterology department at the AGEL Ostrava-Vítkovice Hospital and included 116 patients with their first and subsequent recurrence of CDI that were treated with faecal bacteriotherapy. The median age of our patients was 71 years old (the youngest was 19 years old, the oldest 103 years old). 69 women and 47 men took part in the study. 56 patients had their first recurrence of CDI, 41 had a second attack, and 20 patients had a third and subsequent recurrences. In 62 patients (53.4 %), the route of FMT administration was a local enema into the left colon. With 37 patients (31.9 %) we used a colonoscopy after standard anterograde bowel preparation. With 12 patients (10.3 %) gastroscopy administration (deep into the duodenum) was used. 4 patients (3.5 %) were given a nasoenteral tube and one patient (0.9 %) was administered FMT per percutaneous endoscopic gastrostomy (PEG). We applied a frozen universal donor FMT in 81 patients (69.8 %), and a freshly prepared FMT from a person living in the same household was used in 35 patients (30.1 %). The secondary endpoint (the absence of clinical manifestations of CDI within 7 days of FMT administration) was achieved with 102 patients (87.9 %) in our study. The fulfilment of the primary endpoint (the development of long-term remission) was observed with 93 patients (80.2 %). An early administration of FMT appears to be a significant predictor of treatment effect (p = 0.05; OR 5.11; 95% CI 1.65–15.8).
Faecal microbiota transplantation is an effective and safe therapy for recurrent intestinal Clostridioides difficile infection, and it respects the up-to-date guidelines for treatment. Of the 116 patients included in our study with first and subsequent CDI, we achieved long-term remission in 80.2 % of them. An early administration of FMT appears to be a significant predictor of treatment effect.
Keywords:
Colitis – microbiota – faecal microbiota transplantation (FMT) – Clostridioides difficile infection (CDI)
Autoři: Barbora Pipek 1,2,3; Hana Valentová 4; Petr Fojtík 1,3; Ondřej Urban 2
Působiště autorů: Centrum péče o zažívací trakt, Nemocnice AGEL Ostrava-Vítkovice, a. s. 1; II. interní klinika – gastroenterologická a geriatrická LF UP a FN Olomouc 2; Katedra interních oborů LF OU v Ostravě 3; Oddělení klinické biochemie a hematologie, Nemocnice AGEL Ostrava-Vítkovice, a. s. 4
Vyšlo v časopise: Čas. Lék. čes. 2022; 161: 126-130
Kategorie: Původní práce
Souhrn
Infekce grampozitivní anaerobní a sporulující bakterií Clostridioides difficile (dle starší taxonomie Clostridium difficile) je v rozvinutých zemích světa v současnosti hlavní příčinou nozokomiálních průjmů. Vzhledem k velké pravděpodobnosti vzniku rezistence bakterií na léčbu, četným recidivám a vysokému věku, včetně polymorbidity nakažených, představuje rozsáhlý medicínský problém. Fekální bakterioterapie (FMT – faecal microbiota transplantation/therapy) je vysoce efektivní metodou léčby recidivující střevní infekce bakterií Clostridioides difficile (CDI), kdy předpokládaným mechanismem účinku je přenos komplexního střevního ekosystému, včetně vitálních mikroorganismů, z dárce na příjemce.
Prezentace výsledků monocentrického prospektivního sledování: Primárním cílem studie bylo hodnocení dlouhodobé remise, tzn. pokračující absenci klinických projevů CDI s odstupem tří měsíců od podání FMT. Sekundárním cílem jsme sledovali rozvoj krátkodobé remise, tzn. vymizení klinických obtíží asociovaných s infekcí CDI do sedmi dní od podání FMT.
Demografické údaje, informace o průběhu infekce CDI a detaily terapie byly získány ze zdravotnické dokumentace za probíhající hospitalizace pacienta nebo cíleným dotazováním pacienta či rodinných příslušníků. Ke stanovení efektu léčby jsme využili klinického sledování. Vyšetření dárců stolice a příprava fekální transplantátu probíhala dle aktuálně platných doporučení Společnosti infekčního lékařství ČLS JEP pro léčbu rekurující bakteriální infekce Clostridioides difficile fekální bakterioterapii.
Sledování probíhalo od února 2011 do července 2021 v Centru péče o zažívací trakt v Nemocnici AGEL Ostrava-Vítkovice a bylo do něho zařazeno 116 pacientů s první a další recidivou střevní infekce bakterií Clostridioides difficile, kteří byli léčeni fekální bakterioterapií. Medián věku pacientů byl 71 let, v souboru bylo 69 žen a 47 mužů. U 55 (48,3 %) pacientů se jednalo o podání FMT při první recidivě CDI, u 41 (35,3 %) při druhé atace, u 20 (17,2 %) pacientů se jednalo o třetí a další recidivu. Způsob podání FMT byl u 62 pacientů (53,4 %) lokálním klysmatem do levého tračníku, u 37 nemocných (31,9 %) kolonoskopicky po standardní anterográdní přípravě, u 17 pacientů (14,7 %) bylo podání zajištěno do duodena. U 81 pacientů (69,8 %) jsme aplikovali zamražený transplantát univerzálního dárce, 35 nemocných (30,1 %) souboru bylo léčeno čerstvě připraveným transplantátem od osoby žijící ve společné domácnosti. Splnění primárního cíle (rozvoj dlouhodobé remise) jsme pozorovali u 93 pacientů (80,2 %). Jako významný prediktor efektu léčby se jeví časná fáze rekurence v době podání FMT (p = 0,05; OR 5,11; 95% CI 1,65–15,8).
Fekální bakterioterapie je při respektování dosud známých odborných doporučení pro léčbu účinnou a bezpečnou terapií recidivující střevní infekce bakterií Clostridioides difficile. V našem souboru 116 pacientů s první a další atakou CDI bylo zjištěno, že významným prediktorem efektu léčby byla časná fáze rekurence nemoci v době podání FMT. Dlouhodobé remise (tzn. pokračující absenci klinických projevů CDI s odstupem 3 měsíců od podání FMT) bylo dosaženo u 80,2 % pacientů.
Klíčová slova:
mikrobiota – Clostridioides difficile – kolitida – fekální bakterioterapie
ÚVOD
Střevní infekce bakterií Clostridioides difficile (CD) je celosvětově nejčastějším infekčním průjmovým onemocněním vzniklým za hospitalizace, jehož dominantní příčinou je narušení střevní mikrobioty užíváním širokospektrých antibiotik. V Česku je jeho incidence v posledním desetiletí na vzestupu a v roce 2019 bylo hlášených jeho 4600 případů (1). Spolu s nárůstem počtu případů nákazy se zvyšuje i závažnost průběhu infekce, mortalita léčených a stále více problematický je i výskyt recidiv, které bývají hůře léčitelné než prvotní nákaza. Rekurence této nákazy je v Česku udávaná kolem 20 % a u každé další ataky stoupá až k riziku 60 % (2).
Standardní terapii CDI představují antibiotika (ATB), přičemž v první linii antibiotik je poslední léta nahrazován dlouho užívaný metronidazol perorálně podávaným vankomycinem, který disponuje oproti metronidazolu výbornou intestinální koncentrací a prokazuje zatím dostatečnou citlivost na většinu ribotypů CD (3, 4).
FMT je vysoce efektivní léčebnou metodou indikovanou k léčbě rekurující střevní infekce bakterií Clostridioides difficile po selhání antibiotické léčby podávané při první, popř. další atace (5, 6).
METODIKA
Design studie a studijní populace
Jedná se o monocentrickou studii, do které byly v období od února 2011 do července 2021 zařazení pacienti s první a další recidivou CDI. Diagnostika CDI byla klinická a laboratorní. Mezi klinické příznaky infekce jsme zařadili změnu defekačního stereotypu ve smyslu rozvoje průjmů (více než tři řídké stolice denně). Dále jsme zaznamenávali bolesti břicha, systémové projevy infekce (teploty, schvácenost, dehydrataci), anamnézu léčbu antibiotiky v předchozích 3 měsících nebo provedené kolonoskopické vyšetření (obr. 1). Tyto údaje pro nás měly zásadní anamnestický potenciál, ale jejich absence nebránila zařazení pacienta do sledování. Zahájená ATB terapie pro CDI před podáním FMT byla den před samotným výkonem ukončena.
Obr. 1. Endoskopický obraz bělavých pablán ulpívajících na sliznice tračníku u pacienta s CDI 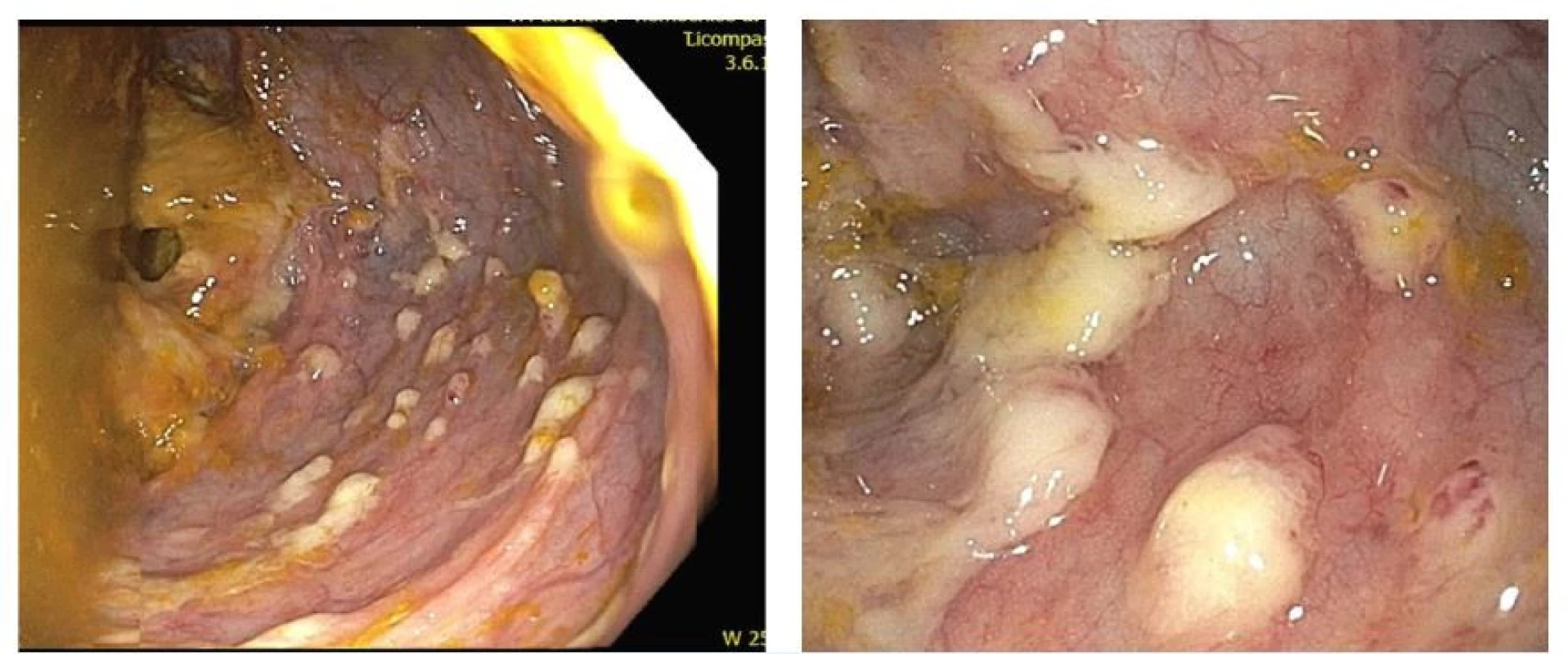
(zdroj: archiv autorů) Laboratorní diagnostika zahrnovala dvoustupňový testovací algoritmus, kdy každý vzorek stolice byl vyšetřen imunoenzymovou analýzou (EIA) na přítomnost glutamátdehydrogenázy (GDH, tzv. antigen) a toxinu A/B.
- Při pozitivitě na přítomnost GDH a toxinu (A, B nebo obojího) byl pacient veden jako CDI-pozitivní a zařazen do sledování.
- Při pozitivitě GDH a negativitě toxinů byly izoláty, pro odlišení toxigenních a netoxigenních kmenů, dále testovány na přítomnost genů (DNA) pro tvorbu toxinů pomocí molekulární metody na základě PCR (NAAT – amplifikační test nukleové kyseliny). Při pozitivitě daného vyšetření a při klinických obtížích odpovídajících CDI byl pacient zařazen do sledování.
- Při negativitě GDH i toxinů pacient do sledování zařazen nebyl.
Sběr dat
Demografické údaje, informace o průběhu infekce CDI a detaily terapie byly získány ze zdravotnické dokumentace za probíhající hospitalizace pacienta nebo cíleným dotazováním pacienta či rodiny. Pro účely sledování jsme stanovili zařazovací a vylučovací kritéria. Mezi zařazovací kritéria patřila první a další recidiva CDI, která byla mikrobiologicky verifikována s výše uvedenými laboratorními známkami infektu a klinickým projevem průjmů, věk 18 let a více a podepsaný informovaný souhlas se sledováním. Vyřazovací kritéria zahrnovala věk do 18 let, diagnózu chronického střevního zánětu typu Crohnovy choroby či ulcerózní kolitidy, probíhající septický šok nebo multiorgánové selhání, podezření na toxické megakolon, absence klinických a laboratorních známek CDI, současně užívané inhibitory protonové pumpy v medikaci (nutné je jejich vysazení 72 hodin před podáním léčby), současná ATB terapie (nutno vysadit minimálně 24 hodin před podáním transplantátu) a nesouhlas pacienta.
Cíle sledování
Primárním cílem studie bylo hodnocení dlouhodobé remise, tzn. pokračující absence klinických projevů CDI s odstupem tří měsíců od podání FMT.
Sekundárním cílem jsme sledovali rozvoj krátkodobé remise, tzn. vymizení klinických obtíží asociovaných s CDI infekci do sedmi dní od podání FMT.
Vyšetření dárců stolice
Dárci stolice byli vyšetřování dle aktuálně platných doporučení Společnosti infekčního lékařství ČLS JEP pro fekální bakterioterapii (5). Část našich pacientů byla léčena (převážně v prvotních fázích sledování) podáním nálevu od dárce žijícího ve společné domácnosti s nemocným, druhou variantou byl tzv. univerzální dárce (tj. zdravá osoba, která poskytla stolici za účelem FMT).
Oba typy dárců jsme podrobili detailnímu odběru anamnézy, klinickému a laboratornímu vyšetření. Při výběru univerzálního dárce jsme preferovali mladé zdravé vitální a neobézní jedince ve věku do 50 let, s dlouholetým neužíváním antibiotické léčby a s aktivním pohybovým přístupem k životu.
Vylučovali jsme všechny ostatní potenciální dárce s anamnézou jakékoliv malignity, s aktivně probíhajícím infekčním onemocněním, alergiky, diabetiky, hypertoniky. Dále pak pacienty s anamnézou dlouhodobého pobytu v rizikových zemích s nízkým socioekonomickým a hygienickým standardem, s lékovou polypragmazií, s anamnézou transfuzní léčby atd. Univerzální dárce byl vyšetřován pravidelně před každým darováním stolice. Sledování pacientů probíhalo až do července 2021 a s nástupem pandemie COVID-19 jsme nepozorovali žádné podstatné změny v algoritmu výběru či testování dárce a zpracování dárcovské stolice.
Příprava, skladování a podání fekálního mikrobiálního transplantátu
Čerstvá stolice dárce, ne starší 12 hodin o hmotnosti 30–50 g (odpovídající jedné dávce transplantátu) byla mechanicky rozmělněna ve fyziologickém roztoku za vzniku kašovité směsi, ze které byla následně odfiltrována tuhá složka přes gázu a doředěna roztokem do požadovaného objemu dle způsobu podání. Pro přípravu mraženého nálevu byla směs navíc naředěna glycerolem do koncentrace 10 % a zamražena na –70–80 °C.
Nálev z připravené stolice jsme pacientům aplikovali do duodena (v objemu 100 ml) při provedení horní endoskopie nebo kolonoskopem (v objemu 300 ml) při vytahování přístroje z céka pomalou aplikací do celého tračníku sprejovou kanylou nebo nálevem do levého tračníku při vhodném polohování pacienta bez potřeby střevní očisty (150 ml) nebo nazoenterální sondou (100 ml). V jednom případě při nemožnosti jiného podání u vysoce polymorbidního pacienta se špatnou prognózou jsme realizovali aplikaci perkutánní endoskopickou gastrostomií zavedenou z jiného důvodu.
Statistická analýza
Byla provedena standardní deskriptivní statistická analýza. K analýze dat byl použit statistický software IBM SPSS Statistics verze 23 a k vyhledání významných prediktorů úspěšnosti léčby byla použita Logistická regresní analýza.
Etické aspekty
Schválení Centrální etické komise proběhlo před zahájením sledování v říjnu 2010 ve Vítkovické nemocnici AGEL, Ostrava (referenční číslo: 2010/13). Všichni účastníci studie poskytli před zařazením do sledování písemný informovaný souhlas.
VÝSLEDKY
Do sledování bylo zařazeno 116 pacientů s první a další recidivou střevní infekcí bakterií Clostridioides difficile, kteří byli léčeni fekální bakterioterapií. Detailní charakteristiku souboru popisuje tab. 1.
Tab. 1. Demografické a klinické údaje pacientů (n = 116) 
V souboru bylo 69 žen a 47 mužů a jejich medián věku dosahoval 71 let (nejmladšímu bylo 19 let, nejstaršímu 103 let). Většina pacientů souboru (114) byli nemocní s minimálně jednou komorbiditou a 69 z nich užívalo více než 5 léčebných přípravků denně (59,5 %).
76 pacientů (65,5 %) užívalo v předchozích 90 dnech od rozvoje první ataky CDI antibiotickou léčbu, přičemž nejčastěji se jednalo o skupinu betalaktamových antibiotik (21 pacientů, 27,6 %), 13 pacientů užívalo fluorochinolony (17,1 %), u 27 pacientů jsme typ užívaného antibiotika nezjistili (35,5 %). Indikací pro léčbu antibiotiky byl u dvou třetin nemocných plicní infekt. Opakovanou léčbu antibiotiky v předchozích 90 dnech udávalo 61 pacientů (52,6 %).
Prvotní ataka CDI byla u 75 pacientů (64,7 %) léčena metronidazolem, u 37 nemocných perorálně vankomycinem (31,9 %), u čtyřech pacientů (3,44 %) jsme se typu antibiotické léčby nedopátrali.
U 56 pacientů (48,3 %) se jednalo o podání FMT při první recidivě CDI, u 41 (35,3 %) při druhé atace, u 20 (17,2 %) pacientů se jednalo o třetí a další recidivu. Recidivu jsme definovali jako návrat klinických obtíží typických pro CDI potvrzených výše zmíněnou laboratorní diagnostikou.
Způsob podání FMT byl u 62 pacientů (53,4 %) lokálním klysmatem do levého tračníku, u 37 nemocných (31,9 %) kolonoskopicky po standardní anterográdní přípravě, u 12 pacientů (10,3 %) bylo podání gastroskopem hluboko do duodena, u 4 pacientů (3,5 %) nazoenterální sondou a u jednoho pacienta (0,9 %) jsme transplantát podali do perkutánní endoskopické gastrostomie.
U 81 pacientů (69,8 %) jsme aplikovali zamražený transplantát univerzálního dárce, 35 nemocných (30,1 %) souboru bylo léčeno FMT čerstvě připravenou od osoby žijící ve společné domácnosti.
Ze 13 pacientů, kteří nereagovali na podání transplantátu, jsme druhou FMT podali u 3 pacientů (23,1 %), efekt léčby ale nenastal ani u jednoho pacienta. Rekurence zde byla hodnocena jako časný návrat CDI po předchozí FMT. 3 pacienti byli indikováni k provedení kolektomie pro následný rozvoj toxického megakolon (23,1 %). Z těchto pacientů přežila jedna pacientka, která je i nyní je v dlouhodobé remisi onemocnění. Všech 13 pacientů, kteří na podání FMT nereagovali byli léčení dalším stupněm ATB terapie (fidaxomicin nebo tigecyklin). 7 pacientů ze 13, kteří nereagovali na léčbu (53,8 %) zemřelo v důsledku závažných komorbidit a při přetrvávající infekci CDI. Celková mortalita souboru v asociaci s CDI je velmi limitovaně zjistitelná vzhledem k četným komorbiditám a věku nemocných. Do 3 měsíců od podání FMT zemřelo celkem 8 pacientů s přítomnou CDI (celková mortalita souboru činí 6,9 %).
Časné nežádoucí účinky léčby (do 12 hodin po podání) jsme zaznamenali u 9 pacientů (7,8 %) a jednalo se nejčastěji o udávanou nauzeu po gastroskopickém zavedení u sedmi pacientů a bolesti břicha u dvou nemocných.
Splnění primárního cíle (rozvoj dlouhodobé remise) jsme pozorovali u 93 pacientů (80,2 %). Sekundárního cíle (absence klinických projevů CDI do 7 dní od podání FMT) bylo v našem souboru dosaženo u 102 pacientů (87,9 %).
Jako významný prediktor efektu léčby se jeví časnost podání FMT (četnost recidivy CDI). Pacienti při druhé rekurenci nemoci měli 9× vyšší šanci úspěšné léčby než pacienti po třetí a další recidivě (poměr šancí [OR] 9,25; 95% interval spolehlivosti [CI] 2,39–35,8) a pacienti po první recidivě nemoci měli více než 5× vyšší šanci úspěšné léčby než pacienti po třetí a další (OR 5,11; 95% CI 1,65–15,8). Typ transplantátu (zamrazený transplantát od univerzálního dárce nebo osoby spolužijící) a způsob aplikace nebyly významnými prediktory úspěšnosti léčby.
DISKUSE
V námi sledovaném souboru nemocných jsme se zabývali významem a efektivitou fekální bakterioterapie u recidivující střevní infekce bakterií Clostridioides difficile. První odborná publikace zabývající se léčebným využitím FMT pochází z šedesátých let minulého století, prvotní zmínky o využití lidské stolice k léčbě průjmů a otrav z jídla však pochází již ze staré Číny ze 4 století n. l. (6). Předpokládaným mechanismem účinku FMT je přenos bohatého a komplexního střevního ekosystému, včetně vitálních mikroorganismů, z dárce na příjemce, a tím obnovení mikrobiální homeostázy střeva (6–8).
FMT je vysoce efektivní léčebnou metodu, jejichž efekt a bezpečnost jsou již léta diskutovány v obsáhlých zahraničních souborech (7–10). Dle Evropské společnosti pro klinickou mikrobiologii a infekční nemoci (ESCMID) je u recidivující CDI FMT léčbou volby (3, 6). FMT je již v mnoha zemích součásti péče o tyto pacienty, nejedná se však o metodu globálně standardizovanou a mnohdy je doprovázena četnými etickými či medicínskými nesrovnalostmi a otázkami.
V naší studii jsme prokázali efektivitu léčby u 87,9 % (resp. 80.2 %) pacientů, což je výsledek srovnatelný se zahraničními studiemi. Terveerová et al. prezentovali nizozemský soubor 129 pacientů s rekurentní CDI léčených 143 FMT v celkem 40 nemocnicích. Remise po dvou měsících po podání transplantátu byla zaznamenána u 89 % pacientů souboru, dlouhodobá remise (po 42 týdnech) přetrvávala u 61 % pacientů (9). Pro léčbu využívali řádně vyšetřené dárce stolice a centralizovanou „banku stolice“. Baunwall et al. v roce 2020 publikovali obsáhlé review, do kterého zahrnuli 45 studií z celého světa. Souhrnný klinický efekt zde byl prokázán u 91 % pacientů s recidivující CDI léčených FMT (10).
V Česku je průkopníkem fekální bakterioterapie u CDI brněnské pracoviště Kliniky infekčních chorob LF MU a FN Brno. Polák a kol. v roce 2014 prezentovali zatím největší český soubor 80 pacientů, kde dominovalo podání transplantátu orálním přístupem (nazojejunální sondou) a celková úspěšnost metody byla 83,1 %. Neprokázali závažné nežádoucí události a léčbu taktéž považují za bezpečnou (13, 14).
V našem souboru 116 pacientů jsme léčili 81 pacientů (69,8 %) zamraženým transplantátem univerzálního dárce, 35 nemocných (30,1 %) čerstvě připravenou od osoby žijící ve společné domácnosti a nepozorovali jsme zde statistický významný rozdíl v efektivitě léčby. V české literatuře nenacházíme srovnání těchto dvou metod. Satokariová et al. i Costello et al. ve svých souborech nemocných taktéž neprokázali sníženou účinnost jedné z výše uvedených modalit (15, 16).
Jako významný prediktor efektu léčby se však jeví časnost podání FMT (četnost recidivy CDI). Pacienti, kterým je aplikována FMT při druhé recidivě mají 9,25× vyšší šanci úspěšné léčby (dosažení dlouhodobé remise) než pacienti v recidivě třetí a další.
ZÁVĚR
Fekální mikrobiální terapie je vysoce efektivní a bezpečnou metodou terapie recidivující střevní infekce bakterií Clostridioides difficile. V našem souboru 116 pacientů jsme prokázali rozvoj dlouhodobé remise (tzn. pokračující absenci klinických projevů CDI s odstupem 3 měsíců od podání FMT) u 80,2 % nemocných, nezaznamenali jsme závažné nežádoucí účinky léčby a míra rekurence onemocnění po provedení FMT při respektování režimových opatření byla nízká. Jako významný prediktor efektu léčby se jeví časnost podání.
Seznam použitých zkratek
CD Clostridioides difficile
CDI infekce bakterií Clostridioides difficile
EIA imunoenzymová analýza
FMT přenos fekální mikrobioty/léčba fekální mikrobiotou
GDH glutamátdehydrogenáza
NAAT amplifikační test nukleové kyseliny
PCR polymerázová řetězová reakce
Adresa pro korespondenci:
MUDr. Barbora Pipek
Centrum péče o zažívací trakt
Nemocnice AGEL Ostrava-Vítkovice, a. s.
Zalužanského 1192/15, 703 00 Ostrava-Vítkovice
Tel.: 595 633 224
e-mail: barbora.pipek@seznam.cz
Zdroje
- Stebel R, Vojtilová L, Husa P. Aktuality v léčbě a prevenci klostridiové kolitidy. Vnitřní lékařství 2020; 66: e24–e28.
- Krutová M. Epidemiologie infekcí vyvolaných Clostridium difficile (CDI) v České republice. Vnitřní lékařství 2020; 66: e4–e5.
- van Prehn J, Reigadas E, Vogelzang EH et al. European Society of Clinical Microbiology and Infectious Diseases: 2021 update on the treatment guidelines document for Clostridioides difficile infection in adults. Clin Microbiol infect 2021; 27 (Suppl. 2): S1–S21.
- Debast SB, Bauer MP, Kuijper EJ et al. European Society of Clinical Microbiology and Infectious Diseases: Update of the treatment guidance document for Clostridium difficile infection. Clin Microbiol Infect 2014; 20 (Suppl. 2): 1–26.
- Polívková S, Vojtilová L, Husa P a kol. Doporučený postup fekální bakterioterapie pro léčbu rekurentní klostridiové kolitidy. Společnost infekčního lékařství ČLS JEP, 2018. Dostupné na: www.infekce.cz/DPFMT18.htm
- Stebel R, Vojtilová L, Husa P a kol. Transplantace střevní mikrobioty – historie, současnost a budoucnost. Gastroenterologie a hepatologie 2020; 74 : 54–61.
- Drastich P, Bajer L, Kverka M. Možnosti terapeutické manipulace se střevní mikrobiotou. Vnitřní lékařství 2018; 64 : 665–671.
- Husa P, Beneš J, Nyč O. Klostridiová kolitida – stále narůstající nebezpečí. Interní medicína pro praxi 2013; 15 : 201–204.
- Terveer EM, Vendrik KE, Ooijevaar RE et al. Faecal microbiota transplantation for Clostridium difficile infection: Four years' experience of the Netherlands Donor Feces Bank. United European Gastroenterol J 2020; 8 : 1236–1247.
- Baunwall SM, Lee MM, Eriksen MK et al. Faecal microbiota transplantation for recurrent Clostridioides difficile infection: An updated systematic review and meta-analysis. EClinicalMedicine 2020; 29–30 : 100642.
- Kassam Z, Lee CH, Yuan Y et al. Faecal microbiota transplantation for Clostridium difficile infection: systematic review and meta-analysis. Am J Gastroenterol 2013; 108: 500–508.
- Moayyedi P, Yuan Y, Baharith H et al. Faecal microbiota transplantation for Clostridium difficile-associated diarrhoea: a systematic review of randomised controlled trials. Med J Aust 2017; 207: 166–172.
- Polák P, Freibergerová M, Husa P a kol. Fekální bakterioterapie v léčbě rekurentní kolitidy způsobené Clostridium difficile na Klinice infekčních chorob Fakultní nemocnice Brno v letech 2010–2014 – prospektivní studie. Epidemiologie, mikrobiologie, imunologie 2015; 64 : 232–235.
- Šturdík I, Hlavatý T, Payer J. Fekálná mikrobiálna terapia. Vnitřní lékařství 2016; 62 : 147–151.
- Satokari R, Mattila E, Kainulainen V et al. Simple faecal preparation and efficacy of frozen inoculum in faecal microbiota transplantation for recurrent Clostridium difficile infection – an observational cohort study. Aliment Pharmacol Ther 2015; 41: 46–53.
- Costello SP, Conlon MA, Vuaran MS et al. Faecal microbiota transplant for recurrent Clostridium difficile infection using long-term frozen stool is effective: clinical efficacy and bacterial viability data. Aliment Pharmacol Ther 2015; 42 : 1011–1018.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek ÚvodemČlánek Harold Eliot Varmus (*1939)
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
2022 Číslo 3-4- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
-
Všechny články tohoto čísla
- Současná bariatrická/metabolická chirurgie
- Antiobezitika před bariatrickou operací a po ní – jak je využít co nejlépe
- Nutriční péče o bariatrické pacienty
- Doporučení k psychologickému vyšetření před bariatrickou operací
- Fekální bakterioterapie v léčbě recidivující střevní infekce bakterií Clostridioides difficile – 10leté zkušenosti gastroenterologického pracoviště
- Bartterův a Gitelmanův syndrom
- Myokarditida jako projev onemocnění COVID-19 a po očkování proti této nemoci
- Anesteziologická péče pro nekardiochirurgické výkony u pacientů po transplantaci srdce
- Torakoskopický přístup v terapii poranění hrudního mízovodu – kazuistiky a revize literatury
- Využití autonomních leteckých systémů ve zdravotnictví
- Současná problematika dárcovství těl pro výukové a výzkumné účely a jejich využití v Česku
- Islámská republika Írán – překvapivě progresivní centrum zdravotního turismu
- Horizont Evropa, rámcový program Evropské komise na období 2021–2027 – novinky ve srovnání s programem Horizont 2020
- Veřejné zdravotnictví v průběhu času – vývoj a současnost
- Jakub Hron Metánovský a jeho stopy v medicíně
- Harold Eliot Varmus (*1939)
- 64. Purkyňův den – rozloučení s prof. MUDr. Otto Hrodkem, DrSc.
- Karel Lukáš, Josef Kautzner, Jiří Hoch a kol. Bolest na hrudi (Grada Publishing, Praha, 2022, 642 s.)
- Přednáškové večery Spolku českých lékařů v Praze (září - říjen 2022)
- Úvodem
- Současnost a perspektivy léčby obezity: Co již víme a co můžeme očekávat?
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Bartterův a Gitelmanův syndrom
- Současná bariatrická/metabolická chirurgie
- Fekální bakterioterapie v léčbě recidivující střevní infekce bakterií Clostridioides difficile – 10leté zkušenosti gastroenterologického pracoviště
- Doporučení k psychologickému vyšetření před bariatrickou operací
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



