-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamamiRNA jako nový ukazatel u diabetes mellitus a u rozvoje karcinomu pankreatu
miRNA as a new marker of diabetes mellitus and pancreatic carcinoma progression
Pancreatic cancer is a disease with increasing incidence and high (and nearly unchanged) lethality that is caused mainly due to its late diagnosis. Risk factors for neoplastic transformation are especially chronic pancreatitis, diabetes mellitus, but also obesity and smoking. The search for suitable early markers becomes a key element of research in this area. Such markers could be microRNAs, short single-stranded RNA molecules functioning as regulators of translation. This article serves as a review of contemporary evidence of microRNA in diabetes mellitus and pancreatic cancer.
Keywords:
diabetes mellitus – miRNA – pancreatic cancer – chronic pancreatitis
Autoři: Pavel Škrha 1; Jan Hajer 1; Michal Anděl 1; Aleš Hořínek 2; Marie Korabečná 3
Působiště autorů: II. interní klinika 3. LF UK a FNKV, Praha 1; III. interní klinika 1. LF UK a VFN, Praha 2; Ústav biologie a lékařské genetiky 1. LF UK a VFN, Praha 3
Vyšlo v časopise: Čas. Lék. čes. 2015; 154: 122-126
Kategorie: Přehledový článek
Souhrn
Karcinom pankreatu je onemocnění s rostoucí incidencí a vysokou (a téměř neměnnou) letalitou, která je dána především jeho pozdní diagnostikou. Rizikovými faktory nádorové transformace jsou zejména chronická pankreatitida, diabetes mellitus, ale také obezita a kouření. Nalezení vhodných časných markerů se tak stává stěžejním bodem výzkumu v této oblasti. Dle současných poznatků by těmito markery mohly být microRNA, krátké jednovláknové molekuly RNA fungující jako regulátory translace. Článek je přehledem současných poznatků o microRNA u diabetes mellitus a karcinomu pankreatu.
Klíčová slova:
diabetes mellitus – miRNA – karcinom pankreatu – chronická pankreatitidaBIOSYNTÉZA A FUNKCE miRNA
U různých nemocí a jejich komplikací dosud používáme biochemické ukazatele, které více či méně přesně charakterizují aktivitu či závažnost procesu, ale jsou velmi často nespecifické. Poznání genetické podmíněnosti, a tedy účasti určitých genů na vývoji patologického procesu vedlo k využívání polymorfismů genů. Cílem časné diagnostiky a výhledově terapie i prevence je využívat časné a specifické markery. Novou oblastí jsou v tomto směru microRNA(miRNA). miRNA jsou krátké, jednovláknové molekuly RNA o velikosti 21–23 nukleotidů, účastnící se regulací expresí genů na posttranskripční úrovni (1). Touto regulací tak ovlivňují mnoho fyziologických i patofyziologických pochodů, při nichž zasahují do dráhy angiogeneze, apoptózy i kancerogeneze. Odlišné exprese miRNA byly popsány u diabetes mellitus, akutního infarktu myokardu, neurologických a dalších onemocnění. Šíře působení v jednotlivých orgánových systémech naznačuje, že se jedná o velmi významný regulační mechanismus v celém organismu.
Termín miRNA byl použit poprvé v roce 2001 (2), přestože první objevenou miRNA byla již v roce 1993 lin-4, kdy byla popsána inhibice proteinu lin-14 u organismu Caenorhabditis elegans mechanismem RNA-RNA interakce (3). Dnes je známo přes 1500 lidských miRNA (Sanger miRNA database 19.0 – www.mirbase.org).
miRNA vzniká nejčastěji za účasti RNA polymerázy II jako tzv. pri-miRNA během transkripce z DNA. Po samotném přepisu dojde k vytvoření sekundární struktury za vzniku smyčky a dvojvlákna RNA. Z jednoho vláknapri-miRNA může vzniknout 1–6 zralých miRNA. Lokalizace genů pro miRNA je v oblastech mimo geny kódující proteiny nebo v intronech uvnitř sekvencí kódujících proteiny (4–6). Tato pri-miRNA, tvořená asi 80 nukleotidy, je následně štěpena tzv. mikroprocesorem, tedy enzymatickým komplexem obsahujícím protein DGCR8 (DiGeorge Syndrome Critical Region 8), rozpoznávajícím dvouvláknovou sekvencipri-miRNA, a enzymem Drosha s RNázovou aktivitou, díky které dojde k vlastnímu odštěpení konců pri-miRNA za vzniku prekurzorové miRNA (pre-miRNA) (7–9). Ta je následně aktivně transportována pomocí transportního proteinu exportinu 5 z jádra do cytoplazmy (10–11). Zde dojde k dalšímu štěpení (díky ribonukleázové aktivitě enzymu Dicer), při kterém nakonec z pre-miRNA odštěpením oblasti smyčky vznikne dvojvlákno miRNA. Dicer je součástí tzv. RISC (RNA-induced silencing complex) a je navíc zodpovědný za rozvolnění dvojvlákna miRNA. Nepřítomnost Diceru znamená afunkční miRNA, a tedy i poruchu posttranskripční regulace, jak bylo prokázáno in vivo na myších (12). Ve většině případů je použito pouze jedno vlákno miRNA(z pre-miRNA), druhé je degradováno (obr. 1). Vlastní jednovláknová sekvence miRNA je zavzata do RISC, který zprostředkuje navázání na cílovou mRNA, a dále umožní podle míry komplementarity miRNA-mRNA buď přímo degradaci cílové mRNA (v případě úplné komplementarity bází), nebo inhibici její translace. Degradace mRNA je umožněna RNázovou aktivitou proteinu Ago2, který je rovněž součástí RISC (13). Oběma způsoby je dosaženo regulační funkce – inhibice vzniku proteinu.
Obr. 1. Mechanismus vzniku miRNA DGCR8 – DiGeorge Syndrome Critical Region 8 RISC – RNA-induced silencing complex 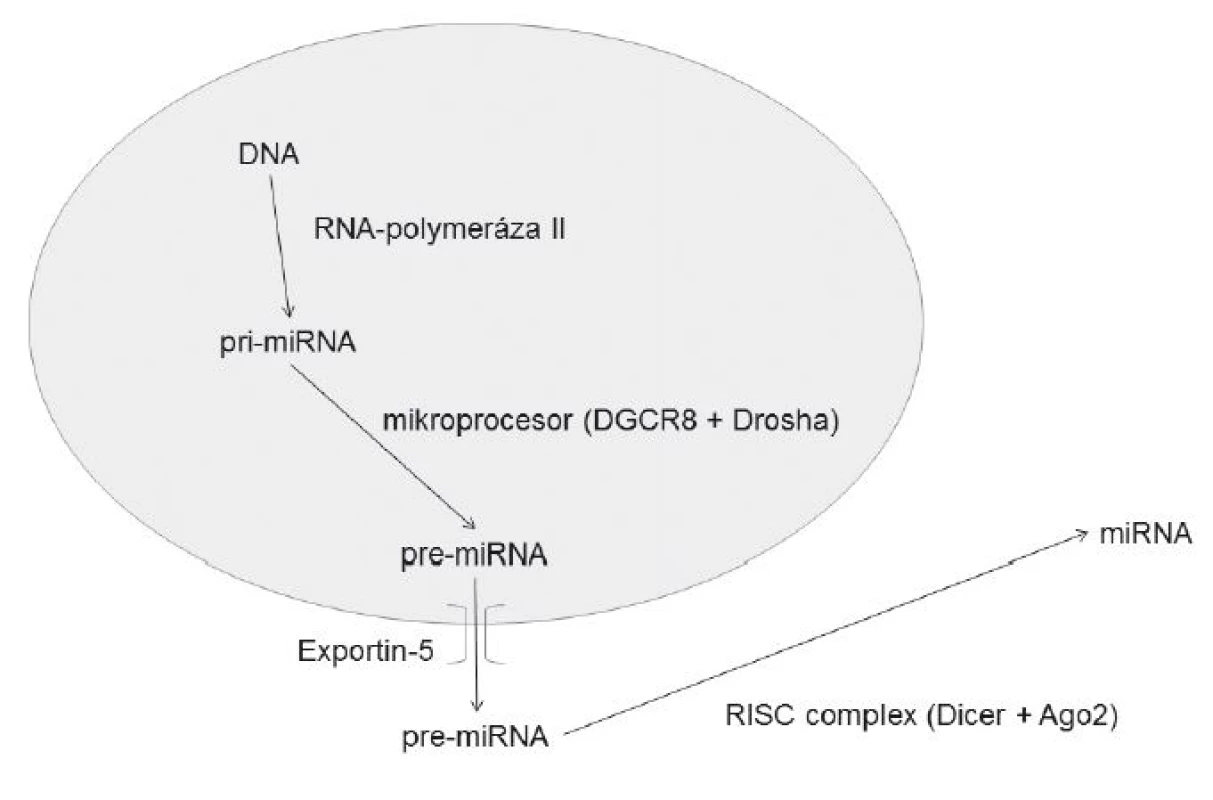
miRNA není vázána pouze na buňku – je detekovatelná v plazmě a dalších tělních tekutinách. Nicméně volná RNA podléhá v plazmě rychlé degradaci díky přítomnosti RNáz. Proto v plazmě necirkuluje volně, ale ve vezikulech, případně navázána na protein. Tím je zabráněno její degradaci (14–15). Vezikuly mohou být reprezentovány exozomy, mikročásticemi aktivně se uvolňujícími z buňky, nebo apoptotickými tělísky (16–18). Ukázalo se, že vysoce denzní lipoprotein (HDL) má vliv nejenom na snížení kardiovaskulárního rizika ovlivněním transportu cholesterolu, ale navíc je schopen přenášet i miRNA, chránit ji tak před degradací a jejím prostřednictvím ovlivňovat cílovou tkáň (19). Použití HDL jako vektoru v transportu specifických miRNA je jedna z možností, kterou by bylo možné v budoucnu využít i pro cílenou léčbu některých onemocnění (20–21). Kromě HDL cirkulují v plazmě miRNA navázané i na další proteiny, jako je například nucleophosmin 1 (NPM1) a Ago2, výše zmíněný protein, jenž je součástí RISC.
miRNA A DIABETES MELLITUS
Při diabetes mellitus dochází k hyperglykémii, která je způsobena absolutním nebo relativním nedostatkem inzulinu. Inzulin je produkován beta-buňkami v ostrůvcích pankreatu a dále uvolňován do krevního řečiště. V cílových tkáních pak vazbou na svůj receptor usnadní vstup glukózy do buněk s následným poklesem glykémie. Při inzulinové rezistenci je potřeba k dosažení normoglykémie většího množství inzulinu. Tím se zvyšují nároky na beta-buňku. Při jejím selhání se rozvíjí hyperglykémie. miRNA hraje významnou roli jednak v samotném vývoji pankreatických ostrůvků a diferenciaci beta buněk, jednak pak v produkci a sekreci inzulinu a rozvoji inzulinové rezistence. Účastní se taktéž metabolismu tuků a svou úlohu hraje i v patogenezi obezity. miRNA se tak účastní všech důležitých kroků, jejichž selhání může vést k rozvoji diabetes mellitus, metabolického syndromu a jejich komplikací (22).
Diabetes mellitus 1. typu (T1DM) je způsoben autoimunitním mechanismem, který vede k destrukci a zániku beta buněk. Ukázalo se, že regulační T-lymfocyty u diabetiků 1. typu zvýšeně exprimují miR-510, naopak miR-191 a miR-342 byly exprimovány méně v porovnání se zdravými jedinci (23). V jiné studii byly porovnávány exprese miRNA u dětí s nově diagnostikovaným T1DM proti zdravým dětem. U 12 miRNA (miR-152, miR-30a-5p, miR-181a, miR-24, miR-148a, miR-210, miR-27a, miR-29a, miR-26a, miR-27b, miR-25, miR-200a) byla pozorována zvýšená exprese. Jedná se o miRNA, které jsou zapojeny do apoptotických dějů a regulací beta buňky. V této studii byla navíc prokázána asociace mezi miR-25 a zbytkovou funkcí beta buňky, vedoucí k lepším hodnotám glykémií (24).
U diabetes mellitus 2. typu (T2DM) byla signifikantně zvýšená exprese sedmi miRNA (miR-9, miR-29a, miR-30d, miR-34a, miR-124a, miR-146a a miR-375) v porovnání s kontrolami, přičemž u pěti z nich byla navíc signifikantně zvýšená exprese v porovnání s prediabetiky (hraniční glykémie nalačno, porušená glukózová tolerance). Rozdíl mezi prediabetiky a kontrolami nebyl zjištěn (25). Zvýšená exprese miR-375 potlačila glukózou stimulovanou sekreci inzulinu a naopak její inhibice vedla k vyplavování inzulinu. Tato miRNA posttranskripčně reguluje translaci proteinu myotrofinu (Mtpn), jehož dereprese sníženou hladinou miR-375 vedla ke zvýšení produkce inzulinu (26). Myši neexprimující miR-375 mají zmnožené alfa buňky pankreatu a zvýšenou hladinu glukagonu. Naopak množství beta buněk je snížené. To pak vede k hyperglykémii. miR-375 se tak účastní prostřednictvím svých cílových transkriptů i buněčného růstu a proliferace buněk (27).
miR-124, a zejména pak jeho izoforma miR-124a, se také účastní vývoje pankreatu. Inhibuje translaci transkripčního faktoru FOXA2, který reguluje specifické geny beta buňky (PDX1, KIR6.2 a SUR1). NadbytekmiR-124 vede ke snížení produkce inzulinu. Zdá se, že dráhy regulace sekrece inzulinu jsou pro miR-124a miR-375 shodné (28).
U prediabetiků při rozvoji inzulitidy byla pozorována zvýšená exprese miR-21, miR-34a a miR-146a (29). miR-9 snižuje expresi granuphilinu, a tím i vyplavování inzulinu při stimulaci glukózou (30–31).
Ve velké prospektivní studii (n = 822) byla sledována exprese miR-126, kdy byla prokázána významná negativní korelace mezi miR-126 a rozvojem T2DM, navíc s výrazným gradientem mezi kontrolami, prediabetiky a diabetiky. Zatímco nejvyšších hladin miR-126 dosahovala skupina kontrol, nejnižších dosahovali diabetici. Exprese u prediabetiků byla uprostřed. Původ miR-126 zatím není znám, ale její snížení je spojováno s nemocí periferních arterií u diabetu (32), stejně tak jako s nemocí koronárních tepen (33). Cílovou mRNA pro miR-126 je transkript genu IRS-1. Při nadbytku miR-126 v hepatocytech dochází k redukci translace IRS-1, a tím k poruše signalizace inzulinové dráhy (34). Při in vitro pokusu na endoteliích pěstovaných v podmínkách hyperglykémie nebyla změněna exprese miR-126, ale bylo snížené její „balení“ do apoptotických tělísek (32, 35), čímž se snížila možnost parakrinního působení a ovlivnění cílových struktur. Zůstává tedy otázkou, jestli například změna v koncentraci jiných miRNA nemůže ovlivňovat uvolňování apoptotických tělísek, a způsobovat tak sníženou hladinu kolující miR-126 v krvi.
EXPRESE miRNA U CHRONICKÉ PANKREATITÍDY A KARCINOMU PANKREATU
Karcinom pankreatu zaujímá v České republice u mužů i u žen 5. místo v úmrtnosti z nádorové příčiny, pokud neuvažujeme kožní nádory a nádory z pohlavních žláz (36). Mortalita je tak podobná jako v USA (37). Svým maligním chováním, pozdní diagnostikou a zvyšující se incidencí představuje karcinom pankreatu významnou oblast v onkologii, dosud však bohužel se špatnou prognózou. Pozdní diagnostika je dána pozdními klinickými projevy, které se objeví většinou již v pokročilé fázi onemocnění, a také absencí vhodných markerů karcinogeneze (38). Nalezení takového markeru by znamenalo pokrok v diagnostice, a tím i v možném zlepšení prognózy pacienta. Jedním z recentně studovaných mechanismů jsou i odlišné exprese miRNA u nádorů. U karcinomu pankreatu byly pozorovány pozitivní i negativní změny v expresi miRNA.
Mezi miRNA, jejichž koncentrace jsou snížené, patří miR--126, která inhibuje translaci ADAM9, proteinu s metaloproteinázovou a disintegrinovou doménou, jehož nadprodukce byla prokázána při progresi karcinomu (39–41). Substituce miR-126 by tak mohla být jednou z možností prevence progrese a metastazování karcinomu (41). Jak bylo uvedeno výše, tato miRNA má změněnou koncentraci i u jinak zdravých diabetiků. To by mohlo jednak pomoci zdůvodnit, proč mají diabetici obecně vyšší riziko neoplazie než zdraví jedinci, a jednak objasnit časný výskyt diabetu (a zároveň mnohdy první příznak) v souvislosti s rozvojem karcinomu. Oblast DNA kódující miR-148a je u karcinomu pankreatu hypermetylována a exprese samotné miR-148a je pak snížená. Míra metylace této oblasti DNA by tak mohla sloužit jako diagnostický marker k odlišení karcinomu od chronického zánětu (průměrná metylace miR-148a u karcinomu pankreatu a chronické pankreatitidy je 4,25 %, resp. 1,21 %; p < 0,05) (42). Taktéž miR-132 je sníženě exprimována u karcinomů pankreatu a její genová sekvence je hypermetylována. Při in vitro pokusu na buněčných liniích došlo při podání miR-132 ke zpomalení růstu nádorových buněk a naopak při podání anti-miR-132 k progresi buněčného růstu a tvorbě větších buněčných kolonií (43).
Na rozdíl od diabetiků, kde bylo pozorováno zvýšení exprese miR-375, byla tato miRNA u karcinomu snížená. Nízká exprese pak korelovala s horším stagingem podle pTNM klasifikace (44). Tento poznatek by se mohl využít při výskytu diabetu u rizikové skupiny pacientů, kdy by daná miRNA pomohla rozlišit primární – a sekundární diabetes mellitus (prvotní symptom karcinomu pankreatu).
U pacientů s karcinomem byla rovněž pozorována nižší exprese miR-218, která také korelovala s horší diferenciací nádoru, pokročilostí a horší prognózou pro pacienta (45).
Mezi miRNA, jejichž exprese jsou u karcinomu naopak zvýšené, patří miR-16, miR-21, miR-27a, miR-100, miR-135b, miR-155, miR-181b, miR-196a, miR-200 a miR-221. Liu et al. prokázal signifikantní zvýšení exprese u sedmi miRNA, z nichž pro diagnostiku karcinomu navrhl miR-16 a miR-196a v kombinaci s biochemickým markerem CA 19-9. Tento test k odlišení karcinomu od kontrol a pacientů s chronickou pankreatitidou dosahoval 92% senzitivity a 95,6% specificity. Pro odlišení karcinomu od chronického zánětu pak byla senzitivita a specificita 88,4 % a 96,3 % (46). K odlišení nádoru od zánětu byla v jiné studii použita exprese miR-135b ve vzorku 42 pacientů s karcinomem a 33 s chronickou pankreatitidou, která byla schopna tyto jednotky odlišit se senzitivitou 92,9 % a specificitou 93,4 %. Pozitivní a negativní prediktivní hodnota testu byla 95 % a 91 % (47).
Při analýze vzorků odebraných při aspirační biopsii bylo pozorováno zvýšení exprese miR-21, miR-196a a miR-221 (p < 0,001, p < 0,001, p = 0,009) (48). Ke zvýšení miR-21 dochází i u jiných nádorů, např. jícnu, plic, tlustého střeva, u glioblastomu (49–52). Tato miR-21 reguluje translaci LRRFIP1, který inhibuje antiapoptotickou signalizační dráhu NF-κB, a tím významně zasahuje do regulačních procesů buňky. Zvýšením hladiny miR-21 dojde k inhibici LRRFIP1, čímž je dráha NF-κB deblokována a buňka chráněna před apoptózou, což vede k delšímu přežívání (až imortalizaci) a proliferaci nádorových buněk (52–53). NF-κB představuje společnou signalizační dráhu, která je aktivní při zánětech i nádorech. Tak lze vysvětlit pojetí chronické pankreatitidy jako rizikového faktoru pro rozvoj karcinomu pankreatu (54). Míra exprese miR-21 nekorelovala s velikostí tumoru, stupněm diferenciace, ani s metastatickým postižením uzlin. Výrazně zvýšená exprese však souvisela s horší prognózou pacienta (55–56).
Koncentrace miR-155 je taktéž zvýšena u celé řady nádorů (57–59). To ukazuje na společné prvky v karcinogenezi různých tkání. miR-155 reguluje translaci TP53INP1 (tumor protein 53-induced nuclear protein 1), proteinu indukovaného při buněčném stresu, který se s p53 spolupodílí na buněčné smrti v apoptotickém procesu (60–61). Zvýšená koncentrace miR-155 u karcinomů však vede k inhibici TP53INP1, čímž opět dojde k inhibici apoptózy a imortalizaci nádorových buněk (60) (obr. 2).
Obr. 2. Schéma působení miR-155 a její role v inhibici apoptózy TP53INP1 – tumor protein 53-induced nuclear protein 1 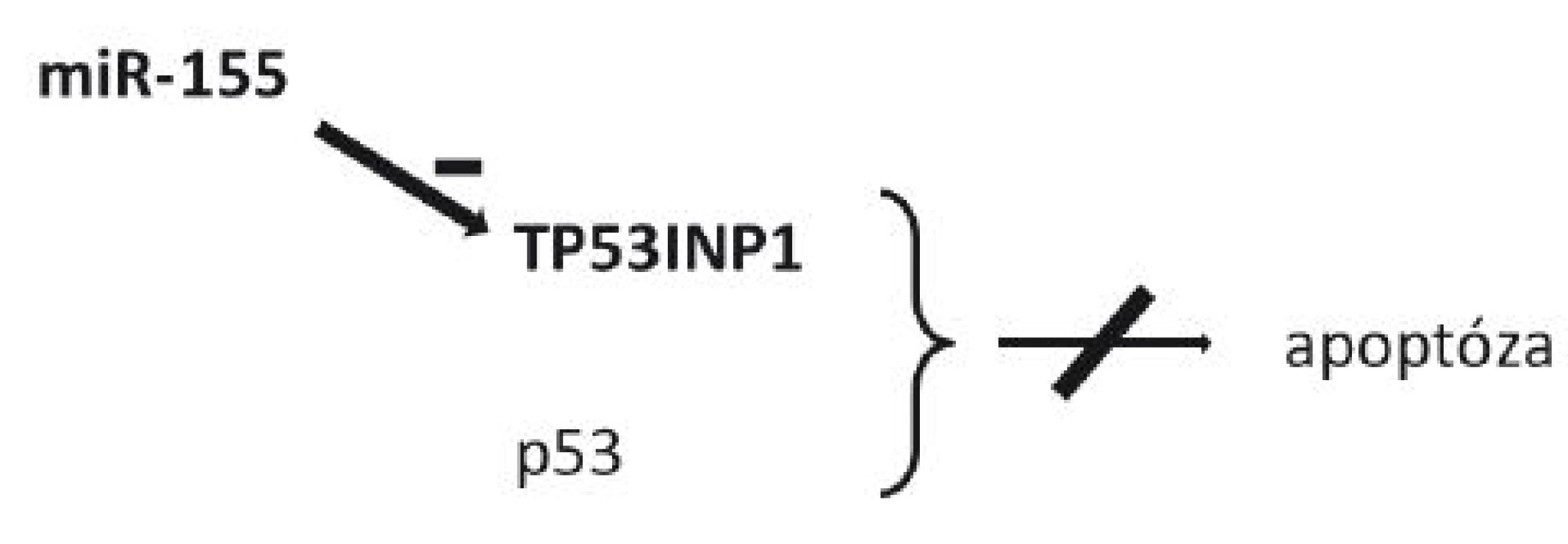
Sestavením vhodného panelu miRNA by bylo možné získat účinný diagnostický nástroj. Bloomston et al. vybral 25 miRNA, které v 95 % správně určily nádor a nenádorovou tkáň (tedy kontroly a chronickou pankreatitídu), v 93 % správně zařadily nádor a chronický zánět a ve 100 % odlišily chronickou pankreatitídu od normální tkáně pankreatu (62).
Podobně jako v séru či plazmě, i v pankreatické šťávě byly pozorovány odlišné exprese některých miRNA. Testováním miR-205, miR-210, miR-492 a miR-1247 spolu s CA 19–9 bylo dosaženo senzitivity 91 % při specificitě 100 % (pro záchyt karcinomu), tedy daleko více než při použití samotného CA 19-9 (77 %, 93 %) (63).
miRNA – NOVINKA V ÚČINNÉ TERAPII NÁDORŮ?
Studium miRNA se stává významnou oblastí vědy, což dokládá i množství publikací vznikajících v posledních 10 letech. Rostoucí počet prací směřuje k využití miRNA v diagnostice určitých chorob, ke zpřesnění zažitých testů, k přesunu od invazivní diagnostiky k méně invazivní. Zároveň roste i snaha o využití poznatků v terapii.
Aby však bylo možné ovlivnit cílovou tkáň, je potřeba konkrétní miRNA-modulátor nějakým způsobem dopravit na cílové místo. Způsob podání může být lokální nebo systémový. Zatímco lokální má výhodu v zamezení nežádoucího působení modulátoru na jiném místě v organismu, systémový má zase výhodu v možnosti semi-invazivně (intravenózně) ovlivňovat i tkáně, které nejsou přímo dostupné. Nicméně miRNA při systémovém podání je vystavena nukleázové aktivitě v krevním řečišti, a tak musí být molekula chemicky upravena, konjugována a opouzdřena, aby byla před RNázou ochráněna, dopravena na cílové místo, schopna projít buněčnou membránou a dostat se do cytoplazmy. Pouze chemická modifikace sice stabilizuje molekuly v krevním řečišti a ochrání je od RNáz, nicméně neumožní efektivní vstup do buňky. Proto byly vyvinuty nosiče na virové a nevirové bázi, které prostup buněčnou membránou usnadní. Jako virové nosiče se používají lentiviry, adenoviry a adeno-asociované viry, mezi nevirové nosiče se řadí lipozomy, biodegradabilní polymery, kolagen 1. typu a makrofágy. Pokud se ke komplexu připojí nosič obsahující molekulu, jež bude rozeznána povrchovým receptorem konkrétní buňky, bude dosaženo cíleného působení modulátoru s minimalizováním nežádoucích účinků jinde v organismu a umožněním redukce jeho dávky. V současné době se připravuje ke klinickému testování první lék používající miRNA (proti hepatitidě C). Vzhledem k často velmi limitujícím možnostem protinádorové terapie jsou sníženy nároky na bezpečnost a toxicitu protinádorového léku, což může usnadnit proniknutí miRNA-orientované léčby na trh v oblasti onkologie. To může přinést nové a zatím netušené možnosti v nádorové terapii, ať už se bude jednat o samostatný lék nebo jako senzitizér v kombinaci s chemoterapií (64).
ZÁVĚR
Oblast miRNA je sice zatím vědecky mladá, málo probádaná, nicméně již současné poznatky předpokládají slibné nasazení miRNA jak v rutinní diagnostice, tak v terapii. Například u diabetu by mohla být detekovatelná časná stadia selhávání beta buňky, u karcinomu pankreatu pak časná stadia neogeneze, včetně zatím problematického odlišení karcinomu v terénu chronické pankreatitidy. Dosud netušené možnosti skrývá předpokládané využití miRNA v terapii, kdy by bylo možné úpravou miRNA spektra (blokováním zvýšeně exprimovaných, případně doplněním méně exprimovaných miRNA) u nádorů podpořit apoptózu neoplasticky transformovaných buněk, blokovat metastazování, eventuálně docílit redukce ložiska. Blokování destruktivního autoimunitního procesu u diabetes mellitus 1. typu, ochrana beta buňky a snížení inzulinové rezistence u 2. typu atd. by pak znamenalo revoluci v terapii diabetu. To je však zatím hudba budoucnosti, ke které bude ještě potřeba mnoho dalších výzkumných studií.
Konflikt zájmů: žádný.
Článek byl doručen do redakce 14. 2. 2014.
ADRESA PRO KORESPONDENCI:
MUDr. Pavel Škrha
II. interní klinika 3. LF UK a FNKV
Šrobárova 50, 100 34 Praha 10
e-mail: pavel.skrha@email.cz
Zdroje
1. Locke JM, et al. MicroRNA expression profiling of human islets from individuals with and without Type 2 diabetes: promises and pitfalls. Biochem Soc Trans 2012; 40 : 800–803.
2. Ruvkun G. Molecular biology: Glimpses of a tiny RNA world. Science 2001; 294(5543): 797–799.
3. Lee RC, et al. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993; 75(5): 843–854.
4. Rodriguez A, et al. Identification of mammalian microRNA host genes and transcription units. Genome Res 2004; 14 : 1902–1910.
5. Lee Y, et al. MicroRNA genes are transcribed by RNA polymerase II. EMBO J 2004; 23(20): 4051–4060.
6. Kim V. MicroRNA biogenesis: coordinated cropping and dicing. Nat Rev Mol Cell Biol 2005; 6 : 376–385.
7. Gregory RI, et al. MicroRNA biogenesis: isolation and characterization of the microprocessor complex. Methods Mol Biol 2006; 342 : 33–47.
8. Lee Y. The nuclear RNase III Drosha initiates microRNA processing. Nature 2003; 425 : 415–419.
9. Lynn FC. Meta-regulation: microRNA regulation of glucose and lipid metabolism. Trends Endocrinol Metab 2009; 20(9): 452–459.
10. Murchison EP, et al. miRNAs on the move: miRNA biogenesis and the RNAi machinery. Curr Opin Cell Biol 2004; 16(3): 223–229.
11. Leisegang MS, et al. Exportin T and Exportin 5: tRNA and miRNA biogenesis – and beyond. Biol Chem 2012; 393(7): 599–604.
12. Lynn FC, et al. MicroRNA expression is required for pancreatic islet cell genesis in the mouse. Diabetes 2007; 56(12): 2938–2945.
13. Carthew RW, et al. Origins and mechanisms of miRNAs and siRNAs. Cell 2009; 136 : 642–655.
14. Tsui NBY, et al. Stability of Endogenous and Added RNA in Blood Specimens, Serum, and Plasma. Clin Chem 2002; 48 (10): 1647–1653.
15. Zampetaki A, et al. Profiling of circulating microRNAs: from single biomarkers to re-wired networks. Cardiovasc res 2012; 93 : 555–562.
16. Xiao D, et al. Identifying mRNA, MicroRNA and Protein Profiles of Melanoma Exosomes. PLoS One 2012; 7(10): e46874. doi:10.1371/journal.pone.0046874
17. Hunter MP, et al. Detection of microRNA expression in human peripheral blood microvesicles. PLoS One 2008; 3(11): e3694. doi: 10.1371/journal.pone.0003694.
18. Bidzhekov K, et al. Delivery of microRNA-126 by apoptotic bodies induces CXCL12-dependent vascular protection. Sci Signal 2009; 2(100): 81.
19. Vickers KC, et al. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins. Nat Cell Biol 2011; 13 : 423–433.
20. Xing L, et al. HDL drug carriers for targeted therapy. Clin Chim Acta 2013; 415 : 94–100.
21. Uno Y, et al. High-density lipoprotein facilitates in vivo delivery of alpha-tocopherol-conjugated short-interfering RNA to the brain. Hum Gene Ther 2011; 22 : 711–719.
22. Dehwah MA, et al. MicroRNAs and Type 2 Diabetes/Obesity. J Genet Genomics 2012; 39 : 11–18.
23. Hezova R, et al. microRNA-342, microRNA-191 and microRNA-510 are differentially expressed in T regulatory cells of type 1 diabetic patients. Cell Immunol 2010; 260(2): 70–74.
24. Nielsen LB, et al. Circulating Levels of MicroRNA from Children with Newly Diagnosed Type 1 Diabetes and Healthy Controls: Evidence That miR-25 Associates to Residual Beta-Cell Function and Glycaemic Control during Disease Progression. Exp Diabetes Res 2012; 2012 : 896362. doi:10.1155/2012/896362
25. Kong L, et al. Significance of serum microRNAs in pre-diabetes and newly diagnosed type 2 diabetes: a clinical study. Acta Diabetol 2011; 48(1): 61–69.
26. Poy MN, et al. A pancreatic islet-specific micrRNA regulates insulin secretion. Nature 2004; 432 : 226–230.
27. Poy MN, et al. miR-375 maintains normal pancreatic alpha - and beta-cell mass. Proc Natl Acad Sci USA 2009; 106(14): 5813–5818.
28. Krek A, et al. Combinatorial microRNA target predictions. Nat Genet 2005; 37 : 495–500.
29. Roggli E, et al. Involvement of microRNAs in the cytotoxic effects exerted by proinflammatory cytokines on pancreatic B-cells. Diabetes 2010; 59 : 978–986.
30. Plaisance V, et al. MicroRNA-9 controls the expression of Granuphilin/Slt4 and the secretory response of insulin-producing cells. J Biol Chem 2006; 281 : 26932–26942.
31. Ramachandran D, et al. Sirt1 and miR-9 expression is regulated during glucose-stimulated insulin secretion in pancreatic B-islets. FEBS J 2011; 278 : 1167–1174.
32. Zampetaki A, et al. Plasma MicroRNA Profiling Reveals Loss of Endothelial MiR-126 and Other MicroRNAs in Type 2 Diabetes. Circ Res 2010; 107(6): 810–817.
33. Fichtlscherer S, et al. Circulating microRNAs in patients with coronary artery disease. Circ Res 2010; 107 : 677–684.
34. Ryu HS, et al. The induction of MicroRNA targeting IRS-1 is involved in the development of insulin resistance under conditions of mitochondrial dysfunction in hepatocytes. PLos ONE 2011; 6: e17343.
35. Zampetaki A, et al. Profiling of circulating microRNAs: from single biomarkers to re-wired networks. Cardiovasc res 2012; 93(4): 555–562.
36. GLOBOCAN 2008 (IARC) Section of Cancer Information. (Online) 2008. (Citace: 2. 1. 2013) http://globocan.iarc.fr/factsheet.asp.
37. Jemal A, et al. Cancer statistics. CA Cancer J Clin 2005; 55 : 10–30.
38. Zavoral M. Gastroenterologie: Nádory pankreatu, žlučového ústrojí a Vaterovy papily. Mařatka Z. (ed.) Praha: Karolinum 1999; 385–405.
39. Zubel A, et al. Expression of ADAM9 in CIN3 lesions and squamous cell carcinomas of the cervix. Gynecol Oncol 2009; 114(2): 332–336.
40. Fritzsche FR, et al. ADAM9 Expression is a Significant and Independent Prognostic Marker of PSA Relapse in Prostate Cancer. Eur Urol 2008; 54(5): 1097–1108.
41. Frampton AE, et al. Loss of miR-126 is crucial to pancreatic cancer progression. Expert Rev Anticancer Ther 2012; 12(7): 881–884.
42. Hanoun N, et al. The silencing of microRNA 148a production by DNA hypermethylation is an early event in pancreatic carcinogenesis. Clin Chem 2010; 56(7): 1107–1118.
43. Zhang S, et al. Downregulation of miR-132 by promoter methylation contributes to pancreatic cancer development. Carcinogenesis 2011; 32(8): 1183–1189.
44. Song S, et al. Expression levels of microRNA-375 in pancreatic cancer. Biomed Rep 2013; 1(3): 393–398. Epub 2013 Mar 27.
45. Zhu Z, et al. Expression of microRNA-218 in human pancreatic ductal adenocarcinoma and its correlation with tumor progression and patient survival. J Surg Oncol 2014; 109(2): 89–94.
46. Liu J, et al. Combination of plasma microRNAs with serum CA19-9 for early detection of pancreatic cancer. Int J Cancer 2012; 131(3): 683–691.
47. Munding JB, et al. Global microRNA expression profiling of microdissected tissues identifies miR-135b as a novel biomarker for pancreatic ductal adenocarcinoma. Carcinogenesis 2012; 33(3): 637–643.
48. Panarelli NC, et al. MicroRNA Expression Aids the Preoperative Diagnosis of Pancreatic Ductal Adenocarcinoma. Pancreas 2012; 41(5): 685–690.
49. Feber A, et al. MicroRNA expression profiles of esophageal cancer. J Thorac Cardiovasc Surg 2008; 135(2): 255–260.
50. Yanaihara N, et al. Unique microRNA molecular profiles in lung cancer diagnosis and prognosis. Cancer Cell 2006; 9 : 189–198.
51. Schetter A, et al. MicroRNA expression profiles associated with prognosis and therapeutic outcome in colon adenocarcinoma. JAMA 2008; 299(4): 425–436.
52. Li Y, et al. MicroRNA-21 targets LRRFIP1 and contributes to VM-26 resistance in glioblastoma multiforme. Brain Res 2009; 1286 : 13–18.
53. Sheikh M, et al. Death Receptor Activation Complexes: It Takes Two to Activate TNF Receptor 1. Cell Cycle 2003; 2 : 549–551.
54. Jackson L, et al. Chronic inflammation and pathogenesis of GI and pancreatic cancers. Cancer Treat Res 2006; 130 : 39–65.
55. Dillhoff M, et al. miRNA-21 is Overexpressed in Pancreatic Cancer and a Potential Predictor of Survival. J Gastrointest Surg 2008; 12(12): 2171–2176.
56. Wang P, et al. The serum miR-21 level serves as a predictor for the chemosensitivity of advanced pancreatic cancer, and miR-21 expression confers chemoresistance by targeting FasL. Mol Oncol 2013; 7(3): 334–345.
57. Nikiforova MN, et al. MicroRNA expression profiling of thyroid tumors: biological significance and diagnostic utility. J Clin Endocrinol Metab 2008; 93 : 1600–1608.
58. Volinia S, et al. A microRNA expression signature of human solid tumors defines cancer gene targets. Proc Natl Acad Sci U S A 2006; 103 : 2257–2261.
59. Faraoni I, et al. miR-155 gene: A typical multifunctional microRNA. Biochim Biophys Acta 2009; 1792(6): 497–505.
60. Gironella M, et al. Tumor protein 53-induced nuclear protein 1 expression is repressed by miR-155, and its restoration inhibits pancreatic tumor development. Proc Natl Acad Sci USA 2007; 104(41): 16170–16175.
61. Tomasini R, et al. TP53INP1s and homeodomain-interacting protein kinase-2 (HIPK2) are partners in regulating p53 activity. J Biol Chem 2003; 278(39): 37722–37729.
62. Bloomston M, et al. MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis. JAMA 2007; 297(17): 1901–1908.
63. Wang J, et al. Circulating microRNAs in Pancreatic Juice as Candidate Biomarkers of Pancreatic Cancer. J Cancer 2014; 5(8): 696–705.
64. Pereira DM, et al. Delivering the promise of miRNA cancer therapeutics. Drug Discov Today 2013; 18(5–6): 282–289.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek Kmenové buňky v ortopediiČlánek Zprávy
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- INFOGRAFIKA: Léčba CHOPN dle aktuálních doporučení GOLD
-
Všechny články tohoto čísla
- Kmenové buňky v ortopedii
- Histologické hodnocení vlivu in vivo aplikace biomateriálů na hojení chrupavky, kosti a kůže
-
Spiritualita a etika v psychosomatické medicíně –
biopsychosociospirituální vztahy - miRNA jako nový ukazatel u diabetes mellitus a u rozvoje karcinomu pankreatu
- První zkušenosti s preimplantačním genetickým screeningem chromozomových abnormalit pomocí komparativní genomové hybridizace na oligonukleotidových DNA mikročipech
- Připravenost izraelského zdravotnictví na krizové situace
- Zprávy
- Historie výroby inzulinu v Československu
- Zásluhy prof. Josefa Hally o rozvoj pražské lékařské fakulty
- Doprovodná mise věda, výzkum, inovace G2G
- 16. Vejdovského olomoucký vědecký den
- PLÁNOVANÉ AKCE SLOŽEK ČLS JEP
- Profesor MUDr. Josef Fusek, DrSc., dr. h. c. sedmdesátníkem
-
Jindřiška Perušičová
Injekční léčba diabetu a novinky v léčbě metforminem -
GODFREY NEWBOLD HOUNSFIELD
(1919 –2004)
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Historie výroby inzulinu v Československu
-
Spiritualita a etika v psychosomatické medicíně –
biopsychosociospirituální vztahy - Kmenové buňky v ortopedii
- Připravenost izraelského zdravotnictví na krizové situace
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



