-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Úloha estrogénov v regulácii biologických procesov zapojených do hojenia rán – literárny prehľad
The role of estrogens in regulations of biological processes involved into wound healing – a review
Since the average age of female population in developed countries has increased, women live up to one-third of their life in the post-menopausal period during which altered wound healing frequently occurs. It has been shown that estrogens and estrogen receptors play a key role in the regulation of processes involved in tissue repair and regeneration. Hence, for better orientation in this area of biomedical research and clinical practice the role of estrogens and their receptors in wound healing was described in this review.
Key words:
post-menopausal period, aging, steroid hormones, tissue repair and regeneration, inflammation.
Autoři: Vlasta Peržeľová 1,2; Martin Slezák 1; Silvia Toporcerová 3; Peter Gál 1,2,4
Působiště autorů: Východoslovenský ústav srdcových a cievnych chorôb, a. s., Košice 1; Univerzita veterinárskeho lekárstva a farmácie, Košice 2; Univerzita Pavla Jozefa Šafárika a Univerzitná nemocnica Louisa Pasteura v Košiciach, II. gynekologicko-pôrodnícka klinika 3; Univerzita Karlova v Praze, 1. lékařská fakulta, Ústav pro histologii a embryologii 4
Vyšlo v časopise: Čas. Lék. čes. 2011; 150: 599-604
Kategorie: Přehledové články
Souhrn
Keďže vo vyspelých krajinách stúpol priemerný vek ženskej populácie, až tretina života žien sa odohráva v post-menopauzálnom období s častým výskytom zhoršeného hojenia rán. Ukázalo sa, že estrogény a estrogénové receptory zohrávajú kľúčovú úlohu v regulácií mnohých procesov zapojených do tkanivovej reparácie a regenerácie. Z dôvodu lepšej orientácie v danej problematike biomedicínskeho výskumu a klinickej praxe bola v tomto prehľadnom článku popísaná úloha estrogénov a ich receptorov v hojení rán.
Kľúčové slová:
post-menopauzálne obdobie, starnutie, steroidné hormóny, regenerácia a reparácia tkaniva, zápal.ÚVOD
Vo vyspelých krajinách s kvalitnou zdravotnou starostlivosťou sa zvyšuje priemerný vek populácie, pričom sa v priemere až tretina života ženy odohráva v stave so zníženou sérovou koncentráciou estrogénov (1). U žien v tomto období života dochádza k rozvoju tzv. post-menopauzálnych symptómov, medzi ktoré patrí aj zhoršené hojenie rán (2). V predchádzajúcich štúdiách bolo preukázané, že ženy užívajúce hormonálnu substitučnú terapiu (HST) mali nižšiu incidenciu chronických rán (3, 4), znížené riziko zlomenín, kolorektálneho karcinómu, ako aj nižší výskyt postmenopauzálnych symptómov (5).
Hojenie rán je dynamický proces prebiehajúci v troch základných fázach: zápalová, proliferačná a maturačná. Keratinocyty migrujú cez ranu a vytvárajú bariéru medzi vonkajším a vnútorným prostredím organizmu. Fibroblasty vytvárajú granulačné tkanivo, pričom produkujú a pretvárajú proteíny extracelulárnej matrix (ECM), zatiaľ čo diferencované myofibroblasty kontrahujú okraje samotnej rany (6). Endotelové bunky tvoria ďalšiu súčasť granulačného tkaniva a vytvárajú nové cievy, ktoré zabezpečujú nutričnú podporu novovznikajúcemu tkanivu (7). Keďže v post-menopauzálnom období sa vyskytuje zhoršené hojenie rán a bunky zapojené do týchto procesov exprimujú estrogénové receptory (8–10), môžeme usudzovať, že aj prostredníctvom týchto receptorov budú reparatívne procesy modulované.
Cieľom tejto prehľadnej práce je zosumarizovať fyziologické mechanizmy účinkov, ktorými estrogény regulujú hojenie rán v snahe pomôcť lepšie sa orientovať v danej oblasti biomedicínskeho výskumu.
ESTROGÉNOVÉ RECEPTORY A MODULÁTORY ESTROGÉNOVÝCH RECEPTOROV
Estrogénové receptory fungujú ako transkripčné faktory, regulujúce génovú expresiu. Existujú dva typy „jadrových“ estrogénových receptorov (ER), ER-α a ER-ß. Prvý, ER-α, bol klonovaný v roku 1986 (11). O desať rokov neskôr bol objavený druhý receptor, ER-ß (12). Gén pre ER-α bol nájdený na chromozóme číslo 6, zatiaľ čo gén pre ER-ß na chromozóme číslo 14. Estrogénom aktivované ER vytvárajú dimér. Keďže v mnohých bunkách sa súčasne exprimuje ER-α a ER ß, receptory môžu vytvoriť buď homodimér (αα alebo ßß), alebo heterodimér (αß) (13). Len dva roky po objavení ER-ß bol popísaný aj membránový estrogénový receptor G proteínového typu – GPR30 (14).
Pomer ER-α a ER-ß môže hrať dôležitú úlohu v modulačnom účinku estrogénov na fyziologické a patologické deje v organizme (15). Napríklad v kožných fibroblastoch je expresia ER-α približne polovičná v porovnaní s bunkami papily folikulu a tretinová v porovnaní s bunkami pošvy folikulu. Expresia ER-ß je nižšia v kožných fibroblastoch o tretinu v porovnaní s bunkami papily folikulu a pošvy folikulu (16). Endogénny estradiol, alebo v terapii bežne používaný neselektívny agonista ER na báze estradiolu má podobnú afinitu k obom jadrovým receptorom (17), a môže teda v závislosti od miesta aplikácie vyvolať rôzne účinky na čo by sa malo prihliadať pri HST.
Na druhej strane, selektívne modulátory estrogénových receptorov (SERM) sú prednostne viazané buď na ER-α, alebo ER-ß. Tieto modulátory môžu v rôznych bunkách a tkanivách vyústiť do agonistického, alebo antagonistického efektu (18) (tab. 1). Medzi základné SERM, ktoré majú schopnosť modifikovať funkciu estrogénových receptorov, patria trifenyletylény (clomifen, tamoxifén a jeho deriváty) a benzotiofény (raloxifén). Napríklad tamoxifén pôsobí v prsnej žľaze ako antagonista, preto sa používa na liečbu prsných nádorov (19). Na druhej strane má tamoxifén agonistický efekt v kostiach, čím pôsobí preventívne proti osteoporóze a je aj parciálnym agonistom v endometriu, kde môže zvyšovať riziko karcinómu maternice. Raloxifén má estrogénne účinky na kosti, sérove lipidy a v prsnej žľaze a endometriu pôsobí ako antagonista estradiolu (20). Najviac študovaný SERM rastlinného pôvodu je fytoestrogén genisteín.
Tab. 1. Vplyv modulátorov estrogénových receptorov na kľúčové molekuly zapojené do regulácie hojenia rán (↑ – stimulácia, ↓ – inhibícia, ? – nie je známe) 
ESTROGÉNY A ZÁPALOVÁ FÁZA HOJENIA
Prvotnou reakciou organizmu na poranenie je zápal, ktorý je kľúčový pre vyčistenie rany a vytvorenie priaznivých podmienok pre nástup ďalších fáz hojenia. V postmenopauzálnom období dochádza k nadmernej infiltrácii rany neutrofilmi, čo je spojené so zvýšenou produkciou elastázy, ktorá degraduje okolité tkanivo (21). Zistilo sa, že estradiol znižuje počet neutrofilov a makrofágov, a tým umožňuje hladký prechod do proliferačnej fázy hojenia.
Kľúčovou molekulou, prostredníctvom ktorej estrogény modulujú zápalovú fázu hojenia rán, je faktor inhibujúci migráciu makrofágov (MIF) (22). Produkcia tohto cytokínu v postmenopauzálnom období výrazne stúpa (obr. 1). Zistilo sa, že estrogén cestou ER-α potláča expresiu MIF u ovarektomizovaných myší in vivo, ako aj v izolovaných peritoneálnych makrofágoch in vitro (23).
Obr. 1. Hojenie rán v post-menopauzálnom období je charakteristické zvýšenou zápalovou reakciou organizmu, čo je založené na chýbajúcom inhibičnom efekte estrogénu na kľúčové zápalové faktory ako IL-6, TNF-α a MIF. HST inhibuje expresiu týchto mediátorov, a tým skracuje zápalovú fázu hojenia. HST – hormonálna substitučná terapia, IL-6 – interleukín 6, MIF – faktor inhibujúci migráciu makrofágov, TNF-α – tumor nekrotizujúci faktor alfa, PMNL – polymorfonukleárny leukocyt 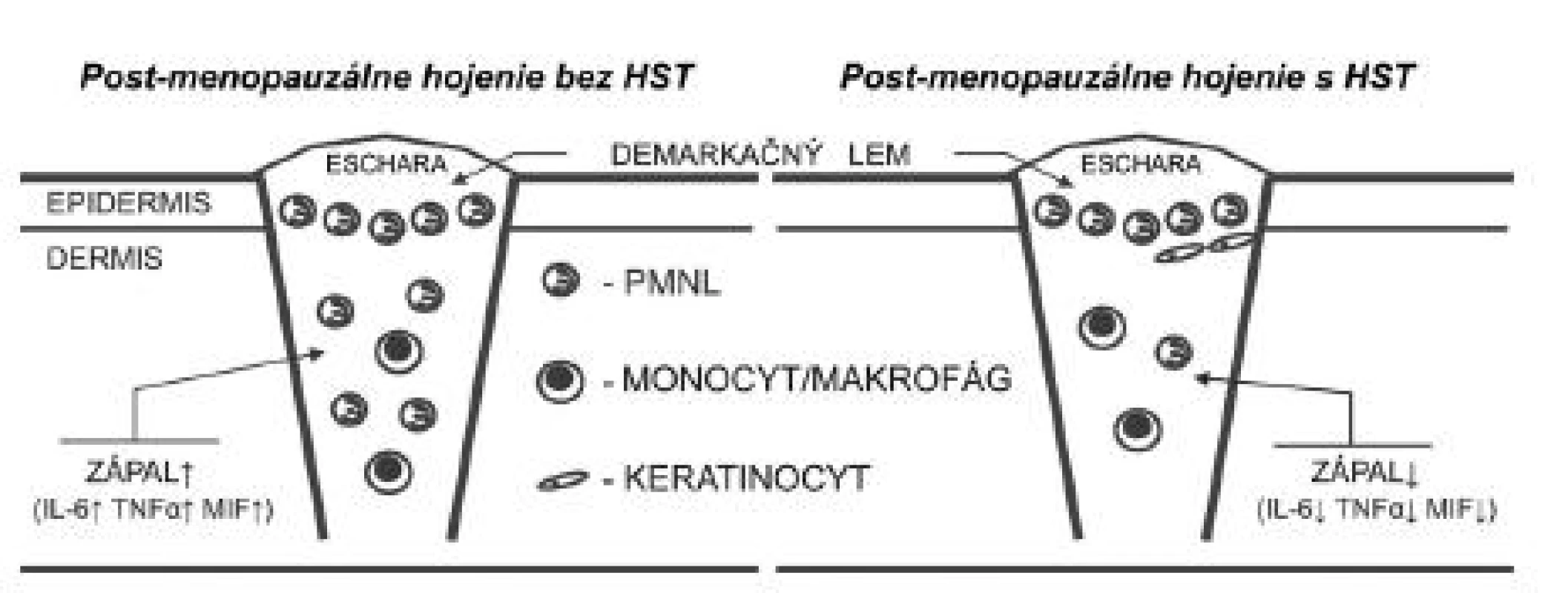
Podobne ako estradiol, aj raloxifén a tamoxifén tlmia expresiu MIF v ranách (24). Produkciu MIF znižuje aj genisteín, ktorý na rozdiel od estradiolu nie je schopný inhibovať expresiu receptora pre MIF CD74 (25). Okrem inhibície MIF sa zistilo, že genisteín, raloxifén a tamoxifén sú schopné inhibovať aj ďalšie prozápalové cytokíny, medzi ktoré patrí IL-6 a tumor nekrotizujúci faktor alfa (TNF-α) (24, 25) (obr. 1). Avšak na rozdiel od estradiolu je tento protizápalový efekt genisteínu nezávislý od jadrovej signalizácie (25).
Systémové podávanie dehydroepiandrosterónu (DHEA) ovarektomizovným myšiam vedie k signifikantnému zníženiu počtu neutrofilov a makrofágov. Ukázalo sa, že DHEA podobne ako ostatné (fyto)estrogény znižuje produkciu zápalových cytokínov MIF, TNF-α a IL-6. Tento efekt DHEA je však zablokovaný pri súčasnom podávaní inhibítora aromatázy. Z toho dôvodu možno usudzovať, že DHEA zrýchľuje zápalovú fázu hojenia rán prostredníctvom jadrových ER, ale až po konverzii na estrogén (26).
VPLYV ESTROGÉNOV NA REEPITELIZÁCIU
Starnutie je spojené s narušením základných funkcií epidermis ako aj s narušením jej schopnosti regenerácie v prípade poranenia. Zistilo sa, že estrogény majú mitogénny efekt na keratinocyty (27). Najprv sa predpokladalo, že tento stimulačný efekt estrogénu na bunkovú proliferáciu a diferenciáciu je sprostredkovaný up-reguláciou TGF-ß1 (28). Až neskôr sa zistilo, že estrogén zrýchľuje regeneráciu epidermis u ovarektomizovaných myší cestou ER-ß (29), ktorý zvyšuje proliferáciu keratinocytov nezávisle od TGF-ß1 (30). Na druhej strane sa ukázalo, že E2 spomaľuje proces reepitelizácie u kastrovaných myších samcoch cestou ER α (31).
Vzhľadom ku množstvu nežiaducich účinkov klasickej HST (5) sa výskum stále viac začal uberať smerom k terapii využívajúcej SERM. Zistilo sa, že v ranách ovarektomizovaných myší ako tamoxifén, tak aj raloxifén zvyšujú expresiu ER-ß a znižujú expresiu ER-α, pričom zrýchľujú epitelizáciu (24). Navyše genisteín bol schopný aktivovať v rane ER-ß a zároveň dokonca zvýšiť aj jeho expresiu. Tieto deje pravdepodobne viedli k tomu, že tento fytoestrogén zrýchlil epitelizáciu rán u ovarektomizovaných zvierat ešte výraznejšie ako samotný estradiol (25) alebo raloxifén (32). Z tohto pohľadu je logické, že v Ázii popísaný nižší výskyt chronicky sa hojacich rán je pripisovaný vysokému obsahu sóje (obsahujúcej fytoestrogény) v potrave.
VPLYV ESTROGÉNOV NA FIBROPLÁZIU
Hojenie v postmenopauzálnom období je charakteristické poklesom proliferácie fibroblastov, syntézy DNA, zníženou depozíciou fibronektínu a kolagénu a zvýšenou aktivitou niektorých proteináz, čo vedie k spomaleniu tvorby granulačného tkaniva. Estrogén stimuluje makrofágy k zvýšenej expresii rastového faktora fibroblastov (FGF), IL-1 a rastového faktora odvodeného od krvných doštičiek (PDGF) (2), a tým aj tvorbu granulačného tkaniva (obr. 2). Ďalší dôležitý rastový faktor, ktorého produkcia bola u post-menopauzálnych žien znížená a HST opätovne zvýšila jeho tvorbu je TGF-ß1 (28). Podobne bol v hojacich sa ranách u ovarektomizovaných potkanov po liečbe 17-α etinylestradiolom, raloxifénom a genisteínom pozorovaný vzostup produkcie TGF-ß1 a taktiež transglutaminázy 2 (TG2) (32).
Obr. 2. Proliferačná fáza hojenia rán prebieha v post-menopauzálnom období života výrazne spomalene. Charakteristická je znížená expresia viacerých rastových faktorov vrátane FGF, IL-1 a PDGF, čo vedie k inhibícii tvorby granulačného tkaniva. HST je schopná stimulovať hojenie až na úroveň normálneho pre-menopauzálneho stavu. HST – hormonálna substitučná terapia, FGF – fibroblastový rastový faktor, IL-1 – interleukín 1, PDGF – rastový faktor odvodený od krvných doštičiek 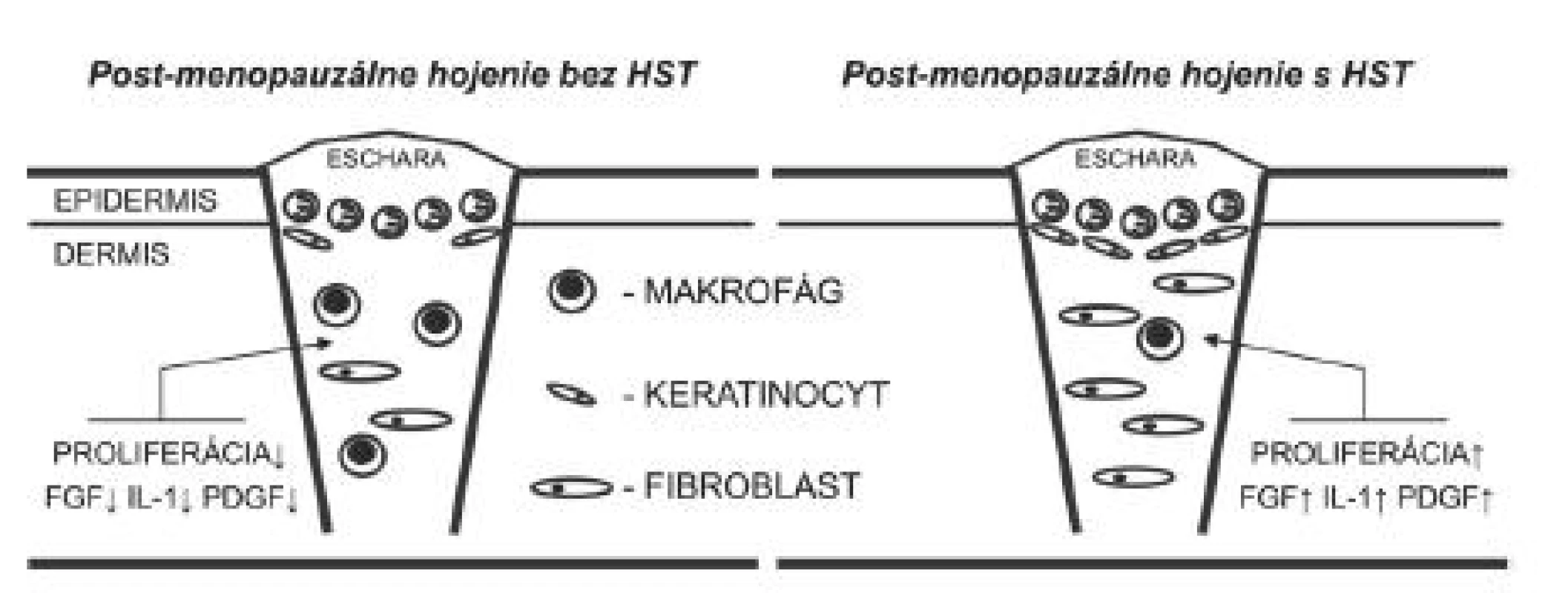
Estrogén síce nezvyšuje proliferáciu fibroblastov (28), zrýchľuje však ich migráciu in vitro (35). Použitím vysoko selektívnych agonistov ER sa zistilo, že táto stimulácia humánnych dermálnych fibroblastov je sprostredkovaná cez ER-α (36). Fytoestrogén genisteín je taktiež významný modulátor migrácie fibroblastov (25). Na druhej strane sa ukázalo, že genisteín inhibuje proliferáciu ľudských fibroblastov z hypertofických jaziev, ale nevplýva na normálne kožné fibroblasty.
Post-menopauzálne ženy užívajúce HST mali výrazne zvýšenú tvorbu kolagénu v porovnaní s neliečenými. Podobný priebeh malo hojenie u ovarektomizovaných myší (28). Okrem estrogénmi sprostredkovanou redukciou infiltrácie tkaniva neutrofilmi, ktoré degradujú ECM (28), sa zistilo, že estrogén priamo stimuluje tvorbu kolagénu fibroblastami (27). Podobne bolo pri modelovaní hojenia in vivo množstvo kolagénu I v rane rovnaké v skupine ovarektomizovaných ako aj falošne operovaných potkanov a pri podávaní estradiolu došlo k výraznému zvýšeniu produkcie kolagénu (26, 36).
VPLYV ESTROGÉNOV NA ANGIOGENÉZU
Normálny priebeh angiogenézy je nevyhnutný proces, ktorý zabezpečí dostatočný prísun živín v novovznikajúcom tkanive. Ukázalo sa, že aj v týchto biologických pochodoch zohrávajú estrogény významnú úlohu.
Estrogény modulujú expresiu rastových faktorov stimulujúcich angiogenézu vrátane PDGF (42), TGF-ß (28) a najdôležitejšieho faktora VEGF (32). Zistilo sa, že estrogén moduluje expresiu VEGF v závislosti od typu bunky. Za normálnych okolností dermálne fibroblasty, bunky papily ako aj bunky pošvy folikulu v koži produkujú približne rovnaké množstvo VEGF. Po poranení neporušenej vrstvy buniek v kultúre sa zvýši produkcia VEGF vo fibroblastoch a bunkách pošvy folikulu. Avšak na zvýšenie produkcie VEGF bunkami papily je potrebná stimulácia estradiolom. Naproti tomu v bunkách pošvy folikulu dochádza dokonca k estrogénom indukovanému poklesu expresie VEGF po poranení (16). Podobne sa zistilo, že v kultúre ľudských kožných fibroblastov tamoxifén znižuje expresiu VEGF (43). Na druhej strane 17-α etinylestradiol ako aj raloxifén a genisteín výrazne zvyšujú produkciu VEGF v hojacich sa ranách u ovarektomizovaných potkanov (32).
Okrem modulácie rastových faktorov môžu byť endotelové bunky ovplyvnené estrogénmi aj priamo (44). V tomto kontexte sa potvrdilo, že estradiol zvyšuje lepivosť endotelových buniek na laminín, kolagén a fibronektín. Navyše bunky stimulované estrogénom migrujú výrazne rýchlejšie v porovnaní s kontrolou. V prípade, že sú endotelové bunky pestované na matrigély, zvýši sa ich schopnosť vytvárať kapiláram podobné štruktúry. Všetky tieto efekty sú zablokované pridaním antagonistu ER do kultivačného média čo poukazuje na jadrovú signalizáciu (45).
VPLYV ESTROGÉNOV NA PROTEÍNÁZY ZAPOJENÉ DO PRESTAVBY ECM
Matrixové metaloproteinázy (MMP) patria do skupiny endopeptidáz, ktoré hrajú významnú úlohu pri degradácii a prestavbe komponentov ECM. Zistilo sa, že u starších jedincov dochádza k vzostupu aktivity MMP-2 a -9 a k poklesu expresie tkanivových inhibítorov MMP (TIMP) (38). Táto nerovnováha medzi aktivitou MMP a TIMP neumožňuje vyvážený priebeh medzi degradáciou a syntézou ECM.
Liečba ovarektomizovaných potkanov estrogénom viedla k zníženiu gelatinolytickej aktivity MMP-2 a -9 (39). Na druhej strane pri aplikácii genisteínu spolu s antagonistom ER došlo k zvýšenej produkcii MMP-2 a -9 a taktiež sa v rane zvýšil počet buniek exprimujúcich MMP-9 (25). Z toho vyplýva, že tento fytoestrogén dokáže modulovať expresiu MMP aj mimo jadrovej signalizácie.
Ukázalo sa, že u ovarektomizovaných potkanov, ktoré boli liečené estrogénom, došlo k poklesu kolagenolytickej aktivity MMP. Znížená expresia a aktivita MMP-8 a MMP-13 viedli k inhibícii kolagenolýzy a obnoveniu kolagénu v rane (36). Prevahu novotvorby ECM nad jej degradáciou umožnilo estrogénom indukované stimulovanie expresie TIMP fibroblastami (40). Navyše sa ukázalo, že u estrogén deficitných myší dochádza k zvýšenej aktivite MMP-13 v koži, pričom aktivita TIMP nie je zmenená. Podaním estradiolu dochádza k poklesu aktivity MMP-13 (41). Navyše bolo zistené, že podávanie estradiolu kastrovaným samcom myší vedie k vytvoreniu nerovnováhy medzi degradáciou a produkciou ECM (31). Z týchto výsledkov vyplýva, že estrogén môže byť považovaný za výrazný modulátor prestavby ECM.
VPLYV ESTROGÉNOV NA KONTRAKCIU RÁN
Myofibroblastami indukovaná kontrakcia rany je kľúčová pre optimálny priebeh hojenia a redukciu výslednej jazvy.
Ukázalo sa, že estradiol, agonista ER-α a agonista ER-ß inhibujú kontrakciu kolagénového disku in vitro. Navyše sa pri porovnávaní rán normálnych a ER-α a ER-ß transgénnych myší našli približne rovnaké počty myofibroblastov (31). Z toho vyplýva, že samotná konverzia fibroblastov na myofibroblasty pravdepodobne nie je nevyhnutná pre estrogénmi indukované zmenšenie plochy rany (6). Na druhej strane sme v našej predchádzajúcej práci potvrdili, že ovarektomizované potkany majú výrazne menej myofibroblastov v rane v porovnaní s kontrolou a taktiež, že diferenciácia fibroblastov na myofibroblasty je sprostredkovaná cez ER-α (37).
Okrem toho sa ukázalo, že systémové podávanie DHEA ovarektomizovaným myšiam, taktiež vedie k signifikantnému zmenšeniu plochy rany (26).
VPLYV ESTROGÉNOV NA MATURAČNÚ FÁZU HOJENIA
U ovarektomizovaných potkanov a rovnako aj u zdravých postmenopauzálnych žien síce prebieha hojenie pomalšie, na konci však má lepší kozmetický efekt (28). S týmto dejom súvisí pokles koncentrácie TGF-ß1 (28), ktorý je po liečbe rôznymi estrogénmi vrátane estradiolu, 17-α etinylestradiolu, raloxifénu a genisteínu opätovne stimulovaný (32) (obr. 3). Ukázalo sa, že neutralizovanie TGF-ß1 vedie k lepšiemu kozmetickému efektu jazvy (46). Z toho vyplýva, že HST môže mať negatívny vplyv na výsledný vzhľad jazvy, keďže vráti proces hojenia do „pôvodného“ pre-menopauzálneho stavu.
Obr. 3. Maturačná fáza hojenia rán v post-menopauzálnom období života je charakteristická poklesom expresie TGF-ß1, čo vedie k nižšej depozícii a organizácii kolagénu. Navyše dochádza aj k tvorbe tenšej epidermis. Hojenie rán po HST je stimulované k normálnemu priebehu. HST – hormonálna substitučná terapia, TGF-ß1 – transformujúci rastový faktor beta 1 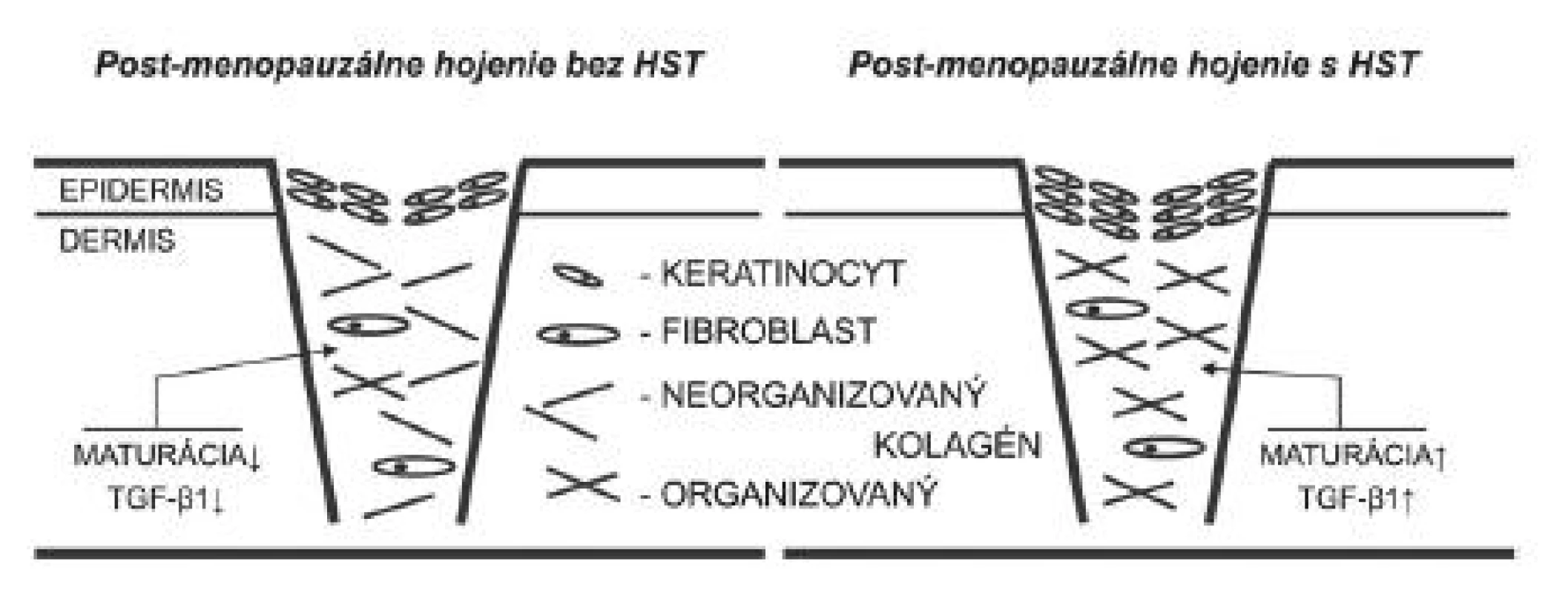
Na základe týchto pozorovaní sa naskytla otázka, či by bolo možné modulátorom ER zlepšiť výsledný vzhľad jazvy. Keďže sa potvrdilo, že tamoxifén znižuje expresiu TGF-ß1 vo fibroblastoch izolovaných z keloidnej jazvy (47), bolo logické realizovať klinickú štúdiu na pacientoch oboch pohlaví s prechádzajúcim výskytom hypertrofických jaziev. Zistilo sa, že tamoxifén funguje ako prevencia proti tvorbe keloidnej jazvy (48). Tento SERM znižuje vo fibroblastoch sekréciu FGF, VEGF a len mierne znižuje produkciu TGF-ß (42). Z tohto pohľadu je možné dosiahnuť zlepšenie estetického výsledku jazvy na úkor mierneho predĺženia doby hojenia.
VPLYV ESTROGÉNOV NA PEVNOSŤ RÁN
Pre celkový priebeh hojenia je dôležitá aj pevnosť rán. Sutúry môžu byť odstránené až vtedy, keď má rana dostatočnú pevnosť (49). V rozsiahlej klinickej štúdii sa zistilo, že lokálna aplikácia estrogénu u starších postmenopauzálnych žien vedie k výraznému zvýšeniu pevnosti rán po 80 dňoch hojenia a k miernemu zvýšeniu pevnosti rán u mužov rovnakého veku (27). Podobne počas skorej maturačnej fázy bola u ovarektomizovaných potkanov znížená pevnosť rán, ktorá bola opätovne zvýšená po liečbe raloxifénom a genisteínom (32). Je vysoko pravdepodobné, že zvýšenie pevnosti rany po liečbe genisteínom je sprostredkované cez ER-ß (50).
Na druhej strane, liečba potkanov 17-α etinylestradiolom vedie k zníženiu pevnosti rán (32). Podobne bola v našej štúdii počas proliferačnej fázy nameraná najnižšia pevnosť rán v skupine potkanov liečených estradiol-benzoátom (51). Neskôr sa ukázalo, že tento pokles je sprostredkovaný cez ER-α (52) pravdepodobne cestou up-regulácie MMP-2 (37). Na druhej strane sme zistili, že farmakologická aktivácia ER-ß vedie k zvýšeniu pevnosti rán. Okrem toho je potvrdené, že liečba ovarektomizovaných potkanov estrogénom neovplyvnila pevnosť granulačného tkaniva sedem dní po vytvorení rán (53). Z publikovaných prác vyplýva, že estrogény majú rôzne, avšak s vysokou pravdepodobnosťou receptorovo-špecifické účinky na pevnosť rán a objasnenie presných mechanizmov ostáva aj naďalej predmetom ďalšieho výskumu.
NEŽIADÚCE ÚČINKY HORMONÁLNEJ SUBSTITUČNEJ TERAPIE (HST)
Začiatok éry HST bol spojený s jej propagáciou ako lieku zlepšujúceho kvalitu života peri - a postmenopauzálnych žien, bez akýchkoľvek vedľajších účinkov. Nepoužívala sa len na odstránenie vazomotorických klimakterických syndrómov, ale tiež ako prevencia vzniku kardiovaskulárnych ochorení a osteoporózy (5). Od roku 1997 sa však v literatúre začínajú objavovať štúdie, ktoré u užívateliek HST poukázali na vzostup incidencie karcinómu prsníka, ako aj náhlych kardiovaskulárnych príhod (53). HST sa tak postupne stala strašiakom a v súčasnosti sa jej väčšina gynekológov i pacientok snaží vyhnúť. Dnes sa udáva, že zvýšené riziko karcinómu prsníka pri HST je priamo závislé od dĺžky a typu terapie (5). Taktiež nebol potvrdený protektívny vplyv HST v rámci prevencie kardiovaskulárnych ochorení, ale na druhej strane bol potvrdený na veku závislý vzostup incidencie náhlych cievnych príhod a hlbokej žilovej trombózy pri užívaní HST (5). Na základe súčasných vedomostí HST nemá protektívny vplyv na pokles kognitívnych funkcií a prevenciu demencie (54). Nie sú zhodné názory na vplyv HST na osteoporózu, keďže niektoré štúdie jej vplyv na osteoporózu vylúčili, zatiaľ čo iné stále doporučujú HST ako liek prvej voľby (5).
V súčasnosti dvomi základnými indikáciami užívania HST zostávajú predčasné ovariálne zlyhanie a výrazné príznaky klimakterického syndrómu, ktoré negatívne ovplyvňujú kvalitu života ženy. V prípade indikácie HST by dávka hormónov mala byť čo najnižšia a dĺžka trvania liečby čo najkratšia. Pacientka by mala byť poučená o tom, že ide len o symptomatickú liečbu klimakterického syndrómu a že HST na základe súčasných vedomostí nie je prevenciou civilizačných ochorení. Rovnako by pacientka mala byť informovaná o vzostupe rizika vzniku niektorých ochorení (56). Štúdia realizovaná na kalifornských učiteľkách odhalila 19% zvýšenie rizika vzniku karcinómu prsníka počas prvých pätnástich rokoch užívania estrogénovej substitučnej terapie, čo je však výrazne menej v porovnaní s 83% nárastom v prípade kombinovanej terapia estrogén/progesterón (57).
ZÁVER
Z klinických i experimentálnych prác vyplýva, že v postmenopauzálnom období dochádza k zhoršenému hojeniu rán. Taktiež sa podarilo preukázať regulačnú úlohu estrogénových receptorov v procese hojenia ako aj to, že estrogénová suplementačná terapia je schopná za určitých podmienok tento nepriaznivý sprievodný jav postmenopauzy zvrátiť. Medzi kľúčové mechanizmy, ktorými estrogény ovplyvňujú hojenie rán, patrí regulácia zápalovej fázy hojenia cestou modulácie expresie MIF a taktiež proliferačnej a maturačnej fázy hojenia prostredníctvom regulácie vybraných MMP, VEGF a TGF-ß1.
Hojenie rán je komplexný proces, ktorý si vyžaduje komplexný prístup. Z pohľadu novotvorby a opravy tkaniva existujú dva základné modely hojenia rán: incízny (primárne hojenie) a excízny (sekundárne hojenie). Pričom pre otvorenú ranu je kontrakcia rany kľúčová, naproti tomu pre ranu incíznu je skôr kontraproduktívna. V tomto procese by mohla hrať kľúčovú úlohu ER regulovaná expresia TGF-ß1. ER-α indukuje expresiu TGF-ß1, čím stimuluje diferenciáciu fibroblastov na myofibroblasty, ktoré kontrahujú okraje rany, zatiaľ čo ER ß stimuluje hojenie rán cestou nezávislou od TGF-ß1.
Na záver teda môžeme konštatovať, že estrogénové receptory a estrogény zohrávajú významnú úlohu v procese hojenia rán. Cielená substitučná terapia hojenia rán v postmenopauzálnom období môže výrazným spôsobom pomôcť predchádzať rozvoju komplikácií ako aj skrátiť čas potrebný na liečbu pacientov, a tým predísť zvýšeným nákladom spojených s liečbou. Určite nie je správny prvotný ošiaľ predpisovania HST ako „lieku na všetko“ zo začiatku 80-tych rokov, ale rovnako by sme HST nemali jednoznačne zatracovať. Cestou sa skôr zdá byť selekcia tých pacientok, u ktorých by HST mohla mať negatívny vplyv na incidenciu onkologických a kardiovaskulárnych ochorení, zatiaľ čo ostatné pacientky by mohli profitovať z jej benefitov.
Skratky
- DHEA – dehydroepiandrosterón
- ECM – extracelulárna matrix
- ER – estrogénový receptor
- FGF – fibroblastový rastový faktor (fibroblast growth factor)
- GPR30 – g-protein coupled receptor 30 (s g-proteínom spojený receptor 30)
- HST – hormonálna substitučná terapia
- IL – interleukín
- MAPK – proteínová kináza aktivovaná mitogénom (mitogen activated protein kinase)
- MIF – faktor inhibujúci migráciu makrofágov (macrophage migration inhibitory facor)
- MMP – matrixová metaloproteináza (matrix metalloproteinase)
- PDGF – rastový faktor odvodený od krvných doštičiek (platelet derived growth factor)
- PMNL – polymorfonukleárny leukocyt
- Ras – potkaní sarkóm (rat sarcoma)
- RTK – tyrozín kinázový receptor (receptor tyrosine kinase)
- SERM – selektívny modulátor estrogénového receptora (selective estrogen receptor modulator)
- TG2 – transglutamináza 2
- TGF – transformujúci rastový faktor (transforming growth factor)
- TNF – tumor nekrotizujúci faktor (tumor necrosis factor)
- VEGF – cievny endotelový rastový faktor (vascular endothelial growth factor)
ADRESA PRE KOREŠPONDENCIU:
RNDr. Peter Gál
Východoslovenský ústav srdcových a cievnych chorôb, a.s., Úsek pre biomedicínsky výskum
Ondavská 8, 040 11 Košice, Slovenská republika
e-mail: pgal@vusch.sk
Zdroje
1. Barrett-Connor E. Epidemiology and the menopause: a global overview. Int J Fertil Menopausal Stud 1993; 38(Suppl 1): 6–14.
2. Hall G, Philips TJ. Estrogen and skin: the effects of estrogen, menopause, and hormone replacement therapy on the skin. J Am Acad Dermatol 2005; 53 : 555–568.
3. Kovacs EJ. Aging, traumatic injury, and estrogen treatment. Exp Gerontol 2005; 40 : 549–555.
4. Margolis DJ, et al. Hormone replacement therapy and prevention of pressure ulcers and venous leg ulcers. Lancet 2002; 359 : 675–677.
5. Warren MP. A comparative review of the risks and benefits of hormone replacement therapy regimens. Am J Obstet Gynecol 2004; 190 : 1141–1167.
6. Emmerson E, et al. Unique and synergistic roles for 17ß--estradiol and macrophage migration inhibitory factor during cutaneous wound closure are cell type specific. Endocrinology 2009; 150 : 2749–2757.
7. Toporcer T, Radoňák J. Podtlakové uzatváranie rán – nové poznatky a možnosti aplikácie. Čas Lek čes 2006; 145 : 702–707.
8. Grohé C, et al. Cardiac myocytes and fibroblasts contain functional estrogen receptors. FEBS Lett 1997; 416 : 107–112.
9. Lindner V, et al. Increased expression of estrogen receptor-beta mRNA in male blood vessels after vascular injury. Circ Res 1998; 83 : 224–229.
10. Thornton MJ. The biological actions of estrogens on skin. Exp Dermatol 2002; 11 : 487–502.
11. Greene GL, et al. Sequence and expression of human estrogen receptor complementary DNA. Science 1986; 231 : 1150–1154.
12. Mosselman S, et al. ER beta: identification and characterization of a novel human estrogen receptor. FEBS Lett 1996; 392 : 49–53.
13. Li X, et al. Single-chain estrogen receptors (ERs) reveal that the ERalpha/beta heterodimer emulates functions of the ERalpha dimer in genomic estrogen signaling pathways. Mol Cell Biol 2004; 24 : 7681–7694.
14. O’Dowd BF, et al. Discovery of three novel G-protein-coupled receptor genes. Genomics 1998; 47 : 310–313.
15. Bakas P, et al. Estrogen receptor alpha and beta in uterine basis for altered estrogen responsiveness. Fertil Steril 2008; 90 : 1878–1885.
16. Stevenson S, et al. Differing responses of human follicular and nonfollicular scalp cells in an in vitro wound healing assay: Effects of estrogen on vascular endothelial growth factor secretion Wound Repair Regen 2008; 16 : 243–253.
17. Kuiper GG, et al. Comparison of the ligand binding specificity and transcript tissue distribution of estrogen receptors alpha and beta. Endocrinology. 1997; 138 : 863–870.
18. Smith CL, et al. Coregulator function: a key to understanding tissue specificity of selective receptor modulators. Endocr Rev 2004; 25 : 45–71.
19. Santen RJ. Recent progress in development of aromatase inhibitors. J Steroid Biochem Mol Biol 1990; 37 : 1029–1035.
20. Vokrouhlická J, et al. Selective estrogen receptor modulators as a new concept in preventing health risks of menopause. Čas Lek čes 1998; 137 : 679–685.
21. Herrick S, et al. Up-regulation of elastase in acute wounds of healthy aged humans and chronic venous leg ulcers are associated with matrix degradation. Lab Invest 1997; 77 : 281–288.
22. Hardman MJ, et al. Macrophage migration inhibitory factor: a central regulator of wound healing. Am J Pathol 2005; 167 : 1561–1574.
23. Ashcroft GS, et al. Estrogen modulates cutaneous wound healing by downregulating macrophage migration inhibitory factor. J Clin Invest 2003; 111 : 1309–1318.
24. Hardman MJ, et al. Selective Estrogen Receptor Modulators Accelerate Cutaneous Wound Healing in Ovariectomized Female Mice. Endocrinology 2008; 149 : 551–557.
25. Emmerson E, et al. The phytoestrogen genistein promotes wound healing by multiple independent mechanisms. Mol Cell Endocrinol 2010; 321 : 184–193.
26. Mills SJ, et al. The Sex Steroid Precursor DHEA Accelerates Cutaneous Wound Healing Via the Estrogen Receptors. J Invest Dermatol 2005; 125 : 1053–1062.
27. Ashcroft GS, et al. Topical Estrogen Accelerates Cutaneous Wound Healing in Aged Humans Associated with an Altered Inflammatory Response. Am J Pathol 1999; 155 : 1137–1146.
28. Ashcroft GS, et al. Estrogen accelerates cutaneous wound healing associated with an increase in TGF-beta1 levels. Nat Med 1997; 3 : 1209–1215.
29. Campbell L, et al. Estrogen promotes cutaneous wound healing via estrogen receptor beta independent of its antiinflammatory activities. J Exp Med 2010; 207 : 1825–1833.
30. Merlo S, et al. Differential involvement of estrogen receptor alpha and estrogen receptor beta in the healing promoting effect of estrogen in human keratinocytes. J Endocrinol 2009; 200 : 189–197.
31. Gilliver SC, et al. 17ß-Estradiol Inhibits Wound Healing in Male Mice via Estrogen Receptor-α. Am J Pathol 2010; 176 : 2707–2721.
32. Marini H, et al. Genistein aglycone improves skin repair in an incisional model of wound healing: a comparison with raloxifene and oestradiol in ovariectomized rats. Br J Pharmacol 2010; 160 : 1185–1194.
33. Fujimoto J, et al. Ovarian steroids regulate the expression of basic fibroblast growth factor and its mRNA in fibroblasts derived from uterine endometrium. Ann Clin Biochem 1997; 34(Pt 1): 91–96.
34. Stevenson S, et al. 17beta-estradiol regulates the secretion of TGF-beta by cultured human dermal fibroblasts. J Biomater Sci Polym Ed 2008; 19 : 1097–1109.
35. Stevenson S, et al. Effects of oestrogen agonists on human dermal fibroblasts in an in vitro wounding assay. Exp Dermatol 2009; 18 : 988–990.
36. Pirilä E, et al. Wound Healing in Ovariectomized Rats: Effects of Chemically Modified Tetracycline (CMT-8) and Estrogen on Matrix Metalloproteinases -8, -13 and Type I Collagen Expression. Curr Med Chem 2001; 8 : 281–294.
37. Novotný M, et al. ER-α agonist induces conversion of fibroblasts into myofibroblasts, while ER-ß agonist increases ECM production and wound tensile strength of healing skin wounds in ovarectomized rats. Exp Dermatol 2011; 20 : 703–708.
38. Ashcroft GS, et al. Human ageing impairs injury-induced in vivo expression of tissue inhibitor of matrix metalloproteinases (TIMP)-1 and -2 proteins and mRNA. J Pathol 1997; 183 : 169–176.
39. Pirilä E, et al. Chemically modified tetracycline (CMT-8) and estrogen promote wound healing in ovariectomized rats: Effects on matrix metalloproteinase-2, membrane type 1 matrix metalloproteinase, and laminin-5 c2-chain. Wound Repair Regen 2002; 10 : 38–51.
40. Sato T, et al. Hormonal regulation of collagenolysis in uterine cervical fibroblasts. Modulation of synthesis of procollagenase, prostromelysin and tissue inhibitor of metalloproteinases (TIMP) by progesterone and oestradiol-17 beta. Biochem J 1991; 275(Pt 3): 645–650.
41. Kassira N, et al. Estrogen deficiency and tobacco smoke exposure promote matrix metalloproteinase-13 activation in skin of aging B6 mice. Ann Plast Surg 2009; 63 : 318–322.
42. Battegay EJ, et al. PDGF-BB modulates endothelial proliferation and angiogenesis in vitro via PDGF beta-receptors. J Cell Biol 1994; 125 : 917–928.
43. Ruffy MB, et al. Effects of Tamoxifen on Normal Human Dermal Fibroblasts. Arch Facial Plast Surg 2006; 8 : 329–332.
44. Ashcroft GS, Ashworth JJ. Potential role of estrogens in wound healing. Am J Clin Dermatol. 2003; 4 : 737–743.
45. Morales DE, et al. Estrogen promotes angiogenic activity in human umbilical vein endothelial cells in vitro and in a murine model. Circulation. 1995; 91 : 755–763.
46. Shah M, et al. Control of scarring in adult wounds by neutralising antibody to transforming growth factor beta. Lancet. 1992; 339 : 213–214.
47. Mikulec AA, et al. Effect of tamoxifen on transforming growth factor beta1 production by keloid and fetal fibroblasts. Arch Facial Plast Surg 2001; 3 : 111–114.
48. Mousavi SR, et al. Evaluating tamoxifen effect in the prevention of hypertrophic scars following surgical incisions. Dermatol Surg 2010; 36 : 665–669.
49. Gál P, et al. Early changes in the tensile strength and morphology of primary sutured skin wounds in rats. Folia Biol (Praha) 2006; 52 : 109–115.
50. Kuiper GG, et al. Interaction of estrogenic chemicals and phytoestrogens with estrogen receptor beta. Endocrinology 1998; 139 : 4252–4263.
51. Gál P, et al. Postsurgical Administration of Estradiol Benzoate Decreases Tensile Strength of Healing Skin Wounds in Ovariectomized Rats. J Surg Res 2008; 147 : 117–122.
52. Gál P, et al. Decrease in wound tensile strength following post-surgical estrogen replacement therapy in ovariectomized rats during the early phase of healing is mediated via ER-alpha rather than ER-beta: a preliminary report. J Surg Res 2010; 159 : 25–28.
53. Pallin B, et al. Granulation tissue formation in oophorectomized rats treated with female sex hormones. II. Studies on the amount of collagen and on tensile strength. Acta Chir Scand 1975; 141 : 710–714.
54. Mosconi P, et al. Informing women about hormone replacement therapy: the consensus conference statement. BMC Womens Health. 2009; 9 : 14.
55. Collaborative Group on Hormonal Factors in Breast Cancer: Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52 705 women with breast cancer and 108 411 women without breast cancer. Lancet 1997; 350 : 1047–1059.
56. Saxena T, et al. Menopausal hormone therapy and subsequent risk of specific invasive breast cancer subtypes in the California Teachers Study. Cancer Epidemiol Biomarkers Prev. 2010; 19 : 2366–2378.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Současný stav diagnostiky karcinomu pankreatu
- Pooperační rekurence Crohnovy nemoci*
- Úloha estrogénov v regulácii biologických procesov zapojených do hojenia rán – literárny prehľad
- Sledování metabolismu v intenzivní péči pomocí mikrodialýzy
- Spolek českých lékařů v Praze
- Korelace intraatriálních elektrických potenciálů a tlaků s morfologickými a funkčními ukazateli přetížených síní stanovenými echokardiografií
- Babyboxy v České republice – jak dál?
- Opět je v módě boj o dlouhověkost
- Čtyřnásobné jubileum Bohumila Eiselta (1831–1908)
- Plánované akce odborných složek ČLS JEP
-
Hygiena ženy V
První republika -
Pediatrický den Kliniky dětského lékařství Fakultní nemocnice v Ostravě
Ostrava, 17. září 2011 -
IX. valtické kurzy abdominální a gastrointestinální radiologie
Valtice, 1. až 4. září 2011 -
Co nového ve výzkumu nikotinu a tabáku
Antalya, 8. až 11. září 2011 -
Krajský dermatovenerologický seminář
Rytířsko u Jihlavy, 9. září 2011 -
Biologická léčba IBD v roce 2011
Praha, 9. září 2011 -
8. kongres radiační onkologie
Nový Jičín, 16. až 17. září 2011 -
XIX. výroční sjezd České oftalmologické společnosti ČLS JEP
Ostrava, 22. až 24. září 2011 - Ľudovít M. Jurga a kol.: KLINICKÁ A RADIAČNÁ ONKOLÓGIA
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Současný stav diagnostiky karcinomu pankreatu
- Pooperační rekurence Crohnovy nemoci*
- Úloha estrogénov v regulácii biologických procesov zapojených do hojenia rán – literárny prehľad
-
Hygiena ženy V
První republika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



