-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Změny ve složení mastných kyselin v lipidech plazmy a erytrocytů u kriticky nemocných v průběhu sepse
Autoři: František Novák 1; Jiřina Borovská 2; Marek Vecka 1; Lucie Vávrová 1; Jana Kodydková 1; Magdaléna Mráčková 1; sr. František Novák 2,3,4; Olga Nováková 3; Aleš Žák 1
Působiště autorů: Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN 1; Univerzita Karlova v Praze, Přírodovědecká fakulta, Katedra biochemie 2; Univerzita Karlova v Praze, Přírodovědecká fakulta, Katedra buněčné biologie 3; Centrum kardiovaskulárního výzkumu, Praha 4
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 324-331
Kategorie: Původní práce
Souhrn
Východisko.
Složení mastných kyselin a zejména poměr n-6 a n-3 vícenenasycených mastných kyselin v lipidech plazmy a buněčných membrán významně ovlivňuje biologické funkce a pochody jednotlivých buněk, orgánů až po úroveň celého organismu. Vícenenasycené mastné kyseliny přispívají k fluiditě membrán, a tím ovlivňují aktivitu membránových proteinů (enzymů, přenašečů a receptorů). Tyto mastné kyseliny rovněž slouží jako prekurzory eikosanoidů a ostatních autakoidů (resolvinů a protektinů). Změny složení mastných kyselin v tucích kriticky nemocných pacientů proto určují jejich vnímavost k různým patologickým podnětům. Cílem této studie bylo určit složení mastných kyselin v triacylglycerolech, esterech cholesterolu a fosfolipidech plazmy a erytrocytů u pacientů v průběhu sepse.Materiál a metody.
Sledovaný soubor se skládal z 30 septických pacientů. U 19 z těchto pacientů byly k dispozici kompletní tři odběry: odběr 1 do 24 hodin od počátku příznaků sepse, odběr 2 po 7 dnech od odběru 1 a odběr 3 týden po odeznění sepse.Výsledky.
Osm pacientů v sepsi zemřelo. Ve srovnání se zdravými kontrolami došlo ve všech třech pozorování u septických pacientů k poklesu n-6 vícenenasycených mastných kyselin, který byl kompenzován vzestupem mastných kyselin s jednou dvojnou vazbou v cholesterylesterech a fosfolipidech plazmy a erytrocytů. Tento nález byl signifikantně výraznější v cholesterylesterech a plazmatických fosfolipidech u pacientů, kteří následně zemřeli při porovnání s přeživšími. U nepřeživších pacientů bylo ve srovnání s přeživšími nižší zastoupení n-3 vícenenasycených mastných kyselin v plazmatických fosfolipidech.Závěry.
Signifikantní snížení zastoupení vícenenasycených mastných kyselin v tucích septických pacientů odráží závažnost jejich stavu a podporuje význam vhodné nutriční suplementace vícenenasycených mastných kyselin.Klíčová slova:
mastné kyseliny plazmatických lipidů, mastné kyseliny fosfolipidů v erytrocytech, vícenenasycené mastné kyseliny řady n-6 a n-3, C-reaktivní protein, sepse, intenzivní péče.ÚVOD
Mastné kyseliny (FA) patří mezi klíčové stavební prvky lidského těla. Poskytují důležitou zásobu energie a ovlivňují strukturu a funkce buněčných membrán. Navíc jsou substrátem pro vznik látek s významnými fyziologickými účinky.
Složení FA v lipidech se díky různým podnětům v průběhu života neustále mění (např. hladovění, stárnutí, těhotenství, dietní zvyklosti a nemoci). Tyto změny ve složení a metabolismu FA zároveň ovlivňují odpověď organismu na různé podněty. Jednoduché i složené lipidy plazmy a různých tkání se vyznačují charakteristickým složením FA s měnícím se zastoupením nasycených a nenasycených FA. Podle polohy první dvojné vazby od metylové koncové skupiny (α pozice) uhlovodíkového řetězce nenasycených FA se odvozuje názvosloví řad n-7, n-9, n-6 a n-3. Řady n-6 a n-3 jsou označením pro vícenenasycené FA (PUFA). Člověk a ostatní savci syntetizují pouze nasycené FA (SFA) a mononenasycené FA (MUFA) řady n-7 a n-9, protože u nich nejsou přítomné enzymy Δ12 a Δ15 desaturázy (přítomné u rostlin), které zajišťují vznik dvojné vazby v pozicích n–6 a n-3 u PUFA. Z tohoto důvodů musejí savci získávat esenciální n-6 (linolová kyselina, LA, 18 : 2n-6) a n-3 (α-linolenová kyselina, ALA, 18 : 3n-3) PUFA z diety. Buňky savců jsou schopné konverze PUFA v rámci každé řady pomocí enzymatické elongace, desaturace a retrokonverze zajišťované příslušnými enzymy. Po příjmu v potravě je LA metabolizována pomocí řady postupných oxidativních desaturací a elongací na kyselinu dihomo-γ-linolenovou (DHGLA, 20 : 3n-6) a dále na kyselinu arachidonovou (AA; 20 : 4n-6). Hlavní metabolické dráhy konverze PUFA ukazuje schéma 1. Metabolická dráha Δ6, která slouží ke konverzi LA na AA a ALA na eikosapentaenovou kyselinu (EPA, 20 : 5n-3), probíhá primárně v endoplazmatickém retikulu jaterních buněk. Po požití esenciálních PUFA, jsou tyto konvertovány na FA s delším a vícenenasyceným řetězcem pomocí enzymů elongáz a desaturáz (1, 2). Konverze ALA na EPA a dokosahexaenovou kyselinu (DHA, 22 : 6n-3) je u lidí omezená. Předpokládá se, že jen méně než 10 % z potravy ALA je konvertováno na EPA. Navíc má lidská tuková tkáň významně omezenou schopnost skladovat n-3 PUFA s dlouhým řetězcem. Z výše uvedeného vyplývá, že u člověka je potřeba průběžného a dostatečného přísunu n-3 PUFA s dlouhým řetězcem v dietě (3).
Schéma 1. Metabolismus vícenenasycených mastných kyselin (PUFA) 
LA – kyselina linolová, GLA – kyselina γ-linolenová, DGLA – dihomo-γ-linolenová kyselina, AA – kyselina arachidonová, ALA – kyselina α-linolenová, EPA – kyselina eikosapentaenová, DHA – kyselina dokosahexaenová Existuje celá řada biologických účinků PUFA. PUFA obou řad, které se přednostně nacházejí v sn-2 pozici membránových fosfolipidů, určují biofyzikální vlastnosti membrán (fluiditu, tloušťku a deformovatelnost) a ovlivňují aktivitu transmembránových proteinů (enzymů, přenašečů a receptorů). Membránové fosfolipidy slouží jako prekurzory signálních molekul jako např. diacylglyceroly, kyselina fosfatidová, inositol-1,4,5-trifosfát, ceramidy a eikosanoidy. Relativní poměr n-6 PUFA (LA, DHGLA, AA) a n-3 PUFA (ALA, EPA, DHA) v membránách určuje po štěpení fosfolipázou A2 substrátovou dostupnost pro cyclooxygenázy (COX) a lipoxygenázy (LOX), a tím i rovnováhu mezi jednotlivými eikosanoidy (pro - a protizánětlivé) a ostatními autakoidy (resolviny a neuroprotektiny). Konečně PUFA jsou i ligandy nukleárních receptorů (peroxizomálními proliferátory-aktivovaný receptor (PPAR) a X-receptor pro kyselinu retinovou), které řídí genovou expresi. Esenciální PUFA řady n-6 a n-3 jsou po desaturaci a elongaci na 20 uhlíkové molekuly metabolizovány za vzniku prostaglandinů (PG), tromboxanů (TX), hydroxyeikosatetraenových kyselin (HETE) a leukotrienů (LT), a to díky enzymové aktivitě COX a LOX (4). Eikosanoidy modulují růst buněk a jejich diferenciaci, zánětlivou aktivitu, imunitní odpověď, agregaci destiček a mají řadu dalších funkcí. Obecně lze říci, že eikosanoidy odvozené od n-6 PUFA mají prozánětlivé účinky a naproti tomu ty, které vznikají z n-3 PUFA mají účinky opačné, protizánětlivé. DHGLA je metabolizována na prostaglandiny série-1 (PGE1, s výraznými vazodilatačními a antiagregačními účinky) a na LT série-3 (např. 15 hydroxyeikosatrienová kyselina, HEtrE), které inhibují vznik leukotrienu B4. Eikosanoidy, které vznikají z AA působením COX, resp. LOX se nazývají PG série-2 a LT série-4 a působí jako mediátory zánětlivých procesů (mají prozánětlivé účinky, např. indukují bolest, horečku, vazodilataci apod.). Kromě těchto přímých účinků jsou schopné ovlivňovat odpovědi organismu na jiné mediátory (např. prostaglandin PGE2 zesiluje bolest vyvolanou bradykininem) a může regulovat další procesy, jako jsou chemotaxe leukocytů, srážení krve, agregaci destiček, produkci cytokinů a imunitní reakce (5–7). Vzhledem k tomu, že PGE2 zároveň potlačuje syntézu TNF α, IL-1, IL-2 a INF-γ, lze mu také připsat i imunosupresivní potenciál. PGE2 také inhibuje 5-LOX, a tím potlačuje další vznik prozánětlivých LT série-4. PGE2 dále indukuje tvorbu lipoxinu A4 produktu15-LOX, který je „stop signálem“ zánětu. Přestože má PGE2 nesporný prozánětlivý účinek, účastní se také ukončení zánětu prostřednictvím ovlivnění tvorby jiných eikosanoidů (8). EPA dává vznik PG série-3 a TX, které mají antiagregační účinky bez doprovodné imunosupresivní aktivity. Podobně LT série-5, deriváty EPA, mají protizánětlivé a antiagregační účinky (9). Kromě biologických účinků, zprostředkovaných vlastními eikosanoidy, n-3 PUFA působí ještě nepřímo tak, že inhibují syntézu eikosanoidů z n-6 PUFA. Když jsou v membránách n-6 PUFA, resp. AA nahrazeny n-3 PUFA, dojde ke kompetici desaturáz, elongáz, COX a LOX o oba substráty (10). Tato kompetice vede ke snížení syntézy PGE2, TXA2 a LTB4. Proto je substituce n-3 PUFA doprovázena snížením agregace destiček, prodloužením srážlivosti krve a ovlivněním syntézy zánětlivých cytokinů a dalších zánětlivých a imunitních funkcí (11). EPA má vliv na odpověď imunokompetentních buněk regulací genové exprese prostřednictvím PPAR a transkripčního faktoru SREBP (sterol regulatory element binding protein). Tato mastná kyselina také snižuje expresi NFκB po aplikaci lipopolysacharidu (9).
Sepse stále patří mezi důležité příčiny morbidity a mortality i ve vyspělých zemích. Těžká sepse a septický šok jsou časté a díky vysoké úmrtnosti i medicínsky závažné. Sepse je podobně jako ostatní příčiny syndromu systémové zánětlivé odpovědi (SIRS) charakterizována zvýšenou sekrecí stresových hormonů (např. katecholaminů a kortizolu), vysokou produkcí cytokinů, aktivací komplementu a mitochondriální dysfunkcí se sníženou dostupností ATP. Zánětlivá reakce způsobená sepsí vede k poruchám mikrocirkulace, k neadekvátní dodávce kyslíku do tkání včetně dysfunkce na celulární a subcelulární úrovni (12, 13). V současné době přibývají důkazy o klíčové úloze reaktivních kyslíkových a dusíkových sloučenin (RONS) a oxidačního stresu při rozvoji poškození endotelu v patogenezi sepse (14).
Početné studie ukazují na významné změny ve složení FA u kriticky nemocných včetně pacientů se sepsí. Míra oxidace FA, jejich obrat a lipolýza se zvyšuje, což napovídá, že zřejmě zvýšení mobilizace tukových zásob a zvýšená oxidace FA patří mezi základní atributy metabolické odpovědi na stres (15–17). Bylo publikováno, že podíl PUFA v plazmatických lipidech je snížený, zatímco podíl SFA a MUFA je zvýšený u pacientů s popáleninami, u septikémie a prokázaného syndromu akutní dechové tísně dospělých (ARDS). Uvedené výsledky naznačují, že za těchto stavů dochází k nedostatku esenciálních FA, který vzniká zřejmě v důsledku zvýšeného oxidačního stresu (18–20).
Složení FA v erytrocytárních PL částečně odráží jejich příjem v dietě. Navíc tento ukazatel poskytuje informaci o metabolismu PUFA a jejich inkorporaci do buněčných membrán různých tkání. Analýzou erytrocytárních FA tak lze zjistit jak nedostatek a nerovnováhu PUFA v potravě, tak i různé metabolické poruchy a míru peroxidace lipidů (21). Změny ve složení erytrocytárních PUFA byly zjištěny u onemocnění koronárních tepen, u cévních mozkových příhod, hypertenze a v průběhu zánětu (22–27).
Cílem této studie proto bylo analyzovat složení FA v lipidech plazmy a erytrocytů během sepse s cílem určit potenciálně klinicky užitečné metabolické ukazatele, které by zlepšily předpověď závažnosti průběhu sepse u kriticky nemocných pacientů.
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
Pacienti
Jedná se o prospektivní studii případů a kontrol, která probíhala na souboru nemocných jednotky intenzivní péče IV. interní kliniky Všeobecné fakultní nemocnice v Praze. Do studie bylo zařazeno 30 pacientů v septickém stavu (SP) a k nim bylo vyhledáno 30 zdravých kontrol párovaných podle věku a pohlaví (HC). U SP byla stanovena diagnóza sepse na základě kritéria Society of Critical Care Medicine/American College of Chest Physicians (SCCM/ACCP) (28). SP ještě navíc splňovali další vstupní kritéria: Acute Physiologic and Chronic Health Evaluation II (APACHE II) skóre > 10 (29) a C reaktivní protein (CRP) v séru > 20 mg/l. Zdrojem sepse u SP byly zejména plíce (20 případů). Další zdroje sepse byly: centrální žilní katétr (4 případy), abdominální infekce (4 případy), a infekce močových cest (2 případy). Nutriční péče byla standardizována podle doporučení ESPEN guidelines (30). Vylučovací kritéria platná pro obě sledované skupiny byla: terapie antioxidanty, chronická dialýza, diabetes mellitus, generalizovaná malignita, imunosupresivní léčba a chemoterapie. V průběhu studie se 22 SP ze sepse plně zotavilo. Z těchto uzdravených byli tři přeloženi do jiného zdravotnického zařízení před ukončením studie a u zbývajících 19 byly provedeny všechny tři odběry (S1–S3). Odběr S1 byl proveden u SP do 24 hodin od počátku příznaků sepse, po té byl po 7 dnech proveden odběr 2 (S2), a konečně týden od odeznění klinických a laboratorních příznaků sepse odběr 3 (S3). U osmi SP došlo k úmrtí před odezněním sepse buď před, nebo po S2 (nepřeživší S1, n = 8; nepřeživší S2, n = 4). Zdravé kontroly byly definovány jako jedinci bez klinických a laboratorních známek sepse, zánětu nebo jiného známého onemocnění. Podmínkou zařazení do studie byl podpisem stvrzený informovaný souhlas s účastí ve studii. Protokol studie byl schválen etickou komisí Všeobecné fakultní nemocnice v Praze.
Odběr vzorků
Odběry krve byly provedeny u SP v intervalech S1, S2 a S3 a u HC ráno nalačno. Anonymita vzorků byla zajištěna přiřazením unikátních identifikačních čísel a data byla zkompletována až po stanovení. Vzorky krve byly hned po odběru zpracovány. Plazma byla separována za použití antikoagulace K2EDTA. Oddělené erytrocyty po separaci plazmy byly 3× promyty fyziologickým roztokem a separovány centrifugací 5 minut, 2500 × g při laboratorní teplotě. Sérum bylo získáno po koagulaci ve Vacutainer® zkumavkách centrifugací 10 minut, 2500 × g při 4 °C. Vzorky séra, plazmy a erytrocytů byly následně až do analýzy skladovány zmražené na -80 °C. Pokud není uvedeno jinak, chemikálie byly zakoupeny od Sigma (USA).
CRP
Koncentrace v séru byla měřena imunoturbidimetricky pomocí kitu K-ASSAY CRP kit (Kamiya Biomedical Company, USA) na analyzátoru Hitachi Modular (Japonsko).
FA v lipidech plazmy a erytrocytů
Plazmatické lipidy byly extrahovány podle modifikované metody dle Folche (31). K plazmě (1 ml) bylo přidáno 21 ml směsi chloroform-methanol (2 : 1) a roztřepáno.Precipitované proteiny séra byly odstraněny filtrací, k filtrátu přidáno 10 ml směsi chloroform-methanol-voda (3 : 48 : 47 v/v/v) a po důkladném protřepání byla oddělena spodní fáze s lipidy, která byla vysušena při 40 °C v proudu dusíku. Jednotlivé plazmatické lipidy, tzn. celkové PL, triacylglyceroly (TAG) a cholesterylesterech (CE), byly separovány jednorozměrnou, tenkovrstevnou chromatografií (0,5 mm Silica Gel H, Merck, Germany) pomocí směsi rozpouštědel hexan-éter-kyselina octová (70 : 30 : 1 v/v/v), detekovány 2,7-dichlorofluoresceinem (0,005 % v methanolu), následně vyškrabány a uskladněny v dusíkové atmosféře při -20 °C. Následující den byly připraveny a separovány metylestery FA pomocí plynové chromatografie (32). Erytrocytární lipidy byly extrahovány podle metody Roseho a Oklandera (33). Pro separaci erytrocytárních PL (EPL) a analýzu jejich FA byly použity stejné metody jako v případě plazmatických lipidů.
Statistická analýza
Parametrické proměnné jsou vyjádřeny jako průměr Ī standardní odchylka (SD) a neparametrické proměnné jako medián a mezikvartilové rozpětí (25.–75. percentil). Normalita distribuce byla testována Shapiro-Wilkovým testem. Významnost rozdílů mezi zkoumanými skupinami byla testována pomocí jednostranné ANOVA s Scheffého a Newman-Keuls post-hoc testy. Neparametrická analýza byla provedena Kruskal-Wallis ANOVA testem. Friedman ANOVA byla použita pro analýzu závislých proměnných. Všechny statistické výpočty byly provedeny ve statistickém software Statistica verze 8.0 (StatSoft 2007, CZ) a za statisticky významnou byla považována hodnota P < 0,05.
VÝSLEDKY
Kriticky nemocní pacienti v průběhu sepse
V průběhu studie se 22 SP zotavilo ze sepse a u 19 z nich byly k dispozici kompletní 3 odběry. Tabulka 1 ukazuje demografické a klinické charakteristiky spolu s koncentrací CRP při odběrech S1, S2 a S3. Zvýšená hodnota koncentrace CRP ve srovnání s HC přetrvávala u všech tří odběrů skupiny SP. Nejvyšší koncentrace CRP zjištěná v S1 se postupně snižovala v S2 a S3, ale ani u S3 nedosáhla hodnot naměřených u HC.
¨
Tab. 1. Klinické charakteristiky pacientů v průběhu sepse 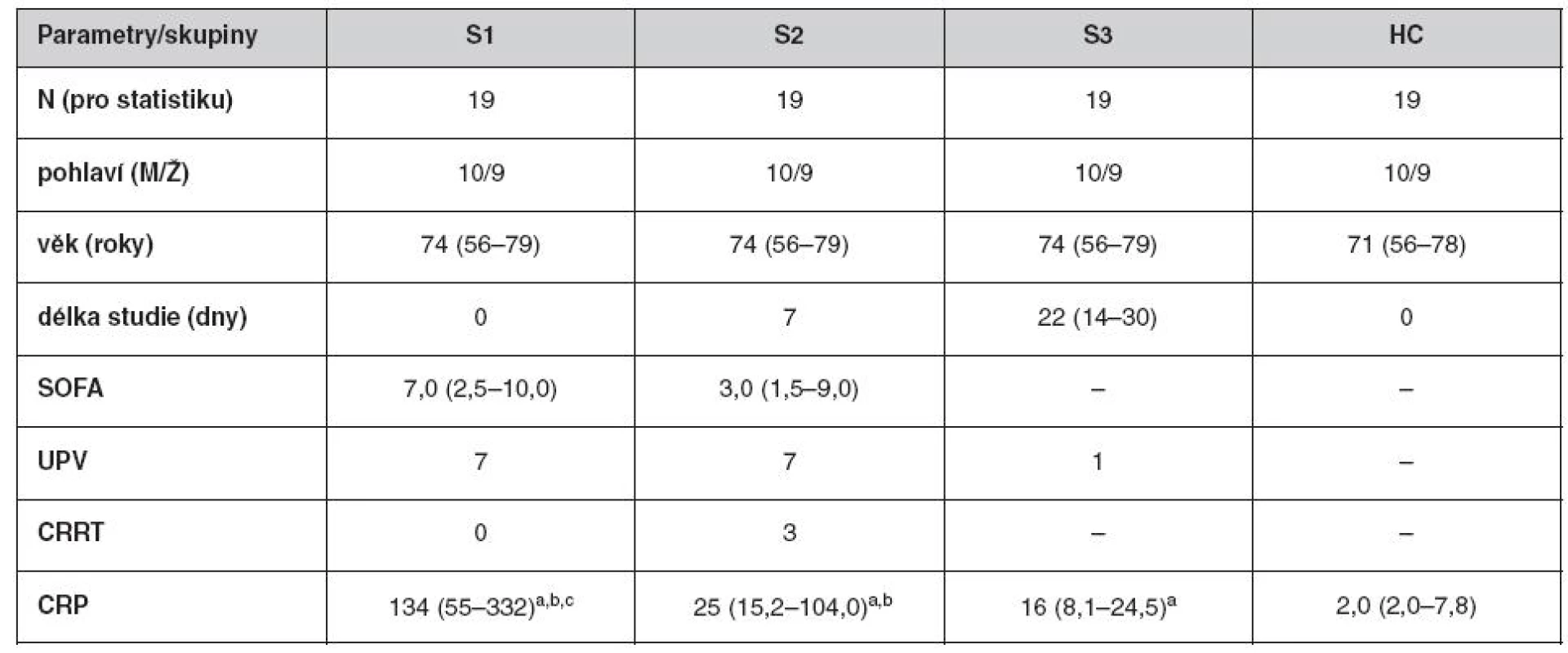
SP – septičtí pacienti zařazení do studie během 24 hodin od začátku sepse (S1), SP 7 dnů po S1 (S2) a SP jeden týden po odeznění symptomů sepse (S3), HC – zdravé kontroly, SOFA – SOFA skóre, UPV – umělá plicní ventilace, CRRT – kontinuální náhrada funkce ledvin, CRP – C-reaktivní protein Data jsou prezentovaná jako medián (25.–75. percentil) pro neparametrické proměnné; aS1, S2, S3 vs. HC, bS1, S2 vs. S3, cS1 vs. S2, p < 0,05. Graf 1 ukazuje zastoupení FA v TAG, CE, plazmatických fosfolipidech (PPL) a EPL v průběhu sepse. Graf 1A ukazuje mírné zvýšení v zastoupení MUFA v TAG u SP, které je v porovnání s HC signifikantně vyšší v S2 a S3 odběrech. Snížení relativního množství n-6 PUFA v CE u SP, detekované ve všech třech odběrech, je kompenzováno zvýšeným zastoupením SFA a MUFA (graf 1B). Tyto změny jsou způsobeny především snížením podílu LA (18 : 2n-6) a navýšením podílu kyselin palmitové (PA, 16 : 0), palmitolejové (POA, 16 : 1n-7), olejové (OA, 18 : 1n-9) a vakcenové (VA,18 : 1n-7) u SP (tab. 2). Spolu se snížením hladiny LA bylo ve srovnání s HC pozorováno u SP ve všech třech odběrech zvýšení DHA (22 : 6n-3) v CE, což vysvětluje snížení poměru n-6/n-3 PUFA. V PPL došlo ke snížení n-6 PUFA a vzestupu MUFA, které kopíruje posuny pozorované v CE u SP. V PPL odběru S3 bylo také pozorováno zvýšené zastoupení n-3 PUFA, ve srovnání s S2 a HC, které způsobil vzestup DHA (graf 1C, tab. 3). Poměry 16 : 1n-7/16 : 0 a 18 : 1n-9/18 : 0 (markery 9 desaturázy) a poměr 18 : 3n-6/18 : 2n-6 (makrer Δ6 desaturázy) jsou zvýšené v CE a PPL u SP (tab. 2, 3). Změny v zastoupení jednotlivých tříd FA v EPL u SP jsou podobné těm, které byly pozorovány v PPL, ale jejich významnost je nižší (graf 1D).
Graf 1. Zastoupení tříd mastných kyselin v esterech cholesterolu, triacylglycerolech a fosfolipidech plazmy a erytrocytů v průběhu sepse Septičtí pacienti (SP) zařazení do studie do 24 hodin po nástupu sepse (S1), SP 7 dnů po odběru S1 (S2) a SP jeden týden po odeznění klinických a laboratorních symptomů sepse (S3), zdravé kontroly (HC); SFA – nasycené mastné kyseliny, MUFA – mononenasycené mastné kyseliny, n-6 – n-6 vícenenasycené mastné kyseliny, n-3 – n-3 vícenenasycené mastné kyseliny Data jsou uvedena jako průměr ± SD, *S1/S2/S3 vs. HC, +S1/S2 vs. S3; ***p 0,001, **p 0,01, *,+p 0,05. 
Tab. 2. Složení mastných kyselin (mol %) v esterech cholesterolu plazmy v průběhu sepse 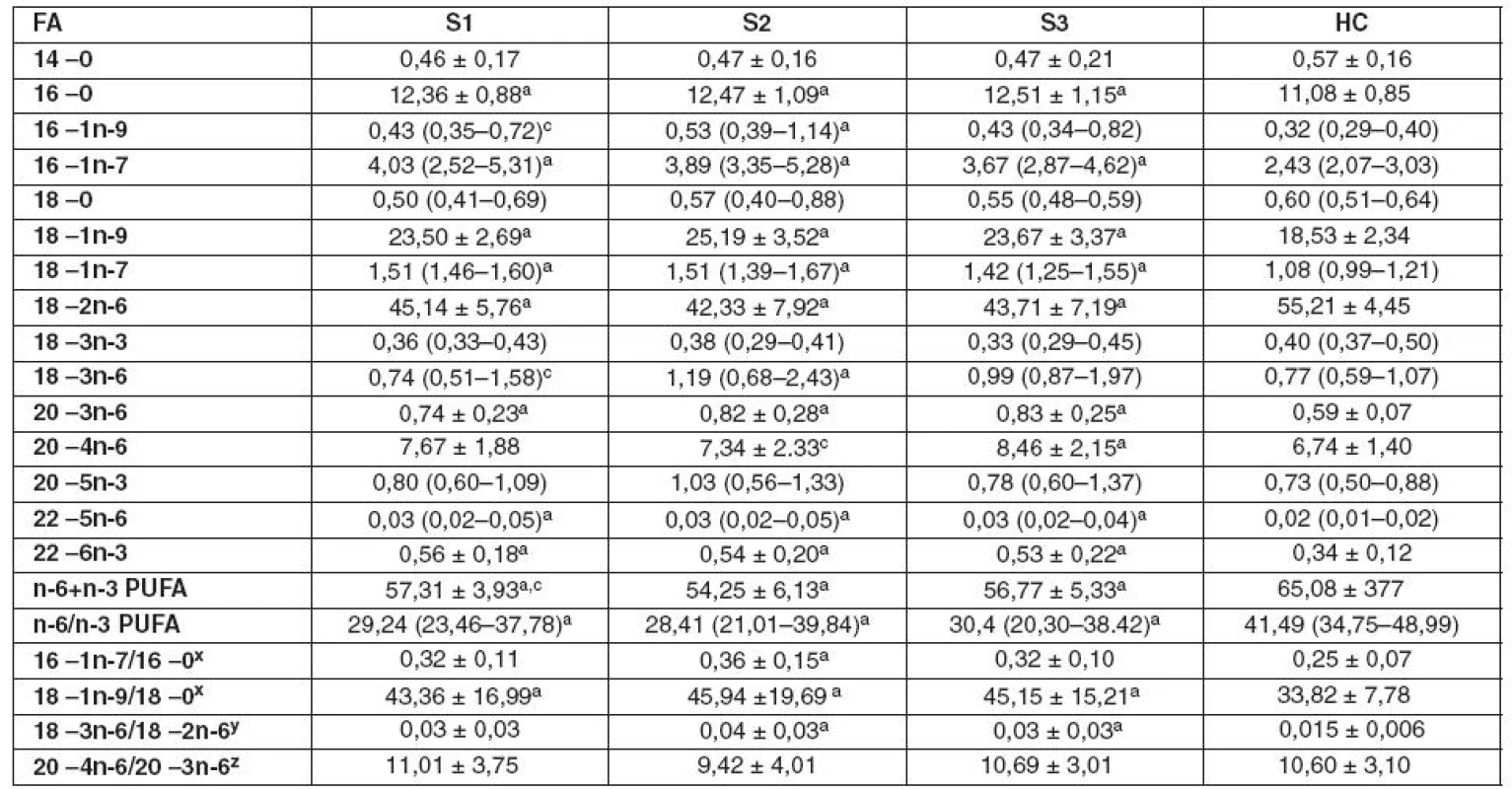
SP – septičtí pacienti zařazení do studie během 24 hodin od začátku sepse (S1 = 19), SP 7 dnů po S1 (S2 = 19) a SP jeden týden po odeznění symptomů sepse (S3 = 19), HC – zdravé kontroly (n = 19); FA – mastné kyseliny, PUFA – vícenenasycené FA xmarker Δ9-desaturázy, ymarker Δ6-desaturázy zmarker Δ5-desaturázy, data jsou prezentovaná jako průměr ± SD pro parametrické a jako medián (25.–75. percentil) pro neparametrické proměnné; aS1, S2, S3 vs. HC, bS1, S2 vs. S3, cS1 vs. S2, p < 0,05 Tab. 3. Složení mastných kyselin (mol %) ve fosfolipidech plazmy v průběhu sepse 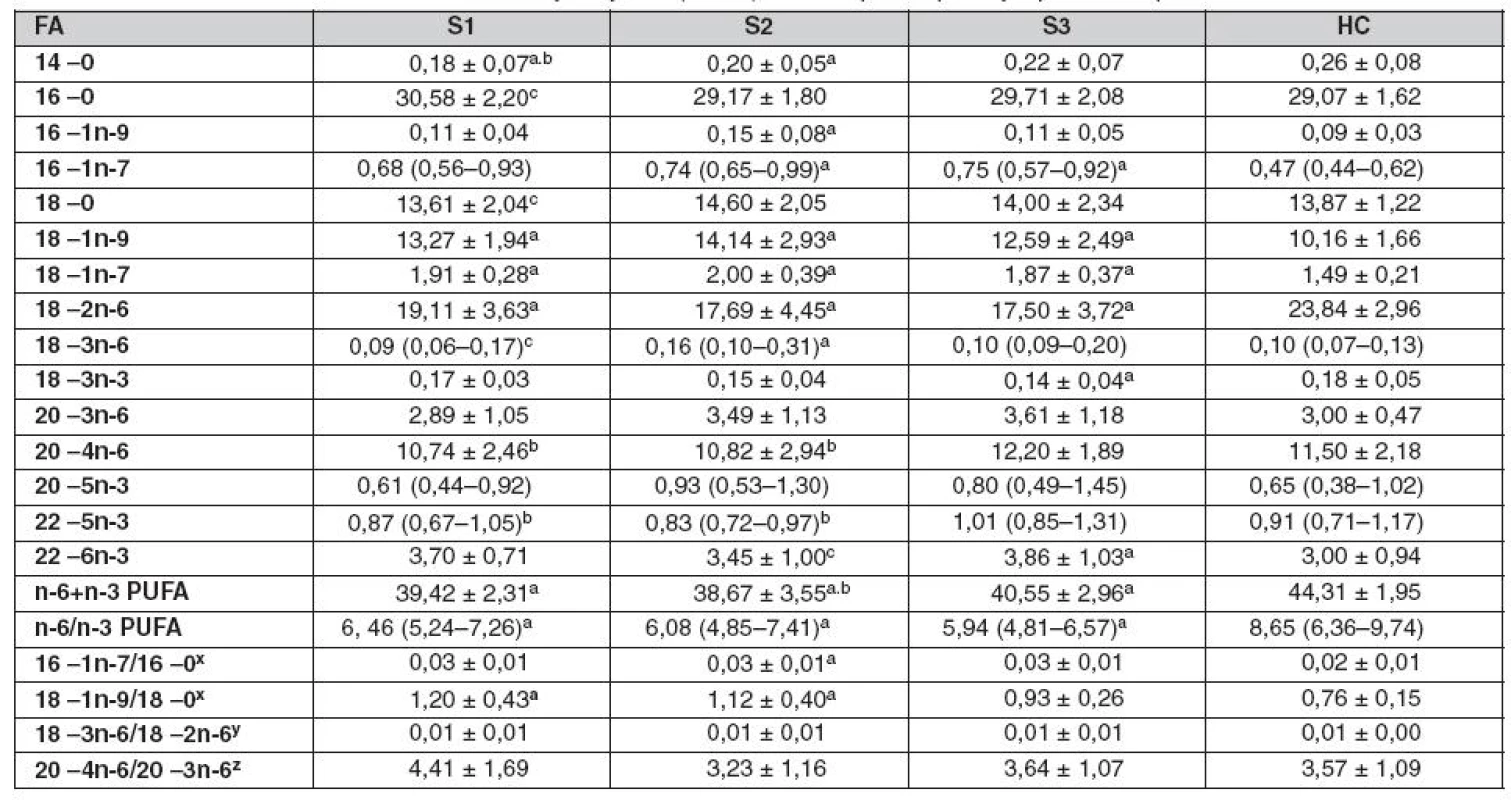
Vysvětlivky viz tabulka 2. Srovnání přeživších a nepřeživších septických pacientů
Pacienti se sepsí, kteří přežili (přeživší první odběr (S1, n = 22) a přeživší druhý odběr (S2, n = 21)), byli porovnáni s pacienty, kteří v průběhu sepse zemřeli po S1 nebo S2 (nepřeživší S1, n = 8 a nepřeživší S2, n = 4). Klinické charakteristiky souboru přeživších/nepřeživších ukazuje tabulka 4. APACHE II bylo u nepřeživších v porovnání s přeživšími signifikantně vyšší. Graf 2 ilustruje zastoupení FA v CE a PPL u přeživších a nepřeživších. Mezi odběrem S1 a S2 se v porovnání s přeživšími u nepřeživších zvyšuje podíl MUFA na úkor PUFA řady n-6 i n-3. V CE došlo v porovnání s přeživšími u nepřeživších ke zvýšení MUFA a snížení n-6 PUFA pouze u odběru S1.
Graf 2. Zastoupení tříd mastných kyselin v esterech cholesterolu, triacylglycerolech a fosfolipidech plazmy a erytrocytů v průběhu sepse 
Septičtí pacienti (SP) zařazení do studie do 24 hodin od nástupu sepse (S1), SP 7 dnů po odběru S1 (S2). S1 (přeživší, n = 22; nepřeživší, n = 8) a S2 (přeživší, n = 21; nepřeživší, n = 4); SFA – nasycené mastné kyseliny, MUFA – mononenasycené mastné kyseliny, n-6 – n-6 vícenenasycené mastné kyseliny, n-3 – n-3 vícenenasycené mastné kyseliny Data jsou uvedena jako průměr ± SD, **p < 0,01, *p < 0,05, nepřeživší vs. přeživší. Tab. 4. Základní charakteristiky septických pacientů – přeživší/nepřeživší v S1 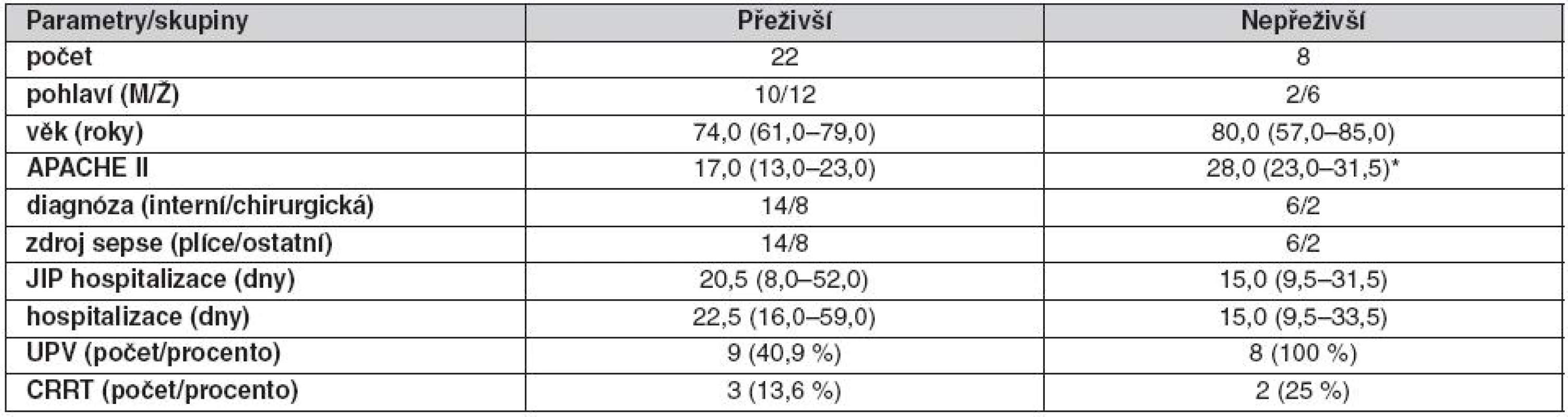
S1 – septičtí pacienti zařazení do studie během 24 hodin od začátku sepse, APACHE II – APACHE II skóre, JIP – jednotka intenzivní péče, UPV – umělá plicní ventilace, CRRT – kontinuální náhrada funkce ledvin Data jsou prezentovaná jako medián (25.–75. percentil) pro neparametrické proměnné, *nepřeživší vs. přeživší, p < 0,05. DISKUZE
Zásadním nálezem této studie je pozorované snížení podílu n-6 PUFA v lipidech plazmy a erytrocytů (způsobené především poklesem LA, 18 : 2n-6) u pacientů v sepsi, které bylo provázeno vzestupem podílu MUFA, zejména díky vzestupu POA (16 : 1n-7), OA (18 : 1n-9) a VA (18 : 1n-7). Zmíněné změny byly pozorovány především v CE a PPL. Podobné posuny ve složení FA v porovnání s HC jsme zaznamenali i v EPL u SP. Tyto změny byly přítomné na počátku sepse (S1), zvýraznily se po sedmi dnech (S2) a přetrvávaly i po uzdravení (S3). Srovnání přeživších a nepřeživších SP ukázalo, že snížení n 6 PUFA a vzestup MUFA je významně výraznější u nepřeživších. Navíc byl zjištěn signifikantně nižší podíl n-3 PUFA v PPL u nepřeživších než u přeživších SP. Složení FA v CE a PPL odráží jak jejich přísun dietou v posledních několika týdnech, tak jejich endogenní metabolismus (de novo syntéza FA, β-oxidace, enzymová desaturace a elongace a také lipoperoxidace) (34, 35). Lidský organismus má jen omezené schopnosti vytvářet zásoby n-3 PUFA. V TAG lidské tukové tkáně má z PUFA nejvyšší zastoupeni LA, která tvoří 14 % z celkového množství FA. Naproti tomu koncentrace ALA (18 : 3n-3), nejvýznamnější n-3 PUFA v TAG tukové tkáně, tvoří pouze 1 % všech FA. Podobný rozdíl platí pro PUFA s dlouhým řetězcem, kdy AA (20 : 4n-6) tvoří 7 % všech FA tukové tkáně, ale n-3 PUFA (EPA, 20 : 5n-3 a DHA, 22 : 6n-3) jsou přítomné pouze v minimálních množstvích (3). Z výše uvedených faktů vyplývá potřeba kontinuálního přísunu n-3 PUFA potravou. Samozřejmě lze předpokládat, že deficit n-6 PUFA u SP je způsoben jen snížením příjmu LA v dietě. Obecně však platí, že pokles n-6 PUFA může vzniknout z více příčin nebo jejich kombinací: 1. nižší přísun LA dietou, 2. porucha konverze LA na její metabolity, 3. zvýšená potřeba PUFA s dlouhým řetězcem (zejména AA) pro syntézu PL a eikosanoidů a 4. zvýšená degradace PUFA β-oxidací a/nebo peroxidací. U kriticky nemocných (např. u sepse a traumatu) je známo, že se aktivita Δ-6 a podobně i Δ-5--desaturázy snižuje (9). Navíc platí, že ačkoliv n-3 PUFA obsahují více dvojných vazeb, jsou ve srovnání s LA pravděpodobně rezistentnější vůči oxidaci (36). Naše výsledky jsou ve shodě s nálezy studie Pratta et al., která popisuje snížení podílu n-6 a n-3 PUFA a zvýšený podíl MUFA a SFA v plazmatických a erytrocytárních lipidech u popálenin časně po vzniku traumatu. Snížené hladiny AA a n-3 PUFA v plazmatických lipidech pacientů s popáleninami svědčí o zvýšené spotřebě těchto FA v procesu zánětu a hojení po traumatu (20). Podobně je tomu u pacientů s ARDS, u kterých byla nižší plazmatická koncentrace LA kompenzována zvýšením OA a POA. U těchto pacientů bylo snížení LA doprovázeno zvýšením plazmatické koncentrace 4-hydroxy-2-nonenalu. Tato látka je specifickým produktem peroxidace lipidů a její přítomnost lze vysvětlit existencí těžkého oxidačního stresu u ARDS, který působí peroxidativní změny v molekulách lipidů (37). Das et al. prokázali negativní korelaci mezi vznikem RONS a hladinami n-6 a n-3 PUFA v PPL u pacientů s pneumonií, sepsí a nemocemi pojiva, jako je revmatoidní artritida a systémový lupus erythematosus (2). Sepse, SIRS a ARDS se klinicky vyznačují poruchou vaskulární mikrocirkulace, která je způsobena nadprodukcí RONS. To vede k porušení oxido-redukční rovnováhy a vzniku oxidačního stresu (38, 39). Za zvýšené zastoupení MUFA u SP zodpovídá zvýšený podíl POA, OA a VA. Tento vzestup MUFA byl popsán za různých patologických stavů, jako jsou kwashiorkorová malnutrice, anorexia nervosa, obezita, diabetes mellitus, karcinom pankreatu a kardiovaskulární onemocnění. Společným znakem těchto stavů je snížení koncentrace n-3 a n-6 PUFA. Zvýšené zastoupení OA a POA je nepřímým ukazatelem aktivity 9-desaturázy , která je známá také jako stearoyl-CoA desaturasa 1 (SCD1). Tento enzym je limitujícím faktorem syntézy MUFA a vkládá dvojnou vazbu v pozici Δ-9 acyl-CoA (40). SCD1, v játrech převažující izoenzym, působí pravděpodobně jako hlavní regulátor energetického metabolismu díky následujícím mechanismům: 1. Aktivita SCD1 snižuje oxidaci FA prostřednictvím akumulace malonyl-CoA, který inhibuje karnitinpalmitoyltransferasu-1. 2. Aktivita SCD1 zvyšuje poměr MUFA/SFA, což bývá spojeno s obezitou, diabetem, kardiovaskulárními onemocněními a rakovinou. 3. SCD1 ovlivňuje expresi genů lipidového metabolismu. Je známo, že aktivitu SCD1 zvyšují některé živiny jako je glukóza, fruktóza a cholesterol v dietě, zatímco PUFA ji naopak snižují. Inzulín aktivitu SCD1 zvyšuje a leptin má účinky opačné (41). V souboru SP by pozorované zvýšení podílu MUFA, způsobené pravděpodobně zvýšenou aktivitou Δ9-desaturázy, mohlo kompenzovat ztrátu membránové fluidity způsobené snížením obsahu PUFA v buněčných membránách. Pozorované rozdíly mezi přeživšími a nepřeživšími SP ukazují, že významným metabolickým prediktorem, který odlišuje nepřeživší SP, je vyšší podíl MUFA spolu se sníženým zastoupením n-3 PUFA. N-3 PUFA vykazují řadu pleitropních příznivých účinků, mezi které patří protizánětlivé, vazodilatační a protisrážlivé vlastnosti, a tak zmírňují závažnost a prognózu sepse.
ZÁVĚR
U septických pacientů jsme ukázali konzistentní pokles n-6 PUFA, který byl provázen zvýšeným zastoupením MUFA v plazmatických lipidech a erytrocytárních fosfolipidech. Tyto změny byly pozorovány na začátku sepse (S1), vrcholily 7. den (S2) a přetrvávaly až do zotavení (S3). Srovnání SP přeživších s nepřeživšími ukázalo, že zatímco u přeživších došlo pouze k poklesu n-6 PUFA, u nepřeživších se snížila hladina jak n-6, tak n-3 PUFA, pravděpodobně díky zvyšujícímu se oxidačnímu stresu. Náš nález deficitu PUFA, závažný zejména u nepřeživších SP, upozorňuje na nezbytnost pečlivé volby lipidových doplňků v dietě SP s ohledem na jednotlivé třídy FA.
Zkratky
- AA – kyselina arachidonová
- ALA – α-linolenová kyselina
- APACHE II – Acute Physiologic and Chronic Health Evaluation II
- ARDS – akutní dechová tíseň dospělých
- CE – cholesterylester
- COX – cyclooxygenáza
- CRP – C–reaktivní protein
- DHA – kyselina dokosahexaenová
- DHGLA – kyselina dihomo—linolenová
- EPA – kyselina eikosapentaenová
- EPL – erytrocytárních PL
- FA – mastné kyseliny
- HC – zdravá kontrola
- HETE – kyselina hydroxyeikosatetraenová
- HEtrE – kyselina hydroxyeikosatrienová
- IL – interleukin
- INF-γ – interferon gama
- LA – kyselina linolová
- LOX – lipoxygenáza
- LT – leukotrien
- LTB4 – leukotrien B4
- MUFA – mononenasycené mastné kyseliny
- NFκB – nukleární faktor kappa B
- OA – kyselina olejová
- PA – kyselina palmitová
- PG – prostaglandin
- PGE2 – prostaglandin E2
- POA – kyselina palmitolejová
- PPAR – peroxizomální proliferátor – aktivovaný receptor
- PPL – plazmatický fosfolipid
- PUFA – vícenenasycené mastné kyseliny
- RONS – reaktivní kyslíková a dusíková sloučenina
- SCCM/ACCP – Society of Critical Care Medicine/American College of Chest Physicians
- SD – směrodatná odchylka
- SFA – nasycené mastné kyseliny
- SIRS – syndrom systémové zánětlivé odpovědi
- SP – septický pacient
- SREBP – sterol regulatory element binding protein
- TAG – triacylglycerol
- TNF-α – tumor nekrotizující faktor alfa
- TX – tromboxan
- TXA2 – tromboxan A2
- VA – kyselina vakcenová
Studie byla podporována z prostředků výzkumného grantu MZ ČR č. IGA NR/8943-4.
Adresa pro korespondenci:
MUDr. František Novák jr., Ph.D.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha
e-mail: fnova@lf1.cuni.cz
Zdroje
1. Cook HW, McMaster ChR. Fatty acid desaturation and chain elongation in eukaryotes. In: Vance DE, Vance JE, eds. Biochemistry of lipids, lipoproteins and membranes. 4th Ed. Amsterdam: Elsevier 2002; 181–204.
2. Das UN. Essential fatty acids: biochemistry, physiology and pathology. Biotechnol J 2006; 1 : 420–439.
3. Arterburn LM, et al. Distribution, interconversion, and dose response of n-3 fatty acids in humans. Am J Clin Nutr 2006; 83 : 1467S–1476S.
4. Smith WL, Murphy RC. The eicosanoids: cyclooxygenase, lipoxygenase and epoxygenase pathways. In: Vance DE, Vance JE, eds. Biochemistry of lipids, lipoproteins and membranes. 4th Ed. Amsterdam: Elsevier 2002; 341–369.
5. Harris SG, et al. Prostaglandins as modulators of immunity. Trends Immunol 2002; 23 : 144–150.
6. Lewis RA, et al. Leukotrienes and other products of the 5-lipoxygenase pathway. Biochemistry and relation to pathobiology in human diseases. N Engl J Med 1990; 323 : 645–655.
7. Tilley SL, et al. Mixed messages: modulation of inflammation and immune responses by prostaglandins and thromboxanes. J Clin Invest 2001; 108 : 15–23.
8. Levy BD, et al. Lipid mediator class switching during acute inflammation: signals in resolution. Nat Immunol 2001; 2 : 612–619.
9. Pontes-Arruda A, deMichele SJ. Enteral nutrition with antiinflammatory lipids in ALI/ARDS. In: Vincent JL, ed. Yearbook of intensive care and emergency medicine 2009. Berlin: Springer-Verlag 2009; 695–704.
10. Obata T, et al. Eicosapentaenoic acid inhibits prostaglandin D2 generation by inhibiting cyclo-oxygenase-2 in cultured human mast cells. Clin Exp Allergy 1999; 29 : 1129–1135.
11. Calder PC. Long-chain n-3 fatty acids and inflammation: potential application in surgical and trauma patients. Braz J Med Biol Res 2003; 36 : 433–446.
12. Brandt S, et al. The role of hypoxia and inflammation in the expression and regulation of proteins regulating iron metabolism. In: Vincent JL, ed. Yearbook of intensive care and emergency medicine 2008. Berlin: Springer-Verlag 2008; 473–480.
13. Forceville X, van Anterpen P. Selenocompounds and selenium: a biochemical approach to sepsis. In: Vincent JL, ed. Yearbook of intensive care and emergency medicine 2008. Berlin: Springer-Verlag 2008; 454–469.
14. Halliwell B, Gutteridge JM. Free radicals in biology and medicine. 4th Ed. Oxford: Oxford University Press 2007.
15. Barton RG. Nutrition support in critical illness. Nutr Clin Pract 1994; 9 : 127–139.
16. Wolfe RR, et al. Energy metabolism in trauma and sepsis: the role of fat. Prog Clin Biol Res 1983; 111 : 89–109.
17. Wolfe RR, et al. Effect of severe burn injury on substrate cycling by glucose and fatty acids. N Engl J Med 1987; 317 : 403–408.
18. Kumar KV, et al. Oxidant stress and essential fatty acids in patients with risk and established ARDS. Clin Chim Acta 2000; 298 : 111–120.
19. Prabha PS, et al. Free radical generation, lipid peroxidation and essential fatty acids in patients with septicemia. Prostaglandins Leukot Essent Fatty Acids 1991; 42 : 61–65.
20. Pratt VC, et al. Fatty acid content of plasma lipids and erythrocyte phospholipids are altered following burn injury. Lipids 2001; 36 : 675–682.
21. Zamaria N. Alteration of polyunsaturated fatty acid status and metabolism in health and disease. Reprod Nutr Dev 2004; 44 : 273–282.
22. Berquin IM, et al. Multi-targeted therapy of cancer by omega-3 fatty acids. Cancer Lett 2008; 269 : 363–377.
23. Imre SG, et al. Increased proportion of docosahexanoic acid and high lipid peroxidation capacity in erythrocytes of stroke patients. Stroke 1994; 25 : 2416–2420.
24. Lemaitre RN, et al. Red blood cell membrane alpha-linolenic acid and the risk of sudden cardiac arrest. Metabolism 2009; 58 : 534–540.
25. Rodrigo R, et al. Relationship between (Na + K)-ATPase activity, lipid peroxidation and fatty acid profile in erythrocytes of hypertensive and normotensive subjects. Mol Cell Biochem 2007; 303 : 73–81.
26. Santos MJ, et al. Influence of dietary fish on fatty acid composition of the erythrocyte membrane in coronary heart disease patients. Int J Vitam Nutr Res 1996; 66 : 378–385.
27. Ueda Y, et al. Elevated concentrations of linoleic acid in erythrocyte membrane phospholipids in patients with inflammatory bowel disease. Nutr Res 2008; 28 : 239–244.
28. Bone RC, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 1992; 101 : 1644–1655.
29. Knaus WA, et al. APACHE II: a severity of disease classification system. Crit Care Med 1985; 13 : 818–829.
30. Kreymann KG, et al. ESPEN Guidelines on Enteral Nutrition: Intensive care. Clin Nutr 2006; 25 : 210–223.
31. Folch J, et al. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem 1957; 226 : 497–509.
32. Tvrzická E, et al. Analysis of fatty acids in plasma lipoproteins by gas chromatography-flame ionization detection. Quantitative aspects. Anal Chim Acta 2002; 465 : 337–350.
33. Rose HG, Oklander M. Improved procedure for the extraction of lipids from human erythrocytes. J Lipid Res 1965; 6 : 428–431.
34. Riccardi G, et al. Dietary fat, insulin sensitivity and the metabolic syndrome. Clin Nutr 2004; 23 : 447–456.
35. Warensjo E, et al. Factor analysis of fatty acids in serum lipids as a measure of dietary fat quality in relation to the metabolic syndrome in men. Am J Clin Nutr 2006; 84 : 442–448.
36. Yazu K, et al. Mechanism of lower oxidizability of eicosapentaenoate than linoleate in aqueous micelles. Lipids 1996; 31 : 337–340.
37. Quinlan GJ, et al. Plasma fatty acid changes and increased lipid peroxidation in patients with adult respiratory distress syndrome. Crit Care Med 1996; 24 : 241–246.
38. Goodyear-Bruch C, et al. Oxidative stress in critically ill patients. Am J Crit Care 2002; 11 : 543–551.
39. Gutteridge JM, et al. Redox imbalance in the critically ill. Br Med Bull 1999; 55 : 49–75.
40. Nakamura MT, et al. Structure, function, and dietary regulation of delta6, delta5, and delta9 desaturases. Annu Rev Nutr 2004; 24 : 345–376.
41. Biddinger SB, et al. Leptin suppresses stearoyl-CoA desaturase 1 by mechanisms independent of insulin and sterol regulatory element-binding protein-1c. Diabetes 2006; 55 : 2032–2041.
Štítky
Adiktologie Alergologie a imunologie Anesteziologie a resuscitace Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská dermatologie Dětská gastroenterologie Dětská gynekologie Dětská chirurgie Dětská kardiologie Dětská nefrologie Dětská neurologie Dětská onkologie Dětská otorinolaryngologie Dětská pneumologie Dětská psychiatrie Dětská radiologie Dětská revmatologie Dětská urologie Diabetologie Endokrinologie Farmacie Farmakologie Fyzioterapie Gastroenterologie a hepatologie Genetika Geriatrie a gerontologie Gynekologie a porodnictví Hematologie a transfuzní lékařství Hygiena a epidemiologie Hyperbarická medicína Chirurgie cévní Chirurgie hrudní Chirurgie plastická Chirurgie všeobecná Infekční lékařství Intenzivní medicína Kardiochirurgie Kardiologie Logopedie Mikrobiologie Nefrologie Neonatologie Neurochirurgie Neurologie Nukleární medicína Nutriční terapeut Obezitologie Oftalmologie Onkologie Ortodoncie Ortopedie Otorinolaryngologie Patologie Pediatrie Pneumologie a ftizeologie Popáleninová medicína Posudkové lékařství Praktické lékařství pro děti a dorost Protetika Psychologie Radiodiagnostika Radioterapie Rehabilitační a fyzikální medicína Reprodukční medicína Revmatologie Sestra Sexuologie Soudní lékařství Stomatologie Tělovýchovné lékařství Toxikologie Traumatologie Urgentní medicína Urologie Laboratoř Domácí péče Foniatrie Algeziologie Zdravotnictví Dentální hygienistka Student medicíny
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
-
Všechny články tohoto čísla
- Postgenomová éra a co příjde po ní?
- Žírné buňky – nový pohled na staré známé
- Změny ve složení mastných kyselin v lipidech plazmy a erytrocytů u kriticky nemocných v průběhu sepse
- Výskyt etanolu a dalších drog u smrtelných dopravních nehod v České republice v roce 2008
- Výskyt metabolického syndromu u žen se syndromem polycystických ovarií
- Biliární ileus – diagnostická i terapeutická výzva
- Pavel Jerie: Pro koho je medicína
- Odborně-edukační činnost České společnosti pro zdravotnickou techniku
- Tradiční setkání lékárníků
- Konference o kardiálních markerech
- 54. výroční sjezd českých a slovenských revmatologů
- Jana Korandová
- 5. středoevropský kurz estetické plastické chirurgie a celostátní sympozium s mezinárodní účastí
- Prof. MUDr. Jan Šmarda, DrSc., osmdesátiletý
- Pocta prof. MUDr. Jiřímu Záhejskému, DrSc.
- VYBRANÉ, KURZY, STÁŽE A SEMINÁŘE IPVZ – 2. POLOLETÍ ROKU 2010
- AKCE ODBORNÝCH SLOŽEK čLS JEP
- Vybíral Z, Roubal J. (eds.): Současná psychoterapie
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Biliární ileus – diagnostická i terapeutická výzva
- Žírné buňky – nový pohled na staré známé
- Prof. MUDr. Jan Šmarda, DrSc., osmdesátiletý
- Změny ve složení mastných kyselin v lipidech plazmy a erytrocytů u kriticky nemocných v průběhu sepse
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



