-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vliv ventilace trvalým pozitivním tlakem na stupeň zánětlivé reakce a funkce orgánů – experimentální studie
The influence of continuous positive pressure ventilation on the degree of inflammatory reaction and organ function – experimental study
Objective:
Assessment of the functioning of extra-pulmonary organs during the ventilation of healthy lungs.Type of study:
Experimental, comparative.Setting:
Experimental Centre of the University Hospital.Materials and methods:
15 white piglets weighing 22.7 (18.8–27) kg were identically instrumentated and monitored under general anaesthesia and divided into three equal groups. The pigs in Group A breathed spontaneously, group B pigs were ventilated with VT 6 ml . kg-1 and group C pigs were ventilated with VT 10 ml . kg-1. Measurements and samplings were performed in all the animal groups in the first hour and in groups B and C at 12 hours. The data were compared in groups and between groups, they were statistically analyzed and considered significantly different when p < 0.05.Results:
The levels of soluble adhesion molecules, left ventricular contractility, FeNa, GFI and Cfw were found to be higher in groups B and C compared with group A in the first hour of the study. Higher levels of inflammatory mediators and BNP, and lower right ventricular performance and Cfw were observed in group C compared to group B. At 12 hours a decline in the ventricular performance and a reduction of inflammatory mediator expression were observed in groups B and C and a reduction of Cfw was observed in group C. Higher values of OI and VI and lower ventricular performance, PaO2/FiO2, Cfw and hourly urine output were found in group C compared to group B.Conclusions:
The results support the hypothesis that mechanical ventilation of healthy lungs activates early inflammatory response. The neuro-humoral regulation and stabilization of other organs’ function are temporary. Mechanical ventilation with VT 10 ml . kg-1 reduces the treatment effect and its prolonged use has an adverse impact on extra-pulmonary organs.Keywords:
mechanical ventilation – inflammatory reaction, neuro-humoral regulation – cardiac performance – renal function
Autoři: Kobr Jiří 1; Fremuth Jiří 1; Pizingerová Kateřina 1; Fikrlová Šárka 1; Jehlička Petr 1; Honomichl Petr 1; Šašek Lumír 1; Racek Jaroslav 2; Topolčan Ondřej 3
Působiště autorů: Dětská klinika JIP, LF UK v Plzni a FN v Plzni 1; Ústav klinické biochemie a hematologie, LF UK v Plzni a FN v Plzni 2; Oddělení imunoanalytické diagnostiky, LF UK v Plzni a FN v Plzni 3
Vyšlo v časopise: Anest. intenziv. Med., 20, 2009, č. 2, s. 88-95
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cíl studie:
Ověřit ovlivnění funkce mimoplicních orgánů v průběhu ventilace zdravých plic.Typ studie:
Experimentální, komparativní.Pracoviště:
Experimentální centrum LF.Materiál a metoda:
Patnáct selat prasete bílého, o hmotnosti 22,7 kg (18,8–27 kg), bylo v celkové anestezii identicky instrumentováno, monitorováno a rozděleno do tří pětičlenných skupin. Skupina A spontánně dýchající, skupina B ventilována s VT 6 ml . kg-1, skupina C s VT 10 ml . kg-1. Měření i odběry byly provedeny u všech zvířat v 1. hodině studie a ve 12. hodině ve skupinách B a C. Funkce orgánů doloženy reprezentativními parametry. Data byla porovnána ve skupinách a mezi skupinami. Výsledky byly statisticky analyzovány, za významný byl považován rozdíl p < 0,05.Výsledky:
V 1. hodině byly ve skupinách B a C vyšší hladiny solubilních adhezivních molekul, kontraktilita levé komory, FeNa, GFI a nižší Cfw v porovnání se skupinou A. Ve skupině C byly vyšší hladiny mediátorů zánětu a BNP a nižší hodnoty výkonnosti pravé komory i Cfw v porovnání se skupinou B. V 12. hodině došlo ve skupinách B a C k poklesu výkonnosti obou srdečních komor, snížení exprese mediátorů zánětu a ve skupině C ke snížení Cfw. Ve skupině C byly ve srovnání se skupinou B vyšší OI i VI a nižší výkonnost obou srdečních komor, PaO2/FiO2, Cfw i hodinová diuréza. Rozdíly zbývajících parametrů nebyly statistické významné.Závěry:
Výsledky podporují hypotézu, že umělá ventilace zdravých plic aktivuje časnou zánětlivou reakci. Neurohumorální regulace a stabilizace funkce mimoplicních orgánů jsou časově limitované. Ventilace dechovým objemem 10 ml . kg-1 snižuje efekt léčby a s dobou trvání potencuje nežádoucí reakce mimoplicních orgánů.Klíčová slova:
umělá plicní ventilace – zánětlivá reakce – neurohumorální regulace – výkonnost myokardu – funkce ledvinÚvod
Umělá plicní ventilace trvalým pozitivním tlakem je v konvenční podobě rutinní metodou podpory nebo náhrady funkce respiračního systému. Indikací k umělé ventilaci je v pediatrické praxi převážně respirační insuficience plicní etiologie. V průběhu léčby mají děti tendenci k retenci tekutin. Otázkou je, zda retence tekutin vzniká vlivem zprostředkované reakce mimoplicních orgánů na plicní postižení nebo léčebnou metodu.
Koncept naší studie je původní tím, že umělé plicní ventilaci vystavil zdravý organismus experimentálních zvířat, vyloučil vliv orgánové patologie a strategií ventilace eliminoval arteriální hypoxii či hyperkapnii. Na plně instrumentovaném zvířecím modelu byla v pravidelných intervalech ověřována funkce plic, kardiovaskulárního systému, jater i ledvin, hodnocena aktivita neurohumorální regulace a zánětlivé reakce. Ventilační indexy dokladovaly funkci plic. Pulzová frekvence, krevní tlaky, natriuretický peptid, kontraktilita levé a výkonnost obou srdečních komor dokumentovaly funkci kardiovaskulárního systému. Frakcionovaná exkrece sodíku (FeNa) a clearance bezsolutové vody (Cfw) vyjadřovaly aktivitu neurohumorální regulace, solubilní adhezivní molekuly a cytokiny systémovou zánětlivou reakci. Exkreční funkce jater byla doložena celkovým bilirubinem, proteosyntéza fibrinogenem a integrita hepatocytu jaterními transaminázami. Funkci ledvin vyjadřovaly hodinová diuréza a index glomerulární filtrace.
Cílem naší studie bylo zjistit, zda dochází k ovlivnění mimoplicních orgánů v průběhu umělé ventilace zdravých plic.
Materiál a metodika
Studie proběhla na akreditovaném experimentálním pracovišti LF UK v Plzni, se souhlasem etické komise a v souladu s platnými předpisy ČR i EU pro práci s experimentálními zvířaty. Do experimentální komparativní studie bylo zařazeno celkem 15 plně instrumentovaných selat prasete bílého, stáří 6–8 týdnů, průměrné hmotnosti 22,7 kg (rozsah 18,8–27 kg).
Instrumentace a zajištění zvířat
Premedikace kombinací atropin 0,07 mg . kg-1 (Atropin; Biotika, Slovakia) a azaperon 5,0 mg . kg-1 (Stresnil; Janssen Neuss, Germany) byla aplikována intramuskulárně všem zvířatům 30 minut před zahájením studie. Anestezie byla indukována aplikací thiopentalu 10,0 mg . kg-1(Thiopental; ICN, CZ) do periferní žíly a všechna zvířata byla orotracheálně intubována (Kendall 5,5F; GPS Praha, s. r. o., CZ) [1]. Umělá plicní ventilace (Servo 900 C; Elema-Siemens, Germany) byla vedena v režimu tlakově řízené ventilace s konstantní dechovou frekvencí (BR) 26/min, endexspiračním tlakem (PEEP) 6 cm H2O a frakcí kyslíku ve vdechované směsi (FiO2) 0,21. V kontinuální intravenózní anestezii thiopentalem 2,0 mg . kg-1 . hod-1 a analgezii bolusovými dávkami fetanylu 5,0 μg . kg-1 (Fentanyl; Torrex Chiesi, CZ) byly zavedeny invazivní vstupy. Centrální žilní katétr (Certofix Mono 5F; B. Braun Melsungen AG, Germany) byl zaveden punkcí vnitřní jugulární žíly, preparací femorální cévy arteriální linka (Arrow 22G; International CR, Germany) a perkutánní cystostomií byl zaveden močový katétr (Cystofix, B. Braun Melsungen AG, Germany). Po dobu studie byla všem zvířatům podána kontinuální infuze krystaloidu rychlostí 2,5 ml . kg-1 . hod-1 (Ringer; Infusia, a. s., CZ).
Podle strategie ventilace byla experimentální zvířata rozdělena do tří stejně početných, pětičlenných skupin (A, B, C). Kontrolní porovnávací skupinu A tvořila tracheálně intubovaná, spontánně dýchající selata, která byla připojena k ventilátoru bez tlakové podpory s přívodem vzduchu (FiO2 0,21) za účelem měření parametrů plicní mechaniky. Zvířata skupin B a C byla ventilována v supinační poloze dvěma odlišnými nastaveními, a to skupina B s protektivním dechovým objemem 6 ml . kg-1 a skupina C konvenčním dechovým objemem 10 ml . kg-1. Funkce mimoplicních orgánů nebyly záměrně farmakologicky ovlivňovány.
Měření a výpočty
Byly sledovány: EKG záznam, srdeční frekvence (HR), pulzní oxymetrií saturace hemoglobinu kyslíkem (SpO2, %), koncentrace oxidu uhličitého na konci výdechu (etCO2, kPa), centrální žilní tlak (CVP, cm H2O), systolický (SBP, mm Hg), střední (MAP, mm Hg) a diastolický (DBP, mm Hg) systémový arteriální tlak monitorem (Nihon Kohden, Japan), hodinová diuréza (UO, ml . kg-1 . hod-1), teplota tělesného jádra permanentním močovým katétrem, vrcholový inspirační (PIP, cm H2O), střední tlak v dýchacích cestách (Paw, cm H2O), frekvence dechů (BR . min-1), endexspirační tlak (PEEP, cm H2O), dechový objem (VT, ml . kg-1), minutový dechový objem (MV, l . min-1) a frakce kyslíku ve vdechované plynné směsi (FiO2) z plicního ventilátoru. Provedeno bylo konvenční planimetrické a dopplerovské echokardiografické vyšetření (Sono Line; sonda 3,5–5,0 Hz; Siemens, Germany) z přední strany hrudníku. Laboratorní vyšetření zahrnovala stanovení: urey, kreatininu, Na, K, Cl, osmolality v séru i moči; ALT, AST, celkového bilirubinu v séru, APTT, PT a fibrinogenu v plasmě, acidobazické rovnováhy a krevních plynů v arteriální krvi. Alogenní imunoanalýzou byly stanoveny: interleukin 6 v séru (IL-6, pg . ml-1; RD-ELISA), tumor nekrotizující faktor alfa (TNF-α, pg . ml-1;RD-ELISA), intercelulární solubilní adhezivní molekuly 1 (ICAM, ng . ml-1;Bender - -ELISA), vaskulární solubilní adhezivní molekuly 1 (VCAM, ng . ml-1; Bender-ELISA) a natriuretický peptid (BNP, ng . ml-1, Bachem-EIA) v plasmě.
Výpočty: alveoloarteriální tlaková diference kyslíku (AaDO2, kPa), arterioalveolární tlaková diference kyslíku (a/ADO2, kPa), oxygenační index [OI = (Paw . FiO2) . 100/PaO2], hypoxemické skóre (PaO2/FiO2, mm Hg), poměr dechového objemu a mrtvého prostoru (VD/VT, %), ventilační index (VI = Paw . BR), dynamická poddajnost respiračního systému (Cdyn; ml . cmH2O-1 . kg-1), dynamický průtočný odpor dýchacích cest (Raw, cmH2O . l-1 . s-1) [2]; frakce zkrácení levé komory [SF = (diastolický–systolický rozměr levé komory)/diastolický rozměr levé komory] a Tei – index výkonnosti pravé (RIMP) i levé (LIMP) srdeční komory (IMP = (izovolumová relaxace + izovolumová kontrakce)/ejekční čas), který vyjadřuje globální, systolickou i diastolickou funkci každé z komor a elevace hodnoty je výrazem dysfunkce příslušné komory [3]; frakční exkrece sodíku [FeNa = (u-Na/s-Na)/(u-kreatinin/s-kreatinin)], index glomerulární filtrace [GFI = u-Na/(u-kreatinin/s-kreatinin)], clearance bezsolutové vody (Cfw = [hodinová diuréza – (hodinová diuréza . u-osmolalita)]/s-osmolalita ml/h) [4].
Protokol studie
Po instrumentaci selat a 60minutovém intervalu zotavení byla studie zahájena – čas 0. Měření i odběry materiálu k laboratorním testům byly u všech zvířat realizovány v 1. hodině studie – čas 1 (A, B1, C1) a u ventilovaných selat znovu ve 12. hodině studie – čas 12 (B12, C12). Krev byla odebírána z arteriální linky, moč močovým katétrem, vzorky byly na místě zpracovány a následně laboratorně analyzovány. Data měření a výsledky laboratorních analýz byly zaznamenány do protokolu každého zvířete v PC databázi. Po ukončení studie byla selata v celkové anestezii utracena bolusovou dávkou kardioplegického roztoku (10 % St. Thomas sol. 15 ml . kg-1 i. v.). Těla usmrcených zvířat byla odstraněna v souladu s platnými předpisy EU a ČR.
Statistická analýza
Parametrická i neparametrická popisná analýza stanovila každému datu průměr, medián, minimum, maximum, směrodatné odchylky, interkvartilové rozmezí (25. percentil a 75. percentil) a konfidenční interval (95% CI). Data skupin B a C byla porovnávána s kontrolní skupinou A, v každé skupině s intervalem 12 hodin a mezi skupinami. Rozdíly v jednotlivých skupinách, výběrech (B1vs B12 a C1vs C12) byly hodnoceny dvouvýběrovým t-testem a nepárovým testem podle Wilcoxonova testu. Byly stanoveny intervaly spolehlivosti (Andersonův-Darlingův test), rozptylu dvouvýběrovým F-testem a shody dat (Blandův-Altmanův test). Rozdíl dat mezi výběry byl hodnocen párovým t-testem (Studentův test) a momentální regresní korelací (Pearsonův test). Mnohonásobná porovnání byla provedena Bonferroniho korekcí t-testu a lineární regresí mezi daty Cfw, GFI, FeNa, UO jako cílovými, závisle proměnnými a daty AaDO2, PaO2/FiO2, OI, VD/VT, VI, Cdyn, Raw, TNF-α, Il-6, BNP, VCAM, ICAM, MAP, SF, RIMP, LIMP jako nezávisle proměnnými. Pro stanovení významnosti porovnání tří experimentálních skupin byla použita dvoufaktorová ANOVA analýza (software Analyse-it211 Software, Ltd.).
Data v textu, tabulkách i grafech jsou uvedena jako průměr se směrodatnou odchylkou – mean (SD). Za významný byl považován rozdíl p < 0,05.
Výsledky
Data měření, laboratorních analýz a indexovaných parametrů u spontánně dýchajících zvířat skupiny A byla použita jako porovnávací kontroly.
- •Čas 1 – ANOVA analýzou byly nalezeny významné rozdíly dat sledovaných parametrů mezi skupinami experimentálních zvířat (F = 6,1; p < 0,001; Fcrit = 2,699). V první hodině studie se rozdíly parametrů ventilace týkaly výhradně skupiny C s nižší a/ADO2 0,55 kPa (SD 0,22) vs 0,89 kPa (SD 0,19) skupiny A (p = 0,019) a vyšší Raw 1,21 cmH2O . l-1 . s-1 (SD 0,28) vs 1,01 cmH2O . l-1 . s-1 (SD 0,36) skupiny B (p = 0,049).
Data reprezentativních imunoanalytických, renálních a kardiálních parametrů v 1. hodině uvádí tabulka 1.
Tab. 1. Imunoanalytické, renální a kardiální parametry v 1. hodině studie 
A – spontánní dýchání, B₁ – umělá plicní ventilace s VT 6 ml . kg⁻¹ v 1. hodině studie, C₁ – umělá plicní ventilace s VT 10 ml . kg⁻¹v 1. hodině studie, TNF-α – tumor nekrotizující faktor alfa, Il-6 – interleukin 6, BNP – natriuretický peptid, VCAM – vaskulární solubilní adhezivní molekuly, ICAM – intercelulární solubilní adhezivní molekuly, Cfw – clearance bezsolutové vody, GFI – index glomerulární fil - trace, FeNa - frakcionovaná exkrece sodíku, UO – hodinová diuréza, MAP – střední arteriální tlak, SF – frakce zkrácení levé komory, RIMP – Tei-index výkonnosti myokardu pravé komory, LIMP – Tei-index výkonnosti levé komory. Hodnoty jsou uvedeny jako průměr a směrodatná odchylka – mean (SD). Dvouvýběrový párový Studentův t-test: ap < 0,05 vs A, bp < 0,01 vs A, cp < 0,05 vs B₁, dp < 0,01 vs B₁, eBonferroniho korekce t-testu Imunoanalytické parametry byly s vyšší VCAM ve skupině B vs A (p = 0,045) i ve skupině C vs A (p = 0,001), vyšší ICAM ve skupině B vs A (p = 0,005) a ve skupině C vs A (p = 0,001) i ve skupině C vs B (p = 0,032), vyšší TNF-α ve skupině C vs A (p = 0,050) a vyšší BNP ve skupině C vs A (p = 0,008). Rozdíly IL-6 mezi skupinami nebyly významné. Rozptyl dat indexovaných renálních parametrů byl důvodem pro Bonferroniho korekci t-testu k vyjádření rozdílu průměrů mezi skupinami. Nižší Cfw byla ve skupině C vs A (p = 0,048) i C vs B (p = 0,044), vyšší GFI ve skupině B vs A (p = 0,028) i ve skupině C vs A (p = 0,049) a vyšší byla FeNa ve skupině B vs A (p = 0,034) i skupině C vs A (p = 0,030). Kardiální indexy byly s vyšší SF ve skupině B vs A (p = 0,018) i ve skupině C vs A (p = 0,037) a vyšším RIMP ve skupině C vs A (p = 0,016). Nevýznamné byly rozdíly dat systémových tlaků i LIMP. Rozdíly dat hodinové diurézy a parametrů funkce jater byly pod hranicí statistické významnosti.
- Čas 12 – ANOVA analýzou byly nalezeny významné rozdíly dat sledovaných parametrů mezi skupinami experimentálních zvířat (F =4,595, p < 0,01, Fcrit = 2,725). Rozdíly parametrů ventilace se týkaly výhradně skupiny C s nižší a/ADO2 0,67 kPa (SD 0,39) vs2/FiO2 322,97 mm Hg (SD 173,50) vs 414,12 mm Hg (SD 107,62) skupiny B (p = 0,040), vyšším OI 4,33 (SD 2,73) vs 2.10 (SD 1,38) ve výběru C1 (p = 0,041) a vyšším VI 41,69 (SD 25,21) vs 0,87 kPa (SD 0,24) a skupiny B (p = 0,021) s nižším PaO 20,66 (SD 5,99) skupiny A (p = 0,047).
Data reprezentativních imunoanalytických, renálních a kardiálních parametrů ve 12. hodině studie jsou uvedena v tabulce 2.
Tab. 2. Imunoanalytické, renální a kardiální parametry ve 12. hodině studie 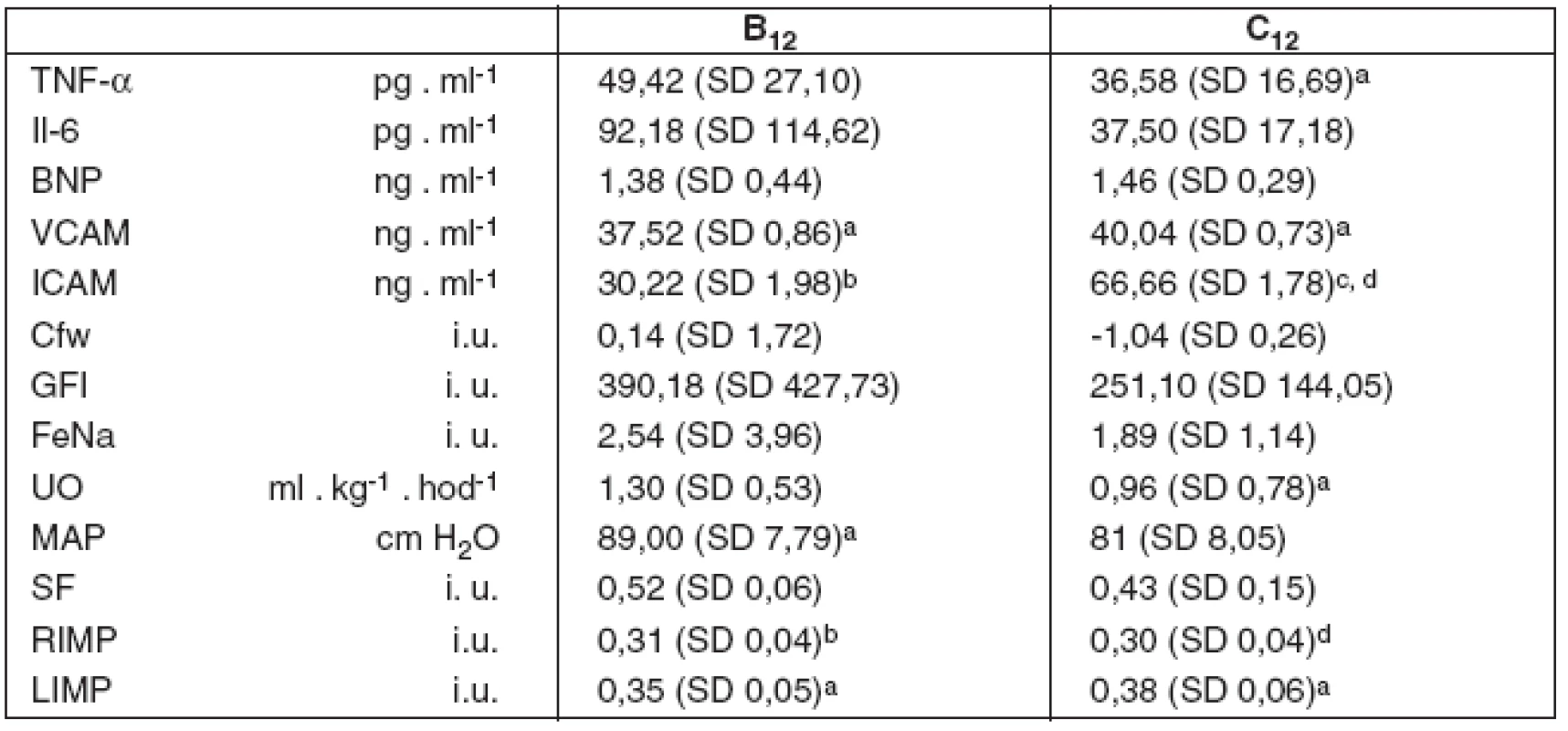
B12 – umělá plicní ventilace s VT 6 ml . kg-1 ve 12. hodině studie, C12 – umělá plicní ventilace s VT 10 ml . kg-1 ve 12. hodině studie (A – spontánní dýchání). TNF-α – tumor nekrotizující faktor alfa, Il-6 – interleukin 6, BNP – natriuretický peptid, VCAM – vaskulární solubilní adhezivní molekuly, ICAM – intercelulární solubilní adhezivní molekuly, Cfw – clearence bezsolutové vody, GFI – index glomerulární filtrace, FeNa – frakcionovaná exkrece sodíku, UO – hodinová diuréza, MAP – střední arteriální tlak, SF – frakce zkrácení levé komory, RIMP – Tei-index výkonnosti myokardu pravé komory, LIMP – Tei-index výkonnosti levé komory. Hodnoty jsou uvedeny jako průměr a směrodatná odchylka – mean (SD). Dvouvýběrový párový Studentův t-test: ap < 0,05 vs A, bp < 0,01 vs A, cp < 0,05 vs B12, dp < 0,001 vs B12 Imunoanalytické parametry byly s vyšší VCAM v obou skupinách ventilovaných proti kontrolní skupině, s rozdíly B vs A (0,043), C vs A (p = 0,045), a vyšší ICAM v obou skupinách ventilovaných proti kontrolní skupině i mezi sebou, s rozdíly B vs A (p = 0,008), C vs A (p = 0,002) i C vs B (p=0,017). Nižší byl TNF-α ve skupině C vs A (p = 0,014) a nevýznamně nižší ve skupině B. Rozdíly dat IL-6 a BNP nebyly statisticky významné.
Trendy změn imunoanalytických parametrů v celém průběhu studie dokumentuje graf 1.
Graf 1. Imunoanalytické parametry v průběhu studie (n = 25) A – spontánní dýchání, B<sub>1</sub> – umělá ventilace s T<sub>V</sub> 6 ml . kg<sup>-1</sup> v 1. hodině studie, B<sub>12</sub> – umělá ventilace s T<sub>V</sub> 6 ml . kg<sup>-1</sup> ve 12. hodině studie, C<sub>1</sub> – umělá plicní ventilace s T<sub>V</sub> 10 ml . kg<sup>-1</sup> v 1. hodině studie, C<sub>12</sub> – umělá plicní ventilace s T<sub>V</sub> 10 ml . kg<sup>-1</sup> ve 12. hodině studie TNF-α – tumor nekrotizující faktor alfa, IL-6 – interleukin 6, intercelulární (ICAM) a vaskulární (VCAM) solubilní adhezivní molekuly. Hodnoty jsou uvedeny jako průměr a směrodatná odchylka – mean (SD). 
Rozdíly renálních indexů se týkaly výhradně skupiny C s nižší Cfw vs C1(p = 0,040), nižší UO vs C1 (p = 0,008) a nižší OU vs A (p = 0,010). Rozdíly dat zbývajících parametrů, včetně funkce jater, byly pod hranicí statistické významnosti.
Trendy změn renálních parametrů v celém průběhu studie dokumentují grafy 2 a 3.
Graf 2. Frakční exkrece sodíku (FeNa), hodinová diuréza (UO) a clearance bezsolutové vody (Cfw) v průběhu studie ( n= 25) A – spontánní dýchání, B<sub>1</sub> – umělá ventilace s T<sub>V</sub> 6 ml . kg<sup>-1</sup> v 1. hodině studie, B<sub>12</sub>– umělá ventilace s T<sub>V</sub> 6 ml . kg<sup>-1</sup> ve 12. hodině studie, C<sub>1</sub> – umělá plicní ventilace s T<sub>V</sub> 10 ml . kg<sup>-1</sup> v 1. hodině studie, C<sub>12</sub> – umělá plicní ventilace s T<sub>V</sub> 10 ml . kg<sup>-1</sup> ve 12. hodině studie Hodnoty jsou uvedeny jako průměr a směrodatná odchylka – mean (SD). 
Graf 3. Index glomerulární filtrace (GFI) v průběhu studie (n = 25) A – spontánní dýchání, B<sub>1</sub> – umělá ventilace s T<sub>V</sub> 6 ml . kg<sup>-1</sup> v 1. hodině studie, B<sub>12</sub> – umělá ventilace s T<sub>V</sub> 6 ml . kg<sup>-1</sup> ve 12. hodině studie, C<sub>1</sub> – umělá plicní ventilace s T<sub>V</sub> 10 ml . kg<sup>-1</sup> v 1. hodině studie, C<sub>12</sub>– umělá plicní ventilace s T<sub>V</sub>10 ml . kg<sup>-1</sup> ve 12. hodině studie Hodnoty jsou uvedeny jako průměr a směrodatná odchylka – mean (SD). 
Kardiální indexy byly s nižší SF ve skupině B vs B1 (p = 0,037) a nižší ve skupině C vs C1 (p = 0,041), vyšší RIMP ve skupině B vs B1(p = 0,0085), vyšší ve skupině B vs A (p = 0,006), vyšší ve skupině C vs A (p = 0,0016), vyšší ve skupině C vs C1 (p = 0,019) a vyšší LIMP ve skupině B vs A (p = 0,028), ve skupině C vs A (p = 0,019) a C vs C1 (p = 0,032). Rozdíly krevních tlaků nebyly významné, s výjimkou vyššího MAP ve skupině B vs A (p = 0,045).
Trendy změn kardiálních parametrů a exprese natriuretického faktoru v celém průběhu studie dokumentuje graf 4.
Graf 4. Kardiální parametry a natriuretický peptid v průběhu studie (n= 25) A – spontánní dýchání, B<sub>1</sub> – umělá ventilace s T<sub>V</sub> 6 ml . kg<sup>-1</sup> v 1. hodině studie, B<sub>12</sub> – umělá ventilace s T<sub>V</sub> 6 ml . kg<sup>-1</sup> ve 12. hodině studie, C<sub>1</sub> – umělá plicní ventilace s T<sub>V</sub> 10 ml . kg<sup>-1</sup> v 1. hodině studie, C<sub>12</sub> – umělá plicní ventilace s T<sub>V</sub> 10 ml . kg<sup>-1</sup> ve 12. hodině studie, BNP – natriuretický peptid, SF – frakce zkrácení levé komory, RIMP – Tei-index výkonnosti myokardu pravé komory, LIMP – Tei-index výkonnosti myokardu levé komory Hodnoty jsou uvedeny jako průměr a směrodatná odchylka – mean (SD). 
Data studie byla analyzována pro stanovení významnosti, příčinného vztahu, kvalifikace pravděpodobnosti a spolehlivosti. Cílovými, závislými proměnnými byly renální parametry. Analýza dat renálních parametrů prokázala, že Cfw korelovala s FeNa (r = 0,085, p < 0,01) a mohla být hodnotou FeNa ovlivněna s vysokou spolehlivostí (p = 0,043, 95% CI -0,90;-0,02), Cfw korelovala s GFI (r = 0,059, p < 0,01) s hraniční spolehlivostí (p = 0,077, 95% CI -0,94;-0,001) a Cfw korelovala s UO (r = 0,113, p < 0,05) s nízkou spolehlivostí (p = 0,111, 95% CI -1,59; 0,17). GFI korelovala s UO (r = 0,029, p < 0,001) s nízkou spolehlivostí (p = 0,342, 95% CI -1546; 4273). Naopak FeNa nekorelovala s UO (r = 0,009, p = 0,099) s nízkou spolehlivostí (p = 0,325, 95% CI -12,2; 35,3) a FeNa nekorelovala ani s GFI (r = 0,994, p = 0,988) s nízkou spolehlivostí (p = 0,327, 95% CI -82; 236).
Korelace, regrese a hladina s intervalem spolehlivosti dat cílových, závislých s nezávislými jsou uvedeny v tabulce 3.
Tab. 3. Korelace, regrese a spolehlivost dat studie (n = 25) 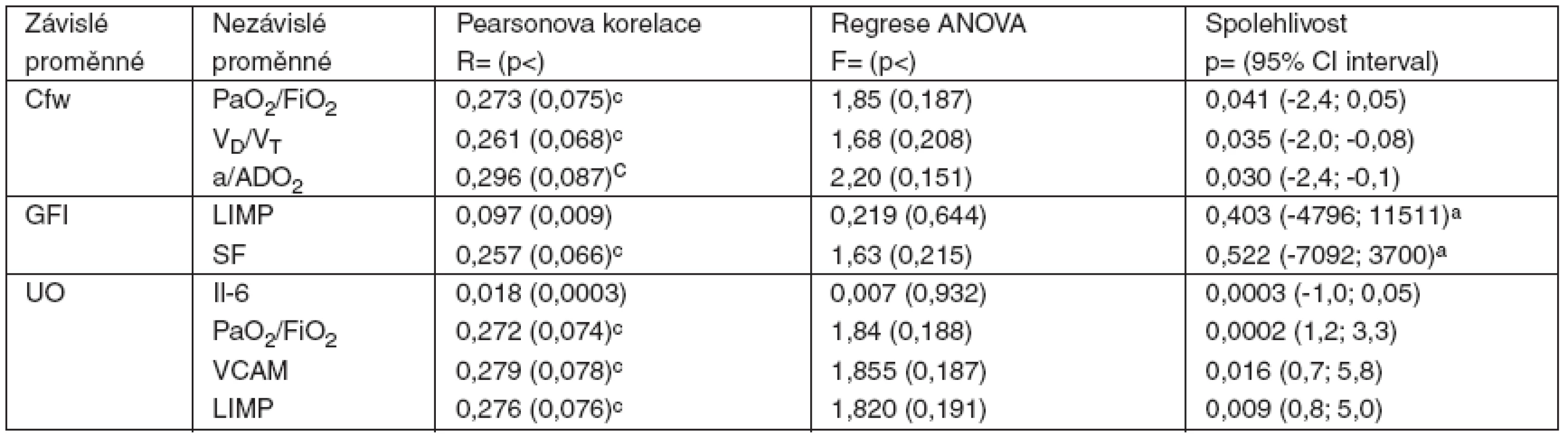
Cílové, závislé proměnné: clearence bezsolutové vody (Cfw), index glomerulární filtrace (GFI) a hodinová diuréza (UO). Nezávislé proměnné: arterio-alveolární tlaková diference kyslíku (a/ADO2), hypoxemický index (PaO2/FiO2), podíl ventilace mrtvého prostoru (VD/VT), tumor nekrotizující faktor alfa (TNF-α), interleukin 6 (Il-6), vaskulární solubilní adhezivní molekuly (VCAM), intercelulární solubilní adhezivní molekuly (ICAM), střední arteriální tlak (MAP), frakce zkrácení levé komory (SF), Tei-index výkonnosti pravé (RIMP) a levé komory (LIMP). ANOVA analýza: anízká hladina a široký interval spolehlivosti, chraniční významnost korelace. Cílová proměnná FeNa není v přehledu uvedena, protože nekorelovala s žádnou z nezávisle proměnných a nemohla být ovlivněna hodnotou žádné z nich. Výsledkem analýzy byla dvě negativní zjištění: GFI nekoreloval s MAP (r = 0,327, p = 0,107) s hraniční spolehlivostí (p = 0,058, 95% CI -322; 17712) a UO nekorelovala s MAP (r = 0,487, p = 0,238) s vysokou spolehlivostí (p < 0,001, 95%CI 2,2; 6,6).
Diskuse
Předkládaná studie vycházela z předpokladu, že umělá plicní ventilace generuje periodické změny objemu při trvale pozitivním nitrohrudním tlaku a hypoteticky může ovlivnit funkci mimoplicních orgánů třemi odlišnými mechanismy. Prvním je fyzikální limitace srdečního výdeje, aktivace neurohumorální regulace a deprese systémové hemodynamiky. Druhým je plicní mechanotransdukce s expresí mediátorů zánětu a lokální generalizace se systémovou zánětlivou reakci. Třetím možným mechanismem je ovlivnění regionální hemodynamiky arteriální hypoxémií, popř. hyperkapnií. Výsledkem kombinované interakce je zachování účinné perfuze ledvin za cenu retence sodíku a vody v organismu.
Výsledky naší studie podporují tvrzení o příčinné souvislosti mezi umělou ventilací a reakcí mimoplicních orgánů. V průběhu studie postupně došlo k ovlivnění funkce myokardu, plic a ledvin bez významného ovlivnění krevního tlaku nebo funkce jater. V souladu s literárními údaji produkoval cévní endotel plicního řečiště solubilní adhezivní molekuly a alveolární makrofágy uvolnily cytokiny [5, 6]. Cirkulující mediátory zánětu vyvolaly molekulární interakce a změny cévní propustnosti i mikrocirkulace v orgánech [7]. Nitrohrudní fyzikální vlivy limitovaly diastolické plnění srdečních oddílů, změna srdečního výkonu aktivovala neurohumorální autoregulace ke stabilizaci krevního oběhu. Aldosteron snížil vylučování sodíku močí a naopak natriuretický peptid vylučování sodíku močí zvýšil. Aktivované receptory vegetativního nervového systému, angiotenzin a endogenní katecholované aminy ovlivnily renální perfuzi a connexiny mikrocirkulaci v kůře ledvin. Renální mikrocirkulace, funkce membránových receptorů, transportních „kanálů“ i buněčných organel byla regulována tzv. signálními molekulami a ovlivňována orgánovými, tkáňovými, buněčnými a molekulárními interakcemi [8, 9]. Výslednou funkci ledvin ovlivnily převážně změny na regionální úrovni [10, 11].
Výsledky naší studie prokázaly, že na rozdíl od permanentní aktivity zánětu byla účinnost neurohumorální regulace časově diferencována. V první hodině studie došlo k významnému zvýšení kontraktility levé komory, sekrece natriuretických peptidů a exkrece sodíku i glomerulární filtrace. Po 12 hodinách přetrvával vliv aldosteronu s poklesem exkrece sodíku a zvýšením vylučování draslíku močí (u-Na/u-K < 1,0). V průběhu studie nebyly významně ovlivněny hodnoty systémového krevního tlaku, hodinová diuréza, oxémie ani funkce jater.
Regresní analýzou byla odkryta zajímavá zjištění. Clearance bezsolutové vody nekorelovala s glomerulární filtrací, hodinovou diurézou ani ventilačními či kardiálními indexy, ale mohla být jimi ovlivněna s proměnlivou spolehlivostí. Frakční exkrece sodíku nekorelovala s žádným ze sledovaných parametrů a také nemohla být žádným z nich ovlivněna. Clearance bezsolutové vody a frakční exkrece sodíku byly ukazatele působení aldosteronu, nikoliv funkce ledvin. Glomerulární filtrace a hodinová diuréza nekorelovaly s hodnotou středního arteriálního tlaku, ale mohly jí být ovlivněny s hraniční až vysokou spolehlivostí. Výsledky studie prokázaly, že glomerulární filtrace i hodinová diuréza byly významně ovlivněny výkonem levé srdeční komory, respektive srdečním výdejem, a nikoliv hodnotou středního arteriálního tlaku.
Změny vylučování sodíku a argumentaci neurohumorální regulace by ve studii podpořilo přímé stanovení hladin příslušných peptidů a hormonů v séru zvířat. Z technických důvodů nebylo možné u selat použít metodiku RIA analýzy séra. Ve studii jsme využili možnosti komplexní alogenní imunoanalýzy s vědomím, že informace o podílu hormonů na rozvoji interakce budou nepřímé. Výpovědní hodnota studie mohla být částečně limitována rozptylem dat renálních indexů (Anderson-Darling; p ≥ 0,05), způsobeným postanalytickými matematickými kalkulacemi z laboratorních hodnot. Indexovaná data potřebám studie vyhovovala s dobrou shodu (Bland-Altman, p < 0,01), protože koncept vycházel z hodnocení změn, nikoliv z absolutních čísel.
V zahraniční literatuře jsou klinické i experimentální práce zabývající se umělou ventilací poškozených plic a reakcemi mimoplicních orgánů. Výsledky naší práce se s nimi v zásadních závěrech shodují. Recentní klinická práce dokumentuje protektivní vliv spontánního dýchání s tlakovou podporou u pacientů s akutním plicním postižením na funkci ledvin [12]. Soubor pacientů s akutní dekompenzací chronického srdečního městnání a umělou ventilací plic byl podkladem pro závěr, že selhání ledvin souvisí s kardiorenální interakcí [13]. Kuiper et al. analyzovali studie zabývající se akutním selhání ledvin v průběhu umělé plicní ventilace a tuto formu selhání ledvin hodnotili jako významnou komorbiditu s vysokou četností výskytu, multifaktoriální etiologií a potřebou optimální intervenční strategie léčby [14]. Model kombinující aspirační poškození plic a poškozující strategii umělé ventilace byl použit u psů k laboratornímu průkazu dysfunkce ledvin se závěrem, že morfologická vyšetření tkání plic a ledvin neprokázala strukturální změny [15]. Studie na myším modelu korozivního poškození plic a dvou odlišných strategií ventilace laboratorně doložila rozvoj systémového zánětu v obou skupinách ventilovaných a histochemicky potvrdila zvýšenou koncentraci mediátorů zánětu v plicích, játrech a ledvinách ve skupině s konvenční strategií, ve skupině ventilované protektivně bez účasti ledvin [16]. Dhanireddy et al. na modelu experimentální pneumonie a umělé plicní ventilace prokázali, že umělá ventilace potencuje zánětlivou reakci, která je příčinou sekundární dysfunkce plic, jater a ledvin [17]. Naše studie prokázala systémovou zánětlivou reakci, ale neprokázala poruchu funkce jater. V domácím i zahraničním písemnictví není mnoho prací, které by použily model umělé ventilace nepoškozených plic. Kobr et al. na modelu umělé ventilace s hyperinflací doložili adverzní efekt, snížení výkonu pravé srdeční komory, nepříznivé změny plicní hemodynamiky, aktivaci endotelu plicního řečiště s extravazální migrací granulocytů a uvolněním mediátorů zánětlivé reakce z alveolárních makrofágů [18]. Naše pokračující studie navázala na výsledky této práce a pokračovala studiem reakcí mimoplicních orgánů na umělou ventilaci nepoškozených plic.
Závěr
Na základě rozboru výsledků studie autoři vyvodili následující závěry:
- Umělá ventilace nepoškozených plic trvalým pozitivním tlakem aktivuje časnou zánětlivou reakci.
- Efektivita neurohumorální regulace a stabilizace funkcí mimoplicních orgánů jsou v průběhu umělé plicní ventilace časově limitované.
- V průběhu 12 hodiny umělé plicní ventilace trvá vliv aldosteronu, klesá clearance bezsolutové vody i výkon obou srdečních komor.
- Clearance bezsolutové vody a frakcionovaná exkrece sodíku jsou ukazatele vlivu aldosteronu. Jejich hodnoty může funkce ledvin ovlivnit s malou spolehlivostí.
- V našem experimentu byly hodnoty glomerulární filtrace a hodinové diurézy závislé převážně na výkonu levé srdeční komory.
- Ventilace dechovým objemem 10 ml . kg-1 snižuje efekt léčebné metody a s dobou trvání má adverzní vliv na výkon levé komory i hodinovou diurézu.
V pediatrické klinické praxi má absolutní přednost strategie nižších dechových objemů a maximální zkrácení doby umělé plicní ventilace v zájmu snížení časné morbidity pacientů.
Studie byla podpořena Výzkumným záměrem LF UK v Plzni č. MSM0021620819-6096.
Došlo 14. 4. 2008.
Přijato 4. 12. 2008.
Adresa pro korespondenci:
Doc. MUDr. Jiří Kobr, Ph.D.
Dětská klinika JIRP FN
Alej Svobody 80
304 60 Plzeň
e-mail: kobr@fnplzen.cz
Zdroje
1. Jackson, P. G., Cockcroft, P. Analgesia, anesthesia, and surgical procedures in the pig; Diseases of the urogenital system and the mammary gland. In Jackson, P. G., Cockcroft, P. Handbook of Pig Medicine. Saunders Elsevier, 2007.
2. Levin, D. L., Moya, F. A. Congenital diaphragmatic hernia. In Levin, D. L. et al. Essentials of Pediatric Intensive Care. 2nd Edd. Churchill Livingstone: New York, 1997, 104 p.
3. Tei, Ch., Seward, J. B., Tajik, A. J., Minagoe, S., Toyama, Y. Index of Myocardial Performance: A Simple and Reproducible Measurement of „Global“ Right Ventricular Myocardial Function. Circulation, 1995, 92, 8, p. 2832–2833 (Supplement I 2834).
4. Quigley, R., Alexander, S. R. Acute renal failure. In Levin D. L. et al.: Essentials of Pediatric Intensive Care. 2nd Edd. Churchill Livingstone: New York, 1997, p. 509–523.
5. Blendea, M. C., Jacobs, D., Stump, C. S., McFarlane, S. I., Ogrin, C., Bahtyiar, G., Stas, S., Kumar, P., Sha, Q., Ferrario, C. M., Sowers, J. R. Abrogation of oxidative stress improves insulin sensitivity in the Ren-2 rat model of tissue angiotensin II over expression. Am. J. Physiol. Endocrinol. Metab., 2005, 288, 2, p. 353–359.
6. Flori, H. R., Ware, L. B., Glidden, D., Matthay, M. A. Early elevation of plasma soluble inter cellular adhesion molecule-1 in pediatric acute lung injury identifies patients at increased risk of death and prolonged mechanical ventilation. Pediatr. Crit. Care Med., 2003, 4, 3, p. 315–321.
7. Hiro, Y., Yoshimoto, T., Suzuki, N., Sugiyama, T., Sakurada, M., Takai, S., Kobayashi, N., Shichiri, M., Hirata, Y. Angiotensin II receptor type 1-mediated vascular oxidative stress and pro-inflammatory gene expression in aldosterone-induced hypertension: the possible role of local rennin-angiotensin system. Endocrynology, 2007, 148, 4, p. 1688–1696.
8. Haeflinger, J. A., Nicod, P., Meda, P. Contribution of connexins to the function of the vascular wall. Cardiovasc. Res., 2004, 62, 2, p. 345–356.
9. Wölfle, S. E., Schmidt, V. J., Hoepfl, B., Gebert, A., Alcoléa, S., Gros, D., de Wit, C. Connexin 45 cannot replace the function of connexiny 40 in conducting endothelium-dependent dilations along arterioles. Circ. Res., 2007, 101, 12, p. 1292–1299.
10. Schmidt, V. J., Wölfle, S. E., Boettcher, M., de Wit, C. Gap junctions synchronize vascular tone within the microcirculation. Pharmacol. Rep., 2008, 60, 1, p. 68–74.
11. Hoste, E. A. J., Kellum, J. A. Acute kidney injury: epidemiology and diagnostic criteria. Curr. Opin. Crit. Care, 2006, 12, p. 531–537.
12. Morgan, B. J. Vascular consequences of intermittent hypoxia. Adv. Exp. Med. Biol., 2007, 618, p. 69–84.
13. Hering, R., Peters, D., Zinserling, J., Wrigge, H., von Spiel, T., Putensen, C. Effects of spontaneous breathing during airway pressure release ventilation on renal perfusion and function in patients with acute lung injury. Intensive Care Med, 2002, 28, 10, p. 1426–1433.
14. Liang, K. V., Williams, A. W., Greene, E. L., Redfield, M. M. Acute decompensate heart failure and the cardio renal syndrome. Crit. Care Med., 2008, 36, 1 Suppl., p. S75–88.
15. Kuiper, J. W., Groeneveld, A. B., Slutsky, A. S., Plötz, F. B. Mechanical ventilation and acute renal failure. Crit. Care Med., 2005, 33, 6, p. 1408–1415.
16. Hoang, J. B., Liu, M., Easley, R. B., Britos-Bray, M. F., Kesari, P., Hassoun, H., Haas, M., Tuder, R. M., Rabb, H., Simon, B. A. Effects of acid aspiration-induced acute lung injury on kidney function. Am. J. Physiol. Renal Physiol., 2008, Feb 6 (Epub adhead of print).
17. Gurkan, O. U., O´Donnell, C., Brower, R., Ruckdeschel, E., Becner, P. M. Differential effects of mechanical ventilatory strategy on lung injury and systemic organ inflammation in mice. Am. J. Physiol. Lung Cell Mol. Physiol., 2003, 285, 3, p. L710–718.
18. Dhanireddy, S., Altemeier, W. A., Matute-Bello, G., O´Mahony, D. S., Glenny, R. W., Martin, T. R., Liles, W. C. Mechanical ventilation induces inflammation, lung injury, and extra-pulmonary organ dysfunction in experimental pneumonia. Lab. Invest., 2006, 86, 8, p. 790–799.
19. Kobr, J., Kuntscher, V., Třeška, V., Moláček, J., Vobruba, V., Fremuth, J., Racek, J., Trefil, L., Kočová, J. Adverse effects of the high tidal volume during mechanical ventilation of the healthy lung. An experimental study in pigs. Bratisl. Med. J., 2008, 109, 2, p. 45–51.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Zprávy ČSARIMČlánek Gratulatio
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2009 Číslo 2- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Evaluation of changes in brain tissue oxygen levels (PbtO2) for detection of vasospasm in patients after subarachnoid haemorrhage
- Fatální komplikace tracheostomie u třináctiletého pacienta s Duchenneovou svalovou dystrofií – kazuistika
- Doc. MUDr. Josef Hoder, CSc., ve vzpomínkách kolegů a přátel
- Doc. MUDr. Josef HODER, CSc. (1912–1987)
- Zprávy ČSARIM
- Gratulatio
- Doporučené postupy – stanovisko k inhalačnímu úvodu do anestezie u dětí
- Zápis z jednání výboru č. 1/2009
- Dopis členům České společnosti intenzivní medicíny – bilance volebního období 2007–2009
- Dvacáté první století – století bezkrevní medicíny?
- Anafylaxe po úvodu do celkové anestezie – čtyři kazuistiky
- Syndrom arteria spinalis anterior jako komplikace neuroaxiální blokády – úspěšná léčba pomocí prostacyklinu
- Erytropoetin a jiné léky stimulující erytropoezu na pozadí bezkrevní medicíny – nová éra v léčbě anémie?
- Vliv ventilace trvalým pozitivním tlakem na stupeň zánětlivé reakce a funkce orgánů – experimentální studie
- Hypocholesterolémie u interních pacientů na jednotce intenzivní péče – porušená syntéza i absorpce cholesterolu v akutním stadiu nemoci
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Anafylaxe po úvodu do celkové anestezie – čtyři kazuistiky
- Erytropoetin a jiné léky stimulující erytropoezu na pozadí bezkrevní medicíny – nová éra v léčbě anémie?
- Syndrom arteria spinalis anterior jako komplikace neuroaxiální blokády – úspěšná léčba pomocí prostacyklinu
- Fatální komplikace tracheostomie u třináctiletého pacienta s Duchenneovou svalovou dystrofií – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



