-
Medical journals
- Career
Léčba non-neurogenního hyperaktivního močového měchýře – přehled guidelines Americké urologické asociace a Society of Urodynamics, Female Pelvic Medicine & Urogenital Reconstruction
Authors: Z. Ficko; E. A. Gormley
Authors‘ workplace: USA ; Dartmouth Hitchcock Medical Center ; Lebanon, New Hampshire ; Urology Section
Published in: Urol List 2015; 13(3): 6-13
Overview
Tento dokument uvádí přehled terapeutických možností pro léčbu nonneurogenního hyperaktivního močového měchýře na základě aktualizovaných guidelines Americké urologické asociace a Society of Urodynamics, Female Pelvic Medicine & Urogenital Reconstruction z roku 2014. Guidelines vycházejí z celkem 223 článků v anglickém jazyce, které byly uveřejněny v letech 1966–2014 a zabývají se správným pořadím, ve kterém jednotlivé terapie indikovat. Léčba první volby spočívá v behaviorální terapii, v rámci léčby druhé volby se podávají antimuskarinika a agonisté β3-adrenergních receptorů, léčba třetí volby zahrnuje injekční aplikaci onabotulotoxinu A, stimulaci periferního tibiálního nervu a sakrální neuromodulaci. Zavedení katetru, augmentační cystoplastika a derivace moči jsou modality poslední instance vyhrazené pouze pro dobře vybrané pacienty.
Klíčová slova:
hyperaktivní močový měchýř močová inkontinence močová urgence močová frekvence nykturieÚvod
Mezinárodní společnost pro kontinenci (International Continence Society – ICS) definuje hyperaktivní močový měchýř (overactive bladder – OAB) jako „močovou urgenci, obvykle v kombinaci s frekvencí a nykturií, s urgentní močovou inkontinencí (UUI), nebo bez ní, při současné absenci infekce močových cest (urinary tract infection – UTI) nebo jiné zřejmé patologie“ [1]. Prevalence onemocnění se pohybuje v rozmezí 9–43 % u žen a 7–27 % u mužů. Spolu s přibývajícím věkem se prevalence onemocnění zvyšuje a zhoršuje se i jeho závažnost. U třetiny pacientů (37–39 %) se symptomy během roku zmírní, u většiny pacientů však přetrvávají po celé roky [2].
ICS definuje urgenci jako „náhlou a naléhavou potřebu močit, kterou je obtížné oddálit“ [1]. Urgence představuje charakteristický znak OAB, vzhledem k tomu, že tento parametr je však obtížné jakkoli kvantifikovat, obvykle se neužívá pro výzkumné ani klinické účely. Naopak močovou frekvenci lze spolehlivě měřit s pomocí mikčního diáře. Až sedm močení během dne (v bdělém stavu) se považuje za normální [3], tento údaj však může být velmi proměnlivý v závislosti na délce spánku, příjmu tekutin, medikaci (např. diuretika) a dalších komorbiditách.
S ohledem na léčbu OAB se objevuje stále větší množství údajů. Na základě dalších vědeckých publikací budou guidelines průběžně aktualizována.
Metody
Primárním zdrojem jsou guidelines pro léčbu OAB Americké urologické asociace (AUA)/Society of Urodynamics, Female Pelvic Medicine & Urogenital Reconstruction (SUFU) z roku 2012 [2] a aktualizace tohoto dokumentu z roku 2014 [4]. Tvorba guidelines je velmi pečlivý proces, který zaštiťuje AUA. Na tvorbě OAB guidelines se podílela rovněž společnost SUFU. Členové panelu jsou současně členy AUA a/nebo SUFU a zastupují nejrůznější typy lékařské praxe a pocházejí z různých geografických lokalit. Vzhledem k tomu, že cílem guidelines je oslovit všechny lékaře, kteří se setkávají s OAB, byli v panelu zastoupeni i lékaři z jiných než z urologických oborů. Autoři hodnotili celkem 151 článků v anglickém jazyce, které byly publikovány od ledna 1966 do prosince 2011, a v rámci aktualizace dokumentu bylo přidáno dalších 72 článků za období 2011 až únor 2014. Důkazy byly hodnoceny na základě významnosti: A (vysoká), B (střední) nebo C (nízká). V případě absence dostatečných důkazů byly závěry guidelines označeny jako „principy z klinické praxe“ nebo „názor odborníků“.
Nomenklatura Americké urologické asociace (tab. 1)
Diagnostika
Table 1. Nomenklatura AUA . Korelace jednotlivých pokynů s úrovní důkazů/jistoty. 
Dostupné publikace týkající se diagnostiky OAB neumožnily aplikovat přístup založený na důkazech. Z tohoto důvodu jsou závěry v této sekci klasifikovány jako „principy z klinické praxe“ nebo „názor odborníků“.
Klinický lékař by měl zaznamenat známky a symptomy, které jsou charakteristické pro OAB a vylučují přítomnost jiných poruch, mezi minimální požadavky patří pečlivá anamnéza, fyzikální vyšetření a rozbor moči. U některých pacientů mohou být nutná i další opatření, jako např. kultivace moči, měření postmikčního rezidua, užívání mikčního diáře a/nebo symptom skóre. Urodynamické vyšetření, cystoskopie a ultrazvukové vyšetření ledvin a močového měchýře se v rámci úvodního vyšetření nekomplikovaného pacienta nedoporučuje (principy z klinické praxe).
Dále je třeba odlišit samotnou nykturii od nykturie související s OAB. ICS definuje nykturii jako „jedno nebo více močení, které přeruší spánek z důvodu potřeby močit“ [1]. Pokud nykturii během dne neprovází frekvence nebo urgence, pravděpodobně nebude souviset s OAB. Noční polyurie (tvorba 20–33 % celkového 24hod výdeje moči během spánku), malá kapacita močového měchýře během noci a poruchy spánku vč. spánkové apnoe mohou způsobovat nykturii, a je tedy nutné je vyloučit.
OAB mohou připomínat i další poruchy jako např. polydipsie. Tyto dvě poruchy můžeme rozlišit pouze pomocí pitné//mikční karty. Polydipsie způsobuje časté močení s normálním nebo velkým mikčním objemem jako adekvátní odpověď na nadměrný příjem tekutin. Další příčinou velkého mikčního objemu může být rovněž diabetes insipidus.
Další poruchou, kterou je nutné odlišit od OAB, je intersticiální cystitida nebo syndrom bolestivého močového měchýře (bladder pain syndrome). Pacienti s intersticiální cystitidou mohou pozorovat frekvenci a urgenci a často také inkontinenci. OAB se však neprojevuje bolestí v oblasti pánve, močového měchýře ani dyspareunií.
Léčba
Členové panelu hodnotili terapeutické možnosti a zvážili potenciální benefity a rizika, invazivní povahu léčby, její trvanlivost a reverzibilitu a závažnost potenciálních nežádoucích účinků. Terapeutický postup byl stanoven na základě zohlednění výše uvedených kritérií, nikoli podle počtu studií hodnocených pro konkrétní léčebnou modalitu. Kupříkladu behaviorální léčba první volby nepředstavuje prakticky žádné riziko a lze ji nabízet všem pacientům, zatímco augmentace močového měchýře spojená s riziky rozsáhlé operace se považuje za možnost poslední instance a je nezvratná.
OAB není onemocnění, jedná se o soubor symptomů, které obvykle neohrožují život pacienta. Poté, co lékař vyloučí přítomnost onemocnění vyžadujících léčbu, a v případě, že pacient nevyžaduje žádné poradenství, představuje žádná léčba pro řadu pacientů přijatelnou alternativu (názor odborníků).
Pro zahájení léčby je nezbytné, aby byl pacient schopen vnímat zlepšení symptomů. Např. pacient s narušenými kognitivními funkcemi nemusí rozpoznat své symptomy a jeho inkontinence v tomto případě obtěžuje spíše jeho pečovatele. V podobné situaci může být vhodnější využití technik časované mikce a/nebo použití plen, protože medikamentózní léčba může být nebezpečná a/nebo dokonce zbytečná. Před zahájením léčby by měl klinický lékař spolu s pacientem a/nebo jeho pečovatelem stanovit realistické cíle. Žádná léčba představuje vhodnou alternativu v případě, že rizika související s léčbou převáží její benefity, a lékař by měl pacienta/pečovatele podpořit, pokud se rozhodne nepodstoupit žádnou léčbu.
Lékař by měl pacienta poučit o normální funkci dolních cest močových, poskytnout mu dostupné informace o OAB, benefitech a rizicích souvisejících s léčbou a rovněž jej upozornit na skutečnost, že pro zabezpečení přijatelné kontroly symptomů může být nutná indikace několika terapeutických možností (princip z klinické praxe).
Poradenství umožní pacientovi porozumět tomu, co je normální, a může tak pomoci stanovit cíl léčby. Pacient musí souhlasit se zahájením léčby a musí porozumět tomu, že léčba může vést ke zlepšení pouze některých symptomů. Dále je nutné pacienta informovat o tom, že léčba bude dlouhodobá, bude spojena s výskytem nežádoucích účinků a že v současné době neexistuje jediná „nejlepší“ terapeutická modalita. Před dosažením kontroly nad symptomy s přijatelným profilem nežádoucích účinků je často vyzkoušeno několik terapeutických přístupů.
Aby bylo možné posoudit, zda je terapie účinná a pacienty dobře snášená, musí pacient dodržovat každý terapeutický režim po přiměřeně dlouhou dobu. V případě kombinované léčby je nutné postupovat metodicky a novou modalitu zařadit pouze v případě, že je známa relativní účinnost předchozí terapie. V případě, že se po dostatečně dlouhém zkušebním intervalu neprokáže účinek, doporučuje se konkrétní terapeutický přístup ukončit (názor odborníků).
U farmakoterapie se doporučuje setrvat po dobu 4–8 týdnů, u behaviorální terapie po dobu 8–12 týdnů. Lékař by měl pacientovi navrhnout kontrolní vyšetření, při kterém zhodnotí dodržování léčebného režimu, jeho účinnost, výskyt vedlejších účinků a případně doporučí změnu terapie (názor odborníků).
Záznam mikčního režimu pomocí mikčního diáře nebo validovaného dotazníku může pomoci při monitorování efektu léčby.
Léčba první volby – behaviorální terapie
Behaviorální terapie by měla být nabídnuta všem pacientům s OAB v rámci léčby první volby (standard, úroveň důkazu B). V rámci redukce symptomů dosahuje behaviorální terapie srovnatelného účinku jako léčba antimuskariniky.
Behaviorální terapie může zahrnovat nejrůznější strategie, jako je úprava pitného režimu s omezením tekutin, omezení látek, které dráždí močový měchýř (např. kofein), redukce váhy, trénink močového měchýře (pravidelné nebo oddálené močení), posilování svaloviny pánevního dna (s biofeedbackem nebo bez něj), elektrická stimulace a techniky pro potlačení urgence spočívající v rozptýlení pacienta. Všechny zmiňované techniky vyžadují aktivní zapojení pacienta nebo jeho pečovatele.
Ačkoli u většiny pacientů nedojde k úplnému vymizení symptomů, většina z nich pozoruje redukci příznaků a zlepšení kvality života (QoL). Vědecké studie podporují techniky pravidelného močení s rozptýlením a sebeujištěním, že tyto techniky jsou možné a účinné [5,6], a posilování svaloviny pánevního dna s potlačováním urgence [7].
Při užívání těchto technik se uvádí snížení četnosti příhod inkontinence o 50–80 % a redukce frekvence močení u mužů [8] i žen [5,9,10]. Jedna ze studií uvádí, že redukce váhy u obézních pacientek o 8 % vedla ke snížení počtu příhod inkontinence o 47 % týdně a snížení počtu příhod urgentní inkontinence o 42 % [11]. S ohledem na úpravu pitného režimu vedla redukce příjmu tekutin o 25 % k poklesu frekvence i urgence [12] a omezení příjmu kofeinu k větší redukci frekvence [13].
Žádná z behaviorálních strategií nemá pravděpodobně zásadnější vliv na dosažení účinku než ostatní. Při tréninku močového měchýře s biofeedbackem, verbální zpětnou vazbou nebo i v případě, že jej pacient provádí sám pouze s pomocí informační brožury, byly zaznamenány stejné objektivní výsledky (redukce inkontinence a zvětšení kapacity močového měchýře) [14]. Při užití zpětné vazby však pacienti uváděli lepší subjektivní výsledky. Rovněž při posilování svaloviny pánevního dna byly zaznamenány lepší výsledky (inkontinence, síla stahů svaloviny pánevního dna a QoL) v kombinaci s feedbackem [15].
Behaviorální techniky lze kombinovat s medikamentózní léčbou (doporučení, úroveň důkazu C).
Zahájení medikamentózní léčby v případě, že se prokáže, že je behaviorální terapie neúčinná, nebo zahájení obou terapií současně může podpořit výsledek léčby. To je důležité zejména u pacientů se správným mikčním i pitným režimem. U těchto pacientů jsou medikamentózní a behaviorální léčba zahájeny současně.
Léčba druhé volby – farmakoterapie
V rámci léčby druhé volby by měl lékař pacientovi nabídnout léčbu pomocí antimuskarinik nebo perorální aplikaci agonistů β3-adrenergního receptoru (standard, úroveň důkazu B).
Antimuskarinika
Nežádoucí účinky léčby pomocí antimuskarinik zahrnují pocit suchosti v ústech, zácpu, vysychání spojivkového vaku nebo pálení očí, rozmazané vidění, dyspepsii, UTI, močovou retenci, narušení kognitivních funkcí a ve vzácných případech život ohrožující arytmii. Vzhledem k tomu, že podrobný přehled publikací nepřinesl žádné přesvědčivé důkazy o rozdílech v účinnosti jednotlivých preparátů, je seznam antimuskarinik v guidelines uveden v abecedním pořadí bez jakékoli hierarchie [4].
Obecně platí, že u pacientů se závažnějšími symptomy dojde k výraznější redukci symptomů. V doménách urgentní inkontinence a úplné inkontinence byla úplná úleva symptomů zaznamenána pouze u pacientů, kteří měli na počátku pouze velmi mírné symptomy. V doménách urgence a nykturie však nebyla prokázána žádná zřejmá souvislost mezi stupněm závažnosti počátečních symptomů a jejich redukcí.
Vzhledem ke srovnatelné účinnosti všech perorálních antimuskarinik závisí volba konkrétní medikace na samotném pacientovi a jeho lékaři. Studie však odhalily odlišný profil nežádoucích účinků s ohledem na výskyt suchosti v ústech a zácpy. Většina publikací srovnává preparáty oxybutynin a tolterodin. Při léčbě oxybutyninem byla zaznamenána statisticky významně vyšší míra výskytu suchosti v ústech 61,4 % (95% CI: 52,5–69,5 %) než při léčbě tolterodinem 23,7 % (95% CI: 20,7–26,9 %; p < 0,001). Studie rovněž srovnávaly antimuskarinika s různou formou uvolňování léčiva. Míra výskytu suchosti v ústech při podávání oxybutyninu s prodlouženým uvolňováním (extended release – ER) 40,0 % (95% CI: 28,0–53,0 %) byla statisticky významně nižší než při podávání forem s okamžitým uvolňováním (immediate release – IR) 69,0 % (95% CI: 60,6–76,5 %). Míra výskytu suchosti v ústech při podávání tolterodinu s ER 18,0 % (95% CI: 14,8–21,4 %) byla statisticky významně nižší (p < 0,001) než při aplikaci formy s IR 28,8 % (95% CI: 25,1–32,8 %). Podobný vzorec byl zaznamenán i při aplikaci trospia [2]. Na základě těchto výsledků vytvořili členové panelu následující doporučení: Pokud je preparát k dispozici ve formě s IR i s ER, měl by být vzhledem k menšímu výskytu suchosti v ústech upřednostněn lék v ER formě (standard, úroveň důkazu B).
Míra výskytu zácpy je statisticky významně vyšší při léčbě oxybutyninem 12,1 % (95% CI: 7,9–18,0 %; p < 0,001) než při léčbě tolterodinem 4,9 % (95% CI: 4,1–5,7 %) [2].
Před tím, než lékař vysadí jinak účinnou léčbu antimuskariniky, by se měl pokusit vyřešit pacientovy potíže v podobě zácpy a suchosti v ústech. Možné strategie zahrnují úpravu střevní peristaltiky, úpravu pitného režimu, modifikaci dávkování nebo případně výměnu antimuskarinika (principy z klinické praxe).
Pacientům, kteří pozorují úlevu symptomů, ale obtěžuje je sucho v ústech, lze nabídnout transdermální (TDS) aplikaci oxybutyninu – v podobě náplasti nebo gelu (doporučení, úroveň důkazu C).
TDS aplikace oxybutyninu (v podobě náplasti nebo gelu) přináší účinek rovněž s ohledem na redukci počtu epizod inkontinence. Uvádějí se následující nežádoucí účinky: erytém a pruritus (38 vs. 27 % u placeba) [16]. U některých pacientů dojde při TDS léčbě antimuskariniky rovněž ke vzniku systémových nežádoucích účinků, výskyt suchosti v ústech se však zdá být méně častý než údaje uváděné v metaanalýzách: 40,0 % při perorální aplikaci oxybutyninu s ER a 68,0 % při perorální aplikaci oxybutyninu s IR.
Antimuskarinika by neměla být indikována u pacientů s glaukomem s uzavřeným úhlem, pokud léčbu neschválí ošetřující oftalmolog. U pacientů s poruchou vyprazdňování žaludku nebo anamnézou močové retence by měla být antimuskarinika podávána s nejvyšší opatrností (principy z klinické praxe).
Antimuskarinika jsou kontraindikována rovněž u pacientů, kteří užívají perorálně chlorid draselný v tabletách, protože zhoršené vyprazdňování žaludku v důsledku léčby antimuskariniky by mohlo zvyšovat absorpci draslíku.
Zvýšené opatrnosti je třeba dbát při preskripci antimuskarinik u pacientů, kteří užívají jiné léky vykazující anticholinergní účinky (názor odborníků).
Preparáty s anticholinergními účinky mohou zhoršovat nežádoucí účinky antimuskarinové terapie. Mezi nejčastější anticholinergika patří tricyklická antidepresiva, léky pro léčbu Parkinsonovy a Alzheimerovy choroby, léky pro léčbu nevolnosti a preparáty na bázi atropinu.
Agonisté β3-adrenergních receptorů – mirabegron
Studie ukazují, že mirabegron ve srovnání s placebem statisticky významně snižuje počet močení a epizod inkontinence za den. Bylo zaznamenáno zlepšení UUI, snížení počtu epizod urgence a zlepšení QoL pacienta, ale tento efekt nebyl trvale statisticky signifikantní. Studie srovnávající mirabegron a tolterodin uvádějí podobné výsledky a srovnatelný profil nežádoucích účinků s výjimkou pocitu suchosti v ústech, jejíž výskyt byl méně častý u mirabegronu (tab. 2) [17].
Table 2. Vybrané nežádoucí účinky ze studií fáze III . 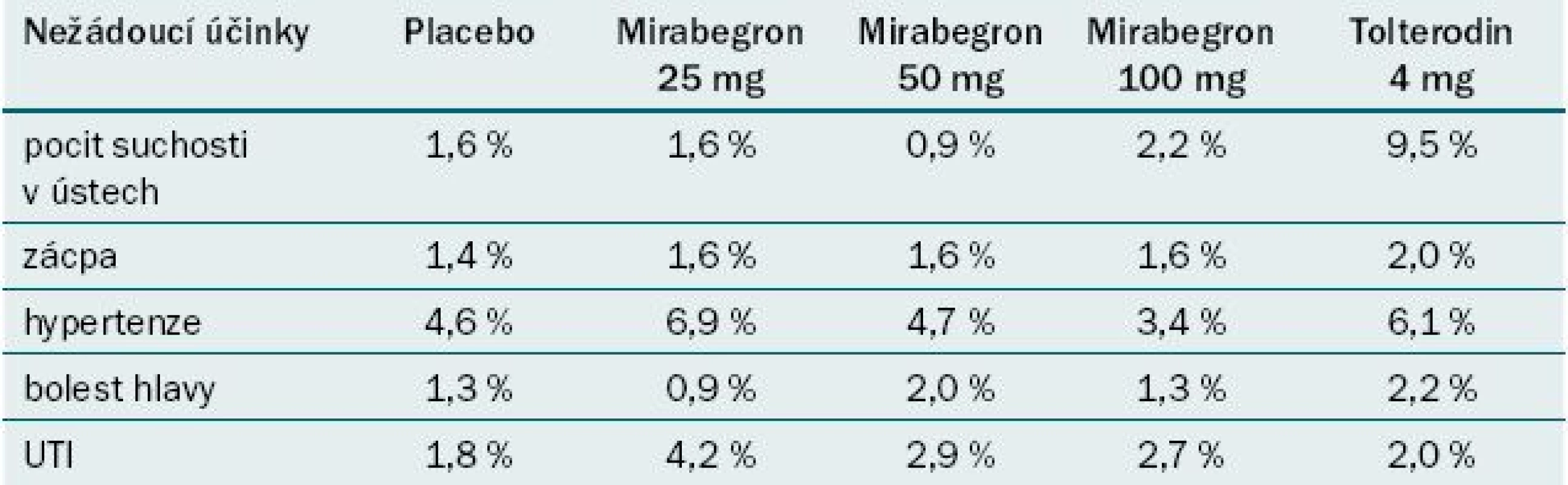
UTI – infekce močových cest Převzato z [17]. Celkově se efekt mirabegronu jeví jako srovnatelný s antimuskariniky. Aplikace mirabegronu je však spojena s méně častým výskytem suchosti v ústech a nižší mírou výskytu zácpy než při užívání některých antimuskarinik.
Pokud pacient nepozoruje dostatečnou úlevu symptomů nebo dojde k výskytu nepřijatelných nežádoucích účinků, může lékař upravit dávku léčiva, vyzkoušet jiné antimuskarinikum nebo agonistu β3-adrenergního receptoru (principy z klinické praxe).
V dostupné literatuře nejsou k dispozici žádné údaje hodnotící kombinaci různých antimuskarinik, antimuskarinik s agonisty β3-adrenergního receptoru, ani antimuskarinik s jinými skupinami medikamentů, jako jsou např. tricyklické preparáty.
U „frail“ pacientů s OAB je třeba při preskripci antimuskarinik a agonistů β3-adrenergního receptoru rovněž dbát zvýšené opatrnosti (principy z klinické praxe).
U „frail“ pacientů (pacientů s narušenou mobilitou, úbytkem váhy, slabostí bez prokazatelné příčiny nebo s poruchou kognitivních funkcí) byl zaznamenán výskyt horších nežádoucích účinků a horší terapeutický efekt. Pro tuto skupinu pacientů nemáme k dispozici dostatek údajů, protože studie testující medikaci pro léčbu OAB obvykle nezahrnují tento typ populace. Léčba by tedy měla být zahájena na nejnižší možné dávce a pacient musí být pečlivě monitorován. V reakci na antimuskarinika byly zaznamenány případy kognitivních poruch, zejména problémů s pamětí [18], a starší pacienti mohou být obzvláště náchylní k těmto nežádoucím účinkům. Podle některých informací existuje u některých novějších preparátů (např. darifenacin) menší pravděpodobnost, že dojde ke vzniku kognitivní poruchy u starších pacientů, v literatuře však existuje minimum údajů a délka studií nepřesahuje dva týdny [19,20]. Ačkoli studie testující mirabegron neuvádějí výskyt kognitivních poruch, tyto studie nezahrnují populace „frail“ pacientů.
Pacienti, kteří neodpovídají na behaviorální ani farmakologickou léčbu, by měli být odesláni ke specialistovi, který posoudí, zda je nezbytná další doplňující léčba (názor odborníka).
Léčba třetí volby – onabotulotoxin A, PNTS nebo neuromodulace
Tyto tři terapeutické modality lze pacientovi nabízet v libovolném pořadí. Pokud u pacienta selže jeden z přístupů třetí volby, lze vyzkoušet zbývající dva. Dosud nebyly publikovány žádné informace o kombinovaném využití těchto modalit.
Onabotulotoxin A
Dobře vybraným a patřičně informovaným pacientům, u nichž selhala léčba první i druhé volby, lze nabídnout injekční aplikaci onabotulotoxinu A (americký Úřad pro kontrolu potravin a léčiv schválil dávkování 100 U) do detruzoru. Pacient musí být schopen a ochoten podstupovat opakované měření postmikčního rezidua a v případě potřeby si sám zavádět katetr (standard, úroveň důkazu B).
Je třeba zmínit, že nemáme k dispozici dostatek důkazů pro podporu nejvhodnějšího místa aplikace intravezikální injekce – do trigona, nebo naopak trigonum ušetřit. V současnosti lze injekci aplikovat do jakékoli části detruzoru.
Většina studií uvádí statisticky signifikantní zlepšení hodnocených mikčních parametrů (UUI, frekvence, urgence, nykturie, užívání vložek) a zlepšení QoL oproti placebu. V nedávné době publikovaném systematickém přehledu, který srovnává onabotulotoxin A s placebem, činil rozdíl v počtu epizod inkontinence –3,85 (95% CI: –4,79 až –2,90) a rozdíl v počtu epizod frekvence –5,13 (95% CI: –7,86 až –2,39) [21]. Studie z roku 2010, která srovnává účinek onabotulotoxinu A v různém dávkování (50–300 U), uvádí, že dávka ≥ 100 U způsobuje dostatečnou redukci příhod inkontinence a zlepšuje QoL pacienta, ovšem bez jasně prokázané závislosti účinku na velikosti dávky, protože aplikace dávky > 150 U nepřispívá k dalšímu klinicky relevantnímu zlepšení symptomů [22].
V jedné ze studií uvádělo 93 % pacientů tři měsíce po injekční aplikaci 100 U onabotulotoxinu A vynikající výsledek nebo mírné zlepšení symptomů [23]. Déletrvající studie uvádějí po určité době postupné snižování efektu. Pro obnovení účinku bylo nezbytné injekční léčbu opakovat.
Nejčastější nežádoucí účinky léčby pomocí onabotulotoxinu A jsou UTI a močová retence. Míra výskytu UTI se pohybovala v rozmezí 3,6–54,5 %, čtyři randomizované kontrolované studie uvádějí > 40 % [22]. Močová retence se vyskytovala u 0–43 % pacientů. Katetr si muselo zavádět 0–43 % pacientů, šest studií uvádí > 20% míru selfkatetrizace [22,24–29]. U některých pacientů přetrval nárůst PVR a potřeba selfkatetrizace po dobu 6–9 měsíců [26]. Je však třeba zmínit, že při srovnávání QoL pacientek, které si musely/nemusely po léčbě pomocí onabotulotoxinu A zavádět katetr, nebyly shledány žádné rozdíly [28]. Další nežádoucí účinek, makroskopická hematurie, byl zaznamenán až u 10 % pacientů [22].
Účinek onabotulotoxinu A byl testován rovněž u speciálních populací pacientů. U diabetiků byl účinek srovnatelný jako u pacientů bez diabetu, u této populace pacientů však byl zaznamenán častější výskyt nežádoucích účinků (velký objem PVR u 60 vs. 33 % pacientů a celková slabost u 10 vs. 0 % pacientů) [30]. U „frail“ starších pacientů byla zaznamenána srovnatelná míra úspěšnosti léčby jako u starších pacientů v lepším zdravotním stavu a mladších pacientů, po 12 měsících však efekt u „frail“ pacientů dosahoval pouze 25 % účinku zjištěného u ostatních populací pacientů (6,8 vs. 22–23 %) [31]. U „frail“ starších pacientů byl rovněž naměřen větší postmikční reziduální objem moči a delší interval do obnovy spontánní mikce po močové retenci. „Frail“ starší pacienti rovněž častěji uváděli celkovou slabost (6,6 vs. 0 % u starších pacientů v lepším zdravotním stavu a mladších pacientů). Zajímavým zjištěním je fakt, že míra výskytu UTI byla vyšší u mladších pacientů (28,6 %) než u starších pacientů a „frail“ starších pacientů (9,5 a 13,1 %) [31].
Nejrůznější studie testují efekt opakované aplikace (2–10 injekcí v těchto studiích) injekční léčby a optimální interval mezi jednotlivými terapiemi [32–34]. Medián intervalu mezi jednotlivými injekcemi činil až 14,4 měsíce, po první injekci přetrval účinek déle než po každé další aplikaci (17,6 měsíce; 15,7, 15,4 a 11,6 měsíce) [33]. Jedním z potenciálních vysvětlení menšího účinku dalších injekcí může být vznik protilátek proti onabotulotoxinu A, ačkoli tyto byly detekovány pouze u 5 z 20 pacientů, kteří podstoupili 2–3 aplikace [35].
Stimulace periferního tibiálního nervu
U velmi pečlivě vybrané populace pacientů lze v rámci léčby třetí volby indikovat stimulaci periferního tibiálního nervu (PTNS) (doporučení, úroveň důkazu C).
Klinické studie prokázaly zlepšení inkontinence (typická redukce o 1–3 příhody/den), frekvence (redukce o 2–5 příhod/den), nykturie (redukce o 1–2 příhody/den) i QoL pacienta. Nejčastěji byl testován následující protokol: 30min interval stimulace jednou týdně, zlepšení přetrvalo pouze po dobu trvání léčby [36–38]. Studie testující délku trvání účinku léčby ukázaly, že po ukončení léčby efekt přetrval po dobu 4–6 měsíců [39]. Jiná studie testuje 12 terapeutických cyklů (v intervalu jednou týdně) s postupným snižováním intenzity léčby na jeden cyklus jednou za 28 dnů a konečně na stimulaci pouze v případě zhoršení symptomů OAB. Pacienti uváděli výrazné zlepšení ve všech doménách OAB (medián jeden cyklus léčby za měsíc) [40]. V jiné studii činil medián 8,42 léčebných cyklů za rok [41].
Výskyt nežádoucích účinků při PTNS není častý a vedlejší účinky mají obvykle mírnou povahu: bolest během stimulace (která nemá negativní vliv na výsledek léčby) a slabé krvácení v místě aplikace.
Při srovnání s léčbou antimuskariniky (tolterodin) vykazuje PTNS srovnatelné zlepšení, pacienti však uvádějí větší spokojenost s léčbou [42]. Při kombinaci PTNS s tolterodinem byl zaznamenán větší účinek než při podávání samotného tolterodinu [43]. Jiná studie srovnává aplikaci oxybutyninu, oxybutyninu v kombinaci s PTNS a samotnou PTNS po dobu 12 týdnů. Po 12 týdnech vykazovaly všechny skupiny srovnatelné výsledky, po 24 týdnech však pacienti léčení pouze pomocí oxybutyninu uváděli významně horší skóre QoL než pacienti ve zbývajících dvou skupinách [44]. Systematické přehledy a metaanalýzy uvádějí, že PTNS významně zlepšuje symptomy OAB, a ačkoli je rozsah účinku srovnatelný s léčbou antimuskariniky, PTNS je spojena s méně častým výskytem méně závažných vedlejších účinků [45,46]. Pro zabezpečení benefitu léčby musí být pacient schopen a ochoten podstupovat častá kontrolní vyšetření.
Sakrální neuromodulace
U velmi pečlivě vybrané populace pacientů se závažnými refrakterními symptomy OAB nebo pacientů, kteří nejsou vhodnými kandidáty pro léčbu druhé volby a jsou ochotni podstoupit operační léčbu, lze v rámci léčby třetí volby indikovat sakrální neuromodulaci (SNS) (doporučení, úroveň důkazu C).
SNS byla původně testována jako modalita pro léčbu pacientů se závažným refrakterním OAB. Studie prokázaly zlepšení všech hodnocených parametrů. Po ukončení léčby její efekt vymizí [4]. Co se týče nastavení, prokazuje jedna ze studií lepší účinek při užití frekvence 14 Hz a 25 Hz než 5,2 Hz [40].
V nedávné době provedená studie, která srovnává SNS s léčbou antimuskariniky, prokazuje lepší výsledky u pacientů léčených pomocí SNS (61 vs. 42% míra úspěšnosti; p = 0,02), vč. lepší sexuální funkce a menšího výskytu symptomů deprese [47]. Tato studie však zahrnovala pouze pacienty s méně závažnými symptomy OAB. Další limitací této studie je způsob, jakým pacienti v kontrolní skupině užívali antimuskarinika (někteří pacienti neužívali lék každý den, jiní užívali více než jeden preparát).
Při testování účinku SNS u populace starších pacientů (> 64 let) bylo prokázáno zlepšení rovněž u této populace (po jednom roce se u 55,5 % pacientů nevyskytovala žádná UUI a u 27,8 % pacientů došlo ke zlepšení symptomů) [48].
Studie zahrnující pacienty, kteří trpěli současně i fekální inkontinencí, prokázala redukci příhod močové i fekální inkontinence. Celkem 74 % pacientů uvádělo pět let po implantaci zařízení spokojenost s léčbou [49]. Další studie hodnotí účinnost SNS u pacientů, kteří přerušili léčbu pomocí onabotulotoxinu A (nedostatečný účinek u 85 % jedinců nebo potřeba trvalejšího řešení u 15 % jedinců). S léčbou pomocí SNS bylo spokojeno 79 % pacientů [50].
Ačkoli je SNS terapie účinná, bohužel je často provázena nežádoucími účinky. V jedné ze studií uvedlo 90 % pacientů spokojenost s léčbou, ovšem u 56 % z nich se vyskytly nežádoucí účinky [51]. Nežádoucí účinky léčby zahrnují bolest v místě implantace stimulátoru (3,3–19,8 % pacientů), bolest v místě elektrody (4,5–19,1 %), migraci elektrody (1,1–8,6 %), infekci/iritaci (2,2–14,3 %), elektrický šok (5,5–10,2 %) a operační revizi (6,25–39,5 %). Pacienti rovněž popisují potíže při procházení detektory kovu a nemohou podstoupit vyšetření magnetickou rezonancí. Existují důkazy, že modernější, méně invazivní operační přístupy a implantace menších zařízení mohou vést k redukci nežádoucích účinků [52]. V jedné ze studií byli pacienti instruováni k vypnutí zařízení po dobu několika hodin denně s cílem omezit adaptaci nervového systému a následný pokles účinnosti. U 63 % pacientů díky tomuto postupu zlepšení přetrvalo [53].
Pacienti, kteří zvažují tuto modalitu, musejí být motivování a ochotní nosit implantát a podstoupit opakovanou výměnu generátoru po vybití baterie.
Modality poslední instance – zavádění katetru, augmentační cystoplastika nebo derivace moči
Zavedení katetru
S výjimkou poslední instance u vybraných pacientů se zavedení katetru pro léčbu OAB vzhledem k poměru nežádoucích účinků ku benefitu léčby nedoporučuje (názor odborníků).
U některých pacientů není léčba první, druhé ani třetí volby možná nebo účinná nebo ji nejde doporučit (např. pacienti se závažnou poruchou kognitivních funkcí nebo problémy s mobilitou). Preferovaným řešením (před zavedením katetru) je užívání plen po co možná nejdelší dobu. Zavedený katetr může přinášet celou řadu rizik: vznik UTI, erozi močové trubice a vznik urolitiázy. Z tohoto důvodu se katetr doporučuje až jako poslední instance v případě, kdy inkontinence vede k poškození kožního krytu.
Chirurgické řešení
Ve výjimečných případech lze u pacientů se závažným, refrakterním OAB spojeným s komplikacemi přistoupit k chirurgickému řešení v podobě augmentační cystoplastiky nebo derivace moči (názor odborníků).
Dostupné publikace zabývající se augmentační cystoplatikou zahrnují obvykle pacienty s neurogenním OAB a nikoli non-neurogenním OAB. Tato operační léčba s sebou nese podstatné riziko, že pacient bude muset provádět čistou intermitentní katetrizaci, a rovněž dlouhodobé riziko vzniku maligního onemocnění. Po zavedení stimulace sakrálního nervu a aplikace onabotulotoxinu A do urologické praxe má augmentační cystoplatika omezenější využití. Indikace se omezuje na ojedinělé případy, kdy selžou všechny ostatní možnosti léčby.
Sledování
Lékař by měl pacientovi navrhnout kontrolní vyšetření, při kterém zhodnotí dodržování léčebného režimu, jeho účinnost, výskyt vedlejších účinků a případně doporučí změnu terapie (názor odborníků).
Při kontrolním vyšetření by měl lékař ověřit, zda byla splněna pacientova očekávání. Dále je třeba se pacienta dotázat na výskyt symptomů, nežádoucích účinků a zkonzultovat případnou změnu léčby. Pacienty užívající antimuskarinika je třeba podpořit, aby s léčbou vytrvali po dobu alespoň 4–8 týdnů [2]. V případě, že pacientovi hrozí riziko močové retence (při léčbě antimuskariniky, agonisty β3-adrenergních receptorů nebo onabotulotoxinem A), se doporučuje měření postmikčního rezidua. Pro udržení efektu PTNS je nutné léčbu opakovat. U pacientů léčených pomocí SNS může být nezbytné časem zařízení přeprogramovat. Rovněž léčba pomocí onabotulotoxinu A vyžaduje pro zajištění trvalé kontroly symptomů opakovanou aplikaci preparátu.
Závěr
Guidelines AUA nabízejí přehledný algoritmus pro diagnostiku a léčbu non-neurogenního OAB. Poté, co pacient vyzkouší behaviorální terapii, se doporučuje medikamentózní léčba antimuskariniky nebo agonisty β3-adrenergních receptorů. Vědecké studie neprokázaly, že by jedna skupina léčiv vykazovala větší účinnost než druhá. Farmakoterapii se tedy doporučuje zvolit na základě pacientovy reakce na předchozí medikaci a upravit na základě výskytu nežádoucích účinků. V případě, že selže behaviorální i medikamentózní léčba, může být pomocí doplňujících testů vhodné ověřit diagnózu OAB. Pacientům, kteří si přejí podstoupit další léčbu, se doporučuje následně nabídnout techniky PTNS, SNS nebo injekční podávání onabotulotoxinu A do detruzoru. Všichni pacienti by měli podstoupit kontrolní vyšetření pro hodnocení účinku léčby, nežádoucích účinků a případné změny léčby.
Poděkování
Chtěli bychom poděkovat autorům AUA//SUFU Guidelines pro léčbu hyperaktivního močového měchýře, z jejichž práce čerpá tento článek.
Zita Ficko, MD, MS
Urology Section
Dartmouth Hitchcock Medical Center
Lebanon, New Hampshire
USA
zita.ficko@hitchcock.org
Sources
1. Haylen BT, de Ridder D, Freeman RM et al. An International Urogynecological Association (IUGA)/International Continence Society (ICS) joint report on the terminology for female pelvic floor dysfunction. Neurourol Urodyn 2010; 29(1): 4–20. doi: 10.1002/nau.20798.
2. Gormley EA, Lightner DJ, Burgio KL et al. Diagnosis and treatment of overactive bladder (non-neurogenic) in adults: AUA/SUFU guideline. J Urol 2012; 188(6): 2455–2463. doi: 10.1016/j.juro.2012.09.079.
3. Fitzgerald MP, Brubaker L. Variability of 24-hour voiding diary variables among asymptomatic women. J Urol 2003; 169(1): 207–209.
4. Gormley EA, Lightner DJ, Faraday M et al. Diagnosis and treatment of overactive bladder (non-neurogenic) in adults: AUA/SUFU guideline amendment. J Urol 2015; 193(5): 1572–1580. doi: 10.1016/j.juro.2015.01.087.
5. Fantl JA, Wyman JF, McClish DK et al. Efficacy of bladder training in older women with urinary incontinence. JAMA 1991; 265(5): 609–613.
6. Jarvis GJ. A controlled trial of bladder drill and drug therapy in the management of detrusor instability. BJU Int 1981; 53(6): 565–566.
7. Burgio KL, Locher JL, Goode PS et al. Behavioral vs drug treatment for urge urinary incontinence in older women: a randomized controlled trial. JAMA 1998; 280(23): 1995–2000.
8. Burgio KL, Goode PS, Johnson TM et al. Behavioral versus drug treatment for overactive bladder in men: the male overactive bladder treatment in veterans (MOTIVE) trial. J Am Geriatr Soc 2011; 59(12): 2209–2216. doi: 10.1111/j.1532-5415.2011.03724.x.
9. Goode PS, Burgio KL, Locher JL et al. Urodynamic changes associated with behavioral and drug treatment of urge incontinence in older women. J Am Geriatr Soc 2002; 50(5): 808–816.
10. Kaya S, Akbayrak T, Beksac S. Comparison of different treatment protocols in the treatment of idiopathic detrusor overactivity: a randomized controlled trial. Clin Rehabil 2011; 25(4): 327–338. doi: 10.1177/0269215510385481.
11. Subak LL, Wing R, West DS et al. Weight loss to treat urinary incontinence in overweight and obese women. N Engl J Med 2009; 360(5): 481–490. doi: 10.1056/NEJMoa0806375.
12. Hashim H, Abrams P. How should patients with an overactive bladder manipulate their fluid intake? BJU Int 2008; 102(1): 62–66. doi: 10.1111/j.1464-410X.2008.07463.x.
13. Bryant CM, Dowell CJ, Fairbrother G. Caffeine reduction education to improve urinary symptoms. Br J Nurs 2002; 11(8): 560–565.
14. Burgio KL, Goode PS, Locher JL et al. Behavioral training with and without biofeedback in the treatment of urge incontinence in older women: a randomized controlled trial. JAMA 2002; 288(18): 2293–2299.
15. Wang AC, Wang YY, Chen MC. Single-blind, randomized trial of pelvic floor muscle training, biofeedback-assisted pelvic floor muscle training, and electrical stimulation in the management of overactive bladder. Urology 2004; 63(1): 61–66.
16. Cartwright R, Srikrishna S, Cardozo L et al. Patient-selected goals in overactive bladder: a placebo controlled randomized double-bind trial of transdermal oxybutynin for the treatment of urgency and urgent incontinence. BJU Int 2010; 107(1): 70–76. doi: 10.1111/j.1464-410X.2010.09591.x.
17. Nitti, VW, Khullar V, van Kerrebroeck P et al. Mirabegron for the treatment of overactive bladder: a prespecified pooled efficacy analysis and pooled safety analysis of three randomized, double-blind, placebo-controlled, phase III studies. Int J Clin Pract 2013; 67(7): 619–632. doi: 10.1111/ijcp.12194.
18. Herschorn S, Barkin J, Castro-Diaz D et al. A phase III, randomized, double-blind, parallel-group, placebo-controlled, multicentre study to assess the efficacy and safety of the beta(3) adrenoceptor agonist, mirabegron, in patients with symptoms of overactive bladder. Urology 2013; 82(2): 313–320. doi: 10.1016/j.urology.2013.02.077.
19. Lipton RB, Kolodner K, Wesnes K. Assessment of cognitive function of the elderly population: effects of darifenacin. J Urol 2005; 173(2): 493–498.
20. Kay G, Crook T, Rekeda L et al. Differential effects of the antimuscarinic agents darifenacin and oxybutynin ER on memory in older subjects. Eur Urol 2006; 50(2): 317–326.
21. Cui Y, Wang L, Liu L et al. Botulinum toxin-A injections for idiopathic overactive bladder: a systematic review and meta-analysis. Urol Int 2013; 91(4): 429–438. doi: 10.1159/000351037.
22. Dmochowski R, Chapple C, Nitti V et al. Efficacy and safety of onabotulinumtoxin A for idiopathic overactive bladder: a double-blind, placebo controlled, randomized, dose ranging trial. J Urol 2010; 184(6): 2416–2422. doi: 10.1016/j.juro.2010.08.021.
23. Kuo, HC. Comparison of effectiveness of detrusor, suburothelial and bladder base injections of botulinum toxin A for idiopathic detrusor overactivity. J Urol 2007; 178(1): 1359–1363.
24. Brubaker L, Richter HE, Visco A et al. Refractory idiopathic urge urinary incontinence and botulinum A injection. J Urol 2008; 180(1): 217–222. doi: 10.1016/j.juro.2008.03.028.
25. Sahai A, Khan MS, Dasgupta P. Efficacy of botulinum toxin-A for treating idiopathic detrusor overactivity: results from a single center, randomized, double-blind, placebo controlled trial. J Urol 2007; 177(6): 2231–2236.
26. Jeffery S, Fynes M, Lee F et al. Efficacy and complications of intradetrusor injection with botulinum toxin A in patients with refractory idiopathic detrusor overactivity. BJU Intl 2007; 100(6): 1302–1306.
27. Kessler TM, Danuser H, Schumacher M et al. Botulinum A toxin injections into the detrusor: an effective treatment in idiopathic and neurogenic detrusor overactivity? Neurourol Urodyn 2005; 24(3): 231–236.
28. Kessler TM, Khan S, Panicker J et al. Clean intermittent self-catheterization after botulinum neurotoxin type A injections: short-term effect on quality of life. Obstet Gynecol 2009; 113(5): 1046–1051. doi: 10.1097/AOG.0b013e3181a1f5ea.
29. Khan S, Kessler TM, Apostolidis A et al. What a patient with refractory idiopathic detrusor overactivity should know about botulinum neurotoxin type A injection. J Urol 2009; 181(4): 1773–1778. doi: 10.1016/j.juro.2008.11.110.
30. Wang CC, Liao CH, Kuo HC. Diabetes mellitus does not affect the efficacy and safety of intravesical onabotulinumtoxin A injection in patients with refractory detrusor overactivity. Neurourol Urodyn 2014; 33(8): 1235–1239. doi: 10.1002/nau.22494.
31. Liao CH, Kuo HC. Increased risk of large post-void residual urine and decreased long-term success rate after intravesical onabotulinumtoxin A injection for refractory idiopathic detrusor overactivity. J Urol 2013; 189(5): 1804–1810. doi: 10.1016/j.juro.2012.11.089.
32. Dowson C, Watkins J, Khan MS et al. Repeated botulinum toxin type A injections for refractory overactive bladder: medium-term outcomes, safety profile, and discontinuation rates. Eur Urol 2012; 61(4): 834–839. doi: 10.1016/j.eururo.2011.12.011.
33. Veeratterapillay R, Harding C, Teo L et al. Discontinuation rates and inter-injection interval for repeated intravesical botulinum toxin type A injections for detrusor overactivity. Int J Urol 2014; 21(2): 175–178. doi: 10.1111/iju.12205.
34. Mohee A, Khan A, Harris N et al. Long-term outcome of the use of intravesical botulinum toxin for the treatment of overactive bladder (OAB). BJU Int 2013; 111(1): 8. doi: 10.1111/j.1464-410X.2012.11285.x.
35. Hegele A, Frohme C, Varga Z et al. Antibodies after botulinum toxin A injection into musculus detrusor vesicae: incidence and clinical relevance. Urol Int 2011; 87(4): 439–444. doi: 10.1159/000332194.
36. Klingler HC, Pycha A, Schmidbauer J et al. Use of peripheral neuromodulation of the S3 region for treatment of detrusor overactivity: a urodynamic--based study. Urology 2000; 56(5): 766–771.
37. MacDiarmid SA, Peters KM, Shobeiri SA et al. Long-term durability of percutaneous tibial nerve stimulation for the treatment of overactive bladder. J Urol 2010; 183(1): 234–240. doi: 10.1016/j.juro.2009.08.160.
38. Peters KM, Carrico DJ, Perez-Marrero RA et al. Randomized trial of percutaneous tibial nerve stimulation versus Sham efficacy in the treatment of overactive bladder syndrome: results from the SUmiT trial. J Urol 2010; 183(4): 1438–1443. doi: 10.1016/j.juro.2009.12.036.
39. Marchal C, Herrera B, Antuna, F et al. Percutaneous tibial nerve stimulation in treatment of overactive bladder: when should retreatment be started? Urology 2011; 78(5): 1046–1050. doi: 10.1016/j.urology.2011.07.1394.
40. Peters KM, Shen L, McGuire M. Effect of sacral neuromodulation rate on overactive bladder symptoms: a randomized crossover feasibility study. LUTS 2013; 5(3): 129–133.
41. Yoong W, Shah P, Dadswell R et al. Sustained effectiveness of percutaneous tibial nerve stimulation for overactive bladder syndrome: 2-year follow-up of positive responders. Int Urogynecol J 2013; 24(5): 795–799. doi: 10.1007/s00192-012-1936-3.
42. Peters KM, MacDiarmid SA, Wooldridge LS et al. Randomized trial of percutaneous tibial nerve stimulation versus extended-release tolterodine: results from the overactive bladder innovative therapy trial. J Urol 2009; 182(3): 1055–1061. doi: 10.1016/j.juro.2009.05.045.
43. Sancaktar M, Ceyhan ST, Akyol I et al. The outcome of adding peripheral neuromodulation (Stoller afferent neuro-stimulation) to anti-muscarinic therapy in women with severe overactive bladder. Gynecol Endocrinol 2010; 26(10): 729–732. doi: 10.3109/09513591003649815.
44. Souto SC, Reis LO, Palma T et al. Prospective and randomized comparison of electrical stimulation of the posterior tibial nerve versus oxybutynin versus their combination for treatment of women with overactive bladder syndrome. World J Urol 2013; 32(1): 179–184. doi: 10.1007/s00345-013-1112-5.
45. Gaziev G, Topazio L, Iacovelli V et al. Percutaneous Tibial Nerve Stimulation (PTNS) efficacy in the treatment of lower urinary tract dysfunctions: a systematic review. BMC Urol 2013; 13 : 61–72. doi: 10.1186/1471-2490-13-61.
46. Moossdorff-Steinhauser HF, Berghmans B. Effects of percutaneous tibial nerve stimulation on adult patients with overactive bladder syndrome: a systematic review. Neurourol Urodyn 2013 : 32(3): 206–214. doi: 10.1002/nau.22296.
47. Siegel S, Noblett K, Mangel J et al. Results of a prospective, randomized, multicenter study evaluating sacral neuromodulation with InterStim therapy compared to standard medical therapy at 6-months in subjects with mild symptoms of overactive bladder. Neurourol Urodyn 2015; 34(3): 224–230. doi: 10.1002/nau.22544.
48. Angioli R, Montera R, Plotti F et al. Success rates, quality of life, and feasibility of sacral nerve stimulation in elderly patients: 1-year follow-up. Int Urogynecol J 2013; 24(5): 789–794. doi: 10.1007/s00192-012-1928-3.
49. Faucheron JL, Chodez M, Boillot B. Neuromodulation for fecal and urinary incontinence: functional results in 57 consecutive patients from a single institution. Dis Colon Rectum 2012; 55(12): 1278–1283. doi: 10.1097/DCR.0b013e31826c7789.
50. Smits MA, Oerlemans D, Marcelissen TA et al. Sacral neuromodulation in patients with idiopathic overactive bladder after initial botulinum toxin therapy. J Urol 2013; 190(6): 2148–2152. doi: 10.1016/j.juro.2013.07.017.
51. Leong RK, Marcelissen TA, Nieman FH et al. Satisfaction and patient experience with sacral neuromodulation: results of a single center sample survey. J Urol 2011; 185(2): 588–592. doi: 10.1016/j.juro.2010.09.090.
52. Sutherland SE, Lavers A, Carlson A et al. Sacral nerve stimulation for voiding dysfunction: one institution’s 11-year experience. Neurourol Urodyn 2007; 26(1): 19–28.
53. Oerlemans DJ, Van Voskuilen AC, Marcelissen T et al. Is on-demand sacral neuromodulation in patients with OAB syndrome a feasible therapy regime? Neurourol Urodyn 2011; 30(8): 1493–1496. doi: 10.1002/nau.21070.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2015 Issue 3-
All articles in this issue
- Editorial
- Současné možnosti řešení neurogenního močového měchýře u dospělých pacientů – přehled
- Selektivní modulátory estrogenních receptorů a léčba mužského hypoandrogenizmu – systematická analýza
- Technologie „The Rezūm™ System“ v léčbě BPH – klinické výsledky střednědobého sledování
- Sexuální funkce po transuretrální resekci prostaty
- Fokální léčba lokalizovaného karcinomu prostaty
- Léčba non-neurogenního hyperaktivního močového měchýře – přehled guidelines Americké urologické asociace a Society of Urodynamics, Female Pelvic Medicine & Urogenital Reconstruction
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Selektivní modulátory estrogenních receptorů a léčba mužského hypoandrogenizmu – systematická analýza
- Současné možnosti řešení neurogenního močového měchýře u dospělých pacientů – přehled
- Technologie „The Rezūm™ System“ v léčbě BPH – klinické výsledky střednědobého sledování
- Sexuální funkce po transuretrální resekci prostaty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

