-
Medical journals
- Career
Současné možnosti řešení neurogenního močového měchýře u dospělých pacientů – přehled
: H. Tunuguntla; Y. Suk Kwon
: Section of Voiding Dysfunction, Neuro-Urology, Female Pelvic Medicine and Reconstructive Surgery, and Urodynamics ; Rutgers, the State University of New Jersey, Robert Wood Johnson Medical School ; Division of Urological Surgery
: Urol List 2015; 13(3): 14-21
Autoři tohoto přehledu prezentují různé formy mikčních abnormalit a uvádějí přehled konvenčních způsobů léčby i nejnovějších terapeutických modalit za účelem poskytnout informace urologům, kteří chtějí poskytovat péči pacientům s neurogenní dysfunkcí dolních močových cest na základě nejnovějších poznatků. Dostupné možnosti řešení dysfunkce dolních močových cest neurogenního původu nejsou dostatečně konzistentně ani efektivně využívány. Významné pokroky na poli urodynamiky dosažené v uplynulých 20 letech umožnily lépe porozumět složitým mechanizmům zodpovědným za vznik neurogenní dysfunkce dolních močových cest a vyvíjet vhodné terapeutické strategie. Dysfunkce dolních močových cest neurogenního původu u dospělých představuje velmi častý urologický problém postihující muže i ženy trpící poruchami centrálního, periferního a autonomního nervového systému nebo kombinací těchto poruch. Autoři ve svém aktuálním přehledu hodnotí roli základního a urodynamického vyšetření u pacientů s různými dysfunkcemi dolních cest močových neurogenního původu a zabývají se možnostmi medikamentózní, nemedikamentózní, min. invazivní a rekonstrukční operační léčby. Pozornost je věnována výskytu dysfunkce dolních močových cest neurogenního původu u pacientů s běžnými neurologickými poruchami, ke kterým patří cerebrovaskulární příhody, Parkinsonova nemoc, roztroušená skleróza, nádory mozku, poranění míchy, myelodysplázie, nádory míchy, herniace meziobratlové ploténky, poranění periferních nervů, syndrom cauda equina a syndrom medulárního konu. Autoři prezentují rovněž nejnovější poznatky v léčbě dysfunkce dolních močových cest neuro-genního původu u dospělých pacientů, které se dnes praktikují v referenčních akademických centrech po celém světě. V současné době je kladen důraz na praktickou a klinickou klasifikaci neurogenní dysfunkce dolních močových cest do kategorií s nízkým a vysokým rizikem a její využití při léčbě pacientů s touto poruchou. Pravidelné a doživotní urologické sledování může pomoci ochránit horní močové cesty, zlepšit výsledky léčby, zabránit vzniku komplikací a potenciálně zlepšovat kvalitu života a očekávanou délku života pacienta.
Kíčová slova:
míšní poraněníneurogenní močový měchýřdetruzoro-sfinkterická dyssynergieneurogenní dysfunkce dolních močových cesturodynamikamikční dysfunkceÚvod
Neurologická onemocnění jsou častou příčinou urologických symptomů a dysfunkce dolních močových cest. Symptomy dolních močových cest (lower urinary tract symptoms – LUTS) vč. močové inkontinence (urinary incontinence – UI) představují významnou klinickou, ekonomickou a sociální zátěž jak pro pacienta, tak pro poskytovatele zdravotní péče i systém zdravotnictví. Včasné rozpoznání a řešení neurogenních dysfunkcí dolních močových cest (NLUTD) hraje zásadní roli v rámci prevence potenciálně ireverzibilních nežádoucích stavů, zejména u pacientů s „vysokým rizikem“, jako je např. vysoký detruzorový leak point pressure a nízká compliance detruzoru. Vysoké riziko NLUTD hrozí pacientům s míšním poraněním, roztroušenou sklerózou a spina bifida. Tito pacienti mají vyšší riziko selhání ledvin, vzniku konkrementů v ledvinách i močovém měchýři, infekcí močových cest (UTI) a vezikoureterálního refluxu (VUR). Mezi terapeutické cíle při léčbě NLUTD patří prevence poškození horních močových cest, minimalizace rizika infekce a zajištění co možná nejvyšší kvality života (QoL) pacienta díky obnově společensky přijatelné kontinence. Zdokonalování modalit pro sledování močových cest, antibiotické léčby a možností řešení významně přispěly k prodloužení délky života pacientů s NLUTD. V rámci diagnostiky je nezbytné provést kompletní urologické vyšetření, které je třeba v rámci sledování pravidelně opakovat. Tento článek prezentuje komplexní přístup (založený na případech) k urodynamickému vyšetření a léčbě pacientů s NLUTD. Při řešení neurogenního měchýře je nutné udržet křehkou rovnováhu mezi zachováním renálních funkcí a QoL pacienta. V minulosti představovaly hlavní příčinu úmrtí po míšním poranění urologické komplikace, jako např. urosepse a selhání ledvin. Zdokonalování modalit pro sledování močových cest, antibiotické léčby a možností řešení významně přispěly k prodloužení délky života těchto pacientů [1].
Patofyziologie
Normální mikce je koordinovaný proces, na kterém se podílejí nervová spojení z mozku a míchy do hladké svaloviny močového měchýře a močové trubice. Močení řídí mozková kůra, mikční centrum pontu (pontine micturition center – PMC) a sakrální mikční centrum (S2–S4). Mozková kůra zastává zásadní roli v rámci volní kontroly mikce prostřednictvím PMC. Parasympatické eferentní (motorické) nervy vedou z míšních segmentů S2–S4. Sakrální eferentní nervy probíhají cestou pánevních nervů a vedou excitační impulzy do močového měchýře. Stimulace cholinergních receptorů v močovém měchýři vyvolává jeho kontrakce. Sympatické eferentní zásobení močového měchýře a močové trubice začíná v intermediolaterální šedé hmotě míšní na úrovni segmentů Th11 a L2 a zprostředkovává inhibiční impulzy do močového měchýře. Sympatické impulzy vedou do bederních sympatických paravertebrálních ganglií. Odtud sympatické impulzy pokračují prostřednictvím postgangliových vláken v hypogastrických nervech do synapsí v močovém měchýři a močové trubici. Sympatická eferentní stimulace usnadňuje jímací funkci díky relaxaci hladké svaloviny stěny močového měchýře, k níž dochází v důsledku stimulace b receptorů a kontrakce svěrače a hladké svaloviny prostaty a stimulace a receptorů v oblasti báze močového měchýře a v prostatické části močové trubice. Inhibice zevního svěrače (která působí jeho relaxaci) je ovlivňována z PMC cestou somatického pudendálního nervu (S2–S4).
Typy mikční dysfunkce
Mícha končí na úrovni spojení obratlů L1–L2. Primární neurologickou poruchu lze klasifikovat jako suprapontinní, infrapontinní-suprasakrální, infrasakrální nebo periferní lézi. Na základě této klasifikace lze lépe predikovat konkrétní klinickou//urodynamickou abnormalitu, rozdělení má tedy terapeutický a prognostický význam. Míšní segmenty S2/3/4 se nalézají na úrovni obratle Th12. Léze lokalizované na úrovni Th11 nebo výše se označují jako suprasakrální léze, léze lokalizované na úrovni L1 nebo níže se označují jako infrasakrální léze. Léze lokalizované na úrovni obratle Th12 lze charakterizovat jako smíšené.
Urodynamické vyšetření umožní charakterizovat typ mikční dysfunkce a identifikovat ty pacienty, kterým hrozí vyšší riziko poškození horních cest močových (např. míšní poranění, roztroušená skleróza, spina bifida), což usnadní volbu vhodné léčby zaměřené na ochranu zachování renální funkce. Při diagnostikování komplikované dysfunkce dolních cest močových může být navíc užitečné použití skiaskopie (videourodynamické studie), což umožní přesně lokalizovat obstrukci, potvrdit normální funkci hrdla močového měchýře, zobrazit detruzoro-sfinkterickou dyssynergii a zhodnotit anatomické abnormality u pacientů s komplikovanou inkontinencí. Skiaskopie může rovněž dokumentovat přítomnost VUR během videourodynamického vyšetření. Přesnější specifikace dysfunkce dolních cest močových jako „porucha jímací funkce“ nebo „porucha vyprazdňovací funkce“ usnadní volbu vhodné léčby.
Suprapontinní léze
Neurologické léze lokalizované nad PMC, vč. CVA a tumoru mozku, vedou k hyperaktivitě detruzoru při koordinované činnosti svěračů (bez detruzoro-sfinkterické dyssynergie), což je u těchto pacientů obvyklý urodynamický nález. Během kontrakce močového měchýře zůstavují svěrače relaxovány a senzitivita močového měchýře je intaktní.
Suprasakrální léze
Urodynamicky prokázaná hyperaktivita detruzoru u pacientů se suprasakrálním míšním poraněním je často spojena s dyssinergií detruzoru a zevního svěrače (DESD), což vede k intermitentnímu nebo úplnému selhání relaxace močového svěrače během kontrakce močového měchýře a močení. Výskyt DESD se uvádí u 96 % pacientů se suprasakrálními míšními lézemi. U těchto pacientů často dochází ke vzniku vysokého intravezikálního mikčního tlaku za účelem překonat kontrakce zevního svěrače, což vede k následné hydronefróze a poškození horních močových cest.
Herniace lumbální meziobratlové ploténky
K herniaci lumbální meziobratlové ploténky obvykle dochází na úrovni segmentů L3–L4 a L4–L5. Mezi nejčastější symptomy u pacientů s touto poruchou patří močová retence v kombinaci s paradoxní ischurií v důsledku akontraktility detruzoru. V 1–15 % případů protruze lumbální ploténky jsou postiženy kořeny S2–S4. U většiny (až 65 %) pacientů je detruzor akontraktilní i během sledování, přibližně u jedné třetiny pacientů dojde k obnově normální funkce detruzoru i compliance. U těchto pacientů se doporučuje intermitentní katetrizace nebo provádění Credého a/nebo Valsavova manévru v přesně stanovených intervalech.
Sakrální léze
Při poškození sakrální míchy dochází ke vzniku akontraktility močového měchýře. Zevní močový svěrač obvykle zůstává funkční, což může přispívat k nadměrnému rozpínání močového měchýře. U pacientů, u nichž se léze nalézá distálně od sakra, byla zaznamenána snížená compliance. U pacientů se sakrální spinální lézí je obvykle účinná intermitentní selfkatetrizace, protože tito pacienti disponují dostatečnou manuální obratností, aby byli schopni tuto proceduru provádět, a neporušený močový svěrač zajišťuje kontinenci [2].
Periferní léze a poranění pánevního plexu
Mikční dysfunkce se vyskytuje u 10–60 % pacientů po radikální operaci v pánvi, s touto komplikací se běžně setkáváme po abdominoperineální resekci a radikální hysterektomii. Nejčastější příčinu mikční dysfunkce u této populace pacientů představuje narušení nebo destrukce autonomní inervace dolních cest močových. Přibližně u 15–20 % pacientů má NLUTD trvalý charakter. Zpočátku se u pacientů manifestuje močová retence v důsledku hypokontraktilního detruzoru a stresová močová inkontinence (SUI) způsobená otevřením a fixací zevního močového svěrače. Urodynamické vyšetření prokáže sníženou complianci, otevřené hrdlo močového měchýře a fixovaný příčně pruhovaný svěrač. U těchto pacientů je obvykle indikována čistá intermitentní katetrizace.
Detrusor leak point pressure a NLUTD
Ve své průlomové publikaci McGuire et al prokázali souvislost mezi zvýšeným tlakem detruzoru a poškozením horních cest močových ve velké skupině myelodysplastických pacientů, kteří byli sledováni po dobu sedmi let [3]. Pacienti s tlakem detruzoru > 40 cmH2O měli 68% riziko VUR a 81% riziko ureterální dilatace. Objev korelace mezi tlakem detruzoru a výtokem z močového měchýře měl zcela zásadní význam. Vyšší tlak detruzoru může být vyvolán sníženou compliancí močového měchýře a/nebo obstrukcí v jeho výtoku. Při hodnotách detrusor leak point pressure > 40 cmH2O dochází u pacientů s NLUTD k poškození horních cest močových.
Úvodní urologické vyšetření
Klinické vyšetření
Rutinní urologické vyšetření spočívá ve zhodnocení krajiny břišní a zevního genitálu. U mužů by mělo být dále provedeno digitální rektální vyšetření za účelem posouzení velikosti, citlivosti a konzistence prostaty. U žen se doporučuje provedení vaginálního vyšetření, vč. palpace močové trubice na přední straně vaginy, které umožní odhalit případný výtok nebo rezistenci a vyloučit přítomnost uretritidy, uretrálního divertiklu nebo tumoru. Vyšetření vaginální sliznice pohledem a pohmatem umožní detekovat případnou atrofickou vaginitidu související s vyšším rizikem infekce a identifikovat anatomické abnormality, jako jsou např. cystokéla, enterokéla, prolaps dělohy a gynekologická nádorová onemocnění. Všechna uvedená onemocnění mohou vyvolávat stejné symptomy jako neurologické poruchy.
Na základě podrobné anamnézy a důkladného klinického vyšetření lze stanovit, o jaký typ funkční abnormality se jedná (porucha jímací nebo vyprazdňovací funkce nebo obou funkcí současně). Je důležité provést jak funkční (radioizotopové vyšetření ledvin, měření hladiny kreatininu v séru), tak anatomické (ultrazvukové vyšetření (UZ) nebo CT) horních cest močových. Vyšetření dolních cest močových by mělo zahrnovat urodynamickou studii, cystogram pro vyloučení VUR a cystoskopické vyšetření, které umožní zhodnotit anatomii močového měchýře. V našem centru vždy v rámci úvodního postupu u pacientů s NLUTD indikujeme urodynamickou studii a UZ ledvin/močového měchýře.
Urodynamické vyšetření
Urodynamické vyšetření umožní charakterizovat typ mikční dysfunkce a identifikovat ty pacienty, kterým hrozí vyšší riziko poškození horních cest močových, což usnadní volbu vhodné léčby zaměřené na ochranu zachování renální funkce. Při diagnostikování komplikované dysfunkce dolních cest močových může být užitečné použití skiaskopie (videourodynamické studie), což umožní přesně lokalizovat obstrukci, potvrdit normální funkci hrdla močového měchýře, zobrazit detruzoro-sfinkterickou dyssynergii a zhodnotit anatomické abnormality u pacientů s komplikovanou inkontinencí. Skiaskopie může rovněž dokumentovat přítomnost VUR.
Řešení NLUTD
Léčba NLUTD vychází z klinické manifestace symptomů, úrovně míšního poranění a preference pacienta.
Porucha vyprazdňovací funkce vs. porucha jímací funkce
Porucha vyprazdňovací funkce
Úplné vyprázdnění močového měchýře je nezbytné pro zajištění ochrany horních cest močových a prevenci UTI. V závislosti na typu a lokalizaci neurologické léze je u pacientů, kteří nejsou schopni spontánně močit, indikována intermitentní selfkatetrizace (případně katetrizaci provádí pečovatel). V některých případech může být pro stimulaci mikce nezbytné provedení Credého manévru. U pacientů s nekompletní lézí, kteří trpí UI, může být účinná behaviorální terapie.
Čistá intermitentní katetrizace
Od zavedení čisté intermitentní katetrizace (ČIK) do klinické praxe v roce 1972 [4] představuje tato metoda preferovaný způsob řešení u pacientů s částečnou nebo úplnou močovou retencí [5]. Oficiální publikace považují ČIK za zlatý standard pro medicínsky relevantní vyprázdnění močového měchýře, zejména pokud pacientův fyzický a psychický stav umožňuje tuto proceduru provádět, případně pokud pacientovi může asistovat pečovatel [2,6–15]. Tato metoda nepředstavuje optimální řešení pro pacienty, kteří nejsou schopni katetrizaci provádět sami z důvodu zhoršené manuální obratnosti (v případě poranění horních etáží míchy) a nemají k dispozici pečovatele, který by jim byl nápomocen. Vhodnými kandidáty pro ČIK nejsou rovněž pacienti s abnormální anatomií močové trubice, fosse route nebo narušenou kognitivní funkcí [16]. Pacienti, kteří nejsou schopni močit normálně, mohou časovanou katetrizaci užívat podobným způsobem jako normální močení. ČIK umožňuje vyprazdňování a následné jímání moči. V případě, že má močový měchýř dostatečnou kapacitu a nízký tlak, a v případě adekvátní frekvence provádění katetrizace lze u pacientů s neurogenním močovým měchýřem docílit kontinence pouhou ČIK [17]. Často je však nutné pro zajištění kontinence doplnit ČIK farmakoterapií nebo operační léčbou. Podrobnější popis je uveden v dalších kapitolách. Abychom předešli nadměrnému rozpínání měchýře, doporučuje se ČIK provádět každých 4–6 hod. Normální kapacita močového měchýře je méně než 500 ml. Jestliže objem močového měchýře trvale převyšuje 500 ml, je nutné modifikovat příjem tekutin nebo frekvenci provádění katetrizace [2]. Ačkoli UTI představuje nejčastější komplikaci ČIK, celková míra je přijatelně nízká – incidence bakteriurie činí 1–3 % na katetrizaci [18] a 1–4 příhody bakteriurie za 100 dnů ČIK. Užívání antimikrobiální profylaxe se u těchto pacientů považuje za kontroverzní a obecně nelze doporučit [19].
Permanentní močový katetr
Ve srovnání s ČIK signifikantně zvyšuje zavedení permanentního katetru riziko selhání ledvin, vzniku konkrementů v močovém měchýři a ledvinách, vzniku píštělí močové trubice, striktur a eroze močové trubice a karcinomu močového měchýře [6,11,20,21]. Studie, která hodnotí léčbu močového měchýře a související výskyt komplikací u 70 žen s míšní lézí, prokazuje výskyt závažných komplikací u 17 % (4 z 23) pacientek, které prováděly ČIK, a více než 200% výskyt (58 z 22) u žen se zavedeným katetrem [11]. Bohužel ne všichni pacienti jsou ideálními kandidáty pro ČIK. Pacienti s poraněním horních etáží míchy čelí řadě překážek, které brání efektivnímu provádění ČIK, zejména problematickému přístupu k močové trubici, špatné funkci rukou, neschopnosti zaujmout vhodnou polohu pro katetrizaci a absenci pečovatele, který by mohl být nápomocen. V některých případech je zavedení permanentního katetru nezbytné za účelem prevence dysreflexie mezi katetrizacemi [6].
Zavedení epicystostomie poskytuje oproti permanentnímu katetru několik výhod, vč. vyhnutí se poranění močové trubice, protože není nutné zavádět uretrální katetr, a absence katetru v oblasti genitálu pro sexuálně aktivní pacienty [22]. Kvadruplegičtí pacienti bez ohledu na pohlaví uvádějí větší spokojenost s použitím epicystostomie než s ČIK [23]. Z populace pacientů, kteří vyzkoušejí léčbu pomocí ČIK, od této modality v dlouhodobém horizontu ustoupí častěji ženy, kvadruplegici a pacienti s kompletní lézí míšní. Pacienti uvádějí následující důvody pro opuštění ČIK: závislost na pečovateli, svalovou spasticitu a přetrvávající inkontinenci navzdory maximálnímu dávkování anticholinergní terapie [24].
Při protrahovaném zavedení katetru se uvádí 3–10% riziko bakteriurie//katetr-den, toto riziko se blíží 100 % po 30 dnech od zavedení katetru [25–27]. I když je u těchto pacientů přítomna bakteriurie, incidence horečnatých atak vyvolaných UTI se vyskytuje pouze s frekvencí 1/100 dnů katetrizace [28]. Katsumi et al ve své studii zahrnující pacienty s lézí míšní srovnávali 46 pacientů s epicystostomií a 133 pacientů se zavedeným permanentním katetrem a uvádí výskyt alespoň jedné příhody symptomatické UTI (definované jako symptomy vyžadující léčbu antibiotiky) u 98 % pacientů s epicystostomií a 93 % pacientů s uretrálním katetrem po průměrné době sledování 131 měsíců. V obou skupinách byl během jednoho roku zaznamenán výskyt vícečetné UTI u 30 % pacientů, febrilní UTI u 15–16 %, vznik pyelonefritidy u 2–4 % a vznik urosepse u 11–15 % pacientů [29]. U pacientů se zavedeným uretrálním katetrem byla zaznamenána vyšší incidence epididymitidy, periuretrálního abscesu, iatrogenní hypospadie a uretrokutánní píštěle než u pacientů s epicystostomií [30]. Některým pacientkám s dlouhodobě zavedeným katetrem navíc hrozí vyšší riziko uretrální eroze způsobující široce otevřenou močovou trubici s obtížně řešitelnou inkontinencí. Nejlepším způsobem léčby se v těchto případech podle našich zkušeností jeví kombinace uzávěru hrdla močového měchýře a zavedení epicystostomie spíše než rozsáhlé rekonstrukční operace s derivací moči.
Porucha jímací funkce
Časované močení
Režim časované mikce spočívá v močení v pravidelných intervalech a úzce souvisí s funkcí močového měchýře a pracovním režimem pacienta. Obecně je časované močení vhodnější u pacientů s neúplným poraněním míchy, kdy může sloužit rovněž jako prevence urgentní UI neboli nutkavé inkontinence [17,31,32]. Těmto příhodám lze zabránit předcházením přeplnění močového měchýře a vzniku močové urgence. Důležitou pomůcku při volbě optimálního režimu představuje mikční diář. Časovaná mikce může být efektivní pouze u pacientů, kteří mají stále určitou kontrolu nad funkcí svého močového měchýře. Ersoz et al hodnotí senzitivitu plnění močového měchýře pomocí plnicí cystometrie u 73 pacientů s traumatickou lézí míšní. Pocit plnění močového měchýře zaznamenali všichni pacienti s nekompletní lézí míšní, 82,4 % pacientů s kompletní lézí míšní pod Th10 a 38,9 % pacientů s kompletní lézí míšní nad Th11. Pocit plnění močového měchýře před dosažením Pves 25 cmH2O uvedlo 86 % pacientů s nekompletní lézí míšní, 53 % pacientů s kompletní lézí pod Th10 a 22 % pacientů s kompletní lézí nad Th11 [32]. Tato studie ukazuje, že pacienti s lézí míšní vykazují stále potenciál pro vyprazdňování močového měchýře na základě pocitu.
Léčba antimuskariniky
Antimuskarinika se užívají pro léčbu neurogenního hyperaktivního detruzoru (neurogenic detrusor overactivity – NDO) první volby [33]. Tato léčba je založena na předpokladu, že kontrakce detuzoru jsou zprostředkovány muskarinovými receptory (M2 a M3) [34] a že aplikace antimuskarinik vede ke stabilizaci detruzoru a redukci jeho hyperaktivity, díky čemuž se stává více refrakterní na parasympatickou stimulaci. Bylo prokázáno, že podávání anticholinergik zlepšuje complianci močového měchýře a zabraňuje poškození horních cest močových a zlepšuje QoL pacienta [34]. Ačkoli je léčba pomocí antimuskarinik bezpečná a účinná, studie ukazují, že vyšší dávkování užívané při léčbě NDO je často spojeno se závažnějšími nežádoucími účinky, což vede pacienty k ukončení léčby [33–35]. Jiní autoři naopak uvádějí, že u pacientů s míšními lézemi může být dopad nežádoucích účinků léčby méně výrazný a pacienti jsou schopni snášet vyšší dávky [36].
Agonisté β3-adrenergních receptorů
Úřad pro kontrolu potravin a léčiv (FDA) před nedávném schválil preparát mirabegron, agonistu β3-adrenergního receptoru, pro léčbu hyperaktivního močového měchýře. β1-, β2-, i β3-adrenergní receptory se nacházejí v lidském močovém měchýři a urotelu, v 95 % se jedná o β3-receptory [37,38]. Při užívání preparátů z této skupiny léčiv jsou pacienti ušetřeni nežádoucích účinků v podobě suchosti v ústech a zácpy, které se vyskytují při užívání anticholinergik. Bylo pozorováno mírné zvýšení krevního tlaku. Studie fáze III, které srovnávají mirabegron s placebem, prokázaly redukci počtu močení během 24 hod (–1,77 při užívání mirabegronu vs. –1,18 u placeba). Dosud nebyly provedeny žádné studie, které by testovaly léčbu specificky u pacientů s neurogenním močovým měchýřem.
Onabotulotoxin A
FDA schválil v srpnu roku 2011 využití botulotoxinu A (BoNT-A), neurotoxinu produkovaného grampozitivní anaerobní bakterií Clostridium botulinum, při léčbě NDO [39,40]. NDO je z urodynamického hlediska charakterizován mimovolními kontrakcemi detruzoru během plnicí fáze, kontrakce mohou být spontánní nebo vyvolané z důvodu přítomnosti neurologické poruchy [41]. Za účelem schválení onabotulotoxinu A pro léčbu NDO FDA byly provedeny dvě velké multicentrické randomizované, placebem kontrolované studie. U pacientů, kteří byli léčeni pomocí 200 U onabotulotoxinu A, bylo prokázáno významné zlepšení vs. placebo. Léčba vedla ke snížení průměrného počtu příhod inkontinence a zlepšení dalších klinických a urodynamických parametrů (tab. 1), účinek léčby přetrval průměrně po dobu 36–42 týdnů [39]. Před schválením BoNT-A pro léčbu NDO měli pacienti, u nichž selhala medikamentózní terapie, k dispozici následující možnosti: zavedení permanentního katetru, užívání vložek/plen nebo komplexní rekonstrukční operaci s augmentací močového měchýře nebo derivací moči [2]. Aplikace BoNT-A představuje méně invazivní terapeutickou alternativu pro tuto populaci pacientů s NDO. Je pravděpodobné, že v budoucnosti bude augmentace močového měchýře vyhrazena pouze pro pacienty s hyperaktivním detruzorem nebo pacienty se sníženou compliancí, u nichž selhala léčba pomocí BoNT-A [42]. Při opakovaném podávání BoNT-A nebyl pozorován pokles účinnosti [34,43].
1. Sledování pacientů s neurogenní dysfunkcí dolních cest močových. 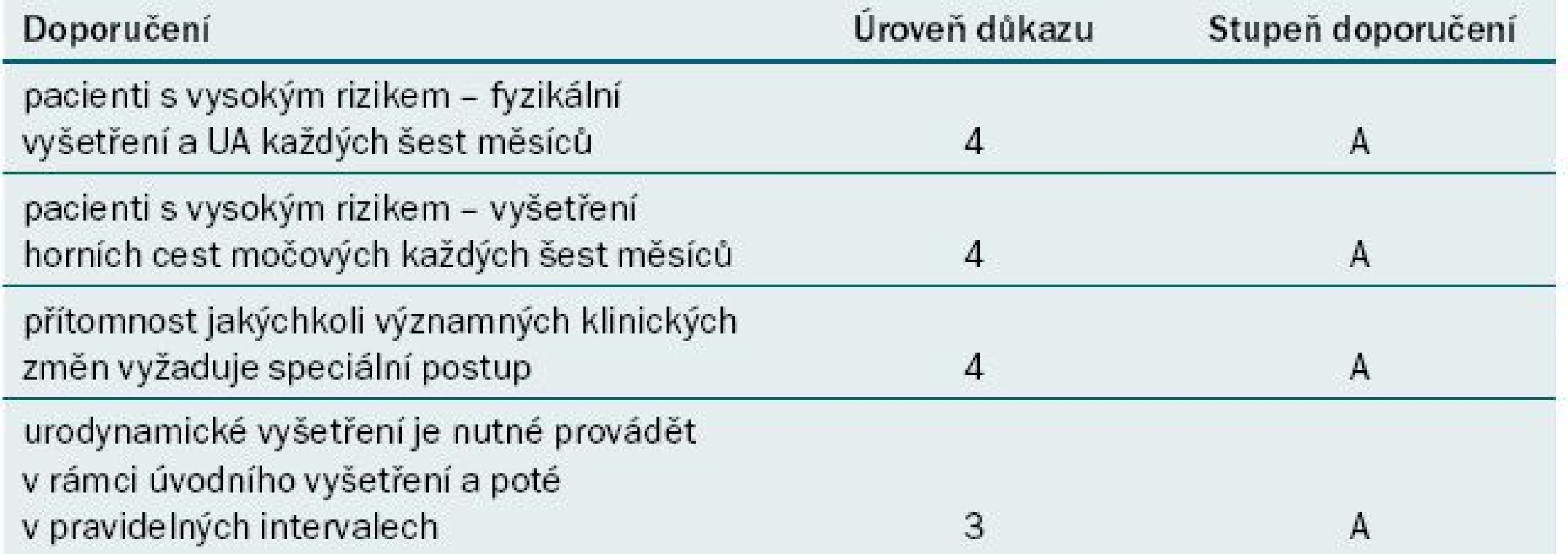
UA – kyselina močová Upraveno dle [71] Stále více důkazů nasvědčuje tomu, že BoNT-A může u pacientů s míšní lézí a se sníženou compliancí detruzoru představovat vhodnou modalitu rovněž pro léčbu první volby [44]. Účinek BoNT-A byl testován rovněž jako modalita k provedení chemické denervace zevního močového svěrače u pacientů s těžkou obstrukcí výtoku z močového měchýře [45]. Ve skutečnosti se jedná o první urologickou indikaci, pro kterou bylo využití toxinu testováno; vzhledem ke krátkému trvání účinku a absenci výrazného efektu se však léčba neosvědčila.
Operační léčba
V případě, že dojde k selhání konzervativních opatření, a pokud hrozí riziko, že tlaky v dolních cestách močových mohou v dlouhodobém horizontu poškodit funkci horních cest močových, lze přistoupit k operační léčbě.
Sfinkterotomie zevního svěrače
Techniku sfinkterotomie zevního svěrače poprvé popsali Ross et al, kteří se pokoušeli o ochranu funkce horních cest močových vyprazdňováním močového měchýře při nízkém tlaku [1,46]. Vhodnými kandidáty pro tuto techniku jsou pacienti s DSD, s UTI, dilatací horních cest močových, autonomní dysreflexií, nebo pacienti, u nichž selhala ČIK [1,2,47]. Sfinkterotomie se provádí prostřednictvím jediné incize na pozici 12. hod na ciferníku, která je vedena skrze vrstvy sliznice a svaloviny z místa proximálně od verumontana směrem do proximální části bulbární močové trubice [1]. Ačkoli se dříve předpokládalo, že pomocí zavedení permanentního stentu nebo sfinkterotomie lze dosáhnout stejné míry úspěšnosti [48], v současné době se užívání uretrálního stentu nedoporučuje z důvodu poměrně vysoké míry komplikací a nutnosti opakovaného zavádění [49]. Bylo prokázáno, že po sfinkterotomii dochází ke zmenšení objemu postmikčního rezidua a snížení tlaku detruzoru [50–52]. U pacientů s nedostatečnou kontraktilitou detruzoru nemusí být operace účinná a naopak může docházet ke zvětšení objemu postmikčního rezidua, což vyžaduje změnu metody řešení této poruchy. Míra reoperace je v případě sfinkterotomie vysoká, uvádí se rozmezí 15–40 % [13,53–56]. Po eliminaci funkce svěrače musí pacient používat zevní jímací zařízení.
Augmentační cystoplastika
Pokud ČIK, anticholinergní terapie ani BoNT-A nezajistí jímavost dostatečného objemu močového měchýře při nízkém tlaku, je namístě přistoupit k operačnímu řešení [57]. Augmentační cystoplastika představuje důležitou modalitu pro léčbu refrakterní NDO a neřešitelné inkontinence a dysfunkce horních cest močových v důsledku zvýšeného tlaku v močovém měchýři [58]. Tato definitivní modalita spojená s vysokou mírou spokojenosti pacientů umožňuje u 80–95 % pacientů dosáhnout kontinence a ochrany horních cest močových [57]. Mezi nejčastější dlouhodobé nežádoucí účinky patří vznik konkrementů v močovém měchýři a UTI, riziko metabolických abnormalit, zejména hyperchloremické acidózy [58].
Ileální konduit
Vytvoření ileálního konduitu se považuje za standardní metodu derivace moči u pacientů s karcinomem močového měchýře invadujícím svalovinu. Tato modalita se využívá rovněž u pacientů s neurogenním močovým měchýřem (může být doplněna cystektomií, nebo nikoli) pro zajištění kontinuální drenáže a prevenci vzniku nežádoucího cizorodého materiálu [59,60]. Tuto možnost lze zvážit u kvadruplegiků, kteří si přejí zachovat relativní nezávislost, nebo pacientů s trvale zavedeným katetrem, kteří trpí recidivující UTI. Při hodnocení QoL po výkonu uvádějí pacienti celkovou spokojenost (9,1 bodů na 10bodové škále), žádný z pacientů nelitoval svého rozhodnutí podstoupit tuto intervenci [61]. Komplikace vyskytující se po derivaci moči zahrnují pyelonefritidu, střevní obstrukci, ureterální stenózu, únik moči, absces a stenózu stomatu, počet komplikací se zvyšuje při dlouhodobějším sledování [62]. Na provádění cystektomie současně s touto procedurou existují rozporuplné názory vzhledem k 21–61% riziku empyemu přirozeného močového měchýře.
Ileovezikostomie je procedura, která spočívá ve vytvoření anastomózy exkludované ileální kličky s přirozeným močovým měchýřem, díky čemuž není nutné provádět reimplantaci močovodu, která je nezbytná při užití technik derivace s použitím pouze ileální kličky. Smysl techniky spočívá v močové drenáži při zachování nízkého tlaku. Výhody této procedury oproti technice ileálního konduitu zahrnují možnost vyhnutí se zúžení ureteroileální anastomózy, vzniku empyemu močového měchýře a zachování přirozeného antirefluxního mechanizmu [63]. Technika dosahuje nejlepšího výsledku u pacientů s malým močovým měchýřem a těžkou hyperaktivitou, existuje obava, že u pacientů s velkým atonickým měchýřem může docházet k narušenému vyprazdňování.
Stresová močová inkontinence
Léčba SUI u pacientů s míšní lézí může být komplikovaná. Při UZ močového měchýře může být přehlédnuta patologie výtokové části močového měchýře. U žen lze přistoupit k implantaci fasciálního slingu, u mužů s míšní lézí a nedostatečným výtokem je léčba daleko obtížnější. Sledování má u těchto pacientů zásadní význam, aby nedošlo ke konverzi nízkotlakého systému na systém s vysokým tlakem, což by představovalo riziko pro horní cesty močové. Výkony užívané při léčbě SUI zahrnují implantaci umělého močového svěrače, suburetrální pásky (syntetické nebo autologní), injekční léčbu nebo uzávěr hrdla močového měchýře. Při sledování trvajícím déle než pět let byla u pacientů s umělým močovým svěračem prokázána téměř 100% míra kontinence, roční míra operační revize činila 0,2 na jednoho pacienta [64]. Navzdory nízké míře operační revize budou mladší pacienti téměř jistě nuceni v určité fázi podstoupit revizi, této populaci pacientů navíc hrozí vyšší riziko uretrální eroze. U mužů lze implantovat puboprostatický sling kolem močové trubice distálně k prostatě, tato technika dosahuje 83% míry úspěšnosti, vyžaduje však provedení abdominální incize [65]. Abdul-Rahman et al v retrospektivním přehledu, který zahrnuje 10 žen s neurogenním močovým měchýřem a SUI, které podstoupily implantaci tahuprosté vaginální pásky, uvádějí vyléčení inkontinence u devíti z 10 pacientek [66]. Uzavření hrdla močového měchýře se obvykle považuje za modalitu poslední instance, která je vyhrazena pro pacienty s nenávratně poškozenou močovou trubicí vlivem dlouhodobě zavedeného katetru nebo tlakového vředu, který zničil perineální část močové trubice.
Riziko karcinomu močového měchýře v souvislosti s neurogenním močovým měchýřem
Pacienti s neurogenním močovým měchýřem mají vyšší riziko karcinomu močového měchýře, než činí riziko v obecné populaci. U pacientů s neurogenním močovým měchýřem se uvádí 0,27–10% prevalence karcinomu močového měchýře v páté nebo šesté dekádě života, což je dříve, než lze očekávat v obecné populaci [67,68]. Na zvýšeném riziku se u této populace pacientů pravděpodobně podílí chronický zánět a iritace, UTI, močové konkrementy a trvale zavedený katetr. Polovinu z diagnostikovaných tumorů tvoří karcinom ze skvamózních buněk, což je mnohem vyšší podíl než v obecné populaci [67]. Bylo zjištěno, že cystoskopie ani cytologické vyšetření moči nemá při vyšetřování pacientů s míšním poraněním a dlouhodobě zavedeným Foleyho katetrem žádný přínos, pravděpodobně z důvodu nízké incidence onemocnění a malého počtu případů [69].
Sledování
Podle doporučení pro klinickou praxi, která vydává Consortium for Spinal Cord Medicine, by měli pacienti s poraněním míchy podstoupit jednou ročně urologické vyšetření. S ohledem na konkrétní typ vyšetření ani optimální frekvenci jeho provádění však nebylo dosaženo konsenzu. Rovněž nebylo dosaženo konsenzu o tom, jaký postup zvolit při urologickém sledování pacientů s NLUTD. V našem centru obvykle v rámci kontrolního vyšetření (jednou ročně) provádíme následující procedury: odebrání anamnézy, fyzikální vyšetření, urea/kreatinin, prostý snímek ledvin a močového měchýře a urologické vyšetření ledvin. Urodynamické vyšetření se doporučuje provádět jednou za 5–10 let nebo v případě klinické indikace. Screeningové provádění rozboru ani kultivace moči není rutinně indikováno. Řada klinických lékařů doporučuje jednou ročně provádět UZ ledvin a močového měchýře, které při nízké ceně umožňuje detekovat hydronefrózu se srovnatelnou senzitivitou jako vylučovací urografie, mikční CUG a radioizotopové vyšetření ledvin [69]. Prostý snímek ledvin a močového měchýře umožňuje detekovat močové kameny s 14–54% senzitivitou [70]. Podle názoru odborníků lze toto vyšetření v rámci screeningu urolitiázy vynechat. Optimální frekvence pro provádění urodynamické studie u pacientů s míšní lézí nebyla dosud stanovena. Někteří autoři doporučují screening provádět jednou ročně, jiní dvakrát ročně. Ostatní provádějí opakované vyšetření výhradně na základě symptomů. Pokud je nám známo, žádná studie nesrovnává počáteční a pozdější výsledky urodynamického vyšetření; pouze jediná studie uvádí urodynamické údaje u pacientů s míšním poraněním a dysfunkcí dolních cest močových po dlouhodobém sledování. Bez ohledu na zvolený monitorovací protokol je třeba si uvědomit, že charakteristika neurogenního močového měchýře je elastická a dynamická. Selhání léčby se nemusí projevit klinickými symptomy.
Závěry
Pro volbu účinné a individualizované léčby u pacientů s NLUTD je nezbytné provedení detailního neurourologického vyšetření s hodnocením dysfunkce močového měchýře. Míšní léze lokalizované nad segmenty Th6 mohou být příčinou autonomní dysreflexie. Pacienti s NLUTD v důsledku diabetes mellitus trpí často poruchou vyprazdňovací funkce, zatímco u pacientů s perniciózní anémií se setkáváme s vysokým objemem postmikčního rezidua a ztrátou senzitivity močového měchýře. Myelodysplazie je spojena s otevřeným a fixovaným svěračem.
V rámci úvodního vyšetření se u všech pacientů doporučuje UZ močového měchýře a ledvin a urodynamická studie. Urodynamické vyšetření hraje zásadní roli v rámci hodnocení a sledování pacientů s NLUTD. Hodnocení anamnézy, fyzikální vyšetření a UZ ledvin a močového měchýře se doporučuje opakovat jednou ročně. Pacientům s míšním poraněním, pokročilou roztroušenou sklerózou a spina bifida hrozí vyšší riziko poškození horních cest močových. Vzhledem k predispozici ke vzniku močových kamenů, UTI, maligních onemocnění a poškození horních cest močových by měli být pacienti pravidelně monitorováni. Urodynamické vyšetření je třeba opakovat podle klinického nálezu. Léčba NLUTD je zaměřena na ochranu horních i dolních cest močových. U této populace pacientů je nutné zvolit přístup, který zohledňuje rizika a současně je zaměřený na pacienta, který vyžaduje pravidelné celoživotní urologické sledování. Tato strategie umožňuje zlepšit výsledek, zabránit vzniku komplikací a potenciálně zlepšovat QoL pacienta a prodloužit očekávanou délku života.
Hari Siva G.R. Tunuguntla, MD, MS, MCh, FPMRS
Division of Urological Surgery
Section of Voiding Dysfunction, Neuro-Urology, Female Pelvic Medicine and Reconstructive Surgery, and Urodynamics
Rutgers, the State University of New Jersey, Robert Wood Johnson Medical School
1 RWJ Place
New Brunswick, NJ 089 01
USA
tunuguha@rwjms.rutgers.edu
Sources
1. Sorokin I, De E. Options for independent bladder management in patients with spinal cord injury and hand function prohibiting intermittent catheterization. Neurourol Urodyn 2015; 34(2): 167–176. doi: 10.1002/nau.22516.
2. Consortium for Spinal Cord Medicine. Bladder management for adults with spinal cord injury: a clinical practice guideline for health-care providers. J Spinal Cord Med 2006; 29(5): 527–573.
3. McGuire EJ, Woodside JR, Borden TA et al. Prognostic value of urodynamic testing in myelodysplastic patients. J Urol 1981; 126(2): 205–209.
4. Lapides J, Diokno AC, Silber SM et al. Clean, intermittent self-catheterization in the treatment of urinary tract disease. J Urol 2002; 167(4): 1584–1586.
5. Dorsher PT, McIntosh PM. Neurogenic bladder. Adv Urol 2012; 2012 : 816274. doi: 10.1155/2012/816274.
6. Cameron AP, Wallner LP, Tate DG et al. Bladder management after spinal cord injury in the United States 1972 to 2005. J Urol 2010; 184(1): 213–217. doi: 10.1016/j.juro.2010.03.008.
7. Abrams P, Agarwal M, Drake M et al. A proposed guideline for the urological management of patients with spinal cord injury. BJU Int 2008; 101(8): 989–994. doi: 10.1111/j.1464-410X.2008.07457.x.
8. Razdan S, Leboeuf L, Meinbach DS et al. Current practice patterns in the urologic surveillance and management of patients with spinal cord injury. Urology 2003; 61(5): 893–896.
9. Singh G, Thomas DG. The female tetraplegic: an admission of urological failure. Br J Urol 1997; 79(5): 708–712.
10. Jackson AB, Dijkers M, Devivo MJ et al. A demographic profile of new traumatic spinal cord injuries: change and stability over 30 years. Arch Phys Med Rehabil 2004; 85(11): 1740–1748.
11. Bennett CJ, Young MN, Adkins RH et al. Comparison of bladder management complication outcomes in female spinal cord injury patients. J Urol 1995; 153(5): 1458–1460.
12. Pan D, Troy A, Rogerson J et al. Long-term outcomes of external sphincterotomy in a spinal injured population. J Urol 2009; 181(2): 705–709. doi: 10.1016/j.juro.2008.10.004.
13. Yang CC, Mayo ME. External urethral sphincterotomy: long-term follow-up. Neurourol Urodyn 1995; 14(1): 25–31.
14. Eastwood EA, Hagglund KJ, Ragnarsson KT et al. Medical rehabilitation length of stay and outcomes for persons with traumatic spinal cord injury – 1990–1997. Arch Phys Med Rehabil 1999; 80(11): 1457–1463.
15. Kessler TM, Ryu G, Burkhard FC. Clean intermittent self-catheterization: a burden for the patient? Neurourol Urodyn 2009; 28(1): 18–21. doi: 10.1002/nau.20610.
16. Dmochowski RR, Ganabathi K, Leach GE. Non-operative management of the urinary tract in spinal cord injury. Neurourol Urodyn 1995; 14(1): 47–55.
17. Wyndaele JJ, Madersbacher H, Kovindha A. Conservative treatment of the neuropathic bladder in spinal cord injured patients. Spinal Cord 2001; 39(6): 294–300.
18. Warren JW. Catheter-associated urinary tract infections. Int J Antimicrob Agents 2001; 17(4): 299–303.
19. Morton SC, Shekelle PG, Adams JL et al. Antimicrobial prophylaxis for urinary tract infection in persons with spinal cord dysfunction. Arch Phys Med Rehabil 2002; 83(1): 129–138.
20. Esclarín De Ruz A, García Leoni E, Herruzo Cabrera R. Epidemiology and risk factors for urinary tract infection in patients with spinal cord injury. J Urol 2000; 164(4): 1285–1289.
21. West DA, Cummings JM, Longo WE et al. Role of chronic catheterization in the development of bladder cancer in patients with spinal cord injury. Urology 1999; 53(2): 292–297.
22. Sugimura T, Arnold E, English S et al. Chronic suprapubic catheterization in the management of patients with spinal cord injuries: analysis of upper and lower urinary tract complications. BJU Int 2008; 101(11): 1396–1400. doi: 10.1111/j.1464-410X.2007.07404.x.
23. Mitsui T, Minami K, Furuno T et al. Is suprapubic cystostomy an optimal urinary management in high quadriplegics? A comparative study of suprapubic cystostomy and clean intermittent catheterization. Eur Urol 2000; 38(4): 434–438.
24. Yavuzer G, Gok H, Tuncer S et al. Compliance with bladder management in spinal cord injury patients. Spinal Cord 2000; 38(12): 762–765.
25. Kass EH. Asymptomatic infections of the urinary tract. Trans Assoc Am Physicians 1956; 69 : 56–64.
26. Nickel JC, Grant SK, Costerton JW. Catheter--associated bacteriuria. An experimental study. Urology 1985; 26(4): 369–375.
27. Liedl B. Catheter-associated urinary tract infections. Curr Opin Urol 2001; 11(1): 75–79.
28. Warren JW. The catheter and urinary tract infection. Med Clin North Am 1991; 75(2): 481–493.
29. Katsumi HK, Kalisvaart JF, Ronningen LD et al. Urethral versus suprapubic catheter: choosing the best bladder management for male spinal cord injury patients with indwelling catheters. Spinal Cord 2010; 48(4): 325–329. doi: 10.1038/sc.2009.134.
30. Weld KJ, Dmochowski RR. Effect of bladder management on urological complications in spinal cord injured patients. J Urol 2000; 163(3): 768–772.
31. Hadley EC. Bladder training and related therapies for urinary incontinence in older people. JAMA 1986; 256(3): 372–379.
32. Ersoz M, Akyuz M. Bladder-filling sensation in patients with spinal cord injury and the potential for sensation-dependent bladder emptying. Spinal Cord 2004; 42(2): 110–116.
33. Stohrer M, Blok B, Castro-Diaz D et al. EAU guidelines on neurogenic lower urinary tract dysfunction. Eur Urol 2009; 56(1): 81–88. doi: 10.1016/j.eururo.2009.04.028.
34. del Popolo G, Mencarini M, Nelli F et al. Controversy over the pharmacological treatments of storage symptoms in spinal cord injury patients: a literature overview. Spinal Cord 2012; 50(1): 8–13. doi: 10.1038/sc.2011.110.
35. Benner JS, Nichol MB, Rovner ES et al. Patient--reported reasons for discontinuing overactive bladder medication. BJU Int 2010; 105(9): 1276–1282. doi: 10.1111/j.1464-410X.2009.09036.x.
36. O’Leary M, Erickson JR, Smith CP et al. Effect of controlled-release oxybutynin on neurogenic bladder function in spinal cord injury. J Spinal Cord Med 2003; 26(2): 159–162.
37. Tyagi P, Thomas CA, Yoshimura N et al. Investigations into the presence of functional Beta1, Beta2 and Beta3-adrenoceptors in urothelium and detrusor of human bladder. Int Braz J Urol 2009; 35(1): 76–83.
38. Yamaguchi O. Beta3-adrenoceptors in human detrusor muscle. Urology 2002; 59 (Suppl 1): 25–29.
39. Cruz F, Herschorn S, Aliotta P et al. Efficacy and safety of onabotulinumtoxinA in patients with urinary incontinence due to neurogenic detrusor overactivity: a randomized, double-blind, placebo-controlled trial. Eur Urol 2011; 60(4): 742–750. doi: 10.1016/j.eururo.2011.07.002.
40. Ginsberg D, Gousse A, Keppenne V et al. Phase 3 efficacy and tolerability study of onabotulinumtoxinA for urinary incontinence from neurogenic detrusor overactivity. J Urol 2012; 187(6): 2131–2139. doi: 10.1016/j.juro.2012.01.125.
41. Abrams P, Blaivas JG, Stanton SL et al. Sixth report on the standardisation of terminology of lower urinary tract function. Procedures related to neurophysiological investigations: electromyography, nerve conduction studies, reflex latencies, evoked potentials and sensory testing. The International Continence Society Committee on Standardization of Terminology, New York, May 1985. Scand J Urol Nephrol 1986; 20(3): 161–164.
42. Cox L, Cameron AP. OnabotulinumtoxinA for the treatment of overactive bladder. Res Rep Urol 2014; 6 : 79–89. doi: 10.2147/RRU.S43125.
43. Grosse J, Kramer G, Stohrer M. Success of repeat detrusor injections of botulinum a toxin in patients with severe neurogenic detrusor overactivity and incontinence. Eur Urol 2005; 47(5): 653–659.
44. Mehta S, Hill D, McIntyre A et al. Meta-analysis of botulinum toxin A detrusor injections in the treatment of neurogenic detrusor overactivity after spinal cord injury. Arch Phys Med Rehabil 2013; 94(8): 1473–1481. doi: 10.1016/j.apmr.2013.04.011.
45. Dykstra DD, Sidi AA. Treatment of detrusor-sphincter dyssynergia with botulinum A toxin: a double-blind study. Arch Phys Med Rehabil 1990; 71(1): 24–26.
46. Ross JC, Damanski M, Gibbon N. Resection of the external urethral sphincter in the paraplegic; preliminary report. J Urol 1958; 79(4): 742–746.
47. Reynard JM, Vass J, Sullivan ME et al. Sphincterotomy and the treatment of detrusor-sphincter dyssynergia: current status, future prospects. Spinal Cord 2003; 41(1): 1–11.
48. Chancellor MB, Bennett C, Simoneau AR et al. Sphincteric stent versus external sphincterotomy in spinal cord injured men: prospective randomized multicenter trial. J Urol 1999; 161(6): 1893–1898.
49. Wilson TS, Lemack GE, Dmochowski RR. UroLume stents: lessons learned. J Urol 2002; 167(6): 2477–2480.
50. Catz A, Luttwak ZP, Agranov E et al. The role of external sphincterotomy for patients with a spinal cord lesion. Spinal Cord 1997; 35(1): 48–52.
51. Fontaine E, Hajri M, Rhein F et al. Reappraisal of endoscopic sphincterotomy for post-traumatic neurogenic bladder: a prospective study. J Urol 1996; 155(1): 277–280.
52. Carrion HM, Brown BT, Politano VA. External sphincterotomy at the 12 o’clock position. J Urol 1979; 121(4): 462–463.
53. Ricottone AR, Pranikoff K, Steinmetz JR et al. Long-term follow-up of sphincterotomy in the treatment of autonomic dysreflexia. Neurourol Urodyn 1995; 14(1): 43–46.
54. Santiago JA. Sphincterotomy failure. J Am Paraplegia Soc 1993; 16(3): 164–168.
55. Kiviat MD. Transurethral sphincterotomy: relationship of site of incision to postoperative potency and delayed hemorrhage. J Urol 1975; 114(3): 399–401.
56. Vapnek JM, Couillard DR, Stone AR. Is sphincterotomy the best management of the spinal cord injured bladder? J Urol 1994; 151(4): 961–964.
57. Chartier-Kastler EJ, Mongiat-Artus P, Bitker MO et al. Long-term results of augmentation cystoplasty in spinal cord injury patients. Spinal Cord 2000; 38(8): 490–494.
58. Gurung PM, Attar KH, Abdul-Rahman A et al. Long-term outcomes of augmentation ileocystoplasty in patients with spinal cord injury: a minimum of 10 years of follow-up. BJU Int 2012; 109(8): 1236–1242. doi: 10.1111/j.1464-410X.2011.10509.x.
59. Clark K. Ileal conduit urinary diversion in adults with acquired neurogenic bladder. J Trauma 1962; 2 : 142–146.
60. Leadbetter WF, Shaffer FG. Ileal loop diversion; its application to the treatment of neurogenic bladder dysfunction. J Urol 1956; 75(3): 470–479.
61. Chartier-Kastler EJ, Mozer P, Denys P et al. Neurogenic bladder management and cutaneous non-continent ileal conduit. Spinal Cord 2002; 40(9): 443–448.
62. Madersbacher S, Schmidt J, Eberle JM et al. Long-term outcome of ileal conduit diversion. J Urol 2003; 169(3): 985–990.
63. Hellenthal NJ, Short SS, O’Connor RC et al. Incontinent ileovesicostomy: long-term outcomes and complications. Neurourol Urodyn 2009; 28(6): 483–486. doi: 10.1002/nau.20695.
64. Gonzalez R, Merino FG, Vaughn M. Long-term results of the artificial urinary sphincter in male patients with neurogenic bladder. J Urol 1995; 154(2): 769–770.
65. Daneshmand S, Ginsberg DA, Bennet JK et al. Puboprostatic sling repair for treatment of urethral incompetence in adult neurogenic incontinence. J Urol 2003; 169(1): 199–202.
66. Abdul-Rahman A, Attar KH, Hamid R et al. Long-term outcome of tension-free vaginal tape for treating stress incontinence in women with neuropathic bladders. BJU Int 2010; 106(6): 827–830. doi: 10.1111/j.1464-410X.2010.09203.x.
67. Ginsberg DA. Indications and complications of cystectomy in patients with neurogenic bladder. J Urol 2010; 184(1): 10–11. doi: 10.1016/j.juro.2010.04.024.
68. Groah SL, Weitzenkamp DA, Lammertse DP et al. Excess risk of bladder cancer in spinal cord injury: evidence for an association between indwelling catheter use and bladder cancer. Arch Phys Med Rehabil 2002; 83(3): 346–351.
69. Cameron AP, Rodriguez GM, Schomer KG. Systematic review of urological follow-up after spinal cord injury. J Urol 2012; 187(2): 391–397. doi: 10.1016/j.juro.2011.10.020.
70. Linsenmeyer MA, Linsenmeyer TA. Accuracy of bladder stone detection using abdominal x-ray after spinal cord injury. J Spinal Cord Med 2004; 27(5): 438–442.
71. Blok B, Pannek J, Castro-Diaz D et al. Guidelines on neuro-urology. European Association of Urology 2015. [online]. Available from: http://uroweb.org/wp-content/uploads/21-Neuro-Urology_LR2.pdf.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2015 Issue 3-
All articles in this issue
- Editorial
- CURRENT MANAGEMENT OF ADULT NEUROGENIC BLADDER – A REVIEW
- Selective estrogen receptor modulators and the management of male hypoandrogenism – a systematic analysis
- “THE REZŪM™ SYSTEM” TECHNOLOGY IN THE TREATMENT OF BPH – MEDIUM-TERM CLINICAL OUTCOMES
- SEXUAL FUNCTION AFTER TRANSURETHRAL RESECTION OF THE PROSTATE
- FOCAL THERAPY FOR LOCALIZED PROSTATE CANCER
- Treatment of Non-Neurogenic Overactive Bladder – American Urological Association and Society of Urodynamics, Female Pelvic Medicine & Urogenital Reconstruction Guideline Overview
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Selective estrogen receptor modulators and the management of male hypoandrogenism – a systematic analysis
- CURRENT MANAGEMENT OF ADULT NEUROGENIC BLADDER – A REVIEW
- “THE REZŪM™ SYSTEM” TECHNOLOGY IN THE TREATMENT OF BPH – MEDIUM-TERM CLINICAL OUTCOMES
- SEXUAL FUNCTION AFTER TRANSURETHRAL RESECTION OF THE PROSTATE
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

