-
Medical journals
- Career
Urodynamika – průběh vyšetření a indikace
Authors: M. J. Belsante; A. C. Peterson
Authors‘ workplace: Duke University Medical Center Durham
Published in: Urol List 2015; 13(2): 35-40
Overview
Urodynamické vyšetření v urologii je termín označující celou šíři testů, které společně mohou posloužit zhodnocení docela značného rozsahu urologických obtíží. Zahrnují celou skupinu individuálních vyšetření od prosté uroflowmetrie až po složitější cystometrii, elektromyografii a videourodynamické vyšetření. Cílem těchto vyšetření je odpovědět na specifické otázky týkající se schopností pacienta jímat a naopak zase vypuzovat moč. K důležitým principům urodynamiky, tak jak byly uvedeny Nittim, patří: 1. urodynamické vyšetření nepřispívá k diagnóze pokud neodráží obtíže uváděné pacientem; 2. neprokázání abnormality při vyšetření ještě neznamená, že neexistuje; 3. ne všechny zachycené abnormální nálezy jsou klinicky významné. K součástem dobré urodynamické praxe patří jasná indikace k vyšetření, precizní provedení a dokumentace, stejně jako přesná analýza a intepretace výsledků. Cílem urodynamického vyšetření je reprodukovat symptomy při současném objektivním měření fyziologie močového měchýře. V tomto článku popisujeme vlastní urodynamické vyšetření a jeho indikace.
Klíčová slova:
urodynamika, neurogenní močový měchýř, symptomy dolních cest močovýchÚvod
Urodynamické vyšetření v urologii označuje celý soubor testů, které mohou být (pokud jsou indikovány společně) užitečné při hodnocení celé řady urologických potíží. Patří sem celá řada samostatných testů – od jednoduchých vyšetření jako uroflowmetrie až po složitější vyšetření jako cystometrie, elektromyografie (EMG) a videourodynamika (skiaskopie). Cíl urodynamického vyšetření spočívá v hodnocení pacientovy schopnosti jímat a vyprazdňovat moč [1]. Nitti et al uvádí následující důležité principy tohoto vyšetření:
- urodynamické vyšetření nemá diagnostickou roli, pakliže nepomůže objasnit pacientovy symptomy;
- absence identifikace abnormálního nálezu ještě nevylučuje jeho přítomnost;
- ne všechny diagnostikované abnormality jsou klinicky závažné [2].
Správný postup při provádění urodynamického vyšetření vyžaduje stanovení jasné indikace pro toto vyšetření, zajištění precizního měření a adekvátní dokumentace spolu s přesnou analýzou a interpretací výsledků [1,3]. Cíl urodynamického vyšetření spočívá v interpretaci symptomů při současném zohlednění objektivních parametrů fyziologie močového měchýře.
Indikace
Indikace pro urodynamické vyšetření se různí, Guidelines Americké urologické asociace a SUFU uvádějí přehled nejvhodnějších postupů v rámci nejrůznějších klinických scénářů [4].
Stresová inkontinence
V případě nekomplikované stresové močové inkontinence (stress urinary incontinence – SUI) není indikace urodynamické studie nezbytná [5]. V případě indikace urodynamického vyšetření (urodynamic study – UDS) u pacientů se SMI je vhodné studii doplnit měřením profilu uretrálního tlaku a měřením objemu postmikčního rezidua (post-void residual – PVR) [4]. Pokud UDS vyšetření se zavedeným katetrem neprokáže přítomnost stresové inkontinence, je třeba pro průkaz SUI katetr vyjmout. V tomto klinickém scénáři lze při hodnocení ALPP/VLPP (abdominal leak point pressure nebo valsalva leak point pressure) užívat abdominální tlak (abdominal pressure – Pabd) jako zástupný parametr intravezikálního tlaku (intravesical pressure – Pves). Při urodynamickém vyšetření, které provádíme před operační léčbou prolapsu pánevních orgánů (pelvic organ prolapsed – POP), se snažíme u pacientů s POP vysokého stupně prolaps redukovat tak, abychom neovlivnili symptomy SUI a odhalili skrytou SUI a dysfunkci detruzoru.
Hyperaktivní močový měchýř, nutkavá močová inkontinence a smíšená močová inkontinence
V případě, že zvažujeme invazivní výkon nebo léčbu spojenou s potenciální morbiditou, v komplikovaných případech, kdy selhaly různé formy předchozí léčby, nebo v případě, že zvažujeme různé diagnózy, lze zvolit multikanálové urodynamické vyšetření. Cíl UDS v těchto případech spočívá v detekci případné poruchy compliance, hyperaktivity nebo hypokontraktility detruzoru nebo jiných abnormalit. Je třeba zdůraznit, že absence hyperaktivity detruzoru při UDS ji automaticky nevylučuje jako diagnózu. V případech de novo hyperaktivního močového měchýře, nutkavé močové inkontinence nebo smíšené močové inkontinence po operační léčbě SUI je třeba provést tlakově průtokové studie, abychom zjistili, zda je přítomna obstrukce výtoku z močového měchýře jako důsledek zavedení slingu nebo jiných operačních technik výtoku z močového měchýře z důvodu SUI.
Neurogenní močový měchýř
U pacientů s neurologickými chorobami, jako je např. myelodysplazie, roztroušená skleróza atd., a s diagnózou neurogenního močového měchýře se při úvodním vyšetření i při opakovaných vyšetřeních doporučuje měření PVR [4]. Cystometrie by měla být rutinně indikována při počátečním vyšetření a společně s tlakově průtokovým vyšetřením a EMG i během kontrolních vyšetření pro detekci případných abnormalit v complianci močového měchýře a identifikaci detruzoro-sfinkterické dyssynergie. U této populace pacientů se doporučuje pro identifikaci abnormalit v močovém měchýři během plnicí, jímací i mikční fáze provedení videourodynamické studie.
Symptomy dolních cest močových
U pacientů s refrakterními symptomy dolních cest močových (lower urinary tract symptoms – LUTS) se před invazivním UDS vyšetřením doporučuje měření PVR a neinvazivní urodynamické vyšetření. Před invazivní léčbou LUTS lze provést UDS. Konkrétně pomocí cystometrického vyšetření lze identifikovat hyperaktivitu, hypokontraktilitu nebo atonii detruzoru. V případě podezření na obstrukci výtoku z močového měchýře může být u pacientů před operací prostaty nebo u pacientek s podezřením na obstrukci užitečné provedení tlakově průtokové studie [4]. U pacientů s podezřením na primární obstrukci hrdla močového měchýře nebo pokud je nezbytné přesně lokalizovat obstrukci, může být prospěšné provedení videourodynamické studie.
Multikanálové urodynamické vyšetření
Multikanálové urodynamické vyšetření sestává z následujících komponent.
Uroflowmetrie
Uroflowmetrie je neinvazivní, levné vyšetření, pomocí něhož se měří objem vymočené moči v průběhu času. Tento parametr má zásadní roli při vyšetřování pacientů se symptomy dolních cest močových. Uroflowmetrie by měla být indikována před jakýmkoli invazivním urodynamickým testem nebo instrumentací, tedy před tím, než jakýkoli invazivní zásah naruší přirozený mikční cyklus. Normální průtoková křivka by měla být plynulá a ve tvaru oblouku. Jakákoli asymetrie, oploštění křivky nebo větší počet vrcholů indikují mikční dysfunkci. Byly popsány a definovány různé typy průtokových křivek [6,7].
- Typ 1. Normální nepřerušovaná průtoková křivka ve tvaru zvonu.
- Typ 2. Křivka je nepřerušovaná, asymetrická a prodloužená, v místě od Qmax do konce močení je oploštělá.
- Typ 3. Kolísavá, nepřerušovaná průtoková křivka s několika vrcholy.
- Typ 4. Přerušovaná průtoková křivka.
- Typ 5. Nepřerušovaná křivka tvaru plateau dosahuje téměř konstantního Qmax.
Užitečné údaje zahrnují maximální rychlost průtoku (Qmax), celkový vymočený objem, průměrnou rychlost průtoku a objem PVR (měřeno pomocí ultrazvuku nebo katetrizací). Objem vymočené moči ovlivňuje průtokovou křivku i Qmax, vymočené objemy < 150 ml se tedy obvykle nepovažují za dostatečné množství a neměly by být interpretovány [8–10].
U mladších mužů by měla normální maximální rychlost průtoku činit ≥ 15 ml/s, objem ≤ 10 ml/s se může považovat za abnormální. Spolu s věkem hodnota Qmax postupně klesá až na 5,5 ml/s v osmé dekádě života muže [11,12]. U žen se hodnota Qmax pohybuje v rozmezí 20–36 ml/s a s přibývajícím věkem se nesnižuje [8,13,14].
Cystometrogram
Pomocí cystometrie se vyšetřuje plnicí část fyziologie močového měchýře. Vzhledem k tomu, že je výsledek podmíněn technickými parametry, se doporučuje dodržovat standardizovaný protokol [1]. Pro výpočet tlaku detruzoru (Pdet = Pves – Pabd) se doporučuje cystometrii provádět s katetrem s tlakovým snímačem zavedeným do močového měchýře i rekta (multikanálová urodynamika). Klasické katetry jsou naplněny tekutinou, novější systémy jsou založeny na principu vzduchem naplněných snímačů. Systémy obsahující tekutinu je nutné vynulovat na úrovni symfýzy kosti stydké, zatímco katetry naplněné vzduchem nevyžadují nastavení na specifickou výšku ani proplachování pro odstranění vzduchových bublin [15]. Před zahájením urodynamické studie by měly být všechny tlakové snímače vynulovány na úroveň atmosférického tlaku.
Cystometrogram (cystometrogram – CMG) obvykle zahrnuje plnicí a jímací fázi, případně jakýkoli další požadovaný test jako např. testování mikční fáze.
Mezinárodní společnost pro kontinenci definuje rychlost plnění měchýře následujícím způsobem: pomalé (fyziologické) plnění (< 10 ml/min), středně rychlé plnění (10–100 ml/min) a rychlé plnění (> 100 ml/min). Pro první naplnění měchýře se obvykle doporučuje střední rychlost plnění kolem 60 ml/min a v případě, že výsledek prokáže závažnou hyperaktivitu detruzoru, je vhodné rychlost plnění zpomalit. Rychlejší plnění se užívá k vyvolání hyperaktivity detruzoru u pacientů, kteří si stěžují na urgenci [16], protože pomalejší plnění nemusí vyvolat symptomy související s močovou urgencí. Cystometrie se obvykle provádí po neinvazivním uroflowmetrickém vyšetření s měřením PVR při zavádění cystometrického katetru. Během plnění se doporučuje opakovaně vyvolat zakašlání, abychom zajistili přesný záznam tlaku ve všech snímačích a přesný výpočet tlaku detruzoru.
Během plnění se zaznamenává kapacita močového měchýře, pocity, compliance a výskyt mimovolních kontrakcí. Z klinického hlediska lze cystometrii rozdělit do dvou fází: odpověď na plnění měchýře a jímací fázi, kdy je měchýř pacienta naplněn na maximální kapacitu. Při maximální kapacitě je systém vystaven dráždivým stimulům, jako např. kašel, Valsalvův manévr a další.
Maximální kapacita vyjadřuje objem močového měchýře na konci plnění při CMG, kdy pacient pociťuje silné nucení na močení, které již nemůže dále odkládat [17]. Při měření cystometrické kapacity je nutné kromě celkového vymočeného objemu započítat rovněž objem PVR. Tento parametr je třeba rozlišovat od funkční kapacity močového měchýře, která je definována jako největší vymočený objem během třídenního zápisu do mikčního diáře, a maximální anestetické kapacity, která vyjadřuje maximální kapacitu močového měchýře během anestezie.
Pocity pacienta jsou hodnoceny dotazováním na pocit plnosti močového měchýře během plnicí fáze CMG, což samozřejmě vyžaduje vzájemnou spolupráci a důvěru mezi pacientem a vyšetřujícím lékařem. Během plnění je nutné zaznamenat následující tři senzorické vjemy: první pocit náplně močového měchýře, první nucení na močení a silné nutkání močit. Dále je třeba zdokumentovat jakékoli další vjemy, jako např. urgence nebo bolest, což nám umožní posoudit, zda pacient pociťuje normální vjemy v močovém měchýři, nebo naopak zesílené, potlačené nebo žádné vjemy.
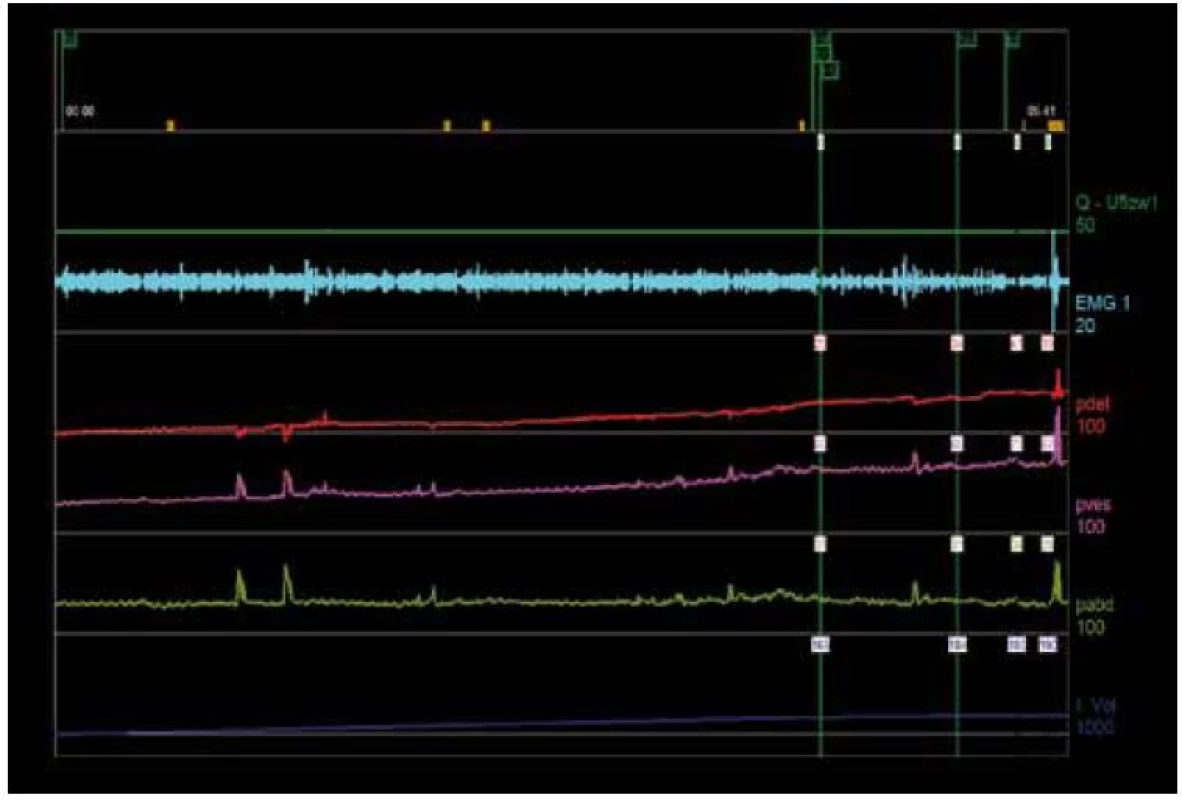
Compliance vyjadřuje vztah mezi změnou objemu močového měchýře a změnou tlaku v měchýři (∆V/∆Pdet) [1]. Během plnění by se měl objem měchýře zvětšovat při minimální nebo žádné změně Pdet. Při výpočtu compliance se užívá hodnota Pdet prázdného močového měchýře a hodnota Pdet při maximální cystometrické kapacitě. U normálního močového měchýře by compliance měla činit < 12,5 ml/cm H2O (obr. 1) [18]. Při abnormálním výsledku compliance by měl být zahájen další plnicí cyklus (při nižší rychlosti), který tento nález potvrdí pro případ, že by počáteční nízká compliance byla vyvolána suprafyziologickou rychlostí plnění měchýře.
Během plnění by měl být měchýř stabilní bez výskytu mimovolních kontrakcí. Mimovolní kontrakce svědčí o hyperaktivitě detruzoru (detrusor overactivity – DO) (obr. 2). U symptomatických pacientů (pacient si stěžuje na příhody urgence) nasvědčuje jakékoli přechodné zvýšení Pdet přítomnosti DO. DO se dále dělí na idiopatickou a neurogenní DO na základě přítomnosti nebo absence konkrétní neurologické poruchy [17]. Vzhledem k tomu, že až u 40 % pacientů s urgentní močovou inkontinencí neprokáže CMG vyšetření DO, musí si být klinický lékař vědom skutečnosti, že absence tohoto nálezu při invazivní urodynamické studii ve skutečnosti nemusí znamenat absenci klinické přítomnosti tohoto syndromu [19]. V případě výskytu nestabilních kontrakcí je nezbytné zaznamenat jejich počet, objem měchýře, při kterém se vyskytují, tlakovou amplitudu, skutečnost, zda se jedná o spontánní kontrakce nebo kontrakce vyvolané dráždivými stimuly, a zda je pacient potlačuje nebo nikoli.
Image 2. Časté neinhibované kontrakce bez výskytu urgentní močové inkontinence. 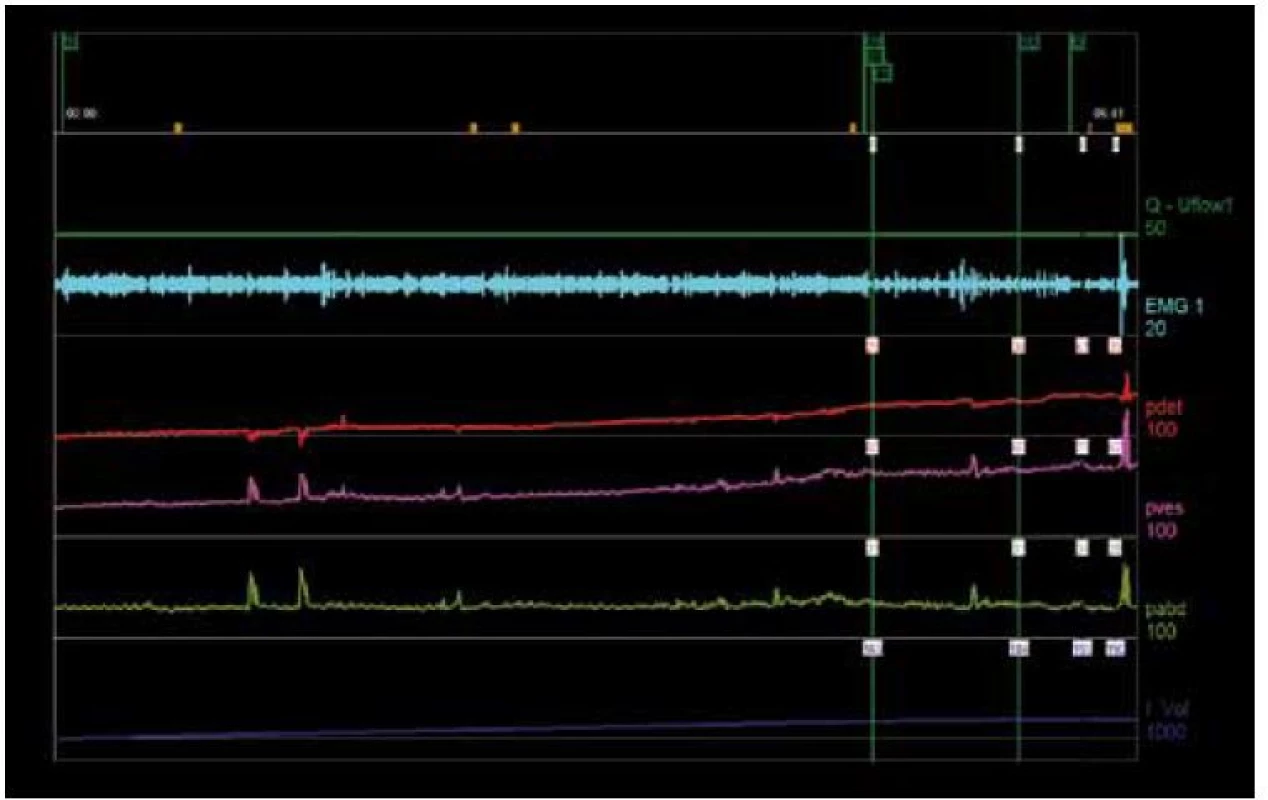
Pro mikční část CMG vyšetření je charakteristická redukce odporu v místě výtoku z močového měchýře a současný nárůst Pdet při vyprazdňování měchýře. Není neobvyklé, že až jedna třetina pacientů není schopna během urodynamického vyšetření spontánně močit, což ovšem nemusí nutně svědčit o abnormálním nálezu.
Tlakově průtoková studie
Pomocí tlakově průtokové studie (pressure flow study – PFS) se hodnotí vztah mezi Pdet a rychlostí průtoku moči při vyprazdňování. Toto vyšetření umožňuje rozlišit obstrukci od špatné kontraktility. PFS se užívá při vyšetřování mužů trpících LUTS, protože přibližně u jedné třetiny starších mužů s LUTS neprokáže urodynamické vyšetření žádné známky obstrukce [20,21]. Nízká Qmax navíc neumožňuje diagnostikovat obstrukci, protože přibližně 25–30 % pacientů s nízkou rychlostí průtoku trpí hypokontraktilitou detruzoru [22,23]. Podobně lze u pacientů s LUTS dosáhnout normální rychlosti průtoku zvýšením tlaku, což umožní překonat obstrukci [24]. Indikace PFS se doporučuje u pacientů, u nichž má výsledek vliv na volbu léčby, tj. v případě, kdy uvažujeme o operační intervenci. Dosud nebylo dosaženo konsenzu v otázce, při jakém tlaku a rychlosti průtoku lze hovořit o močové obstrukci. Muži obvykle močí při tlaku 40–60 cm H2O a ženy při nižším tlaku (obr. 3) [25]. Pro hodnocení obstrukce při PFS slouží nejrůznější nomogramy (Abrams-Griffiths [26,27], ICS [28,29] a další).
Image 3. Obstrukce výtoku z močového měchýře související s hyperaktivním močovým měchýřem. 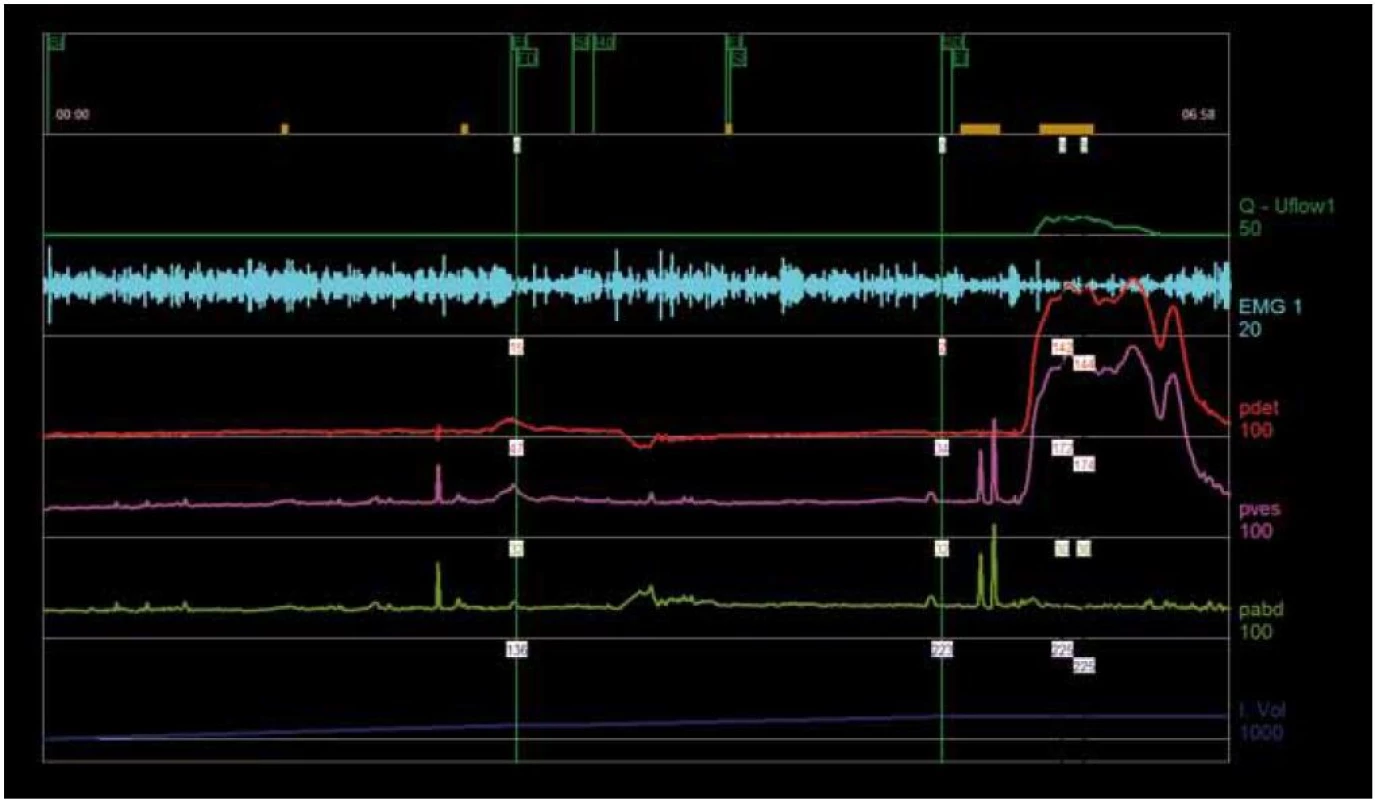
Videourodynamické vyšetření
Videourodynamické vyšetření spočívá v CMG za skiaskopické kontroly. Toto vyšetření je užitečné v případě podezření na abnormální strukturu nebo funkci dolních močových cest. Videourodynamické vyšetření může mít zásadní roli vzhledem k tomu, že PFS umožní pouze identifikovat přítomnost obstrukce, ovšem nikoli její přesnou lokalizaci, zejména u jedinců s neurologickým onemocněním, dysfunkcí hrdla močového měchýře nebo prolapsem pánevních orgánů [30–32].
Elektromyografie
Elektromyografie (electromyography – EMG) umožňuje záznam elektrického potenciálu vznikajícího při depolarizaci svalu. V rámci urodynamiky se EMG užívá pro hodnocení funkce svaloviny zevního močového svěrače a pánevního dna během plnicí, jímací i vyprazdňovací fáze. Z klinického hlediska představuje nejdůležitější informaci získanou při EMG fakt, zda mezi močovým měchýřem a zevním močovým svěračem existuje synergie nebo nikoli (obr. 4). Při EMG se zavádí jehlová elektroda do perinea (zejména do m. bulbocavernosus u mužů a superficiálního análního svěrače u žen), případně je lepicí elektroda upevněna na kůži perinea. Absence relaxace svěrače nebo úplné relaxace během mikce při EMG se považuje za abnormální výsledek [17]. U pacientů s neurologickou diagnózou (poranění míchy, roztroušená skleróza atd.) se tento stav označuje jako detruzoro-sfinkterická dyssynergie. V případě absence neurologického onemocnění bývá tento stav popisován termíny dysfunkce svaloviny pánevního dna, pseudo-dyssynergie nebo hyperaktivita pánevního dna. EMG neumožňuje od sebe tyto dva stavy odlišit, a stanovení správné diagnózy tedy vyžaduje klinické hodnocení neurologické poruchy. Artefakt EMG představuje problém, který může vzniknout v důsledku samotné urodynamické technologie, přítomnosti kabelů ve vyšetřovně, nedostatečného uzemnění pacienta, pohybu pacienta nebo obtíží při zavádění elektrod (zejména při užívání lepicích elektrod). Vzhledem k častému výskytu artefaktů autoři doporučují při EMG užívání jehlových elektrod spíše než lepicích elektrod.
Obr. 4a. Normální cystometrogram s normální detrusoro-sfinkterickou synergií. 
Obr. 4b. Detruzoro-sfinktrická dyssynergie. 
„Leak Point Pressure“
Při hodnocení funkce dolních cest močových (s ohledem na kontinenci) během urodynamického vyšetření lze měřit dva důležité tlakové údaje. „Detrusor leak point pressure“ (DLPP) je definován jako nejnižší tlak detruzoru, při němž dochází k úniku moči při současné absenci kontrakce detruzoru nebo zvýšení abdominálního tlaku. Termínem „abdominal leak point pressure“ (ALPP) se označuje intravezikální tlak, při němž dochází k úniku moči v důsledku zvýšení abdominálního tlaku při současné absenci kontrakce detruzoru [17].
Koncepce DLPP byla původně navržena pro vyšetřování pacientů se špatnou compliancí močového měchýře v důsledku myelodysplazie [33]. Tlak detruzoru je podmíněn zejména výtokovým odporem z močového měchýře [34–36]. V případě velkého odporu v místě výtoku musí být tlak v močovém měchýři (Pdet) vyšší, aby vůbec mohl pacient začít močit. Hodnota DLPP > 40 cm H2O byla stanovena jako krajní mez pro hodnocení, zda vysoký tlak v močovém měchýři vystavuje horní cesty močové riziku poškození nebo nikoli. Tato hodnota byla stanovena na základě pozorování McGuire et al, že pacientům s myelodysplazií a větším odporem v místě výtoku z močového měchýře hrozí vyšší riziko poškození horních cest močových (hydronefróza a reflux) při DLPP > 40 cm H2O [33,37]. Je třeba zdůraznit, že DLPP nepředstavuje jediný faktor indikující potenciální riziko pro horní cesty močové a že délka intervalu, po kterou zvýšený tlak překonává transport moči ureterem, má zásadní roli [33,37]. V případě prokázaného rizika poškození horních cest močových by měla být léčba zacílena na redukci odporu v močové trubici a relaxaci močového měchýře. Bylo prokázáno, že tento postup umožňuje předcházet a zvrátit nebezpečný dopad zvýšeného výtokového tlaku na complianci močového měchýře a v konečném důsledku na horní cesty močové [38–40].
ALPP41 (často označovaný rovněž jako „valsalva leak point pressure“ (VLPP)) je reprodukovatelný a užitečný parametr u inkontinentních pacientů jako prostředek pro korelaci se závažností symptomů, užíváním vložek a kvantifikací inkontinence [41–44]. Tento údaj by se měl měřit během cystometrie s měchýřem naplněným na 150–200 ml. Pacient by měl provádět Valsalvův manévr až do momentu, než dojde k úniku moči. Pokud nedojde při Pabd 100–140 cm H2O k úniku moči, pacient je vyzván k zakašlání, a pokud ani v tomto případě nedojde k úniku, měl by být měchýř naplněn více a test opakován. Při výpočtu ALPP by se měl tlak, při němž dojde k úniku moči, odčítat od počátečního tlaku, při němž se studie provádí. McGuire et al uvádí, že 81 % pacientů se stresovou močovou inkontinencí s VLPP < 60 cm H2O trpělo závažnou SUI a u 75 % pacientů prokázalo videourodynamické vyšetření nedostatečnost vnitřního svěrače, zatímco u pacientů s VLPP > 90 cm H2O byla zjištěna uretrální hypermobilita [41]. VLPP v rozmezí 60–90 cm H2O se považuje za nejednoznačný výsledek.
Závěr
Urodynamické vyšetření představuje užitečný nástroj pro hodnocení celé škály nejrůznějších klinických scénářů včetně močové inkontinence, LUTS a neurogenního močového měchýře. Výsledky dobře provedené urodynamické studie lze snadno analyzovat a na jejich základě stanovit reprodukovatelnou diagnózu. Pro dosažení kvalitního výsledku nelze více zdůraznit význam konzistentní a důkladné přípravy procedury a její monitorování ve skutečném čase přítomným lékařem. Pokud první výsledek nasvědčuje přítomnosti abnormality nebo naopak neumožňuje zodpovědět na otázky, pro které byla studie indikována, nebo v případě technických potíží znemožňujících provedení správné analýzy by měl být test opakován. Doporučujeme všechny výsledky zaznamenat okamžitě po vyšetření a před tím, než pacient opustí vyšetřovnu, abychom se ujistili o tom, že máme k dispozici všechny informace pro případ, že bude nutné vyšetření opakovat. Stručně řečeno, urodynamické vyšetření je přínosné pouze v případě, že je provedeno správně a pro vhodnou indikaci, pokud studie potvrdí symptomy, na něž si pacient stěžuje, a pokud má urolog k dispozici dostatečné vybavení pro stanovení správné diagnózy.
Assoc. Prof. Andrew C. Peterson, MD
Duke University Medical Center
Durham, NC 277 07
USA
drew.peterson@duke.edu
Sources
1. Schäfer W, Abrams P, Liao L et al. Good urodynamic practices: uroflowmetry, filling cystometry, and pressure-flow studies. Neurourol Urodyn 2002; 21(3): 261–274.
2. Nitti VW, Combs AJ. Urodynamics: when, why, and how. In: Nitti VW (ed). Practical Urodynamics. Philadelphia: Saunders 1998 : 15–26.
3. Peterson AC, Webster GD. Urodynamic and Videourodynamic Evaluation of Voiding Dysfunction. Campbell-Walsh Urology. 9th ed. Philadelphia: Saunders Elsevier 2007.
4. Winters JC, Dmochowski RR, Goldman HB et al. Urodynamic studies in adults: AUA/SUFU guideline. J Urol 2012; 188 (Suppl 6): 2464–2472. doi: 10.1016/j.juro.2012.09.081.
5. Nager CW, Brubaker L, Litman HJ et al. A randomized trial of urodynamic testing before stress-incontinence surgery. N Engl J Med 2012; 366(21): 1987–1997. doi: 10.1056/NEJMoa1113595.
6. Jorgensen JB, Jensen KM. Uroflowmetry. Urol Clin North Am 1996; 23(2): 237–242.
7. Jorgensen JB, Jensen KM, Klarskov P et al. Intraobserver and interobserver variations in classification of urinary flow curve patterns. Neurourol Urodyn 1990; 9(5): 535–539.
8. Drach GW, Ignatoff J, Layton T. Peak urinary flow rate: observations in female subjects and comparison to male subjects. J Urol 1979; 122(2): 215–219.
9. Drach GW, Layton TN, Binard WJ. Male peak urinary flow rate: relationships to volume voided and age. J Urol 1979; 122(2): 210–214.
10. Drach GW, Steinbronn DV. Clinical evaluation of patients with prostatic obstruction: correlation of flow rates with voided, residual or total bladder volume. J Urol 1986; 1 35(4): 737–740.
11. Jorgensen JB, Jensen KM, Bille-Brahe NE et al. Uroflowmetry in asymptomatic elderly males. Br J Urol 1986; 58(4): 390–395.
12. Jorgensen JB, Jensen KME, Mogensen P. Longitudinal observations on normal and abnormal voiding in men over the age of 50 years. Br J Urol 1993; 72(4): 413–420.
13. Bottaccini MR, Gleason DM. Urodynamic norms in women. I. Normals versus stress incontinents. J Urol 1980; 124(5): 659–662.
14. Susset JG, Shoukry I, Schlaeder G et al. Stress incontinence and urethral obstruction in women: value of uroflowmetry and voiding urethrography. J Urol 1974; 111(4): 504–513.
15. Nitti VW. Urodynamic and Video-urodynamic evaluation of the lower urinary tract. In: Wein AJ, Kavoussi LR, Novick AC et al (eds). Campbell-Walsh Urology. 10th ed. Philadelphia: Saunders Elsevier 2012.
16. Klevmark B. Motility of the urinary bladder in cats during filling at physiological rates. III. Spontaneous rhythmic bladder contractions in the conscious and anesthetized animal. Influence of distension and innervation. Scand J Urol Nephrol 1980; 14(3): 219–224.
17. Abrams P, Cardozo L, Fall M et al. The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub-committee of the International Continence Society. Neurourol Urodyn 2002; 21(2): 167–178.
18. Toppercer A, Tetreault JP. Compliance of the bladder: an attempt to establish normal values. Urology 1979; 14(2): 204–205.
19. McGuire EJ. Urodynamic evaluation of stress incontinence. Urol Clin North Am 1995; 22(3): 551–555.
20. Blaivas JG. Multichannel urodynamic studies in men with benign prostatic hyperplasia. Indications and interpretation. Urol Clin North Am 1990; 17(3): 543–552.
21. Abrams P. In support of pressure-flow studies for evaluating men with lower urinary tract symptoms. Urology 1994; 44(2): 153–155.
22. Rollema HJ, Van Mastrigt R. Improved indication and follow-up in transurethral resection of the prostate using the computer program CLIM: a prospective study. J Urol 1992; 148(1): 111–115.
23. Schafer W. The value of free flow rate and pressure/flow-studies in the routine investigation of BPH patients. Neurourol Urodyn 1988; 7 : 219–221.
24. Gerstenberg TC, Andersen JT, Klarskov P et al. High flow infravesical obstruction in men: symptomatology, urodynamics and the results of surgery. J Urol 1982; 127(5): 943–945.
25. Mundy AR, Stephenson TP, Wein AJ. Urodynamics: principles, practice and application. 2nd ed. Edinburgh, New York: Churchill Livingstone 1994.
26. Abrams PH, Griffiths DJ. The assessment of prostatic obstruction from urodynamic measurements and from residual urine. Br J Urol 1979; 51(2): 129–134.
27. Lim CS, Abrams P. The Abrams-Griffiths nomogram. World J Urol 1995; 13(1): 34–39.
28. Griffiths D, Hofner K, van Mastrigt R et al. Standardization of terminology of lower urinary tract function: pressure-flow studies of voiding, urethral resistance, and urethral obstruction. International Continence Society Subcommittee on Standardization of Terminology of Pressure-Flow Studies. Neurourol Urodyn 1997; 16(1): 1–18.
29. Abrams P. Bladder outlet obstruction index, bladder contractility index and bladder voiding efficiency: three simple indices to define bladder voiding function. BJU Int 1999; 84(1): 14–15.
30. McGuire EJ, Cespedes RD, Cross CA et al. Videourodynamic studies. Urol Clin North Am 1996; 23(2): 309–321.
31. McGuire EJ, Woodside JR. Diagnostic advantages of fluoroscopic monitoring during urodynamic evaluation. J Urol 1981; 125(6): 830–834.
32. Keane DP, Eckford SD, Shepherd AM et al. Urodynamic investigation in elderly women. BMJ 1993; 306(6870): 145.
33. McGuire EJ, Woodside JR, Borden TA et al. Prognostic value of urodynamic testing in myelodysplastic patients. J Urol 1981; 126(2): 205–209.
34. McGuire EJ, Cespedes RD, O’Connell HE. Leak-point pressures. Urol Clin North Am 1996; 23(2): 253–262.
35. Griffith D, Van Mastrigt R. The routine assessment of detrusor contraction strength. Neurourol Urodyn 1985; 4(2): 77–87.
36. Schaefer W. Eine physiologische methode zur beschreibung der druck/flow-beziehung während der miktion. Biomedizinische Technik/Biomedical Engineering 1976; 21(1): 11–12.
37. McGuire EJ, Woodside JR, Borden TA. Upper urinary tract deterioration in patients with myelodysplasia and detrusor hypertonia: a follow-up study. J Urol 1983; 129(4): 823–826.
38. Wang SC, McGuire EJ, Bloom DA. Urethral dilation in the management of urological complications of myelodysplasia. J Urol 1989; 142(4): 1054–1055.
39. Bloom DA, Knechtel JM, McGuire EJ. Urethral dilation improves bladder compliance in children with myelomeningocele and high leak point pressures. J Urol 1990; 144(2): 430–433.
40. Flood HD, Ritchey ML, Bloom DA et al. Outcome of reflux in children with myelodysplasia managed by bladder pressure monitoring. J Urol 1994; 152(1): 1574–1577.
41. McGuire EJ, Fitzpatrick CC, Wan J et al. Clinical assessment of urethral sphincter function. J Urol 1993; 150(1): 1452–1454.
42. Nitti VW, Combs AJ. Correlation of Valsalva leak point pressure with subjective degree of stress urinary incontinence in women. J Urol 1996; 155(1): 281–285.
43. Bump RC, Coates KW, Cundiff GW et al. Diagnosing intrinsic sphincteric deficiency: comparing urethral closure pressure, urethral axis, and Valsalva leak point pressures. AM J Obstet Gynecol 1997; 177(2): 303–310.
44. Cummings JM, Boullier JA, Parra RO et al. Leak point pressures in women with urinary stress incontinence: correlation with patient history. J Urol 1997; 157(3): 818–820.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2015 Issue 2-
All articles in this issue
- Dietologické vyšetření pacientů s ledvinnými kameny
- Vyšetřování pacientů s kalciovou litiázou
- Jak na perkutánní nefrolitotomii
- Medikamentózní léčba karcinomu močového měchýře
- Urodynamika – průběh vyšetření a indikace
- Poruchy ejakulace, sexuální apetence a orgazmu u mužů po spinálním traumatu v závislosti na rozsahu míšní léze
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Urodynamika – průběh vyšetření a indikace
- Jak na perkutánní nefrolitotomii
- Poruchy ejakulace, sexuální apetence a orgazmu u mužů po spinálním traumatu v závislosti na rozsahu míšní léze
- Vyšetřování pacientů s kalciovou litiázou
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career