-
Medical journals
- Career
Hodnocení současných trendů a kontroverzních otázek při užívání ureterálních stentů
Authors: H. B. Joshi
Published in: Urol List 2013; 11(1): 40-46
Overview
Krátkodobé zavedení stentu zůstává i nadále jednou z nejčastějších urologických intervencí. Zavedený ureterální stent však způsobuje závažné vedlejší účinky a problémy ovlivňující pacientovu kvalitu života související se zdravotním stavem (HrQOL). Dotazník, který hodnotí symptomy vyvolané ureterálním stentem (Ureteric Stent Symptoms Questionnaire – USSQ), je validovaný nástroj, pomocí něhož je možné hodnotit dopad zavedeného stentu na stav a komfort pacienta. USSQ rovněž slouží jako užitečný nástroj pro hodnocení výsledných parametrů v klinických studiích. Pro klinickou praxi jsou k dispozici nejrůznější druhy stentů. Žádné důkazy dosud neprokázaly, že by určitý výrobce poskytoval kvalitnější produkty než ostatní. Na trh jsou stále uváděny nové typy stentů a rovněž farmakoterapie, které si kladou za cíl snížení morbidity související s aplikací stentu. Tento přehled se zaměřuje na současné praktiky a problémy související s užíváním stentů a rovněž hodnotí opodstatnění pro nabízená řešení.
Klíčová slova:
ureterální, stenty, praktiky, problémy
Zavádění přechodných ureterálních stentů představuje nadále jednu z nejběžnějších urologických procedur. Ačkoli od prvního cystoskopického zavedení stentu uběhla více než čtyři desetiletí, základní principy zavádění a užívání stentů se významně nezměnily [1]. Ačkoli se stenty zavádí pro celou řadu indikací (v akutních i elektivních případech), v mnoha situacích zůstává rozporuplnou otázkou, zda je nutné stent zavádět, nebo nikoli [2]. Nejnovější pokroky v léčbě močových konkrementů mají za následek zvyšování míry indikace (a rovněž složitosti) výkonů, jako je např. ureteroskopie a rovněž počtu zaváděných stentů.
Není snadné získat údaje o roční spotřebě ureterálních stentů ve Velké Británii ani přesné údaje o jejich prodeji od jednotlivých výrobců. Velmi hrubý odhad o spotřebě stentů lze získat z databáze HES (Hospital Episode Statistics). Údaje ukazují, že v období 2011–2012 bylo ve Velké Británii užito přibližně 15 000 přechodných ureterálních stentů [3].
Je známým faktem, že navzdory běžnému užívání je zavedení stentu spojeno se závažnými komplikacemi a morbiditou, která má negativní dopad na kvalitu života související se zdravotním stavem (HrQoL) [4,5]. Komerčně dostupné stenty se liší velikostí, materiály, ale i dalšími faktory (schéma 1). Cílem navrhování nových modelů je zlepšení komfortu pacienta a zdokonalení drenáže. V souvislosti s modernizací designu stentů jsou vyvíjeny nové farmakoterapie usnadňující jejich užívání.
1. Stent s dvěma pigtaily. Materiál: Sof-Flex, C-Flex, Polyuretan, Silikon. 
2. Stent s mnohočetným zatočením, které umožňuje modifikovat celkovou délku stentu. Materiál: Sof-Flex, C-Flex, Silikon. 
3. Kwart Retro-Inject Stent. Materiál: Sof-Flex. Opět může mít modifikovatelnou délku nebo dva pigtaily. 
4. Filiform stent s dvěma pigtaily. Materiál: Sof-Flex, černý silikon. Může mít hydrofilní povrch. 
5. Filiform stent s modifikovatelnou délkou. Materiál: Flex, Silikon. Může mít hydrofilní povrch. 
6. Endoureterotomický stent. Materiál: C-Flex, Ultrathan. Pro incizi striktury – dvě různé části s různými průměry. 
7. Tail Plus Stent. Materiál: Percuflex s povrchem z hydrogelu: 3Fr zúžené zakončení pro lepší komfort pacienta. 
8. Periferní stent Towers. Materiál: C-Flex. Umožňuje lepší periferní a luminální drenáž.<br><br> Schéma 1. Příklady typů v současné době užívaných stentů a polymerů. 
Tento stručný přehled se zaměřuje na současnou klinickou praxi a problémy spojené s aplikací ureterálních stentů a vědecké metody pro kvantifikaci problémů souvisejících s jejich užíváním. Dále hodnotí současný design stentů a farmakologická řešení pro léčbu symptomů souvisejících s užíváním stentů. Náš přehled je omezen na polymerické stenty pro krátkodobé užívání.
URETERÁLNÍ STENTY: SOUČASNÉ VYUŽITÍ A PROBLÉMY
Ureterální stenty se obvykle zavádí jako prevence ureterální obstrukce a s ní spojených následků, a to jako přechodné opatření nebo jako doplněk k definitivní léčbě. Četnost zavádění stentu se zvýšila pravděpodobně díky technologickému zdokonalování ureteroskopů, které zůstávají nejčastější intervencí vyžadující zavádění přechodných stentů.
Rozhodnutí, zda po ureteroskopii zavést stent, závisí na celé řadě faktorů, jako např. litiáza (velikost, lokalizace, objem konkrementu a reziduální litiáza), faktory týkající se pacienta (anatomie, renální rezerva, sepse), faktory související s instrumentací (typ ureteroskopu, dilatace močovodu, intrakorporální litotryptor) a rovněž na peroperačních faktorech jako ureterální trauma nebo perforace. Rozhodnutí, zda po ureteroskopii zavádět stent, nebo nikoli, je tedy velmi subjektivní.
Po publikaci velké randomizované studie srovnávající ureteroskopii a Ho:YAG laserovou fragmentaci se zavedením stentu i bez něj, kterou provedli Denstedt et al [6], byl předložen závěr, že pakliže je operace bez komplikací, není rutinní zavádění stentu nutné. Podobné závěry uvádějí i další studie vycházející z nejrůznějších kazuistik. V současné klinické praxi jsou však značné rozdíly. Průzkum mezi 173 americkými urology zaměřený na postupy při ureteroskopii prokázal značné rozdíly [7]. Většina respondentů považovala tento výkon za rutinní záležitost a obvykle zaváděli stent po dilataci močovodu. 80 % lékařů uvedlo, že stent ponechá na místě po < 7 dnů. Jako nejvýznamnější problém spojený s užíváním stentů uvedlo 97,6 % respondentů snášenlivost stentu pacienty.
V jiné randomizované studii Djaladt et al [8] hodnotí výsledky u 109 pacientů, kteří podstoupili ureteroskopii se zavedením stentu i bez něj bez jakýchkoli komplikací. Autoři studie dospěli k závěru, že krátkodobé zavedení stentu po ureteroskopii je užitečné.
Tanriverdi et al [9] ve své studii retrospektivně hodnotí 23 z celkem 276 pacientů, kteří podstoupili nekomplikovanou URS, a u nichž bylo 24 hod po výkonu nezbytné akutní zavedení stentu z důvodu nesnesitelné bolesti. Autoři definovali několik rizikových faktorů, kdy je operační zavedení stentu užitečné. Tyto faktory zahrnují delší operaci, opakovaný přístup do močovodu, léčbu velkého konkrementu, zaklíněné konkrementy a otok ureterální stěny, ponechané konkrementy v kalichu a v nedávné době prodělanou UTI. Autoři dospěli k závěru, že zavedení stentu po dobu alespoň 24 hod po ureteroskopii přinese s velkou pravděpodobností užitek.
V roce 2007 byl v BMJ publikován systematický přehled a metaanalýza studií zkoumajících výsledný stav po zavedení stentu u pacientů po nekomplikované ureteroskopii [2]. Přehled zahrnoval celkem devět randomizovaných kontrolovaných studií (831 pacientů). Výsledky prokázaly, že incidence LUTS, jako např. dysurie, frekvence a urgence, je významně vyšší u pacientů se zavedeným stentem. Analýza neprokázala žádné významné rozdíly s ohledem na pooperační požadavky na analgetika, výskyt infekce močových cest, SFR (míru odstranění litiázy) ani vznik ureterální striktury. Analýza rovněž prokázala menší četnost neplánovaných návštěv lékaře a další hospitalizace u pacientů, kterým byl zaveden stent. Výsledky cenové analýzy ve třech randomizovaných kontrolovaných studiích ukazovaly ve prospěch výkonů bez zavedení stentu. Tyto studie však měly významné nedostatky. Žádná ze studií totiž nezohledňuje kvalitu života související se zdravotním stavem, což je velmi důležitý výsledný parametr. Výše zmiňované studie byly celkově nekvalitní a způsob zaznamenávání výsledků nekonzistentní. Vzhledem k významné nesourodosti a nekvalitnímu způsobu zaznamenávání výsledků v těchto studiích zůstává role stentů při léčbě pacientů po nekomplikované ureteroskopii dle očekávání nadále nejasná.
Už sám termín „nekomplikovaná ureteroskopie“ nebyl dosud dostatečně standardizován. Hodnocení řady rizikových faktorů tedy nadále zůstává subjektivní. Pro standardizaci zavádění ureterálních stentů po ureteroskopii je tedy nezbytné provedení kvalitních studií, které budou zahrnovat i hodnocení výsledného stavu samotnými pacienty.
URETERÁLNÍ STENTY – DALŠÍ KLINICKÉ PROBLÉMY
Enkrustace stentu představuje častý jev, který je pozorován po vyjmutí stentu. Řada studií zkoumá délku zavedení stentu, výskyt enkrustace, zabarvení stentu a vznik biofilmu [10–12]. Je třeba zdůraznit, že role enkrustace v rámci symptomů souvisejících se stentem nebyla dosud dostatečně definována. Na rychlosti a rozsahu enkrustace se podílí řada faktorů. Žádný ze současně dostupných stentů nenabízí klinický benefit s ohledem na tvorbu enkrustace nebo biofilmu. Ačkoli je obtížné stanovit přesnou dobu, stent by měl být odstraněn co možná nejdříve a každou situaci je třeba posuzovat individuálně.
Zapomenutý stent – stent ponechaný na místě delší dobu, než je nezbytné, bude s velkou pravděpodobností zdrojem problémů. Odstranění stentu v tomto případě bude obtížné a bude vyžadovat provedení další intervence [13]. Pro včasné odstranění stentu byla navržena řada řešení jako např. databáze stentů, upomínka prostřednictvím PC/e-mailu nebo mobilního telefonu [14]. Abychom předcházeli těmto komplikacím, je třeba vyvinout takovou metodu, která bude vyhovovat jednotlivým zdravotním systémům.
URETERÁLNÍ STENTY: HODNOCENÍ SYMPTOMŮ A HRQOL
Spolu se zvyšující se frekvencí užívání stentů začalo být zřejmé, že je jejich aplikace spojena s významnými vedlejšími účinky. Pro porozumění symptomům souvisejícím s užíváním stentů a nalezení odpovídajících řešení je nezbytné objektivní hodnocení subjektivních symptomů. Touto otázkou se detailně zabývají Joshi et al. Na základě moderních sociologických metod byl vytvořen validovaný dotazník pro hodnocení symptomů souvisejících se zaváděním stentu – Ureteric Stent Symptom Questionnaire (USSQ) [15]. Výzkum prokázal, že zavedený stent významně ovlivňuje fyzický i psychický stav pacienta a má negativní dopad na funkční i pracovní schopnosti [5]. Pomocí tohoto instrumentu byla poprvé definována „zkušenost se zavedením stentu“ (stent experience), složitý komplex negativních zkušeností pro pacienta.
Výsledky validačních studií ukazují, že 78 % pacientů se zavedeným stentem si stěžovalo na obtížné močové symptomy (symptomy spojené s jímáním moči, inkontinenci a hematurii) a 80 % pacientů uvádělo bolest narušující každodenní činnosti. 78 % pacientů uvádí zhoršenou pracovní schopnost s negativními ekonomickými důsledky, 32 % pacientů si stěžuje na sexuální dysfunkci a celkem 80 % pacientů popisovalo zhoršení kvality života se stentem in situ.
Od první publikace dotazníku USSQ v roce 2003 byla provedena řada kulturních a lingvistických úprav v různých jazycích (pro Německo, Itálii, Francii, Koreu, Japonsko atd.). USSQ byl využit jako nástroj pro hodnocení primárního výsledku v mnoha studiích zabývajících se ureterálními stenty a zůstává i nadále spolehlivým měřítkem pro hodnocení různých intervencí pro výzkumné účely.
ŘEŠENÍ PRO ZLEPŠENÍ SNÁŠENLIVOSTI ZAVEDENÉHO STENTU PACIENTEM – VÝZNAM MODIFIKACÍ V DESIGNU STENTŮ (TECHNICKÁ ŘEŠENÍ) A FARMAKOLOGICKÁ ŘEŠENÍ
Ve snaze zlepšit snášenlivost stentu a zdokonalit drenáž přicházejí výrobci neustále s novými řešeními. Tyto modifikace lze klasifikovat do dvou skupin: modifikace designu stentu (technická řešení) a aplikace farmak pro úlevu symptomů vyvolaných zavedením stentu.
FYZIKÁLNÍ VLASTNOSTI STENTŮ A TECHNICKÁ ŘEŠENÍ
Výrobci se zaměřují na nejrůznější parametry, jež mohou ovlivňovat výskyt symptomů souvisejících se zavedeným stentem, jako např. materiál stentu (polymery), jeho průměr, délka nebo tvar. Byly navrženy stenty, které se po zavedení zcela rozpustí [16], stenty s nejrůznějšími povrchy, jako např. heparin [17], nebo stenty vylučující určitá farmaka [18]. Dosud byla provedena řada studií pokoušejících se identifikovat ideální materiál, velikost a tvar stentu, ovšem bez průkazných závěrů (tab. 1).
Table 1. Studie, které hodnotí fyzikální vlastnosti stentů (technické aspekty). 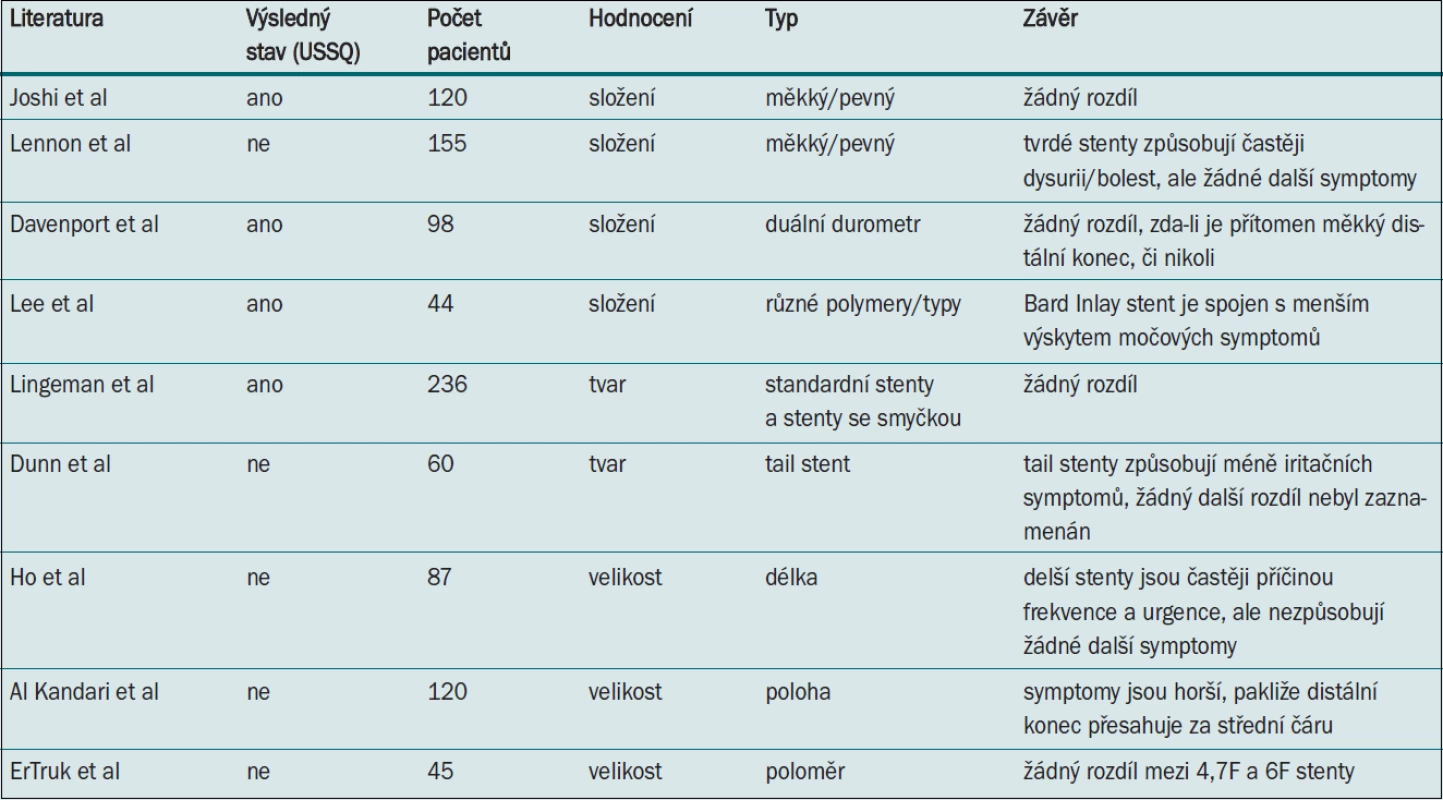
Materiál
Beiko et al [19] hodnotí design a vlastnosti několika druhů stentů. Většina moderních stentů je vyrobena z polymerů chráněných vlastnickými právy jako např. C-flex, Percuflex a Sof-Flex. Dalším běžně užívaným materiálem je polyuretan. V současné době se pozornost zaměřuje na výrobu stentů z několika druhů polymerů nebo polymerů v kombinaci s inertními kovy.
Složení stentu
Předpokládá se, že ureterální stenty z měkčích biomateriálů jsou pacienty lépe snášeny než stenty z tvrdších materiálů. Lennon et al [20] srovnávali stenty z „tvrdého“ polyuretanu a „měkké“ hydrofilní stenty z materiálu Sof-FlexTM pomocí nevalidovaného symptom skóre. Výsledky prokázaly významně vyšší incidenci dysurie, bolesti v ledvině a suprapubické oblasti u pacientů se stenty z tvrdších materiálů a naopak žádný významný rozdíl v incidenci urgence, frekvence, nykturie nebo hematurie. Výsledky nasvědčují tomu, že snášenlivost stentu pacienty souvisí s měkkostí materiálu, z něhož je stent vyroben.
Joshi et al [21] v prospektivní randomizované jednoduše zaslepené studii srovnávají na základě USSQ dva typy stentů – stent Percuflex® z tvrdého polymeru a stent Contour® z měkkého polymeru. Tyto dva stenty se liší pouze svou tvrdostí (měřeno pomocí durometru) bez významných odlišností v designu. Autoři neprokázali žádné rozdíly v žádném z aspektů kvality života pacienta související se zdravotním stavem a dospěli k závěru, že samotné složení stentu nemá žádný vliv na komfort pacienta se zavedeným stentem.
Davenport et al [22] srovnávali výsledky uváděné samotnými pacienty pomocí USSQ s cílem stanovit, zda je duální durometr stent Polaris™ pacienty lépe snášen než standardní stent Bard Inlay™. Autoři neshledali mezi těmito dvěma typy žádné rozdíly v žádném z hodnocených parametrů. Lee et al [23] hodnotí u 44 pacientů pět různých stentů, o nichž jejich výrobci tvrdí, že jsou spojeny s nejmenším dyskomfortem. Autoři dospěli k závěru, že Inlay stent (Bard) je spojen s výskytem méně závažných močových symptomů a hematurie než další čtyři stenty. Autoři studie využívali USSQ, ale studie neměla dostatečnou sílu pro statistické zhodnocení.
El-Nahas et al [24] srovnávali silikonový stent Porges a ureterální stent Percuflex (Boston Scientific) u sta pacientů a neprokázali mezi těmito dvěma stenty žádný statisticky významný rozdíl v morbiditě.
S ohledem na výskyt vedlejších účinků tedy nebyl u žádného konkrétního polymeru prokázán zřejmý benefit. Mezi stenty srovnatelné tvrdosti pacienti nemusejí vůbec zaznamenat žádný rozdíl.
Velikost – průměr a délka
Velikost stentu lze modifikovat změnou průměru či délky stentu. Erturk et al [25] srovnávali v randomizované jednoduše zaslepené studii (n = 45) snášenlivost dvou Bard Inlay ureterálních stentů s různými průměry (4,7F a 6F) pomocí nevalidovaného dotazníku. Mezi oběma skupinami nebyly zaznamenány žádné významné rozdíly, ačkoli u pacientů se 6F stentem byla pozorována tendence vyššího skóre v doménách bolestivosti a iritačních symptomů a méně častá migrace stentu.
Ho et al [26] srovnávali pomocí nevalidovaného dotazníku konfiguraci (stenty o délce 22, 24 a 26 cm) stentu a výskyt souvisejících symptomů (n = 87). Analýza prokázala, že užívání delších stentů je spojeno s významně vyšší incidencí a závažností frekvence a urgence močení. Naopak s ohledem na incidenci a závažnost nykturie, hematurie ani bolesti v močovém měchýři/boku nebyl zaznamenán žádný rozdíl [16]. V podobné studii Al-Kandari et al [27] na základě jednoduchého dotazníku srovnávají vliv umístění proximálních a distálních konců stentu (n = 120). Autoři dospěli k závěru, že morbidita spojená s aplikací stentu nezávisí na umístění jeho proximálního konce (ledvinná pánvička vs horní kalich), ale úzce souvisí s umístěním distálního konce. Symptomy byly horší, pokud stent zasahoval přes střední čáru.
Stenty překračující střední čáru tedy mohou vyvolávat závažnější symptomy, ale nemáme k dispozici žádné zjevné důkazy o tom, že by menší průměr stentu byl spojen s menším výskytem symptomů.
Tvar
Dunn et al [28] v jednoduše zaslepené studii využívající nevalidovaný dotazník prokázali, že zúžený (Tail) stent (proximálně 7F a distálně 3F) vyvolává významně méně iritujících mikčních symptomů než standardní 7F stent s dvěma pigtaily. Autoři neshledali jiné rozdíly.
V prospektivní multicentrické studii zahrnující čtyři větve hodnotí Lingeman et al [29] komfort pacientů při užívání moderních stentů – stentů s krátkou (SLT) a dlouhou smyčkou (LLT), které ponechávají méně materiálu v močovém měchýři, a dvou kontrolních stentů – Polaris™ a Percuflex Plus® (Boston Scientific). Autoři nezaznamenali žádný významný rozdíl v parametrech dotazníku USSQ u pacientů, jimž byl zaveden SLT stent, ačkoli zde byla zaznamenána tendence nižších skóre v doméně bolestivosti a menší spotřeba analgetik než u pacientů, jimž byl zaveden standardní stent.
Nemáme tedy konzistentní důkazy, že by měl tvar stentu dopad na související symptomy.
Nové designy stentu
Jedním z pokusů, jak zachovat drenáž při současné minimalizaci iritačních symptomů, bylo vyvinutí lehkého, samoexpandujícího síťového stentu. Olweny et al [30] na modelu prasete srovnávali reakci tkáně a vlastnosti průtoku síťového stentu a standardního 7F polyuretanového stentu s dvěma pigtaily. Aplikace síťového stentu byla spojena s menším výskytem zánětu a zároveň umožňovala rychlejší průtok (první i šestý týden), ačkoli rozdíl nebyl statisticky významný. Tento typ stentu však dosud nebyl testován v žádné klinické studii. V nedávné době byly vyvinuty ureterální stenty z biologicky vstřebatelných a rozpustných materiálů s cílem eliminovat potřebu jejich cystoskopického odstranění. Lingeman et al [18] v multicentrické klinické studii II. fáze prokázali bezpečnost a účinnost přechodných ureterálních stentů (TUDS). 90 % stentů se dle očekávání rozpustilo po střední době osm dnů a 89 % pacientů bylo s TUDS spokojeno. Bude třeba provedení větších klinických studií a dalších modifikací, abychom zjistili, zda tato technologie najde širší uplatnění.
Byla vyzkoušena řada dalších nových designů, které se nedočkaly širšího přijetí, jako např. Buoy Stent [31], 3F MicroStent s moderním ukotvovacím mechanizmem [32] nebo stenty s chlopní [33].
Závěrem lze říci, že byla vyvinuta značná snaha vyrobit a testovat stenty nejrůznějších velikostí, tvarů a materiálů. Změna vlastností stentů, jako např. zavedení polymerových stentů, však neměla významný dopad na komfort/dyskomfort pacientů. V tomto ohledu nenabízí žádný ze v současné době dostupných stentů benefit oproti ostatním.
STUDIE ZAMĚŘUJÍCÍ SE NA FARMAKOLOGICKÁ ŘEŠENÍ A HRQOL
Pro úlevu symptomů souvisejících se zaváděním stentů bylo navrhováno několik typů farmak jako např. nesteroidní protizánětlivé preparáty, narkotika, anticholinergika, perorální analgetika nebo alfa-blokátory. Tyto medikamenty jsou aplikovány lokálně/topicky nebo systémově (tab. 2).
Table 2. Studie testující farmakoterapii. 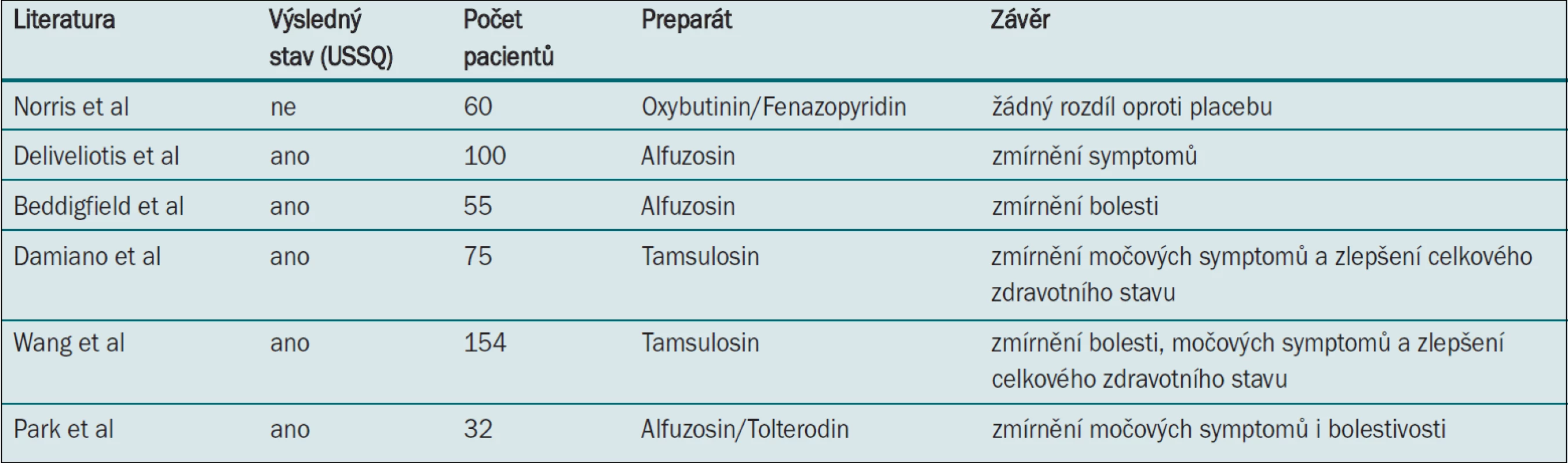
Lokální agens
Bylo prokázáno, že aplikace tří injekcí botulotoxinu A kolem ústí močovodu významně zmírňuje pooperační bolestivost a snižuje nároky na aplikaci narkotik, nevede však ke zlepšení iritačních symptomů [34]. Beiko et al hodnotí výsledky intravezikální aplikace lidokainu, anticholinergik, ketorolacu a normálního fyziologického roztoku. Autoři zjistili, že hodinu po intravezikálním podání ketorolacu dochází ke zlepšení symptomů [35]. Žádné z výše uváděných farmak si však nenašlo cestu do běžné klinické praxe.
Systémové preparáty
Anticholinergika
Norris et al [36] srovnávají v prospektivní, randomizované, dvojitě zaslepené, placebem kontrolované studii pomocí nevalidovaného symptom skóre účinnost oxybutyninu (anticholinergika) s postupným uvolňováním, s fenazopyridinem (perorálním topickým analgetikem) a placebem v rámci úlevy dyskomfortu vyvolaného aplikací stentu u 60 pacientů. Aplikace oxybutyninu ani fenazopyridinu se s ohledem na úlevu symptomů nijak nelišila od placeba (ačkoli tato studie neměla dostatečnou statistickou průkaznost).
Alfablokátory v kombinaci s anticholinergiky i bez nich
Deliveliotis et al předkládají hypotézu, že selektivní alfablokátory běžně užívané při léčbě symptomů dolních cest močových u mužů mohou zmírňovat symptomy související s aplikací stentu [37]. Nejúčinnější metodou relaxace hladké svaloviny močovodu je antagonismus alfa-adrenoreceptoru, jenž také posloužil jako impuls pro využití alfablokátorů v rámci zmírnění symptomů souvisejících se stenty [38]. Deliveliotos et al [37] v randomizované studii srovnávající alfuzosin s placebem pomocí USSQ prokázali, že aplikace selektivního alfa-1-blokátoru, jako je např. alfuzosin, zmírňuje močové symptomy a bolestivost. Dále prokázali, že tato léčba umožňuje lépe zachovat pacientovu sexuální funkci i celkový zdravotní stav. Další prospektivní randomizované studie pak srovnávají nejrůznější alfablokátory (s dalšími preparáty i bez nich jako např. anticholinergika) (tab. 2) [39–42]. Tyto studie prokazují konzistentní klinické zmírnění řady symptomů souvisejících s aplikací stentu.
V nedávné době byly publikovány dva systematické přehledy a metaanalýzy, jež hodnotí roli alfablokátorů v rámci léčby symptomů souvisejících s aplikací stentů u 450 pacientů, kteří užívali alfablokátory v pěti randomizovaných studiích [43,44]. Autoři (Yakoubi et al) prokázali u pacientů užívajících alfablokátory významné zmírnění močových symptomů, bolesti a potenciální zlepšení celkového zdravotního stavu (ve srovnání s placebem). Tato léčba však neměla významný vliv na počet dnů pracovní neschopnosti ani na sexuální funkci. Tato studie má nedostatky v podobě nesourodých typů stentů, intervencí i metodologií hodnocení. Autoři obou studií přesto dospěli k závěru, že léčba vedla k statisticky i klinicky významné redukci symptomů i bolestivosti a doporučují alfablokátory pro klinickou praxi.
Narozdíl od předchozích studií, které se zabývaly technickými aspekty stentů, prokazují tyto studie jasný a konzistentní benefit aplikace alfablokátorů u pacientů se zavedeným ureterálním stentem. Některé údaje nasvědčují tomu, že kombinace alfablokátorů s anticholinergiky může přinášet ještě větší benefit než samotná aplikace alfablokátorů.
Stenty vylučující medikamenty
Cílem tohoto typu stentů je úleva symptomů, zkušenosti s tímto typem drenáže jsou však teprve v počátcích. Dosud byla popsána aplikace dvou stentů s povrchem napuštěným medikamenty – Ketorolacem (Krambeck et al [45]) a triclosanem (Mendez-Probst et al [18]). Výsledky však dosud neprokázaly definitivní klinický benefit. Dosud nebyla definována ani pravidla a mechanizmy pro kontrolované užívání tohoto typu stentů. Na tomto potenciálně přínosném vybavení pracuje v současné době několik výzkumných skupin včetně vědců z Cardiffu. Aplikace alfablokátorů vykazuje nejkonzistentnější výsledky s ohledem na zmírnění dyskomfortu u pacientů se zavedeným stentem.
Poučení pacienta: je třeba zdůraznit, že adekvátní poučení pacienta představuje nedílnou součást procesu společného rozhodování a to platí zejména v případě intervenčních procedur. Poskytování ověřených informací má v tomto procesu nesmírnou roli [46].
ZÁVĚR
Ureterální stenty jsou zdrojem významných vedlejších účinků. Indikace pro zavedení stentu, zejména po ureteroskopii, zůstávají nadále subjektivní a rozporuplné. Snaha o redukci symptomů a vyvinutí ideálního stentu je předmětem řady studií. Bylo prokázáno, že některé třídy perorálních preparátů, jako např. alfablokátory s anticholinergiky, nebo bez nich, zmírňují dyskomfort spojený s užíváním stentu. Je třeba kvalitního výzkumu, který bude zohledňovat výsledky uváděné samotnými pacienty a umožní nám lépe porozumět všem aspektům dopadu stentu na pacienty a výrobcům vyvinout ideální stent.
Adresa pro korespondenci:
H. B. Joshi, MD
Professor
Consultant Urological Surgeon and Honorary Clinical Teacher
Department of Urology
University Hospital of Wales
Heath Park
Cardiff CF14 0TN
hrishi.joshi@wales.nhs.uk
Sources
1. Zimskind PD, Fetter TR, Wilkerson JL. Clinical use of long-term indwelling silicone rubber ureteral splints inserted cystoscopically. J Urol 1967; 97(5): 840–844.
2. Nabi G, Cook J, N'Dow J et al. Outcomes of stenting after uncomplicated ureteroscopy: systematic review and meta-analysis. BMJ 2007; 334(7593): 572.
3. www.hesonline.nhs.uk – Hospital Episode Statistics HES online, NHS information centre.
4. Tolley D. Ureteric stents, far from ideal. Lancet 2000; 356(9233): 872–873.
5. Joshi HB, Stainthorpe A, MacDonagh RP et al. Indwelling ureteral stents: evaluation of symptoms, quality of life and utility. J Urol 2003; 169(3): 1065–1069.
6. Denstedt JD, Wollin TA, Sofer M et al. A prospective randomized controlled trial comparing nonstented versus stented ureteroscopic lithotripsy. J Urol 2001; 165(5): 1419–1422.
7. Auge BK, Sarvis JA, L'esperance JO et al. Practice patterns of ureteral stenting after routine ureteroscopic stone surgery: a survey of practicing urologists. J Endourol 2007; 21(11): 1287–1291.
8. Djaladat H, Tajik P, Payandemehr P et al. Ureteral catheterization in uncomplicated ureterolithotripsy: a randomized, controlled trial. Eur Urol 2007; 52(3): 836–841.
9. Tanriverdi O, Yencilek F, Sarica K. Emergent stenting after uncomplicated ureteroscopy: evaluation of 23 patients Urology 2011; 77(2): 305–308.
10. Kawahara T, Ito H, Terao H et al. Ureteral stent encrustation, incrustation and colouring: morbidity related to indwelling times. J Endourol 2012; 26(2): 178–182.
11. Joshi HB. Ureteral stent encrustation, incrustation and colouring: morbidity related to indwelling times J Endourology 2012; 26(7): 924–925.
12. Canales BK, Higgins L, Markowski T et al. Presence of five conditioning film proteins are highly associated with early stent encrustation. J Endourol 2009; 23(9): 1437–1442.
13. Vanderbrink BA, Rastinehad AR, Ost MC et al. Encrusted urinary stents: evaluation and endourologic management. J Endourol 2008; 22(5): 905–912.
14. Sancaktutar AA, Tepeler A, Söylemez H et al. A solution for medical and legal problems arising from forgotten ureteral stents: initial results from a reminder short message service (SMS). Urol Res 2012; 40(3): 253–258.
15. Joshi HB, Newns N, Stainthorpe A et al. Ureteral Stent Symptom Questionnaire: Development and validation of a multidimensional quality of life measure. J Urol 2003; 169(3): 1060–1064.
16. Lingeman JE, Preminger GM, Segura JW et al. Use of a temporary ureteral drainage stent (TUDS) after uncomplicated ureteroscopy. J Urol 2003; 169(5): 1682–1688.
17. Tenke P, Riedl CR, Jones GL et al. Bacterial biofilm formation on urologic devices and heparin coating as preventive strategy. Int J Antimicrob Agents 2004; 23 (Suppl 1): S67–74.
18. Carlos E, Mendez-Probst LW, Goneau KW et al. The use of Triclosan eluting stents effectively reduces ureteral stents symptoms: a prospective randomized trial. BJU Int 2012; 110(5): 749–754.
19. Beiko BT, Knudsen BE, Denstedt JD. Advances in ureteral stent design. J Endourol 2003; 17(4): 195–199.
20. Lennon GM, Thornhill JA, Sweeney PA et al. ‘Firm’ versus ‘soft’ double pigtail ureteric stents: a randomised blind comparative trial. Eur Urol 1995; 28(1): 1–5.
21. Joshi HB, Chitale SV, Nagarajan M et al. A prospective randomized single-blind comparison of ureteral stents composed of firm and soft polymer. J Urol 2005; 174(6): 2303–2306.
22. Davenport K, Kumar V, Collins J et al. Prospective randomized trial the Bard Inlay ureteric stent with the Boston Scientific Polaris stent using the validated ureteric stent symptom questionnaire. BJU Int 2008; 101(5): 52.
23. Lee C, Kuskowski M, Premoli J et al. Randomized evaluation of ureteral stents using validated symptom questionnaire. J Endourol 2005; 19(8): 990–993.
24. El-Nahas AR, El-Assmy AM, Shoma AM et al. Self-retaining ureteral stents: Analysis of factors responsible for patient discomfort. J Endourol 2006; 20(1): 33–37.
25. Erturk E, Sessions A, Joseph JV. The impact of ureteral stent diameter and symptoms on tolerability. J Endourol 2003; 17(2): 59–62.
26. Ho CH, Chen SC, Chung SD et al. Determining the appropriate length of a double-pigtail ureteral stent by both stent configurations and related symptoms. J Endourol 2008; 22(7): 1427–1431.
27. Al-Kandari AM, Al-Shaiji TF, Shaaban H et al. Effects of proximal and distal ends of double-J ureteral stent position on post procedural symptoms and quality of life: a randomized clinical trial. J Endourol 2007; 21(7): 698–702.
28. Dunn MD, Portis AJ, Kahn SA et al. Clinical effectiveness of new stent design: Randomized single-blind comparison of tail and double pigtail stents. J Endourol 2000; 14(2): 195–202.
29. Lingeman JE, Preminger GM, Goldfischer ER et al. Assessing the Impact of Ureteral Stent Design on Patient Comfort. J Urol 2009; 181(6): 2581–2587.
30. Olweny EO, Portis AJ, Sundaram CP et al. Evaluation of a chronic indwelling prototype mesh ureteral stent in a porcine model. Urology 2000; 56(5): 857–862.
31. Krebs A, Deane LA, Borin JF et al. The 'buoy' stent: evaluation of a prototype indwelling ureteric stent in a porcine model. BJU Int 2009; 104(1): 88–89.
32. Lange D, Hoag NA, Poh BK et al. Drainage characteristics of the 3F MicroStent using a novel film occlusion anchoring mechanism. J Endourol 2011; 25(6): 1051–1056.
33. Ecke TH, Bartel P, Hallmann S et al. Evaluation of symptoms and patients' comfort for JJ-ureteral stents with and without antireflux-membrane valve. J Urology 2010; 75(1): 212–216.
34. Gupta M, Patel T, Xavier K et al. Prospective randomized evaluation of periureteral botulinum toxin type A injection for ureteral stent pain reduction. J Urol 2010; 183(2): 598–602.
35. Beiko DT, Watterson JD, Knudsen BE et al. Double-blind randomized controlled trial assessing the safety and efficacy of intravesical agents for ureteral stent symptoms after extracorporeal shock-wave lithotripsy. J Endourol 2004; 18(8): 723–730.
36. Norris RD, Sur RL, Springhart WP et al. A prospective, randomized, double-blinded placebo-controlled comparison of extended release oxybutinin versus phenazopyridine for the management of postoperative ureteral stent discomfort. Urology 2008; 71(5): 792–795.
37. Deliveliotis C, Chrisofos M, Gougousis E et al. Is there a role for alpha1-blockers in treating double-J stent-related symptoms? Urology 2006; 67(1): 35–39.
38. Davenport K, Keeley FX Jr., Timoney AG. A comparative in vitro study to determine the beneficial effect of calcium-channel and alpha (1)-adrenoceptor antagonism on human ureteric activity. BJU Int 2006; 98(3): 651–655.
39. Beddingfield R, Pedro RN, Hinck B et al. Alfuzosin to releave ureteral stent discomfort: A prospective, randomized, placebo controlled study. J Urol 2009; 181(1): 170–176.
40. Damiano R, Autorino R, de Sio M et al. Effect of tamsulosin in preventing ureteral stent-related morbidity: A prospective study. J Endourol 2008; 22(4): 651–656.
41. Wang CJ, Huang SW, Chang CH. Effects of specific alpha-1A/1D blocker on lower urinary tract symptoms due to double-J stent: A prospectively randomized study. Urol Res 2009; 37(3): 147–152.
42. Park SC, Jung SW, Lee JW et al. The effects of tolterodine extended release and alfuzosin for the treatment of double-j stent-related symptoms. J Endourol 2009; 23(11): 1913–1917.
43. Alastair D, Lamb, Sarah L et al. Wiseman: Meta-analysis showing the beneficial effect of blockers on ureteric stent discomfort BJU Int 2011; 10(8): 1894–1902.
44. Yakoubi R, Lemdani M, Monga M et al. Is There a Role for alpha-Blockers in Ureteral Stent Related Symptoms? A Systematic Review and Meta-Analysis: J Urol 2011; 186(3): 928–934.
45. Krambeck AE, Walsh RS, Denstedt JD et al. A novel drug eluting ureteral stent: a prospective, randomized, multicenter clinical trial to evaluate the safety and effectiveness of a ketorolac loaded ureteral stent. J Urol 2010; 183(3): 1037–1042.
46. Joshi HB, Newns N, Stainthorpe A et al. The development and validation of a patient-information booklet on ureteric stents. BJU Int 2001; 88(4): 329–334.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2013 Issue 1-
All articles in this issue
- Využití inhibitorů fosfodiesterázy v urologii při léčbě erektilní dysfunkce
- Tadalafil v léčbě LUTS/BPH a ED
- Léčba zanořeného penisu
- Varikokéla a smysl jejího řešení
- Laparoskopická nefrektomie při léčbě atrofické ledviny postižené vážnou infekcí
- Simultánní ipsilaterální nefrektomie a transplantace ledviny u pacientů s polycystickým onemocněním ledviny
- Retroperitoneální laparoskopická nefrektomie u pacientů léčených pomocí peritoneální dialýzy
- Předběžné výsledky transperitoneální laparoendoskopické radikální nefrektomie s užitím improvizovaného čínského zařízení s jedním portem
- Hodnocení současných trendů a kontroverzních otázek při užívání ureterálních stentů
- Vede časná ESWL po PCNL k uvíznutí konkrementů v přístupovém kanále? Mýtus nebo skutečnost
- Preference pacientů pro pokročilé urologické techniky: vodítko pro budoucí vývoj chirugické léčby?
- Bipolární plazmatická vaporizace prostaty při léčbě symptomatického zvětšení prostaty: klinické výsledky po dvou letech sledování
- Pohlavie ako faktor ovplyvňujúci klinicko-patologické ukazovatele a prognózu karcinómu obličky
- Guidelines EAU pro léčbu zakřivení penisu
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba zanořeného penisu
- Varikokéla a smysl jejího řešení
- Guidelines EAU pro léčbu zakřivení penisu
- Hodnocení současných trendů a kontroverzních otázek při užívání ureterálních stentů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

