-
Medical journals
- Career
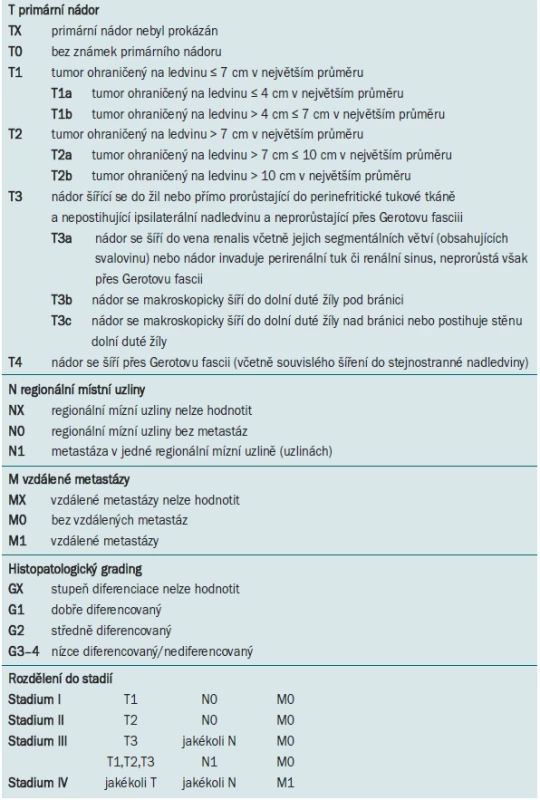
Lokalizované nádory ledvin, epidemiologie, etiologie, chirurgická léčba, operační postupy a jejich indikace, role lymfadenektomie
Authors: P. Filipenský; P. Řehořek; Z. Oplatek; R. Hrabec; M. Krechlerová
Published in: Urol List 2012; 10(3): 24-28
Overview
Adenokarcinom ledviny [1] tvoří asi 3 % maligních tumorů zjištěných v dospělé české populaci. Detekované metastázy v okamžiku stanovení diagnozy má asi 20 % pacientů [2]. Oboustranné nádory ledvin se vyskytují asi u 10 % pacientů. Adenokarcinom ledviny se vyskytuje asi 1,5× častěji u mužů [2]. Dostupnost ultrazvukového vyšetření zvýšila počet nemocných s diagnostikovaným jinak klinicky asymptomatickým nádorem ledviny. Je nezbytné zdůraznit, že včasná diagnostika a léčba karcinomu ledviny zvyšují šanci na vyléčení pacienta. Jestliže je onemocnění zjištěno časně, je CSS (Cancer Specific Survival) mezi 79 a 100 %. Asi 85–92 % expanzivních procesů ledvin jsou maligní, nejčastějším představitelem této skupiny je konvenční renální karcinom (RCC) asi 90 %, jejich primárním buněčným základem jsou buňky proximálního tubulu [10]. Základem pro klasifikaci nádoru ledvin je TNM klasifikace z roku 2004 a patologická klasifikace vychází z Heidelbergské klasifikace renálních neoplazmat (1997).
Klíčová slova:
nádor ledvinyre, sekce ledviny, nefrektomieRIZIKOVÉ FAKTORY
Rizikové faktory nádorů ledvin lze rozdělit na familiární, endogenní a exognenní [10].
Familiární jsou nemoc von Hippel--Lindau, tuberózní skleróza, konstitucionální translokace chromozomu 3, familiární renální karcinom bez identifikace genetického podkladu, Birt-Hogg-Dubé.
Endogenními rizikovými faktory jsou obezita, diabetes, hypertenze, chronická renální insuficience (s nutností, či bez nutnosti HD), výskyt mnohočetných cystických lézí ledvin.
Exogenními rizikovými faktory jsou abúzus analgetika na bázi fenacetinu, kouření, práce s azbestem, chronická iradiace a práce v kožařském a obuvnickém průmyslu.
SYMPTOMATOLOGIE
Klasické trias charakteristické pro nádory ledvin (hematurie, bolest v ledvině a hmatný nádor) se nyní vyskytuje u méně než 5 % pacientů a je přítomno pouze u nádorů velmi pokročilých [11]. Mezi další nespecifické příznaky patří subfebrilie až febrilie, váhový úbytek, nauzea a nechutenství. Asi 30 % pacientů má paraneoplastické projevy, jimiž jsou hypertenze, neuropatie, polycytemie, kožní projevy a febrilie. Díky široké dostupnosti sonografie je v současné době asi 60 % nádorů ledvin detekováno jako bezpříznakových.
INCIDENCE
Konvenční renální karcinom tvoří 2–3 % ze všech dospělých nádorů a je považován za nejmalignější nádor ze všech urologických nádorů [2].
ČR drží již dlouhodobě primát v incidenci zhoubných nádorů ledvin se záchytem 18–21 nádorů ledvin/100 000 obyvatel. Stále zůstává nezodpovězenou otázkou, proč sousední Rakousko či Slovensko mají incidenci asi 60 % ve srovnání s ČR.
Odlišná krajová incidence nádorů ledvin je pozorována i v rámci na území ČR.
KLASIFIKACE NÁDORŮ LEDVIN
Světová zdravotnická organizace (WHO) v roce 2004 představila klasifikaci renálních epiteliálních neoplazmat dospělého věku, která nahrazuje předchozí klasifikaci z roku 1998 [2]. Základem této klasifikace je patologický nález a genetické abnormality [3,4]. Důraz je kladen na definování jednotlivých nádorových entit jako familiárního renálního karcinomu, karcinomu asociovaného s Xp11 translokací, karcinomu asociovaného s neuroblastomem, multilokulárního cystického renálního karcinomu, tubulárního, mucinózního, vřetenobuněčného a smíšených epiteliálních a stromálních nádorů. Je odlišován dále potenciálně agresivní epiteloidní angiomyolipom. Rozlišování těchto kategorií v korelaci s TNM klasifikací může mít zásadní vliv na klinický management léčby této choroby (tab. 1) [5–8].
TERAPIE
Základním těžištěm léčby všech stadií karcinomu ledviny zůstává chirurgická ablace nádoru [9–12]. S rozvojem chirurgické operační techniky se zavedly do běžné urologické praxe v léčbě lokalizovaných nádorů ledvin výkony nefron šetřící, pokud jsou z chirurgického hlediska proveditelné a onkologicky možné, stávají se první volbou v léčbě těchto malignit. Jde o výkon, kdy je do makroskopicky zdravé tkáně odstraněna postižená část ledviny a zbytek ledviny je zachován. V ostatních případech je prováděna nefrektomie, která může být spojena s adrenalektomií u objemných nádorů v oblasti horního pólu nebo při postižení nadledviny a s lymfadenektomií, pokud jsou zvětšeny lymfatické regionální uzliny [13,14]. Význam lymfadenektomie je pouze stagingový. Radikální nefrektomie spočívá v odstranění ledviny s tukovým pouzdrem. Je-li radikální nefrektomie proveditelná laparoskopicky, je laparoskopie metodou první volby. V případě, že je resekční výkon možný, je metodou první volby vždy výkon resekční i za cenu provedení otevřenou cestou. Se zavedením laparoskopie do rutinní urologické praxe je resekční výkon laparoskopicky indikován na pracovištích s adekvátním personálním a technickým vybavením.
RADIKÁLNÍ NEFREKTOMIE
Jedná se o přesně definovaný běžný chirurgický výkon, který je možné provádět laparoskopicky nebo otevřenou cestou transperitoneálně či z lumbotomie [17].
Otevřená radikální nefrektomie
Při výkonu se odstraňuje:
- ledvina včetně tukového pouzdra včetně Gerotovy fascie (25 % nádorů klinicky ohraničených na ledvinu invaduje do perirenální tukové tkáně!)
- nadledvina (u objemných nádorů a nádorů horního pólu)
- regionální lymfadenektomie (stagingový význam)
Při preparaci jsou cíleně identifikovány a ligovány cévní struktury, následně jsou přerušeny a ledvina je i s tukovým pouzdrem odstraněna.
Graph 1. Incidence nádorů ledvin v ČR s distribucí mezi ženskou a mužskou populací. 
Graph 2. Krajová incidence nádorů ledvin. 
Laparoskopická radikální nefrektomie
Je metodou volby pro tumory do 8–10 cm, bez invaze perirenálních tkání, bez trombu [15]. Skýtá v sobě všechny výhody miniinvazivního přístupu, jako jsou menší spotřeba analgetik, dřívější obnovení pasáže střevní, kratší hospitalizace a stran onkologických výsledků se jedná o techniku bez rozdílu onkologických výsledků v přežití oproti otevřenému výkonu. Jak je dokladováno dlouhodobým sledováním, onkologické výsledky jsou srovnatelné s radikální nefrektomií – pětileté CSS (92–98 %).
Image 1. Ošetření cévních struktur při radikální nefrektomii. 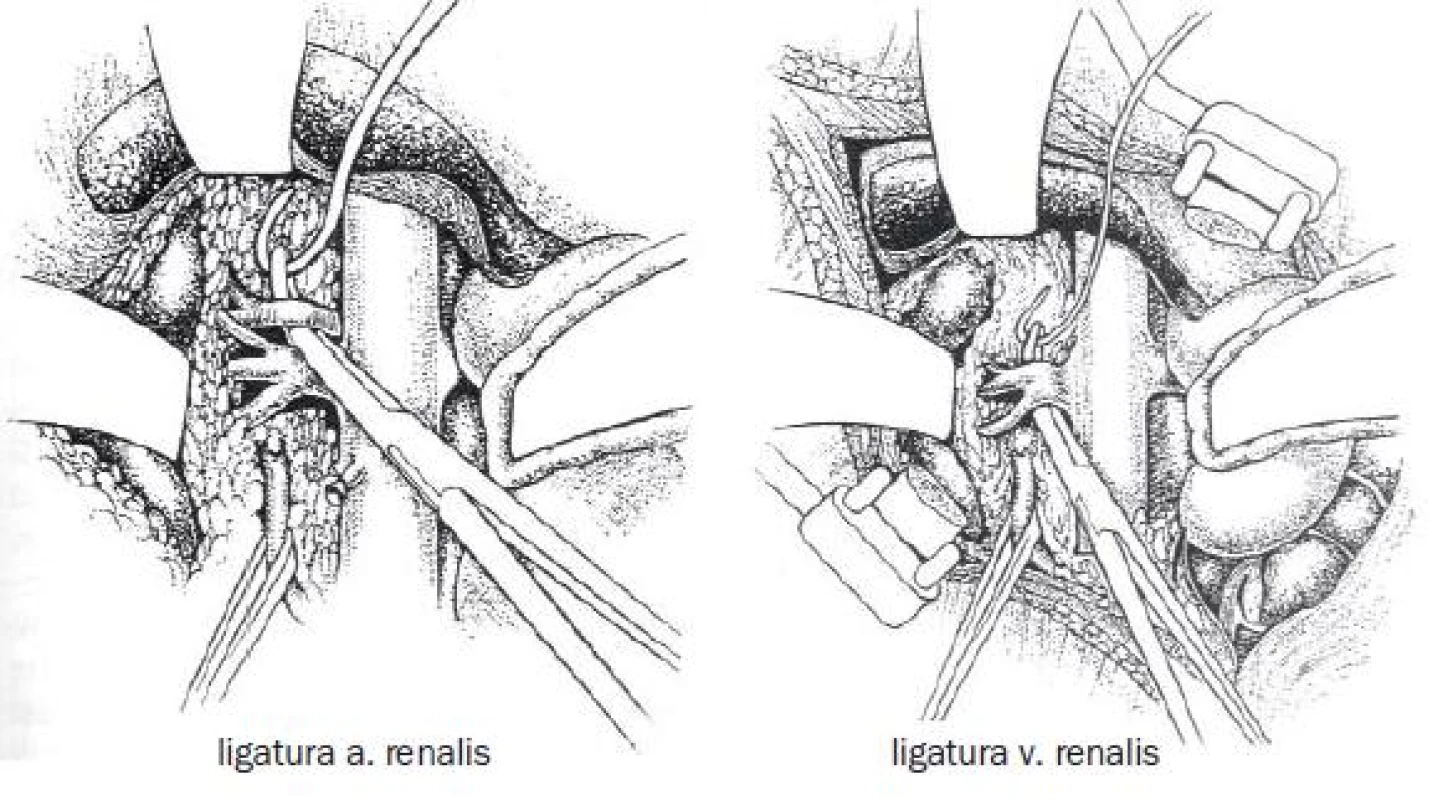
Image 2. Tumor v oblasti středního segmentu ledviny. 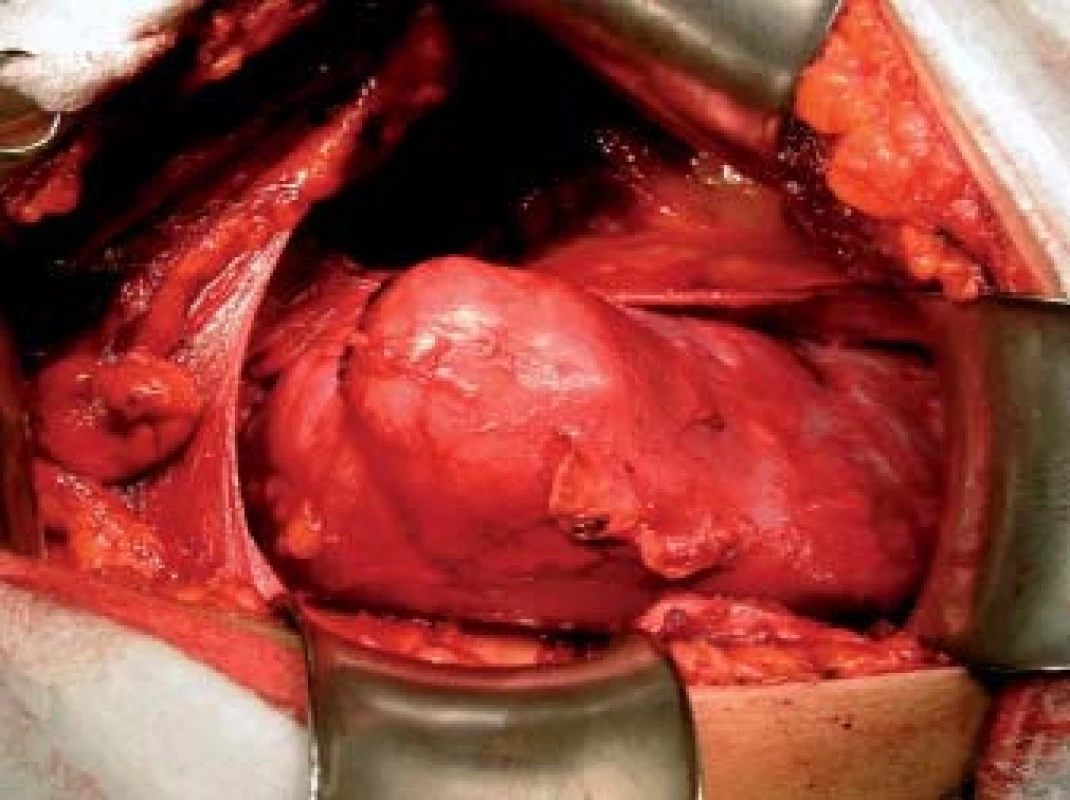
Image 3. Stav po mezorenální resekci ledviny pro tumor. 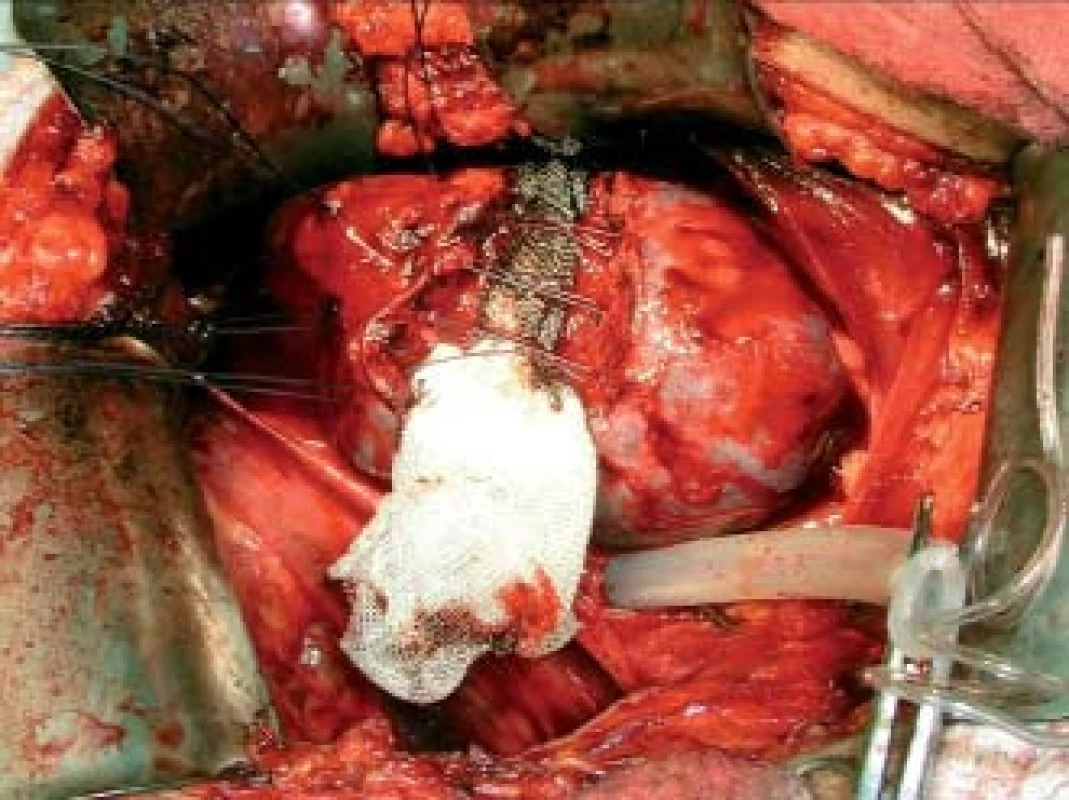
Nelze opomenout i celkový finanční efekt, kde je nutné započítat rychlejší rekonvalescenci a rychlejší návrat do pracovního procesu. Není možné v komplexní kalkulaci léčby renálního karcinomu počítat jen chirurgický výkon!
Limitací pro radikální laparoskopickou nefrektomii je na běžných pracovištích velikost tumoru, standardně jsou k tomuto výkonu indikovány tumory do 8–10 cm, bez invaze perirenálních tkání, bez trombu T1–2 a eventuálně dle posouzení operatéra nádory stadia T3.
Laparoskopická radikální nefrektomie může být prováděna jak z přístupu transperitoneálního, tak z přístupu retroperitoneoskopického. Druhý zmiňovaný přístup vyžaduje větší zkušenost operatéra kvůli limitovanému operačnímu prostoru.
V centrech, kde je prováděna laparoskopická radikální nefrektomie výběrově (low volume centres < 30 výkonů ročně), se vyskytuje vyšší incidence časných i pozdních komplikací. Tyto lze rozdělit na perioperační:
1. poranění okolního orgánu – cca 4 %
- střevo – termické (monopolární), při získání přístupu – 32 %
- slezina – 1,4 % LRN
- pankreas – 0,4 % (kauda – levostranná LRN)
- bránice – 0,6 %
2. vaskulární – cca 2 % (více u retroperit. přístupu)
- dysfunkční stapler – 1,7–10 %, při snaze o separované ošetření arterie a vény může dojít k selhání zámkové svorky
- pozdní – CHRI, chylózní ascites, „port--site“ metastázy
RESEKCE LEDVINY
Resekce ledviny je výkon, většinou v teplé ischemii, kdy je provedeno odstranění části ledviny postižené nádorem a zbytek funkčního parenchymu je zachován. Indikace k resekčnímu výkonu se postupně mění a rozšiřují v souvislosti s vývojem chirurgické operační techniky a dostupností nových instrumentárií.
Absolutní indikace:
- synchronní a oboustranný RCC
- tumor solitární ledviny
- tumor funkčně solitární ledviny při hypofunkci či afunkci kontralaterální ledviny
Relativní indikace při možnosti ohrožení funkce druhé ledviny v budoucnosti:
- hereditární RCC syndromy
- genetická onemocnění s rizikem metachronního RCC
- diabetes mellitus
- hypertenze
- nefrolitiáza
- renovaskulární onemocnění
Elektivní indikace:
- tumory všech velikostí, kde je resekční výkon možný i s normální funkční kontralaterální ledvinou
- suspektní cysty s možným maligním potenciálem
Kontraindikace resekčního výkonu:
- nepříznivě v ledvině centrálně uložený tumor
- trombus renální žíly
- předchozí operace ledviny
- více než 2 tumory (technické obtíže)
- patologická koagulace nebo funkce trombocytů
- ateroskleróza a přítomnost stentu renální arterie
Resekční výkon je tedy proveditelný otevřenou cestou z lumbotomie nebo laparoskopicky. Po odpreparování hilových struktur je naložena svorka na hilové struktury a v teplé ischemii, jejíž trvání by nemělo přesáhnout 30 min, je provedena resekce ledviny. Prolongovaná teplá ischemie ledviny zvyšuje riziko pooperační renální insuficience. Rozsah resekčního výkonu s limitací velikosti nádoru se postupně mění díky dostupnosti nových technologií a metod ablativní chirurgie (argonový skalpel) a běžnou aplikací tkáňových lepidel a sítěk na principu fibrinu.
LAPAROSKOPICKÁ RESEKCE LEDVINY
Výkon je technicky náročný a je zatížen vyšším rizikem komplikací jak časných, tak i pozdních [16]. Značným problémem je sutura resekovaných okrajů, kdy se mnohdy operatér neobejde bez využití tkáňových lepidel.
Komplikace laparoskopické resekce ledviny se i na pracovištích s bohatou zkušeností s tímto výkonem vyskytují v 9–33 %.
- krvácení 1,5–10 %
- urinom 2,0–10,6 %
- renální selhání 0,5–2 %
Zásadní otázkou indikace laparoskopické resekce ledviny zůstává lokalizace nádoru. V problematice resekčního výkonu ledviny miniinvazivní cestou je další možností roboticky asistovaná laparoskopická resekce ledviny, kdy pohyblivost pracovních robotických nástrojů umožňuje lepší ošetření resekční plochy.
TEPLÁ ISCHEMIE – WIT (WARM ISCHEMIA TIME)
Problémem resekčního výkonu ledviny se stává délka teplé ischemie při uzavření hilových struktur cévní svorkou [17]. Až čtvrtina pacientů s tumorem ledviny a „normální“ kontralaterální ledvinou má „baseline“ renální insuficienci (diagnostikováno vyšetřením GFR).
U pacientů s tumorem solitární či funkčně solitární ledviny WIT > 20 min se zvyšuje riziko akutní renální insuficience, následně rozvoje chronické renální insuficience až s nutností chronické hemodialýzy.
Radikální nefrektomie zvyšuje riziko nové pooperační CHRI oproti resekčnímu nefron šetřícímu výkonu pro stejně velký tumor. Obecně se udává, že WIT by neměla přesáhnout 20–30 min!
Při nefron šetřících výkonech, především při zavádění laparoskopické resekce ledviny, dochází k prodloužení – WIT > 25 min, což má za následek ireverzibilní difuzní poškození operované ledviny (ERPF, MAG3, RPV – Renal Parenchymal Volume měřený z CT).
Nové technologie, jako jsou kryoablace nádoru ledviny či radiofrekvenční ablace nádoru ledviny, zatím zůstávají jako metoda volby pro pacienty jinak chirurgicky inkurabilní.
ZÁVĚR
Pouze chirurgická ablace je kurativní léčebnou metodou a měla by být provedena, pokud je z medicínského hlediska možná. Pokud je realizovatelný výkon resekční, měl by být tento preferován. V současné době velikost nádoru není považována za limitaci resekčního výkonu. V případě radikální nefrektomie je přístup laparoskopický metodou volby č. 1. Je-li zvažována alternativa laparoskopické radikální nefrektomie nebo resekčního výkonu otevřenou cestou, pak je resekční výkon metodou volby č. 1. Lymfadenektomie je z kurativního hlediska považována za nepřínosnou, má význam pouze stagingový. Pokud je pooperačně zjištěn nález zvětšených uzlin, je reprezentativní biopsie indikována, a pokud je lymfadenektomie možná, měla by být provedena.
MUDr. Petr Filipenský, Ph.D.
Urologické oddělení FN u sv. Anny v Brně
Urologická klinika FN Brno a LF MU v Brně
petr.filipensky@fnusa.cz
Sources
1. American Cancer Society. Cancer Facts and Figures 2012. Atlanta, Ga: American Cancer Society, 2012.
2. www.svod.cz
3. Thoenes W, Storkel S, Rumpelt HJ et al. Cytomorphological typing of renal cell carcinoma – a new approach. Eur Urol 1990; 18 (Suppl 2): 6–9.
4. Kovacs G, Akhtar M, Beckwith BJ et al. The Heidelberg classification of renal cell tumours. J Pathol 1997; 183(2): 131–133.
5. Latif F, Duh FM, Gnarra J et al. von Hippel-Lindau syndrome: cloning and identification of the plasma membrane Ca(++)-transporting ATPase isoform 2 gene that resides in the von Hippel-Lindau gene region. Cancer Res 1993; 53(4): 861–867.
6. Lendvay TS, Marshall FF. The tuberous sclerosis complex and its highly variable manifestations. J Urol 2003; 169(5): 1635–1642.
7. Bonné AC, Bodmer D, Schoenmakers EF et al. Chromosome 3 translocations and familial renal cell cancer. Curr Mol Med 2004; 4(8): 849–854.
8. Woodward ER. Familial non-syndromic clear cell renal cell carcinoma. Curr Mol Med 2004; 4(8): 843–848.
9. Schmidt L, Duh FM, Chen F et al. Germline and somatic mutations in the tyrosine kinase domain of the MET proto-oncogene in papillary renal carcinomas. Nat Genet 1997; 16(1): 68–73.
10. Nickerson ML, Warren MB, Toro JR et al. Mutations in a novel gene lead to kidney tumors, lung wall defects, and benign tumors of the hair follicle in patients with the Birt-Hogg-Dube syndrome. Cancer Cell 2002; 2(2): 157–164.
11. Cheville JC, Blute ML, Zincke H et al. Stage pT1 conventional (clear cell) renal cell carcinoma: pathological features associated with cancer specific survival. J Urol 2001; 166(2): 453–456.
12. Grignon DJ, Che M. Clear cell renal cell carcinoma. Clin Lab Med 2005; 25(2): 305–316.
13. Algaba F, Trias I, Scarpelli M et al. Handling and pathology reporting of renal tumor specimens. Eur Urol 2004; 45(4): 437–443.
14. Van Poppel H. Conservative vs radical surgery for renal cell carcinoma. BJU Int 2004; 94(6): 766–748.
15. Kim SP, Thompson RH, Boorijan SA et al. Comparative Effectiveness for Survival and Renal Function of Partial and Radical Nephrectomy for Localized Renal Tumors: A Systematic Review and Meta-Analysis. J Urol 2012; 188(1): 51–57.
16. Kim SP, Leibovich BC, Shah ND et al. The relationship of postoperative complications with in-hospital outcomes and costs after renal surgery for kidney cancer. BJU Int 2012; Epub ahead of print.
17. Marszalek M, Ponholzer A, Brossner C et al. Elective open nephron sparin Sumery for renal masses: single – center experience with 129 consecutive patiens. Urology 2004; 64(1): 38–42.
18. Eret V, Hora M et al. Současné možnosti miniinvazivní léčby nádorů ledvin. Praha: Galén 2011; 100 s., příloha DVD (7 videí).
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2012 Issue 3-
All articles in this issue
- Roboticky asistovaná radikální cystektomie: technika podle Mayo Clinic
- Kontinentní a inkontinentní derivace moči, měchýř šetřící postupy
- Minimálně invazivní, ablační techniky při léčbě malých renálních tumorů
- Současný pohled na léčbu malých nádorů ledvin
- Hodnota léčby, riziko a zodpovědnost v urologické praxi
- Lokalizované nádory ledvin, epidemiologie, etiologie, chirurgická léčba, operační postupy a jejich indikace, role lymfadenektomie
- Kompletní duplikace měchýře a uretry jako organická příčina dysfunkce dolních močových cest
- Raritní komplikace zavedení double J stentu – migrace do pravé síně srdeční
- EAU Guidelines pro laserové technologie
- Opakovaná hospitalizace a míra výskytu komplikací u pacientů po PCNL v závislosti na komorbidních faktorech
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Raritní komplikace zavedení double J stentu – migrace do pravé síně srdeční
- Kontinentní a inkontinentní derivace moči, měchýř šetřící postupy
- Současný pohled na léčbu malých nádorů ledvin
- Roboticky asistovaná radikální cystektomie: technika podle Mayo Clinic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career