-
Medical journals
- Career
Terapeutická endourologie: karcinom z přechodných buněk lokalizovaný v horních cestách močových
Authors: Francis X. Keeley 1; Bryan Hinck 2; Mihir Desai 3; Manoj Monga 2
Authors‘ workplace: Bristol Urological Institute 1; University of Minnesota 2; Cleveland Clinic 3
Published in: Urol List 2008; 6(3): 48-53
Overview
Endourologie hraje významnou roli při diagnostice a řešení nádorových onemocnění urotelu lokalizovaných v horních cestách močových. Autoři tohoto článku hodnotí roli endourologie v souvislosti s rozvojem technik laparoskopické a robotické operace a lepšími znalostmi přirozeného vývoje onemocnění. Autoři uvádějí současná kritéria pro výběr pacientů, která jsou založena na výsledcích endoskopického vyšetření a dalších zobrazovacích vyšetření, a podrobný popis („krok za krokem“) léčby tohoto onemocnění pomocí antegrádního a retrográdního endoskopického přístupu.
Klíčová slova:
karcinom z přechodných buněk, horní cesty močové, endourologie, ureteroskopieÚVOD
Primární uroteliální karcinom lokalizovaný v horních cestách močových představuje velmi vzácně se vyskytující urologické onemocnění, jehož incidence tvoří přibližně 5 % všech karcinomů z urotelu a 7–10 % všech tumorů ledviny [1,2]. Toto onemocnění je často multifokální, má tendenci k lokální recidivě a vzniku metastáz. V uplynulých 30 letech bylo zaznamenáno mírné zvýšení incidence tohoto onemocnění a zároveň mírné zlepšení míry přežití [3]. Doporučení pro léčbu karcinomu z přechodných buněk lokalizovaného v horních cestách močových však vzhledem k absenci kontrolovaných randomizovaných studií vycházejí převážně z retrospektivních studií a názorů specialistů [4].
Albarran poprvé popsal nefroureterektomii s excizí en bloc periureterální manžety již před téměř 100 lety [5]. Od této doby se tato metoda stala standardním způsobem léčby většiny pacientů s karcinomem z přechodných buněk (TCC) zasahujícím horní cesty močové. Tento přístup splňuje všechny požadavky, které jsou kladeny na onkologickou operaci, jako jsou například excize celého tumoru s dostatečným chirurgickým okrajem, kontrola lokální recidivy a hodnocení anatomického šíření tumoru [6]. Největší význam je připisován poslednímu uvedenému aspektu, protože několik studií prokázalo, že míra přežití u pacientů s TCC závisí zvláště na stadiu a grade tumoru.
Obecný koncept onkologické operace byl v průběhu posledních 15 let významně modifikován. Pokroky v oblasti diagnostiky, stagingu a léčby pacientů s karcinomem umožnily zlepšení míry přežití a celkové zlepšení prognózy řady maligních onemocnění. Tyto změny měly za následek modifikaci operačních technik a zavedení minimálně invazivních a orgány zachovávajících přístupů. Většina těchto změn byla umožněna pokroky v diagnostice a adjuvantní terapii.
V posledních letech řada autorů publikovala výsledky endoskopické léčby tumorů horních cest močových spojené se snahou o zachování renální funkce u pacientů se solitární ledvinou a pacientů s bilaterálními tumory. V tomto článku uvádíme přehled kritérií pro výběr pacienta pomocí biopsie a různých zobrazovacích vyšetření a podrobný popis antegrádního i retrográdního přístupu.
DIAGNOSTIKA – ZOBRAZOVACÍ VYŠETŘENÍ A BIOPSIE
U pacientů s UTTCC jsou obvykle při rozboru moči detekovány prosté nelokalizované abnormality, jako je například mikroskopická hematurie nebo hematurie detekovaná prostřednictvím testovacího proužku. Standardní hodnocení zahrnuje vizualizaci sliznice močového měchýře pomocí cystoskopie, zobrazovací vyšetření horních cest močových a cytologické vyšetření moči. Výše uvedená vyšetření umožní diagnostikování UTTCC pouze u menší části pacientů. U většiny pacientů je nezbytné provedení dalších testů, jako jsou například retrográdní zobrazovací vyšetření s aplikací kontrastní látky nebo selektivní odběr moči z močovodu. Za zlatý standard se považuje endosko-pické vyšetření horních cest močových a biopsie.
Bez ohledu na to, jaký typ řešení UTTCC zvolíme, je nezbytné před zahájením léčby stanovit přesnou diagnózu. Stejně jako cystoskopie a biopsie vzorku z močového měchýře umožní vizuální a patologickou diagnózu TCC močového měchýře, pro správné diagnostikování TCC horních cest močových je nezbytné provedení endoskopického vyšetření a biopsie. V současné době jsou k dispozici flexibilní ureteroskopy s distálním koncem o rozměru 6,8 Ch a aktivní flexí umožňující ohnutí ureteroskopu o 270 ° ve směru nahoru i dolů. Užívání těchto instrumentů v kombinaci se semirigidními ureteroskopy při vyšetřování distálního močovodu umožní spolehlivé zhodnocení celého sběrného systému [7].
Cytologické vyšetření moči
Řada studií prokázala, že senzitivita cytologického vyšetření moči při detekci UTTCC je velmi nízká – míra detekce onemocnění se pohybuje kolem 29 % [8]. Ačkoliv změny, k nimž dochází u karcinomu nízkého grade, jsou pouze nepatrné [9], míra detekce G3 karcinomů a karcinomů in situ na základě cytologického vyšetření dosahuje téměř 100 % [10] a výsledky cytologického vyšetření často představují jediné abnormality detekované během prvního vyšetření. Xu et al zjistili, jak lze senzitivitu cytologického vyšetření při detekci onemocnění nízkého grade zvýšit pomocí barvení na uroplakin [11]. Několik menších studií prokázalo, že moderní testovací sady, jako jsou například ImmunoCyt, Fibrin Degradation Product Test (AuraTek FDP, PerImmune Inc., Rockville, Maryland, USA) a Bladder Tumor Antigen Test (Bard BTA, Bard UK Ltd, UK), zlepšují senzitivitu a specifitu cytologického vyšetření, užívání těchto testů však není běžně akceptováno [8,10].
Role biopsie
Endoskopické odebrání vzorku v kombinaci s cytopatologickými technikami umožňuje stanovení pozitivní diagnózy a určení přesného grade TCC horních cest močových [12]. Pouze samotná inspekce lézí horních cest močových umožní přesnou predikci TCC nízkého grade v 71 % případů a predikci TCC vysokého grade v 80 % případů [13], biopsie podezřelé léze v horních cestách močových umožní stanovení formální diagnózy a poskytnutí informací týkajících se stadia a grade tumoru. V současné době, kdy se při léčbě stále častěji užívají moderní, minimálně invazivní techniky, mají tyto informace velký význam.
Několik studií zkoumalo, do jaké míry koreluje endoskopická biopsie spolu s konečným patologickým stadiem a grade tumoru:
- Keeley et al hodnotili přesnost ureteroskopické biopsie a korelaci mezi grade určeným na základě biopsie a stadiem stanoveným na základě operačního nálezu u 51 subjektů [14]. V 90 % se grade stanovený při biopsii (nízký i vysoký) shodoval s grade zjištěným na základě operačního nálezu. 87 % lézí označených na základě vzorku biopsie jako tumory nízkého grade byly na základě operačního nálezu klasifikovány jako tumory pTa nebo pT1, 67 % lézí označených na základě vzorku biopsie jako tumory vysokého grade byly na základě operačního nálezu klasifikovány jako tumory T2-3.
- Guarnizo et al ve své studii prokázali, že na základě biopsie byl definitivní grade přesně stanoven u 78 % lézí, u zbývajících 22 % lézí bylo stadium podhodnoceno [15]. V případě, že vzorek získaný při biopsii prokázal invazi lamina propria, nedošlo v žádném případě k nadhodnocení stadia; v případě, že na základě vzorku získaného při biopsii byl tumor klasifikován jako Ta, došlo u 45 % pacientů k podhodnocení stadia.
- Skolarikos et al zjistili, že grade 9 z 32 tumorů klasifikovaných nejprve na základě vzorku biopsie byl na základě vyšetření definitivního preparátu zvýšen na G3. Kombinace výsledků cytologického vyšetření moči a grade stanoveného na základě výsledků biopsie vedla u onemocnění s vysokým grade ke zlepšení senzitivity (ze 43 % na 55 %) i specifity (ze 23 % na 85 %) [16].
- Shiraishi et al také prokázali korelaci mezi grade a stadiem karcinomu v horních cestách močových (u 85 % G2 nebo G3 tumorů byla detekována invaze do svalové tkáně) [17].
Tato zjištění potvrzují další studie prokazující, že u TCC horních cest močových je užší souvislost mezi grade a stadiem tumoru než u TCC lokalizovaného v močovém měchýři [14,18]. Někteří autoři dokonce prokázali, že grade tumoru představuje významnější prognostický faktor než patologické stadium [18].
Diagnostické zobrazovací vyšetření
Na mnoha odděleních je i v současné době u pacientů s hematurií indikováno jediné zobrazovací vyšetření. Při detekci solidních renálních útvarů o velikosti < 3 cm je USS senzitivnější než vylučovací urografie (IVU) [19]. Ultrazvukové vyšetření je však nechvalně známo pro svou nespolehlivost při identifikaci malých UTTCC. Khadra et al zkoumali relativní spolehlivost renálního ultrazvukového vyšetření a IVU při detekci tumorů horních cest močových u 1 930 pacientů s hematurií [20]. Autoři doporučují provádět (vzhledem k signifikantní míře falešně negativních výsledků obou testů při jejich samostatném provádění) u všech pacientů oba dva typy vyšetření (42 % při USS, 27 % při IVU). U žádného pacienta s negativním výsledkem ultrazvukového vyšetření a IVU nedošlo následně ke vzniku UTTCC. Celkem však byly detekovány pouze dva tumory urotelu horních cest močových a na základě tak malého počtu onemocnění je tedy obtížné vyvozovat jakékoliv závěry.
Řada studií srovnávající schopnost multifázového spirálního CT a IVU zobrazit anatomii ledvinné pánvičky a močovodu prokázala, že v rámci hodnocení ledviny a středního močovodu dosahuje CT lepších výsledků [21]. Ve studii zahrnující 86 pacientů s negativní IVU bylo pomocí CT detekováno 8 malých renálních parenchymálních neoplazmat. Tyto studie vedly k vytvoření závěru, že při hodnocení pacientů s hematurií se doporučuje rutinní provádění CT [23]. Zobrazovací schopnost IVU je horší u obézních pacientů a u pacientů, u nichž je zobrazení vývodného systému zastřeno střevním obsahem, který často vyžaduje provedení retrográdního vyšetření v anestezii. Urografie pomocí magnetické rezonance (MRU) s použitím kontrastní látky značené gandoliniem si teprve musí vydobýt svou roli v počáteční diagnostice UTTCC – několik studií zdůrazňuje signifikantní incidenci falešně pozitivních plnících defektů při tomto vyšetření [24,25]; jiná studie uvádí, že při užití této techniky došlo k přehlédnutí UPJ TCC [25].
V některých případech může být užitečné provedení 3D rekonstrukčního CT, které umožňuje zobrazit prostorové rozložení jednotlivých struktur. Vzhledem k zobrazení průřezu těchto struktur nám však tato modalita neposkytne žádné další informace, a tedy nezvyšuje senzitivitu detekce UTTCC. Lepší zobrazení nabízí virtuální ureterorenoskopie. Možnost přesného vyšetření celého urotelu bez nutnosti provádění anestezie a potenciálně morbidních invazivních zákroků je lákavá, zejména v rámci sledování pacienta. Takebayashi et al uvádějí při detekci ureterálních a renálních lézí více než 80% senzitivitu [26,27]. Užívání této modality však zůstává – z důvodu obtíží při prostorovém rozlišení a neschopnosti detekovat nepatrné změny ve vzhledu sliznice nasvědčující přítomnosti CIS – pouze omezené.
Staging
Zobrazovací vyšetření horních cest močových umožňují stanovení přesného stadia pouze výjimečně. Standardní metodou hodnocení lokálního a diseminovaného stadia UTTCC je CT, ačkoliv tato metoda je při detekci nižších stadií poměrně málo senzitivní. Detekce rozsáhlé lokální invaze pomocí CT obvykle odpovídá nálezům histologického vyšetření a odráží špatnou prognózu. Bylo prokázáno, že MRI je při určování lokálního stadia málo senzitivní [28].
Endoluminální ultrazvukové vyšetření v kombinaci s 10Ch katétrem zavedeným retrográdním způsobem může pomoci při hodnocení invaze tumoru. Užití endoluminálního ultrazvukového vyšetření při určování stadia TCC horních cest močových poprvé popsal Goldberg v roce 1991 [29]. Grasso následně tuto techniku zdokonalil pomocí 3D rekonstrukčního zobrazení [30]. Ačkoliv i další autoři uvádějí účinnost této modality [31], doposud nebyla provedena žádná velká studie, která by potvrdila přesnost jejího zobrazení.
VÝBĚR PACIENTŮ NA ZÁKLADĚ DŮKAZŮ
U pacientů s normální kontralaterální ledvinou a normální renální funkcí zůstává standardním léčebným postupem nefroureterektomie. Až u 32 % pacientů může dojít k neúplné resekci tumorů horních cest močových (dokonce i při provádění několika ureteroskopických procedur) [32]. Lokalizace tumoru nemá vliv na počáteční míru stavu bez nádoru (TF), ani na míru recidivy [32]. Pacienti s tumory o velikosti > 1,5 cm mají pouze 36% pravděpodobnost TF, zatímco pacienti s tumory o velikosti < 1,5 cm mají 91% pravděpodobnost TF [32]. Neúplná resekce je také častější u pacientů s multifokálním onemocněním (50 %) [32].
Karcinom z přechodných buněk může během tříletého sledování (po koagulaci elektrokauterem, resekci i laserové ablaci) recidivovat v ledvinné pánvičce (37 %), močovodu (43 %) nebo močovém měchýři (41 %) [33,34]. Přibližně u 10 % pacientů dochází k ureterální perforaci a u 9 % pacientů ke vzniku striktury [34].
K lokální recidivě tumorů horních cest močových po laserové resekci pomocí flexibilního ureteroskopu dochází přibližněu 33 % pacientů (v průběhu 3–132 měsíců) [35]. K recidivě dochází častěji u tumorů 2 grade (44 %) než u tumorů 1 grade (26 %). častěji recidivují také tumory o velikosti > 1,5 cm (50 %) než tumory o velikosti < 1,5 cm (25 %), což však může být způsobeno neúplnou resekcí tumoru [32].
Ke vzniku striktury dochází méně často u pacientů podstupujících ablaci pomocí Nd:YAG laseru než u pacientů léčených pomocí resekce elektrokauterem [36]. V případě, že po endoskopické léčbě TCC horních cest močových dojde ke vzniku striktury močovodu, je nutné provést biopsii vzorku odebraného z této oblasti [34]. V případě, že je diagnostikována maligní striktura, doporučuje se provedení nefroureterektomie, v opačném případě je vhodné provedení endoskopické incize striktury močovodu (viz níže).
Abychom zajistili včasnou detekci a léčbu případné recidivy, je nutné provádět dlouhodobé endoskopické sledování, které zahrnuje flexibilní cystoskopii (každé 3 měsíce) a flexibilní ureteroskopii (každých 6 měsíců) po dobu prvních dvou let a následně cystoskopii jednou za 6 měsíců a flexibilní ureteroskopii jednou ročně [34].
Někteří autoři doporučují provádět v případě, že po ureteroskopii dojde k recidivě onemocnění, nefroureterektomii [37], jiní doporučují opakované provádění ureteroskopie až do doby, kdy se tumor stane invazivní nebo dojde ke vzniku onemocnění vysokého grade [32]. Ve studii zahrnující 199 pacientů vyžadovalo provedení nefroureterektomie během 3–132 měsíců sledování pouze 7 % pacientů s TCC (kteří podstoupili ureteroskopickou léčbu) [35].
Ureteroskopie není vhodnou léčbou pro pacienty s lézemi s vysokým grade a pacienty s invazivními lézemi. Vyšší míra výskytu reziduálních tumorů a recidiva tumorů o velikosti > 1,5 cm nasvědčuje tomu, že pro léčbu větších tumorů je vhodnější perkutánní přístup [32]. Vhodnými kandidáty pro ureteroskopii nejsou ani pacienti s obvodovými lézemi, kteří mají vyšší riziko vzniku ureterální striktrury.
Hlavními kritérii pro výběr pacientů jsou následující faktory: tumor o velikosti < 1,5 cm, unifokální tumory, tumory o nízkém grade a povrchové tumory. Tato čtyři kritéria jsou nejlepšími predikátory úspěšnosti ureteroskopické léčby.
KROK ZA KROKEM: ANTEGRÁDNÍ PŘÍSTUP
Perkutánní léčba TCC horních cest močových vyžaduje získání přístupu do vhodného kalichu – podobným způsobem jako při perkutánní nefrolitotomii. Doporučujeme užívat 24F resektoskop spolu s flexibilním nefroskopem a Ho:YAG laser. Nejprve provedeme retrográdní pyelogram a flexibilní ureteroskopii. V této fázi může být nutné užití přístupové pochvy. Při inspekci tumoru užíváme k irigaci fyziologický roztok, během resekce je irigace při kontinuálním sledování času a tlaku přepnuta na vodu.
Následně provedeme biopsii tumoru, který poté resekujeme nebo kauterizujeme, podobně jako při transureterální léčbě TCC močového měchýře. Technické kontraindikace pro perkutánní resekci zahrnují: rozsáhlé zasažení vývodného systému, hlubokou invazi tumoru do tukové tkáně sinu nebo renálního parenchymu nebo tumor obvodu UPJ. Krátce po operaci můžeme pomocí nefrostomie aplikovat adjuvantní topickou terapii. Někteří autoři doporučují lokální radioterapii s použitím iridiového drátěného zářiče na nefrostomický kanál [38].
Několik poměrně velkých retrospektivních případových souborů uvádí 25 – 30% míru recidivy tumorů nízkého grade (grade 1–2) a 96–100% míru přežití specifického pro onemocnění [39]. Většina studií zahrnujících pacienty s tumory nízkého i vysokého grade však uvádí vyšší míru recidivy. Palou et al uvádějí ve své nedávno publikované studii zahrnující 34 pacientů podstupujících perkutánní léčbu 44% míru lokální recidivy a 73% míru zachování ledviny (během 51měsíčního sledování), 5,9 % pacientů na toto onemocnění v průběhu sledování zemřelo [40].
Image 1. Léze lokalizovaná po obvodu distálního ureteru. Nejvhodnější léčbou této léze je distální ureterektomie a reimplantace, protože endoskopická resekce je spojena s vysokým rizikem vzniku ureterální striktury. 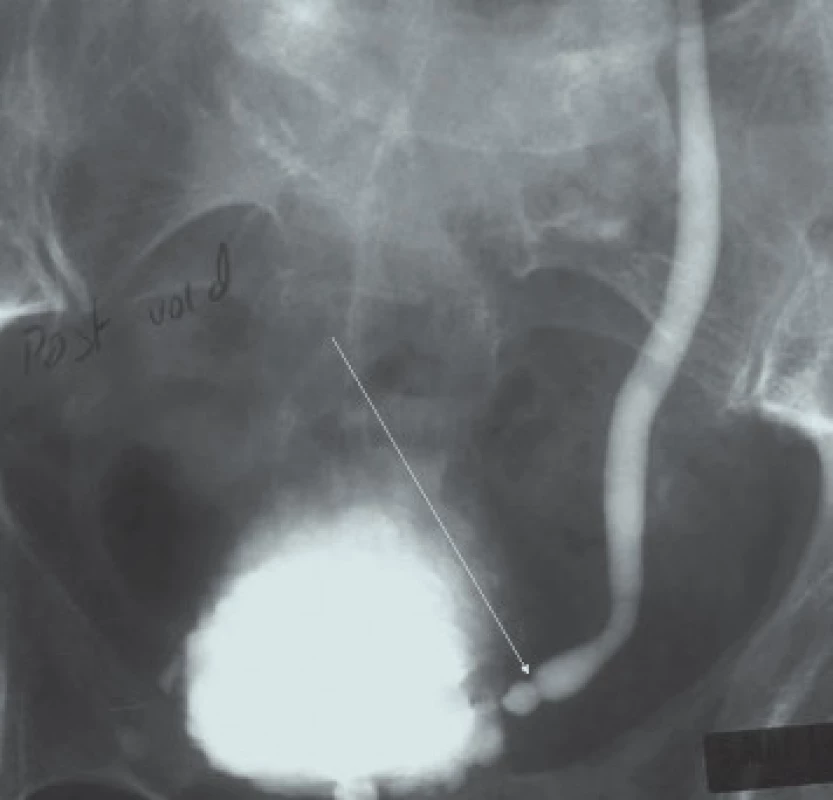
KROK ZA KROKEM: RETROGRÁDNÍ PŘÍSTUP
Ve srovnání s perkutánní léčbou ureteroskopie umožňuje zachování integrity močového systému. Užívání moderních flexibilních ureteroskopů o malém poloměru v kombinaci s laserovým vláknem umožnilo účinnou léčbu v oblasti celých horních cest močových, dokonce v proximálním ureteru a intrarenálním sběrném systému.
Pro léčbu tumorů lokalizovaných v distálním a středním močovodu se doporučuje užívat semirigidní ureteroskop, při léčbě intrarenálních lézí a lézí lokalizovaných v horním ureteru je vhodné užívat flexibilní ureteroskop. Během těchto zákroků se doporučuje minimalizovat vysokotlakou irigaci, vzhledem k tomu, že vysoký intrarenální tlak může způsobovat pyelovenózní nebo pyelolymfatickou migraci maligních buněk [41]. Doposud však nebyl zaznamenán případ, že by ureteroskopie a ureteroskopická resekce měly za následek vznik metastazujícího onemocnění [42].
Image 2. Vzhledem k tomu, že tato léze je papilární a bude snadné ji odstranit intaktní, je vhodné biopsii provést pomocí plochého drátěného košíčku. Následně provedeme ablaci báze tumoru pomocí holmium laseru. 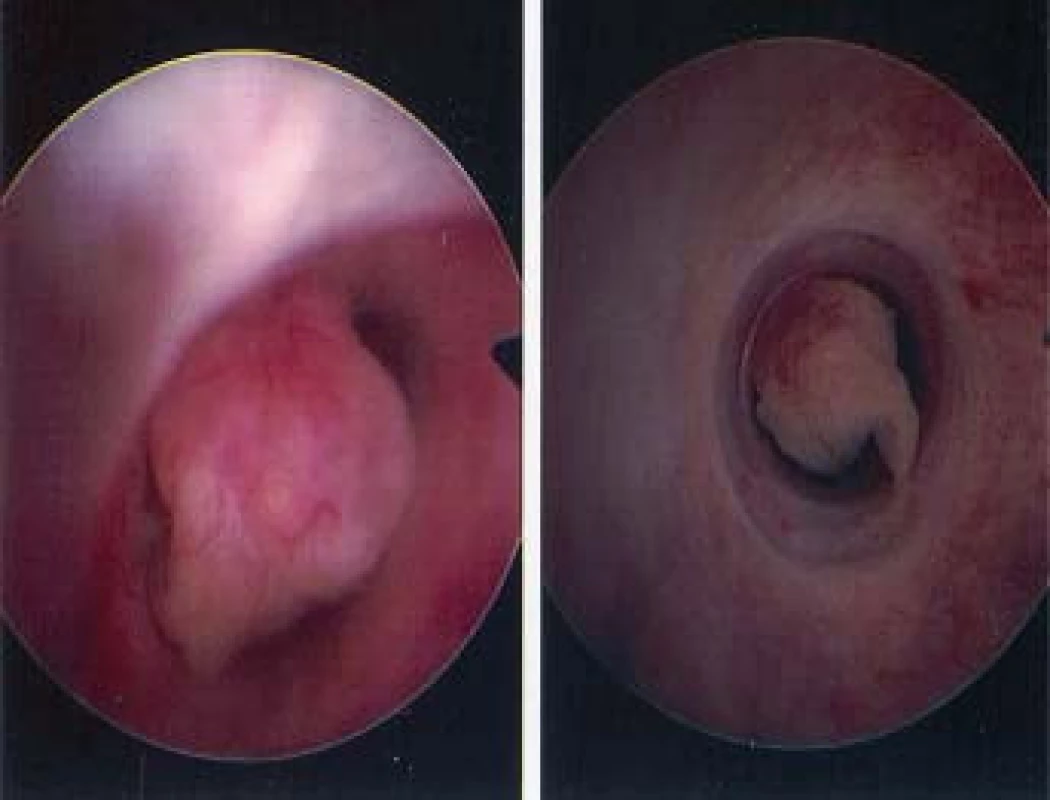
Při diagnostice onemocnění a sledování pacienta je nutné omezit špatnou interpretaci výsledků, k níž může dojít následkem iatrogenního ureterálního traumatu způsobeného drátěným vodičem. Pomocí semirigidního ureteroskopu provedeme retrográdní pyelogram a do středního močovodu zavedeme drátěný vodič se špičkou s dvojitou flexí. Ureteroskop následně odstraníme pod skiaskopickou kontrolou a přes vodič zavedeme flexibilní ureteroskop. Do ureteroskopu aplikujeme kontrastní látku, čímž získáme skiaskopickou „mapu“ sběrného systému.
Při ablaci tumoru je třeba retrográdní pyelografii provádět na samém začátku zákroku. Nezbytným krokem je zavedení bezpečnostního drátěného vodiče na počátku procedury – před biopsií nebo resekcí léze. Peroperační endoluminální ultrazvukové vyšetření nám může před resekcí tumoru pomoci identifikovat invazi svalové tkáně [43].
V případě, že je detekována papilární léze, provedeme biopsii a lézi odstraníme pomocí 2,4F plochého drátěného košíčku, v případě detekce malé a přisedlé léze užijeme 3F bioptické kleště.
Po ukončení ureteroskopické biopsie je nutné odstranit košíček a kleště současně s ureteroskopem tak, abychom předešli ztrátě tkáně vzorku v pracovním kanálu. Vzorky by měly být uloženy ve fyziologickém roztoku a osobně doručeny.
Lepšího (diagnostického) výsledku můžeme dosáhnout analýzou malých vzorků pomocí cytologické techniky buněčného bloku nebo analýzy buněk získaných centrifugací [32,44]. Vzorky lze také získat aspirací nebo irigací fyziologickým roztokem před nebo po ablaci nádoru. Při užití těchto technik lze grade tumorů horních cest močových stanovit s téměř 97% přesností [45].
Image 3. Biopsie této přisedlé léze bude vyžadovat použití Boston Scientific Piranha bioptických kleští. 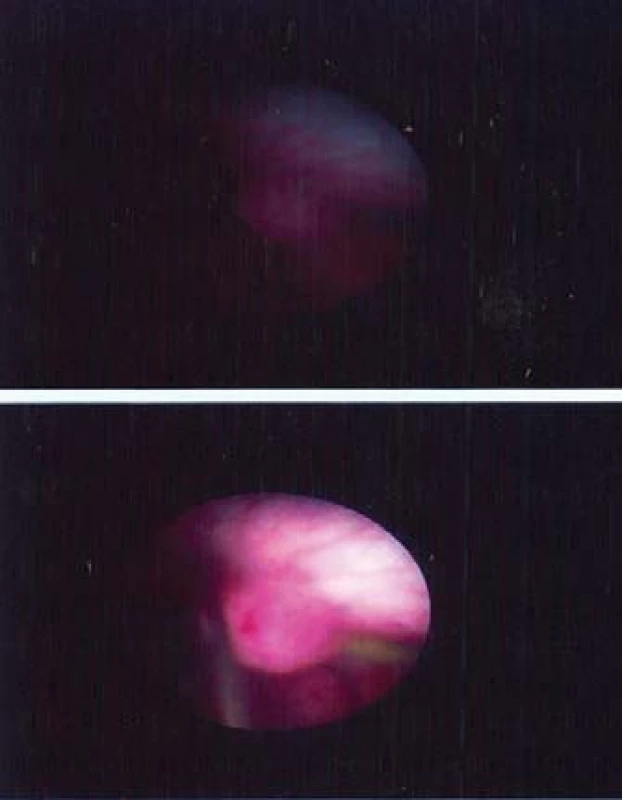
Báze tumoru je elektrokoagulována pomocí 2 Fr Greenwaldovy elektrody. Při ošetření báze tumoru lze případně užívat Ho:YAG laser (1,0 J, 10 Hz) nebo Nd:YAG laser (15–30 W, 2 s). Vhodnější je Ho:YAG laser, protože dosahuje penetrace £ 0,5 mm ve vodním prostředí (ve srovnání s 4–6 mm při Nd:YAG). Je třeba poznamenat, že většina studií uvádějících výsledky dlouhodobého sledování pacientů po ureteroskopické léčbě tumorů horních cest močových užívá jiné modality než je laserová ablace, a je třeba teprve prokázat, zda bude míra recidivy srovnatelná. V případě, že je přístup k lézi obtížný, doporučuje se užití 2F elektrody, která umožní větší aktivní flexi flexibilního ureteroskopu (větší než 200mikron laserové vlákno).
Pro vyloučení synchronního multifokálního onemocnění je třeba provést systematické vyšetření zbývající části vývodného systému. U velkých tumorů nebo v případě zastření viditelnosti z důvodu krvácení nebo krevní sraženiny může být indikována opakovaná resekce [34]. V závislosti na rozsahu resekce ponecháme po dobu 3–14 dnů zavedený ureterální stent. V případě, že detekujeme ureterální perforaci, je třeba operaci ukončit a přes bezpečnostní vodič zavést ureterální stent. V tomto případě obvykle ponecháme stent po dobu 4–6 týdnů, abychom umožnili úplné zhojení močovodu [34].
V průběhu dvou let po resekci by měli pacienti jednou za čtvrt roku v rámci sledování podstoupit cystoskopii a cytologii a jednou za půl roku flexibilní ureteroskopii. Flexibilní ureteroskopii (s užitím moderních 7,5F endoskopů) lze provádět ambulantně v lokální anestezii [37].
Image 4. Perkutánní resekce TCC pánvičky ledviny pomocí TUR kličkové elektrody. 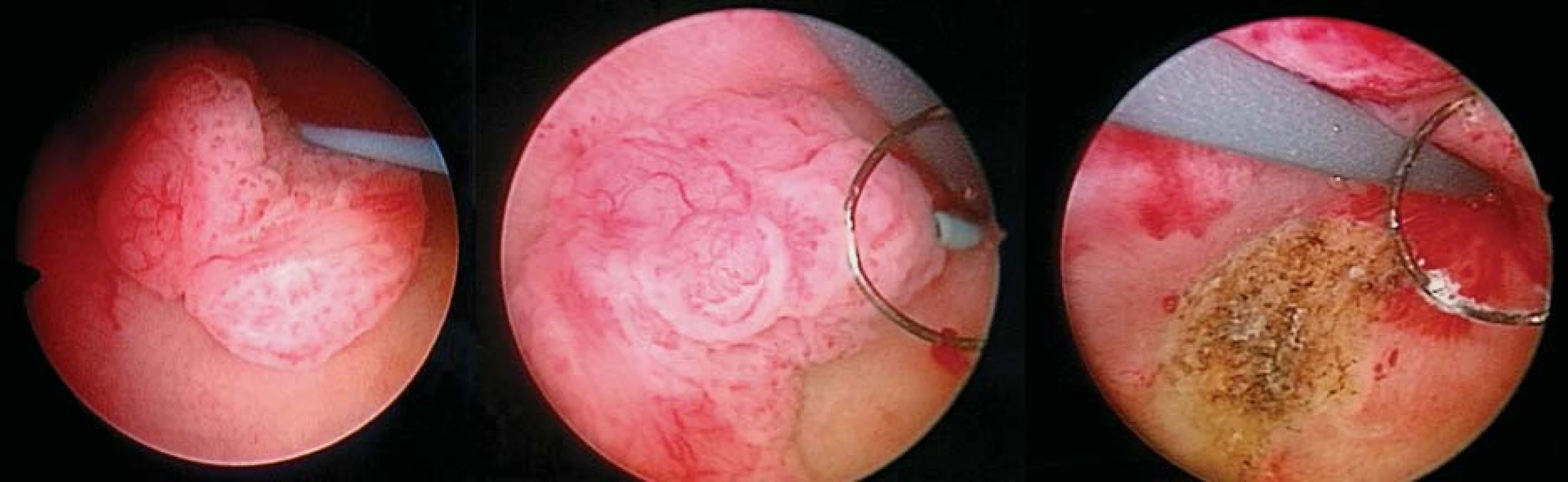
Odstranění klenby ureterálního ústí a poloviny intramurálního ureterálního tunelu pomocí elektrokauteru (např. Orandi) v poloze 12 hodin na ciferníku umožní vytvoření široce průchozího refluxního ureterálního ústí, což usnadní ambulantní provádění ureteroskopie (nevyžadující jinou anestezii než intrauretrální lidocainový gel) – v těchto případech není nutné provádět dilataci močovodu ani zavádět stent [46]. Sledování sběrného systému pouze pomocí radiografického vyšetření není dostatečné, vzhledem k tomu, že 75 % případů recidivy tumoru je identifikováno pouze endoskopicky [32]. Z důvodu (jakkoliv nízkého, < 5%) rizika vzniku kontralaterálního onemocnění se obvykle jednou za rok provádí zobrazovací vyšetření druhostranné ledviny.
ZÁVĚR
Od dob, kdy byla radikální renální operace prováděna pouze s pomocí IVU, prodělala moderní diagnostika TCC horních cest močových signifikantní změny. Při hodnocení podezřelých lézí můžeme v současné době užívat moderní cytologické, radiologické a endoskopické techniky. Mnoho pacientů s UTTCC lze v současné době léčit také endoskopicky – tento druh léčby může být vhodnou volbou pro pacienty, kteří nemohou podstoupit závažnější operační zákrok, pacienty s bilaterálními tumory nebo solitární ledvinou. Vhodnými kandidáty pro tuto techniku jsou také pacienti s tumory nízkého grade a nízkého stadia lokalizovanými v distálním ureteru. Pokud uvážíme, že většina tumorů horních cest močových má vysoký grade i vysoké stadium, je zřejmé, že endoskopická léčba není obvykle vhodná. Klíčem účinné ureteroskopické léčby TCC je vhodný výběr pacientů. Nejlepšími kandidáty pro endourologickou léčbu jsou pacienti s povrchovými, unifokálními tumory nízkého grade o velikosti méně než 1,5 cm.
Francis X. Keeley1
Bryan Hinck2
Mihir Desai3
Manoj Monga2
1Bristol Urological Institute
2University of Minnesota
3Cleveland Clinic
Sources
1. Hall MC, Womack S, Sagalowsky AI et al. Prognostic factors, recurrence, and survival in transitional cell carcinoma of the upper urinary tract: a 30-year experience in 252 patients. Urology 1998; 52 (4): 594–601.
2. Olgac S, Mazuumdar M, Dalbagni G et al. Urothelial Carcinoma of the Renal Pelvis. A Clinicopathological Study of 130 cases. Am J Surg Pathol 2004; 28 (12): 1545–1552.
3. Munoz JJ, Ellison LM. Upper Tract Urothelial Neoplasms: Incidence and Survival during the last 2 Decades. J Urol 2000; 164(5): 1523–1525.
4. Oosterlink W, Solsona E, van der Meijden APM et al. EAU Guidelines on Diagnosis and Treatment of Upper Urinary Tract Transitional Cell Carcinoma. Eur Urol 2004; 46 : 147–154.
5. Albarran J. Medecine operatoire des voies urinaires. Paris : Masson et Cie 1909.
6. Skinner DG. Technique of Nephroureterectomy with regional lymph node dissection. Urol Clin North Am 1978; 5 : 252–260.
7. Grasso M and Bagley DH. A 7.5 F actively deflectable, flexible ureteroscope: A new plateau in both diagnostic and therapeutic upper urinary tract endoscopy. Urology 1994; 43 : 435–438.
8. Siemens DR, Morales A, Johnston B, Emerson L. A comparative analysis of rapid urine tests for the diagnosis of upper urinary tract malignancy. Can J Urol 2003; 10(1): 1754–1758.
9. Hughes JH, Raab SS, Cohen MB. The cytologic diagnosis of low-grade transitional cell carcinoma. Am J Clin Pathol 2000; 114 Suppl: S59–67.
10. Lodde M, Mian C, Wiener H, Haitel A, Pycha A, Marberger M. Detection of upper urinary tract transitional cell carcinoma with ImmunoCyt: a preliminary report. Urology 2001; 58(3): 362–366.
11. Xu X, Genega EM, Nasuti JF. Differential immunocytochemical staining patterns of uroplakin observed on neoplastic and nonneoplastic tissue fragments obtained from upper urinary tract brush specimens. Acta Cytol 2002; 46(4): 684–689.
12. Bagley DH. Ureteroscopic treatment of upper urinary tract neoplasms. In: Smith AD, Badlani GH, Bagley DH et al. Smith's Textbook of Endourology. St. Louis, MO: Quality Medical Publishing, Inc. 1996 : 474–498.
13. El-Hakim A, Weiss GH, Lee BR, Smith AD. Correlation of ureteroscopic appearance with histologic grade of upper tract transitional cell carcinoma. Urology 2004; 63(4): 647–650.
14. Keeley FX, Kulp DA, Bibbo M, McCue PA, Bagley DH. Diagnostic accuracy of ureteroscopic biopsy in upper tract transitional cell carcinoma. J Urol 1997; 157(1): 33–37.
15. Guarnizo E, Pavlovich CP, Seiba M, Carlson DL, Vaughan ED Jr, Sosa RE. Ureteroscopic biopsy of upper tract urothelial carcinoma: improved diagnostic accuracy and histopathological considerations using a multi-biopsy approach. J Urol 2000; 163(1): 52–55.
16. Skolarikos A, Griffiths TR, Powell PH, Thomas DJ, Neal DE, Kelly JD. Cytologic analysis of ureteral washings is informative in patients with grade 2 upper tract TCC considering endoscopic treatment. Urology 2003; 61(6): 1146–1150.
17. Shiraishi K, Eguchi S, Mohri J, Kamiryo Y. Role of ureteroscopic biopsy in the management of upper urinary tract malignancy. Int J Urol 2003; 10(12): 627–630.
18. Das AK, Carson CC, Bolick D, Paulson DF. Primary carcinoma of the upper urinary tract. Effect of primary and secondary therapy on survival. Cancer 1990; 66(9): 1919–1923
19. Warshauer DM, McCarthy SM, Street L et al. Detection of renal masses: sensitivities and specificities of excretory urography/linear tomography, US, and CT. Radiology 1988; 169(2): 363–365.
20. Khadra MH, Pickard RS, Charlton M, Powell PH, Neal DE. A prospective analysis of 1,930 patients with hematuria to evaluate current diagnostic practice. J Urol 2000; 163(2): 524–527.
21. Heneghan JP, Kim DH, Leder RA, De Long D, Nelson RC. Compression CT urography: a comparison with IVU in the opacification of the collecting system and ureters. J Comput Assist Tomogr 2001; 25(3): 343–347.
22. Lang EK, Macchia RJ, Thomas R, Watson R et al. Improved detection of renal pathologic features on multiphasic helical CT compared with IVU in patients presenting with microscopic hematuria. Urology 2003; 61(3): 528–532.
23. Gray Sears CL, Ward JF, Sears ST, Puckett MF, Kane CJ, Amilng CL. Prospective comparison of computerized tomography and excretory urography in the initial evaluation of asymptomatic microhematuria. J Urol 2002; 168(6): 2457–2460.
24. Verswijvel GA, Oyen RH, Van Poppel HP et al. Magnetic resonance imaging in the assessment of urologic disease: an all-in-one approach. Eur Radiol 2000; 10(10): 1614–1619.
25. Girish G, Chooi WK, Morcos SK. Filling defect artefacts in magnetic resonance urography. Eur Radiol 2004; 14(1): 145–150.
26. Takebayashi S, Hosaka M, Kubota Y et al. Computerised tomographic ureteroscopy for diagnosing ureteral tumors. J Urol 2000; 163 : 42–46.
27. Takebayashi S, Hosaka M, Kubota Y et al. Computerised tomographic nephroscopic images of renal pelvic carcinoma. J Urol 1999; 162 : 315–318.
28. Weeks SM, Brown ED, Brown JJ, Adamis MK, Eisenberg LB, Semelka RC. Transitional cell carcinoma of the upper urinary tract: staging by MRI. Abdom Imaging 1995; 20(4): 365–367.
29. Goldberg BB, Bagley D, Liu JB, Merton DA, Alexander A, Kurtz AB. Endoluminal sonography of the urinary tract: preliminary observations. AJR Am J Roentgenol 1991; 156(1): 99–103.
30. Grotas A, Grasso M. Endoluminal sonographic imaging of upper urinary tract: three-dimensional reconstruction. J Endourol 2001; 15(5): 485–488.
31. Kumar PV, Joshi HB, Timoney AG, Keeley FX. Endoluminal ultrasonography with reusable probe: preliminary results. J Endourol 2002; 16(9): 667–671.
32. Keeley FX, Bibbo M, Bagley DH. Ureteroscopic treatment and surveillance of upper urinary tract transitional cell carcinoma. J Urol 1997; 157 : 1560–1565.
33. Nguyen TA, Belis JA. Endoscopic management of urolithiasis in the morbidly obese patient. J Endourol 1998; 12 : 33–35.
34. Chen GL, Bagley DH. Ureteroscopic surgery for upper tract transitional cell carcinoma: complications and management. J Endourol 2001; 15 : 399–404.
35. Bagley DH. Ureteroscopic laser treatment of upper urinary tract tumors. J Clin Laser Med Surg 1998; 16 : 55–59.
36. Schmeller NT, Hofstetter AG. Laser treatment of urothelial tumors. J Urol 1989; 141 : 840–843.
37. Patel A, Fuchs GJ. New techniques for the administration of topical adjuvant therapy after endoscopic ablation of upper urinary tract transitional cell carcinoma. J Urol 1998; 159 : 71–75.
38. Patel A, Soonawalla P, Sheperd SF et al. Long-term outcome after percutaneous treatment of transitional cell carcinoma of the renal pelvis. J Urol 1996; 155 : 868–874.
39. Soderdahl DW, Fabrizio MD, Rahman NU et al. Endoscopic treatment of upper tract transitional cell carcinoma. Urol Oncol 2005; 23 : 114–122.
40. Palou J, Piovesan LF, Huguet J et al. Percutaneous nephroscopic management of upper urinary tract transitional cell carcinoma: Recurrence and long-term follow-up. J Urol 2004; 172 : 66–69.
41. Batter SJ, Dretler SP. Ureterorenoscopic approach to the symptomatic caliceal diverticulum. J Urol 1997; 158 : 709–713.
42. Hendin BN, Streem SB, Levin HS, Klein EA, Novick AC. Impact of diagnostic ureteroscopy on long-term survival in patients with upper tract transitional cell carcinoma. J Urol 1999; 161 : 783–785.
43. Liu JB, Bagley DH, Conlin MJ, Merton DA, Alexander AA, Goldberg BB. Endoluminal sonographic evaluation of ureteral and renal pelvic neoplasms. J Ultrasound Med 1997; 16 : 515–521.
44. Tawfiek E, Bibbo M, Bagley DH. Ureteroscopic biopsy: Technique and specimen preparation. Urology 1997; 50 : 117–119.
45. Keeley FX, Kulp DA, Bibbo M, McCue PA, Bagley DH. Diagnostic accuracy of ureteroscopic biopsy in upper tract transitional cell carcinoma. J Urol 1997; 157 : 33–37.
46. Kerbl K, Clayman RV. Incision of the ureterovesical junction for endoscopic surveillance of transitional cell cancer of the upper tract. J Urol 1993; 150 : 1440–1443.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2008 Issue 3-
All articles in this issue
- Stenóza PUJ – antegrádní a retrográdní endopyelotomie, laparoskopická pyeloplastika. Správné indikace, pro a proti
- Terapeutická endourologie: karcinom z přechodných buněk lokalizovaný v horních cestách močových
- Kombinovaná léčba BHP – aktuální stav
- Ortotopická neovezika – současný stav
- Dnešní indikace extrakorporální litotrypse v léčbě urolitiázy – co se změnilo?
- Dnešní možnosti ureteroskopie
- Objemná nefrolitiáza – perkutánní litotrypse, nebo retrográdní intrarenální operace?
- Terapeutická endourologie: obstrukce ureteropelvické junkce
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stenóza PUJ – antegrádní a retrográdní endopyelotomie, laparoskopická pyeloplastika. Správné indikace, pro a proti
- Dnešní možnosti ureteroskopie
- Objemná nefrolitiáza – perkutánní litotrypse, nebo retrográdní intrarenální operace?
- Ortotopická neovezika – současný stav
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

