-
Medical journals
- Career
Dnešní indikace extrakorporální litotrypse v léčbě urolitiázy – co se změnilo?
Authors: MUDr. Aleš Petřík, Ph.D.
Authors‘ workplace: Urologické oddělení Nemocnice České Budějovice, a. s.
Published in: Urol List 2008; 6(3): 14-21
Overview
Extrakorporální litotrypse (ESWL) je užívána v klinické praxi od roku 1980. Od této doby došlo k vývoji nových přístrojů, ale není jednoznačné, zdali dosahují lepších výsledků, či nikoliv. Současně došlo k podstatnému rozvoji ureteroskopie, která se v terapii ureterolitiázy stává rovnocennou metodou. Přínosem pro extrakorporální litotrypsi je užití nativního spirálního CT v diagnostice urolitiázy, nebo umožňuje odhadnout výsledek ESWL terapie jednak změřením vzdálenosti konkrementu od povrchu těla pacienta, jednak odhadem složení konkrementu, které významně ovlivňuje výsledek terapie. V indikaci ESWL při terapii nefrolitiázy nedochází k podstatným změnám, stále platí hranice 20 mm z hlediska velikosti a anatomická omezení v terapii litiázy dolního kalichu ledviny. V terapii ureterolitiázy se ureteroskopie stala indikačně srovnatelnou metodou, s vyšší efektivitou než ESWL. Pro indikaci ESWL však stále hovoří nižší invazivita a užití analgosedace při terapii. Pokud si bude i nadále ESWL chtít udržet své místo v terapii urolitiázy, je nutný návrat k základnímu výzkumu rázových vln a vývoj nových a účinnějších přístrojů.
Klíčová slova:
ureterolitiáza, terapie, ESWL, ureteroskopieÚVOD
Extrakorporální litotrypse (ESWL) je užívána v klinické praxi od roku 1980 [1]. Je zřejmé, že nastal čas posoudit její efektivitu a indikace již s časovým odstupem, který umožňuje reálné zhodnocení metody. Za uplynulých 25 let došlo nejen ke změnám užívaných extrakorporálních litotryptorů, kde většina výrobců přešla od elektrohydraulického k elektromagnetickému způsobu generování rázových vln, ale i zobrazovacích zařízení, a to nejen zlepšení rozlišení rentgenových a sonografických přístrojů, ale zejména užití CT v diagnostice urolitiázy. Oproti tomu výzkum vlastního mechanismu dezintegrace litiázy o mnoho nepokročil, a tak i přes rutinní užití ESWL v klinické praxi přesný mechanismus dezintegrace konkrementu stále není plně objasněn [2]. Limitujícím faktorem v užití extrakorporální litotrypse je i rozvoj endoskopických metod. Oproti situaci počátkem 80. let, kdy byly dostupné pouze rigidní uretroskopy o průměru 12–14 Fr s Hopkinsovou „rod lens“ optikou, od poloviny 90. let 20. století dochází k uplatnění semirigidních a flexibilních přístrojů umožňujících terapii jak litiázy proximálního ureteru, tak i intrarenální litiázy. Na rozvoji endoskopických metod má nemalý podíl i užití nových dezintegračních zařízení, a to balistických intrakorporálních litotryptorů a zejména holmiového laseru.
SOUČASNÝ STAV EXTRAKORPORÁLNÍ LITOTRYPSE
Extrakorporální litotryptory jsou obvykle rozdělovány do 3 generací, i když nyní se setkáváme s vymezením 4. generace přístrojů.
1. generaci zastupuje Dornier HM3, který je prakticky od uvedení do praxe brán jako zlatý standard, se kterým jsou ostatní přístroje srovnávány. I přesto, že přístroj užívá jen RTG zaměření, pacient je celý ponořen ve vaně k přenosu rázových vln a malý elipsoid v kombinaci s 80 nF kondenzátorem vyžaduje užití celkové anestezie, je ve světě stále užíváno asi 300 přístrojů v praxi.
Druhou generaci zastupují přístroje uvedené na trh v druhé polovině 80. let 20. století. Tyto přístroje již k přenosu rázových vln do těla pacienta nepoužívají vodní vany, ke generování rázových vln je užíváno elektrohydraulického, elektromagnetického a piezoelektrického mechanismu a pro zaměření užívají buï rentgenu, nebo ultrazvuku. Mezi přístroje této generace patří například Dornier HM4, Dornier MPL 9000, Dornier MFL 5000, Siemens Lithostar, Wolf Piezolith 2300 a Edap LT01.
Jako přístroje 3. generace jsou označovány litotryptory, kde se pro zaměření konkrementu užívá kombinace rentgenu a ultrazvuku, mají dostatečný výkon a apertura aplikátoru je dostatečně velká, aby umožňovala provedení terapie s minimální analgezií. Současně stůl přístroje umožňuje provádět rentgenová vyšetření a endoskopické výkony. Mezi přístroje této generace patří například Dornier Lithotriptor 30/50, Philips Litho Diagnost M, Siemens Lithostar Plus, Storz Modulith SL20 a Wolf Piezolith 2300. Do této skupiny je zařaditelný i přístroj Medilit M firmy Medipo.
Jako přístroj 4. generace označuje D. Tolley [4] přístroj Sonolith Vision od Technomed Medical Systems. Tento přístroj užívá modifikace elektrohydraulického generování rázových vln, kdy k výboji dochází mezi hroty elektrody umístěnými v solném roztoku.
DOSAHUJE EXTRAKORPORÁLNÍ LITOTRYPSE LEPŠÍCH VÝSLEDKŮ NEŽ PŘED 25 ROKY?
Stěžejní otázkou je, zdali existuje rozdíl ve výsledcích terapie na přístrojích rozdílných generací, a pokud ano, co je jeho příčinou. I přesto, že přístroje používají zdokonalené zaměření konkrementů pomocí digitalizovaného rentgenu a ultrasonografů s vyšším rozlišením, publikované práce docházejí k rozdílným výsledkům. Na jedné straně ukazují lepší výsledky původního přístroje Dornier HM3 oproti novým přístrojům [3], kdy Hochreiter dosáhl na HM3 při terapii juxtavezikální litiázy výsledků lepších než u přístrojů 2. a 3. generace, které byly srovnatelné s výsledky ureteroskopického odstranění litiázy. Naproti tomu však Nomikos [4] nebo Portis [5] jednoznačně uvádějí lepší výsledky přístrojů novějších generací. Z fyzikálního hlediska je zřejmé, že nejlepším řešením pro dezintegraci litiázy je dosažení objemného ohniska s relativně nízkými tlaky, čehož dosahoval přístroj Dornier HM3 a nyní nový přístroj označovaný Xi Xin-Eisenmenger [6,7]. Pokud chceme litotryptory porovnávat, pak je to možné pouze studií in vitro [8], což v současnosti již prakticky není prováděno. Druhou možností je porovnání klinické. Zde však nastává problém, jak klinická data porovnat. Již samotná metodologie publikování o ESWL není dodržována. Základní pravidla, podle kterých by měly být publikovány výsledky terapie urolitiázy, jsou shrnuta ve dvou pracích Tolleye [9,10] a zahrnují kompletní pokyny pro popis přístroje, konkrementu, vlastní terapie a jejího hodnocení.
Úspěšnost odstranění konkrementu je obvykle hodnocena na podkladě nativního nefrogramu a sonografického vyšetření provedeného v odstupu 3 měsíců od výkonu. Kritériem úspěšnosti je buï kompletní odstranění konkrementů, nebo přítomnost symptomatických reziduálních fragmentů do 4 mm. Při hodnocení souboru pacientů jsou potom tyto hodnoty procentuálně vyjadřovány jako stone-free rate, respektive success-rate (bez konkrementu, nebo s asymptomatickými fragmenty pod 4 mm).
Při hodnocení výsledků extrakorporální litotrypse je nutné vzít v úvahu nejen odstranění konkrementu, ale i opakování výkonu a užití auxiliárních metod před a po litotrypsi. Proto byl definován koeficient úspěšnosti: Efficacy quotient – EQ (Rovnice 1), jako autor je uváděn v části literatury Denstedt, jinde Preminger a Clayman [11,12,13].
Rovnice 1. Efficacy quotient<sub>1</sub>. 
Vzhledem k tomu, že nejsou zahrnuty případy, kdy byl konkrement odstraněn auxiliární metodou, a auxiliární výkony provedené před vlastní terapií, Rassweiler [14] tuto rovnici modifikoval do následujícího stavu (Rovnice 2).
Rovnice 2. Efficacy quotient<sub>2</sub>. 
Tyto 2 koeficienty umožňují porovnání různých prací, i když se jedná o obtížný úkol vzhledem k tomu, že výše stanovená doporučení nejsou často dodržována. Současně metodika výpočtu percentuelního zastoupení auxiliárních výkonů je často rozdílná, nebo ty jsou vztaženy buï k počtu pacientů, nebo počtu terapií.
Pro porovnání by soubory měly být bez statisticky významného rozdílu ve velikosti, lokalizaci a složení konkrementů, měl by být dodržen stejný protokol terapie (indikace výkonu, indikace opakování výkonu, metody hodnocení), stejný analgetický režim a pokud možno i omezený okruh pracovníků provádějících terapii. To prakticky vylučuje srovnání mezi jednotlivými centry. I pokud budeme porovnávat v rámci jednoho centra, ale v rozdílných časových periodách, dostáváme se k problému, zdali užitím rentgenových přístrojů a ultrasonografů novější generace nedochází k zachycení reziduálních fragmentů, které by dříve nebyly zachyceny. Z těchto výše zmíněných důvodů je nutné brát všechna porovnání litotryptorů s určitou rezervou.
TERAPIE UROLITIÁZY
Cílem terapie urolitiázy je odstranění konkrementu co možná nejšetrnějším způsobem. Konkrementy do 4 mm mají vysokou pravděpodobnost spontánního odchodu bez nutnosti jakékoliv intervence. Vždy však musíme brát zřetel na to, že dlouhodobá obstrukce ureteru vede k ireverzibilnímu poškození renálních funkcí [15].
Extrakorporální litotrypse (ESWL) a perkutánní nefrolitolapaxe (PCNL) jsou základní metody léčby nefrolitiázy. PCNL je indikována u odlitkové litiázy, u objemnější pyelolitiázy (obvykle nad 20 mm v průměru) a u konkrementů v divertiklu kalichu či dolním kalichu s nepříznivými anatomickými poměry. Nově nastupující, avšak ekonomicky limitovanou terapií je retrográdní terapie nefrolitiázy flexibilním uretroskopem za použití holmium laseru. Otevřená operativa zůstává vyhrazena pouze pro komplikované případy odlitkové litiázy.
U ureterolitiázy je v případech konkrementů menších než 4 mm na prvním místě medikamentózní terapie, nejčastěji kombinací blokátorů syntézy prostaglandinů a a blokátorů. Při selhání konzervativní terapie jsou extrakorporální litotrypse (ESWL) a ureteroskopie základními metodami v terapii ureterolitiázy. U ESWL se snažíme o dezintegraci konkrementu in situ bez předchozího stentingu či relokace konkrementu. Ureteroskopie po zavedení semirigidních a flexibilních ureteroskopů se stává bezpečnou metodou, jejíž efektivita při prvním výkonu převyšuje ESWL. Perkutánní litolapaxie a antegrádní ureteroskopie jsou primárně vyhrazeny pro vybrané případy subrenální litiázy. Otevřená operativa zůstává vyhrazena, až na výjimečné případy, pro řešení komplikací nebo při selhání výše uvedených metod. Obdobné místo v terapii má i laparoskopická ureterolitotomie.
INDIKACE
Stran indikace obecně platí, že je možné provést terapii ESWL v případech, kdy není kontraindikována, kdy je technicky možná (konkrement lze zaměřit do ohniska) a kdy lze očekávat příznivý efekt (dáno obecnými principy, užitým přístrojem a zkušenostmi pracoviště).
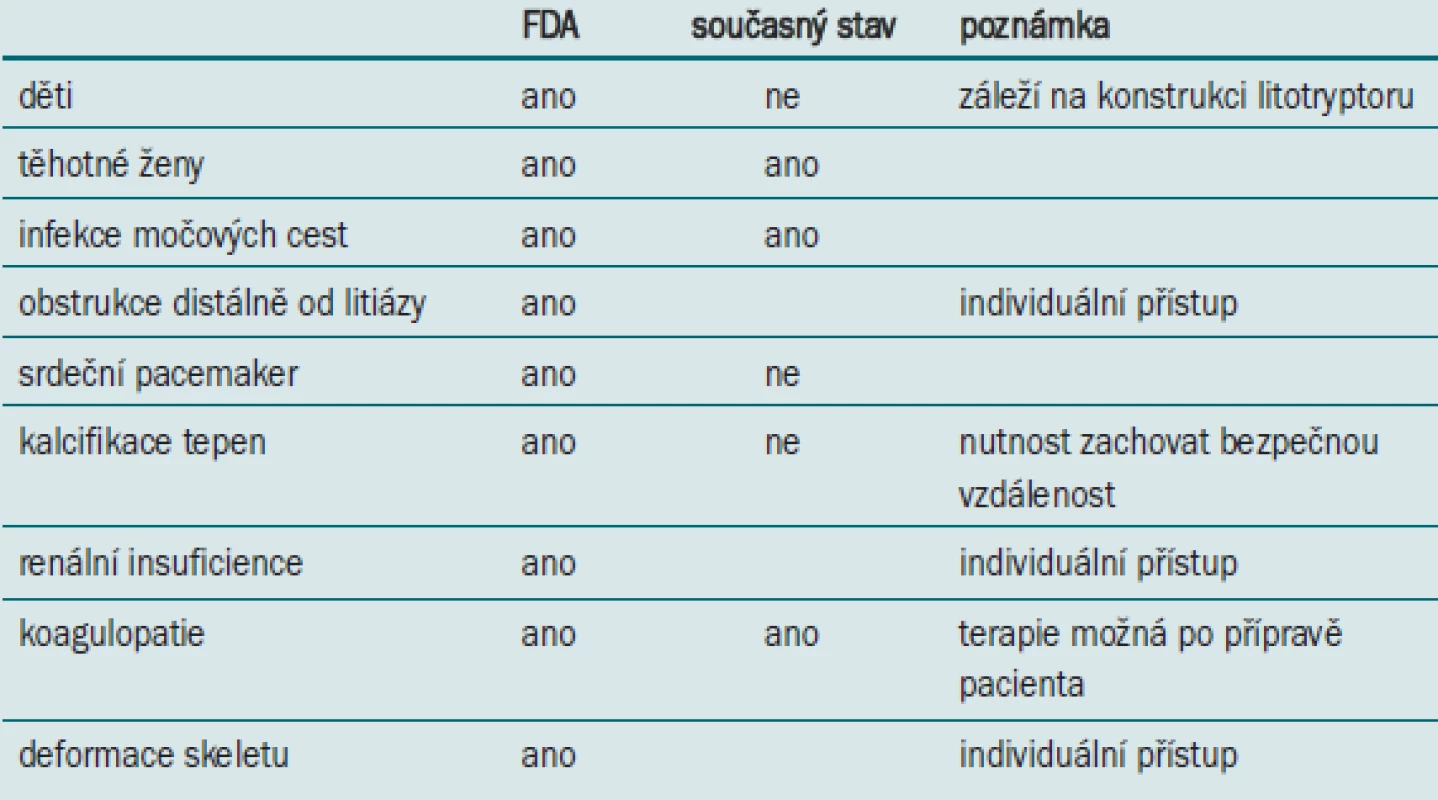
Původní kontraindikace k provedení ESWL byly shrnuty při klinických zkouškách prováděných pro FDA [16]. Postupem času, na podkladě klinických a experimentálních studií, došlo ke zmírnění kontraindikačních kritérií (tab. 1).
Pokud není ESWL kontraindikována, faktory, které ovlivňují indikaci ESWL, lze rozdělit do 3 základních skupin – konkrement (velikost, složení, lokalizace), pacient (anatomické poměry – obezita pacienta, morfologie dutého systému ledviny, solitární ledvina a preference pacienta) a technické faktory (přístroj, ekonomika).
CO SE ZMĚNILO V INDIKACI ESWL?
Výběr pacienta
Pro provedení extrakorporální litotrypse je nutné konkrement v těle pacienta zaměřit do ohniska extrakorporálního litotryptoru, ve kterém dochází ke koncentraci rázových vln. Kromě toho je nutné rázové vlny směrovat tak, aby procházely tkání, která umožní jejich šíření (tedy ne skrze kost či orgány obsahující vzduch). Problémy nastávaly u litotryptoru Dornier HM3, kde pacient byl umisován do vany s vodou, u dětí, pacientů malého vzrůstu, s deformitami skeletu a zejména u obézních pacientů [17]. Současná konstrukce litotryptorů již umožňuje bezproblémovou terapii u dětských pacientů.
U obézních pacientů, respektive pacientů s vysokým Body Mass Index (BMI), je situace stále problematická. Pokud provedeme analýzu výsledků terapie ESWL, je zřejmé zhoršení stone-free rate v závislosti na BMI. Parrek zjistil na souboru 100 pacientů signifikantní rozdíl v BMI u pacientů bez a s reziduální litiázou po terapii (BMI u stone-free pacientů 26,9 ±0,5 versus 30,8 ±0,9 u pacientů s reziduální litiázou; P < 0,05) [18]. Akay dosáhl obdobných výsledků (BMI 23,97 ±0,4 u stone-free a 25,98 ±0,5 u pacientů s reziduální litiázou; P = 0,02) [19]. Samotná obezita zhoršuje možnost terapie již obtížným zobrazením konkrementu. Stěžejním problémem je však nemožnost zaměření konkrementu, tedy nemožnost umístit konkrement do ohniska litotryptoru. Pokud známe z technických dat litotryptoru vzdálenost ohniska od okraje elipsoidu, je možné na nativním spirálním CT změřit odpovídající vzdálenost (vzdálenost mezi konkrementem a povrchem kůže) a vyloučit tak případy, kdy konkrement je nezaměřitelný. Pareek na přístroji DoliS prokázal statisticky signifikantní rozdíl v stone-free rate pacientů, kde vzdálenost konkrement – povrch těla byla pod 10 cm [20]. Robert prokázal na souboru 150 pacientů léčených na piezoelektrickém přístroji EDAP LT02 skutečnost, že konkrementy v ureteru jsou uloženy hlouběji od povrchu těla než konkrementy v ledvině. Porovnáním hloubky uložení konkrementu bylo prokázáno, že při BMI > 25 jsou konkrementy signifikantně uloženy hlouběji (p < 0,00001) [21]. Z hlediska výsledku terapie jsou výsledky lepší u konkre-mentů uložených blíže ke kůži, a to jak v ledvině, tak v ureteru. V ureteru Robert porovnává výsledky při vzdálenosti konkrementů od povrchu těla nad a pod 110 mm, kdy při nižší vzdálenosti dochází k signifikantně lepším výsledkům stone-free rate (85 % versus 57 %, p < 0,05) [21].
Z těchto prací jednoznačně vyplývá, že se zvětšující se vzdáleností konkrementu od povrchu těla klesá účinnost extrakorporální litotrypse. Samotná obezita (jejíž stupeň je vyjádřen BMI) je jen nepřímým vyjádřením nárůstu této vzdálenosti. Přesná vzdálenost, kdy dochází k zhoršení výsledků, je dána geometrickou charakteristikou přístroje, tedy vzdáleností mezi ohniskem a okrajem elipsoidu.
Složení konkrementu
Podstatným faktorem ovlivňujícím výsledek terapie je složení konkrementu. Dretler [22] aplikoval 200 rázových vln při 18 kV na konkrement a měřil podíl fragmentů menších než 2 mm. Stoprocentní dezintegrace dosáhl u kalcium oxalátu dihydrátu a kyseliny močové, nejhorších výsledků pak u cystinu (tab. 2).
Table 2. Dezintegrace konkrementu podle složení. 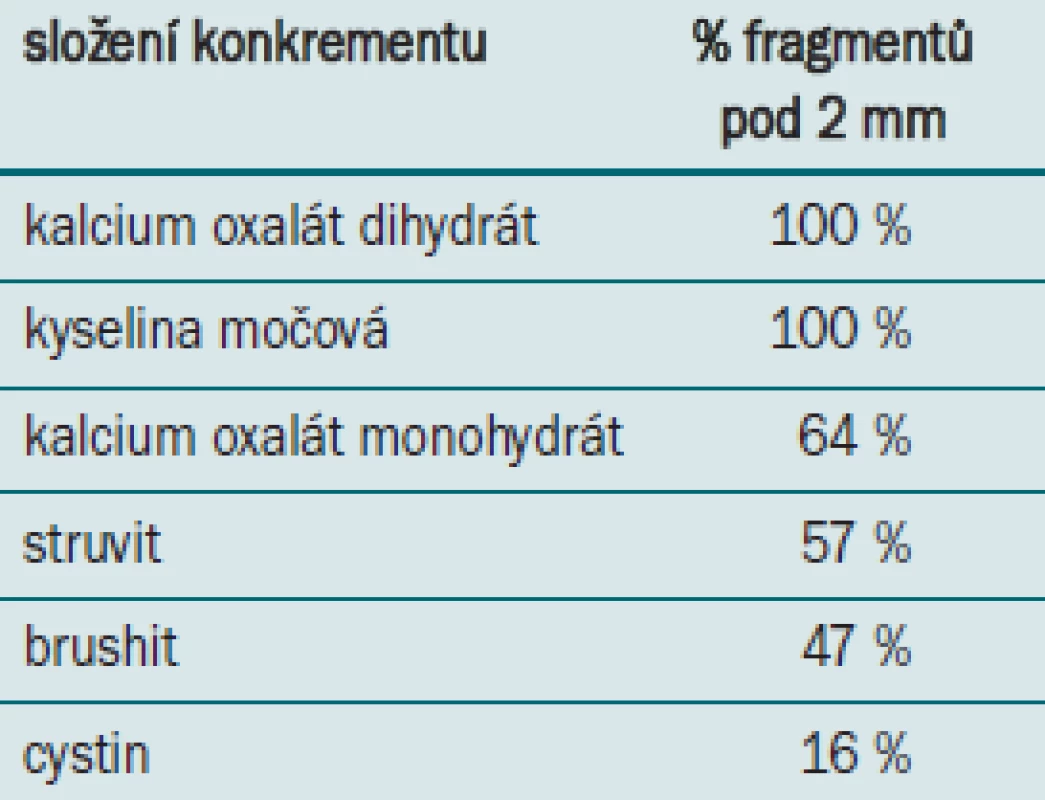
Wiliams [23] při pokusu in vitro došel k obdobným závěrům, zaznamenal však vysokou variabilitu ve fragmentaci (83 ± 15 %) u jednotlivých druhů konkrementů, která byla vyšší než u artificiálních sádrových konkrementů (17 ±8 %).
Jednou z mála klinických prací, která hodnotí výsledek terapie podle složení konkrementu, je publikace Ansariho [24], který porovnává stupeň dosažené fragmentace (I výborný, II dobrý, III uspokojivý, IV nedosaženo fragmentace) pro jednotlivé druhy konkrementů. Do studie bylo zahrnuto celkem 300 konkrementů lokalizovaných jak v ledvině, tak v močovodu. Nejlepší fragmentace bylo dosaženo u urátových konkrementů (100 % typ I) a u konkrementů z kalcium oxalát dihydrátu (63,96 % typ I), nejhorší u kalcium oxalát monohydrátových a u apatitových (44,9 %, resp. 44,44 % typ I). Tyto konkrementy mají také sklon se rozpadat na větší fragmenty.
U konkrementů z cystinu dochází k lepší dezintegraci, pokud mají nerovný povrch, než když je jejich povrch hladký [25].
Pro klinickou praxi je nutné si položit otázku, jak odhadnout složení konkrementu před provedenou terapií. Jistě lze vycházet z předchozího rozboru konkrementu, pokud jej pacient dříve vymočil, či byl-li odstraněn. Proto již od počátku zavedení litotrypse do praxe se vyskytla snaha o odhad efektu terapie podle informací získaných z rentgenového vyšetření. Již v roce 1988 Dretler [22] cituje Chaussyho, který uvádí, že konkrementy, které na nativním nefrogramu dosahují sytosti kosti, jsou špatně dezintegrovatelné. Pareek zaznamenal signifikantní rozdíl v denzitě konkrementů u pacientů, kde došlo ke kompletnímu odchodu drti po výkonu, oproti těm, kde zůstala reziduální litiáza (551,20 ±46,66 versus 926,20 ±51,42 HU, p < 0,0001) [26]. Na základě toho vyslovil domněnku, že výsledek terapie ESWL lze odhadnout pomocí měření denzity konkrementu nativním spirálním CT.
Pro změření denzity konkrementu je nutné si uvědomit omezení daná metodou nativního spirálního CT. Pro změření denzity je nutné, aby rovina řezu prošla středem konkrementu, pravděpodobnost zachycení této roviny je dána krokem CT. Pokud bude CT pracovat s 1 mm krokem spirálního řezu, tak jsme schopni bez významné chyby změřit denzitu konkrementů nad 2,5 mm. Je-li krok CT 3 mm, pak měření je přesné u konkrementů nad 7,5 mm [27]. Pro odečet je pak nutné pro měření nepoužívat abdominální okno (350 W/40 L), ale okno kostní (2500 W/480 L), kde lze rozlišit i strukturu konkrementu [28].
Určit hranici, kdy podle denzity konkrementu ESWL nebude účinné, je obtížné, nebo záleží také na velikosti (objemu) konkrementu a proporcích pacienta. V literatuře se proto setkáváme s hodnotami předpovídajícími neúspěch terapie od 750 HU (Gupta) [29], po 900 HU (Wang) [30] či 1000 HU (El-Nahas) [31]. Kacker nalezl i rozdíl v závislosti na lokalizaci konkrementu, kdy pro ureter byla mezní hodnota 1000 HU a pro ledvinnou pánvičku 640 HU [32].
Nefrolitiáza
Základními faktory pro indikaci extrakorporální litotrypse při terapii konkrementu v ledvině jsou velikost konkrementu a jeho lokalizace v dutém sytému ledviny.
Pro velikost konkrementu obecně platí, že čím je konkrement větší, tím horší je výsledek ESWL terapie. Doporučovanou hranicí pro indikaci ESWL je 20 mm v podélném rozměru konkrementu, měřeném na nativním nefrogramu. U konkrementu nad 20 mm dosahuje extrakorporální litotrypse stone-free rate od 41 do 54 %, oproti tomu perkutánní nefrolitolapaxe (PCNL) od 71 do 95 % [33,34]. U odlitkové litiázy není ESWL primárně indikováno, vzhledem k nízkému stone-free rate 54 % (45–64 %) oproti PCNL 78 % (74–83 %) a výskytu komplikací [34]. Jednoznačné místo ESWL v terapii odlitkové litiázy je však v kombinaci s PCNL, kdy po primárním PCNL je užíváno ESWL k následné terapii z důvodu nutnosti vytvoření dalších traktů pro odstranění reziduální litiázy. Posledním výkonem při sendvičové terapii by vždy mělo být PCNL. Kombinací těchto výkonů lze dosáhnout stone-free rate 66 % (60–72 %).
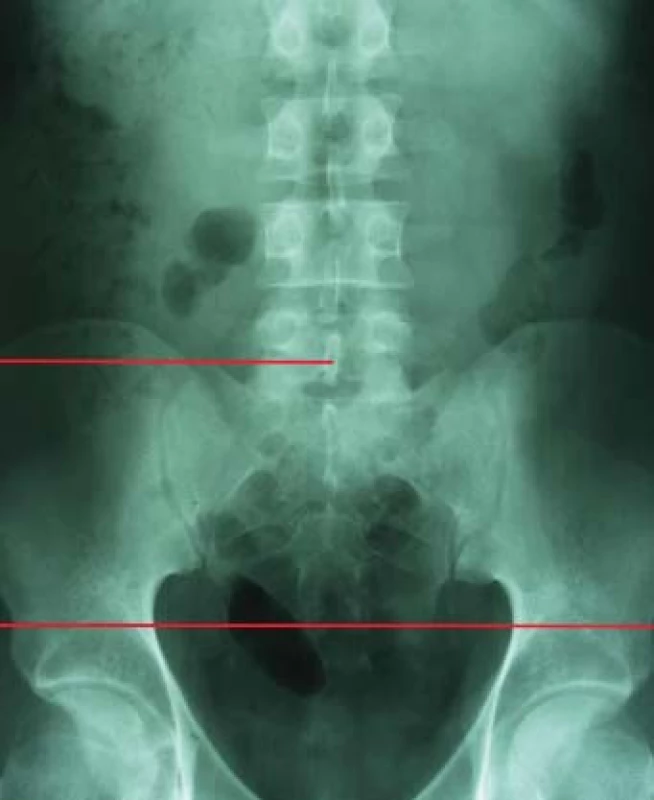
Pro odchod fragmentů po ESWL, a tedy pro výsledek terapie, je nutná příznivá anatomie dutého systému ledviny. V případech stenózy pyelouterální junkce není ESWL indikováno. Stejně tak u litiázy v divertiklech kalichů, kde ESWL dosahuje velmi špatných výsledků (4–58 % stone-free rate) oproti PCNL (85–93 %), která též umožňuje dilataci či discizi stenotické části krčku kalichu [35]. Nejvíce diskutovanou problematikou je terapie litiázy dolního kalichu ledviny, kde morfologie dutého systému ovlivňuje výsledky terapie. Sampaio a Aragao na základě studia pryskyřicových odlitků dutého systému ledviny a porovnání s výsledky vylučovací urografie stanovili 3 základní parametry pro hodnocení morfologie dolního kalichu ledviny: úhel odstupu kalichu, šířku infundibula a hloubku kalichu [36]. V klinické praxi se užívá nejčastěji metodologie měření, kterou publikoval El Bahnasy v roce 1998, kdy měříme úhel, který svírá osa dolního kalichu s ureteropelvickou osou, šířku infundibula dolního kalichu v nejužším místě a hloubku jako vzdálenost mezi nejhlubším místem kalichu a přechodem kalichu a ledvinné pávičky (obr. 1) [37].
Image 1. Měření anatomie dolního kalichu. 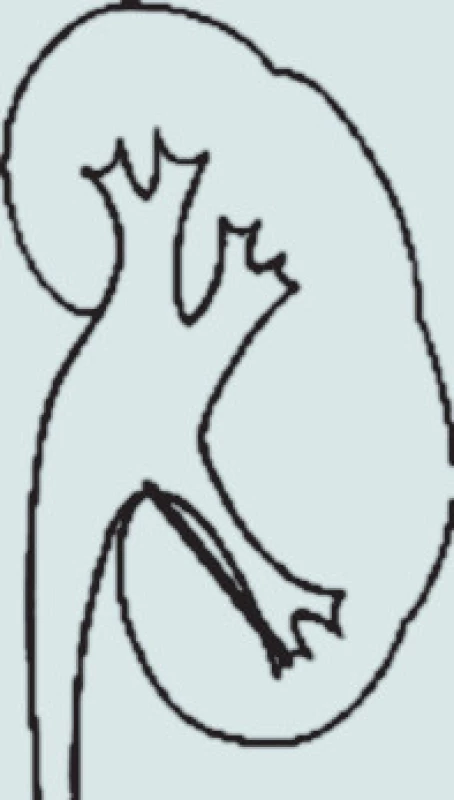
Na základě této studie byla pro úspěšnost terapie stanovena následující kritéria: úhel odstupu větší než 70°, šířka infundibula širší než 5 mm a hloubka kalichu menší než 30 mm. Od té doby publikované studie se příliš od těchto výsledků neodlišují, když úhel odstupu je uváděn od 43 do 72°, hloubka kalichu od 15 do 33 mm a šířka kalichu od 4,9 do 7 mm [38,39,40].
Při srovnání ESWL a PCNL v terapii litiázy dolního kalichu dosahuje jednoznačně PCNL lepších výsledků u konkrementů nad 10 mm (37 % versus 95 % stone-free; p < 0,001) [38].
Ačkoliv flexibilní uretroskopie se stává stále populárnější v terapii renálních konkrementů, dosažené výsledky nedosahují signifikantně lepších hodnot, což dokumentuje Pearle [41] v prospektivní randomizované studii porovnávající terapii konkrementů v dolním kalichu menších než 10 mm, kde bylo dosaženo stone-free rate u ESWL 35 % a u ureteroskopie 50 %. Kromě toho je potřeba zmínit ekonomickou náročnost flexibilní ureteroskopie, kdy se životnost flexibilního uretroskopu pohybuje mezi 10–34 použitími [42].
Výsledky terapie u podkovovité ledviny jsou ovlivněny anatomickými poměry, zejména tím, že ureter přechází přes istmus a často anomálně uložené cévy. Současně je ledvina uložena ventrálněji. Přesto však u menších konkrementů lze dosáhnout stone-free rate od 50 do 79 %, tedy srovnatelných s terapií konkrementů normálních ledvin [34].
Ureterolitiáza
Evropské písemnictví dělí ureterolitiázu na litiázu horní třetiny močovodu (subrenální), zahrnující konkrementy, které se nacházejí kaudálně od pyeloureterálního přechodu po horní okraj sakroiliakálního skloubení. Druhou skupinu tvoří litiáza střední třetiny močovodu, která je ohraničena kraniálně horním okrajem sakroiliakálního skloubení a kaudálně kaudálním okrajem kosti křížové, což přibližně odpovídá místu zkřížení ureteru s ilickými cévami. Třetí skupinu tvoří litiáza dolní třetiny močovodu (juxtavezikální), která je kraniálně vymezena kaudálním okrajem kosti křížové a kaudálně ureterovezikálním spojením [43]. Oproti tomu v americké literatuře se setkáváme s dělením na litiázu proximálního a distálního ureteru, kde předěl tvoří dolní okraj kosti křížové, tedy zkřížení ureteru s ilickými cévami [43,44].
Základní metodou ESWL při terapii ureterolitiázy je litotrypse v místě, kde se konkrement nachází, bez předchozí instrumentace (in situ). Dalšími metodami, které jsou již podstatně méně užívány, jsou: litotrypse druhotně provedená po relokaci konkrementu do dutého systému ledviny (push bang) většinou se zavedeným ureterálním stentem a litotrypse se zavedeným stentem nebo ureterálním katétrem podél konkrementu.
U prvních 2 pacientů léčených ESWL pro ureterolitiázu in situ nedošlo k dezintegraci [45]. Příčinou tohoto stavu bylo uspořádání přístroje Dornier HM3, které neumožňovalo optimální zaměření konkrementu v ureteru a k aplikaci rázových vln docházelo v sagitální rovině. Pokud však byl konkrement relokován do dutého systému ledviny a po zavedení stentu byla provedena litotrypse, zvýšil se success-rate z 50 % na 90 % [46]. Důvodem pro terapii se zavedeným stentem podél konkrementu byla nedostupnost extrakorporální litotrypse a možnost snadnějšího změření litiázy. I přesto, že Cass [47] dosáhl lepších výsledků po zavedení stentu než po relokaci (77 % versus 73 % stone-free rate), bylo prokázáno, že vlastní zavedení stentu do močovodu podél konkrementu snižuje motilitu ureteru a snižuje pravděpodobnost spontánního odchodu konkrementu [48,49,50]. Při vlastní terapii Thompson [51] uvádí jak zhoršení fragmentace in vitro při zavedeném stentu, tak i zvýšení počtu výkonů při zavedeném stentu u pacientů s ureterolitiázou (opakování výkonu 2,26 se stentem, 1,19 bez stentu). Petřík zaznamenal též zvýšení opakování výkonu při zavedení stentu podél konkrementu (in situ 1,56 versus při zavedení stentu 1,92; p < 0,0001). Zavedení stentu či relokace konkrementu proto před ESWL není indikována [52,53].
Stran indikace obecně platí, že je možné provést terapii ESWL v případech, kdy není kontraindikována, kdy je technicky možná (konkrement lze zaměřit do ohniska) a kdy lze očekávat příznivý efekt (dáno obecnými principy, užitým přístrojem a zkušenostmi pracoviště). Nejčastěji užívaný přístup pro terapii ureterolitiázy je dorzální, vyjma litiázy ve střední části močovodu, kde je nutné volit přístup ventrální.
Od počátku 90. let bylo ESWL bráno jako metoda prvé volby v terapii ureterolitiázy. Rozvojem ureteroskopie v poslední době, tedy zavedením semirigidních přístrojů v polovině 90. let a užitím flexibilních ureteroskopů ve spojení s holmium laserem pro dezintegraci litiázy, se však obě metody dostávají na stejnou úroveň. Současně dochází k renesanci konzervativní terapie, kdy u pacientů s kontrolovatelnou symptomatologií u konkrementů do 10 mm je indikován konzervativní postup včetně medikamentózně expulzní terapie. V těchto případech u konkrementů pod 5 mm lze očekávat spontánní odchod v 68 % případů a v 47 % u konkrementů mezi 5 a 10 mm. Užití a blokátorů signifikantně zvyšuje pravděpodobnost odchodu konkrementů a snižuje dobu do jejich odchodu [54–57]. Současné podávání diclofenacu signifikantně snižuje výskyt renálních kolik na den léčby – 22 % versus 44 %, p < 0,01 [58].
Pokud u litiázy proximálního ureteru AUA Ureteral Stones Clinical Guidelines Panel [44] na základě výsledků získaných z metaanalýzy doporučoval u konkrementů pod 10 mm ESWL jako první metodu volby (stone-free pro ESWL in situ 87 % a pro URS 56 %) a u konkrementů nad 10 mm stavěl obě metody společně s perkutánní nefrolitolpaxií na stejnou úroveň (stone-free pro ESWL in situ 76 % a pro URS 44 %), pak 2007 Guidelines for the Management of Ureteral Calculi (společné pro AUA i EAU) [59] na základě výsledků po prvé době terapie (u konkrementů pod 10 mm stone-free pro ESWL in situ 94 % a pro rigidní URS 77 % a flexibilní URS 84 %, u konkrementů nad 10 mm stone-free pro ESWL in situ 94 % a pro rigidní URS 81 %, flexibilní URS data neuvedena) staví obě metody na stejnou úroveň jako metody prvé volby. Tento posun je ještě znatelnější, porovnáme-li současná doporučení s EAU Guidelines on urolithiasis z roku 2001 [60], kde na prvém místě v terapii litiázy proximálního ureteru bylo doporučováno ESWL in situ, na druhém ESWL po relokaci konkrementu, na třetím antegrádní ureteroskopie a retrográdní ureteroskopie až jako čtvrtá metoda volby.
oskopii jako metodu prvé volby. Současné 2007 Guidelines for the Management of Ureteral Calculi doporučují ESWL a URS jako rovnocenné metody prvé volby, přičemž u konkrementů pod 10 mm je stone-free pro ESWL in situ 91 % a pro rigidní URS 92 %, u konkrementů nad 10 mm je stone-free pro ESWL in situ 76 % a pro rigidní URS 80 %.
V terapii litiázy distálního ureteru jak AUA Guidelines z roku 1997, tak EAU Guidelines z roku 2001 doporučují ESWL a URS jako rovnocenné metody prvé volby bez závislosti na velikosti konkrementu (AUA uvádí stone-free rate u konkrementů pod 10 mm u ESWL in situ 85 % a URS 89 %, u konkrementů nad 10 mm u ESWL in situ 50 % a URS 73 %). Současné Guidelines pak považují obě metody za rovnocenné metody prvé volby, přičemž stone-free po prvé době terapie u konkrementů pod 10 je ESWL in situ 86 % a pro rigidní URS 98 % a flexibilní URS 84 %, u konkrementů nad 10 mm je pro ESWL in situ 74 % a pro rigidní URS 94 %.
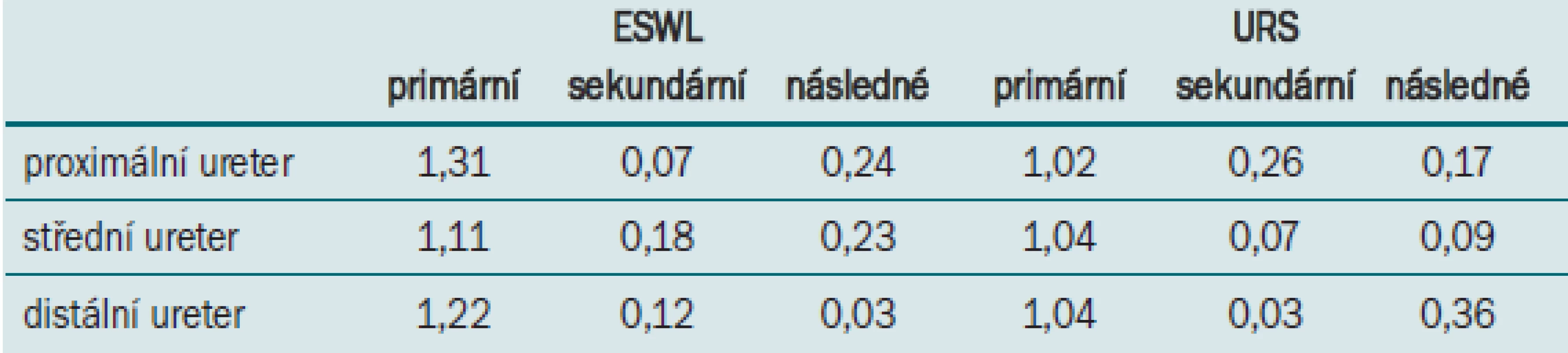
Pro porovnání indikace metod je důležitá skutečnost opakování výkonu. Tabulka 3 převzatá z 2007 Guidelines ukazuje počty výkonů na jednoho pacienta pro ESWL a URS podle loka-lizace konkrementu, přičemž primární výkony jsou ty, které byly primárně indikovány a následně opakovány, sekundární výkony druhotně provedené k odstranění litiázy a následné výkony prováděné k řešení následků či kom-plikací terapie (například odstranění stentu). Z uvedené tab. 3 je zejména patrné charakteristické opakovaní ESWL a vyšší četnost následných výkonů u ureteroskopie.
Při zvažování indikace ESWL a URS je nutné brát v potaz skutečnost, že ESWL je prováděno v analgosedaci, oproti ureteroskopii, která je převážně prováděna v celkové anestezii, a skutečnost vyšší invazivity ureteroskopie a možných rizik komplikací.
V terapii litiázy horní třetiny ureteru primární indikace ESWL přestavuje dobrou volbu, vzhledem k minimální invazivitě. Je potřeba si uvědomit, že pokud chceme provádět kurativní ureteroskopickou terapii litiázy subrenálního ureteru, je třeba mít vždy v záloze flexibilní uretroskop k řešení eventuální relokace konkrementu. Vybavení holmiovým laserem k dezintegraci litiázy je též nezbytností.
I přesto, že ureteroskopie představuje efektivnější metodu oproti ESWL v terapii litiázy dolních dvou třetin ureteru, má ESWL své místo v terapii zejména u pacientů preferujících méně invazivní výkon či u pacientů rizikových s ohledem na celkovou anestezii.
ZÁVĚR
I přes užití nových extrakorporálních litotryptorů v terapii urolitiázy není jednoznačné, zdali dosahují lepších výsledků, či nikoliv. Postupem času došlo k zmírnění kontraindikačních kritérií ESWL tak, že v současnosti je absolutní kontraindikací ESWL pouze gravidita, akutní infekce močových cest a nekorigovatelné koagulopatie.
Podstatným přínosem v indikaci ESWL je užití nativního spirálního CT, nebo umožňuje změřit vzdálenost mezi konkrementem a povrchem těla a tím selektovat konkrementy, které nelze zaměřit, a současně změřením denzity konkrementu odhadnout složení konkrementu a tím i výsledek terapie.
V indikaci ESWL při terapii nefrolitiázy nedochází k podstatným změnám, stále platí hranice 20 mm velikosti konkrementu a anatomická omezení v terapii litiázy dolního kalichu ledviny. U objemnější litiázy a u odlitkové je primárně indikováno PCNL. Retrográdní ureteroskopická terapie nefrolitiázy prozatím nedosahuje lepších výsledků než ESWL.
V terapii ureterolitiázy je ureteroskopie indikačně srovnatelnou metodou, s vyšší efektivitou než ESWL, a to i v horní třetině ureteru. Přesto jsou však obě metody doporučovány jako metody prvé volby u symptomatických pacientů. Zavedení stentu podél konkrementu či relokace litiázy do dutého systému ledviny nezlepšuje výsledky ESWL. U ureterolitiázy menší než 1 cm, která nečiní pacientovi výrazných obtíží, je vždy nutné uvažovat o konzervativní medikamentózní terapii. Pro indikaci ESWL v terapii ureterolitiázy hovoří nižší invazivita a užití analgosedace při terapii, pro ureteroskopii vyšší efektivita výkonu a kratší doba za cenu vyšší invazivity.
Pokud si bude i nadále ESWL chtít udržet své místo v terapii urolitiázy, je nutný návrat k základnímu výzkumu rázových vln a vývoj nových, účinnějších přístrojů.
MUDr. Aleš Petřík, Ph.D.
Urologické oddělení Nemocnice české Budějovice, a. s.
B. Němcové 54, 370 87 české Budějovice
petrik@nemcb.cz
Sources
1. Chaussy C, Brendel W, Schmiedt E. Extracorporeally induced destruction of kidney stones by shock waves. Lancet 1980; 8207 : 1265–1268.
2. Eisenmenger W. The Mechanism of Stone Fragmentation in ESWL. Ultrasound Med Biol 2001; 27 : 583–693.
3. Hochreiter WW, Danuser H, Perrig M, Studer UE. Extracorporeal shock wave lithotripsy for distal ureteral calculi: what a powerful machine can achieve. J Urol 2003; 169 : 878–880.
4. Nomikos MS, Sowter SJ, Tolley DA. Outcomes using a fourth-generation lithotripter: a new benchmark for comparison? BJU Int 2007; 100 : 1356–1360.
5. Portis AJ, Yan Y, Pattaras JG et al. Matched pair analysis of shock wave lithotripsy effectiveness for comparison of lithotriptors. J Urol 2003; 169 : 58–62.
6. Eisenmenger W, Du XX, Tang C et al. The first clinical results of „wide-focus and low-pressure“ ESWL. Ultrasound Med Biol 2002; 28 : 769–774.
7. Evan AP, McAteer JA, Connors BA et al. Independent assessment of a wide-focus, low-pressure electromagnetic lithotripter: absence of renal bioeffects in the pig. BJU Int 2008; 101 : 382–388.
8. Mishriki SF, Cohen NP, Baker AC et al. Choosing a powerful lithotriptor. Br J Urol 1993; 71 : 653–660.
9. Tolley DA. Consensus on lithotriptor terminology. World J Urol 1993; 11 : 37–42.
10. Tolley DA, Wallace DM, Tiptaft RC. First UK consensus conference on lithotriptor terminology – 1989. Br J Urol 1991; 67 : 9–12.
11. Denstedt JD, Clayman RV, Preminger GM. Efficacy quotient as a means of comparing lithotripters. J Endourol 1990; 3 : 100.
12. Preminger GM, Clayman R. The changing face of lithotripsy: impact of second generation machines. In: Proceedings of the 7th World Congress on Endourology and ESWL, Kyoto, Japan, 1989 : 187.
13. Clayman RV, McClennan B, Garvin TD et al. Lithostar, an electromagnetic acoustic shock wave unit for extracorporeal lithotripsy. J Endourol 1989; 3 : 307.
14. Rassweiler J, Köhrmann K, Jünemann KP, Alken P. Use of electromagnetic technology. In: Smith AD. Controversies in endourology. Philadephia: W. B. Saunders 1995 : 95–106.
15. Holm-Nielsen A, Jorgensen T, Mogensen P, Fogh J. The prognostic value of probe renography in ureteric stone obstruction. Br J Urol 1981; 53 : 504–507.
16. McCullough DL. Extracorporeal Shock Wave Lithotripsy. In: Walsh PC et al (eds). Campbell's Urology. Philadephia: W. B. Saunders 1992 : 2157–2182.
17. D'Addessi A, Bongiovanni L, Sasso F et al. Extracorporeal shock wave lithotripsy in pediatrics. J Endourol 2008; 22 : 1–12.
18. Pareek G, Armenakas NA, Panagopoulos G et al. Extracorporeal shock wave lithotripsy success based on body mass index and Hounsfield units. Urology 2005; 65 : 33–36.
19. Akay AF, Gedik A, Tutus A et al. Body mass index, body fat percentage, and the effect of body fat mass on SWL success. Int Urol Nephrol 2007; 39 : 727–730.
20. Pareek G, Hedican SP, Lee FT Jr, Nakada SY. Shock wave lithotripsy success determined by skin-to-stone distance on computed tomography. Urology 2005; 66 : 941–944.
21. Robert M, A'Ch S, Lanfrey P et al. Piezoelectric shock wave lithotripsy of urinary calculi: comparative study of stone depth in kidney and ureter treatments. J Endourol 1999; 13 : 699–703.
22. Dretler SP. Stone fragility – a new therapeutic distinction. J Urol 1988; 139 : 1124–1127.
23. Williams JC, Saw KC, Paterson RF et al. Variability of renal stone fragility in shock wave lithotripsy. Urology 2003; 61 : 1092–1096.
24. Ansari MS, Gupta NP, Seth A et al. Stone fragility: its therapeutic implications in shock wave lithotripsy of upper urinary tract stones. Int Urol Nephrol 2003; 35 : 387–392.
25. Bhatta KM, Prien EL Jr, Dretler SP. Cystine calculi – rough and smooth: a new clinical distinction. J Urol 1989; 142 : 937–940.
26. Pareek G, Armenakas NA, Fracchia JA. Hounsfield units on computerized tomography predict stone-free rates after extracorporeal shock wave lithotripsy. J Urol 2003; 169 : 1679–1681.
27. Williams JC Jr, Saw KC, Monga AG et al. Correction of helical CT attenuation values with wide beam collimation: in vitro test with urinary calculi. Acad Radiol 2001; 8 : 478–483.
28. Williams JC Jr, Paterson RF, Kopecky KK et al. High resolution detection of internal structure of renal calculi by helical computerized tomography. J Urol 2002; 167 : 322–326.
29. Gupta NP, Ansari MS, Kesarvani P et al. Role of computed tomography with no contrast medium enhancement in predicting the outcome of extracorporeal shock wave lithotripsy for urinary calculi. BJU Int 2005; 95 : 1285–1288.
30. Wang LJ, Wong YC, Chuang CK et al. Predictions of outcomes of renal stones after extracorporeal shock wave lithotripsy from stone characteristics determined by unenhanced helical computed tomography: a multivariate analysis. Eur Radiol 2005; 15 : 2238–2243.
31. El-Nahas AR, El-Assmy AM, Mansour O, Sheir KZ. A prospective multivariate analysis of factors predicting stone disintegration by extracorporeal shock wave lithotripsy: the value of high-resolution noncontrast computed tomography. Eur Urol 2007; 51 : 1688–1693.
32. Kacker R, Zhao L, Macejko A et al. Radiographic parameters on noncontrast computerized tomography predictive of shock wave lithotripsy success. J Urol 2008; 179 : 1866–1871.
33. Albala DM, Assimos DG, Clayman RV et al. Lower pole I: a prospective randomized trial of extracorporeal shock wave lithotripsy and percutaneous nephrostolithotomy for lower pole nephrolithiasis-initial results. J Urol 2001; 166 : 2072–2080.
34. Preminger GM, Assimos DG, Lingeman JE et al. AUA Nephrolithiasis Guideline Panel. Chapter 1: AUA guideline on management of staghorn calculi: diagnosis and treatment recommendations. J Urol 2005; 173 : 1991–2000.
35. Wen CC, Nakada SY. Treatment selection and outcomes: renal calculi. Urol Clin North Am 2007; 34 : 409–419.
36. Sampaio FJ, Aragao AH. Inferior pole collecting system anatomy: its probable role in extracorporeal shock wave lithotripsy. J Urol 1992; 147 : 322–324.
37. El Bahnasy AM, Shalhav AL, Hoenig DM et al. Lower caliceal stone clearance after shock wave lithotripsy or ureteroscopy: the impact of lower pole radiographic anatomy. J Urol 1998; 159 : 676–682.
38. Albala DM, Assimos DG, Clayman RV et al. Lower pole I: a prospective randomized trial of extracorporeal shock wave lithotripsy and percutaneous nephrostolithotomy for lower pole nephrolithiasis-initial results. J Urol 2001; 166 : 2072–2080.
39. Gupta NP, Singh DV, Hemal AK, Mandal S. Infundibulopelvic anatomy and clearance of inferior caliceal calculi with shock wave lithotripsy. J Urol 2000; 163 : 24–27.
40. Ghoneim IA, Ziada AM, Elkatib SE. Predictive factors of lower calyceal stone clearance after Extracorporeal Shockwave Lithotripsy (ESWL): a focus on the infundibulopelvic anatomy. Eur Urol 2005; 48 : 296–302.
41. Pearle MS, Lingeman JE, Leveillee R et al. Prospective, randomized trial comparing shock wave lithotripsy and ureteroscopy for lower pole caliceal calculi 1 cm or less. J Urol 2005; 173 : 2005–2009.
42. User HM, Hua V, Blunt LW et al. Performance and durability of leading flexible ureteroscopes. J Endourol 2004; 18 : 735–738.
43. Whitfield HN. The management of ureteric stones. Part II: therapy. BJU Int 1999; 84(8): 916–921.
44. Segura JW, Preminger GM, Assimos DG et al. Ureteral stones clinical guidelines panel summary. Report on the management of ureteral calculi. J Urol 1997; 158 : 1915–1921.
45. Chaussy C, Schmiedt E, Jocham D et al. First clinical experience with extracorporeally induced destruction of kidney stones by shock waves. J Urol 1982; 127 : 417–420.
46. Chaussy C, Schmiedt E. Shock wave treatment for stones in the upper urinary tract. Urol Clin North Am 1983; 10 : 743–750.
47. Cass AS. Do upper ureteral stones need to be manipulated (push back) into the kidney before extracorporeal shock wave lithotripsy? J Urol 1992; 147 : 349–351.
48. Payne SR, Ramsay JW. The effects of double J stents on renal pelvic dynamics in the pig. J Urol 1988; 140 : 637–641.
49. Ryan PC, Lennon GM, McLean PA, Fitzpatrick JM. The effects of acute and chronic JJ stent placement on upper urinary tract motility and calculus transit. Br J Urol 1994; 74 : 434–439.
50. Ramsay JW, Payne SR, Gosling PT et al. The effects of double J stenting on unobstructed ureters. An experimental and clinical study. Br J Urol 1985; 57 : 630–634.
51. Thompson AC, Shamsuddin AB, Mishriki SF et al. In situ ESWL for ureteric stones: the adverse effect of JJ stenting. Br J Urol 1996; 77(suppl 1): 5.
52. Petřík A, Záura F, Beneš J. Vliv stentingu na dezintegraci ureterolitiázy in vitro. čes Urol 2004; 3 : 45–48.
53. Petřík A, Alterová E, Fiala M et al. Vliv stentingu na dezintegraci ureterolitiázy in vivo. čes Urol 2006; 1 : 59–63.
54. Dellabella M, Milanese G, Muzzonigro G. Efficacy of tamsulosin in the medical management of juxtavesical ureteral stones. J Urol 2003; 170 : 2202 – 2205.
55. Borghi L, Meschi T, Amato F et al. Nifedipine and methylprednisolone in facilitating ureteral stone passage: A randomized, double-blind, placebo-controlled study. J Urol 1994; 152 : 1095–1098.
56. De Sio M, Autorino R, Di Lorenzo G et al. Medical expulsive treatment of distal-ureteral stones using tamsulosin: a single-center experience. J Endourol 2006; 20 : 12–16.
57. Kupeli B, Irkilata L, Gurocak S et al. Does tamsulosin enhance lower ureteral stone clearance with or without shock wave lithotripsy? Urology 2004; 64 : 1111–1115.
58. Laerum E, Ommundsen OE, Gronseth JE et al. Oral diclofenac in the rophylactic treatment of recurrent renal colic. A double-blind comparison with placebo. Eur Urol 1995; 28 : 108–111.
59. Preminger GM, Tiselius HG, Assimos DG et al. 2007 guideline for the management of ureteral calculi. J Urol 2007; 178 : 2418–3421.
60. Tiselius HG, Ackermann D, Alken P et al. Working party on lithiasis, European Association of Urology. Guidelines on urolithiasis. Eur Urol 2001; 40 : 362–371.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2008 Issue 3-
All articles in this issue
- Stenóza PUJ – antegrádní a retrográdní endopyelotomie, laparoskopická pyeloplastika. Správné indikace, pro a proti
- Terapeutická endourologie: karcinom z přechodných buněk lokalizovaný v horních cestách močových
- Kombinovaná léčba BHP – aktuální stav
- Ortotopická neovezika – současný stav
- Dnešní indikace extrakorporální litotrypse v léčbě urolitiázy – co se změnilo?
- Dnešní možnosti ureteroskopie
- Objemná nefrolitiáza – perkutánní litotrypse, nebo retrográdní intrarenální operace?
- Terapeutická endourologie: obstrukce ureteropelvické junkce
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Stenóza PUJ – antegrádní a retrográdní endopyelotomie, laparoskopická pyeloplastika. Správné indikace, pro a proti
- Dnešní možnosti ureteroskopie
- Objemná nefrolitiáza – perkutánní litotrypse, nebo retrográdní intrarenální operace?
- Ortotopická neovezika – současný stav
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career