-
Medical journals
- Career
ÚLOHA UROLOGA V IVF-PROGRAMU PŘI DIAGNOSTICE A LÉČBĚ NEPLODNÉHO PÁRU
Authors: MUDr. Vladimír Sobotka 1; MUDr. Jiří Heráček 2,3
Authors‘ workplace: Sanatorium Pronatal, Praha 1; Urologická klinika 3. LF UK a FN KV, Praha 2; Androgeos - soukromé urologické a andrologické centrum, Praha 3
Published in: Urol List 2006; 4(1): 20-25
Overview
Autoři ukazují na funkčním modelu algoritmus diagnostiky a léčby mužů s poruchou plodnosti v centru asistované reprodukce. U mužů s azoospermií odebíráme spermie pomocí invazivních výkonů na varleti (mikro-testicular sperm extraction - mikroTESE) a nadvarleti (MESA). Využití spermií je limitováno výsledkem genetických vyšetření a zralostí odebraných spermií. Součástí zavedeného systému je zajištění fertility u mužů s vrozenými poruchami plodnosti a u pacientů po poranění míchy, a to na základě spolupráce s klinickými pracovišti, která tyto pacienty dispenzarizují. Pro zajištění fertility u onkologicky nemocných pacientů považují autoři za velmi důležité vybudování bezpečně fungujícího systému spolupráce zdravotnických zařízení, která se zabývají onkologickou léčbou a centry asistované reprodukce, která disponují standardní a kvalitní kryokonzervací.
KLÍČOVÁ SLOVA:
neplodný pár, centrum asistované reprodukce, azoospermie, ICSI, MESA, TESE, reprodukční genetika, kryokonzervaceÚVOD
Podle údajů Světové zdravotnické organizace žije na světě 8–10 % nechtěně neplodných párů [1]. V ČR se odhaduje podíl neplodných párů na více než 12 %. Podíl muže na neplodnosti páru nebyl vždy historicky jasně deklarován, v současné době však nejsou pochyby, že andrologický faktor je více než poloviční [2].
V minulosti byla také zcela nedostatečná diagnostika poruch plodnosti mužů, a navíc její léčbu, povětšinou empirickou, prováděli převážně lékaři jiných odborností než urologové. Hlavní pozornost se věnovala řešení otázek fertilizace s použitím stále menšího počtu spermií. Tato snaha vyvrcholila v 90. letech minulého století, kdy po rutinním ověření metodiky na zvířecím modelu byla provedena v roce 1992 intracytoplazmatická injekce spermie muže do vajíčka ženy (intracytoplazmic sperm injection - ICSI). První gravidita po ICSI potvrdila úspěšnost metody, a tím odstartovala novou éru v asistované reprodukci. [3] Po úvodních pochybách o smysluplnosti a bezpečnosti této metody došlo k jejímu překotnému zavedení (v roce 1993 - 3 157 cyklů, dále v roce 1994 - 12 586 a roce 1995 - 47 654 cyklů s ICSI) [4,5]. V současné době je více než polovina všech cyklů mimotělního oplození realizována pomocí ICSI. Poměr záleží na přístupu jednotlivých center k indikaci ICSI (obr. 1). Rutinní zavedení intracytoplazmatické injekce do procesu mimotělního oplození byl čin, který zcela změnil indikace k asistované reprodukci a umožnil efektivní léčbu zejména u párů s mužským faktorem sterility. Bez nadsázky lze říci, že k oplození jednoho oocytu postačí jedna motilní spermie.
Image 1. ICSI - spermie na konci pipety. 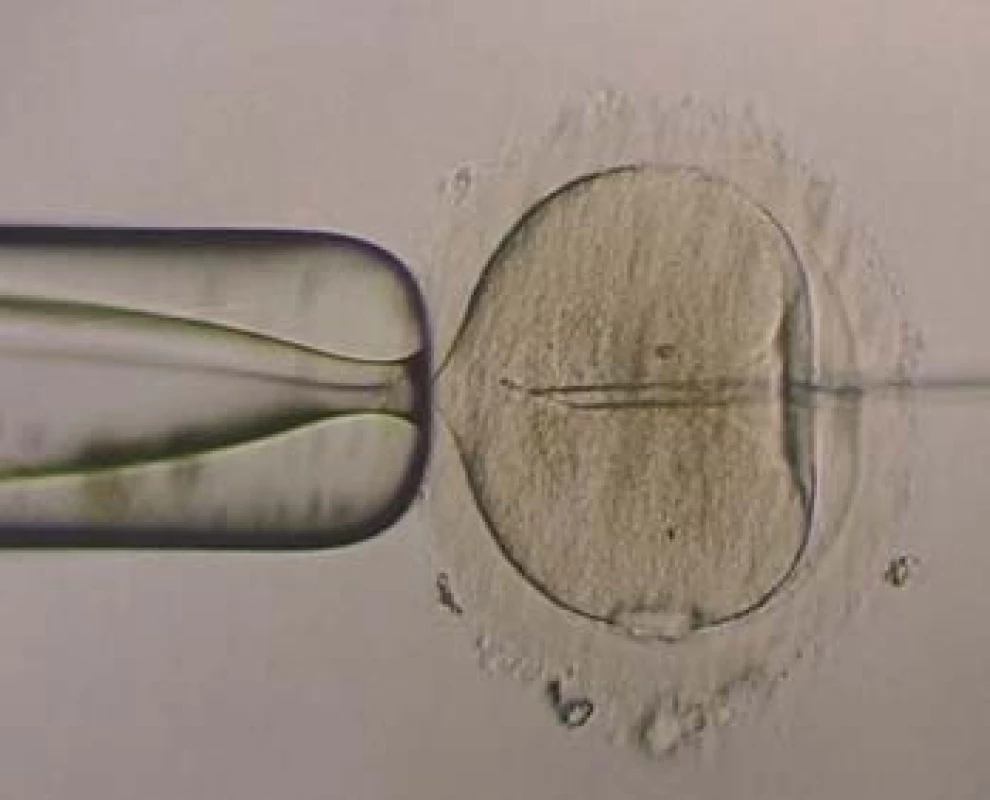
Požadavek na počet spermií nutných k fertilizaci tak ze dne na den poklesl o 6 řádů. Riedel et al prokázali, že minimální množství spermií ke standardnímu IVF je 5 × 106 s 30% progresivní motilitou a s 30% normální morfologií (obr. 2) [6], ale po zavedení ICSI ze dne na den vznikl požadavek na zisk i jednotlivých spermií u mužů s nejtěžšími poruchami spermatogeneze. To byl důvod k zařazení urologa do vyšetřovacího a léčebného algoritmu neplodného páru. Současná představa o racionální diagnostice a léčbě se opírá o nejužší spolupráci gynekologa, který koordinuje práci týmu, dále pak urologa, embryologa, genetika, případně imunologa, endokrinologa a psychologa. Pevné místo urologa, který zodpovídá za diagnostiku a léčbu muže, si vynutilo jistou koncepci a vymezení andrologie, jako podoboru urologie, který se specializuje na diagnostiku a léčbu reprodukčních orgánů muže.
Image 2. Spermie navázané na zona pellucida oocytu - standardní IVF. 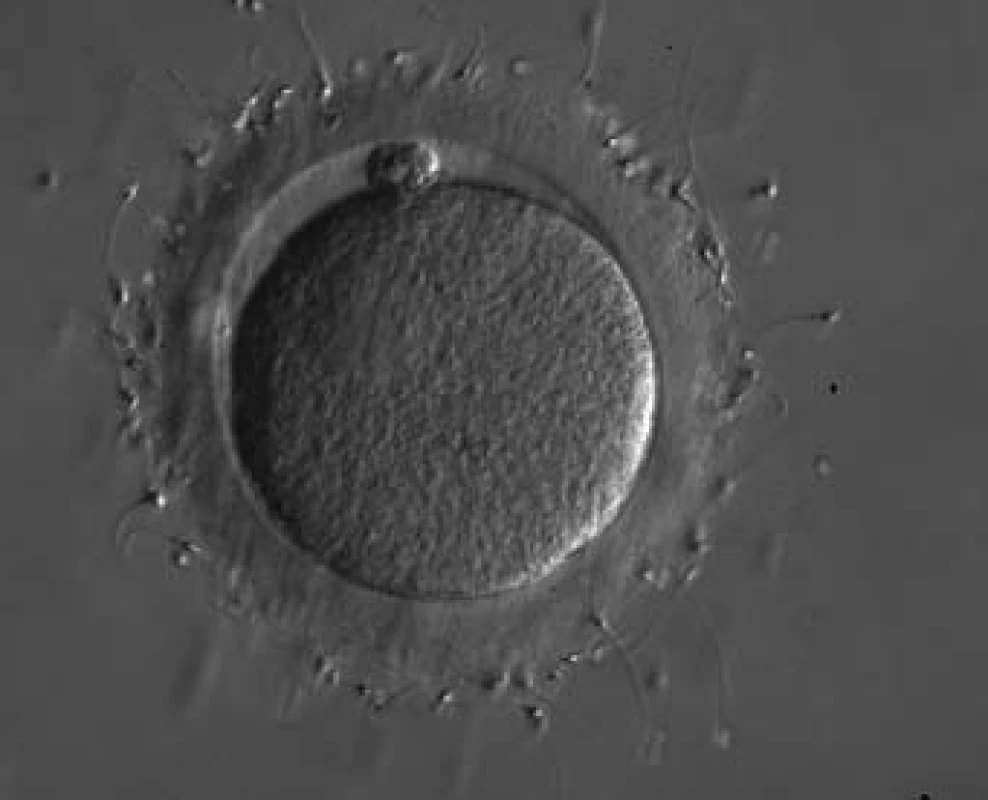
Základní úkoly urologa androloga v IVF týmu jsou:
- diagnostika a léčba mužů s poruchou plodnosti
- invazivní odběr spermií u neplodných mužů
- vyšetřování, výběr a sledování dárců spermií
- organizace odběru spermií u mužů před předpokládanou poruchou plodnosti (např. pacienti s onkologickým onemocněním, po míšním poranění, u endokrinních poruch).
1. DIAGNOSTIKA A LÉČBA MUŽŮ S PORUCHOU PLODNOSTI
Základním vyšetřením muže je spermiogram, tj. standardizované vyšetření ejakulátu [7,8], které posuzuje množství, vzhled, pH a množství spermií v objemové jednotce, životnost, percentuální podíl pohyblivých spermií z celkového počtu a kvalitu jejich pohybu, dále pak hodnotí kvalitu spermií podle stavby a lokalizace jejich poškození. Ve spermiogramu hodnotíme také příměsi, jako jsou bílé a červené krvinky, bakterie, protozoa a zbytky výstelky kanálků varlete. Na základě hodnot spermiogramu a výsledku fertilizace jsou indikována další speciální vyšetření spermií, např. striktní morfologie dle Krugera [9,10] nebo akrozomální reakce. Při odchylce spermiogramu od normy následuje klinické vyšetření urologem, který na základě zhodnocení anamnézy (prodělané operace, nemoci, manipulace s těžkými kovy, expozice ionizačním zářením, zlozvyky jako je abúzus alkoholu, drog a tabáku nebo užívání některých léků), fyzikálního vyšetření (celkový habitus, velikost, tvar, uložení varlat a nadvarlat, vyšetření per rectum, sonografie), hormonálního vyšetření (FSH, LH, prolaktin, testosteron), genetického vyšetření (cytogenetické ke zjištění karyotypu a molekulárně genetické k vyloučení mutace genu pro cystickou fibrózu a mikrodelece chromozomu Y), případně zobrazovacích metod (CT, NMR) zjišuje příčinu poruch plodnosti (schéma). Téměř polovina všech poruch je v současné době nevysvětlitelná.
Schéma. Vyšetřovací schéma muže v neplodném páru v Sanatoriu Pronatal. 
Rozporuplné názory provázejí diskuse o známých příčinách snížené mužské plodnosti, kterým dominuje varikokéla, zmnožení a zvýšená náplň žilních pletení nad varletem, které je vzhledem k anatomickým poměrům zpravidla vlevo. Tento stav způsobuje zvýšený ohřev tkáně varlete, čímž není zachován požadavek, že teplota varlete má být o 2–4 oC nižší než teplota organizmu. Tato hodnota je nutná ke zdárnému vývoji spermií. Negativně se promítá také zvýšení hydrostatického tlaku až na buněčnou úroveň a imunitní odezvou organizmu jsou vytvářeny protilátky proti zárodečnému epitelu varlete, a tak je poškozováno i druhostranné varle, které je žilní poruchy prosto. Není prokázána přímá úměra mezi velikostí varikokély a stupněm poškození varlete. Časový průběh a stupeň poškození varlete je rovněž zcela nevypočitatelný. Řešením je přerušení insuficientní žíly nebo žil buď otevřenou cestou, laparoskopicky, nebo její obliterace cévní cestou. Na podobném principu negativně ovlivňují plodnost nesestouplá varlata, která mají navíc v dospělosti několikanásobně vyšší incidenci malignizace. Věková hranice pro korekci bez předpokladu dalších poškození gonád jsou 2 roky věku chlapce. Každá poloha varlete mimo skrotum má být proto korigována, v dospělosti pak varle odstraněno. Vysloveně zhoubný vliv na tvorbu a maturaci spermií mají alkohol, nikotin a drogy. Často diskutovanou příčinou snížené plodnosti mužů jsou tzv. civilizační faktory: permanentní stres, sedavé zaměstnání, složení potravy, abúzus alkoholu, nikotinu, drog, nevhodné oděvy, promořenost prostředí sloučeninami s volnými radikály, toxiny, těžkými kovy a pesticidy. Především polychlorované bifenyly jsou mimořádně nebezpečné globálním promořením půdy, dlouhým poločasem rozpadu a biologicky aktivním působením.
Neobstrukční azoospermie mají příčiny jednak na úrovni varlete (vrozené - např. Klinefelterův syndrom, vrozená anorchie, kryptorchizmus a další chromozomální defekty nebo získané - orchitidy, torze, následkem orchiektomie, aktino - nebo chemoterapie). Pretestikulární azoospermii způsobují např. hypogonadotropní hypogonadizmy, trauma, tumor, meningitida, izolovaný deficit FSH a následky po hormonální léčbě, zejména kortikoidy a testosteronem [11].
V etiologii obstrukční azoospermie dominují vrozené vady transportu spermií CBAVD (congenital bilateral absence of the vas deferens), cystická fibróza, v získaných příčinách jsou to především záněty nadvarlat a varlat a iatrogenní příčiny (vazektomie, operace hydrokély, tříselné kýly, operace v pánvi).
Léčba poruch plodnosti muže se opírá o řešení příčin, tyto jsou však asi v polovině případů neznámé. Randomizovanými studiemi nebyla potvrzena účinnost empiricky podávaných léků, podpůrných přípravků nebo potravinových doplňků, mimo hormonální substituce při prokázané depleci.
Chirurgická léčba se zaměřuje na odstraňování příčin, které mohou vést ke snížení spermatogeneze nebo transportu spermií z nadvarlete (hydrokéla, varikokéla, retence varlat, refertilizační operace po vazektomii). K zisku spermií pro potřeby asistované reprodukce je však efektivnější invazivní zisk z nadvarlete. Při obstrukční azoospermii je pak efektivita výkonu 100%.
2. INVAZIVNÍ ODBĚR SPERMIÍ U NEPLODNÝCH MUŽŮ
Azoospermii dělíme na obstrukční a neobstrukční, metody odběru spermií se liší podle příčiny azoospermie.
Diagnóza obstrukční azoospermie se opírá o anamnézu (zánětlivá onemocnění, vazektomie, operace v malé pánvi), při fyzikálním vyšetření nacházíme fyziologický nález na varlatech, a naopak tuhá, „plná“ nadvarlata. Pravidlem jsou fyziologické hladiny hormonů včetně FSH. K odběru spermií využíváme metod MESA a PESA.
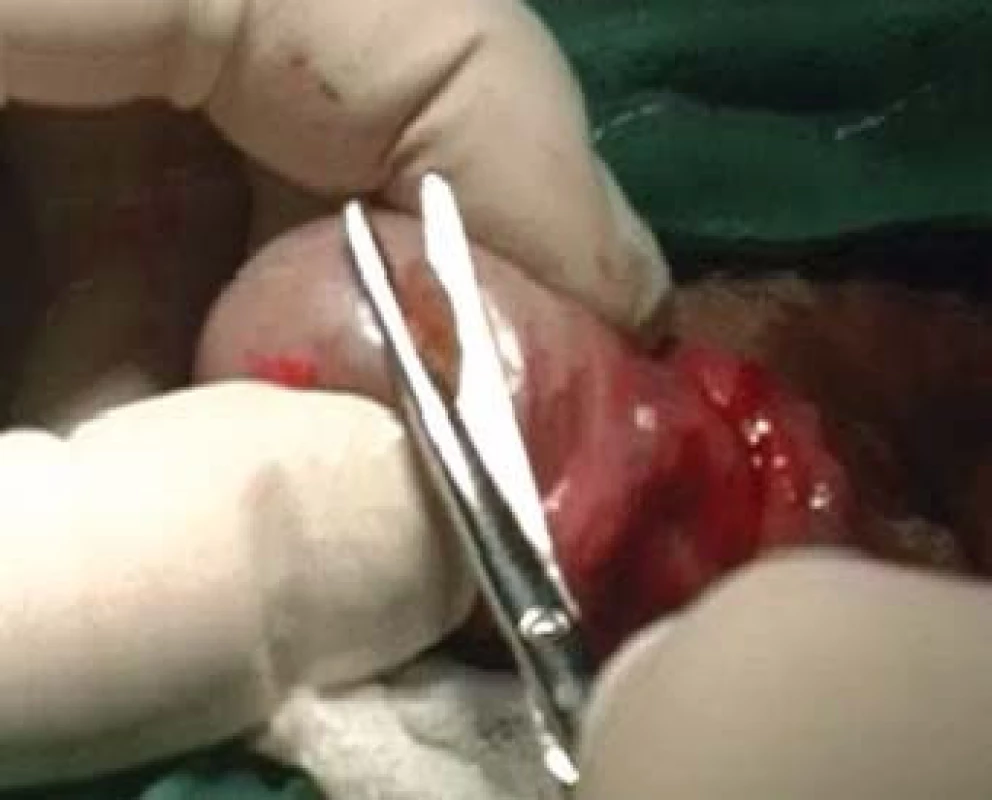
MESA (microsurgical epididymal sperm aspiration) je odběr spermií pod optickou kontrolou, tzv. otevřenou cestou, aspirací tekutiny z dilatovaných kanálků nadvarlete (obr. 3).
Image 3. MESA u pacienta s obstrukční azoospermií. 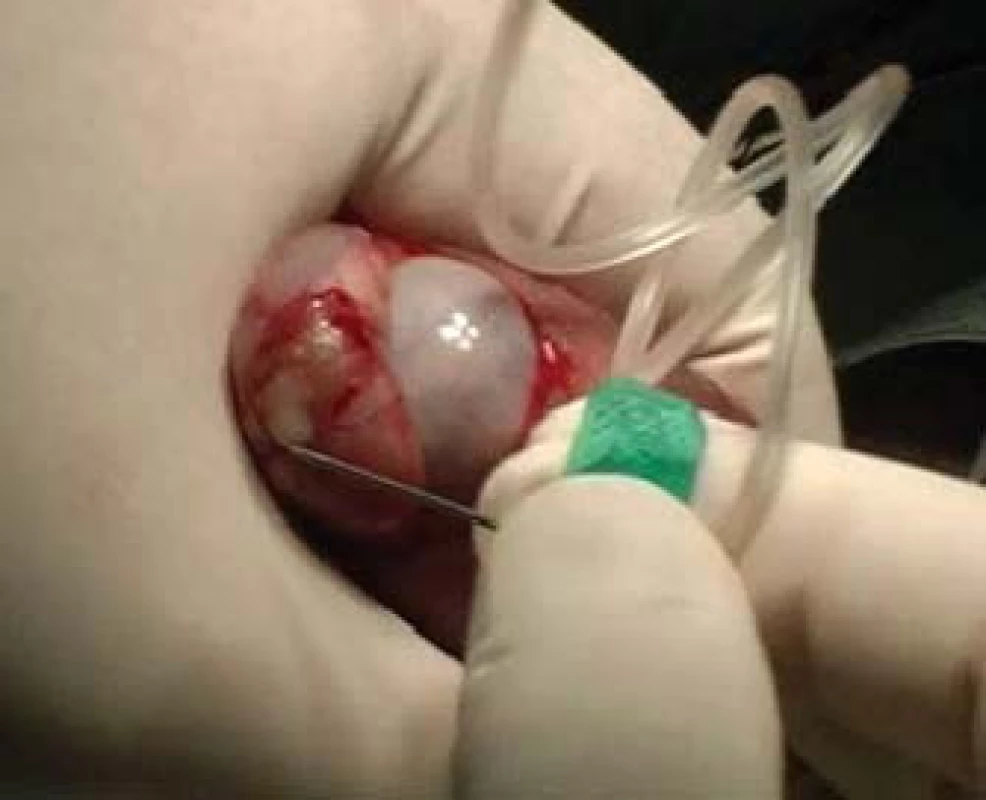
PESA (percutaneus epididymal sperm aspiration), FNA (fine needle aspiration) jsou transkutánní, tzv. naslepo prováděné výkony, při kterých je punktováno nadvarle bez optické kontroly.
Při neobstrukční azoospermii nacházíme při fyzikálním vyšetření změnu velikosti, konzistence nebo uložení varlat, kolaps nadvarlat a vyšší hodnoty FSH. Anamnesticky můžeme zjistit informace o maldescensu, prodělaných zánětech varlat, nebo expozici toxinů a ionizačního záření.
TESE, mikroTESE (testicular sperm extraction) jsou operační výkony, při nichž odebíráme pod optickou kontrolou kanálky varlete buď jednotlivými incisemi tuniky albuginey (obr. 4) a tkáň v laboratoři následně mechanicky destruujeme a hledáme spermie, nebo tuniku protneme po konvexitě varlete (obr. 5), varle rozevřeme „jako knihu“ a pod optickým zvětšením operačního mikroskopu (obr. 6) vyhledáme dilatované úseky kanálků, u kterých předpokládáme, že obsahují spermie. Tkáň varlete je dále zpracována v IVF-laboratoři. Paralelně bychom měli odebírat vzorky pro histologické vyšetření, které pro standardizaci vyšetření obsahují alespoň 100 kanálků. Histologický nález je součástí interpretace výsledku operačního výkonu. Na základě jeho výsledku lze pak po dohodě s pacientem nakládat se zamraženými vzorky. Při možných rozdílných nálezech mezi laboratoří a patologem nutno brát v úvahu, že reziduální spermatogeneze je fokální a může nastat situace, kdy sousední kanálky nemají stejný obsah. Výkonům by mělo předcházet podrobné poučení pacienta o výkonu, včetně možných situací vycházejících z problematiky spojené s odběrem, kryokonzervací a následným použitím spermií.
Image 5. MikroTESE - preparace kanálku varlete. 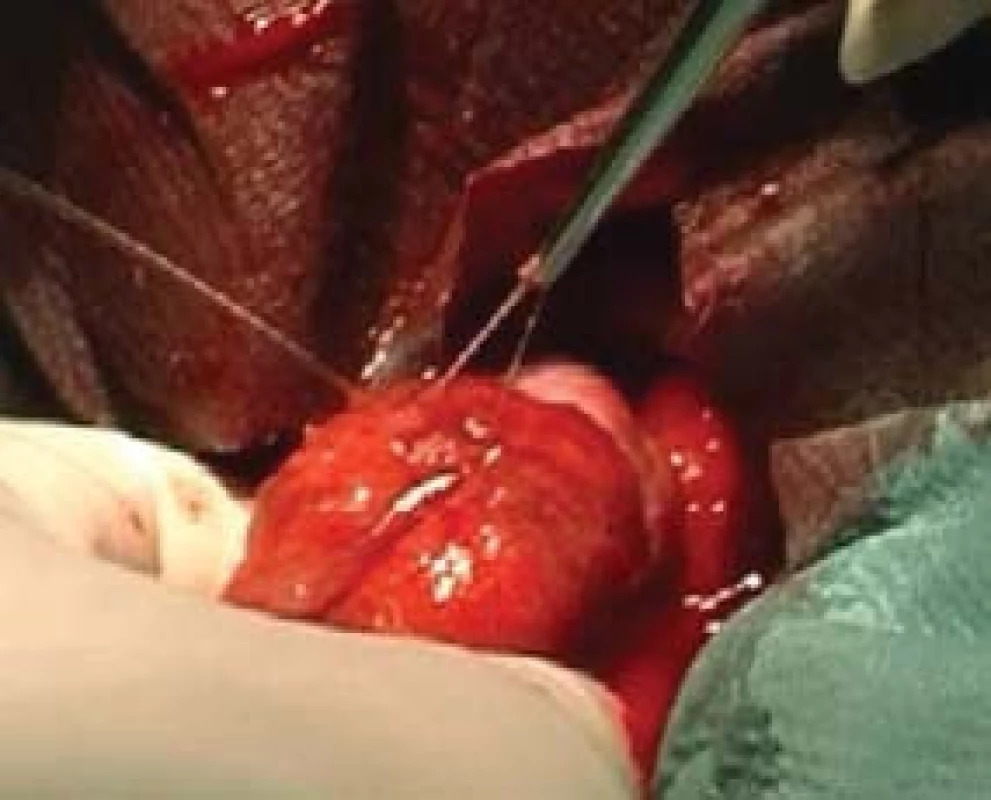
Image 6. Použití mikroskopu při mikroTESE. 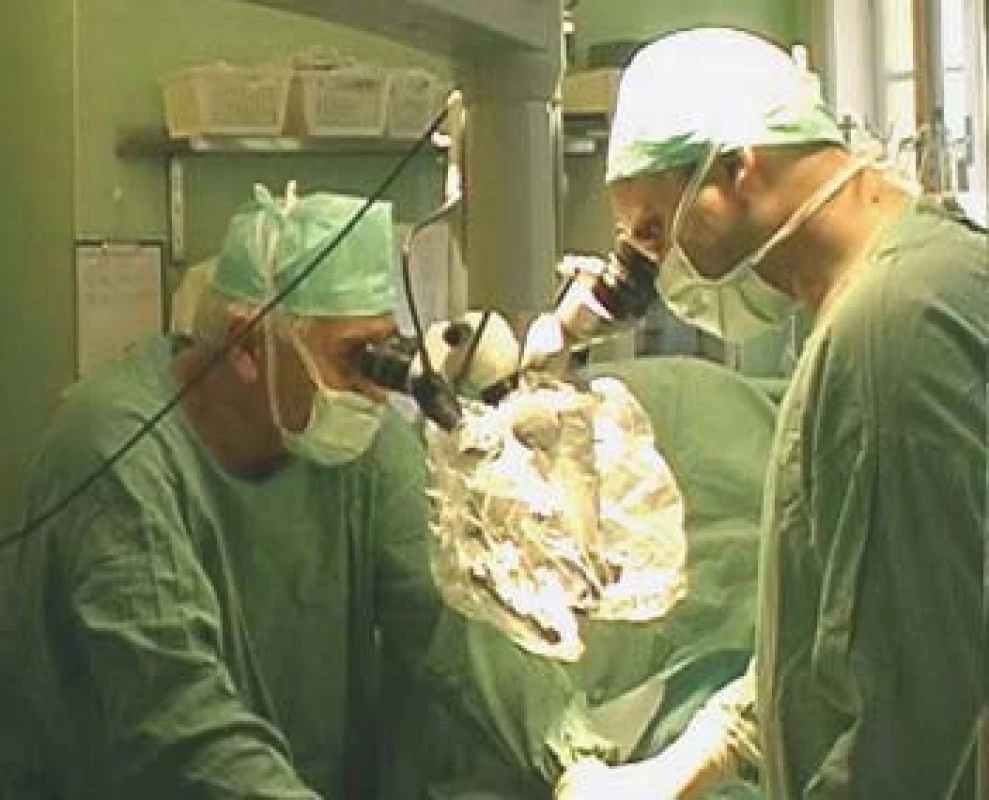
TESA (testicular sperm aspiration) je transkutánně, tzv. naslepo prováděná aspirace spermií z varlete.
Obecně lze požadavky na zisk spermií vyjádřit několika body:
- bezpečnost
- efektivnost
- komfort
- minimalizace komplikací
- cenová dostupnost
- možnost zpětné kontroly
Průsečíkem těchto požadavků je provedení výkonu
- pod optickou kontrolou (tzv. otevřenou cestou)
- v celkové anestezii
- v ambulantním režimu
- při obstrukční azoospermii v den odběru oocytů
- při neobstrukční azoospermii v předstihu, aby pokud nebudou spermie získány, měl pár dostatek času k dalšímu rozhodování
- v zařízení, které disponuje kvalitním systémem kryokonzervace
- s následným histologickým vyšetřením na pracovišti, které má zkušenosti s vyšetřováním tkáně varlat, nejlépe stejným patologem
Výkony spojené s odběrem, zpracováním a kryokonzervací získaných vzorků nejsou hrazeny zdravotními pojišovnami, proto by cenová politika pracoviště měla směřovat k umožnění standardního využití těchto metod.
Všichni pacienti s azoospermií, kteří si přejí operaci, mají podstoupit genetické vyšetření. Klinické vyšetření a indikaci k laboratorním vyšetřením provádí klinický genetik. Vyšetřujeme karyotyp, dále gen pro cystickou fibrózu a mikrodelece chromozomu Y. U mužů s neobstrukční azoospermií je dále doporučen předimplantační genetický screening aneuploidií (PGS), případně předimplantační genetická diagnostika (PGD). V současné době je limitována použitelnost získaných spermií genetickými onemocněními a hranice jsou posouvány možnostmi předimplantační genetické diagnostiky (obr. 7, 8, 9; např. vyšetření mutací pro hemofilii vzhledem k tomu, že je v současné době možná selekce pohlaví), CFTR (cystic fibrosis transmembrane conductance regulator) a další. Druhým limitem je stupeň zralosti získaných spermií nebo stupeň vývojových forem. Zásadní posun nastane po vyřešení in vitro maturace vývojových stadií spermie. Již existují laboratorní modely umožňující maturaci po druhém (haploidním) dělení a je jen otázkou času, kdy budou vyřešeny problémy, což umožní rutinní použití této metody. Její zavedení bude zcela jistě předcházet diskuse o etických otázkách spojených s použitím nezralých forem zárodečných buněk.
Image 7. Biopsie blastomery k fixaci na PGD. 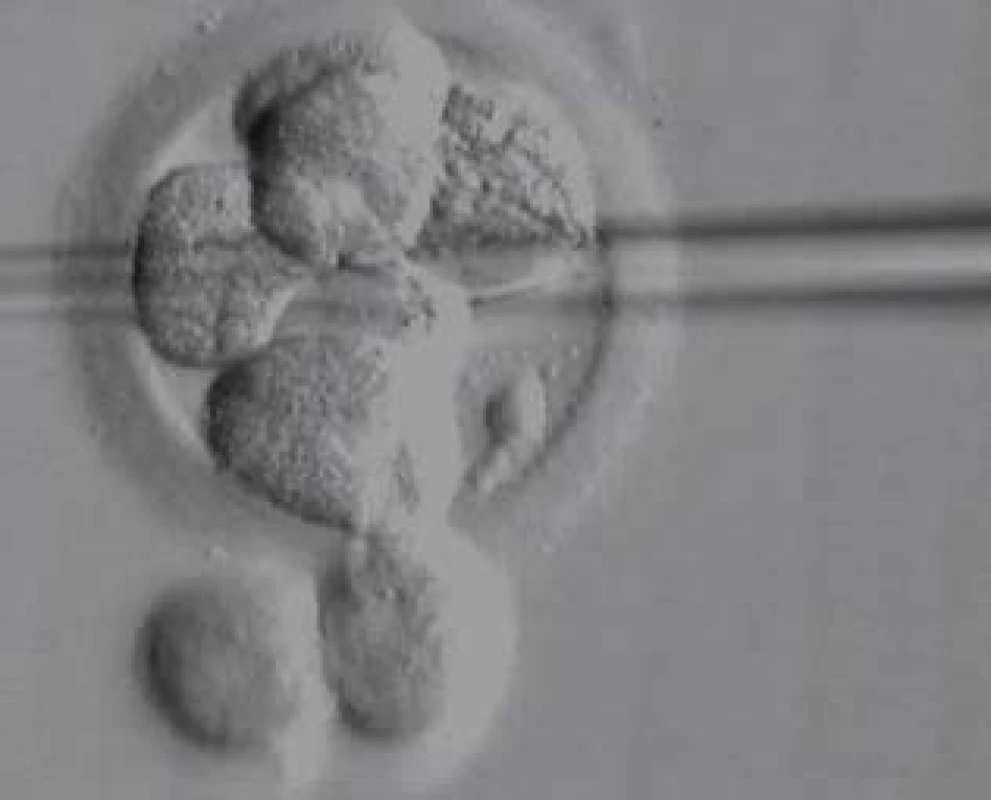
Image 8. Výsledek po PGD analýze - trisomie 21 chromozomu (zelené signály). 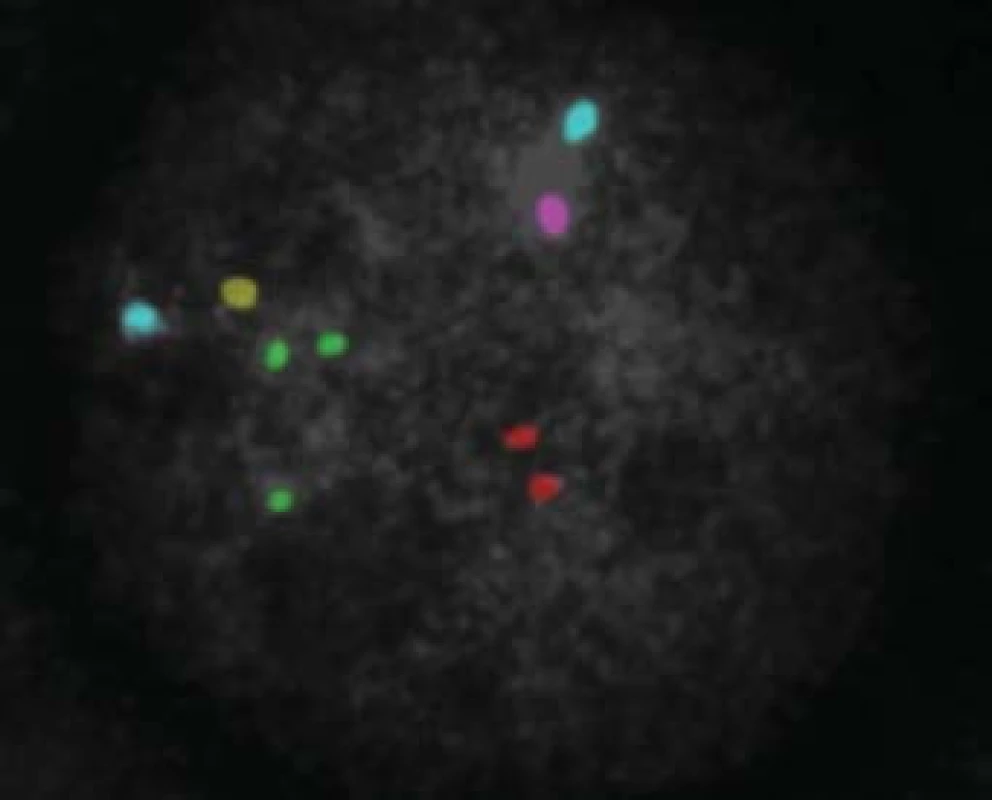
Image 9. Výsledek po PGD analýze - polypoidní blastomera. 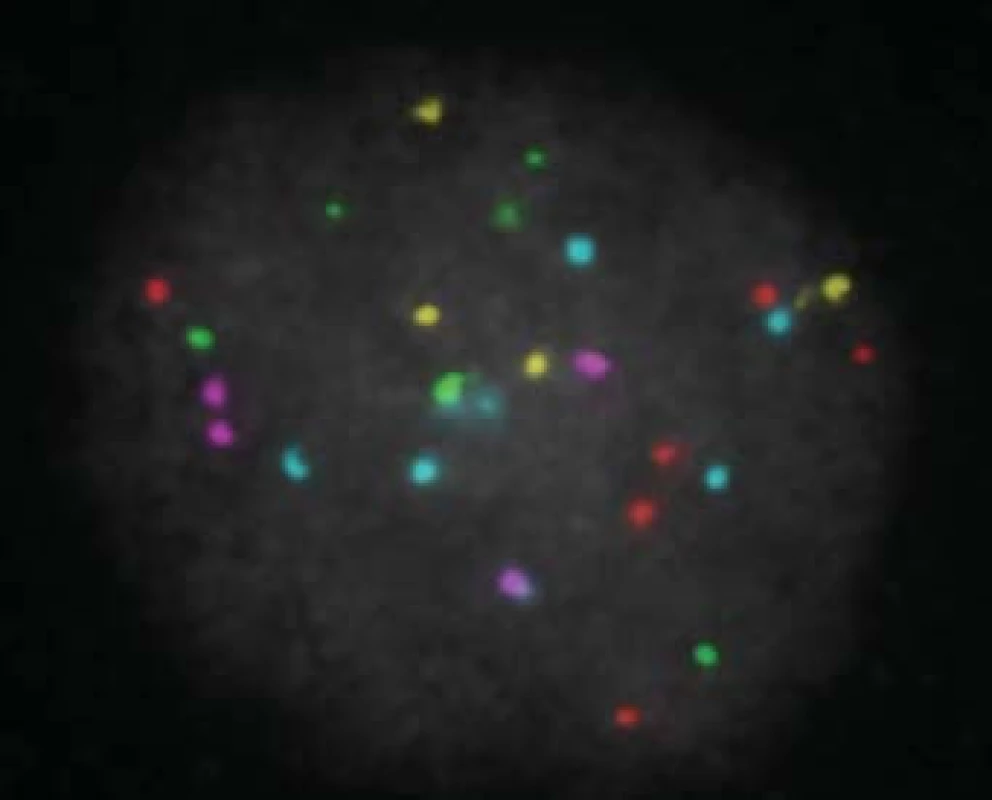
3. DÁRCOVSTVÍ SPERMIÍ
Po rutinním zavedení ICSI do léčebného algoritmu řešení nejtěžších forem mužské neplodnosti zazněly prognózy o útlumu potřeb dárcovských spermií, nedošlo však k tomu z několika důvodů:
- obecně se zvyšuje podíl mužského faktoru na neplodnosti páru
- u některých pacientů nelze spermie získané při TESE použít pro genetickou kontraindikaci
- pacienti mají obavy z operace a preferují jednodušší řešení azoospermie dárcovskými spermiemi
- použití dárcovských spermií je finančně nenáročné (inseminace nevyžaduje metody mimotělního oplodnění, včetně ICSI, PGS, MESA/TESE).
Program dárcovství spermií vyžaduje dispenzarizaci a pravidelné sérologické kontroly dárců po celou dobu procesu darování. Požadavky na zařazení kandidáta do programu jsou:
- standardní výsledek spermiogramu ve všech sledovaných hodnotách, negativní kultivace ejakulátu
- odhad psychického zdraví při vstupním pohovoru
- nepromiskuitní životní styl (na základě sdělení kandidáta)
- kandidát nemá být v rizikové skupině s tetováním a piercingem
- negativní výsledky sérologických vyšetření (HIV, HbSAg)
- vyšetření krevní skupiny
- kladné vyjádření klinického genetika na základě genetické rozvahy, cytogenetického vyšetření a vyšetření CTFR a chromozomu Y na mikrodelece
Při splnění všech kritérií je kandidát zařazen do programu, spermie jsou použitelné pro dárcovské potřeby po negativních sérologických vyšetřeních s odstupem 6 měsíců.
4. ORGANIZACE ZAJIŠTěNÍ SPERMIÍ U MUŽů PŘED PŘEDPOKLÁDANOU PORUCHOU PLODNOSTI (PACIENTI S ONKOLOGICKÝM ONEMOCNěNÍM, S MÍŠNÍM PORANěNÍM, S ENDOKRINNÍMI PORUCHAMI)
4.1. Program včasné kryokonzervace spermií u mužů před plánovanou onkologickou léčbou
Po onkologické léčbě chirurgické, aktinoterapii, chemoterapii nebo imunoterapii je časté ireverzibilní poškození spermatogeneze. Použitelnost spermií je limitována minimálně 24 měsíci po ukončení aktino - nebo chemoterapie. I po uplynutí uvedené doby je však indikován PGS k vyloučení aneuploidií embrya. Proto je tedy správné kryokonzervovat spermie před započetím léčby. Neprovedeme-li kryokonzervaci u pacientů ve fertilním věku, pohybujeme se na hranici lege artis postupu, kromě toho opomenutí nabídky může pacient vnímat jako vyjádření jeho neperspektivnosti. Kryokonzervace nesmí ohrožovat včasnost zahájení onkologické léčby, proto by v ideálním případě měl existovat dohodnutý systém mezi zdravotnickými pracovišti a centry asistované reprodukce, která zajišují odběr a kryokonzervaci spermií, aniž by došlo k časovým ztrátám a omylům při identifikaci pacienta. Vzhledem k tomu, že výkony spojené s odběrem, zpracováním, kryokonzervací a uchováváním vzorků nejsou hrazeny zdravotními pojišovnami, měla by být stanovena cena, která by rutinně zpřístupnila tento program.
4.2. Program zajištění budoucí fertility u mužů po poranění míchy
Snížená plodnost je u mužů po poranění míchy způsobena především poruchou erekce a ejakulace, poškozením tvorby, dozrávání a transportu spermií ve varlatech a nadvarlatech, opakovanými infekcemi močových cest a hormonálními změnami. Kvalitu spermií ovlivňují opakované močové infekce, technika vyprazdňování močového měchýře, stagnace spermií v semenných váčcích při anejakulaci, zvýšená teplota ve skrotu, hormonální změny v ose hypotalamus-hypofýza-varle, protilátky proti spermiím, ale také vedlejší účinky trvalé medikace.
Pro odběr spermií používáme tyto metody:
- odběr spermií z moči po ejakulaci
- elektroejakulace
- vibrostimulace
- MESA/TESE
Odběr spermií z moči po ejakulaci musí být sladěn s ovulací partnerky. Moč nejdříve alkalizujeme perorálním příjmem 1–3 g bikarbonátu sodného 3–4krát denně tak, aby pH bylo v rozmezí 7,2–7,8. Cévkou aplikujeme do močového měchýře 10–15 ml kultivačního roztoku, poté pacient ejakuluje (pohlavním stykem nebo častěji masturbací) a následně provádíme druhou katetrizaci k získání ejakulátu. Tento způsob minimalizuje kontakt spermií s močí. Materiál musí být okamžitě zpracován a použit k oplodnění partnerky.
Principem vibrostimulace je vyvolání ejakulačního reflexu vibrační stimulací penisu, metoda vyžaduje neporušený lumbosakrální segment míchy. Čím je poranění výše nad Th 10, tím vyšší je procento úspěchu metody. Ztráta vnímání tepla v oblasti hráze a žaludu, neschopnost vnímat zmáčknutí varlete a zachovaný bulbokavernózní reflex jsou pozitivní prognostické faktory. K prevenci autonomní dysreflexie podáváme 10–20 mg nifedipinu pod jazyk. Před vibrostimulací vyprázdníme močový měchýř. Vibrátorem s amplitudou 1–3 mm a frekvencí 80–100 Hz stimulujeme žalud penisu v oblasti uzdičky. Stimulace provádíme v 3minutových intervalech s 1minutovou přestávkou celkem 3krát. Ejakulaci lze očekávat do 10 minut a je následována zarudnutím a spazmy břišních svalů a dolních končetin. Po prokázání bezpečnosti a efektivity metody ji pacient může provádět sám doma.
Principem elektroejakulace je vyvolání reflexní ejakulace elektrostimulací rektální sondou (zavedenou do konečníku), která vede ke stahům prostaty, semenných váčků a ampul chámovodů. Elektroejakulace vyžaduje pečlivou přípravu a poučení pacienta na možnost výskytu autonomní dysreflexie nebo popálení sliznice konečníku. Během výkonu u pacienta kontinuálně monitorujeme krevní tlak. Močový měchýř vyprázdníme a naplníme kultivačním roztokem. Pro kontrolu neporušenosti střevní stěny nejprve provedeme anoskopii. Poté umístíme sondu na prostatu tak, aby byl zajištěn kontinuální kontakt sliznice s teplotním senzorem a kovovými destičkami. Pulzně zvyšujeme napětí, většina stimulací je prováděna po dobu 5–7 minut. U 90 % pacientů vyvolá elektroejakulace výron semene, který je v jedné třetině retrográdní.
Pracoviště autorů preferují odběr spermií u mužů po poranění míchy metodou mikroTESE, jelikož vykazuje několik podstatných výhod. Hlavní předností je efektivita, protože zisk spermií je 100%, pokud nejsou přítomny jiné, s poraněním nesouvisející poruchy. Další výhodou je odběr kvalitních vzorků bez kontaktu se zánětlivým prostředím a konečně dostatek materiálu včetně testikulární tkáně, která zajišuje optimální kryokonzervaci. Jistou nevýhodou metody je invazivita, která je jistě vyvážena výše popsanými přednostmi, a navíc umožňuje díky histologickému vyšetření vzorků verifikovat míru poškození spermatogeneze. Výkon provádíme obvykle v intravenózní analgosedaci a v ambulantním režimu, odebíráme vždy paralelní vzorky tkáně varlete k histologickému vyšetření. Pooperační antibiotická profylaxe infekce je nutností. Použili jsme tento postup u 20 pacientů po poranění míchy, vždy jsme kryokonzervovali spermie z varlete a ve všech histologických vyšetřeních jsme našli poruchu spermatogeneze různého stupně. Nezaznamenali jsme vážnější komplikace.
4.3. Program zajištění fertility u mužů s endokrinními onemocněními neplodnosti
Komplexní péče o pacienty s vrozenými hypogonadizmy (např. Kallmannův syndrom) vyžaduje mezioborovou spolupráci. Včasná diagnóza je v dětském věku podmínkou indukce puberty, a tedy i zahájení hormonální substituční léčby v optimálním věku. U dospělých mužů lze pomocí gonadotropinů nebo pulzní léčbou gonadoliberinem indukovat spermatogenezi. Následně provádíme TESE s cílem získat a uchovat pohlavní buňky k jejich pozdějšímu použití při mimotělním oplodnění. Po odběru spermií pokračuje substituce androgenem, pacienti jsou v péči endokrinologa a urologa.
ZÁVĚR
Andrologie je v současnosti jeden z nejdynamičtěji se rozvíjejících oborů. Stalo se tak díky stále se zlepšujícím diagnostickým a terapeutickým možnostem, ale hlavně na základě zvyšující se poptávky medicínské, společenské, ale i pacientů samých. Tento překotný vývoj a atraktivita andrologie vyvolává zájem o diagnostiku a léčbu andrologických onemocnění u historicky spolupracujících oborů. Na jednu stranu je správné a smysluplné rozvíjet spolupráci se styčnými obory, bez kterých si nelze představit lege artis vedenou diagnostiku a léčbu u mužů s poruchou plodnosti, na straně druhé by však měl právě urolog vést a koordinovat tyto procesy. U mnoha pacientů s andrologickými onemocněními je nezbytná celoživotní urologická dispenzarizace a vzájemná spolupráce urologů při péči o ně.
Bedlivě sledované kritérium péče je kvalita. Je to výsledek celosvětového vývoje názoru na práva pacienta, ochranu dat a úroveň všech procesů, které s pacientem přímo či nepřímo souvisí. Kritéria práce v systému řízené kvality si vynucují zavedení procesních kontrol a jasné vymezení kompetencí. V Sanatoriu Pronatal jsou veškeré procesy certifikovány ve shodě s ISO normou 9001 : 2000 a laboratoře jsou pak akreditovány dle ISO EN/IEC 17 025. Právě 5leté zkušenosti našeho zařízení potvrzují nutnost jasné koncepce jednotlivých odborností v tak interdisciplinárním oboru, jakým je reprodukční medicína.
MUDr. Vladimír Sobotka1
MUDr. Jiří Heráček2,3
1Sanatorium Pronatal, Praha
2Urologická klinika 3. LF UK a FN KV, Praha
3Androgeos - soukromé urologické a andrologické centrum, Praha
Sources
1. World Health Organization. Recent Advances in Medically Assisted Conception. WHO Tech Rep Ser. Geneva 1992.
2. World Health Organization. Towards more objectivity in diagnosis and management of male infertility. Results of a World Health Organization multicenter study. Int J Antrol 1987; 7 (Suppl).
3. Palermo G, Joris H, Devroey P et al. Pregnancies after intracytoplasmatic injection of a single spermatozoon into an oocyte. Lancet 1992; 430 : 17-18.
4. Tarlatzis B. Report of the activities of the ESHRE task force on intracytoplasmatis sperm injection. In: Van Steirteghem A, Devroey P, Lkiebaers I (eds). Genetics and Assisted Human Conception. Oxford: Oxford University Press 1996; 160-176.
5. de Mouzon J, Lancaster P. World Collaborative report. Presented at the 10th World Congress at In Vitro Fertilization and Assisted reproduction. J Assist Reprod Genet 1997; 14 : 251-265.
6. Riedel HH, Hubner F, Ensslen SC, et al. Minimal andrological requirements for in vitro fertilization. Hum Reprod 1989;4 : 73-77.
7. Rowe PJ, Comhaire FH, Hargreave TB et al. WHO Manual for the Standardized Investigation and Diagnosis of the Infertile Couple. Cambridge: Cambridge University Press 1994.
8. World Health Organization, WHO Laboratory manual for the Examination of human Semen and Sperm-Cervical Mucus Interaction. 3rd ed. Cambridge: Cambridge University Press 1992.
9. Kruger TF, Menkveld R, Sander FSH, et al. Sperm morphologic features as a prognostic factor in in vitro fertilization. Fertil Steril 1986; 46 : 1118-1123.
10. Menkveld R, Sander FSH, Kotze TkvW, Kruger TF, Van Zyl JA. The evaluation of morphological characteristics of human spermatozoa according to stricter criteria. Hum Reprod 1990; 5 : 586-592.
11. Brinsden PR (ed). A textbook of In Vitro Fertilization and Assisted Reproduction. 2nd ed. Cambridge: Parthenon Publishing 1999.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2006 Issue 1-
All articles in this issue
- MUŽSKÝ FAKTOR INFERTILITY: VYŠETŘENÍ A LÉČBA
- HYPOGONADIZMUS OČIMA ČESKÉHO PRAKTICKÉHO LÉKAŘE: VÝCHODISKA (NEJEN) PRO UROLOGY
- VASKULÁRNÍ RIZIKOVÉ FAKTORY U EREKTILNÍ DYSFUNKCE
- TRANSSEXUALIZMUS A CHIRURGICKÁ KONVERZE POHLAVÍ
- MÍSTO MEDIKAMENTÓZNÍ TERAPIE V LÉČBĚ KOMPLIKOVANÉ EREKTILNÍ DYSFUNKCE
- INTRAKAVERNÓZNÍ VAZOAKTIVNÍ LÉČBA EREKTILNÍ DYSFUNKCE
- PRIAPIZMUS
- INDURATIO PENIS PLASTICA: PEYRONIEOVA CHOROBA
- ÚLOHA UROLOGA V IVF-PROGRAMU PŘI DIAGNOSTICE A LÉČBĚ NEPLODNÉHO PÁRU
- ANDROGENNÍ DEFICIT U STÁRNOUCÍCH MUŽŮ
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- INTRAKAVERNÓZNÍ VAZOAKTIVNÍ LÉČBA EREKTILNÍ DYSFUNKCE
- INDURATIO PENIS PLASTICA: PEYRONIEOVA CHOROBA
- TRANSSEXUALIZMUS A CHIRURGICKÁ KONVERZE POHLAVÍ
- MUŽSKÝ FAKTOR INFERTILITY: VYŠETŘENÍ A LÉČBA
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career