-
Medical journals
- Career
Mnohočetný myelom s primárním multifokálním extramedulárním postižením a raritní cytogenetickou změnou
Authors: V. Látal 1; T. Pika 1; M. Mlynárčiková 1; J. Balcárková 1; D. Hradil 2; T. Tichý 3; E. Buriánková 4; J. Minařík 1; T. Papajík 1
Authors‘ workplace: Hemato-onkologická klinika LF UP a FN Olomouc 1; Urologická klinika LF UP a FN Olomouc 2; Ústav klinické a molekulární patologie, LF UP a FN Olomouc 3; Klinika nukleární medicíny LF UP a FN Olomouc 4
Published in: Transfuze Hematol. dnes,30, 2024, No. 1, p. 44-48.
Category: Case Reports
doi: https://doi.org/10.48095/cctahd2024prolekare.cz5Overview
Následující kazuistické sdělení popisuje případ 66leté ženy došetřované pro bolesti břicha a dilataci kalichopánvičkového systému. Vzhledem k nálezu prostřednictvím zobrazovacích metod bylo vysloveno podezření na primární nádorové onemocnění vývodného močového systému. Bioptické vyšetření překvapivě odhalilo extramedulární postižení mnohočetným myelomem. Během dalšího došetřování byla pomocí cytogenomických metod nalezena raritní chromozomální aberace t (6; 22).
Klíčová slova:
mnohočetný myelom – Fish – extramedulární postižení – cytogenomika
ÚVOD
Mnohočetný myelom (MM) je nádorové onemocnění krvetvorby charakterizované klonální populací plazmatických buněk v kostní dřeni ≥ 10 % a ve většině případů je spojeno s přítomností monoklonálního imunoglobulinu nebo jeho strukturálních komponent, volných lehkých řetězců kappa či lambda, v séru anebo v moči [1]. MM tvoří asi 1 % ze všech nádorových onemocnění a 10 % všech zhoubných onemocnění krvetvorby. Medián věku při diagnóze je 65 let [1].
Pro diagnózu symptomatického mnohočetného myelomu je kromě infiltrace klonálními plazmocyty nebo přítomnosti histologicky potvrzeného plazmocytomu potřeba alespoň jeden ze symptomů CRAB (hyperkalcémie, renální insuficience, anémie nebo osteolytická ložiska), případně alespoň jeden z tzv. biomarkerů malignity (≥ 60 % plazmocytů v kostní dřeni, poměr dominantních a nedominantních volných lehkých řetězců v séru ≥ 100, nebo > 1 fokální ložisko skeletu, ≥ 5 mm, při vyšetření magnetickou rezonancí) [1]. MM nejčastěji postihuje lebku, osový skelet (páteř, sternum, žebra, pánevní kosti) a dlouhé kosti (humery, femury). Při postižení měkkých tkání hovoříme o tzv. extraoseálním plazmocytomu (EO plazmocytom). EO plazmocytomy lze rozdělit na paramedulární plazmocytomy (vyrůstající přímo z osteolytického ložiska kosti) a extramedulární plazmocytomy (měkkotkáňová ložiska bez souvislosti s kostními ložisky) [2]. Udávaná incidence se v jednotlivých studiích velmi liší (od 3 % do 70 %), rozdíly jsou dány nejednotnou definicí extraoseálního postižení i použitím rozdílných zobrazovacích metod.
Prognóza nemocných s mnohočetným myelomem se výrazně proměnila s příchodem léčiv s cíleným mechanizmem účinku a jejich kombinací. V současné době patří mezi základní terapeutické skupiny inhibitory proteazomu, imunomodulační látky (IMiD) či monoklonální protilátky nejčastěji namířené proti antigenu CD38. V rámci vstupní léčby je pak pro většinu vhodných nemocných zlatým standardem podání vysokodávkované chemoterapie s melfalanem s následující autologní transplantací krvetvorných buněk (ASCT). Velká naděje je vkládána mezi nejnovější přístupy imunoterapie tzv. bispecifické protilátky a modifikované autologní T-lymfocyty s chimerickým antigenním receptorem (CAR-T).
Prognóza nemocných s nově diagnostikovaným MM (NDMM) a EO plazmocytomem je velmi variabilní a závisí na míře infiltrace kostní dřeně plazmocyty. Pacienti s pouze paraskeletálním plazmocytomem a malou infiltrací kostní dřeně (< 5 %) mají prognózu spíše příznivou. Pacienti s NDMM a 1–2 extramedulárními plazmocytomy mají prognózu srovnatelnou s nemocnými s NDMM bez extramedulárního postižení. Naopak nemocní s mnohočetnými extramedulárními plazmocytomy (≥ 3) mají prognózu nepříznivou, srovnatelnou s nemocnými s relabovaným/refrakterním MM (RRMM) a extramedulárními plazmocytomy [3].
Image 1. Část sliznice močového měchýře, pod nenádorovým urotelem jsou ve slizničním vazivu hnízdovité infi ltráty atypických plazmatických buněk. Barvení hematoxylin-eozin, zvětšení 100×. 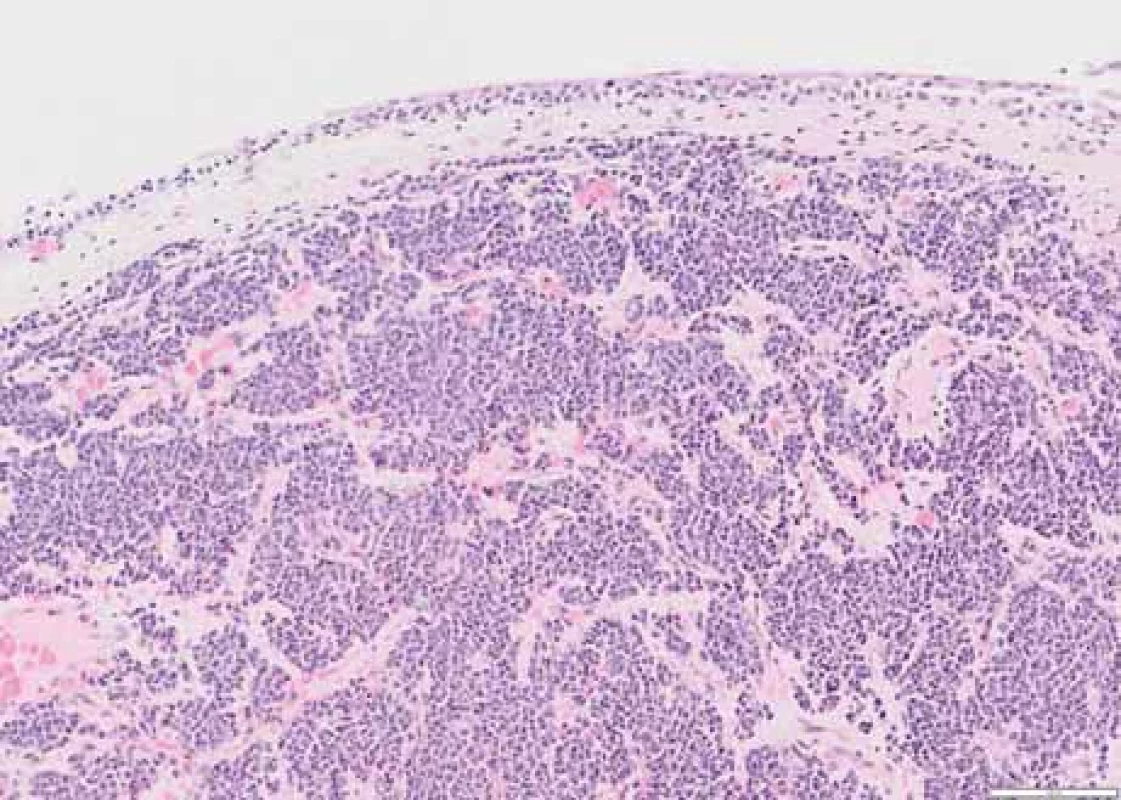
Image 2. Pozitivita plazmocytárního markeru CD138 na membránách nádorových buněk. Imunohistochemické vyšetření, zvětšení 200×. 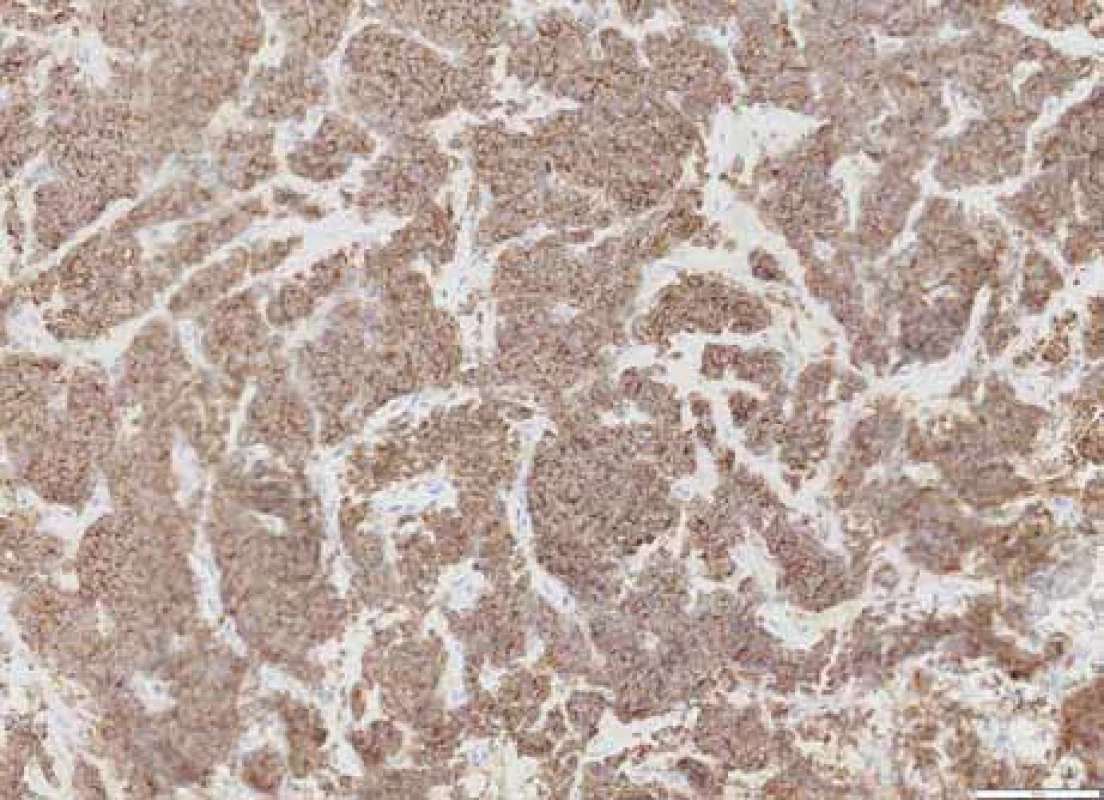
POPIS PŘÍPADU
Šedesáti šestiletá žena dosud léčená pouze pro autoimunitní hypotyreózu a dyslipidémii byla na začátku dubna 2023 vyšetřena na chirurgické ambulanci oddělení urgentního příjmu pro bolesti podbřišku a levého třísla s propagací do zad. Při klinickém vyšetření nebyly přítomny známky peritoneálního dráždění, vlevo byl popsán pozitivní tapottement, vpravo negativní. Provedená laboratorní vyšetření vč. základního iontogramu, renálních parametrů, jaterních testů, krevního obrazu a koagulace neprokázala významnější alteraci. Sonografické vyšetření břicha zachytilo vlevo nález dilatace kalichopánvičkového systému (KPS). Diferenciálně-diagnosticky bylo pomýšleno na přítomnost litiázy. Doplněné nativní vyšetření výpočetní tomografií (CT) prokázalo dilataci KPS levé ledviny s šíří pánvičky (APER) 14 mm a dilataci břišní části ureteru na 9 mm (norma 2–4 mm), v oblasti pánevního úseku až na 14 mm, další část ureteru uložena juxtavezikálně byla štíhlá. Dále byly popsány početné nodulace v peritoneální dutině v oblasti omenta a jedna nodulace o vel. 12 × 11 mm perirenálně vpravo navazující na renální fascii. Pro nejasný nález připouštějící možnou neoplázii bylo doplněno třífázové CT ledvin s intravenózní kontrastní látkou. Vyšetření potvrdilo mnohočetná ložiska na peritoneu, mesenteriu, perirenálně, na obou ledvinách, na stěně močového měchýře, dále v zastižených částech plic, na pleuře a v podkoží. Měkkotkáňová formace tvořila defekt v náplni levého močovodu a nález imponoval jako intraluminální tumor s generalizací. Pacientka byla indikována urologem k diagnostické cystoureteroskopii (URS). Perioperační nález popisoval přítomnost překrvených ložisek na sliznici močového měchýře, největší ve vertexu cca 5–6 mm, na zadní a levé stěně nahoře, do velikosti 5 mm. V levém močovodu byla v souladu s CT popisem zachycena přítomnost podobného útvaru o velikosti 5 mm. Odebrané bioptické vzorky zachytily hnízdovité infiltráty s překvapivou imunohistochemickou pozitivitou CD138, lehkých řetězců lambda a proliferační aktivitou Ki67 40 % (obr. 1 a 2). Závěr histologického popisu potvrdil extramedulární plazmocytom a pacientka byla odeslána na Hemato-onkologickou kliniku Fakultní nemocnice Olomouc k dalšímu došetření.
Doplněná vyšetření (elektroforéza a imunofixace séra) potvrdily přítomnost monoklonálního imunoglobulinu IgG lambda o koncentraci 43,36 g/l. Vyšetření kostní dřeně zachytilo 48% infiltraci pleiomorfní populací plazmatických buněk lymfoplazmocytoidního vzhledu. Při vyšetření průtokovou cytometrií buňky nesly aberantní imunofenotyp CD38+/CD138+/CD19–/CD56–/CD28+/ CD33–/CD117–/CD45–/lambda. Vyšetření biochemických ukazatelů nezachytilo laboratorní známky orgánového postižení vč. normální hladiny laktátdehydrogenázy (LDH), byla zjištěna pouze elevace beta-2-mikroglobulinu – 5,24 mg/l (norma 0,80–2,34 mg/l).
S ohledem na přítomnost extramedulárního onemocnění bylo ze zobrazovacích technik zvoleno vyšetření 18F-FDG-PET/CT, které popsalo mnohočetná ložiska aktivity v plicích, na peritoneu, na mezenteriu, v retroperitoneu, v obou ledvinách, v zesílené stěně močového měchýře, obou prsech, v podkoží břicha a v dřeňové dutině dlouhých kostí dolních končetin (obr. 3). Pro atypický obraz a možnou nádorovou duplicitu při povšechné nespecifické elevaci onkomarkerů (CA 15-3 67,3 kU/l [norma do 25,0 kU/l], CA 125 66,5 kU/l [norma do 35,0 kU/l], thymidinkináza 92,8 IU/l [norma do 9,0 IU/l]) jsme doplnili mammografii s core-cut biopsií ložiska levého prsu, histologický nález však opět potvrdil infiltraci myelomem.
Kromě samotné atypické diagnózy byl jistým překvapením cytogenetický nález u plazmocytů v kostní dřeni, ve kterých byla kombinací cytogenomických metod (karyotyp, FICTION, FISH, M-FISH, arrayCGH) prokázána monozomie chromozomu 13 a raritní reciproká translokace t (6; 22) (p25; q11.2), zahrnující přestavbu genů IRF4 (6p25) a IgL (22q; 11.2) (obr. 4). Popsaná translokace byla zpětně prokázána i z biopsie močového měchýře.
Diagnóza byla uzavřena jako mnohočetný myelom IgG lambda s primárním multifokálním extramedulárním postižením, stadium IIIA dle Durieho-Salmona, ISS 2, s přítomností monozomie 13 a t (6; 22). Od 19. 5. 2023 nemocná zahájila indukční terapii trojkombinací VTD (bortrezomib, thalidomid, dexamethason), k níž jsme vzhledem k rozsáhlému extramedulárnímu postižení empiricky přidali cytostatikum cyklofosfamid. Po 4 cyklech terapie pacientka dosáhla velmi dobré parciální remise (VGPR) s poklesem paraproteinu na 2,18 g/l. V současné době je po podání vysokodávkovaného cyklofosfamidu s úspěšným sběrem periferních kmenových buněk a bude směřována k provedení tandemové ASCT.
Image 3. Transverzální řez hrudníku, na 18F-FDG-PET/CT je vidět zvýšená akumulace 18FDG v měkkotkáňovém ložisku S10 levé plíce s těsným vztahem k aortě (velikosti cca 28 × 26 × 35 mm, SUV max 10), dále v obratlové těle, sternu a v nepravidelných ložiscích obou prsou (do velikosti 15 mm). 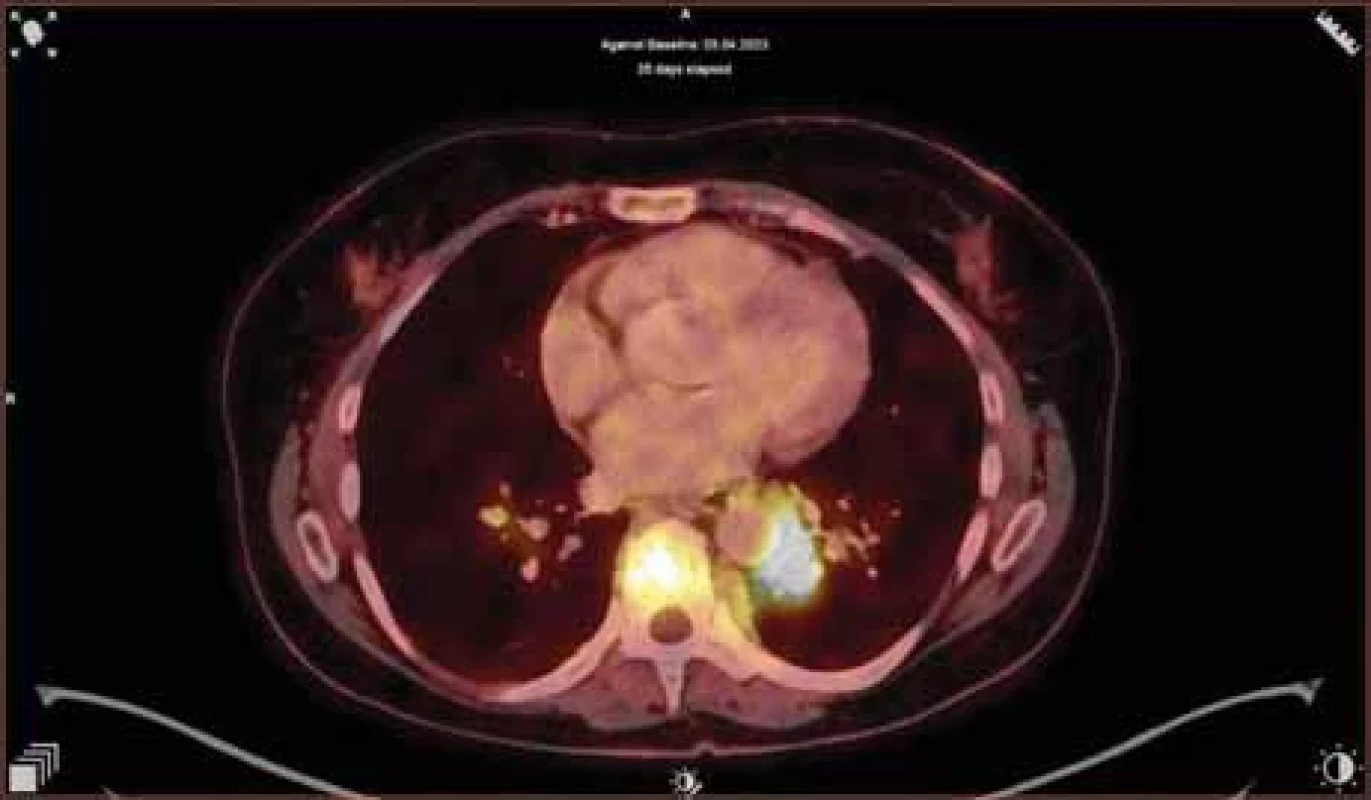
Image 4. Výsledný karyotyp na základě M-FISH (24XCyte, Metasystems): 45,XX, t(6;22)(p25;q11.2),-13. 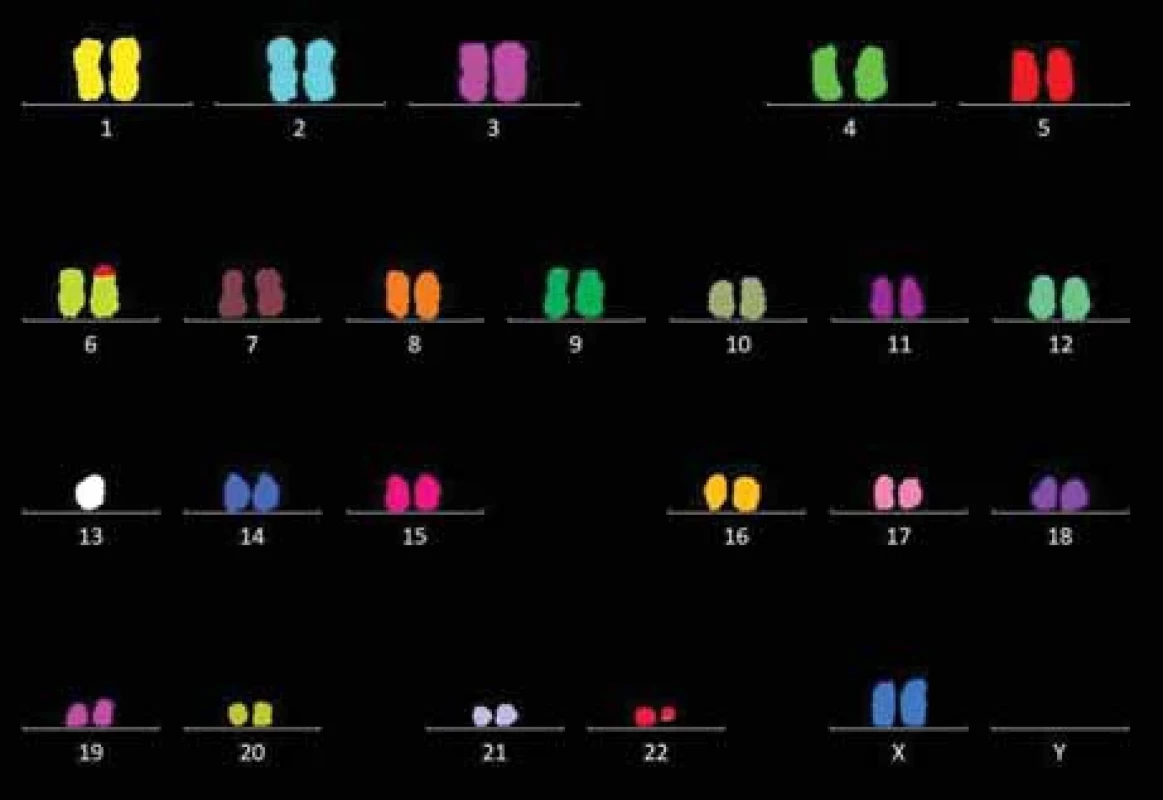
DISKUZE
Extraoseální plazmocytom (EO plazmocytom) je méně častým projevem mnohočetného myelomu. Nemocní tvoří velmi heterogenní skupinu a obecně je přítomnost EO považována spíše za nepříznivý prognostický znak [2,4].
EO plazmocytom může být zachycen v době diagnózy MM (primární), nebo se může vyskytnout až v době relapsu/progrese choroby (sekundární). Chybí ovšem jednotná definice a klasifikace EO plazmocytomů. První klasifikaci navrhli v roce 1969 Pasmantier a Azar, rozlišili tři stádia (intraskeletální, paraskeletální a extraskeletální) [5].
V současné době se řada odborníků kloní k dělení extraoseálních lézí na dvě skupiny: paramedulární plazmocytom vyrůstající přímo z kosti (bone-related), který má obvykle příznivější prognózu, a extramedulární plazmocytom nezávislý na mikroprostředí kostní dřeně (soft tissue-related), který může být spojen s nepříznivým průběhem i prognózou [3,4].
Přítomnost extramedulárního plazmocytomu v době relapsu/progrese onemocnění bývá spojena s vyšším stupněm anémie, hyperkalcémií, renální insuficiencí, elevovanými hladinami LDH, beta-2-mikroglobulinu a fenoménem zvaným light chain escape [6]. Při tomto fenoménu dochází k nárůstu sérových hladin volných lehkých řetězců při stabilní, nebo dokonce nedetekovatelné hladině kompletní molekuly monoklonálního imunoglobulinu. Light chain escape bývá při relapsu odrazem klonálního vývoje a případné dediferenciace buněk.
V současné době neexistuje jednotné doporučení pro léčbu pacientů s EO plazmocytomem. Např. aktuální EHA-ESMO guidelines (European Hematology Association and European Society of Medical Oncology) se o specifické terapii extraoseálního plazmocytomu myelomu nezmiňuje vůbec [7]. Americká doporučení NCCN (National Comprehensive Cancer Network) zmiňují jako jednu z možností režim VTD-PACE (bortezomib, thalidomid, dexamethason, cisplatina, doxorubicin, cyklofosfamid, etoposid), používaný u jiných agresivních forem plazmocelulárních dyskrázií [8]. Vzhledem k heterogenitě onemocnění je nalezení optimálního léčebného postupu u EO plazmocytomu obtížné a je vhodné se zaměřit na subanalýzy klinických studií hodnotící benefit dané terapie pro skupinu pacientů s EO plazmocytomem.
Česká retrospektivní data ukazují na nižší účinnost většiny lékových skupin u pacientů s EO plazmocytomem, vč. IMiDů, inhibitorů proteazomu i monoklonálních protilátek [9]. Ani nové přístupy imunoterapie většinou nepopisují významnější zlepšení prognózy u těchto nemocných – v klinické studii fáze 2 s bispecifickou protilátkou teclistamab (MajesTEC-1, NCT04557098), respektive elranatamab (MagnetisMM-3, NCT04649359), dosahovali pacienti s přítomností EO postižení nižší overall response rate (ORR) [10,11]. Jako slibná se může jevit účinnost CAR-T lymfocytů, např. v klinické studii fáze 2 KarMMa (NCT03361748) byla zaznamenána vysoká míra odpovědi (tj. ≥ 50 %) u pacientů léčených preparátem ide-cel [12].
Druhým neméně zajímavým aspektem kazuistiky je raritní cytogenetický nález reciproké translokace t (6; 22). Obecně lze pacienty s mnohočetným myelomem rozdělit podle cytogenetických změn do dvou, respektive tří skupin. První skupina charakterizována trizomiemi lichých chromozomů (3, 5, 7, 9, 11, 15, 19) je popisována spíše u mladších jedinců a nálezy bývají hodnoceny jako prognosticky příznivé či neutrální. Druhá skupina je charakterizována translokacemi genu IgH na chromozomu 14 s partnerskými lokusy, mezi nejčastější patří 4p16, 6p21, 11q13, 16q23 nebo 20q11. Do třetí nejmenší skupiny patří všichni ostatní pacienti (např. s translokacemi genu IgL, incidence těchto translokací se u NDMM uvádí až 9,8 %). ICC klasifikace (The International Consensus Classification of Mature Lymphoid Neoplasms) dělí MM na dvě skupiny: mnohočetný myelom, NOS (not otherwise specified) a mnohočetný myelom s rekurentními genetickými abnormalitami (s translokacemi rodiny genů CCND, s translokacemi rodiny genů MAF, s translokacemi rodiny genů NSD2 a s hyperploidií) [13]. U EO plazmocytomu bývají častěji popisovány rizikové změny, tedy delece 17p (TP53), monozomie/delece 13q, translokace t (4; 14), zvýšená exprese protoonkogenu C-MYC nebo mutace genů rodiny RAS. Na základě genetických abnormalit jsou pacienti stratifikováni dle rizikovosti. Navržený skórovací systém R-ISS (Revised International Staging System) a nověji také R2-ISS zahrnují vybrané cytogenetické změny s vysokým rizikem, jako jsou delece 17p, t (4; 14), t (14; 16) a v případě R2-ISS také amplifikace 1q [14]. V současné době existuje několik mezinárodních doporučení pro testování daných chromozomálních abnormalit, které se liší v doporučeném rozsahu vyšetřování (EHA-ESMO, NCCN, International Myeloma Working Group) [7,8,15]. Žádné z těchto doporučení však nezahrnuje vyšetření přítomnosti t (6; 22). Ani v dostupné recentní literatuře nebyly zjištěny publikace hodnotící pacienty s MM a translokací t (6; 22).
Zachycená translokace zahrnuje lokus 22q11.2, který nese gen pro lehký řetězec lambda, a lokus 6p25, který nese gen pro transkripční faktor IRF4 (interferon regulatory factor 4, dříve nazývaný jako multiple myeloma oncogene 1 – MUM1). Ten je zásadní pro vývoj Th2, Th17 a Th9 lymfocytů [16]. Přestavba genu IRF4 je obvykle popisována s genem pro těžký řetězec imunoglobulinu, a to nejen u nemocných s mnohočetným myelomem, ale i jinými zralými B-buněčnými neopláziemi [17–19]. Shaffer et al. v roce 2008 publikovali práci, ve které identifikovali Myc jako přímý cíl IRF4 v aktivovaných B-lymfocytech a myelomových buňkách a popsali autoregulační okruh těchto dvou transkripčních faktorů [20]. Lze předpokládat, že popsaná translokace má za následek přemístění genu IRF4 k lokusu pro lehký řetězec, a tím může dojít k deregulaci exprese IRF4 s následnou možnou zvýšenou expresí C-MYC. Toto teoretické zvýšení exprese genů může být ovšem epigeneticky modifikováno a bez izolace RNA a vyšetření expresního profilu se k němu nelze validně vyjádřit.
ZÁVĚR
Extraoseální plazmocytom je klinicky heterogenním projevem mnohočetného myelomu s obecně nepříznivou prognózou. V současnosti nemá jasně definovanou terapeutickou strategii, léčebné přístupy obvykle obsahují kombinaci léků, nezřídka se současným použitím cytostatik i nových léků s cíleným mechanizmem účinku.
Testování genetických abnormalit u pacientů s mnohočetným myelomem je důležitým nástrojem pro pochopení patogeneze, zpřesnění diagnózy a stratifikaci prognózy nemocných s MM, resp. EO plazmocytomy. Zejména u jedinců s přítomností rizikových forem onemocnění je žádoucí cytogenetická analýza k bližšímu ozřejmění možných patogenetických mechanizmů a pro stanovení individuálního rizika i terapeutické strategie. V současné době standardně používaná metoda FISH je dostatečná k detekci prognosticky významných abnormalit. Použití celogenomových metod (arrayCGH, next generation sequencing) může poskytnout další informace. Naše sdělení představuje kombinaci obou, extramedulární postižení s přítomností raritní cytogenetické abnormality s předpokladem zvýšeného prognostického rizika. Proto také byla zvolena rozšířená imunochemoterapie s plánem provedení tandemové ASCT k maximálnímu potlačení nádorové populace a snížení rizika relapsu.
Sources
1. Rajkumar SV, Dimopoulos MA, Palumbo A, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014; 15 (12): e538–e548. doi: 10.1016/S1470-2045 (14) 70442-5.
2. Rosiñol L, Beksac M, Zamagni E, et al. Expert review on soft-tissue plasmacytomas in multiple myeloma: definition, disease assessment and treatment considerations. Br J Haematol. 2021; 194 (3): 496–507. doi: 10.1111/bjh.17338.
3. Stork M, Sevcikova S, Jelinek T, et al. Unexpected heterogeneity of newly diagnosed multiple myeloma patients with plasmacytomas. Biomedicines. 2022; 10 (10): 2535. doi: 10.3390/biomedicines10102535.
4. Sevcikova S, Minarik J, Stork M, Jelinek T, Pour L, Hajek R. Extramedullary disease in multiple myeloma – controversies and future directions. Blood Rev. 2019; 36 : 32–39. doi: 10.1016/j.blre.2019.04.002.
5. Pasmantier MW, Azar HA. Extraskeletal spread in multiple plasma cell myeloma. A review of 57 autopsied cases. Cancer. 1969; 23 (1): 167–174. doi: 10.1002/1097-0142 (196901) 23 : 1<167:: aid-cncr2820230122>3.0.co; 2-0.
6. Bhutani M, Foureau DM, Atrash S, Voorhees PM, Usmani SZ. Extramedullary multiple myeloma. Leukemia. 2020; 34 (1): 1–20. doi: 10.1038/ s41375-019-0660-0.
7. Dimopoulos MA, Moreau P, Terpos E, et al. Multiple myeloma: EHA-ESMO clinical practice guidelines for diagnosis, treatment and follow-up†. Ann Oncol. 2021; 32 (3): 309–322. doi: 10.1016/j.annonc.2020.11.014.
8. NCCN guidelines version 5.2022 multiple myeloma. National Comprehensive Cancer Network – home (nccn.org). [online] [cit. 2023-07-27].
9. Jelinek T, Sevcikova T, Zihala D, et al. Limited efficacy of daratumumab in multiple myeloma with extramedullary disease. Leukemia. 2022; 36 (1): 288–291. doi: 10.1038/s41375-021-01343-w.
10. Moreau P, Garfall AL, van de Donk NWCJ, et al. Teclistamab in relapsed or refractory multiple myeloma. N Engl J Med. 2022; 387 (6): 495–505. doi: 10.1056/NEJMoa2203478.
11. Lesokhin AM, Tomasson MH, Arnulf B, et al. Elranatamab in relapsed or refractory multiple myeloma: phase 2 MagnetisMM-3 trial results. Nat Med. 2023; 29 (9): 2259–2267. doi: 10.1038/s41591-023-02528-9.
12. Munshi NC, Anderson LD Jr, Shah N, et al. Idecabtagene vicleucel in relapsed and refractory multiple myeloma. N Engl J Med. 2021; 384 (8): 705–716. doi: 10.1056/NEJMoa2024850.
13. Campo E, Jaffe ES, Cook JR, et al. The international consensus classification of mature lymphoid neoplasms: a report from the clinical advisory committee. Blood. 2022; 140 (11): 1229–1253. doi: 10.1182/blood.2022015851.
14. D‘Agostino M, Cairns DA, Lahuerta JJ, et al. Second revision of the international staging system (R2-ISS) for overall survival in multiple myeloma: a European Myeloma Network (EMN) report within the HARMONY Project. J Clin Oncol. 2022; 40 (29): 3406–3418. doi: 10.1200/JCO.21.02614.
15. Sonneveld P, Avet-Loiseau H, Lonial S, et al. Treatment of multiple myeloma with high-risk cytogenetics: a consensus of the International Myeloma Working Group. Blood. 2016; 127 (24): 2955–2962. doi: 10.1182/blood-2016-01-631200.
16. Staudt V, Bothur E, Klein M, et al. Interferon-regulatory factor 4 is essential for the developmental program of T helper 9 cells. Immunity. 2010; 33 (2): 192–202. doi: 10.1016/ j.immuni.2010.07.014.
17. Iida S, Rao PH, Butler M, et al. Deregulation of MUM1/IRF4 by chromosomal translocation in multiple myeloma. Nat Genet. 1997; 17 (2): 226–230. doi: 10.1038/ng1097-226.
18. Yoshida S, Nakazawa N, Iida S, et al. Detection of MUM1/IRF4-IgH fusion in multiple myeloma. Leukemia. 1999; 13 (11): 1812–1816. doi: 10.1038/sj.leu.2401563.
19. Salaverria I, Philipp C, Oschlies I, et al. Molecular mechanisms in malignant lymphomas network project of the Deutsche Krebshilfe; German High-Grade Lymphoma Study Group; Berlin-Frankfurt-Münster-NHL Trial Group. Translocations activating IRF4 identify a subtype of germinal center-derived B-cell lymphoma affecting predominantly children and young adults. Blood. 2011; 118 (1): 139–147. doi: 10.1182/blood-2011-01-330795.
20. Shaffer AL, Emre NC, Lamy L, et al. IRF4 addiction in multiple myeloma. Nature. 2008; 454 (7201): 226–231. doi: 10.1038/nature 07064.
PODÍL AUTORŮ NA RUKOPISU
VL – hlavní autor, příprava rukopisu, léčba nemocnéTP – léčba nemocné, kritická revize rukopisuJB, MM, EB – diagnostika nemocné, kritická revize rukopisuDH – diagnostika nemocné, operatér, kritická revize rukopisuTT – diagnostika nemocné, komentář k biopsii, kritická revize rukopisuJM, TP – kritická revize rukopisuPODĚKOVÁNÍ
Podpořeno grantem MZ ČR – RVO (FNOl, 00098892) a IGA_LF_2023_005.
ČESTNÉ PROHLÁŠENÍ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmu a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
ETICKÉ PROHLÁŠENÍ
Nemocná poskytla informovaný souhlas s prezentací nálezů. Publikace článku byla schválena Etickou komisí Fakultní nemocnice Olomouc.
Do redakce doručeno dne: 7. 9. 2023.
Přijato po recenzi dne: 17. 10. 2023.MUDr. Vojtěch Látal
Hemato-onkologická klinika
Fakultní nemocnice Olomouc
Zdravotníků 248/7
779 00 Olomouc
e-mail: vojtech.latal@fnol.czLabels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2024 Issue 1-
All articles in this issue
- Editorial
- Current options of ivosidenib in acute myeloid leukemia
- Therapy targeting CD19 antigen in diffuse large B-cell lymphoma
- Descriptive epidemiology of selected haemato-oncological diseases in the Czech Republic
- Anti-Kpb antibody in pregnancy
- Primary multifocal extramedullary multiple myeloma with a rare cytogentic abnormality
- Artificial intelligence in bone marrow cytomorphology: Morphogo and Scopio
- 16. Střešovický transfuzní den „Krví přenosné infekce – staré i nové hrozby“
- Certifikovaný kurz „Walking Blood Bank“
- Cena České hematologické společnosti ČLS JEP za nejlepší publikaci v oboru hematologie v roce 2023.
- Prof. MUDr. Jaroslav Čermák, CSc. – jubilující
- Jubileum profesora Romana Hájka
- Monoklonální gamapatie klinického významu a další nemoci
- Ibrutinib s venetoklaxem s fixní délkou podávání v první linii léčby CLL – pětiletá data ze studií CAPTIVATE a GLOW
- Možnosti léčby pacientů s AML s nepříznivým rizikem v roce 2024
- Nový inhibitor BTK píše novou kapitolu léčby CLL
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Therapy targeting CD19 antigen in diffuse large B-cell lymphoma
- Descriptive epidemiology of selected haemato-oncological diseases in the Czech Republic
- Artificial intelligence in bone marrow cytomorphology: Morphogo and Scopio
- Primary multifocal extramedullary multiple myeloma with a rare cytogentic abnormality
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

