-
Medical journals
- Career
Změny v imunitním systému u neléčených nemocných s chronickou lymfocytární leukémií – část 2: nespecifická imunita
Authors: P. Vodárek; L. Smolej; D. Belada; M. Šimkovič; D. Écsiová; P. Žák
Authors‘ workplace: IV. interní hematologická klinika, LF UK Hradec Králové a FN Praha
Published in: Transfuze Hematol. dnes,27, 2021, No. 3, p. 218-225.
Category: Review/Educational Papers
doi: https://doi.org/10.48095/cctahd2021218Overview
Chronická lymfocytární leukémie (CLL), nejčastější leukémie dospělých v západním světě, je spojena s významným kombinovaným imunodeficitem. Vedle změn specifické imunity se u nemocných s CLL můžeme setkat s defekty všech složek nespecifické imunity, jednak buněčné, tedy NK buněk, fagocytů a dendritických buněk, ale i humorální, tedy komplementu. NK buňky nemocných s CLL exprimují méně aktivačních a více inhibičních receptorů než u zdravých jedinců. Spolu se změnami exprese jejich ligandů na samotných CLL buňkách to znemožňuje imunitnímu systému účinně potlačit proliferaci maligního klonu. U neutrofilů byly pozorovány poruchy náhodné i cílené migrace, poruchy respiračního vzplanutí, nebo nedostatečná tvorba enzymů a cytokinů. Další změny vedou ke vzniku tzv. s tumorem asociovaných neutrofilů, které potlačují ostatní složky buněčné imunity. Podobně monocyty produkcí interleukinu 10, transforming growth faktoru b a reaktivních forem kyslíku zapříčiňují dysfunkce T-lymfocytů a NK buněk. Makrofágy se pod vlivem CLL buněk a regulačních T-lymfocytů mění na tzv. nurse-like buňky, které atrahují CLL buňky, umožňují jejich přežití a potlačují ostatní T-lymfocyty. Obdobnými změnami prochází i dendritické buňky. Konečně poruchy komplementu u nemocných s CLL mohou hrát roli v rozvoji nejen infekčních, ale i autoimunitních komplikací.
Klíčová slova:
chronická – lymfocytární – leukemie – imunodeficit – buněčná – humorální – NK – neutrofily – monocyty – makrofágy – dendritické – komplement – infekce
ÚVOD
Tento článek navazuje na práci „Změny v imunitním systému u neléčených nemocných s chronickou lymfocytární leukémií – část 1: specifická imunita“ [1]. Zatímco změny specifické imunity, především hypogamaglobulinémie, mají na svědomí vyšší riziko infekčních komplikací, změny nespecifické imunity dominantně umožňují progresi CLL, jak bude popsáno na následujících řádcích. Stejně jako změny specifické imunity se však prohlubují s progresí onemocnění a zároveň jsou ovlivněny podávanou terapií. Zde bude kladen důraz na stav, který nalézáme u dosud neléčených nemocných.
PORUCHY NK BUNĚK
NK buňky jsou aktivovány, nebo naopak inhibovány na základě interakcí mezi řadou aktivačních a inhibičních receptorů na NK buňkách a jejich ligandů na cílových buňkách.
Převaha aktivačních či inhibičních signálů pak rozhoduje o celkovém výsledku interakce mezi NK buňkou a jejím potenciálním cílem. Při převaze aktivačních signálů dochází k uvolnění granul s perforinem a granzymem z NK buňky a k lýze cílové buňky. Takto je zajišťována především obrana proti virem infikovaným a nádorovým buňkám. Na rozdíl od cytotoxických T-lymfocytů (T-ly) nevyžadují NK buňky k aktivaci interakci s HLA molekulami 1. třídy na antigen prezentujících buňkách a nejsou ve svém působení omezeny specifitou T-buněčného receptoru jako T-ly. Již v 80. letech byly u nemocných s CLL pozorovány morfologické abnormality NK buněk, zejména deficit azurofilních granulí a zároveň i snížení cytolytické aktivity [2]. Především v poslední dekádě pak byla popsána abnormální exprese řady aktivačních a inhibičních receptorů na NK buňkách pacientů s CLL. Zároveň ligandy těchto receptorů jsou na CLL buňkách v mnoha případech exprimovány odlišně, než je tomu u zdravých B-lymfocytů (B-ly), a CLL buňky tak unikají imunitnímu dozoru NK buněk. Mezi hlavní změny patří snížení exprese aktivačních receptorů NKG2D, DNAM-1, NKp46 a dále NKp30 (což ale nebylo potvrzeno ve všech studiích) na NK buňkách nemocných s CLL [3–6]. Naopak zvýšeně exprimovány jsou inhibiční receptory, např. ILT-2 (LIR1), nebo Tim-3 [7,8]. Exprese NKG2A, tedy hlavního inhibičního receptoru NK buněk, se ale u nemocných s CLL neliší od zdravých kontrol [5,9]. CLL buňky však zvýšeně exprimují ligandy pro inhibiční receptory, např. právě pro NKG2A je to HLA-E [9]. Nutno upozornit, že některé uvedené změny vycházejí v různých studiích různě a jejich význam je tedy sporný (exprese NKp30, HLA-E). Část protichůdných výsledků lze zřejmě vysvětlit působením CMV infekce, která ovlivňuje fenotyp NK buněk – u CMV séropozitivních jedinců je především zvýšená exprese NKG2C a ILT-2, a naopak snížená exprese NKG2A a NKp30 [10]. I ligandy pro aktivační receptory mohou mít na NK buňky inhibiční vliv, a to pokud se vyskytují v solubilní formě (a nikoliv na membráně buněk, nebo na exosomech), jak to bylo pozorováno v plazmě nemocných s CLL v případě BAG6 (ligand pro NKp30), MICB a ULBP2 (ligandy pro NKG2D) [11]. Zvláštní místo mezi receptory NK buněk zaujímá CD16, tedy receptor pro Fc fragment protilátek. Je to jediný receptor svého typu na NK buňkách – jeho prostřednictvím je realizována na protilátkách závislá buněčná cytotoxicita, vč. té zprostředkované terapeutickými monoklonálními protilátkami, jako jsou rituximab nebo obinutuzumab. I v případě CD16 byla na NK buňkách pacientů s CLL popsána abnormálně nízká exprese ve srovnání se zdravými kontrolami [4]. Ani zde ale nejsou výsledky konzistentní a v jiných studiích nízká exprese CD16 zjištěna nebyla [5,10]. Dále stojí za zmínku, že některé uvedené změny (snížená exprese NKG2D, NKp30, DNAM-1, nebo NKp46 na NK buňkách) byly pozorovány u pacientů s CLL, ale nikoliv u těch, u nichž se onemocnění manifestuje jako lymfom z malých lymfocytů (small lymphocytic lymphoma – SLL) [4]. Nemocní se SLL měli ve srovnání s CLL cytotoxicitu NK buněk do značné míry zachovanou. Mění se i počty NK buněk. Většina nemocných s časnou CLL má ve srovnání se zdravými jedinci absolutní počty NK buněk významně zvýšené [3,6]. Zároveň je však v rámci celé populace NK buněk u CLL potlačen subset zralých buněk s cytolytickou aktivitou, a zvýšení počtu tak jde na vrub nezralých a funkčně nekompetentních NK buněk [12]. Přesto se zdá, že zvýšený počet NK buněk, alespoň v časných stadiích onemocnění, může být prognosticky příznivý. Ve studii Wen-Ting et al. měli pacienti s nižším počtem NK buněk kratší celkové přežití, a zároveň se u nich častěji vykytovaly nepříznivé prognostické znaky jako mutace TP53, mutace ATM, nemutované geny pro těžké řetězce imunoglobulinů (IGHV), vyšší b2 mikroglobulin, vyšší exprese CD38 a další [13]. Zatímco tato data ukazují na prognostický význam početních změn NK buněk, data o souvislosti výše popsaných funkčních změn s prognózou dosud chybí. Lze se tedy pouze domnívat, že tyto defekty mohou podporovat progresi CLL. V současnosti jsou intenzivně zkoumány možnosti terapeutického ovlivnění, či využití NK buněk, např. protilátka proti inhibičnímu receptoru NKG2A – monalizumab, nebo využití alogenních, aktivovaných autologních nebo chimerickým receptorem vybavených (CAR-NK) NK buněk [14,15]. Hlavní změny NK buněk i dalších buněčných populací nespecifické imunity shrnuje tab. 1.
Table 1. Nejdůležitější změny jednotlivých buněčných populací imunitního systému u nemocných s neléčenou CLL. 
CLL – chronická lymfocytární leukemie, IL – interleukin, NET – neutrophils extracellular traps, NLC – nurse-like cells PORUCHY NEUTROFILŮ
S neutropenií bez vztahu k léčbě se lze setkat u nemocných v pokročilých stadiích CLL s masivní infiltrací kostní dřeně. Naopak vyšší absolutní počet neutrofilů před léčbou může být prognosticky příznivý, jak ukázala práce Levyho et al. [16]. Pacienti s absolutním počtem neutrofilů (ANC) > 7×109/l zde měli delší čas do léčby, častěji dosahovali léčebné odpovědi a měli i statisticky signifikantně delší celkové přežití (konkrétně 60 / 88 / 101 měsíců pro nemocné s ANC < 1×109/l / 1–7×109/l / > 7×109/l; p = 0,031). Naopak prognosticky nepříznivá byla monocytóza (absolutní počet monocytů > 1×109/l), jak bude diskutováno níže. V samostatné analýze nemocných bez monocytózy byl příznivý vliv vyššího ANC ještě výraznější (celkové přežití 60 / 107 /133 měsíců pro nemocné s ANC < 1×109/l / 1–7×109/l / > 7×109/l; p = 0,03). Není zatím jasné, zda je delší přežívání nemocných s vyšším ANC pouze projevem nižší aktivity choroby, nižšího rizika infekcí, efektivnější eliminace CLL buněk neutrofily při anti-CD20 léčbě, nebo zda naopak neutrofily samotné potlačují progresi CLL.
V několika málo studiích byly popsány také funkční defekty neutrofilů. Je nutno upozornit, že většina těchto prací pojednává o smíšených souborech léčených i neléčených pacientů. Ve studii Itälä et al. byly popsány defekty náhodné i cílené migrace a respiračního vzplanutí u nemocných s CLL a rekurentními infekcemi, zatímco pacienti, kteří infekcemi netrpěli, měli tyto parametry srovnatelné se zdravými kontrolami [17]. Schopnost fagocytózy a nitrobuněčného zabíjení ovlivněny nebyly. Ve starší práci Zeya et al. byl na malém souboru nemocných zjištěn deficit lysozymu a myeloperoxidázy u neutrofilů a také monocytů, které měly navíc deficit b-glukuronidázy [18]. Nověji Kontoyiannis et al. popsali sníženou efektivitu zabíjení bakteriálních (Staphylococcus aureus a Pseudomonas aeruginosa), ale překvapivě nikoliv houbových (Candida albicans a Aspergillus fumigatus) patogenů neutrofily pacientů s CLL. Zajímavé je, že míra zabíjení Aspergillus fumigatus byla výrazně závislá na sérové koncentraci imunoglobulinů, což naznačuje, že v odpovědi proti tomuto patogenu hraje důležitou roli opsonizace pro fagocyty [19]. Podle nedávné práce českých autorů mají sice neutrofily nemocných s CLL aktivovaný fenotyp charakteristický zvýšenou expresí CD64 (receptor pro Fc fragment IgG) a CD54 (adhezivní molekula) a sníženou expresí CD62L (adhezivní molekula), a to zejména při pokročilém onemocnění, po léčbě, nebo ve skupině s nemutovanými IGHV. Zároveň jsou ale přítomny i funkční defekty neutrofilů, jako porucha produkce IL-1b a TNFa po stimulaci lipopolysacharidy [20]. Ve stejné práci byla pozorována i zvýšená produkce reaktivních forem kyslíku neutrofily nemocných s CLL, což může přispívat k dysfunkci T-ly a NK buněk a progresi onemocnění. Další skupina autorů, která také pozorovala zvýšený počet neutrofilů s nízkou expresí CD62L u nemocných s CLL (a zvláště u těch s pokročilým onemocněním), dokázala, že změnu fenotypu a vlastností neutrofilů způsobují interleukin-10 (IL-10) a TGF-b (transforming growth factor b), produkované CLL buňkami [21]. CLL buňky dále produkují i G-CSF (granulocyte colony-stimulating factor) a GM-CSF (granulocyte-macrophage colony-stimulating factor), které v této studii vedly k abnormálně prodlouženému přežívání neutrofilů. Tyto tzv. s tumorem asociované neutrofily (TAN) kromě již uvedeného potlačovaly aktivaci T-ly. Neutrofily nemocných s CLL dále zvýšeně tvoří tzv. neutrophils extracellular traps (NET) [22]. Jedná se o sítě tvořené DNA, histony a antibakteriálními proteiny. Kromě antimikrobiální funkce hrají NET roli i v trombogenezi a autoimunitních onemocněních, aktivují plazmocytoidní dendritické buňky, usnadňují aktivaci T-ly a jsou toxické pro endotel a epitelie. NET jsou generovány aktivní formou buněčné smrti, zvanou netóza. V této studii NET navíc aktivovaly CLL buňky, (zvyšovaly expresi aktivačního markeru CD69 a kostimulačních molekul CD80 a CD86) a potlačovaly apoptózu CLL buněk, zatímco na B-ly zdravých dárců tento vliv neměly. Zvýšenou tvorbu NET neutrofily u CLL stimuluje IL-8, jehož zdrojem jsou zde zřejmě monocyty [23]. I přes výše uvedený příznivý vliv vyššího ANC na prognózu nemocných neutrofily u CLL nejen že neplní zcela adekvátně své funkce v obraně organizmu před patogeny, ale zároveň mohou být další buněčnou populací, která podporuje progresi choroby. Hlavní změny neutrofilů jsou shrnuty v tab. 1.
PORUCHY MONOCYTŮ A MAKROFÁGŮ
Daleko podrobněji než změny neutrofilů jsou u CLL popsány alterace monocytů a makrofágů. Monocyty mohou hrát významnou roli v rozvoji choroby již ve stadiu monoklonální B-lymfocytózy (MBL). Monocyty pacientů s MBL ve srovnání s těmi od nemocných s časnou CLL zvýšeně produkovali řadu prozánětlivých cytokinů (zejména IL-8, TNFa (tumor necrosis factor a) a IFNg (interferon g)) a měli aktivovány geny pro zánětlivou odpověď (pro uvedené cytokiny, HMGB 1, fagocytózu, receptory pro patogeny a další) [24]. Význam těchto nálezů není zatím zcela jasný, autoři uvedené studie uvažují, že prozánětlivé prostředí může přispívat k progresi MBL do CLL. Pozdější celková imunosuprese ve stadiu CLL pak popsané prozánětlivé procesy tlumí. Vyšší absolutní počet monocytů v době diagnózy byl ve studii z Mayo Clinic spojen s kratším celkovým přežitím (v univariantní analýze) a s kratším časem do léčby (to i v multivariantní analýze, bez ohledu na další prognostické znaky, jako stadium dle Raie, či cytogenetické změny) [25]. Mezi monocyty za fyziologických podmínek rozlišujeme klasický subset (CD14++, CD16–), intermediární subset (CD14++, CD16+) a neklasický subset (CD14+, CD16++). U nemocných s CLL byl ve srovnání se zdravými kontrolami pozorován zvýšený celkový počet monocytů i počet monocytů z klasického i neklasického subsetu. V poměru k celkovému počtu byl nejvíce expandován neklasický subset, i když i u CLL byl stále dominantní klasický subset, tak jako u zdravých kontrol [26]. Byly pozorovány poruchy metabolizmu glukózy monocytů, zejména transportu glukózy přes membránu, poruchy anaerobní glykolýzy a zároveň defekty fagocytózy, pro kterou je glykolýza potřebná. Tyto defekty spouštěla mimo jiné interakce PD-1 (programmed death 1 = CD279) na monocytech s PD-1L (programmed death ligand 1 = CD274) na CLL buňkách, přičemž PD-1 byl na monocytech ve srovnání se zdravými kontrolami exprimován zvýšeně [27]. V krvi nemocných s CLL byly také zjištěny zvýšené hladiny solubilního CD14, který je produkován monocyty a podporuje přežívání CLL buněk [28]. Asi nejdůležitější abnormalitou je pak nízká exprese HLA-DR u části monocytů nemocných s CLL (monocyty s fenotypem CD14+ HLA-DR low/neg). Tyto buňky jsou v novějších pracích označovány jako monocytární „myeloid-derived supressor cells“ (MDSC). MDSC byly popsány u celé řady malignit [29]. Rozlišují se 3 skupiny – monocytární MDSC (s fenotypem CD45+, CD33+, CD11b+, CD15–, CD14+, HLA-DR low/neg), granulocytární MDSC (s fenotypem CD66+ CD11b+, CD15+, CD14–, HLA-DR low/neg) a konečně časné MDSC (early-stage MDSC, charakterizované jako CD33+, Lin–, CD3–, CD14–, CD15–, CD19–, CD56–, HLA-DR–) [29,30]. Granulocytární MDSC zřejmě odpovídají výše zmíněným s tumorem asociovaným neutrofilům, mají obdobný fenotyp [30]. Monocytární MDSC produkují IL-10, TGF-b, reaktivní formy kyslíku a enzymy indolamin-2,3-dioxygenázu (IDO) a arginázu, které působí depleci tryptofanu a argininu důležitého pro T-ly [29,31]. V důsledku působení monocytárních MDSC in vitro bylo popsáno potlačení produkce IFN - g, potlačení proliferace T-ly a naopak podpora diferenciace a proliferace T-reg. [31,32]. Několik prací prokázalo signifikantně vyšší množství monocytárních MDSC v periferní krvi nemocných s CLL ve srovnání se zdravými kontrolami [29,32,33]. Jejich zvýšený počet byl spojený s vyšší aktivitou choroby, kratším přežitím bez progrese a v další studii zase s kratším celkovým přežitím nemocných [31,33].
Monocyty jsou prekurzorem makrofágů. I ty hrají významnou roli v patogenezi celé řady hematologických a solidních malignit. Fyziologicky rozlišujeme M1 subset, tzv. klasicky aktivované makrofágy, a M2 subset – alternativně aktivované makrofágy [34]. M1 subset v odpovědi na bakteriální lipopolysacharidy, IFN - g, nebo GM-CSF produkuje prozánětlivé cytokiny jako IL-1, IL-6, IL-12, IL-23 a TNF-a, CXCL9 (chemokine (C-X-C motif) ligand 9), CXCL10, oxid dusnatý a reaktivní formy kyslíku. M1 makrofágy jsou výkonné fagocyty a APC, indukující především Th1 imunitní odpověď. M2 subset v odpovědi na stimulaci IL-4, IL-13, IL-10 a M-CSF (macrophage colony-stimulating factor) produkuje zejména protizánětlivé cytokiny, jako IL-10, TGF-b, CCL17 (chemokine (C-C motif) ligand 17), CCL22, arginázu a manózu (CD206), a exprimuje scavenger receptory (CD163). M2 makrofágy působí imunosupresivně, fyziologicky mají roli především při hojení a u některých parazitárních a houbových infekcí [34,35]. Makrofágy nalezené v mikroprostředí tumorů se běžně označují jako s tumorem asociované makrofágy (TAM) a většinou mají vlastnosti M2 subsetu. U CLL byly v mikroprostředí lymfatických uzlin, kostní dřeně a sleziny popsány tzv. nurse-like buňky (nurse-like cells – NLC), které se diferencují z monocytů a mají schopnost udržovat při životě CLL buňky v buněčné kultuře [36]. Typicky exprimují CD68 a CD163. Postupně se ukázalo, že NLC jsou vlastně TAM specifické pro CLL. Mají převážně vlastnosti M2 makrofágů, ale i některé rysy typické pro M1, jako jsou exprese CD14, schopnost fagocytózy a produkce reaktivních forem kyslíku [35]. Diferenciaci monocytů do NLC a jejich polarizaci k M2 fenotypu podporují u CLL hepatocyte growth factor (HGF) produkovaný stromálními buňkami a folikulárními dendritickými buňkami (FDC), IL-4, IL-10 a IL-13 z Th-ly a IL-10, M-CSF, nikotinamid fosforibosyl transferáza (NAMPT) a high-mobility group box 1 (HMGB1) z CLL buněk [34,36–38]. Migraci monocytů do uzlin, kde se mění v NLC, stimulují cytokiny CCL2, CCL3 a CCL4 produkované také CLL buňkami. Ty k tomu ale samy potřebují stimulaci T-ly prostřednictvím CD40-CD40L interakce [34,38]. NLC pak produkují plejádu cytokinů, které působí imunosupresivně (IL-10, TGF-b, CCL18, IDO), atrahují CLL buňky (CXCL12 a CXCL13) a podporují jejich přežívání (CCL4, CXCL12, BAFF (B-cell activating factor), APRIL (A proliferation-inducing ligand), CD31, Plexin-B, nebo již zmíněný HGF) [36,37,39]. Výsledným efektem je potlačení proliferace T-ly, kromě T-reg, jejichž množství se naopak zvyšuje [36,37]. NLC exprimují také PD-L1, který interakcí s PD-1 na T-ly přispívá k jejich dysfunkci (tzv. stav pseudovyčerpání) [37,40]. Bylo prokázáno, že míra infiltrace lymfatických uzlin NLC koreluje s pokročilostí CLL [41]. In vitro bylo pozorováno snížení účinku ibrutinibu na CLL buňky ve společné kultuře s NLC (naopak u rituximabu, bendamustinu, venetoclaxu a idelalisibu žádný vliv NLC pozorován nebyl) [42]. In vitro a v experimentu na myším modelu CLL bylo dokázáno, že eliminace M2 makrofágů (tedy NLC) pomocí monoklonální protilátky proti M-CSF potlačuje progresi CLL [43]. Hlavní změny monocytů a makroágů jsou shrnuty v tab. 1.
PORUCHY DENDRITICKÝCH BUNĚK
Poslední buněčnou populací, kterou je nutno zmínit, jsou dendritické buňky. Jde o extrémně heterogenní populaci, kde rozlišujeme řadu subsetů v kůži, sliznicích, kostní dřeni, lymfatických uzlinách i v periferní krvi. Ze zřejmých technických důvodů jsou nejlépe prozkoumány dendritické buňky periferní krve, které lze velmi zjednodušeně rozdělit na myeloidní, neboli klasické dendritické buňky (CDC) a plazmocytoidní dendritické buňky (PDC). Obě populace se dále složitě člení a liší se původem, fenotypem i funkcí (extenzivně popsáno v publikaci autorů Rhodese et al. [44]). CDC (CD11c+ CD123–) fungují zejména jako výkonné APC se schopností stimulovat CD8+ cytotoxické T-ly (CDC1 subset), nebo naivní T-ly, u nichž ovlivňují polarizaci do Th1, Th2 nebo dalších subsetů T-ly (CDC2 subset). Zejména CDC2 jsou zároveň schopné produkce řady cytokinů (TNF-a, IL-1, IL-6, IL-8, IL-12, IL-18, CCL3, CCL4, CXCL8) [44]. Hlavní funkcí PDC (CD11c – CD123+) je naproti tomu antivirová imunita, zprostředkovaná produkcí IFN-a (ten stimuluje aktivaci efektorových T-ly, NK buněk, diferenciaci B-ly v plazmocyty, prezentaci antigenů dalšími dendritickými buňkami atd.), i když minoritní subpopulace PDC má také funkci APC a stimulátorů T-ly [44,45]. U nemocných s CLL byly pozorovány četné funkční defekty dendritických buněk – snížená exprese HLA-DR, kostimulačních molekul (CD80, CD86, CD83, a CD40) a snížená produkce cytokinů (IL-12, TNF, IL-6, IL-10) [46]. Příčinou je zřejmě defektní maturace monocytů v dendritické buňky v důsledku působení IL-6 a IL-10 z CLL buněk. Na molekulární úrovni je aktivována STAT3 dráha, což zvyšuje expresi SOCS5 (suppressor of cytokine signalling 5), který negativně reguluje expresi STAT6, tedy transkripčního faktoru zprostředkovávajícího maturaci monocytů po stimulaci IL-4 [46]. Takto vzniklé dendritické buňky mají nižší schopnost indukovat proliferaci CD4+ T-ly a zejména CD8+ T-ly a naopak indukují T-reg [46]. Množstvím a funkcí PDC u nemocných s CLL se zabývali Saulep-Easton et al. [45]. Množství PDC v periferní krvi u nemocných s progredující CLL bylo ve srovnání se zdravými kontrolami snížené, při indolentním průběhu CLL naopak oproti zdravé populaci zvýšené. U nemocných množství PDC negativně korelovalo s množstvím CLL buněk. Hladiny IFN-a byly snížené jak u indolentní, tak progresivní CLL, u progresivní ale významně více. Hlavním negativním regulátorem diferenciace PDC je TNF, jehož hladiny byli v této studii vyšší u progredující CLL, než u indolentní CLL a u kontrol. Produkce TNF jsou schopné především makrofágy, ale také celá řada dalších buněk (NK buňky, T-ly i CLL buňky) [45]. V patogenezi CLL hrají významnou roli kromě dendritických buněk periferní krve i dendritické buňky v mikroprostředí kostní dřeně. Jejich množství je u nemocných s CLL vyšší než u zdravých jedinců a na myším modelu také koreluje s pokročilostí choroby [47]. Akumulace dendritických buněk v kostní dřeni byla v pokusu na myších závislá na jejich expresi receptorové molekuly CD84, přičemž u myší s nefunkční CD84 nemoc neprogredovala, a její blokáda (např. pomocí monoklonální protilátky) by tak mohla být účinným terapeutickým zásahem [47]. Hlavní změny dendritických buněk jsou shrnuty v tab. 1. Hlavní interakce mezi CLL a buňkami imunitního systému ukazuje obr. 1.
Image 1. Hlavní interakce mezi CLL a buňkami imunitního systému. 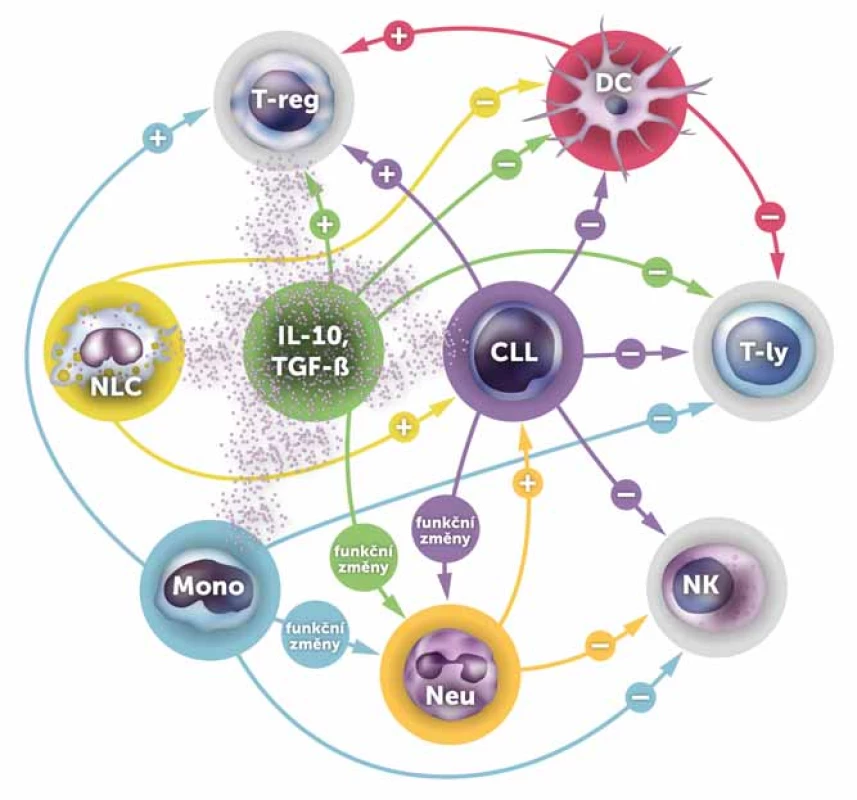
Obrázek schématicky zhrnuje hlavní interakce mezi základními buněčnými populacemi u CLL. Aktivační působení je symbolizováno +, inhibiční –. CLL buňky (CLL) jsou jedním z hlavních zdrojů inhibičně působících cytokinů IL-10 a TGF-β. Dalšími zdroji jsou především regulační T-ly (T-reg), monocyty (Mono) a nurse-like buňky (NLC). Pod vlivem IL-10, TGF-β a dalšími mechanizmy (G-CSF a GM-CSF z CLL buněk, IL-8 z monocytů) se neutrofily (Neu) mění na s tumorem asociované neutrofily, které inhibují NK buňky (NK) a naopak podporují přežívání CLL buněk. Na klasické CD4+ a CD8+ T-ly působí u CLL většina buněčných populací vč. dendritických buněk (DC) inhibičně, na T-reg naopak aktivačně. Velmi zjednodušeně jde o opak fyziologického stavu, který nastává v důsledku působení CLL. PORUCHY KOMPLEMENTu
U CLL byly dále popsány i defekty komplementu. Komplement je důležitý především pro obranu organizmu před opouzdřenými bakteriemi. Vzhledem k celé škále výše diskutovaných imunitních defektů, které se u nemocných vyskytují téměř vždy současně, je ale těžké posoudit, jak významná je jeho role v patogenezi infekčních komplikací. Schlesinger et al. měřili koncentrace jednotlivých složek komplementu v séru nemocných s CLL, přičemž statisticky významný deficit byl zjištěn u 40 % pacientů v časných stadiích onemocnění a u všech nemocných s pokročilou CLL [48]. Nejčastěji byl pozorován deficit properdinu. Prognostický význam aktivity komplementu zkoumali Varga et al. [49]. Hlavním faktorem s vlivem na celkové přežití nemocných byla shledána aktivita klasické cesty aktivace komplementu, nikoliv ale aktivita alternativní cesty. Koncentrace jednotlivých složek komplementu byly méně prognosticky významné. Nebyla pozorována korelace mezi aktivitou komplementu a koncentracemi imunoglobulinů. Nověji bylo zjištěno, že příčinou snížené aktivity klasické cesty aktivace komplementu u nemocných s CLL může být nižší aktivita C5 konvertázy a složky komplementu C2, zatímco hladiny C4 jsou u pacientů s CLL a zdravých osob srovnatelné a hladiny C3 jsou dokonce u nemocných vyšší [50]. Deficit složek komplementu u nemocných s CLL je pravděpodobně důsledkem jeho chronické aktivace, přičemž tím, co tuto aktivaci spouští, jsou agregáty imunoglobulinů IgG (konkrétně hexamery) a a2 makroglobulinu [51,52]. Na komplementu závislá cytotoxicita je také jedním z mechanizmů účinku anti-CD20 monoklonálních protilátek, zejména rituximabu. Defekty komplementu tedy mohou mít dopad na účinnost této léčby, která zároveň složky komplementu při aktivaci spotřebovává. Ve studii Middleton et al. byl pokles aktivity komplementu po anti-CD20 léčbě u nemocných s CLL mnohem hlubší než u zdravých jedinců [53]. Dal se však zvrátit přidáním plazmy nebo jednotlivých složek komplementu, přičemž jako nejvíce limitující se v této studii ukázala hladina složky C2. V další studii 34 nemocných s CLL před léčbou rituximabem měli pacienti s in vitro rezistencí CLL buněk ke komplementu kratší čas do relapsu (45 vs. > 80 měsíců; p = 0,03) a méně často dosahovali kompletní remise (65,2 vs. 100%; p = 0,03) [54]. Defekty komplementu mohou mimo jiné přispívat k progresi CLL samotné a k rozvoji komplikací, jako jsou autoimunitní hemolytická anémie a imunitní trombocytopenie [55]. Mechanizmem je v tomto případě nedostatečná opsonizace apoptotických buněk deficitním komplementem. Opsonizace apoptotických buněk a jejich následná fagocytóza makrofágy je totiž nezbytná k produkci protizánětlivých cytokinů. Naopak nahromadění apoptotických buněk a uvolnění antigenů stimuluje potenciální autoimunitní reakci. Opsonizace apoptotických buněk je také klíčová v negativní selekci autoreaktivních B-ly při jejich vývoji v kostní dřeni – autoreaktivní B-ly bez dostatečného kontaktu s adekvátně opsonizovanými autoantigeny nejsou „odhaleny“ jako autoreaktivní a je umožněna jejich maturace. Progrese CLL v důsledku akumulace apoptotických buněk je zase teoreticky důsledkem chronické stimulace B-buněčného receptoru antigeny, které se z těchto buněk uvolňují.
ZÁVĚR
Na závěr této části lze říci, že jednotlivé buněčné populace zajišťující nespecifickou imunitu (neutrofily, monocyty, makrofágy, dendritické buňky) pod vlivem CLL klonu ztrácí své původní protinádorové a antiinfekční funkce a mění se na komplexní podpůrnou síť pro CLL buňky. Ta se navíc významně podílí na přestavbě specifické imunity prostřednictvím expanze T-reg. a potlačením ostatních T-ly, což samozřejmě zase přispívá k progresi CLL a kruh se uzavírá. Defekty komplementu nadto mohou hrát roli i v rozvoji autoimunitních komplikací. Pochopení popsaných interakcí může v budoucnu umožnit rozvoj zcela nových léčebných přístupů směřujících k rozbití této podpůrné sítě pro CLL. Možnosti terapeutického ovlivnění NK buněk (protilátka monalizumab), či jejich využití jako CAR-NK buňky jsou již ve stadiu klinických studií. V praxi je také jistě zajímavý poznatek o příznivém prognostickém významu vyššího počtu neutrofilů, či naopak nepříznivém vlivu vyššího počtu monocytů, tedy parametrů jednoduše dostupných z vyšetření krevního obrazu. Jinak ale znalosti změn nespecifické imunity u CLL na praktické využití zatím čekají.
PODÍL AUTORŮ NA PŘÍPRAVĚ RUKOPISU
První verzi sepsal P. Vodárek. Ostatní autoři (L. Smolej, D. Belada, M. Šimkovič, D. Écsiová a P. Žák) následně rukopis revidovali. Všichni autoři souhlasí s finální verzí rukopisu.
PODĚKOVÁNÍ
Práce byla podpořena programem PROGRES Q40/08 a RVO (MZO 00179906)
ČESTNÉ PROHLÁŠENÍ
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne: 18. 1. 2021.
Přijato po recenzi dne: 6. 4. 2021.
MUDr. Pavel Vodárek
Jungmannova 1400,
Hradec Králové, 500 02
e-mail: vodarek.pavel@seznam.cz
Sources
- Vodárek P, Smolej L, Belada D, Šimkovič M, Écsiová D, Žák P. Změny v imunitním systému u neléčených nemocných s chronickou lymfocytární leukémií – část 1: specifická imunita. Transfuze Hematol Dnes. 2021; 27 (2): 128–136.
- Kay NE, Zarling JM. Impaired natural killer activity in patients with chronic lymphocytic leukemia is associated with a deficiency of azurophilic cytoplasmic granules in putative NK cells. Blood. 1984; 63 (2): 305–309.
- Huergo-Zapico L, Acebes-Huerta A, Gonzalez-Rodriguez AP, et al. Expansion of NK cells and reduction of NKG2D expression in chronic lymphocytic leukemia. correlation with progressive disease. PLoS One. 2014; 9 (10): e108326
- Parry HM, Stevens T, Oldreive C, et al. NK cell function is markedly impaired in patients with chronic lymphocytic leukaemia but is preserved in patients with small lymphocytic lymphoma. Oncotarget. 2016; 7 (42): 68513–68526.
- Veuillen C, Aurran-Schleinitz T, Castellano R, et al. Primary B-CLL resistance to NK cell cytotoxicity can be overcome in vitro and in vivo by priming NK cells and monoclonal antibody therapy. J Clin Immunol. 2012; 32 (3): 632–646.
- Costello RT, Knoblauch B, Sanchez C, Mercier D, Le Treut T, Sébahoun G. Expression of natural killer cell activating receptors in patients with chronic lymphocytic leukaemia. Immunology. 2012; 135 (2): 151–157.
- Villa-Álvarez M, Sordo-Bahamonde C, Lorenzo-Herrero S, et al. Ig-like transcript 2 (ILT2) blockade and lenalidomide restore NK cell function in chronic lymphocytic leukemia. Front Immunol. 2018; 9 : 2917.
- Hadadi L, Hafezi M, Amirzargar AA, Sharifian, RA, Abediankenari S, Asgarian-Omran H. Dysregulated expression of Tim-3 and NKp30 receptors on NK cells of patients with chronic lymphocytic leukemia. Oncol Res Treat. 2019; 42 (4): 202–208.
- McWilliams EM, Mele JM, Cheney C, et al. Therapeutic CD94/NKG2A blockade improves natural killer cell dysfunction in chronic lymphocytic leukemia. Oncoimmunology. 2016; 5 (10): e1226720.
- Hofland T, Endstra S, Gomes CKP, et al. Natural killer cell hypo-responsiveness in chronic lymphocytic leukemia can be circumvented in vitro by adequate activating signaling. Hemasphere. 2019; 3 (6): e308.
- Reiners KS, Topolar D, Henke A, et al. Soluble ligands for NK cell receptors promote evasion of chronic lymphocytic leukemia cells from NK cell anti-tumor activity. Blood. 2013; 121 (18): 3658–3665.
- MacFarlane AW 4th, Jillab M, Smith MR, et al. NK cell dysfunction in chronic lymphocytic leukemia is associated with loss of the mature cells expressing inhibitory killer cell Ig-like receptors. Oncoimmunology. 2017; 6 (7): e1330235.
- Wang WT, Zhu HY, Wu YJ, et al. Elevated absolute NK cell counts in peripheral blood predict good prognosis in chronic lymphocytic leukemia. J Cancer Res Clin Oncol. 2018; 144 (3): 449–457.
- Sivori S, Meazza R, Quintarelli C, et al. NK cell-based immunotherapy for hematological malignancies. J Clin Med. 2019; 8 (10): 1702.
- Hofland T, Eldering E, Kater AP, Tonino SH. Engaging cytotoxic T and NK cells for immunotherapy in chronic lymphocytic leukemia. Int J Mol Sci. 2019; 20 (17): 4315.
- Levy I, Vadasz Z, Polliack A, Tadmor T. The frequency and prognostic value of neutrophilia in chronic lymphocytic leukemia. Anticancer Res. 2018; 38 (8): 4731–4734.
- Itälä M, Vainio O, Remes K. Functional abnormalities in granulocytes predict susceptibility to bacterial infections in chronic lymphocytic leukaemia. Eur J Haematol. 1996; 57 (1): 46–53.
- Zeya HI, Keku E, Richards F 2nd, Spurr Cl. Monocyte and granulocyte defect in chronic lymphocytic leukemia. Am J Pathol. 1979; 95 (1): 43–54.
- Kontoyiannis DP, Georgiadou SP, Wierda WG, et al. Impaired bactericidal but not fungicidal activity of polymorphonuclear neutrophils in patients with chronic lymphocytic leukemia. Leuk Lymphoma. 2013; 54 (8): 1730–1733.
- Manukyan G, Papajik T, Gajdos P, et al. Neutrophils in chronic lymphocytic leukemia are permanently activated and have functional defects. Oncotarget. 2017; 8 (49): 84889–84901.
- Podaza E, Risnik D, Colado A, et al. Chronic lymphocytic leukemia cells increase neutrophils survival and promote their differentiation into CD16high CD62Ldim immunosuppressive subset. Int J Cancer. 2019; 144 : 1128–1134.
- Podaza E, Sabbione F, Risnik D, et al. Neutrophils from chronic lymphocytic leukemia patients exhibit an increased capacity to release extracellular traps (NETs). Cancer Immunol Immunother. 2017; 66 (1): 77–89.
- Risnik D, Podaza E, Almejún MB, et al. Revisiting the role of interleukin-8 in chronic lymphocytic leukemia. Sci Rep. 2017; 7 (1): 15714.
- Blanco G, Puiggros A, Sherry B, et al. Chronic lymphocytic leukemia-like monoclonal B-cell lymphocytosis exhibits an increased inflammatory signature that is reduced in early-stage chronic lymphocytic leukemia. Exp Hematol. 2021; 7: S0301-472X (21) 00001-1.
- Friedman DR, Sibley AB, Owzar K, et al. Relationship of blood monocytes with chronic lymphocytic leukemia aggressiveness and outcomes: a multi-institutional study. Am J Hematol. 2016; 91 (7): 687–691.
- Maffei R, Bulgarelli J, Fiorcari S, et al. The monocytic population in chronic lymphocytic leukemia shows altered composition and deregulation of genes involved in phagocytosis and inflammation. Haematologica. 2013; 98 (7): 1115–1123.
- Qorraj M, Bruns H, Böttcher M, et al. The PD-1/PD-L1 axis contributes to immune metabolic dysfunctions of monocytes in chronic lymphocytic leukemia. Leukemia. 2017; 31 (2): 470–478.
- Seiffert M, Schulz A, Ohl S, Dohner H, Stilgenbauer S, Lichter P. Soluble CD14 is a novel monocyte-derived survival factor for chronic lymphocytic leukemia cells, which is induced by CLL cells in vitro and present at abnormally high levels in vivo. Blood. 2010; 116 (20): 4223–4230.
- Palumbo GA, Parrinello NL, Giallongo C, et al. Monocytic myeloid derived suppressor cells in hematological malignancies. Int J Mol Sci. 2019; 20 (21): 5459.
- Bronte V, Brandau S, Chen SH, et al. Recommendations for myeloid-derived suppressor cell nomenclature and characterization standards. Nat Commun. 2016; 7 : 12150.
- Gustafson MP, Abraham RS, Lin Y, et al. Association of an increased frequency of CD14+ HLA-DR lo/neg monocytes with decreased time to progression in chronic lymphocytic leukaemia (CLL). Br J Haematol. 2012; 156 (5): 674–676.
- Jitschin R, Braun M, Büttner M, et al. CLL-cells induce IDOhi CD14+HLA-DRlo myeloid-derived suppressor cells that inhibit T-cell responses and promote TRegs. Blood. 2014; 124 (5): 750–760.
- Liu J, Zhou Y, Huang Q, Qiu L. CD14 (+) HLA-DR (low/-) expression: A novel prognostic factor in chronic lymphocytic leukemia. Oncol Lett. 2015; 9 (3): 1167–1172.
- Petty AJ, Yang Y. Tumor-associated macrophages in hematologic malignancies: new insights and targeted therapies. Cells. 2019; 8 (12): 1526.
- Filip AA, Ciseł B, Koczkodaj D, Wasik-Szczepanek E, Piersiak T, Dmoszyńska A. Circulating microenvironment of CLL: are nurse-like cells related to tumor-associated macrophages? Blood Cells Mol Dis. 2013; 50 (4): 263–270.
- Giannoni P, Pietra G, Travaini G, et al. Chronic lymphocytic leukemia nurse-like cells express hepatocyte growth factor receptor (c-MET) and indoleamine 2,3-dioxygenase and display features of immunosuppressive type 2 skewed macrophages. Haematologica. 2014; 99 (6): 1078–1087.
- Audrito V, Serra S, Brusa D, et al. Extracellular nicotinamide phosphoribosyltransferase (NAMPT) promotes M2 macrophage polarization in chronic lymphocytic leukemia. Blood. 2015; 125 (1): 111–123.
- Van Attekum MHA, van Bruggen JAC, Slinger E, et al. CD40 signaling instructs chronic lymphocytic leukemia cells to attract monocytes via the CCR2 axis. Haematologica. 2017; 102 (12): 2069–2076.
- Boissard F, Fournié JJ, Laurent C, Poupot M, Ysebaert L. Nurse like cells: chronic lymphocytic leukemia associated macrophages. Leuk Lymphoma. 2015; 56 (5): 1570–1572.
- Brusa D, Serra S, Coscia M, et al. The PD-1/PD-L1 axis contributes to T-cell dysfunction in chronic lymphocytic leukemia. Haematologica. 2013; 98 (6): 953–963.
- Boissard F, Laurent C, Ramsay AG, et al. Nurse-like cells impact on disease progression in chronic lymphocytic leukemia. Blood Cancer J. 2016; 6 (1): e381.
- Boissard F, Fournié JJ, Quillet-Mary A, Ysebaert L, Poupot M. Nurse-like cells mediate ibrutinib resistance in chronic lymphocytic leukemia patients. Blood Cancer J. 2015; 5 (10): e355.
- Galletti G, Scielzo C, Barbaglio F, et al. Targeting macrophages sensitizes chronic lymphocytic leukemia to apoptosis. Cell Reports. 2016; 14 (7): 1748–1760.
- Rhodes JW, Tong O, Harman AN, Turville SG. Human dendritic cell subsets, ontogeny, and impact on HIV infection. Front Immunol. 2019; 10 : 1088.
- Saulep-Easton D, Vincent FB, Le Page M, et al. Cytokine-driven loss of plasmacytoid dendritic cell function in chronic lymphocytic leukemia. Leukemia. 2014; 28 (10): 2005–2015.
- Toniolo PA, Liu S, Yeh JE, Ye DQ, Barbuto JA, Frank DA. Deregulation of SOCS5 suppresses dendritic cell function in chronic lymphocytic leukemia. Oncotarget. 2016; 7 (29): 46301–46314.
- Barak AF, Lewinsky H, Perpinial M, et al. Bone marrow dendritic cells support the survival of chronic lymphocytic leukemia cells in a CD84 dependent manner. Oncogene. 2020; 39 (9): 1997–2008.
- Schlesinger M, Broman I, Lugassy G. The complement system is defective in chronic lymphatic leukemia patients and in their healthy relatives. Leukemia 1996; 10 (9): 1509–1513.
- Varga L, Czink E, Miszlai Z, et al. Low activity of the classical complement pathway predicts short survival of patients with chronic lymphocytic leukaemia. Clin Exp Immunol. 1995; 99 (1): 112–116.
- Michelis R, Tadmor T, Barhoum M, et al. A C5a-Immunoglobulin complex in chronic lymphocytic leukemia patients is associated with decreased complement activity. PLoS One. 2019; 14 (1): e0209024.
- Michelis R, Tadmor T, Aviv A, et al. Cell-free IgG-aggregates in plasma of patients with chronic lymphocytic leukemia cause chronic activation of the classical complement pathway. PLoS One. 2020; 15 (3): e0230033.
- Naseraldeen N, Michelis R, Barhoum M, et al. The Role of Alpha 2 Macroglobulin in IgG-Aggregation and Chronic Activation of the Complement System in Patients With Chronic Lymphocytic Leukemia. Front Immunol. 2021; 11 : 603569.
- Middleton O, Cosimo E, Dobbin E, et al. Complement deficiencies limit CD20 monoclonal antibody treatment efficacy in CLL. Leukemia. 2015; 29 : 107–114. 54. Bordron A, Bagacean C, Mohr A, et al. Resistance to complement activation, cell membrane hypersialylation and relapses in chronic lymphocytic leukemia patients treated with rituximab and chemotherapy. Oncotarget. 2018; 9 (60): 31590–31605.
- García-Muñoz R, Roldan Galiacho V, Llorente L. Immunological aspects in chronic lymphocytic leukemia (CLL) development. Ann Hematol. 2012; 91 (7): 981–996.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today
2021 Issue 3-
All articles in this issue
- Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
- Změny v imunitním systému u neléčených nemocných s chronickou lymfocytární leukémií – část 2: nespecifická imunita
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Laboratorní diagnostika imunitně podmíněných trombocytopenií
- Ph negativní myeloproliferativní neoplázie na českých hematologických centrech – analýza dat MIND
- Kryokonzervované směsné trombocyty v náhradním roztoku
- Mnohočetná plazmocytóza lymfatických uzlin s přítomností monoklonální gamapatie – plazmocelulární neoplázie či indolentní B-lymfom?
- Primář MUDr. Jiří Horák, 11. 6. 1936 – 21. 6. 2021
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laboratorní diagnostika imunitně podmíněných trombocytopenií
- Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Kryokonzervované směsné trombocyty v náhradním roztoku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

