-
Medical journals
- Career
Regenerující krvetvorba se podobá embryonální krvetvorbě nezávislé na kmenových buňkách
Authors: E. Nečas; K. Faltusová 1,2 1
Authors‘ workplace: Ústav patologické fyziologie, 1. lékařská fakulta, Univerzita Karlova 1; BIOCEV, 1. lékařská fakulta, Univerzita Karlova 2
Published in: Transfuze Hematol. dnes,26, 2020, No. 3, p. 157-166.
Category: Review/Educational Papers
Overview
Regenerace poškozené tkáně je komplexní proces závislý na buňkách s potenciálem obnovit struktury a funkce poškozené tkáně a na řídicích faktorech z tkáňového mikroprostředí. Krvetvorná tkáň má velkou schopnost regenerace, která je přičítána přítomnosti kmenových buněk. Znalosti o složení krvetvorné tkáně a funkci jejích kmenových a progenitorových buněk jsou především z experimentálního výzkumu myší krvetvorby. V práci jsou shrnuty současné pohledy na hierarchii a funkci nezralých krvetvorných buněk, včetně buněk kmenových. Je také stručně pojednáno o třech fázích embryonální a fetální krvetvorby, které předchází ustavení krvetvorby dospělého jedince. Stručně prezentuje výsledky experimentálního výzkumu časné fáze regenerace kostní dřeně po jejím poškození ionizujícím zářením. Výzkum ukázal na významnou roli, kterou v intenzivní fázi regenerace mají vývojově pozdní myeloidní progenitorové buňky, které dočasně nahradí chybějící buňky kmenové a multipotentní progenitory. Protože zdrojem krevních buněk jsou v intenzivně regenerující kostní dřeni buňky progenitorové, ne buňky kmenové a multipotentní progenitory, nelze regenerující kostní dřeň účinně transplantovat. Studie poukazuje na podobnost mezi intenzivně regenerující kostní dření dospělého jedince a embryonální krvetvorbou, která předchází vzniku krvetvorných kmenových buněk a jejímž zdrojem jsou erytroidní-myeloidní buňky progenitorové.
Klíčová slova:
krvetvorba – kmenová buňka – progenitorová buňka – kostní dřeň – regenerace – embryo – fetální játra
ÚVOD
Krvetvorná (hematopoetická) tkáň stále produkuje velké množství myeloidních a lymfoidních krevních buněk. Tyto buňky jsou odvozeny od multipotentní myeloidní-lymfoidní buňky kmenové. Velká část poznatků o funkci krvetvorné tkáně byla získána při experimentálním výzkumu myší krvetvorby. Dostupnost syngenních a kongenních myších kmenů umožnila studovat krvetvornou tkáň pomocí její transplantace. Možnost analyzovat a separovat nezralé krvetvorné buňky pomocí průtokové cytometrie a následně je transplantovat dále významně přispěla k poznání krvetvorby u myší. Základním definičním znakem krvetvorné kmenové buňky zůstává její schopnost transplantace a dlouhodobého obnovení zničené hematopoetické tkáně. Kmenová buňka je po transplantaci schopná obnovit myelopoezu i lymfopoezu a dlouhodobě udržovat produkci krevních buněk. Vývojový potenciál kmenových buněk však není u všech těchto buněk stejný. Některé kmenové buňky více podporují myelopoezu, jiné lymfopoezu [1, 2] (obr. 1). Některé mají dokonce vývojový potenciál omezený na dlouhodobou tvorbu jen dvou linií krevních buněk nebo dokonce jen na tvorbu megakaryocytů [3]. Populace krvetvorných kmenových buněk je tedy heterogenní a má vnitřní vývojovou hierarchii [4, 5]
Image 1. Myelodní-lymfoidní krvetvorné kmenové buňky nejsou homogenní populací. Některé mají potenciál pro tvorbu myeloidních a lymfoidních buněk stejný (A), jiné více podporují myelopoezu (B), jiné lymfopoezu (C). 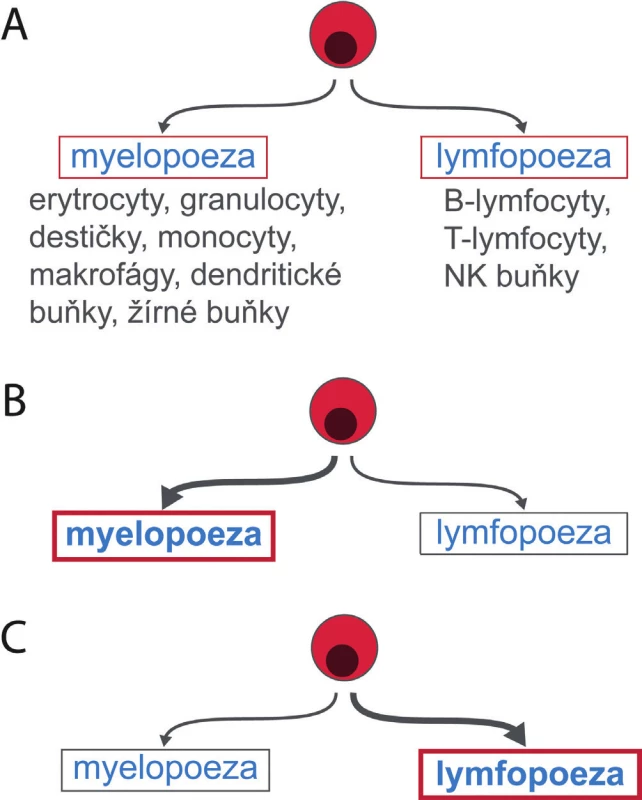
Původ krvetvorných kmenových buněk je embryonální. Diferenciací specifických buněk cévního endotelu vzniknou první kmenové buňky s charakteristickou schopností být transplantovány dospělému jedinci s poškozenou krvetvorbou, v jehož kostní dřeni se přihojí a stanou se dlouhodobým zdrojem všech krevních buněk. V časné fázi embryonálního vývoje vznikne v embryu paralelně několik kmenových buněk, které kolonizují fetální játra a posléze kostní dřeň. Několik kmenových buněk vzniklých v určité fázi embryonálního vývoje vytvoří klony kmenových buněk, které jsou dlouhodobě současně činné při tvorbě krevních buněk. Normální krvetvorba je proto polyklonální. Klony kmenových buněk v krvetvorné tkáni dlouhodobě přetrvávají, přestože jsou zdrojem buněk krevních. Schopnost udržovat vlastní populaci (klon) kmenových buněk a současně poskytovat buňky, které se diferencují a zrají v buňky krevní, je obecným definičním znakem kmenových buněk různých tkání [6] (obr. 2).
Image 2. V nepoškozené kostní dřeni dospělého jedince je pravděpodobnost, že se kmenová buňka bude diferencovat (Pd), a pravděpodobnost, že po buněčném dělení zůstane buňkou kmenovou (Ps), stejná. Počet kmenových buněk zůstává konstantní a z diferencovaných buněk vznikají klony krevních buněk s omezenou dobou setrvání v krvi. 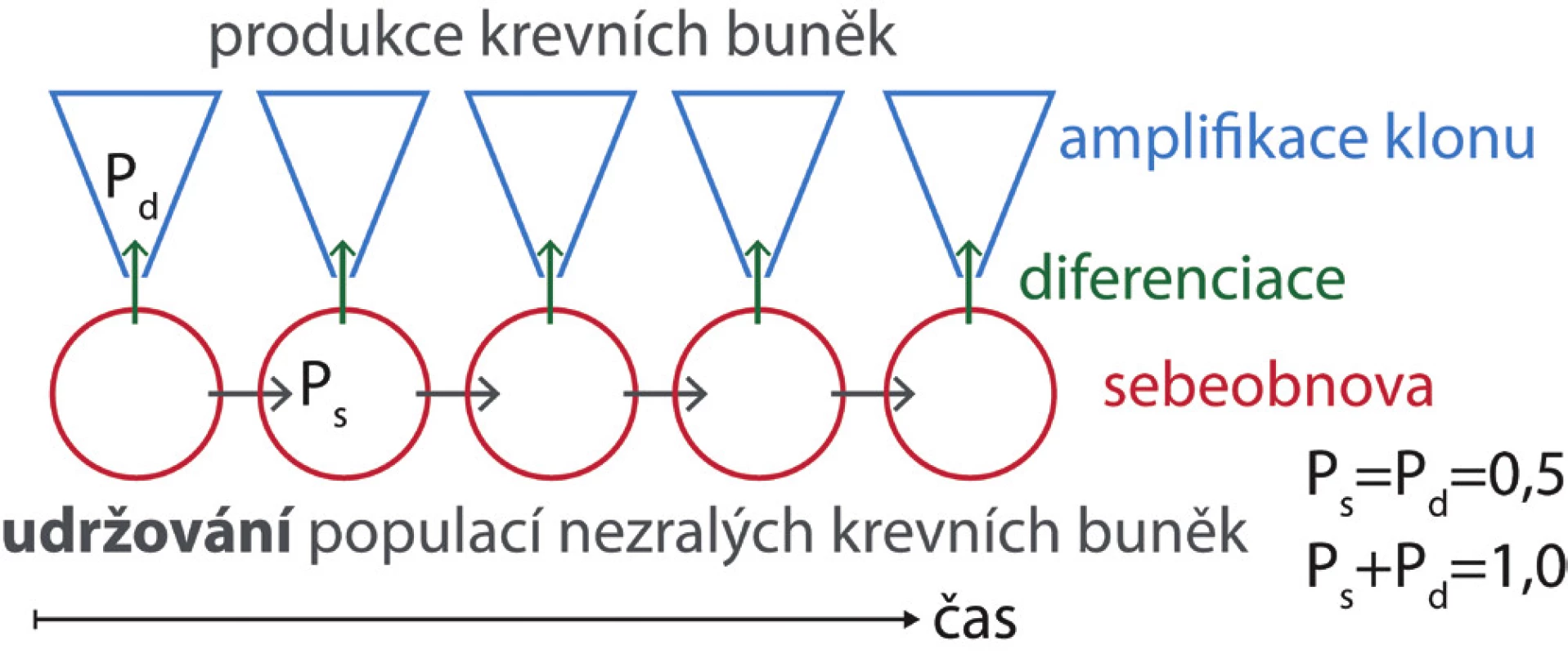
Sebeobnova kmenových buněk asymetrickým a symetrickým buněčným dělením
Udržování stálé populace kmenových buněk při jejich současné diferenciaci v buňky progenitorové spočívá v jejich asymetrickém dělení, kdy jen jedna nově vzniklá kmenová buňka se diferencuje a stane se zdrojem funkčně specializovaných buněk, zatímco druhá buňka nahradí buňku kmenovou, která se rozdělila (obr. 3A). Asymetrická mitóza kmenových buněk je považována za dlouhodobý zdroj diferencovaných a funkčně specializovaných buněk ve tkáních, které stále nahrazují buňky zaniklé. Při dělení krvetvorných buněk in vitro byla existence asymetrického výsledku buněčného dělení prokázána [7]. Při studiu průběhu buněčného cyklu u nezralých krvetvorných buněk jsme zjistili, že přibližně polovina buněk exprimujících znak Sca-1 tento znak po buněčném dělení ztratí a diferencuje se do zralejších forem progenitorů Sca-1 negativních. Druhá polovina dceřiných buněk vstupuje do nového buněčného cyklu s fenotypem buňky mateřské, tj. zachová si znak Sca-1 [8]. Tento výsledek odpovídá asymetrickému buněčnému dělení nezralých krvetvorných buněk v krvetvorné tkáni in situ.
Image 3. Kmenové buňky udržují svůj počet, přestože se diferencují a dávají vznik progenitorům a buňkám krevním. Mechanismem, kterým toho lze dosáhnout, je asymetrická mitóza, kdy se jedna dceřiná buňka diferencuje a druhá dceřiná buňka zůstane ve stavu buňky kmenové (A). Zvýšení počtu kmenových buněk je možné jen symetrickou mitózou, kdy obě dceřiné buňky zůstanou buňkami kmenovými (B). Osud kmenových buněk a z nich vzniklých buněk dceřiných určují zevní vlivy působící na kmenovou buňku z bezprostředního buněčného a mezibuněčného prostředí, které se označuje jako „niche“. 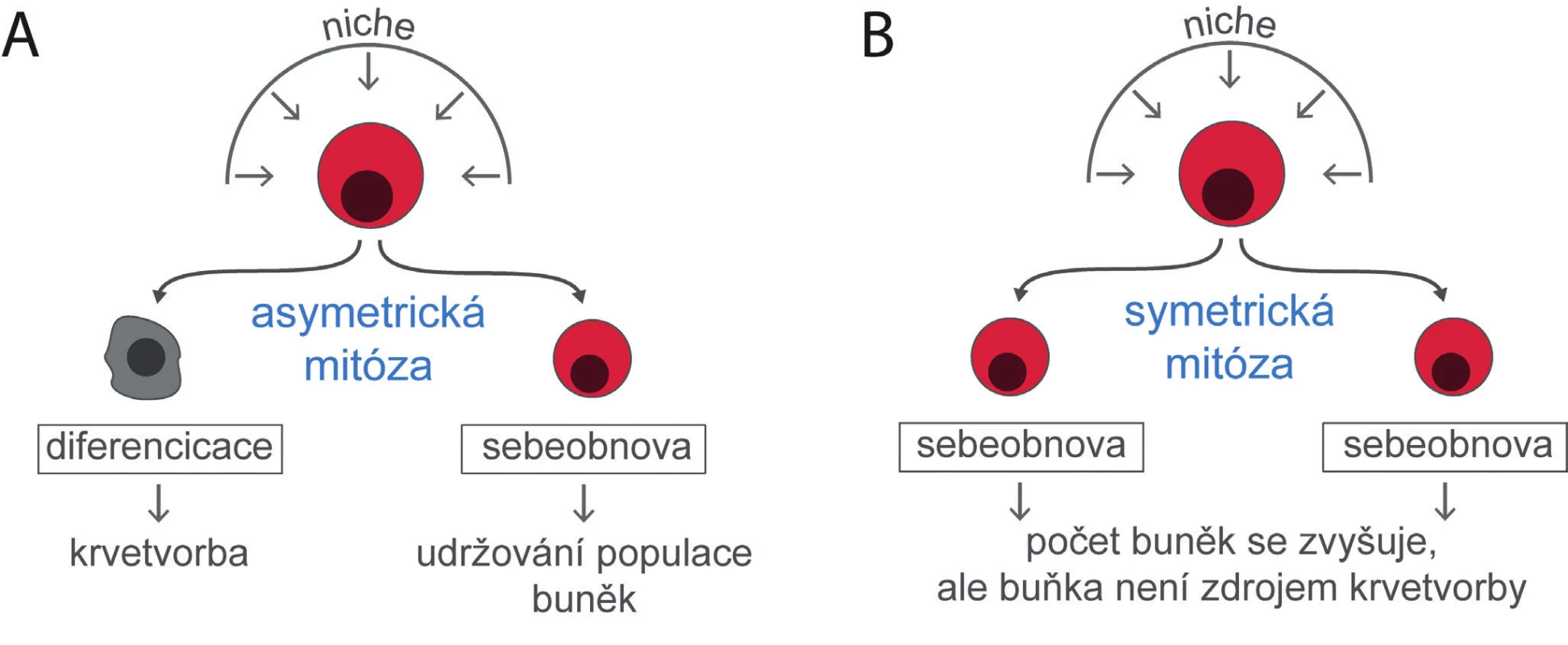
Možnost transplantace velmi malého počtu krvetvorných kmenových buněk, dokonce jen jedné kmenové buňky [9] dokazuje, že vedle asymetrického dělení má kmenová buňka také možnost symetrického sebeobnovného buněčného dělení. Monoklonální krvetvorbu odvozenou od jedné transplantované kmenové buňky lze následně transplantovat několika myším. Jedna transplantovaná buňka tedy dala vzniknout několika kmenovým buňkám, které lze transplantovat [4]. Symetrické sebeobnovné dělení není zdrojem krevních buněk, ale zvyšuje počet buněk kmenových (obr. 3B).
Podpůrná a řídicí funkce stromatu krvetvorné tkáně
Výsledek buněčného dělení kmenové buňky je ovlivňován stavem bezprostředního okolí kmenové buňky, pro které se vžil termín „niche“. Konkrétních znalostí o řízení krvetvorných kmenových a progenitorových buněk jejich mikroprostředím je však stále velmi málo. Výrazně probádanější jsou buněčné interakce mezi stromatem a kmenovými buňkami v některých tkáních, které mají pevnou mikroarchitekturu. Patří mezi ně např. střevní epitel, epidermis a především zárodečné tkáně mouchy Drosophila melanogaster a červa Caenorhabditis elegans. Studium těchto tkání umožnilo vhled do biologické podstaty interakcí mezi „niche“ a kmenovými a progenitorovými buňkami, které jsou zdrojem specializovaných buněk příslušných tkání (přehledně např. [10]
Krvetvorba v ustáleném stavu v dospělém jedinci
V posledních letech byla v experimentálním výzkumu krvetvorné tkáně myší věnována značná pozornost ustálené krvetvorbě dospělých myší. Řešena byla otázka heterogenity kmenových buněk, tj. vnitřního nastavení vývojového potenciálu buněk schopných dlouhodobého obnovení poškozené krvetvorné tkáně po jejich transplantaci, a dále otázka aktivní účasti kmenových buněk na tvorbě zralých buněk krevních. Zatímco první otázku lze považovat za vyřešenou tak, že existují kmenové buňky s odlišným vnitřním vývojovým potenciálem (obr. 1), byla aktivní účast kmenových buněk na normální krvetvorbě některými studiemi zpochybněna [11], jinými potvrzena [12]. Žádná z těchto studií nerozporuje přítomnost kmenové buňky v kostní dřeni, ale jde o to, zda se tyto buňky v dospělé nepoškozené krvetvorné tkáni dělí a diferencují, tj. zda se aktivně podílí na tvorbě krevních buněk, nebo zda jsou to buňky „spící“, jejichž potenciál k buněčnému dělení a diferenciaci se aktivuje jen po poškození krvetvorné tkáně nebo po jejich transplantaci. Výsledek experimentálních studií není v této otázce jednoznačný a jejich shrnutí a diskuse jsou předmětem nedávného sdělení [13].
V této souvislosti je třeba uvést poznatky o vývojové hierarchii nezralých krvetvorných buněk a o jejich schopnosti udržovat své populace sebeobnovným buněčným dělením. Hierarchie nezralých krvetvorných buněk v kostní dřeni je znázorněna na obrázku 4A. Předpokládá se, že jde o vývojovou hierarchii jednosměrnou, ve které se progresivně snižuje schopnost sebeobnovných dělení ve prospěch diferenciace ve zralejší typy buněk. Buňky kmenové i multipotentní progenitory (MPP) jsou buňky transplantovatelné. Liší se však dobou, po kterou jsou po transplantaci zdrojem krevních buněk. Zatímco buňky kmenové obnoví a podporují krvetvorbu po transplantaci dlouhodobě a současně obnoví i samy sebe, MPP jsou zdrojem krevních buněk po jejich transplantaci po omezenou dobu. Kmenové buňky jsou proto také označovány jako buňky LTRC (long-term repopulating cells) a MPP jako buňky STRC (short-term repopulating cells) [14]. Ve výše zmíněných nejednotných názorech na účast kmenových buněk na krvetvorbě dospělého jedince jde v zásadě o to, do jaké míry jsou buňky MPP doplňovány z buněk kmenových a do jaké míry jsou jejich populace autonomní.
Image 4. (A) Kmenové buňky (HSC), multipotentní progenitory (MPP) a myeloidní progenitory (CMP, GMP a MEP) tvoří vývojovou hierarchii stále více diferencovaných buněk se stále menším spektrem krevních buněk, kterým mohou dát vzniknout. (B) Nezralé buňky v kostní dřeni myší nemají liniové znaky (L) a exprimují receptor c-Kit (K; LK buňky). Dělí se na méně zralé buňky LSK a zralejší buňky LS– K pomocí znaku Sca-1 (Stem cell antigen-1). Buňky LSK lze rozlišit pomocí znaků CD150, CD48 a CD135 na buňky kmenové (HSC) a čtyři druhy multipotentních progenitorů (MPP1, MPP2, MPP3 a MPP4). MPP4 mají výrazně lymfoidní vývojový potenciál. Na obrázku není jejich určení pomocí znaku CD135 (Flt3) ukázáno. Rozdělení LSK buněk podle znaků CD34 a CD16/32 není běžně používáno, je zde jen uvedeno pro porovnání s buňkami LS– K. Buňky LS– K obsahují progenitory myeloidních buněk, které lze rozlišit pomocí znaků CD34 a CD16/32 na CMP – společný (common) progenitor myeloidních buněk, GMP – progenitor granulocytů a makrofágu a MEP – progenitor megakaryocytů a erytroidních buněk. Buňky LSK mají v normální tkáni CD34/CD16-32 fenotyp stejný jako buňky CMP. 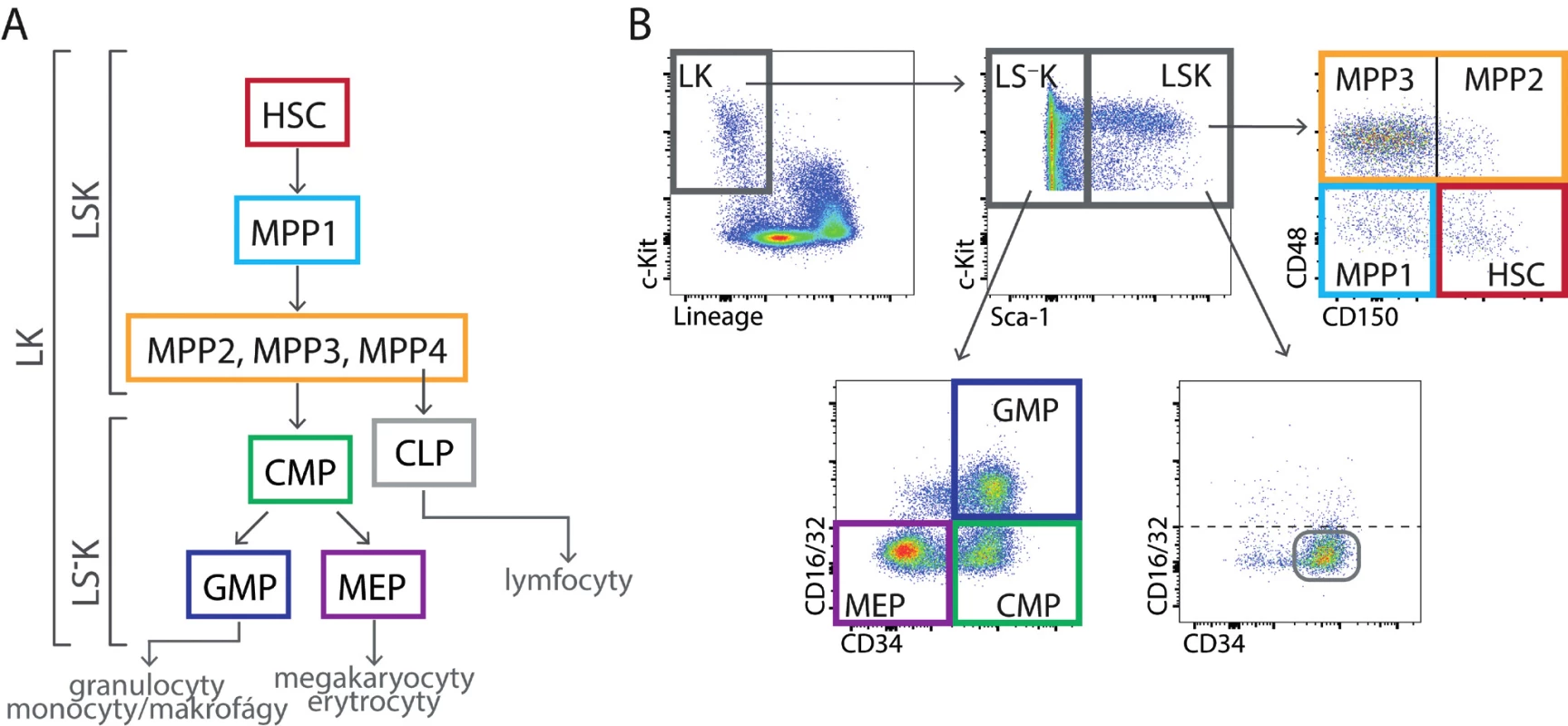
V krvetvorné tkáni myší lze buňky kmenové, MPP a progenitory s omezeným vývojovým spektrem tvorby krevních buněk rozlišit průtokovou cytometrií stanovením jejich příslušného imunofenotypu pomocí protilátek. Základní znaky sloužící k jejich rozlišení jsou uvedeny na obrázku 4B.
Hierarchie kmenových a progenitorových buněk se ustavuje již ve fetálních játrech, která jsou krvetvornou tkání. Během tohoto období je již krvetvorba závislá na transplantovatelných kmenových buňkách, které však stále ještě vyzrávají [15, 16].
Tři vlny krvetvorby v embryu a vznik kmenových buněk
Vznik krvetvorby vycházející z kmenových buněk předchází v embryu dvě přechodné fáze krvetvorby, které produkují převážně myeloidní krevní buňky. Tato krvetvorba je podporována progenitorovými buňkami pocházejícími z extraembryonální tkáně žloutkového vaku a progenitorové buňky, které jsou v tomto období vývoje jedince zdrojem buněk krevních, nejsou schopné transplantace [17, 18].
U myší se první vlna embryonální krvetvorby, která je nazývána primitivní krvetvorbou, objevuje ve žloutkovém vaku po 7. embryonálním dni vývoje (E7) ve formě ostrůvků krvetvorby (u člověka po E16). Tato krvetvorba se uskutečňuje mimo vlastní embryo, produkuje převážně primitivní jaderné erytrocyty, ale také megakaryocyty a makrofágy. Primitivní erytrocyty se od definitivních erytrocytů produkovaných v následných dvou fázích embryonální a fetální krvetvorby liší větší velikostí, přítomností jádra a expresí embryonálního hemoglobinu (globinových řetězců). Jsou to v podstatě erytroblasty, které dozrávají v erytrocyty až v cirkulující krvi. Primitivní erytrocyty jsou v cirkulaci přítomny během embryonálního i fetálního vývoje a u myši přetrvávají v krvi ještě několik dní po narození, tj. po E20–E21, kdy dochází k porodu myších fetů.
Primitivní fáze embryonální krvetvorby je následována první vlnou definitivní krvetvorby. Ta začíná opět ve žloutkovém vaku v období E8,5 vývoje a před vznikem prvních kmenových buněk v embryu [18, 19]. McGrath et al. [20] identifikovali v žloutkovém vaku erytroidní - -myeloidní progenitory (EMP) a stanovili jejich imunofenotyp. Cestou krevní cirkulace migrují tyto buňky ze žloutkového vaku do fetálních jater v období E10,5–E11,5 vývoje a ve fetálních játrech jsou zdrojem myeloidních krevních buněk, ne však buněk lymfoidních. EMP postrádají schopnost dlouhodobého obnovení poškozené krvetvorné tkáně po jejich transplantaci, tj. základní znak buněk kmenových.
Až druhá vlna definitivní krvetvorby (tj. třetí vlna embryonální krvetvorby) je spojena se vznikem prvních krvetvorných kmenových buněk, které se i po transplantaci stanou trvalým zdrojem buněk krevních. Kmenové buňky se diferencují ze specifických buněk endotelových procesem nazývaným endotelová-hematopoetická transformace. Dochází k ní na ventrální části dorzální aorty v oblasti nazývané aorta-gonad-mesonephros (AGM) v období E10 u myši a E27 u lidí [21]. Před migrací do fetálních jater se první vzniklé kmenové buňky množí a prochází zráním, ve kterém lze rozlišit několik jejich vývojových stadií [22]. Zralé kmenové buňky kolonizují fetální játra okolo E12. Intenzivně se množí a po transplantaci dospělému jedinci s poškozenou krvetvorbou jsou zdrojem všech typů krevních buněk včetně B-lymfocytů [23]. V případě transplantace jsou velmi účinné v obnovení poškozené krvetvorby, účinnější než pozdější kmenové buňky z kostní dřeně [24]. Ve fetálních játrech se tedy poprvé ustanovuje hierarchie krvetvorby odvozená od multipotentních kmenových buněk schematicky znázorněná na obrázku 4A. Kolem E17 začnou kmenové buňky migrovat do kostní dřeně. V kostní dřeni novorozených myší kmenové buňky intenzivně proliferují ještě asi 3 týdny, potom většina z nich přechází do klidového stavu [25]. Ve fetálních játrech se kmenové buňky stále ještě vyvíjejí a jejich budoucí vývojový potenciál se dále ustavuje. Kmenové buňky získané z fetálních jater před E18 a transplantované dospělým příjemcům obnoví jejich krvetvorbu v myeloidní i lymfoidní linii, ale B-lymfopoeza od nich odvozená nezíská citlivost k tlumivému účinku estrogenů [15, 16], což je vlastnost normální B-lymfopoezy [26].
Během embryonální krvetvorby, krvetvorby ve fetálních játrech a v kostní dřeni v období po narození, se v krvetvorné tkáni zvyšuje počet kmenových a progenitorových buněk souběžně se stále se zvyšující produkcí zralých krevních buněk (obr. 5).
Image 5. V expandující krvetvorné tkáni, v embryu – fetálních játrech – postnatální kostní dřeni – v regenerující poškozené kostní dřeni, se zvyšuje počet nezralých buněk. To předpokládá, že více než polovina buněk vzniklých rozdělením zůstane stejná jako buňka, která se rozdělila. Pravděpodobnost sebeobnovy buněčným dělením (Ps) je > 0,5. Pravděpodobnost diferenciace těchto buněk vznikající dělením (Pd) je proto < 0,5. Z buňky, která se diferencovala, však může vzniknout větší klon krevních buněk, pokud prodělá během pokračující diferenciace a zrání více amplifikačních dělení. Souběžně se pak může zvyšovat jak počet nezralých buněk, tak i počet produkovaných zralých krevních buněk. 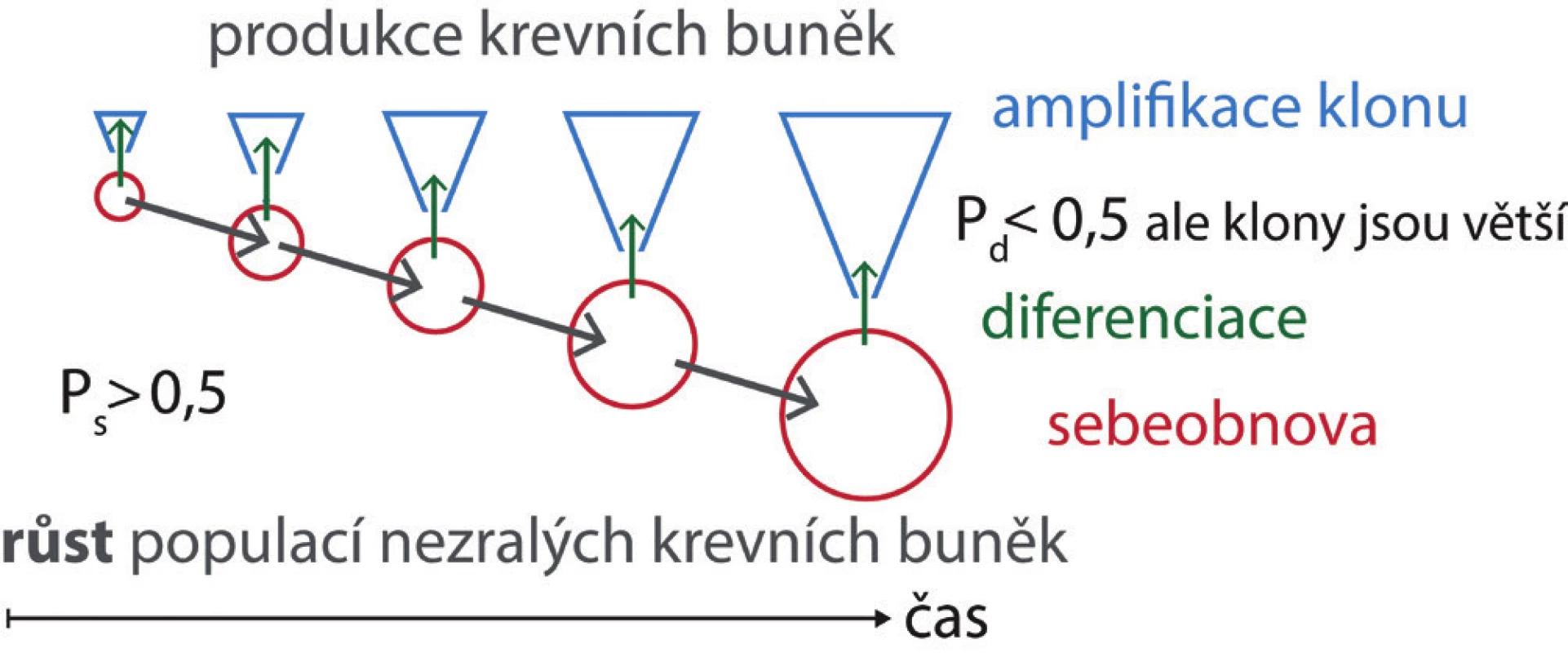
Regenerace poškozené krvetvorné tkáně
Po částečném poškození krvetvorná tkáň rychle regeneruje1 . Velká regenerační schopnost krvetvorné tkáně je spojována s přítomností kmenových buněk. Ty jsou obecně považovány za výchozí zdroj regenerace. Oproti normální krvetvorné tkáni dospělého jedince, která produkuje krevní buňky a současně udržuje populace nezralých krvetvorných buněk kmenových a progenitorových, musí regenerující krvetvorba uskutečňovat dva protichůdné úkoly: obnovit populace kmenových a progenitorových buněk a současně produkovat krevní buňky. Je to situace analogická expandující krvetvorné tkáni v embryu a ve fetálních játrech (obr. 5).
<hr>
Z fylogenetického hlediska není tato její velká regenerační schopnost zcela zřejmá. Velkou regenerační schopnost epidermis a epitelu gastrointestinálního traktu lze spojit s jejich častým mechanickým a toxickým poškozením, ke kterému docházelo během celé fylogeneze metazoí. Patogenní noxy, které silně poškozují kostní dřeň, jsou však zcela nedávným výsledkem lidské činnosti: expozice ionizujícímu záření v účinných dávkách a aplikace cytostatik.
<hr>
Z důvodu podobnosti regenerace kostní dřeně poškozené ionizujícím zářením s embryonální a fetální krvetvorbou (obr. 5) jsme analyzovali kostní dřeň ve stadiu její intenzivní regenerace a porovnali jsme ji s krvetvorbou ve fetálních játrech. Regenerující kostní dřeň jsme také porovnali s publikovanými údaji o dvou fázích embryonální krvetvorby, které předchází vznik krvetvorných kmenových buněk.
Ionizující záření poškozuje populace kmenových a progenitorových buněk v krvetvorných tkáních v závislosti na dávce. Celotělové ozáření myší dávkou 6 Gy zničí asi 99,9 % kmenových a krvetvorných buněk [27] a u některých myší se obnoví krvetvorba jen z jedné buňky [28].
Analyzovali jsme regenerující kostní dřeň po jejím poškození celotělovým ozářením dávkou 6 Gy za 8–20 dnů, kdy již bylo v kostní dřeni dost nezralých buněk pro jejich analýzu průtokovou cytometrií, klonální kultivací a transplantací. V tomto období se také obnovila intenzivní produkce zralých krevních buněk, jak dokládá zvrat v rozvoji anémie (obr. 6).
Image 6. Spontánní regenerace krvetvorby byla analyzována v období mezi 8. a 20. dnem po celotělovém ozáření myší dávkou 6 Gy. Od 12. dne se zastaví rozvoj anémie, což svědčí o obnovené produkci erytrocytů v množství, které se vyrovná a posléze převýší množství erytrocytů zanikajících (délka života erytrocytů je u myší asi 40 dnů). (Faltusová, K. et al. (2020), doi: 10.3389/fcell.2020.00098) 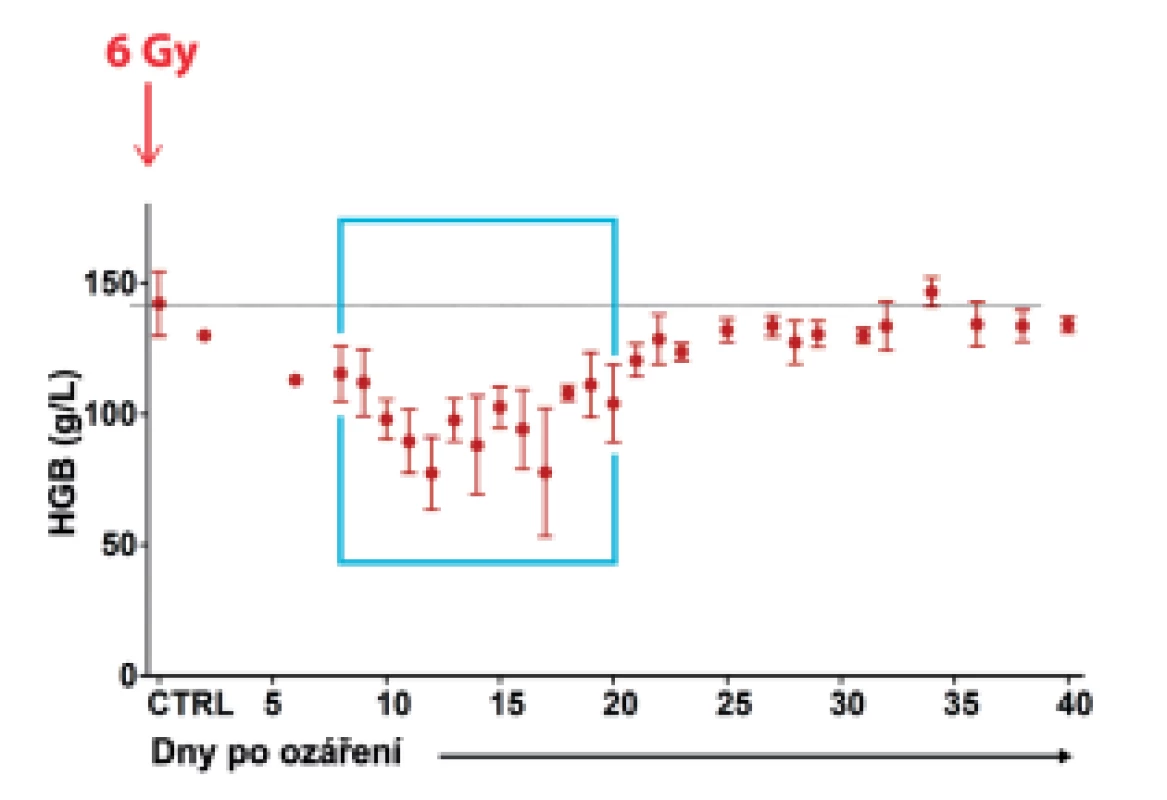
V kostní dřeni se současně zvyšoval počet nezralých krevních buněk (LK buněk). Těmito dvěma charakteristikami se regenerující kostní dřeň podobala expandující krvetvorbě ve fetálních játrech a ve dvou předcházejících fázích embryonální krvetvorby nezávislých na kmenových buňkách.
V intenzivně regenerující kostní dřeni bylo velmi málo buněk s fenotypem buněk kmenových (HSC; LSK CD150+CD48 – ; obr. 4B), multipotentních progenitorů (MMP1; LSK CD150 – CD48 – ; obr. 4B), progenitorů se silným lymfoidních potenciálem (LSK CD150 – CD135+) a společných myeloidních progenitorů (CMP; LS – K CD34+CD16/32 – ; obr. 4B). Naprostá převaha nezralých buněk LK měla imunofenotyp myeloidních progenitorů: granulocytových/makrofágových (GMP; LS – K CD34+CD16/32+; obr. 4B a 7A) a megakaryocytových/erytroidních (MEP; LS – K CD34 – CD16/32 – ; obr. 4B a 7A). Exprese znaku CD16/32 (receptory III a II pro Fc fragment γ-globulinů) byla významně zvýšená jak u buněk LS – K, tak i u buněk LSK (obr. 7A). Část LSK buněk silně exprimovala znak CD71 odpovídající transferinovému receptoru 1, který buňky LSK v normální kostní dřeni nemají. Intenzivně regenerující kostní dřeň a její buňky LSK, které jsou v normální dřeni nositeli jejího transplantačního potenciálu, měly schopnost transplantace sníženou na úroveň jen 1–2 % [29]. Pro odlišení od normálních LK buněk označujeme LK buňky v regenerující kostní dřeni, vyznačující se charakteristicky změněným imunofenotypem a významnou ztrátou schopnosti transplantace, jako LK-R buňky.
Image 7. (A) V regenerující kostní dřeni lze také nezralé buňky LK rozdělit pomocí znaku Sca-1 na LSK a LS– K . V LSK buňkách je velmi málo buněk s imunofenotypem buněk kmenových, multipotentních progenitorů MPP1 a společných myeloidních progenitorů CMP. Analýza buněk LSK ukázala, že buňky s fenotypem multipotentních progenitorů (MPP2 a MPP3) jsou ve skutečnosti pozměněnými (expresí znaku Sca-1) pozdními myeloidními progenitory GMP a MEP. V intenzivně regenerující kostní dřeni je tedy naprostá většina nezralých buněk (LK) granulocytovými a makrofágovými progenitory a megakaryocytovými-erytroidními progenitory. Praktickému chybění buněk s imunofenotypem buněk kmenových, multipotentních progenitorů a společných myeloidních progenitorů v intenzivně regenerující kostní dřeni odpovídá její velmi nízká schopnost transplantace, která je na úrovni 1–2 % [29]. (B) Složení nezralých buněk LSK a LS– K je v regenerující kostní dřeni významně pozměněno a naprostá většina těchto buněk jsou erytroidní a granulocytové/makrofágové progenitory ![(A) V regenerující kostní dřeni lze také nezralé buňky LK rozdělit pomocí znaku Sca-1 na LSK a LS–
K . V LSK buňkách je velmi málo
buněk s imunofenotypem buněk kmenových, multipotentních progenitorů MPP1 a společných myeloidních progenitorů CMP. Analýza
buněk LSK ukázala, že buňky s fenotypem multipotentních progenitorů (MPP2 a MPP3) jsou ve skutečnosti pozměněnými (expresí
znaku Sca-1) pozdními myeloidními progenitory GMP a MEP. V intenzivně regenerující kostní dřeni je tedy naprostá většina nezralých
buněk (LK) granulocytovými a makrofágovými progenitory a megakaryocytovými-erytroidními progenitory. Praktickému chybění buněk
s imunofenotypem buněk kmenových, multipotentních progenitorů a společných myeloidních progenitorů v intenzivně regenerující kostní
dřeni odpovídá její velmi nízká schopnost transplantace, která je na úrovni 1–2 % [29]. (B) Složení nezralých buněk LSK a LS–
K je v regenerující
kostní dřeni významně pozměněno a naprostá většina těchto buněk jsou erytroidní a granulocytové/makrofágové progenitory](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/c0263b9878ef1f7a518e08a1b1877661.jpeg)
V buňkách LSK a LS – K izolovaných z regenerující kostní dřeně, jsme stanovili expresi genů, na úrovni jejich mRNA, jejichž aktivita má vztah k buňkám kmenovým, multipoptentním progenitorům, lymfoidním progenitorům a myeloidním progenitorům (erytroidním a granulocytovým/makrofágovým). Výsledky ukázaly zvýšenou expresi genů spojených s erytroidním a granulocytovým/makrofágovým vývojem a současně nízkou expresi genů charakteristických pro buňky kmenové a multipotentní progenitory [29] (obr. 8). Zvýšená exprese erytroidních genů není způsobena anémií a zvýšenou stimulací erytropoetinem. U myší lze transfuzemi červených krvinek tvorbu erytropoetinu zcela zastavit. Opakované transfuze červených krvinek zabránily u ozářených myší rozvoji anémie a vyvolaly stav polycytemie, při kterém se tvorba erytropoetinu přeruší. Exprese erytroidních genů však zůstala v buňkách LK-R zvýšená podobně jako u myší, u kterých se anémie rozvinula [29].
Image 8. (A) Exprese genů spojených s „kmenovou funkcí“ krvetvorných buněk je v LK-R buňkách snížená nebo nezměněná. (B) Exprese genů spojených s erytroidním vývojovým potenciálem je v LK-R buňkách významně zvýšená jak v jejich LS– K, tak i LSK frakci. *, **, *** udávají významný rozdíl (p < 0,05, p < 0,01, p < 0,001) oproti expresi příslušného genu v LS– K nebo LSK buňkách v normální kostní dřeni. 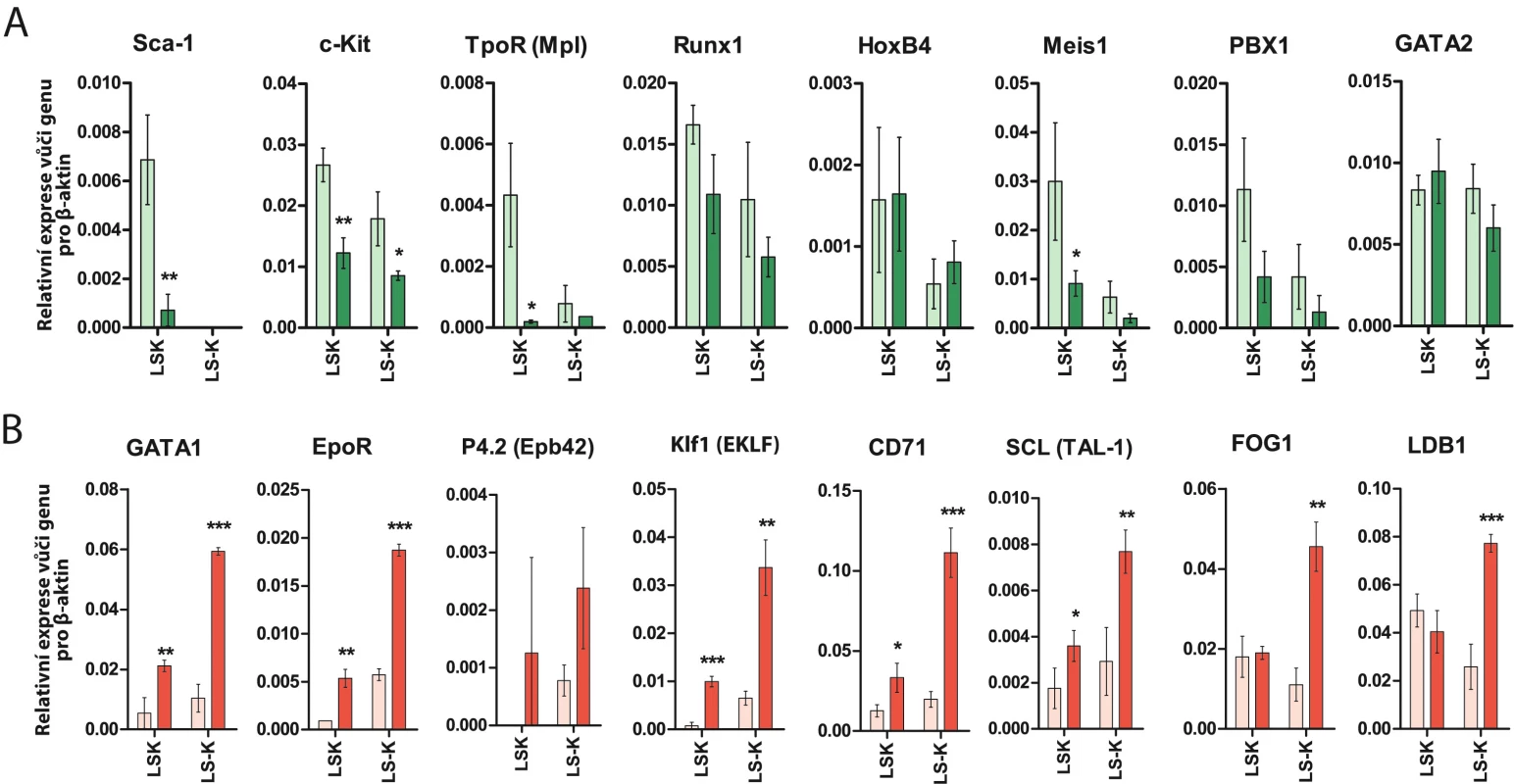
Rovněž kultivace buněk v mediích podporujících klonální expanzi erytroidních progenitorů (BFU-E, CFU-E) a granulocyto-makrofágových progenitorů (GM - -CFC, G-CFC, M-CFC) potvrdila v regenerující kostní dřeni převahu granulocytových/makrofágových a erytroidních progenitorů [29].
Analýza LK buněk v intenzivně regenerující kostní dřeni tak ukázala, že tato fáze regenerace spočívá v aktivitě pozměněných vývojově pozdních myeloidních progenitorů, ne na aktivitě buněk kmenových.
Principiální rozdíl mezi expandující krvetvorbou ve fetálních játrech a regenerující kostní dření dospělého jedince
Porovnali jsme fenotyp buněk LK v regenerující kostní dřeni s jejich fenotypem ve fetálních játrech a postnatální kostní dřeni. Imunofenotyp těchto buněk byl velmi odlišný [29]. Buňky z fetálních jater a postnatální kostní dřeně měly fenotyp obdobný LK buňkám v normální kostní dřeni dospělého jedince (obr. 4B). Významně se proto lišily od fenotypu LK-R buněk v regenerující kostní dřeni (obr. 7A). Schopnost transplantace jsme u buněk z fetálních jater a regenerující kostní dřeně neporovnávali, ale z publikovaných prací je známo, že buňky fetálních jater jsou transplantačně velmi účinné a předčí i transplantační schopnost normální kostní dřeně [24]. V porovnání s tím byla schopnost transplantace regenerující kostní dřeně velmi nízká, na úrovni 1–2 % normální kostní dřeně [29]. Ve fetálních játrech jsou tedy přítomné plnohodnotné kmenové buňky schopné transplantace a obnovení funkce poškozené krvetvorby příjemce transplantátu, které v regenerující kostní dřeni prakticky chybí. Rozdíly mezi expandující krvetvorbou ve fetálních játrech a v regenerující kostní dřeni jsou tedy mnohostranné a podstatné.
Podobnost mezi embryonální a regenerující krvetvorbou
Intenzivně regenerující kostní dřeň se podobá přechodné vlně embryonální definitivní krvetvorby, vychází z erytroidních a myeloidních progenitorů (EMP), která časově předchází vznik prvních transplantovatelných kmenových buněk [18, 19]. Podobnost je především v mohutné produkci myeloidních buněk tkání, která má nepatrné množství buněk kmenových. Podobnost je také v expresi znaku CD16/32 většinou LK buněk. Mezi imunofenotypem buněk EMP [20] a buněk LK–R [29] jsou však i významné rozdíly. LK-R buňky jsou c-Kitlow, EMP jsou c-Kithigh. Část LK-R buněk má znak Sca-1, EMP tento znak nemají. Část Sca-1 pozitivních buněk LK-R exprimuje znak CD150, EMP jsou všechny CD150 negativní. Všechny EMP exprimují znak CD41, jen malá část buněk LK-R exprimuje tento znak.
V naší studii jsme zjišťovali i úlohu signalizace receptorem c-Kit v indukci buněk LK-R. Vysoká exprese c-Kit je základním znakem kmenových a progenitorových buněk u myší [30]. c-Kit je receptorem pro cytokin stem cell faktor (SCF), který je základním cytokinem niche kmenových buněk [31]. Nízká exprese c-Kit na buňkách LK-R je proto paradoxní. Zablokovali jsme signalizaci zprostředkovanou receptorem c-Kit blokující protilátkou a sledovali vznik populace buněk LK-R. Tvorba buněk negativních na znak Sca-1 byla tímto velmi silně potlačena a celková regenerace kostní dřeně též. Signalizace vyvolaná cytokinem SCF je tedy pro regeneraci poškozené krvetvorné tkáně nezbytná přes sníženou expresi receptoru c-Kit. Nízká exprese c-Kit může být kompenzována zesílenou expresí cytokinu SCF. Na úrovni mRNA jsme regenerující kostní dřeni prokázali 10–100násobné zvýšení exprese obou forem SCF, formy membránově vázané a solubilní [29].
DISKUSE
Výsledky naší studie kladou otázku o původu silně expandované populace pozměněných erytroidních a myeloidních progenitorů, buněk LK-R, v regenerující kostní dřeni. Počáteční poškození kostní dřeně po celotělovém ozáření myší dávkou 6 Gy je natolik velké, že regenerace vychází jen z několika přeživších buněk [27, 28], které proto nelze identifikovat a podrobit analýze. V naší studii jsou analyzovány jejich klony v období intenzivní regenerace poškozené krvetvorby, kdy počet buněk LK-R silně roste, ale zároveň jsou již tyto buňky významným zdrojem zralých buněk krevních.
Detailní analýze regenerující kostní dřeně je věnováno málo prací a ani ty nepřinášejí jednoznačnou odpověď o původu buněk, které jsou východiskem pro časnou intenzivní regeneraci. Všeobecně se předpokládá, že jsou to buňky kmenové, které se začnou zvýšeně dělit. Přesvědčivé důkazy však pro to nejsou.
Simonnet et al. [32] analyzovali kostní dřeň myší po jejich vystavení ionizujícímu záření dávkami 3 Gy a 6 Gy. Dva dny po poškození měly LK buňky, které zůstaly v poškozené kostní dřeni, sníženou expresi c-Kit a zvýšenou expresi znaků Sca-1 a CD150. To je v souladu s našimi nálezy.
Peslak et al. [33] analyzovali kostní dřeň myší ozářených dávkou 4 Gy. Po tomto menším poškození krvetvorné tkáně popsali vlnu erytropoezy, která následuje po jejím významném útlumu. Již šestý den se v krvi zvýšil počet retikulocytů a od 8. dne se začal zvyšovat hematokrit. Mezi 4. a 6. dnem se významně zvýšila hladina erytropoetinu. Expanze velmi nezralých erytroidních progenitorů BFU-E vytvářející in vitro kolonie erytroidních buněk až za 7 dnů kultivace, však nebyla na stimulaci erytropoetinem závislá. Kolem 9. dne po ozáření se v cirkulaci zvýšilo množství erytroidních progenitorů a významně se zvýšila erytropoeza ve slezině. Autoři uzavřeli, že regenerace erytropoezy probíhá zpočátku v kostní dřeni, ale později erytroidní progenitory migrují do sleziny, kde se stanou zdrojem extramedulární hematopoezy.
Léčba transplantací kostní dřeně nebo krvetvornými buňkami získanými z krve [34, 35] se opírá jak o vnitřní potenciál těchto buněk, tak i o schopnost stromatu krvetvorné tkáně příjemců transplantátu tento potenciál aktivovat a využít pro obnovu krvetvorné tkáně. Naše studie ukazuje, že poškozená krvetvorná tkáň aktivuje regenerační potenciál ve vývojově pozdních myeloidních progenitorových buňkách. Jedním z mechanismů, které se na této změně podílejí, může být zvýšená tvorba cytokinu SCF. Schematicky je normální a intenzivně regenerující krvetvorná tkáň, ve které se přechodně zvýší počet progenitorových buněk s erytroidním a granulocytovým/makrofágovým vývojovým potenciálem, porovnána na obrázku 9.
Image 9. Grafické znázornění krvetvorby v normální a intenzivně regenerující kostní dřeni. V normální dospělé krvetvorbě jsou zdrojem krevních buněk multipotentní progenitory a eventuálně buňky kmenové (HSC). V intenzivně regenerující krvetvorbě se stávají zdrojem krevních buněk pozměněné myeloidní granulocytové/makrofágové (GMP) a megakaryocytové/erytroidní (MEP) progenitory. Znázorněná představa předpokládá, že stroma krvetvorné tkáně (na obrázku schematicky znázorněné vlnitou čarou se sklonem) se aktivně účastní regenerace vlivem na sebeobnovná dělení buněk a jejich diferenciaci. LK-R buňky jsou výsledkem těchto regulací, které jim umožní na přechodnou dobu plnit funkci méně zralých multipotentních progenitorů a kmenových buněk, jejichž populace se po poškození doplňují mnohem pomaleji. 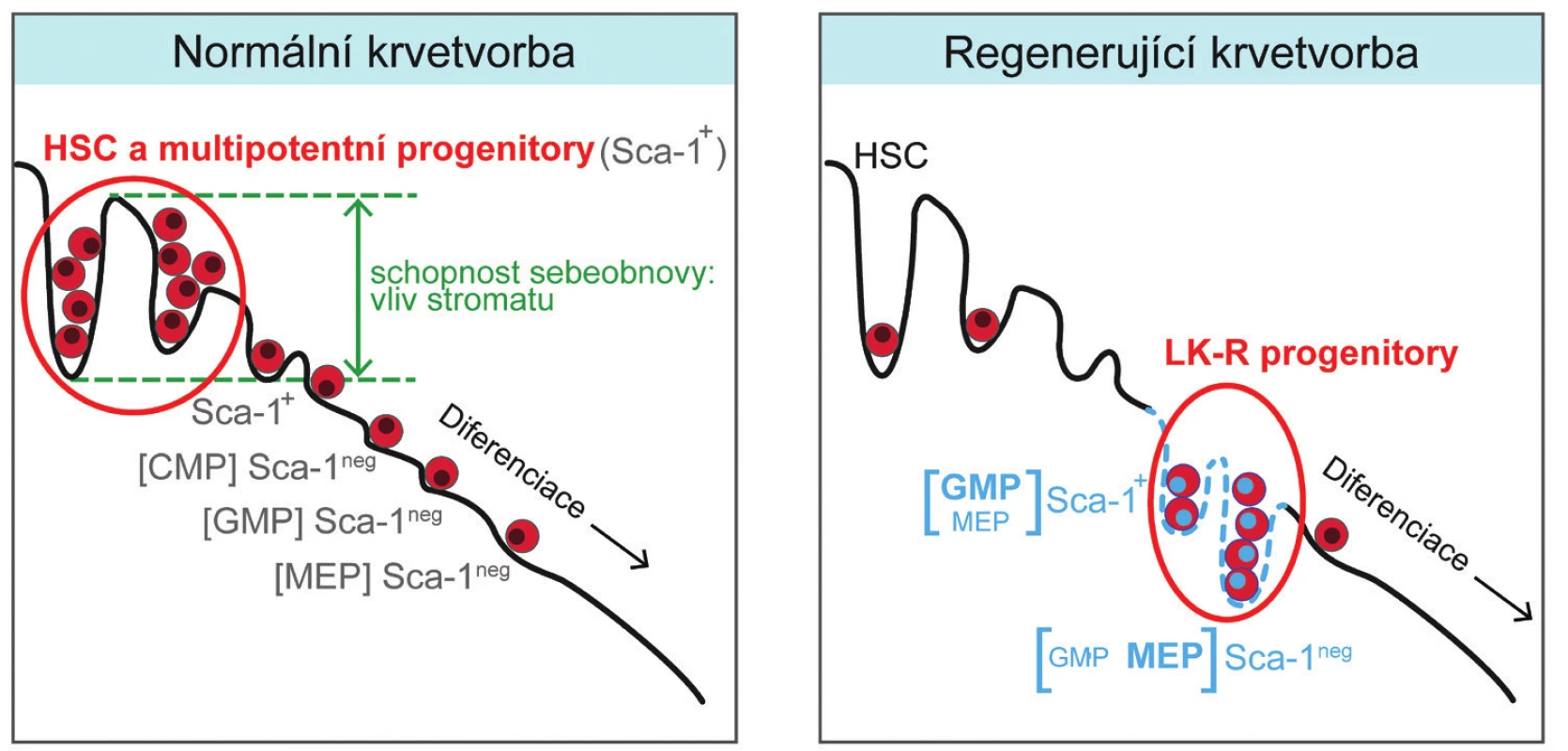
Existuje tak podobnost mezi intenzivně regenerující krvetvorbou a druhou přechodnou fázi embryonální krvetvorby, ve které je produkce erytrocytů, granulocytů, makrofágů a krevních destiček odvozena od buněk progenitorových s velmi malým transplantačním potenciálem a uskutečňuje se v nepřítomnosti buněk kmenových [16, 17]. Zajímavé je i to, že regenerující krvetvorba se významně liší od poslední třetí fáze embryonální a fetální krvetvorby, která je již závislá na buňkách kmenových a na kterou navazuje normální celoživotní tvorba krevních buněk [29].
ZKRATKY
BFU-E – erytroidní progenitor (burst forming unit)
CLP – společný (common) lymfoidní progenitor
CMP – společný (common) myeloidní progenitor
E – embryonální vývojový den
GMP – granulocytový/makrofágový progenitor
HSC – krvetvorná kmenová buňka
LK – buňky bez liniových diferenciačních znaků exprimující receptor c-Kit
LSK – LK buňka exprimující Sca-1 antigen
LS – K – LK buňka bez Sca-1 antigenu
LK-R – LK buňky v regenerující kostní dřeni
MEP – megakaryocytový/ erytroidní progenitor
MPP – multipotetní progenitor
SCF – stem cell factor
Podíl autorů na přípravě rukopisu
EN – koncept a příprava rukopisu, konečné schválení
KF – příprava rukopisu, konečné schválení
Poděkování
Tato práce byla podpořena Grantovou agenturou České republiky (17-01897S), Grantovou agenturou Univerzity Karlovy (1782218), Univerzitou Karlovou (Progres Q26 a SVV 260 519) a Ministerstvem školství, mládeže a tělovýchovy České republiky (LQ1604).
Čestné prohlášení
Autoři prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmu a vznik a publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 18. 2. 2020.
Přijato po recenzi dne 20. 4. 2020.
prof. MUDr. Emanuel Nečas, DrSc.
Ústav patologické fyziologie 1. lékařské fakulty UK
U Nemocnice 5
128 53 Praha 2
e-mail: necas@cesnet.cz; emanuel.necas@lf1.cuni.cz
Sources
1. Dykstra B, Kent D, Bowie M, et al. Long-term propagation of distinct hematopoietic differentiation programs in vivo. Cell Stem Cell. 2007;1 : 218–229.
2. Six E, Guilloux A, Denis A, et al. Clonal tracking in gene therapy patients reveals a diversity of human hematopoietic differentiation programs. Blood. 2020;135 : 1219–1231.
3. Carrelha J, Meng Y, Kettyle LM, et al. Hierarchically related lineage - -restricted fates of multipotent haematopoietic stem cells. Nature. 2018;554 : 106–111.
4. Morita Y, Ema H, Nakauchi H. Heterogeneity and hierarchy within the most primitive hematopoietic stem cell compartment. J. Exp. Med. 2010;207 : 1173–1182.
5. Rodriguez-Fraticelli AE, Wolock SL, Weinreb CS, et al. Clonal analysis of lineage fate in native haematopoiesis. Nature. 2018;553 : 212 – 216.
6. Clevers H, Watt FM. Defining adult stem cells by function, not by phenotype. Ann Rev Biochem. 2018;87 : 1015–1027.
7. Takano H, Ema H, Sudo K, Nakauchi H. Asymmetric division and lineage commitment at the level of hematopoietic stem cells: inference from differentiation in daughter cell and granddaughter cell pairs. J Exp Med. 2004;199 : 295–302.
8. Páral P, Faltusová K, Molík M, et al. Cell cycle and differentiation of Sca-1+ and Sca-1 − hematopoietic stem and progenitor cells. Cell Cycle. 2018;17 : 1979–1991.
9. Brecher G, Bookstein N, Redfearn W, et al. Self-renewal of the long-term repopulating stem cell. Proc Natl Acad Sci U S A. 1993;90 : 6028–6031.
10. Santoro A, Vlachou T, Carminati M, et al. Molecular mechanisms of asymmetric divisions in mammary stem cells. EMBO Rep. 2016;17 : 1700–1720.
11. Sun J, Ramos A, Chapman B, et al. Clonal dynamics of native haematopoiesis. Nature. 2014;514 : 322–327.
12. Sawai CM, Babovic S, Upadhaya S, et al. Hematopoietic stem cells are the major source of multilineage hematopoiesis in adult animals. Immunity 2016;45 : 597–609.
13. McRae HM, Voss AK, Thomas T. Are transplantable stem cells required for adult hematopoiesis? Exp Hematol. 2019;75 : 1–10.
14. Ema H, Morita Y, Suda T. Heterogeneity and hierarchy of hematopoietic stem cells. Exp Hematol. 2014;42 : 74–82.e2.
15. Pelichovská T, Chang KT, Šefc L, et al. The late-stage foetal liver microenvironment is essential for later sensitivity of B-lymphopoiesis to suppression by oestrogens. Folia Biol (Praha). 2008;54 : 125–129.
16. Hlobeňová T, Šefc L, Chang K-T, et al. B-lymphopoiesis gains sensitivity to subsequent inhibition by estrogens during final phase of fetal development. Dev Comp Immunol. 2012;36 : 385–389.
17. McGrath KE, Frame JM, Fromm GJ, et al. A transient definitive erythroid lineage with unique regulation of the -globin locus in the mammalian embryo. Blood. 2011;117 : 4600–4608.
18. Palis J. Hematopoietic stem cell-independent hematopoiesis: emergence of erythroid, megakaryocyte, and myeloid potential in the mammalian embryo. FEBS Lett. 2016;590 : 3965–3974.
19. Dzierzak E, Bigas A. Blood development: hematopoietic stem cell dependence and independence. Cell Stem Cell. 2018;22 : 639–651.
20. McGrath KE, Frame JM, Fegan KH, et al. Distinct sources of hematopoietic progenitors emerge before HSCs and provide functional blood cells in the mammalian embryo. Cell Rep. 2015;11 : 1892–1904.
21. Gritz E, Hirschi KK. Specification and function of hemogenic endothelium during embryogenesis. Cell Mol Life Sci. 2016;73 : 1547–1567.
22. Rybtsov S, Ivanovs A, Zhao S, Medvinsky A. Concealed expansion of immature precursors underpins acute burst of adult HSC activity in foetal liver. Development. 2016;143 : 1284–1289.
23. Chang K-T, Sefc L, Psenák O, et al. Early fetal liver readily repopulates B lymphopoiesis in adult bone marrow. Stem Cells. 2005;23 : 230–239.
24. Copley MR, Babovic S, Benz C, et al. The Lin28b–let-7–Hmga2 axis determines the higher self-renewal potential of fetal haematopoietic stem cells. Nat Cell Biol. 2013;15 : 916–925.
25. Bowie MB, Kent DG, Copley MR, Eaves CJ. Steel factor responsiveness regulates the high self-renewal phenotype of fetal hematopoietic stem cells. Blood. 2007;109 : 5043–5048.
26. Medina KL, Kincade PW. Pregnancy-related steroids are potential negative regulators of B lymphopoiesis. Proc Natl Acad Sci U S A. 1994;91 : 5382–5386.
27. Forgacova K, Savvulidi F, Sefc L, et al. All hematopoietic stem cells engraft in submyeloablatively irradiated mice. Biol Blood Marrow Transplant. 2013;19 : 713–719.
28. McCarthy KF. Population size and radiosensitivity of murine hematopoietic endogenous long-term repopulating cells. Blood. 1997;89 : 834–841.
29. Faltusová K, Chen C-L, Heizer T, et al. Altered erythro-myeloid progenitor cells are highly expanded in intensively regenerating hematopoiesis. Front Cell Dev Biol. 2020;8 : 98.
30. Ogawa M, Matsuzaki Y, Nishikawa S, et al. Expression and function of c-kit in hemopoietic progenitor cells. J Exp Med. 1991;174 : 63–71.
31. Morrison SJ, Scadden DT. The bone marrow niche for haematopoietic stem cells. Nature. 2014;505 : 327–334.
32. Simonnet AJ, Nehmé J, Vaigot P, et al. Phenotypic and functional changes induced in hematopoietic stem/progenitor cells after gamma-ray radiation exposure. Stem Cells. 2009;27 : 1400–1409.
33. Peslak S a, Wenger J, Bemis JC, et al. EPO-mediated expansion of late-stage erythroid progenitors in the bone marrow initiates recovery from sublethal radiation stress. Blood. 2012;120 : 2501–2511.
34. Cetkovský P, Mayer J, Starý J, et al.Transplantace kostní dřeně a periferních hematopoetických buněk. Praha: Galén, 2016.
35. Lysák D, Budina M, Holubová M JP. Externí hodnocení kvality stanovení CD34+ buněk v České a Slovenské republice – dlouhodobé zkušenosti z osmiletého období. Transfuze Hematol Dnes. 2019;25 : 258–263.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2020 Issue 3-
All articles in this issue
- COVID-19 a transfuzní služba v ČR
- Regenerující krvetvorba se podobá embryonální krvetvorbě nezávislé na kmenových buňkách
- Příznaky a projevy Erdheimovy-Chesterovy choroby
- Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
- Léčba multicentrické a unicentrické formy Castlemanovy nemoci
- Tematizace problémů komplexní péče z perspektivy osob s hemofilií
- Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
- Vzácné kožní změny asociované s monoklonální gamapatií: skleredém, skleromyxedém a IgA pemfigus – popis pěti případů a přehled léčebných možností
- Doporučený postup pro použití rekonvalescentní plazmy v léčbě dospělých pacientů s COVID-19
- Doporučený postup při řešení a vyšetřování potransfuzních reakcí
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií, vydání 2., rok 2020
- Hodnocení znalosti transfuzního lékařství u lékařů po promoci v Turecku
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Příznaky a projevy Erdheimovy-Chesterovy choroby
- Doporučený postup při řešení a vyšetřování potransfuzních reakcí
- Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
- Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

