-
Medical journals
- Career
Kryokonzervované trombocyty v klinické praxi: srovnávací studie s nativními trombocyty
Authors: M. Bohoněk 1; D. Kutáč 1; L. Landová 1; M. Kořánová 1; E. Sládková 1; E. Stašková 1; M. Voldřich 2; T. Tyll 2
Authors‘ workplace: Oddělení hematologie a krevní transfuze, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 1; Klinika anestesiologie, resuscitace a intenzivní medicíny 1. LF UK a ÚVN, Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha 2
Published in: Transfuze Hematol. dnes,22, 2016, No. 4, p. 268-278.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Běžné trombocytové přípravky skladované při teplotě 20–24 °C jsou zatíženy nevýhodou krátké doby použitelnosti, která vylučuje tvorbu větších zásob a ztěžuje logistiku spojenou s jejich přípravou, distribucí a použitím. Dostupnost trombocytů k včasné aplikaci moderního masivního transfuzního protokolu během první „zlaté hodiny“ po vzniku krvácení je často problematická a většina nemocnic si je nemůže dovolit mít kvůli krátké exspiraci a vysoké ceně trvale na skladě. Vhodnou alternativou jsou kryokonzervované trombocyty, které se s úspěchem používají ve vojenském zdravotnictví a v Ústřední vojenské nemocnici – Vojenské fakultní nemocnici Praha, byly do běžné klinické praxe zavedeny v září 2014. V období září 2014 až září 2016 bylo v ÚVN podáno celkem 265 terapeutických dávek (T.D.) trombocytů 90 pacientům se závažným krvácením, z toho 160 T.D. trombocytů z aferézy deleukotizovaných kryokonzervovaných (TADK) 57 pacientům. Byla provedena srovnávací studie s čerstvými nativními trombocyty z aferézy deleukotizovanými (TAD), do které bylo zařazeno 25 pacientů, transfundovaných TADK (celkem 81 T.D.), kontrolní skupinu pak tvořilo 19 pacientů transfundovaných TAD (61 T.D.). Jako čerstvé i pro zmražení byly použity trombocyty z aferézy, deleukotizované, o obsahu trombocytů > 280 x 109/T.D. Mražení trombocytů se provádí při -80 °C v 6% koncentraci dimethylsulfoxidu (DMSO) a po odstranění supernatantu, doba použitelnosti při stejné teplotě skladování je 2 roky. Před použitím se rozmražené trombocyty skupiny 0 rekonstituují v rozmražené plazmě skupiny AB. Pro účely studie jsme u transfundovaných pacientů hodnotili tato kritéria: 1. laboratorní hodnoty (před transfuzí a po ní) – krevní obraz, aktivovaný parciální tromboplastinový čas, protrombinový čas a hladinu fibrinogenu; 2. vitální funkce (před transfuzí a po ní) – tělesná teplota, tepová frekvence a střední arteriální tlak; 3. množství podaných trombocytů, erytrocytů, plazmy, fibrinogenu a tranexamové kyseliny (TXA); 4. klinická data – průměrná procentuální šance přežití pacienta po podání trombocytů a výskyt nežádoucích účinků. U podávaných trombocytových přípravků byla hodnocena jejich koagulační aktivita měřená trombelastograficky. TADK jsou ve srovnání s nativními trombocyty částečně aktivované, s patrnou vyšší prokoagulační aktivitou při redukované maximální pevnosti koagula. Laboratorní data obou skupin pacientů nevykazují signifikantní rozdíly, vyjma počtu trombocytů, které jsou vyšší po transfuzi čerstvých trombocytů. Srovnatelné jsou i výsledky klinických pozorování a spotřeba transfuzních přípravků, fibrinogenu a TXA. Kryokonzervované trombocyty jsou vhodným přípravkem nikoli pouze pro vojenské, ale též pro civilní použití, zejména pro řešení akutních stavů spojených s masivním krvácením. Rozmražení a rekonstituce je jednoduchý proces, který trvá maximálně 30 minut. Kryokonzervace trombocytů může nalézt uplatnění i u dalších aplikací (příprava autologních trombocytů pro transfuzní i netransfuzní použití, příprava vzácných či HLA kompatibilních trombocytů apod.).
Klíčová slova:
kryokonzervované trombocyty – kryokonzervace trombocytů – masivní krvácení – rekonstituceÚVOD
Běžné trombocytové přípravky skladované při teplotě 20–24 °C jsou zatíženy nevýhodou krátké doby použitelnosti, která vylučuje tvorbu větších zásob a ztěžuje logistiku spojenou s jejich přípravou, distribucí a použitím. Jedním z míst, kde je toto omezení zvláště limitující, jsou traumacentra, urgentní příjmy a oddělení intenzivní péče, která řeší problematiku masivního krvácení. Nezvladatelné krvácení je druhou nejčastější příčinou úmrtí pacientů s traumatem. Včasná masivní a komplexní transfuzní léčba, kromě substituce erytrocytů, se významně podílí na korekci koagulopatie a zmírnění krvácení. Má se za prokázané, že urychlené podání transfuzních přípravků v celém spektru má značný pozitivní vliv na přežití pacienta. Většina stávajících masivních transfuzních protokolů je proto založena na současném podání erytrocytů a plazmy, doplněných transfuzí trombocytů [1, 2, 3, 4].
Dostupnost trombocytů pro včasnou aplikaci moderního masivního transfuzního protokolu během první „zlaté hodiny“ po vzniku krvácení je často problematická. Navíc většina nemocnic si nemůže dovolit mít trvale na skladě nativní trombocyty, kvůli jejich krátké exspiraci a vysoké ceně. V případě urgentní potřeby většího množství trombocytových přípravků mají problémy s jejich dostupností i pracoviště fakultního typu. Ještě problematičtější je pak zajištění trombocytů pro polní vojenská zdravotnická zařízení, jmenovitě v současných zahraničních misích [4, 5].
Vhodnou alternativou jsou kryokonzervované trombocyty, které s úspěchem používá zejména nizozemská vojenská zdravotnická služba, ale i jiné země. Snadná dostupnost, kompatibilita, bezpečnost a účinnost kryokonzervovaných přípravků signifikantně zlepšila přežití pacientů s válečnými poraněními ošetřenými v průběhu zahraničních misí polních nemocnic nizozemské armády v letech 2001–2012 [7, 8, 9, 10, 11].
Kryokonzervace a skladování mražených krevních buněk může významně až neomezeně prodloužit dobu jejich použití, a ve zmraženém stavu tak zajistit jejich dlouhodobou dostupnost i v situacích, kdy čerstvé a nativní přípravky nejsou k dispozici a není možnost je získat. Další z výhod je možnost uskladnění HLA/HPA specifických a vzácných trombocytů, případně autologních trombocytů [12, 13]. Výroba kryokonzervovaných trombocytů není technologicky příliš náročný proces, velmi jednoduché je pak jejich rozmrazení a rekonstituce [14, 15, 16].
Nezbytností je zajištění zvláštních podmínek během procesu mrazení tak, aby se zabránilo poškození buněk, které se dociluje přidáním kryoprotektivních látek [17]. Trombocyty mohou být zmrazeny za přidání různých typů kryoprotektivních látek, jak intracelulárních (DMSO, glycerol), tak extracelulárních (HES, dextran). Pro kryokonzervaci trombocytů je nejvhodnější použití DMSO [18]. Doba přežití kryokonzervovaných trombocytů v DMSO po rekonstituci v cirkulaci člověka in vitro je srovnatelná s přežitím čerstvých trombocytů [19, 20]. Metodu kryokonzervace trombocytů v DMSO vyvinul v 70. letech Robert Valeri s podporou výzkumného programu amerického námořnictva jako možnou náhradu za nativní trombocyty pro transfuzní léčbu v místě válečného nasazení [21]. Při původní metodě bylo nutné DMSO a supernatant po rozmrazení vymývat, proto uplatnění v polních nemocnicích bylo svízelné. Postupem času byl upraven postup s odstraněním přebytku DMSO a supernatantu před zmrazením [22]. Metoda je velmi jednoduchá, nenákladná a nevyžaduje žádné zvláštní přístrojové vybavení. K transportu na delší vzdálenosti se používají přepravní kontejnery naplněné suchým ledem. Vzhledem k teplotě skladování kryokonzervovaných trombocytů v DMSO, která je -80 °C až -65 °C není nutné používat tekutý dusík, respektive jeho páry, ale lze použít mechanické hlubokomrazicí boxy [23, 24, 25, 26].
V ÚVN Praha byly kryokonzervované trombocyty, s využitím zkušeností vojenské zdravotnické služby Nizozemí, uvedeny do běžné klinické praxe v září 2014. Zavedení předcházela in vitro validační studie. Indikací k podání kryokonzerovaných trombocytů jsou stavy se závažným krvácením. V období září 2014 až září 2016 bylo v ÚVN Praha podáno celkem 265 T.D. trombocytů 90 pacientům se závažným krvácením. Z toho byly 57 pacientům podány trombocyty z aferézy deleukotizované kryokonzervované (TADK), v celkovém počtu 160 T.D. V tomto období jsme provedli srovnávací studii u pacientů transfundovaných TADK s pacienty transfundovanými nativními trombocyty z aferézy deleukotizovanými (TAD).
MATERIÁL A METODIKA
Jedná se o randomizovanou prospektivní observační studii. Soubor tvoří pacienti s masivním, život ohrožujícím krvácením, zpravidla po úrazu, respektive polytraumatu, ale i pacienti s krvácením do trávicího traktu či do jiné lokality s indikovanou komplexní transfuzní terapií. Jednalo se o náhodný výběr, kdy jedním z kritérií byla i dostupnost všech předem stanovených klinických i laboratorních parametrů. Dalším kritériem byla absence klinicky významných komorbidit, ovlivňujících hemostázu. Rozmezí hodnoceného ISS u všech zařazených pacientů bylo 25–75. Základní indikací podání trombocytů byla léčba masivního krvácení, včetně léčby a prevence koagulopatie, případně léčba či prevence krvácení v oblasti hlavy a CNS. Do studie bylo zařazeno 25 pacientů transfundovaných TADK (celkem 81 T.D.), kontrolní skupinu tvořilo 19 pacientů transfundovaných TAD (61 T.D.). Věková skladba pacientů, kterým byly trombocyty podány, byla u skupiny pacientů transfundovaných TADK 20–75 let, s mediánem 51 let. U pacientů transfundovaných TAD 26–79 let, s mediánem 47 let. Nejčastější diagnózou k podání trombocytů bylo sdružené poranění tzv. polytrauma, a to s počtem 26 zraněných, dále 7 pacientů s hemoperitoneem, 5 pacientů s úrazovým izolovaným subdurálním krvácením a 6 pacientů s jinou příčinou krvácení. Seznam diagnóz podle MKN je uveden v tabulce 1.
Table 1. Seznam diagnóz podle MKN u transfundovaných pacientů 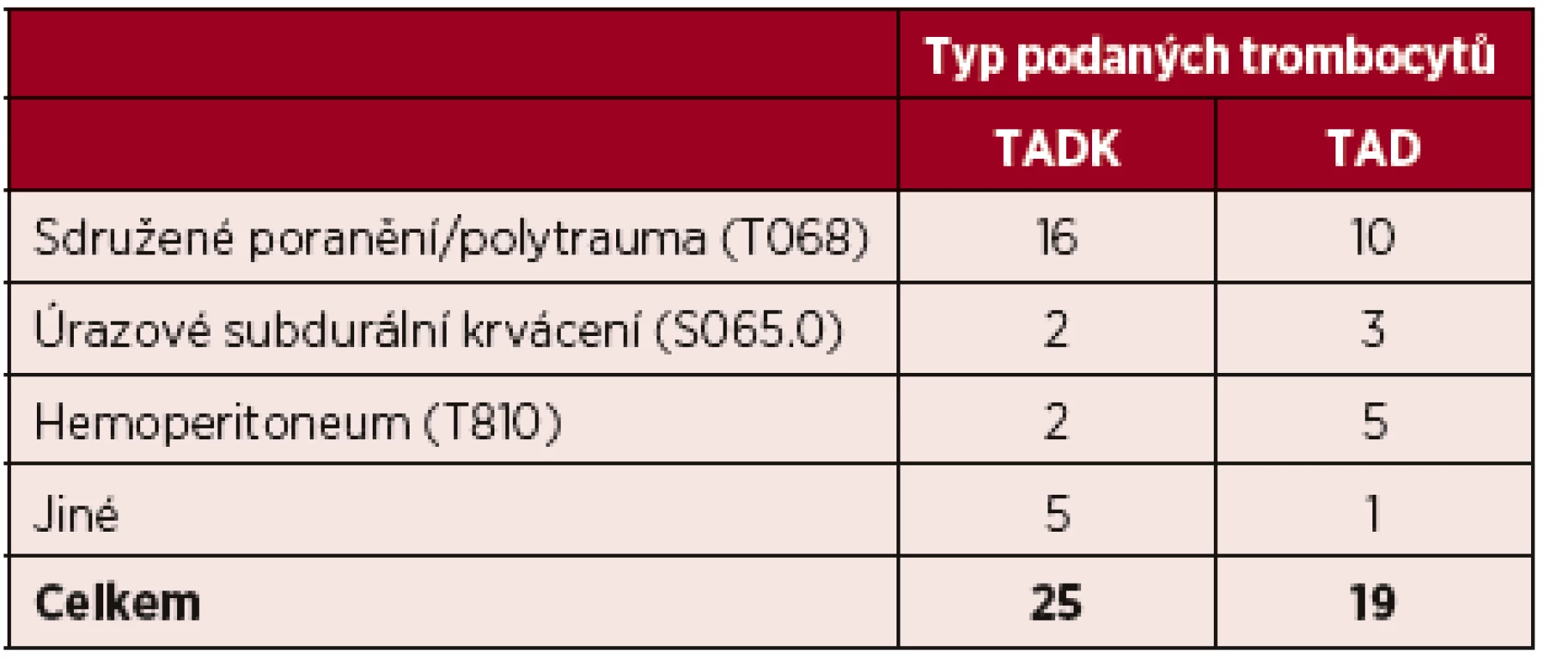
Trombocyty z aferézy deleukotizované (TAD)
Jedná se o transfuzní přípravek získaný trombocytaferézou od jednoho dárce za použití automatických přístrojů na separaci buněk. Trombocyty jsou resuspendovány v plazmě dárce, smísené s antikoagulačním roztokem ACD-A ve složení: citrát sodný 22 g, monohydrát glukózy 24,5 g, monohydrát kyseliny citronové 8 g, aqua pro inj. 1000 ml. 1 T.D. TAD obsahuje > 280 x 109 trombocytů. V přípravku je snížen obsah reziduálních leukocytů na hodnoty pod 1 x 106/TU.
Kryokonzervace trombocytů – výroba trombocytů kryokonzervovaných z aferézy deleukotizovaných zmrazených (TADKZ)
Pro zmražení byly použity trombocyty z aferézy deleukotizované, o obsahu trombocytů > 280 x 109/T.D., krevní skupiny 0. Do vaku s odebranými trombocyty se pomocí infuzní soupravy přidá 75 ml 27 % DMSO, tj. výsledná koncentrace je 5–6 % DMSO v přípravku, podle jeho aktuálního objemu. Následně je přípravek po napojení sterilní svářečkou CompoDock® (Fresenius Kabi Gmbh, Hamburg, SRN) převeden do speciálního kryokonzervačního vaku (Poche de transfrert, REF: R4R2074, Fenwal, Inc, Lahe Zurich, IL, USA) a společně s napojeným původním vakem zcentrifugován 12 min. při 1250 G ve velkoobjemové centrifuze Hereaus 6000i (Heraeus Instruments GmbH, Labortechnik, Hanau, SRN). S pomocí ručního lisu je do původního vaku odstraněn supernatant, kdy celkový konečný objem přípravku je 12–14 ml. Po označení a vložení do kartonového obalu je přípravek zmražen při -80 °C a méně (-80 až -85 °C) prostým založením do hlubokomrazicího boxu. Doba použitelnosti při skladování při -80 °C až -65 °C je 2 roky.
Romrazení a rekonstituce trombocytů – výroba trombocytů kryokonzervovaných z aferézy deleukotizovaných (TADK)
Před klinickým použitím se rozmrazené trombocyty skupiny 0 rekonstituují v rozmrazené plazmě skupiny AB. Kryokonzervované trombocyty i čerstvě zmrazené plazmy se nejprve rozmrazí na teplotu 30 °C v rozmrazovači plazmy Tool PR 50–300 (Tool s.r.o. Praha, ČR). Pomocí bezkontaktního teploměru je zkontrolována shodná teplota obou přípravků před jejich smísením. Vak s rozmrazenými trombocyty a vak s rozmrazenou plazmou se napojí pomocí sterilní svářečky CompoDock® (Fresenius Kabi Gmbh, Hamburg, SRN) a plazma se přepustí do vaku s trombocyty za pozvolného míchání. Opakovaným přepuštěním tam a zpět (3krát) do obou vaků se zajistí dokonalé promísení přípravku a vytvoření homogenní suspenze. Finální přípravek (v původním vaku s trombocyty) se po oddělení vaku od plazmy označí a vydá k transfuzi. Celková doba rozmražení a rekonstituce nepřesahuje 30 min, doba použitelnosti rekonstituovaných trombocytů je 6 hodin. Každý přípravek je podroben kontrole kvality, která musí odpovídat těmto kritériím: množství trombocytů 200–420 x 109/T.D., množství leukocytů < 1 x 106/T.D., množství erytrocytů < 6,8 x 109/T.D., pH > 6,4, bez přítomnosti agregátů, přípravek je sterilní.
Sledované parametry
Každý podaný trombocytový přípravek byl vyšetřen TEG na analyzátoru TEG® 5000 Thrombelastograph® Hemostasis Analyzer System (Haemonetics corp., Hemoscope Division, Niles, IL, USA). Kinetiku, pevnost a stabilitu vzniklého koagula jsme sledovali pomocí parametru MA – maximální amplitudy (v mm), tj. maximální pevnosti koagula jako výsledku dynamické interakce funkčních destiček a fibrinogenu. Dále jsme porovnávali R – čas (v min.) od spuštění analýzy k tvorbě prvního fibrinového vlákna vzorku. Vzorek čerstvě vyrobených trombocytů byl ředěn 1 : 5 AB plazmou, aby bylo dosaženo koncentrace trombocytů asi 200 x 109, a při měření na TEG následně aktivován kaolinem a chloridem vápenatým. Příprava vzorku rozmrazených TADK pro účely vyšetření TEG probíhala stejně jako u TAD, tj. vzorek byl ředěn AB plazmou v poměru 1 : 5. Dále byl vzorek TADK kaolinizován a aktivován chloridem vápenatým.
V obou skupinách byly u pacientů porovnány hodnoty krevního obrazu a základních hemokoagulačních vyšetření, vždy před transfuzí trombocytů a po ní. Jednorázově se jednalo o 1–2 T.D. trombocytů, podle závažnosti krvácení. Krevní obraz byl měřen na automatickém analyzátoru Sysmex XT 2000i (Sysmex corp., Kobe, Japonsko), z parametrů koagulace byl stanovován protrombinovaný čas (PT), aktivovaný částečný tromboplastinový čas (aPTT) a hladina fibrinogenu (Fbg) na automatickém analyzátoru ACL TOP 500 CT (Instrumentation laboratory, Bedford, MA USA). Odběry vzorků po transfuzi trombocytů se prováděly v intervalu 1–6 hodin.
V průběhu transfuzní léčby byly sledovány základní vitální funkce u pacientů, které byly zaznamenány vždy před transfuzí a po ní, tj. tělesná teplota (TT), puls (P) a střední arteriální tlak (MAP).
Porovnali jsme množství podaných trombocytů, erytrocytů, plazmy, fibrinogenu a tranexamové kyseliny u obou skupin pacientů.
Z klinických dat byla porovnávána průměrná procentuální šance přežití pacienta po podání trombocytů a vyhodnoceny nežádoucí účinky podání transfuze trombocytů.
Statistická analýza
Výpočty byly prováděny statistickým softwarem Statistica® společnosti StatSoft (verze 12) určeným k biostatistickým a lékařským výpočtům klinických studií.
VÝSLEDKY
Krykonzervované trombocyty jsou ve srovnání s nativními částečně aktivované, z měření TEG je patrná zkrácená doba iniciace koagulace (vyšší prokoagulační aktivita) při redukované, nicméně dostatečné maximální pevnosti koagula. Výsledky měření TEG jsou znázorněny na obrázcích 1 a 2.
Image 1. Srovnání parametrů TEG u kryokonzervovaných a čerstvých trombocytů 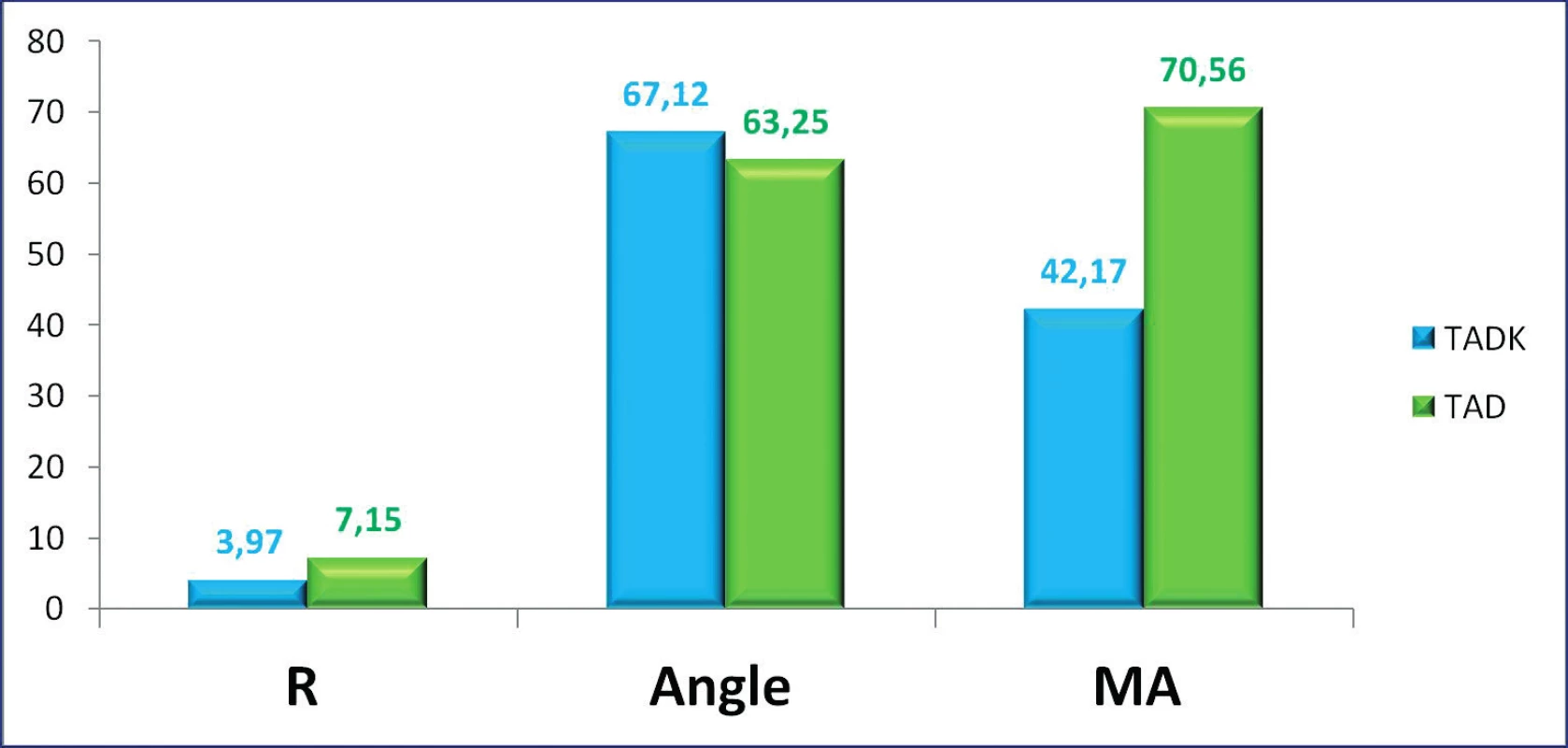
Legenda: R = čas iniciace koagula (min), Angle = úhel mohutnosti koagula (stupně), MA = pevnost koagula (mm) Image 2. Křivky TEG u čerstvých a kryokonzervovaných trombocytů 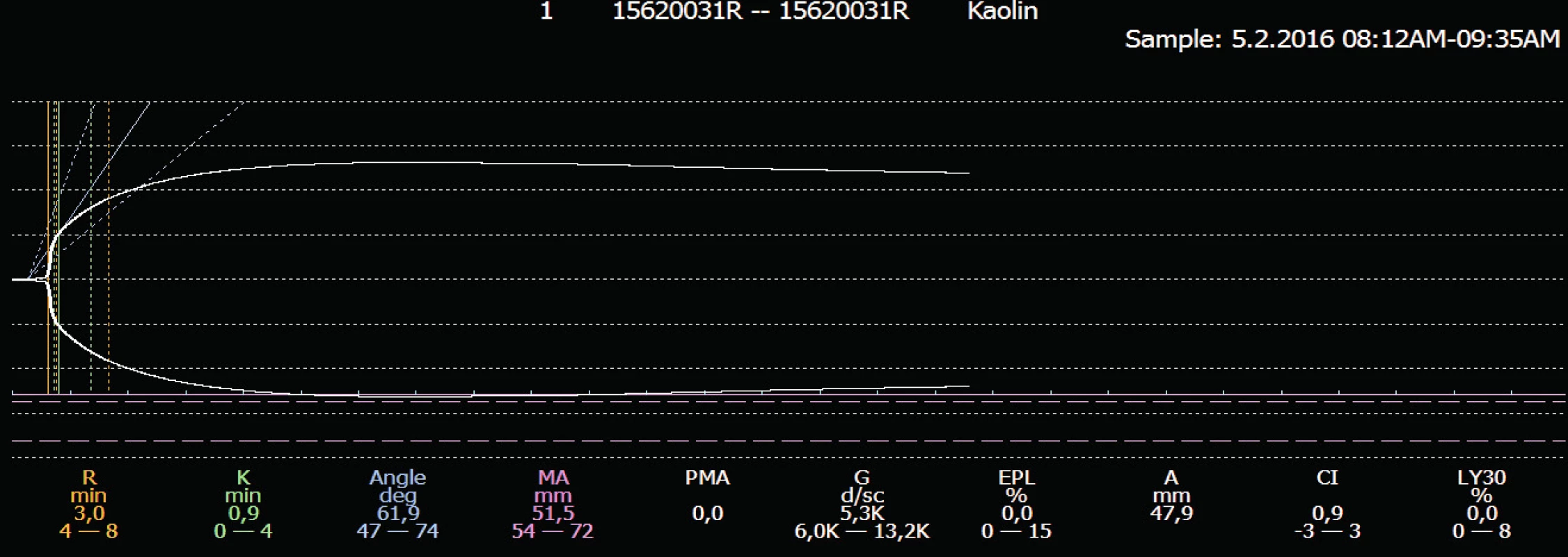
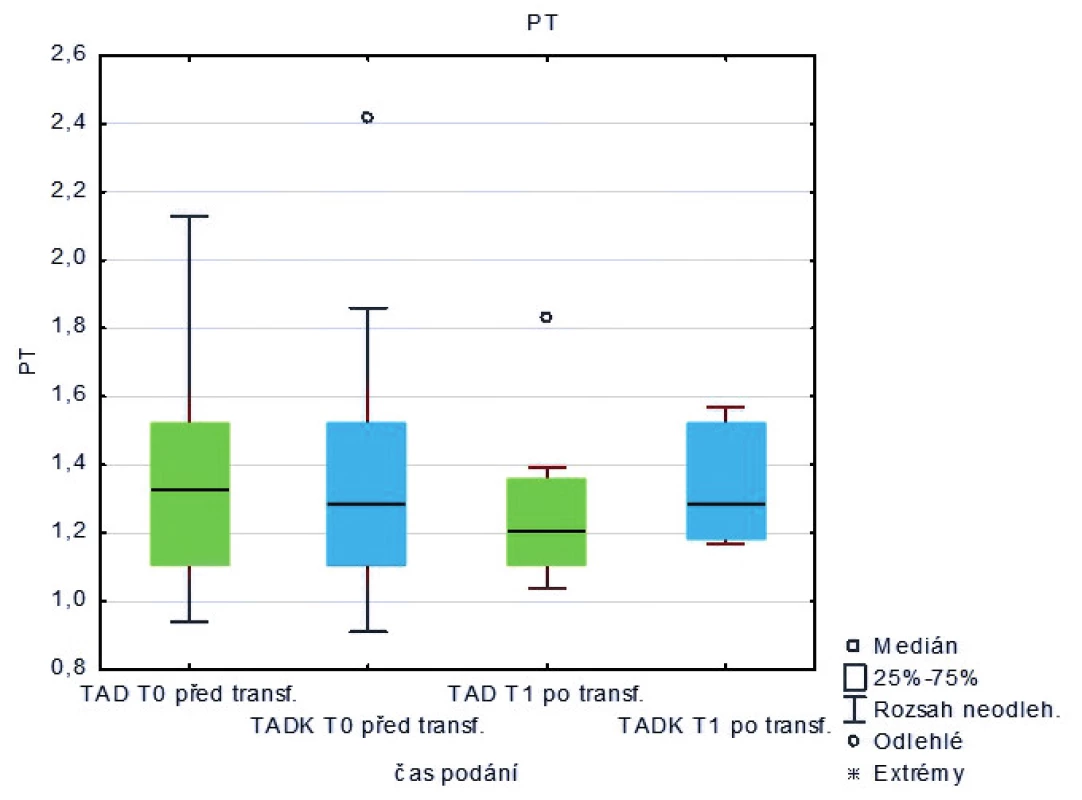
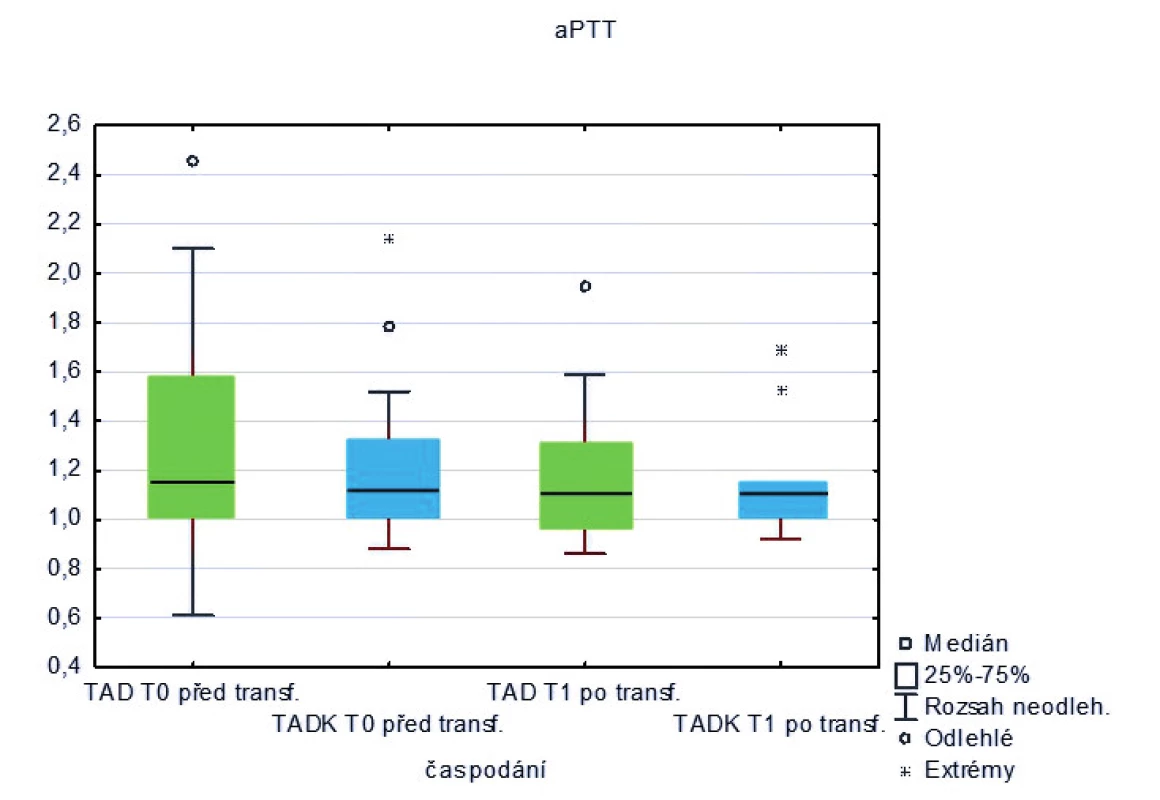
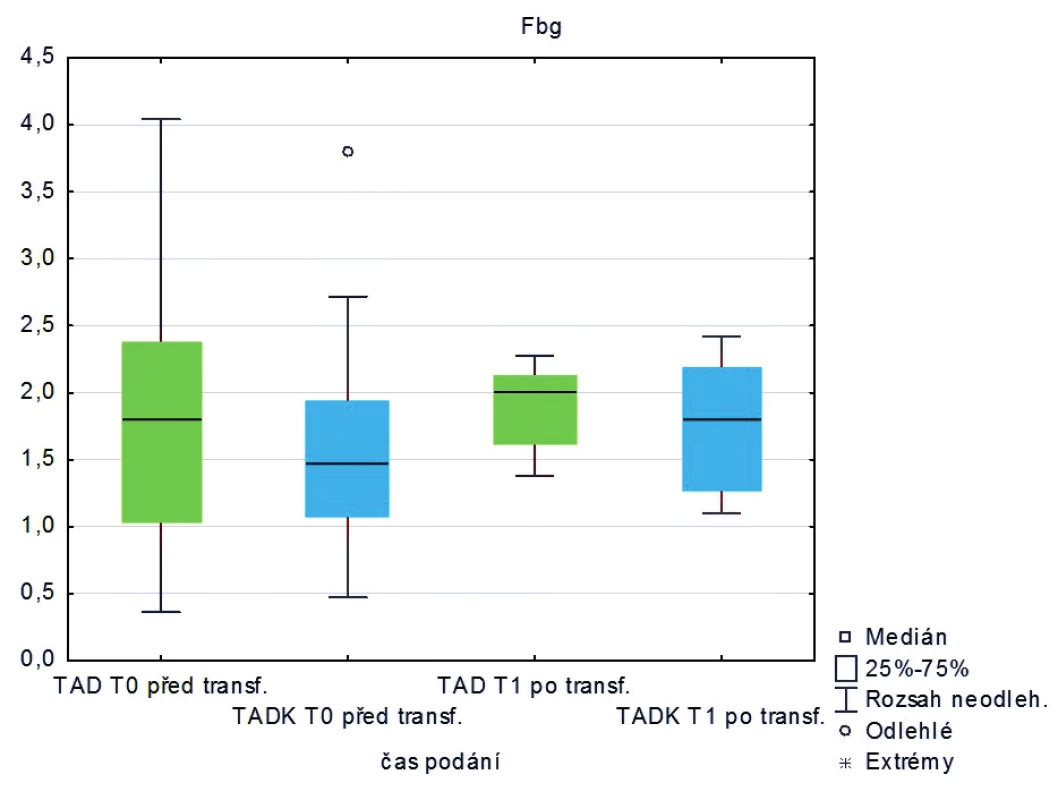
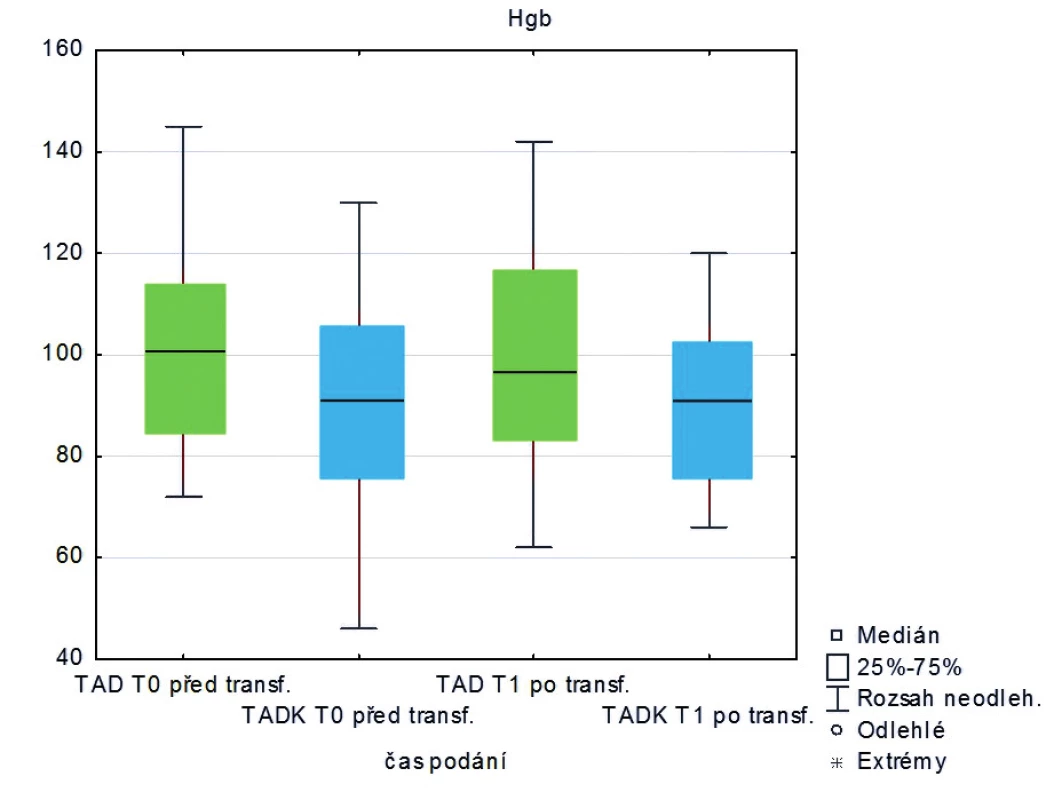
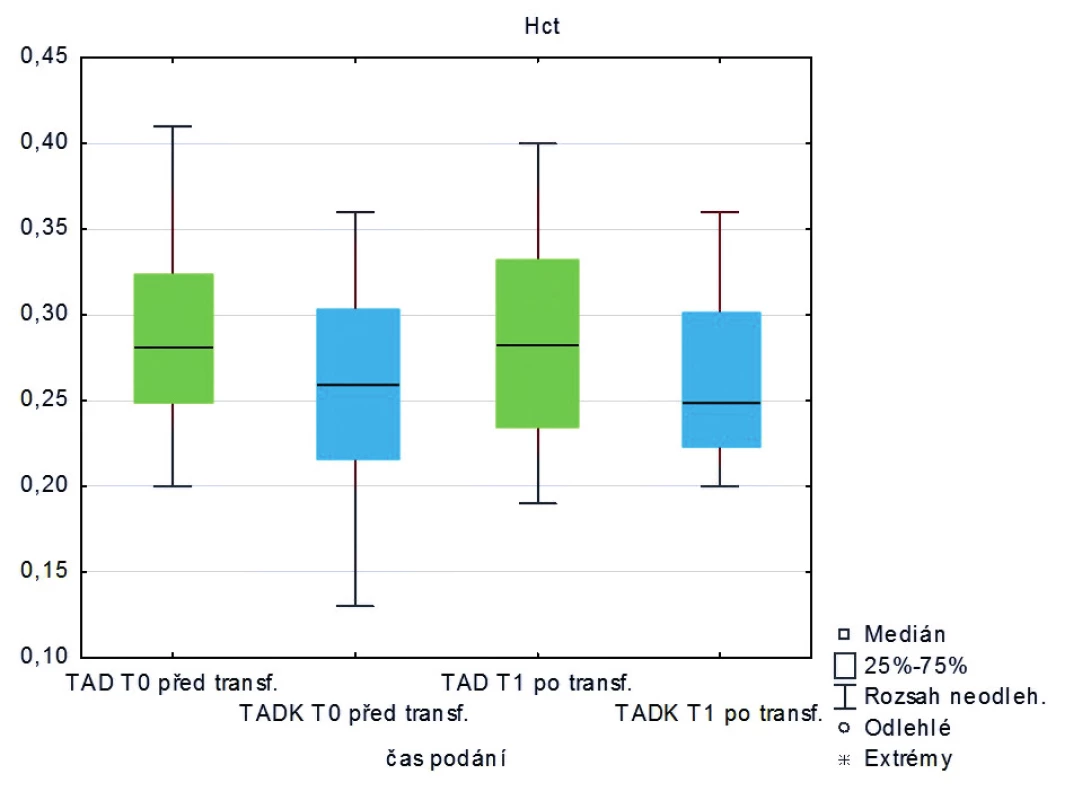
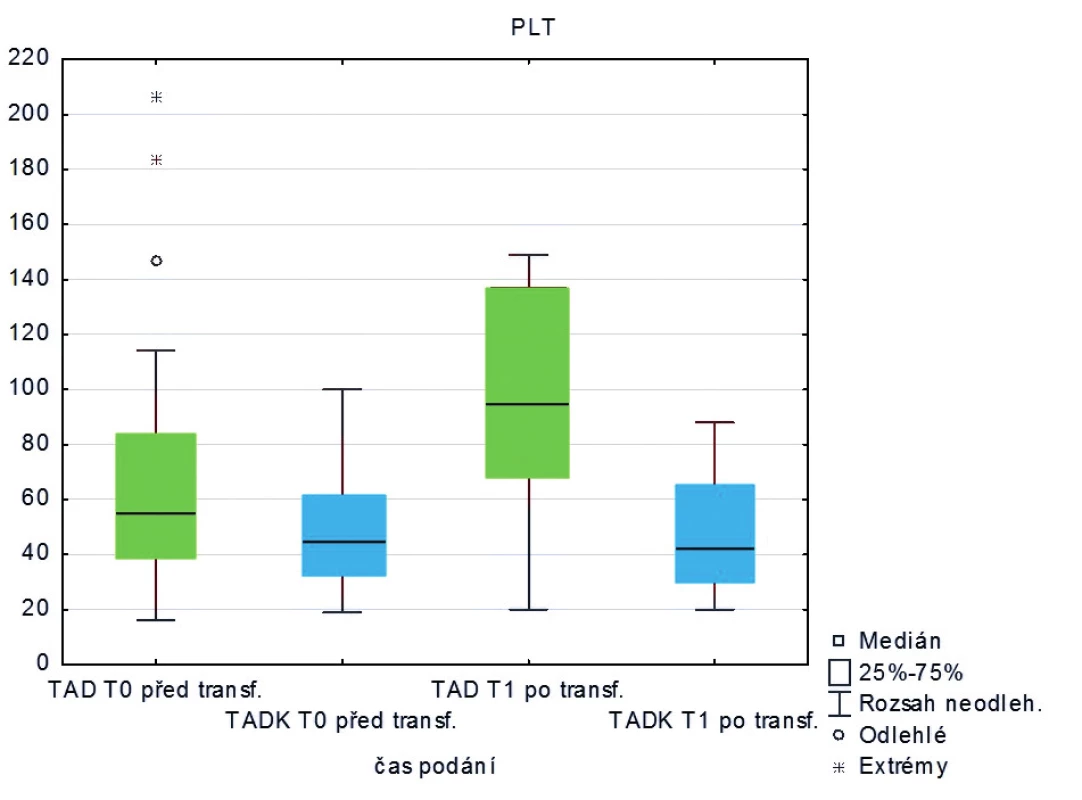
Měřená laboratorní data u skupiny pacientů transfundovaných kryokonzervovanými trom-bocyty při léčbě masivního krvácení ve srovnání se skupinou pacientů transfundovaných nativními trombocyty nevykazují signifikantní rozdíly s výjimkou počtu trombocytů, které jsou vyšší po transfuzi nativních trombocytů (p < 0,05) – tabulka 2 a obrázky 3–8.
Table 2. Hodnoty laboratorních vyšetření u pacientů před a po podání trombocytů (medián) 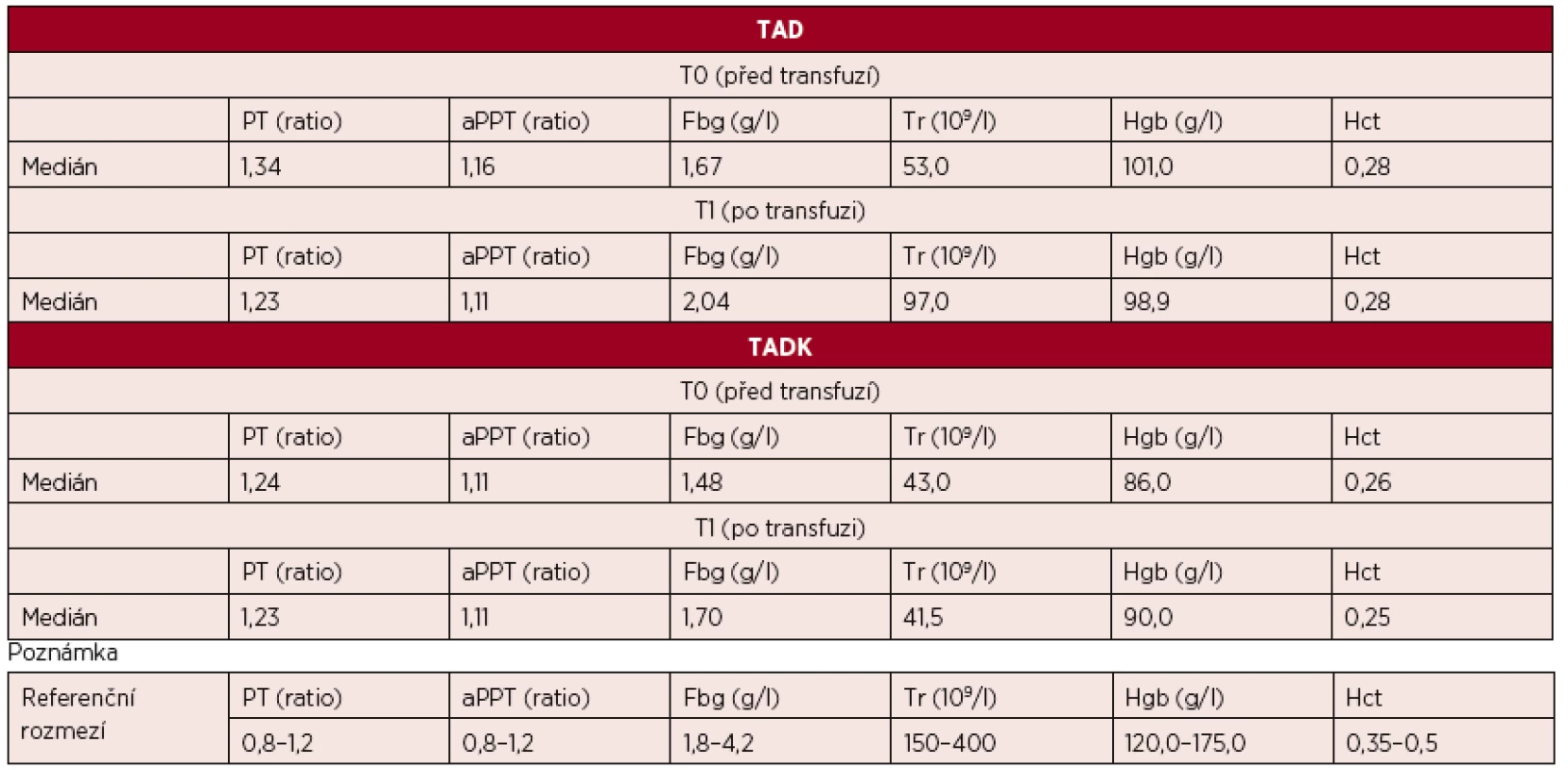
Legenda: PT – protrombinový čas, aPTT – aktivovaný částečný tromboplastinový čas, Fbg – fibrinogen, Tr – trombocyty, Hgb – hemoglobin, Hct – hematokrit Hodnoty základních vitálních funkcí u skupiny pacientů transfundovaných kryokonzervovanými trombocyty při léčbě masivního krvácení ve srovnání se skupinou pacientů transfundovaných nativními trombocyty jsou u obou skupin srovnatelné – tabulka 3.
Table 3. Hodnoty vitálních funkcí před podání trombocytů a po jejich podání (medián) 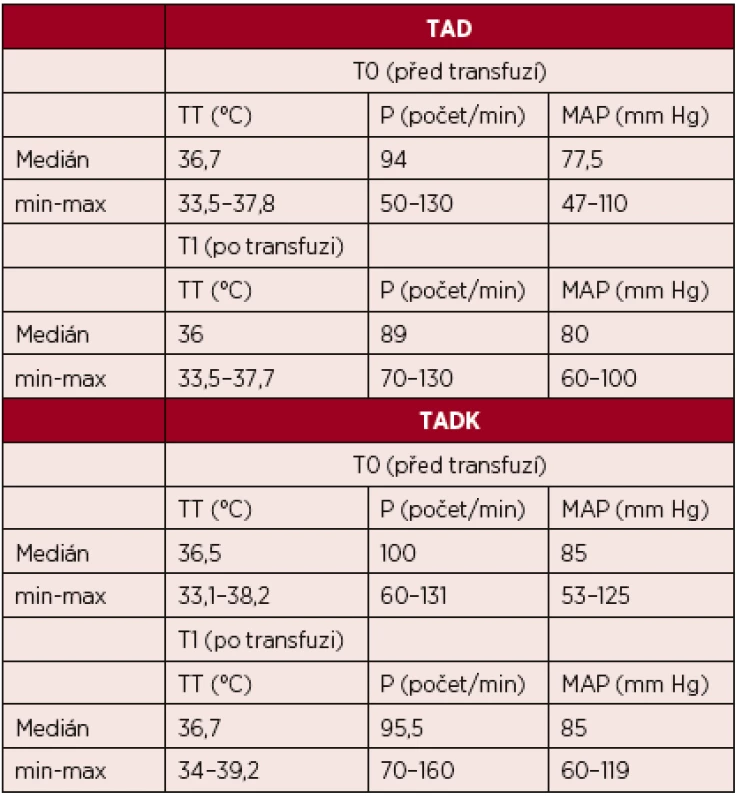
Legenda: TT – tělesná teplota, P – puls, MAP – střední arteriální tlak Spotřeba transfuzních přípravků, fibrinogenu a TXA, přežití a doba hospitalizace u skupiny pacientů transfundovaných kryokonzervovanými trombocyty při léčbě masivního krvácení je ve srovnání se skupinou pacientů transfundovaných nativními trombocyty srovnatelná (obr. 9).
Image 9. Množství podaných transfuzních přípravků, fibrinogenu a TXA (průměr na jednoho pacienta) 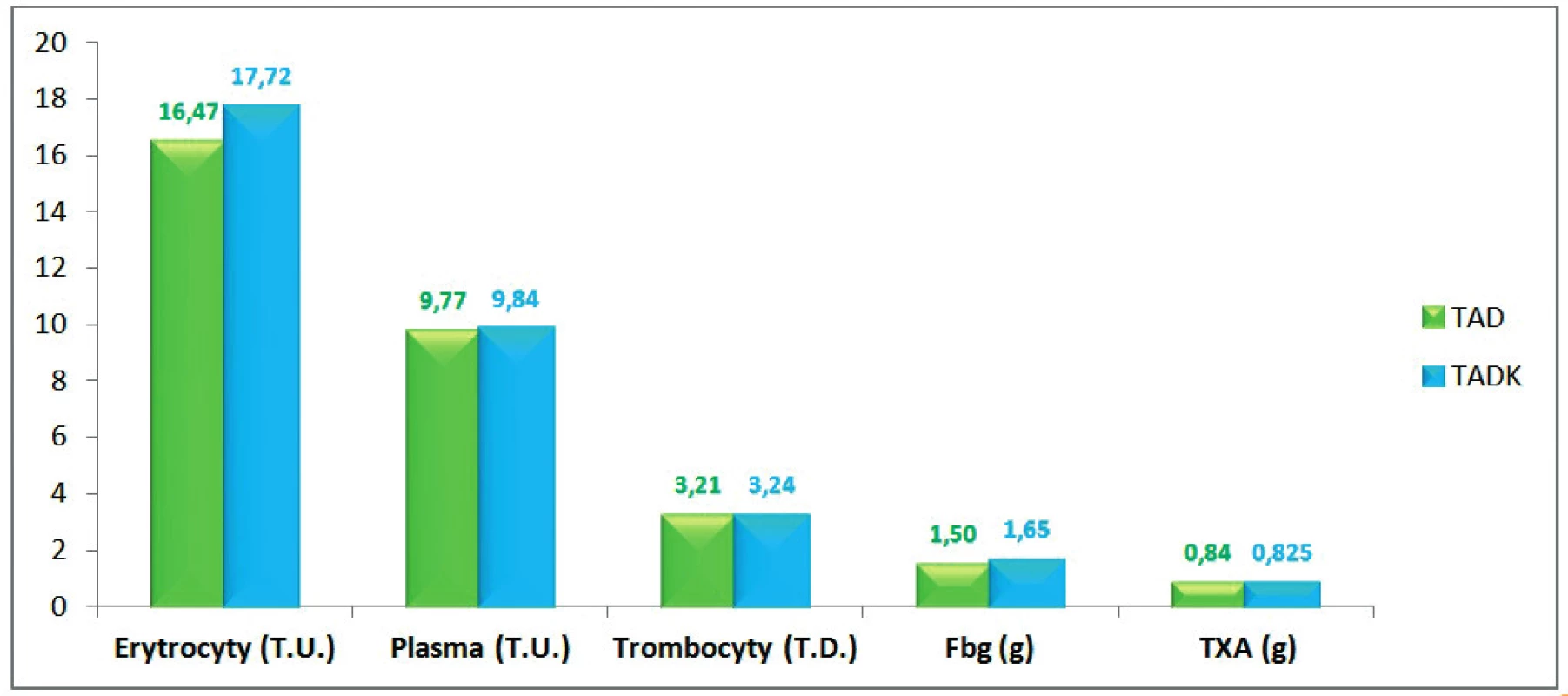
Průměrná procentuální šance přežití pacientů transfundovaných kryokonzervovanými trombocyty při léčbě masivního krvácení je v porovnání se skupinou pacientů transfundovaných nativními trombocyty srovnatelná, v žádném případě nebyly zaznamenány nežádoucí účinky po podání transfuze trombocytů (obr. 10).
Image 10. Průměrná procentuální šance přežití pacienta a výskyt nežádoucích účinků po transfuzi trombocytů 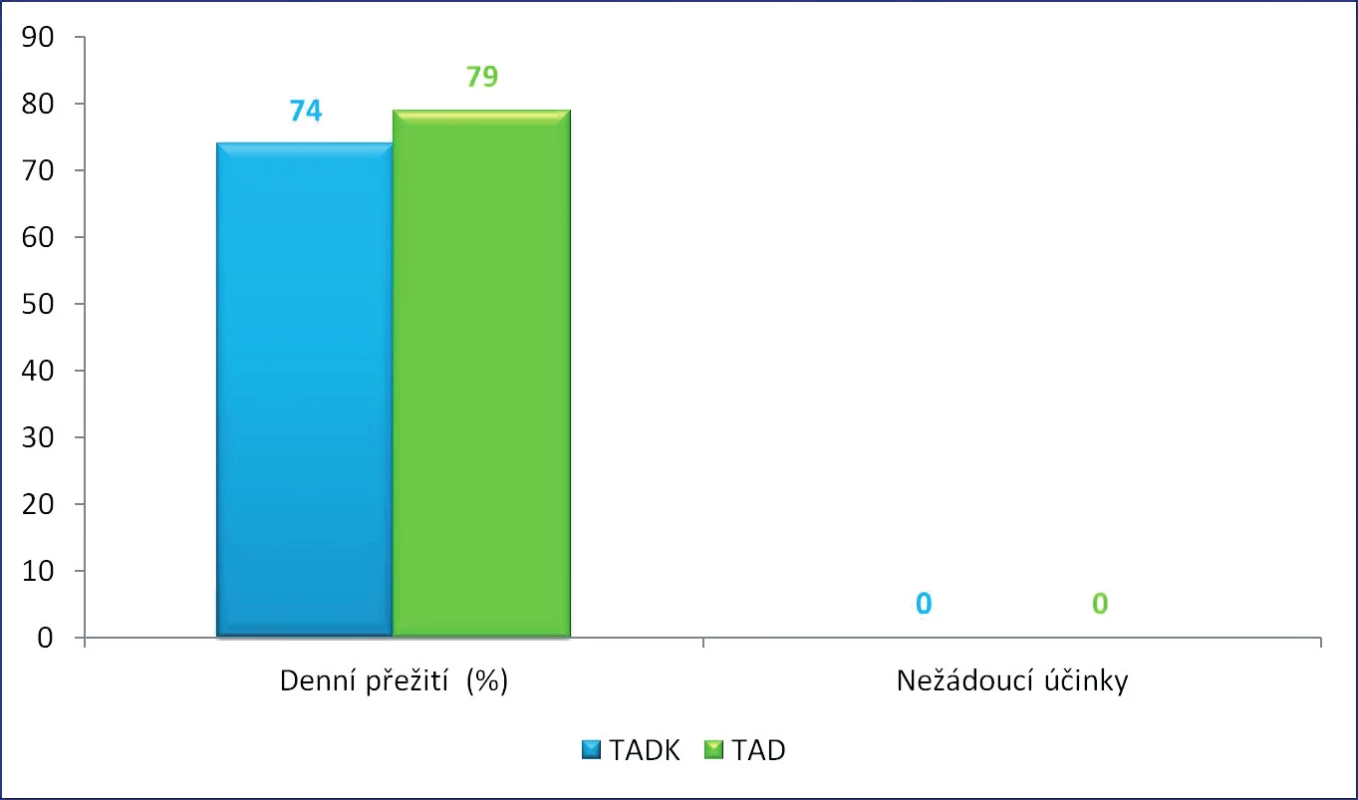
DISKUSE
Trombocyty skladované ve zmrazeném stavu jsou po rozmražení jednoznačně účinné v procesu primární hemostázy a efektivně přispívají k zástavě krvácení v rámci komplexní transfuzní léčby či postupech „damage control resuscitation“ u pacientů s polytraumatem a masivním krvácením. Nicméně proces zmrazení a rozmrazení není zcela intaktní vzhledem k morfologii a některým funkcím trombocytů a jsou popsány defekty jejich funkcí, které postupy kryokonzervace způsobují. Přibližně 15 % kryokonzervovaných trombocytů ztrácí na povrchu vázaný GPIb, na druhou stranu ztráta GPIIb/IIIa kryokonzervačním procesem zjištěna nebyla. Kryokonzervované trombocyty též vykazují signifikantní snížení agregace v ristocetinu, ale přitom neztrácejí schopnost odpovědi na silnější agonisty trombinového receptoru. Přestože tyto funkční defekty nejsou klinicky významné a kryokonzervované trombocyty jsou efektivní při léčbě krvácení, je vhodné mít tyto změny na paměti [7, 27, 28].
Kryokonzervace trombocytů je spojena s uvolněním destičkových membránových partikulí a také generací trombinu. Mikropartikule tvořené při kryokonzervaci nesou na svém povrchu fosfatidylserin a jsou fenotypově odlišné od těch, které nalézáme před zmrazením. To je pravděpodobně důvodem vyšší prokoagulační aktivity zmrazených trombocytů, ale zároveň i nižší stability vzniklého koagula. To potvrzují trombelastografická měření, kdy na křivkách TEG je jasně patrná zkrácená doba iniciace koagulace, tj. vyšší prokoagulační aktivita a rychlejší tvorba koagula (širší úhel α) a poněkud redukovaná maximální pevnost koagula (MA), která je ale pro iniciační koagulační proces dostatečná. Prokoagulační aktivitu ještě dále zvyšuje rekonstituce v rozmrazené plazmě, takto resuspendované trombocyty jsou prokoagulačně účinnější než např. trombocyty resupendované v aditivním roztoku [5, 9, 11, 20, 29, 30, 32].
Některá pozorování elektronovou mikroskopií ukazují na rozpad a vezikulaci plazmatické membrány až u 60 % rozmrazených trombocytů. Více než polovina kryokonzervovaných trombocytů vykazuje známky poškození membrány trombocytů se signifikantním zvýšením její fluidity vyvolané samotným 6% DMSO a také procesem mrazení a rozmrazení [31].
Po podání kryokonzervovaných trombocytů nedochází k vzestupu hodnot trombocytů v oběhu do takové výše jako u nativních trombocytů, což může být dáno okamžitou spotřebou trombocytů při zástavě krvácení [33]. To v praxi potvrzuje i naše pozorování, kdy i přes nižší počet trombocytů po transfuzi v krevním oběhu pacientů, kteří obdrželi kryokonzervované trombocyty, ve srovnání s pacienty transfundovanými čerstvými trombocyty, jsou ostatní laboratorní a hlavně klinické parametry (klinická účinnost), srovnatelné. Je to ale jeden z důvodů, proč se kryokonzervované trombocyty doporučují v prvé řadě pro substituci při stavech spojených se závažným krvácením a méně k profylaktické léčbě u hematologicky podmíněných trombocytopenií [34].
Na paměti je potřeba mít rovněž další odlišnosti kryokonzervovaných trombocytů, jako je koagulační faktor V a X navázaný na membráně, zvýšená exprese Annexinu V, zvýšená tvorba Tromboxanu B2 a výrazná přítomnost vyplavených mikročástic. Tyto detailní nálezy nejsou ale klinicky pro účely akutní substituce při masivním krvácení významné a neovlivňují jejich prokoagulační účinnost. Stejně tak klinickou účinnost neovlivňuje místy snížené množství trombocytů v přípravku a nižší zotavovací schopnost po rozmrazení, které jsou dostatečně kompenzovány srovnatelným přežíváním v oběhu pacienta, jak ukazují dosud publikované studie na zdravých dobrovolnících [18, 31, 35, 36, 37].
Kryokonzervované trombocyty resuspendované v rozmrazené plazmě jsou vhodnější k zástavě krvácení než trombocyty resuspendované v náhradním roztoku. Pro rychlejší rekonstituci kryokonzervovaných trombocytů je možné použití plazmy skladované při 4 °C, kdy je možné použití přípravku do 15 minut [38]. Ovšem pro pacienty vyžadující rozmrazené trombocyty v jiné indikaci, než je zástava krvácení, se jeví resuspenze v náhradním roztoku jako vhodná varianta [26].
V žádné z dosud publikovaných prací nebyly popisovány závažné účinky po podání zmrazených trombocytů pacientům a tuto skutečnost potvrdilo i naše pozorování [5, 9, 11, 12, 16]. Nebyl pozorován ani žádný negativní efekt zvýšené prokoagulační aktivity kryokonzervovaných trombocytů [29, 32, 37].
Ačkoli uvedený postup rozmrazování a rekonstituce popisuje použití sterilní svářečky hadiček vaků při napojování trombocytového vaku s vakem s plazmou, není použití sterilní svářečky nezbytnou nutností. V zařízeních transfuzní služby nebo krevních bankách, která touto technologií nedisponují, lze s výhodou použít napojení obou vaků pomocí jednoduché hadičkové spojky s bodci na obou koncích. Z hlediska manipulace s transfuzním přípravkem se nejedná o výrobní postup, tj. ani o tzv. sekundární výrobu, ale o přípravu transfuzního přípravku pro výdej, respektive podání, podobně jako např. rozmrazení plazmy před jejím výdejem (podáním). Z hlediska výkazu a evidence se vykazuje trombocytový přípravek a plazma použitá k resuspenzi zvlášť.
Relativně krátká doba skladování kryokonzervovaných trombocytů 2 roky vychází z vyhlášky MZ ČR č. 143/2008 Sb., příloha č. 4, část A, nemá ale reálný základ podložený důkazy. V současné době probíhá zpracování dat studie prováděné v laboratoři Militaire Bloedbank v Leidenu v Nizozemí, které podle předběžných informací dokládají možnost prodloužení doby použitelnosti na minimálně 4 roky. Doba použitelnosti přípravku po rozmrazení a rekonstituci 6 hodin je dána tím, že proces přidání DMSO před zmrazením neprobíhá ve zcela uzavřeném systému a současně počítá s možností použití hadičkové spojky pro přidání resuspenzního média. V případě, že by byl k dispozici DMSO průmyslově vyráběný v plastovém vaku, s možností napojení sterilní svářečkou, bylo by možné prodloužit dobu použitelnosti kryokonzervovaných trombocytů i po rekonstituci. Takový výrobek, podle zjištění autorů, ale dosud na trhu EU dostupný není.
ZÁVĚR
Kryokonzervované trombocyty jsou vhodným přípravkem nikoli pouze pro vojenské, ale též pro civilní použití, zejména pro řešení akutních stavů spojených s masivním krvácením, kdy není k dispozici trvalá a dostatečná zásoba nativních trombocytů. Rozmražení a rekonstituce je jednoduchý proces, který trvá maximálně 30 minut. Kryokonzervované trombocyty mohou nalézt uplatnění i v dalších indikacích, např. při přípravě autologních, vzácných či HLA kompatibilních trombocytů nebo v široké škále netransfuzních aplikací. Vzhledem k nízkým nákladům spojeným s jejich přípravou, jejich použití nepředstavuje významné zvýšení nákladů a naše práce i dosavadní studie naznačují, že kryokonzervované trombocyty jsou účinné, efektivní a bezpečné.
Použité zkratky
aPTT – aktivovaný částečný tromboplastinový čas
DMSO – dimethylsulfoxid
Fbg – fibrinogen
ISS – International severity score
KO – krevní obraz
MAP – Mean Arterial Pressure (střední arteriální tlak)
MKN – Mezinárodní klasifikace nemocí
P – puls
PLT – trombocyty
PT – protrombinový čas
TAD – trombocyty z aferézy deleukotizované
TADK – trombocyty z aferézy deleukotizované kryokonzervované
TADKZ – trombocyty z aferézy deleukotizované kryokonzervované zmražené
TEG – tromboelastograf
T.D. – terapeutická dávka
TT – tělesná teplota
TXA – kyselina tranexamová
ÚVN – Ústřední vojenská nemocnice – Vojenská fakultní nemocnice Praha
Podíl autorů na rukopisu
MB – vedoucí autorského kolektivu, vedoucí studie
DK – manažer spolupráce OHKT a KARIM, sběr dat
LL – zpracování dat
MK – sběr dat
ElS – kontrola kvality, měření TEG
EvS – výroba kryokonzervovaných trombocytů
MV – klinický management
TT – klinický management
Čestné prohlášení autorů
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku neshledávají žádný střet zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Doručeno do redakce: 1. 12. 2017
Přijato po recenzi: 17. 1. 2017
plk. MUDr. Miloš Bohoněk, Ph.D.
Oddělení hematologie a krevní transfuze
Ústřední vojenská nemocnice
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: milos.bohunek@uvn.cz
Sources
1. Perkins JG, Cap AP, Spinella PC, et al. An evaluation of the impact of apheresis platelets used in the setting of massively transfused trauma patients. J Trauma 2009; 66(Suppl 4): S77–84 [discussion: S84–5].
2. Simmons JW, White CE, Eastridge BJ, et al. Impact of policy change on US Army combat transfusion practices. J Trauma 2010; 69(Suppl 1): S75–80.
3. Holcomb JB, et al. Increased platelet: RBC ratios are associated with improved survival after massive transfusion. J Trauma 2011 Aug; 71(2 Suppl 3): S318–28.
4. Perkins JG, et al. (31st Combat Support Hospital Research Group), Comparison of platelet transfusion as fresh whole blood versus apheresis platelets for massively transfused combat trauma patients (CME). Transfusion 2011 Feb; 51(2): 242–252.
5. Noorman F, et al. Transfusion: -80 °C Frozen Blood Products Are Safe and Effective in Military Casualty Care, Plos one. 2016 Dec 13; 11(12): 1–18.
6. Hess JR, Thomas MJ. Blood use in war and disaster: lessons from the past century. Transfusion. 2003 Nov; 43(11): 1622–1633.
7. Royce A, Reade MC, Johnson L, Marks DC. CLIP (cryopreserved vs. liquid platelets for surgical bleeding): Protocol for a randomised controlled trial. Heart, Lung and Circulation 2015 Dec; 24(1): e57–e58.
8. Holley A, Marks DC, Johnson L, Reade MC, Badloe JF, Noorman F. Frozen blood products: clinically effective and potentially ideal for remote Australia. Anaesth Intensive Care 2013; 41 : 10–19.
9. Lelkens CCM, et al. Experiences with frozen blood products in the Netherlands military. Transfusion and Apheresis Science 2006; 34 : 289–298.
10. Badloe J., Noorman J. The Netherlands experience with frozen -80 °C red cells, plasma and platelets in combat casualty care. Transfusion 2011; 51 Suppl: 24A.
11. Noorman F, Badloe J. -80 °C Frozen platelets, efficient logistics, available, compatible, safe and effective in the treatment of trauma patients with or without massive blood loss in military theatre. AABB anual meeting 2012.
12. Daly PA, Schiffer CA, Aisner J, Wiernik PH. Successful transfusion of platelets cryopreserved for more than 3 years. Blood 1979 Nov; 54(5):1023-7.
13. Schiffer CA, Aisner J, Wiernik PH. Frozen autologous platelet transfusion for patients with leukemia. N J Med. 1978 Jul 6; 299(1):7–12.
14. Amer KA, Proper AS, Prose CHV. Effect of Different Resuspension Media on the Post-thaw Characteristics of Frozen Blood. British J of Haem. 1980, 44 : 635–644.
15. Isbister J. Frozen Bblood: time for outcomes. Anaesth Intensive Care. 2013 Jan; 41(1):5–7.
16. Neuhaus S, Wishaw K, Lelkens Ch. Australian experience with frozen blood products on military operations. Med J Aust. 2010; 192 (4):203–205.
17. Bohoněk M. Kryokonzervace krve – historie, metody a současnost, Transfuze Hematol Dnes 19, 2013, No. 1 : 44–50.
18. Taylor MA. Cryopreservation of platelets: an in-vitro comparison of four methods. J Clin Pathol. 1981; 34 : 71–75.
19. Dumont LJ, Cancelas JA, Dumont DF, et al. A randomized controlled trial evaluating recovery and survival of 6% dimethyl sulfoxide-frozen autologous platelets in healthy volunteers. Transfusion 2013 Jan; 53(1):128–137.
20. Yılmaz S, Çetinkaya RA, Eker İ, et al. Freezing of Apheresis Platelet Concentrates in 6% Dimethyl Sulfoxide: The First Preliminary Study in Turkey. Turk J Haemato 2015 Apr 27.
21. Handin RI, Valeri CR. Improved Viability of Previously Frozen Platelets. Blood 1972, 40 : 509–513.
22. Valeri CR, Ragno G, Khuri S. Freezing human platelets with 6 percent dimethyl sulfoxide with removal of the supernatant solution before freezing and storage at -80 degrees C without postthaw processing. Transfusion. 2005; 45 : 1890–1898.
23. Daly PA, Schiffer CA, Aisner J, Wierni PH. Successful transfusion of platelets cryopreserved for more than 3 years. Blood 1979, 54 : 1023–1027.
24. Taylor MA. Cryopreservation of platelets: an in-vitro comparison of four methods. J Clin Pathol. 1981, 34 : 71–75.
25. Valeri CR, Ragno G. Cryopreservation of human blood products. Transfus 2006 Jun; 34(3): 271-87.
26. Johnson LN, et al. Crypreservation of buffy-coat-derived platelet concentrates in dimethyl sulfoxide and platelet additive solution, Cryobiology. 2011; 62 : 100–106.
27. Owens M, Werner E, Holme S, Afferbach C. Membrane glycoproteins in cryopreserved platelets. Vox Sanguinis, 1994, 67 : 28–33.
28. Raynel S, Padula MP, Marks DC, Johnson L. Cryopreservation alters the membrane and cytoskeletal protein profile of platelet microparticles. Transfusion. 2015 Oct; 55(10): 2422–2432.
29. Johnson L, Coorey CP, Marks DC. The hemostatic activity of cryopreserved platelets is mediated by phosphatidylserine-expressing platelets and platelet microparticles. Transfusion 2014 Aug; 54(8):1917–1926.
30. Johnson L, Reade RA, Tan S, Marks DC. In vitro comparison of cryopreserved and liquid platelets: potential clinical implications. Transfusion 2015 Apr; 55(4):838–847.
31. Tegegn TZ, De Paoli SH, Orecna M, et al. Characterization of procoagulant extracellular vesicles and platelet membrane disintegration in DMSO-cryopreserved platelets. J 2016 May 4; 5 : 30422.
32. Perez-Ferrer A, Navarro-Suay R, Viejo-Llorente A, et al. In vitro thromboelastometric evaluation of the efficacy of frozen platelet transfusion. Thromb Res 2015 Aug; 136(2):348–353.
33. Valeri CR et al. Freezing human platelets with 6% dimethyl sulfoxide with removal of the supernatant solution before freezing and storage at -80 °C without postthaw processing. Transfusion 2005; 45 : 1890–1898.
34. Ding GL, QinHYPERLINK WS, Zhao LY, Zhu L, Bo YF, Liu Z, Liu JH. Preparation Technique and Clinical Application of Frozen Platelets. Zhongguo 2016 Aug; 24(4): 1226-31.
35. Eker İ, Yılmaz S, Çetinkaya RA, Pekel A, Ünlü A, Gürsel O, Yılmaz S, Avcu F, Muşabak U, PekoğluH A, Ertaş H Z, Açıkel C, Zeybek N, Kürekçi AE, Avcı İY. Generation of Platelet Microparticles After Cryopreservation of Apheresis Platelet Concentrates Contribute to the Hemostatic Activity. Tur J H Haematol 2016 Apr 18.
36. Hornsey VS, McMillan L, Morrison A, Drummond O, Macgregor IR, Prowse CV. Freezing of buffy coat–derived, leukoreduced platelet concentrates in 6 percent dimethyl sulfoxide. Transfusion 2008; 48 : 2508–14.
37. Slichter SJ, Jones M, Ransom J, Gettinger I, Jones MK, Christoffel T, Pellham E, Bailey SL, Corson J, Bolgiano D. Review of In Vivo Studies of Dimethyl Sulfoxide Cryopreserved Platelets. Transfusion Medicine Reviews 28 (2014) 212–225.
38. Badloe J., Noorman J. -80 °C Frozen platelets are activated compared to 24 hour liquid stored platelets and quality of frozen platelets is unaffected by a quick preparation method (15 min) which can be used to prepare platelets for the early treatment of trauma patients in military theatre. AABB annual meeting 2012.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2016 Issue 4-
All articles in this issue
- Využití monoklonální protilátky daratumumab v léčbě mnohočetného myelomu
- Nízkodávková výpočetní tomografie skeletu v hodnocení stadia mnohočetného myelomu
- Trombocyty z aferézy a z plné krve – srovnání kvality a bezpečnosti
- Stabilita parametrů krevního obrazu a mikroskopicky stanoveného diferenciálního počtu leukocytů
- Kryokonzervované trombocyty v klinické praxi: srovnávací studie s nativními trombocyty
- Vplyv ibrutinibu na doštičkovú agregáciu
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Trombocyty z aferézy a z plné krve – srovnání kvality a bezpečnosti
- Stabilita parametrů krevního obrazu a mikroskopicky stanoveného diferenciálního počtu leukocytů
- Nízkodávková výpočetní tomografie skeletu v hodnocení stadia mnohočetného myelomu
- Kryokonzervované trombocyty v klinické praxi: srovnávací studie s nativními trombocyty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career