-
Medical journals
- Career
Stabilita parametrů krevního obrazu a mikroskopicky stanoveného diferenciálního počtu leukocytů
: E. Babuňková 1; P. Kačírková 2; M. Oupická 2; O. Babuněk 3; P. Salačová 2; M. Špaček 1
: Centrální hematologické laboratoře ÚLBLD, Všeobecná fakultní nemocnice v Praze 1; Laboratoř hematologie ÚLD, Fakultní nemocnice Královské Vinohrady, Praha 2; Fakulta ekonomická Západočeské univerzity v Plzni 3
: Transfuze Hematol. dnes,22, 2016, No. 4, p. 254-263.
: Comprehensive Reports, Original Papers, Case Reports
Úvod:
Vyšetření krevního obrazu (KO) a diferenciálního počtu leukocytů patří mezi základní laboratorní vyšetření. Faktorem, který může negativně ovlivnit validitu výsledků, je čas od odběru vzorku do jeho zpracování (stabilita vzorku). Cílem práce bylo při různé teplotě a délce skladování vzorku analyzovat změny v KO (včetně nových rozšířených parametrů) a v diferenciálním počtu leukocytů stanoveném na hematologickém analyzátoru krvinek i mikroskopicky, včetně kvalitativních morfologických změn.Materiál a metoda:
Data byla získána od 20 zdravých dobrovolníků (6 mužů/14 žen), kterým byly odebrány 3 zkumavky venózní krve s K3EDTA. Vzorky krve byly měřeny na hematologickém analyzátoru XE2100 (TOA Sysmex), nátěry periferní krve byly provedeny na nátěrovém a barvícím automatu SP1000i (TOA Sysmex). Vzorky byly opakovaně měřeny v intervalu 20 minut až 72 hodin od odběru a skladovány při laboratorní teplotě (18–25 °C) nebo v lednici (2–8 °C).Výsledky:
Statisticky významné změny KO již po 12 hodinách skladování při laboratorní teplotě byly pozorovány v případě přímo měřených parametrů HCT a PCT, stejně jako u parametrů odvozených výpočtem (MCV, MCHC, RDW, PDW, MPV, P-LCR). Všechny pozorované parametry jsou uvedeny v tabulce 1. Významně se měnily v čase i hodnoty RET-He a IPF. Naopak u ostatních parametrů KO nebyly prokázány statisticky významné změny po celou dobu sledování (72 hodin). Parametry diferenciálního počtu leukocytů z analyzátoru byly stabilní po celou dobu sledování, s výjimkou parametru počet monocytů (absolutně i relativně), který byl stabilní pouze při teplotě 2–8 °C. V případě mikroskopického diferenciálního počtu leukocytů docházelo při laboratorní teplotě po 12 hodinách a při teplotě 2–8 °C většinou po 24 hodinách k apoptóze krevních buněk a ke změnám jejich morfologie.Závěr:
Naše práce ukázala, že výsledky některých klinicky nejdůležitějších parametrů KO (WBC, HGB, PLT) zůstávají stabilní až 72 hodin od odběru bez ohledu na teplotu skladování vzorku, což může být v některých klinických situacích či z forenzních důvodů důležité. Některé parametry KO ale mají výrazně kratší dobu stability, proto je v běžné praxi nutné se řídit doporučením České hematologické společnosti ČLS JEP, které stanoví stabilitu KO a diferenciálního počtu leukocytů na 5 hodin při teplotě 15–25 °C.Klíčová slova:
stabilita – krevní obraz – diferenciální počet leukocytů – leukocyty – erytrocyty – trombocytyÚVOD
Stanovení parametrů krevního obrazu a diferenciálního počtu leukocytů patří mezi jedno ze základních hematologických vyšetření. Vyšetření lze považovat za rychlé a snadno dostupné. Klinickému lékaři přináší jednu z prvních informací o zdravotním stavu pacienta a výsledky mohou sloužit k určení diagnózy či monitorování léčby. V současné době je měření krevního obrazu prováděno vysoce specializovanými automatickými analyzátory, které umožňují stanovení mnoha parametrů, které dříve dostupné nebyly. Výsledky krevního obrazu ale mohou být významně ovlivněny časem dodání vzorku do laboratoře a teplotou jeho skladování. Je proto nutné brát při hodnocení výsledků ohled i na tzv. stabilitu vzorku a teplotu skladování vzorku. Stabilita vzorku je definována jako doba, která uplyne od odběru primárního vzorku do jeho vyšetření [1], tj. doba po kterou je zaručeno vydání spolehlivého výsledku. V doporučení České hematologické společnosti ČLS JEP je stabilita KO a diferenciálního počtu leukocytů stanovena na 5 hodin při teplotě skladování 15–25 °C. V běžné praxi ale může nastat situace, kdy je z vážných důvodů nutné změřit vzorek i po překročení doporučené doby stability, nebo je vyšetřen vzorek, u kterého neznáme přesný čas odběru. Pro laboratorního i klinického pracovníka je proto nutné, být si vědom změn, ke kterým postupně při delší době od odběru dochází.
Cílem práce proto bylo v první řadě zjistit, jaká je při různé délce a teplotě skladování vzorku stabilita základních parametrů krevního obrazu, diferenciálního počtu leukocytů i tzv. rozšířených parametrů KO, které je možné stanovit na automatickém analyzátoru Sysmex XE 2100. Dále pak bylo naším cílem popsat, k jakým změnám v průběhu času dochází, a to jak u jednotlivých parametrů získaných z automatického analyzátoru, tak i v případě mikroskopicky stanoveného diferenciálního počtu leukocytů, včetně kvalitativních změn v morfologii jednotlivých buněk.
MATERIÁL A METODY
Soubor dárců a použitý materiál
Do studie bylo zařazeno 20 zdravých dobrovolníků (6 mužů/14 žen). Zařazení muži s věkovým mediánem 33,5 roků (rozsah 26–45 let) a ženy s věkovým mediánem 35 roků (rozsah 25–58 let). Dobrovolní dárci byli odebráni v ranních hodinách a od každého byly odebrány 3 zkumavky venózní krve s protisrážlivým činidlem K3EDTA. Jedna zkumavka byla změřena do 20 minut od odběru a následně byla měřena po 1, 4, 6, 8, 12, 24, 48 a 72 hodinách; po celou dobu byla zkumavka skladována při laboratorní teplotě (18–25 °C). Druhá zkumavka od každého pacienta byla po odběru uložena do lednice (teplota 2–8 °C) a měřena po 24 hod., 48 hod. a 72 hod. od odběru, při každém měření byl zároveň proveden i nátěr v nátěrovém a barvícím automatu SP-1000i (tedy po 24, 48 a 72 hod.). Z důvodu dostatečného množství vzorku byla krev třetí zkumavky použita pouze pro provedení nátěru v nátěrovém a barvícím automatu SP-1000i, nátěry krve byly provedeny po 20 minutách od odběru a dále po 4, 6, 12, 24, 48, 72 hodinách od odběru, krev byla uchovávána při laboratorní teplotě. Dobrovolní dárci podepsali informovaný souhlas pro účast ve studii.
Metody
Vzorky krve byly měřeny na hematologickém analyzátoru XE 2100 (TOA Sysmex) ve verzi, která umožnuje provést analýzu krevního obrazu, populačního diferenciálu (včetně parametru IG), retikulocytů a nezralých frakcí trombocytů (softwarové programy XE-RET MASTER a XE-IPF MASTER). Princip měření jednotlivých parametrů je uveden v tabulce 1. Nátěry periferní krve byly provedeny na nátěrovém a barvicím automatu SP1000i (TOA Sysmex). Manuální diferenciál byl analyzován jednou laborantkou na digitálním mikroskopu DM96 (Cella Vision), počet hodnocených buněk byl 200, u nátěrů starších byla analýza provedena na 100 buněk. Všechny nátěry byly také zhodnoceny stejným lékařem s použitím světelného mikroskopu Olympus BX43.
1. Přehled stanovovaných parametrů, principů stanovení na analyzátoru XE2100 (TOA Sysmex) a jednotek 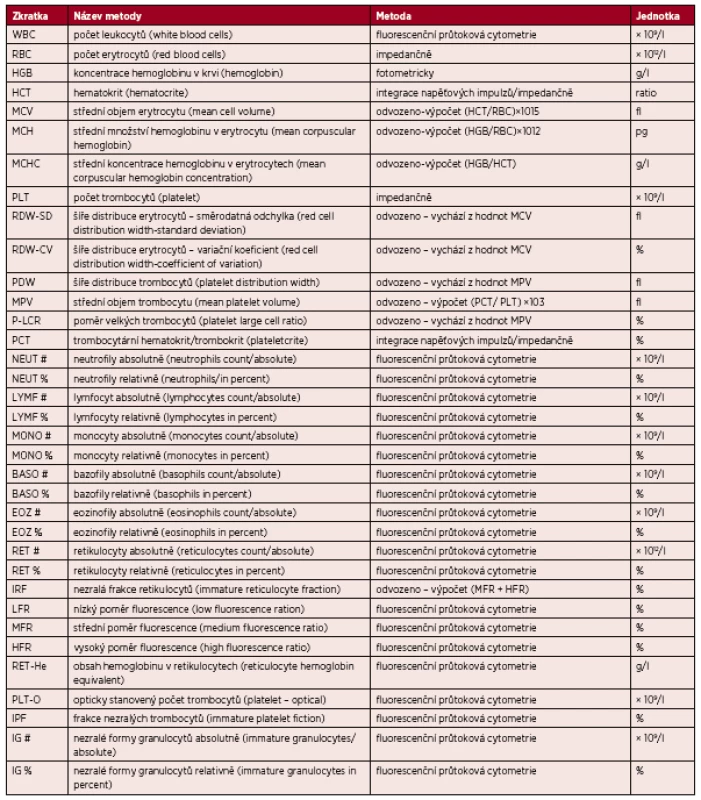
Statistická analýza
Pro analýzu stability parametrů získaných na automatickém analyzátoru XE2100 byla využita metoda analýzy rozptylu (ANOVA), která porovnává velikost středních hodnot ukazatelů. V případě statisticky významně odlišných hodnot byly testovány kontrasty mezi jednotlivými časovými úseky, vedoucí ke zjištění, v jakých časových intervalech vznikají statisticky významné rozdíly [2].
VÝSLEDKY
Stanovené parametry byly rozděleny podle podmínek skladování do dvou skupin. První skupinou jsou výsledky stabilit jednotlivých parametrů vzorků uchovávaných při laboratorní teplotě, měřených do 20 minut od odběru a následně po 1, 4, 6, 8, 12, 24, 48 a 72 hodinách (tab. 2). Parametry WBC, RBC, HGB, MCH, PLT, NEUT ABS/REL, LYMF ABS/REL, BASO ABS/REL, EOZ ABS/REL, RET ABS/REL, IRF, LFR, MFR, HFR, PLT-O a IG ABS/REL lze označit jako stabilní (p-hodnota 0,216-0,999). Zkratky všech zmíněných parametrů (viz tab. 1). Výsledky měření těchto parametrů nejsou ovlivněny dobou od odběru, pokud je vzorek skladován při laboratorní teplotě a je zpracován nejpozději do 72 hodin. Mezi parametry, u kterých bylo zjištěno, že se hodnoty statisticky významně liší v časech od odběru po analýzu vzorku, patří HCT, MCV, MCHC, RDW-SD, RDW-CV, PDW, MPV, P-LCR, PCT, MONO ABS/REL, RET-He a IPF. Po zhruba 12 hodinách od odběru vzorku již nelze výsledné hodnoty těchto parametrů brát za relevantní. Parametry mikroskopicky stanoveného diferenciálního počtu leukocytů byly stabilní do 12 hodin od odběru.
2. Stabilita parametrů vzorků uchovávaných při laboratorní teplotě po dobu 72 hodin 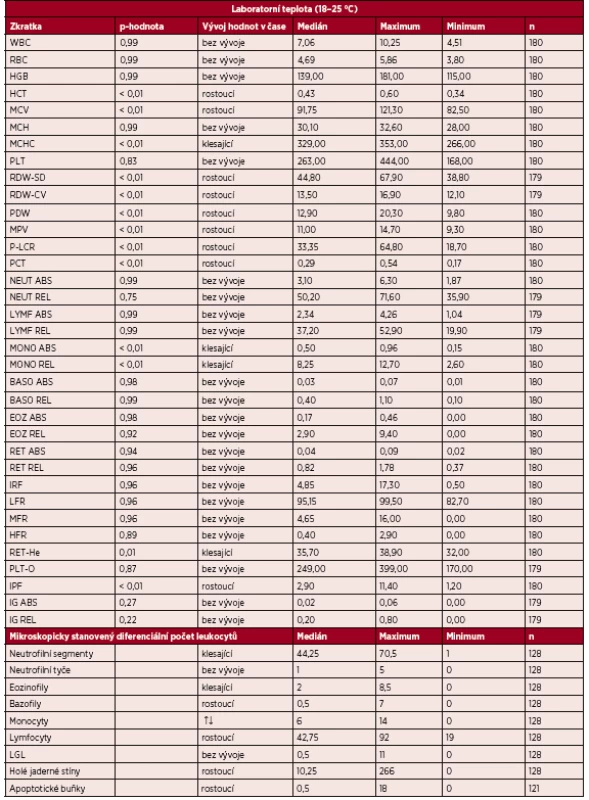
abs. – absolutně, relat. – relativně, ↑↓ trend nejprve rostoucí, následně klesající, n – počet analýz Druhou skupinu tvoří výsledky stabilit parametrů vzorků skladovaných v lednici při teplotě (2–8 °C) a měřených po 24, 48 a 72 hod. od odběru vzorku (tab. 3). Parametry WBC, RBC, HGB, HCT, MCV, MCH, PLT, PCT, NEUT ABS/REL, LYMF ABS/REL, MONO ABS/REL, BASO ABS/REL, EOZ ABS/REL, RET ABS/REL, IRF, LFR, MFR, RET-He a PLT-O jsou stabilní v čase, a ani po 72 hod. od odběru nemají významně rozdílné hodnoty. Naopak parametry MCHC, RDW-SD, RDW-CV, PDW, MPV, P-LCR, HFR, IPF a IG ABS/REL vzorků skladovaných v lednici nelze považovat za stabilní.
3. Stabilita parametrů vzorků uchovávaných při teplotě (2–8 °C) po dobu 72 hodin 
abs. – absolutně, relat. – relativně, ↑↓ trend nejprve rostoucí, následně klesající, ↓↑ trend nejprve klesající, následně rostoucí, n – počet analýz U parametrů mikroskopicky stanoveného diferenciálního počtu leukocytů vzorků uchovaných při teplotě 2–8 °C došlo v celkovém zhodnocení ke zvýšení stability, ze získaných dat lze vyvodit, že parametry mikroskopického diferenciálního počtu leukocytů jsou stabilní při uchování v lednici maximálně do 24 hodin od odběru.
Kvalitativní hodnocení morfologie buněk
Hodnocení morfologie erytrocytů, trombocytů a leukocytů v nátěrech vzorků uchovaných při laboratorní teplotě i při teplotě 2–8 °C.
Erytrocyty
U většiny nátěrů byla pozorována změna tvaru erytrocytů v tzv. echinocyty. Echinocyty se objevují v nátěrech vzorků uchovaných jak při laboratorní teplotě, tak v menší míře i při teplotě 2–8 °C přibližně 24 hod. od odběru vzorku. Se zvyšujícím se časem se zvyšuje i množství echinocytů. V některých nátěrech vzorků uchovaných při laboratorní teplotě i vzorků uchovaných v lednici je patrný mírný sklon k tvorbě rouleaux.
Trombocyty
Objektivně nebyly v nátěrech pozorovány výrazné morfologické odlišnosti v závislosti na čase a teplotě skladování. Ojediněle jsou přítomny menší shluky trombocytů, které jsou však pozorovány pouze u vzorků skladovaných při teplotě 2–8 °C.
Leukocyty
Granulocyty
V nátěrech vzorků uchovaných při laboratorní teplotě se objevují zhruba od 48 hod. preapoptotické a apoptotické formy neutrofilů (obr. 1), je patrná i změna velikosti, neutrofily se zmenšují, svrašťují se nebo se rozpadají (obr. 2). Pro porovnání jsou uvedeny i fyzio-logické neutrofilní segmenty (obr. 3, 4). V nátěrech vzorků skladovaných při 2–8 °C je stejně jako při uchování vzorků při laboratorní teplotě možné vidět preapoptotické neutrofily a také neutrofily polorozpadlé, ojediněle se objevuje zhruba od 24–48 hod. vakuolizace cytoplazmy neutrofilů. Populaci eozinofilních a bazofilních segmentů nebylo možné objektivně zhodnotit z důvodu nízkých počtů buněk v nátěrech.
1. Apoptotická forma neutrofilního segmentu (24 hodin po odběru, laboratorní teplota) 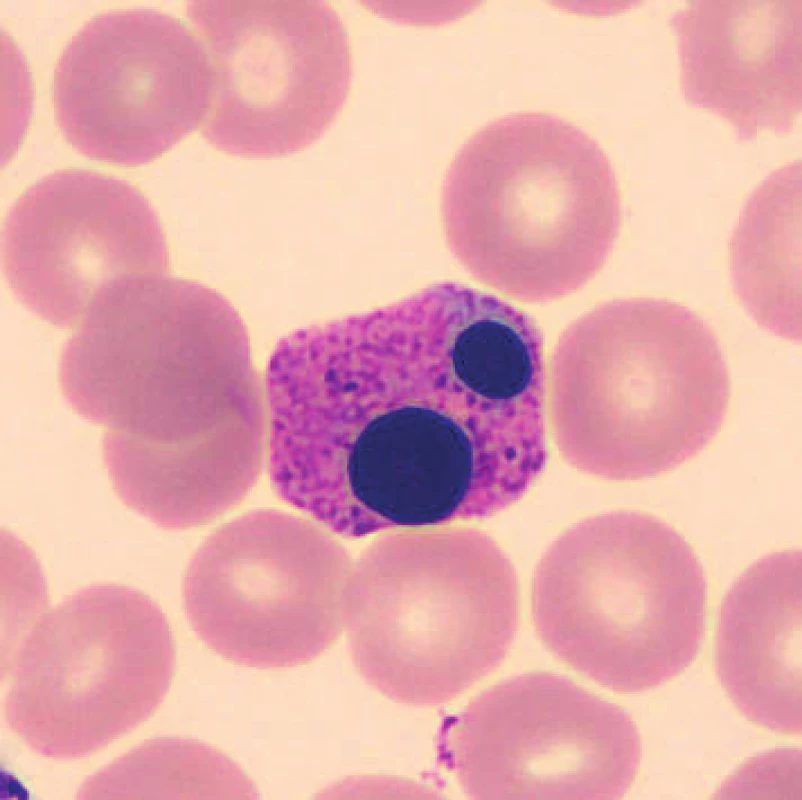
2. Rozpadající se neutrofilní segment (24 hodin po odběru, laboratorní teplota) 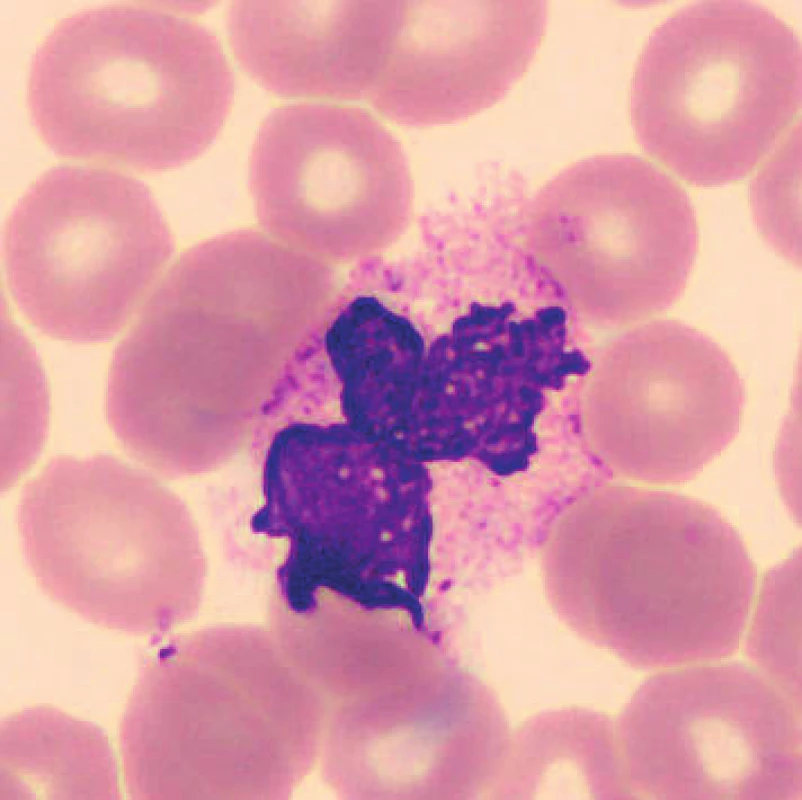
3. Neutrofilní segment (20 minut po odběru, laboratorní teplota) 
4. Neutrofilní segment (6 hodin po odběru, laboratorní teplota) 
Lymfocyty
V nátěrech vzorků uložených při laboratorní teplotě se zhruba po 24 hod. velikost lymfocytů snižuje, blíží se velikosti erytrocytů, svrašťují se, v jiných nátěrech vzorků skladovaných při laboratorní teplotě dochází k lobulizaci jader (obr. 5), fyziologické lymfocyty (obr. 6, 7). V nátěrech vzorků uchovaných při teplotě 2–8 °C je po 24 hod. také patrná lobulizace jader lymfocytů a velikost lymfocytů se zmenšuje, svrašťují se, ojediněle se objevuje i vakuolizace plazmy lymfocytů.
5. Lymfocyt (24 hodin po odběru, laboratorní teplota) 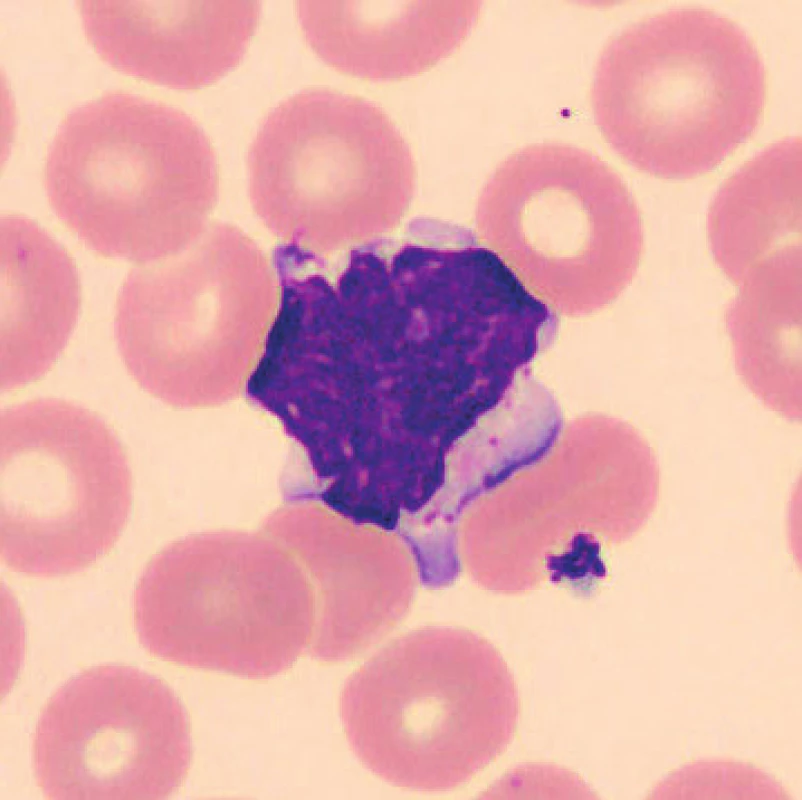
6. Lymfocyt (20 minut po odběru, laboratorní teplota) 
7. Lymfocyt (6 hodin po odběru, laboratorní teplota) 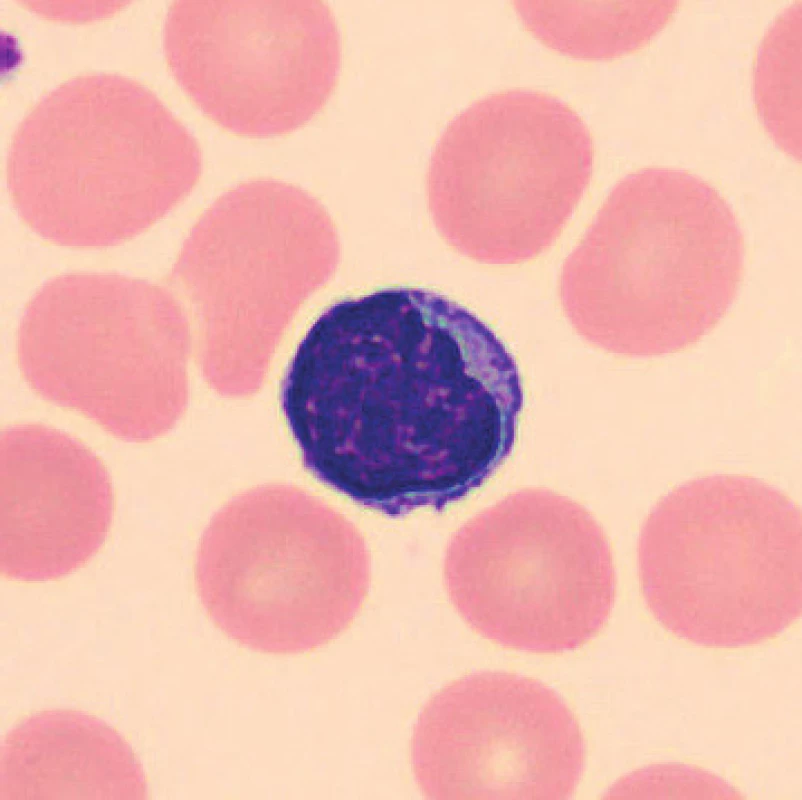
Monocyty
U vzorků uchovávaných při laboratorní teplotě byly pozorovány po 24 hod. od odběru monocyty s výraznější vakuolizací (obr. 8), v některých nátěrech byly monocyty svraštělé a měly abnormálně výrazně lobulizovaná jádra, zhruba po 48 hod. je možné ještě častěji pozorovat v nátěrech menší monocyty. Ojediněle byly u vzorků uchovaných při teplotě 2–8 °C cca od 24 hod. pozorovány protruze jaderné hmoty monocytů. Pro porovnání jsou uvedeny i fyziologické monocyty (obr. 9, 10).
8. Monocyt (24 hodin po odběru, laboratorní teplota) 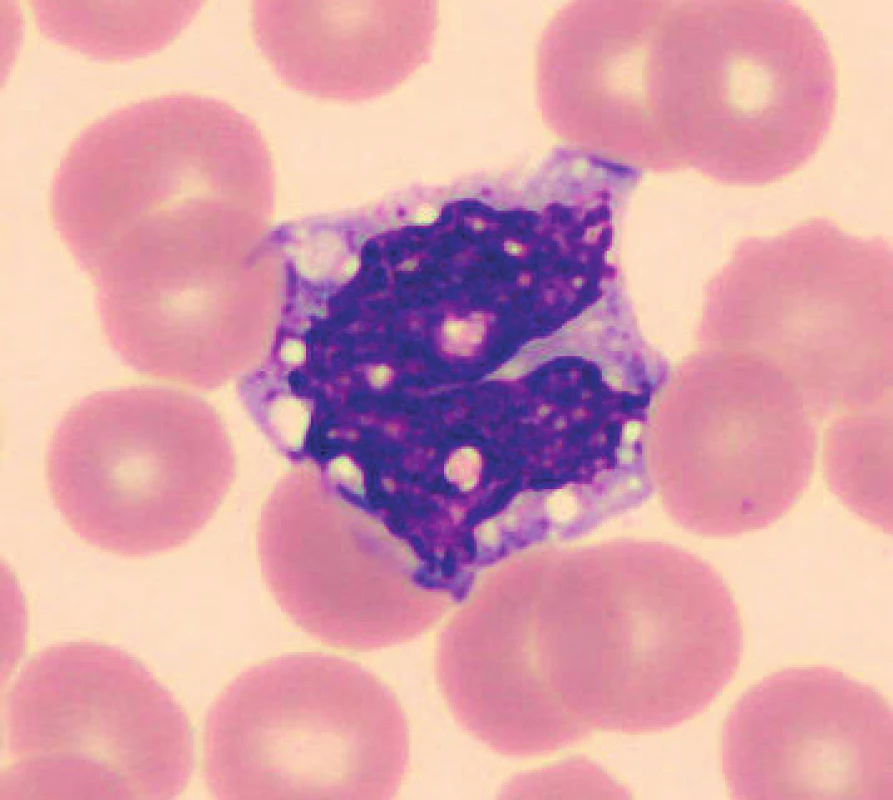
9. Monocyt (20 minut po odběru, laboratorní teplota) 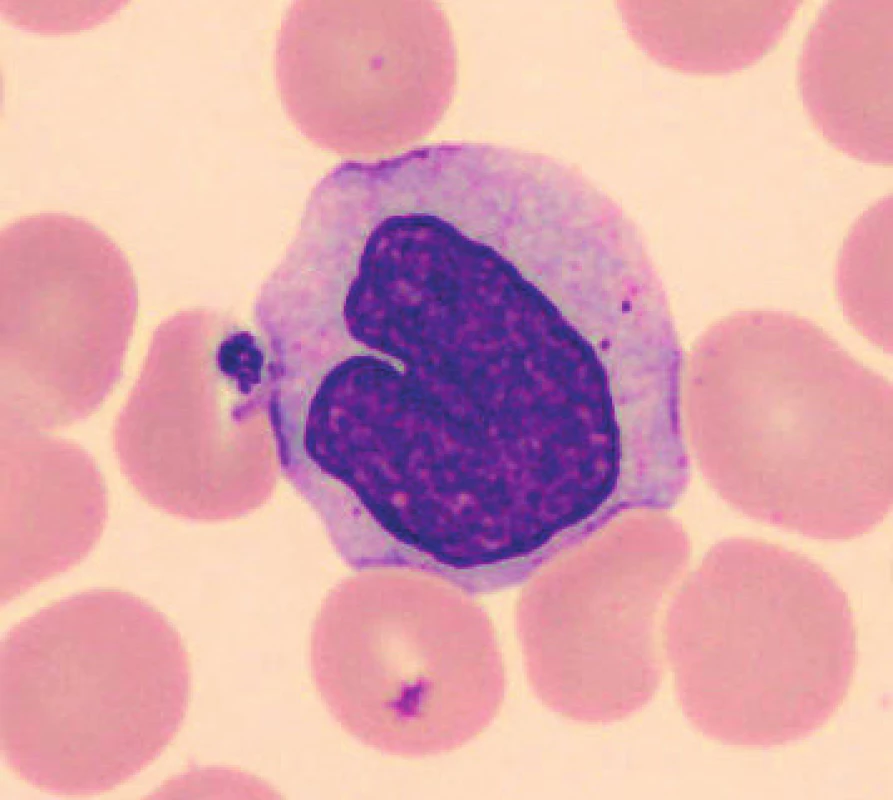
10. Monocyt (6 hodin po odběru, laboratorní teplota) 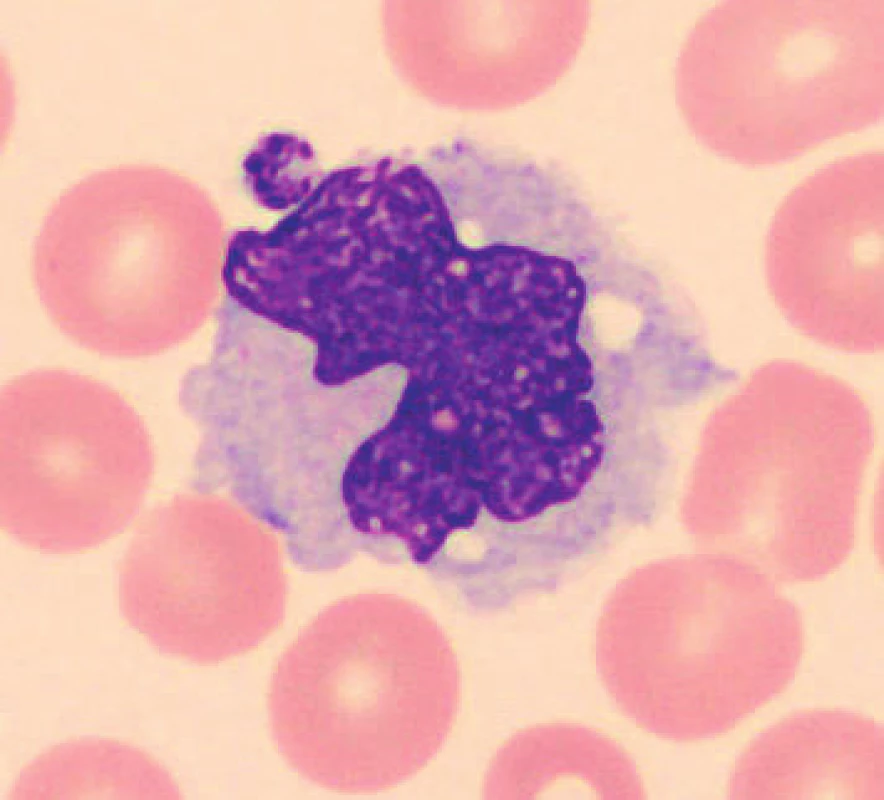
DISKUSE A ZÁVĚR
Podle našich výsledků získaných z normálních vzorků periferní krve od zdravých dobrovolníků se základní parametry krevního obrazu WBC, RBC, HGB, PLT s časem měření a teplotou skladování (18–25 °C i 2 až 8 °C) statisticky až po dobu 72 hod. významně nemění, což je ve shodě s publikovanými pracemi [3–7]. Pouze v jedné studii Imeri et al. [6] byl počet WBC stabilní při uchování při laboratorní teplotě jen po dobu 24 hod.
Dalším parametrem základního krevního obrazu, který je možné označit jako nezávislý na čase měření a teplotě skladování je MCH. Výsledky se statisticky významně nemění, nicméně při skladování vzorku v lednici je parametr MCH stabilnější, což ukazuje i práce Oddoze et al. [4].
Další parametry vzorků uchovaných při laboratorní teplotě (HCT, MCV, MCHC, RDW-SD, RDW-CV, PDW, MPV, P-LCR, PCT) se statisticky významně lišily podle času zpracování vzorku. Parametry MCV, MCHC, RDW-SD a RDW-CV měřené ihned po odběru a 24 hod. po odběru se statisticky významně lišily, stejně jako uvádí Lippi et al. [8]. Po 48 hodinách od odběru vzorku byly významně odlišné parametry HCT, PDW, MPV, P-LCR a PCT. Podle našich výsledků jsou parametry HCT a MPV stabilnější, než uvádí citovaná studie [8], ve které byly pozorovány významné změny již po 24 hod. Naopak Lombardi et al. [7] ukázali podobnou stabilitu parametrů MCV a HCT jako v našem souboru. Navíc se v naší práci stabilita parametrů HCT a MCV výrazně zvýšila u vzorků uchovávaných při teplotě 2–8 °C. Výsledky parametrů MCHC, RDW-SD, RDW-CV, PDW, MPV nejsou při uchovávání vzorků v lednici stabilní. U parametrů automaticky stanoveného diferenciálního počtu leukocytů (neutrofily absolutně/relativně, lymfocyty absolutně/relativně, eozinofily absolutně/relativně, bazofily absolutně/relativně) nebylo prokázáno, že by byly parametry statisticky významně ovlivněny časem měření a teplotou skladování po celou dobu sledování. Shodné výsledky uvádí Lippi et al. [8], naopak další práce [6] označuje parametry eozinofily a lymfocyty jako nestabilní v čase. Podle naší studie se parametr monocyty absolutně/ relativně statisticky významně liší v čase od odběru vzorku po jeho zpracování při skladování za laboratorní teploty, naopak při uchování za teploty 2–8 °C se parametr monocyty absolutně/ relativně jeví jako stabilní v čase.
U ostatních parametrů (RET absolutně/relativně, IRF, LFR, MFR, HFR, PLT-O a IG absolutně/relativně) nebylo prokázáno, že by se hodnoty parametrů statisticky významně lišily v čase při laboratorní teplotě, a to až po dobu 72 hodin od odběru. Parametry RET-He a IPF se statisticky významně liší v čase od odběru vzorku po jeho zpracování při uchování vzorku za laboratorní teploty.
Pokud jsou vzorky uchovávány v lednici a změřeny po 24, 48 a 72 hodinách, je u většiny parametrů patrné zvýšení stability, nicméně u parametrů PLT, lymfocyty absolutně/relativně, bazofily absolutně/relativně a u IRF, LFR, MFR, HFR, IG absolutně/relativně naopak došlo k snížení stability vzorků.
Na základě našich výsledků lze tvrdit, že parametry mikroskopicky stanoveného diferenciálního počtu leukocytů nejsou stabilní déle než 12 hod. od provedeného odběru. Z kvalitativního hodnocení změn v morfologii erytrocytů vyplývá, že s přibývajícím časem od odběru vzorků se mění erytrocyty v echinocyty [9]. V našich výsledcích bylo u vzorků uchovaných při teplotě 2–8 °C echinocytů v nátěrech přítomno méně. V morfologii trombocytů nebyly pozorovány výrazné změny v závislosti na čase odběru vzorku, pouze u vzorků skladovaných při teplotě 2–8 °C byly ojediněle pozorovány shluky trombocytů.
Morfologický popis změn leukocytů se převážně shoduje jak u vzorků uchovávaných při laboratorní teplotě, tak u vzorků uchovávaných v lednici.
Naše práce ukázala, že validní výsledky většiny základních i rozšířených parametrů krevního obrazu a diferenciálního počtu leukocytů lze získat až 12 hod. od odběru vzorku, a to bez ohledu na teplotu skladování. Některé nejdůležitější klinické parametry (např. WBC, HGB, PLT, RET a další) byly stabilní až 72 hod. od odběru. V případě mikroskopického hodnocení diferenciálního počtu leukocytů i morfologie leukocytů, erytrocytů a trombocytů docházelo k významným změnám po 12 hod. od odběru vzorku.
Ke změnám v některých parametrech KO a diferenciálního počtu leukocytů ale docházelo již v kratším čase od odběru. Je proto jistě opodstatněné a důležité se řídit doporučením České hematologické společnosti ČLS JEP, které stanoví stabilitu KO a diferenciálního počtu leukocytů na 5 hod. při teplotě 15–25 °C.
Nicméně v běžné klinické a laboratorní praxi může výjimečně nastat situace, kdy je z vážných důvodů nezbytné vyšetřit KO či provést nátěr k mikroskopickému hodnocení ze staršího vzorku (klinicky závažná situace při nemožnosti odběru nového vzorku, forenzní důvody apod.). V tom případě je pro laboratorního i klinického pracovníka důležité vědět, k jakým změnám může v průběhu času docházet.
Podíl autorů na rukopisu
EB – příprava studie, organizace sběru dat, zpracování rukopisu
PK – morfologické zpracování studie, připomínkování a kontrola rukopisu
MO – příprava studie, organizace sběru dat
OB – statistické zpracování
PS – morfologické zpracování studie
MŠ – návrh studie, připomínkování a kontrola rukopisu
Poděkování
Podpořeno projektem OPPK CZ.2.16/3.1.00/24012.
Prohlášení o konfliktu zájmů
Eva Babuňková prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i spoluautorů Petry Kačírkové, Miroslavy Oupické, Ondřeje Babuňka, Petry Salačové a Martina Špačka.
Doručeno do redakce dne 11. 4. 2016.
Přijato po recenzi dne 21. 9. 2016.
RNDr. Eva Babuňková
Všeobecná fakultní nemocnice v Praze
Centrální hematologické laboratoře ÚLBLD
U Nemocnice 2
128 08 Praha 2
e-mail: Eva.Babunkova@vfn.cz
Sources
1. <http://www.hematology.cz/doporuceni/laboratorni_sekce/k_cinnostem.php>9.12.2015 Hrachovinová I, Charvát J, Pecka M. Doporučení ČHS ČSL JEP ke stabilitě a k transportu primárních vzorků biologického materiálu do hematologické laboratoře. 2012.
2. Karpíšek Z. Kvantitativní metody v řízení (Quantitative methods in management). Brno: Akademie Sting, 2007.
3. Vogelaar SA, Posthuma D, Boomsma D, Kluft C. Blood sample stabi-lity at room temperature for counting red and white blood cells and platelets. Vasc Pharmacol 2002; 39 : 123–125.
4. Oddoze Ch, Lombard E, Portugal H. Stability study of 81 analytes in human whole blood, in serum and in plasma. Clin Biochem 2012; 45 : 464–469.
5. Zini G and International Council for Standardization in Haematology (ICSH). Stability of complete blood count parameters with storage: toward defined specifications for different diagnostic applications. Int J Lab Hematol 2014; 36 : 111–113.
6. Imeri F, Herklotz R, Rish L, et al. Stability of hematological analytes depends on the hematology analyser used: A stability study with Bayer Advia 120, Beckman Coulter LH 750 and Sysmex XE 2100. Clin Chimica Acta 2008; 397 : 68–71.
7. Lombardi G, Lanteri P, Colombini A, Lippi G, Banfi G. Stability of haematological parameters and its relevance on the athletes biological passport model. Sports Med 2011; 41 : 1033–1042.
8. Lippi G, Salvagno GL, Solero GP, Franchini M, Guidi GC. Stability of blood cell counts, hematologic parameters and reticulocytes indexes on the Advia A120 hematologic analyzer. J Lab Clin Med 2005; 146 : 333–340.
9. Bain BJ. Blood cells: a practical guide. 4. vyd. Oxford, Blackwell Publishing, 2006; 476 s.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2016 Issue 4-
All articles in this issue
- The monoclonal antibody daratumumab in the treatment of multiple myeloma
- Low-dose computed tomography of the skeleton in multiple myeloma staging
- Apheresis platelets versus pooled platelets – comparison of quality and safety
- Stability of complete blood count and microscopic differential count parameters
- Frozen platelets in clinical praxis: comparative study of native platelets
- Effect of ibrutinib on platelet aggregation
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Apheresis platelets versus pooled platelets – comparison of quality and safety
- Stability of complete blood count and microscopic differential count parameters
- Low-dose computed tomography of the skeleton in multiple myeloma staging
- Frozen platelets in clinical praxis: comparative study of native platelets
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

