-
Medical journals
- Career
Metabolismus železa u dárců krve
Authors: L. Sulovská 1; D. Holub 2; D. Galuszková 3; I. Sulovská 3; M. Hajdúch 2; M. Horváthová 4; D. Pospíšilová 1
Authors‘ workplace: Dětská klinika, Fakultní nemocnice a Lékařské fakulty Univerzity Palackého v Olomouci 1; Ústav molekulární a translační medicíny, Olomouc 2; Transfuzní oddělení, Fakultní nemocnice a Lékařské fakulty Univerzity Palackého v Olomouci 3; Ústav biologie Lékařské fakulty Univerzity Palackého v Olomouci 4
Published in: Transfuze Hematol. dnes,21, 2015, No. 4, p. 193-199.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Úvod:
Metabolismu železa je velmi úzce spjat s erytropoetickou aktivitou kostní dřeně. Dárcovství krve zasahuje do homeostázy železa a může vést k vyčerpání zásob železa dárce. Cílem práce je zhodnotit vybrané parametry metabolismu železa a jejich význam při prevenci rozvoje deficitu železa u dárců krve.Metody:
U dárců krve, kteří vyhověli kritériím pro darování krve podle platných Doporučených postupů Společnosti pro transfuzní lékařství ČLS JEP, byl vyšetřen krevní obraz, hladina plazmatického železa a feritinu. Celkem bylo vyšetřeno 117 dárců krve (64 mužů a 53 žen), kteří byli způsobilí k darování krve. Hladina hepcidinu byla stanovena proteomickou analýzou založenou na reverzní kapalinové chromatografii spřažené s hmotnostní spektrometrií (LC-MS).Výsledky:
Muži měli signifikantně vyšší počet erytrocytů, hladinu hemoglobinu, hematokritu a feritinu než ženy. Hladina feritinu pozitivně korelovala s hladinou hepcidinu u obou pohlaví. Šest mužů (9,52 %) a devět žen (17,64 %) mělo hladinu feritinu pod 12 ng/ml. Výrazně sníženou hladinu hepcidinu (pod 2,5 ng/ml) jsme zaznamenali u 18 mužů (28 %) a 5 žen (9,8 %).Závěr:
Hladina hepcidinu lépe odráží skutečnou spotřebu železa funkční erytropoézou, a proto je vyšetření hepcidinu vhodným markerem ke zhodnocení stavu metabolismu železa u dárců krve.Klíčová slova:
hepcidin, metabolismus železa, dárcovství krve, deficit železaÚVOD
Železo (Fe) patří mezi nejdůležitější biogenní prvky ve všech živých organismech. Na buněčné úrovni se Fe účastní řady enzymatických reakcí (je kofaktorem peroxidáz, hydroxyláz, oxidáz či ribonukleotidreduktázy), které jsou nezbytné pro přežití buněk a pro jejich dělení. Nedostatek Fe může vést k zástavě růstu buňky i k buněčné smrti. Za fyziologických podmínek je hladina Fe udržována v úzkém rozmezí, protože jak nedostatek, tak jeho akumulace v organismu může mít závažné negativní důsledky pro buněčné pochody.
Největší množství Fe v lidském organismu je obsaženo v molekule hemoglobinu (60–70 % celkového Fe) a myoglobinu (5 %), kde má nezastupitelnou úlohu při vazbě, přenosu a uvolňování kyslíku k zajištění dostatečné oxygenace tkání. Dalších 25 % Fe je uloženo v zásobních proteinech feritinu a hemosiderinu, odkud je v případě potřeby uvolněno a využito. Pouze 1 % Fe cirkuluje v plazmě vázané na molekulu transferinu a po navázání na transferinové receptory (TfR) v buněčné membráně je Fe přijato buňkami k utilizaci. Přibližně 3,5 % celkového Fe je vázáno na metaloproteiny a enzymy (cytochrom P450, katalázy, peroxidázy), které jsou nezbytné pro přežití buněk [1].
Denní potřeba Fe u člověka je přibližně 25 mg Fe, převážná část je využita v kostní dřeni při erytropoéze. Denně je enterocyty v duodenu vstřebáno 1–2 mg Fe, toto množství může být zvýšeno na 3–4 mg, pokud to aktuální situace vyžaduje (např. po akutním krvácení).
Metabolismus a regulace homeostázy železa
Metabolismus Fe je řízený jak na buněčné úrovni, tak na úrovni systémové. Na úrovni organismu se uplatňuje účinek hormonu hepcidinu (hepatic antimicrobial peptide, LEAP-1, liver expressed antimicrobial protein 1), který je klíčovou regulační molekulou metabolismu Fe. Cílovým receptorem pro hepcidin je feroportin (FNP), jediný dosud popsaný transmembránový přenašeč Fe iontů z intracelulárního prostoru do plazmy. Po vazbě hepcidinu na FPN dochází k endocytóze a degradaci komplexu hepcidin-FPN. Fe je tedy zadrženo intracelulárně a nemůže být dále využito. Tento mechanismus je uplatňován na bazolaterální membráně enterocytů v duodenu, v intracytoplazmatických inkluzích a na plazmatické membráně makrofágů v játrech, slezině, kostní dřeni a v hepatocytech, a ovlivňuje tak příjem železa ze stravy a jeho uvolňování ze zásob, což jsou klíčové procesy pro udržování homeostázy Fe v organismu. FPN v buňkách syncytiotrofo-blastu je esenciální pro materno-fetální přestup Fe přes placentu. Většina ostatních buněk exprimuje pouze malé množství FPN pro regulaci vlastního buněčného metabolismus Fe [2]. Syntéza hepcidinu je ovlivněna hladinou sérového Fe a jeho zásobami v organismu, zánětem, erytropoetickou aktivitou a hypoxií [3].
Nedostatek železa u dárců krve
Dárcovství krve je vždy spojeno se ztrátou určitého množství Fe z organismu a dárci krve jsou tedy ohroženi rozvojem deficitu zásob Fe a sideropenické anémie. Při odběru jedné jednotky plné krve o objemu 450 ml dochází ke ztrátě 200–250 mg Fe [4]. Toto množství představuje 5–10 % celkové zásoby Fe v těle. Longitudinální multicentrická studie REDS-II Donor iron status evaluation (RISE) zjišťovala prevalenci deficitu zásobního Fe (feritin < 12 ng/ml) a latentní sideropenie (definované poměrem log solubilního TfR/feritinu ≤ 2,07) u dárců krve, kteří splňovali kritéria pro darování krve; hladina hemoglobinu u mužů i u žen byla vyšší než 125 g/l. Deficit zásobního Fe byl prokázán u 47 % opakovaných dárců – mužů a latentní sideropenie u 18 %. U žen byly výsledky ještě více alarmující – 62 % mělo nedostatečné zásoby Fe a 27 % latentní sideropenii [5].
Hladina feritinu je ukazatelem prostých zásob Fe, ale není ovlivněna aktuálními erytropoetickými signály kostní dřeně. Zároveň je feritin reaktantem akutní fáze zánětlivé odpovědi organismu a jeho syntéza je stimulována zánětlivým procesem. Jsou proto stále hledány další možnosti, které včas pomohou identifikovat dárce ohrožené deficitem Fe. Ke zjištění prevalence subklinického deficitu je možné využít stanovení hladiny zinek-protoporfyrinu (ZPP) v erytrocytech. Metoda je založená na měření hladiny ZPP v erytrocytech. Při nedostatku železa se v posledním kroku syntézy do hemu inkorporuje do protoporfyrinu IX místo Fe zinek, a zvyšuje se tak hladina ZPP. Do studie nizozemských autorů realizované v letech 2008–2010 ve dvou transfuzních centrech (Nijmegen a Utrecht) bylo zařazeno celkem 5 280 dárců krve (2 897 mužů a 2 383 žen). Prevalence subklinického deficitu železa stanovená obsahem ZPP v erytrocytech dárců byla u mužů 6,9 % a 9,8 % u žen. Rozdílné výsledky předchozích dvou studií mohou být vysvětleny různou frekvencí odběrů a odlišnou požadovanou hladinou hemoglobinu v předodběrovém vzorku krve [6].
Měření hepcidinu
Stanovení hladin hepcidinu, jakožto klíčového regulátoru metabolismu železa, je v současnosti doporučováno při diferenciální diagnostice anémií chronických chorob, anémií u chronického poškození ledvin, hypochromních mikrocytárních anémií a hemochromatózy [7]. Hepcidin by proto mohl sloužit i jako nový a doplňující diagnostický marker deficitu železa u všech dárců krve. Nicméně měření hladiny hepcidinu zůstává stále problematické. Ke stanovení hladiny hepcidinu byly vyvinuty metody založené na radioizotopově nebo enzymaticky značené imunoanalýze (ELISA) nebo na hmotnostní spektrometrii. Výhodou metod ELISA je především jejich lepší dostupnost v podobě komerčně vyráběných setů, nevýhodou je jejich nedostatečná validace, nižší přesnost při měření velmi nízkých koncentrací hepcidinu v séru a především skutečnost, že mnohé z nich nedetekují biologicky aktivní hepcidin-25. Jedinou společností se standardizovanou a validovanou metodu ELISA je Intrinsic LifeSciences (Los Angeles, USA) [8, 9, 10]. Při použití hmotnostní spektrometrie lze naopak stanovit i krajní a především velmi nízké koncentrace hepcidinu, její využití je však spojeno s nákladnějším vybavením laboratoře přístrojovou technikou a náročným procesem jejího zavedení [11]. Tato metoda byla zavedena v některých laboratořích na světě včetně naší laboratoře [12, 13]. Hlavní limitací metody v důsledku neexistence mezinárodního standardu pro hepcidin-25 je absence univerzálních referenčních mezí a již patologických hodnot, na základě kterých by byla vypracovaná příslušná doporučení pro léčbu stavů s narušeným metabolismem železa [14]. Otázka standardizace hmotnostní spektrometrie pro stanovení hladin hepcidinu je tedy klíčová pro její rutinní využití v klinické praxi.
Cílem této práce bylo zhodnotit zásoby Fe a možný přínos vyšetření hladiny hepcidinu u dárců krve, kteří splnili kritéria pro darování krve a byli uschopněni k odběru. Podobná studie stanovující prevalenci deficitu zásob železa u dárců krve v České republice dosud nebyla provedena.
MATERIÁL A METODIKA
Cílovou skupinu tvořili dobrovolní dárci krve, kteří byli náhodným výběrem vyzvaní k participaci na výzkumu v letech 2013–2014. Všichni dárci prošli klinickým vyšetřením lékařem a splnili podmínky pro darování podle platné vyhlášky č. 143/2008 Sb. a platných Doporučených postupů Společnosti pro transfuzní lékařství ČLS JEP [15, 16]. Provedení studie bylo schváleno Etickou komisí Fakultní nemocnice a Univerzity Palackého v Olomouci. Celkem bylo do studie zařazeno 117 dárců krve (64 mužů a 53 žen), průměrný věk mužů byl 40,2 roku, průměrný věk žen 35,5 roku. Muži darovali krev před zařazením do studie průměrně 27krát, ženy 14krát. Odběr vzorků byl realizován po podepsání informovaného souhlasu s účastí na výzkumu. Vzorky séra byly zamraženy na -80 °C a udržovány za stálých podmínek do vyšetření hladiny hepcidinu. Kontrolní skupinu při srovnání hladin hepcidinu tvořily zdravé subjekty (muži a ženy) s negativní anamnézou dárcovství krve.
Vyšetření parametrů krevního obrazu – analýza vzorků byla provedena na automatickém analyzátoru Sysmex KX-21N (Sysmex Corporation, Kobe, Japan).
Hladina plazmatického železa byla stanovena fotometricky na přístroji Cobas 8000 (Hitachi, Tokyo, Japan). Ke stanovení hladiny feritinu byla použita chemiluminiscenční metoda a analyzátor Architect i2000SR (Abbott Laboratories, Illinois, USA).
Vyšetření hladiny hepcidinu – použitá metoda měření hladiny hepcidinu je založena na extrakci na pevné fázi (SPE) a kapalinové chromatografii spřažené s hmotnostní spektrometrií (LC-MS/MS). Regresní rovnice získaná z kalibračních standardů byla použita pro zpětný výpočet koncentrace hepcidinu ve vzorku. Metoda byla již dříve detailně popsána a validována v laboratořích Intrinsic LifeSciences ILS (La Jolla, CA, USA) [12, 13].
Statistické zpracování dat bylo provedeno regresní analýzou pomocí cenzorovaného regresního modelu Tobit, software Statistica 12 (StatSoft, Inc.). Za statisticky významné byly považovány výsledky na 5% hladině významnosti.
VÝSLEDKY
Nejprve byly vyhodnoceny hematologické parametry dárců (tab. 1). Všichni dárci splňovali požadavky způsobilosti k dárcovství. Hladina hemoglobinu byla u všech mužů ≥ 135 g/l, u žen ≥ 125g/l, hodnota hematokritu ≥ 0,40 u mužů a ≥ 0,38 u žen. Muži měli signifikantně vyšší počet erytrocytů, hladinu hemoglobinu a hematokritu než ženy. U žen byly zaznamenány signifikantně vyšší hladiny leukocytů a trombocytů než u mužů. Bez rozdílu mezi pohlavími byly hodnoty středního objemu erytrocytů.
Table 1. Hematologické charakteristiky dárců zařazených do studie 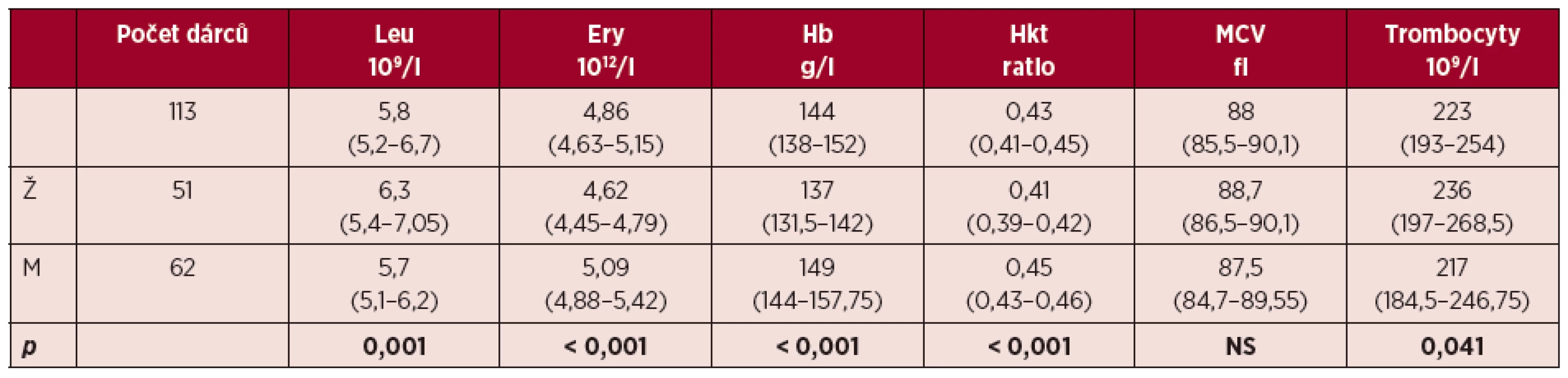
Hodnoty jsou uvedeny jako medián (1. kvartil – 3. kvartil). Ž = ženy; M = muži; Leu = počet leukocytů; Ery = počet erytrocytů; Hb = hemoglobin; Hkt = hematokrit; MCV = střední objem erytrocytů; p = hladina statistické významnosti mezi muži a ženami; NS = nesignifikantní Výsledky měření parametrů metabolismu Fe jsou shrnuty v tabulce 2. V hladinách plazmatického Fe jsme nezaznamenali statisticky významný rozdíl mezi muži a ženami (21,5 vs. 23,3 µmol/l). Hodnota Fe pod dolní hranici normy byla zjištěna pouze u 1 muže dárce; naopak 14 mužů a 11 žen mělo plazmatické Fe mírně zvýšené. Muži měli signifikantně vyšší hladinu feritinu (28 µg/l) než ženy (18 µg/l). Hladinu feritinu pod dolní referenční hodnotu (12 µg/l) jsme zjistili u 6 mužů (9,52 %)a 9 žen (17,64 %).
Na rozdíl od feritinu se hladina hepcidinu mezi oběma pohlavími dárců nelišila (6,61 ng/ml u mužů a 7,14 ng/ml u žen), byla však signifikantně nižší než hladina hepcidinu u kontrolní skupiny (27,6 ng/ml, p < 0,001) [12]. Celkem 58 mužů a 45 žen mělo hladinu hepcidinu pod 1. kvartilem kontrolní skupiny (18 ng/ml); z toho 23 dárců, 18 mužů (28 %) a 5 žen (9,8 %), mělo hladinu hepcidinu sníženou pod detekční limit (2,5 ng/ml). Průměrná hladina feritinu u dárců s hepcidinem pod detekční limit byla signifikantně nižší než u skupiny dárců s měřitelnou hodnotou hepcidinu (17,95 ± 7,46 vs. 32,9 ± 22,32 µg/l).
Table 2. Parametry metabolismu Fe dárců zařazených do studie 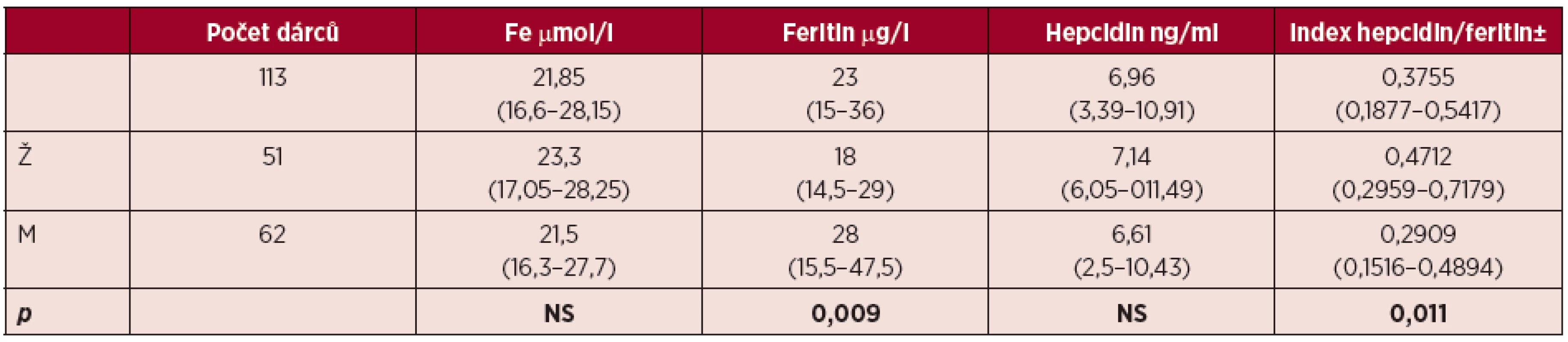
Hodnoty jsou uvedeny jako medián (1. kvartil – 3. kvartil). Referenční meze: Fe (muži 6,6–28; ženy 7,2–29), feritin (12–300)1. Hodnoty kontrolní skupiny, medián (1. kvartil – 3. kvartil): hepcidin 27,6 (18–50,25), index hepcidin/feritin 0,3445 (0,2787–0,3889). Ž = ženy, M = muži, Fe = hladina plazmatického železa, Ref. = referenční meze, p = p-value statistické významnosti mezi muži a ženami, NS = nesignifikantní ± index hepcidin/feritin byl stanoven u dárců s nadprahovou hodnotou hepcidinu U dárců s měřitelnou hodnotou hepcidinu jsme dále stanovovali také poměr hepcidinu k feritinu, který odráží adekvátnost hladiny hepcidinu vzhledem k zásobám Fe. U stavů s narušenou, akcelerovanou a/nebo neefektivní erytropoézou je tento index výrazně snížený díky supresivnímu účinku erytropoetické aktivity na hepcidin [12]. Tento index dosahoval u mužů hodnoty 0,2909; u žen byl 1,6krát vyšší (0,4712), což odpovídá signifikantně nižší hladině feritinu u žen než u mužů (1,6krát); ani v jedné ze skupin se index hepcidin/feritin však signifikantně nelišil od indexu vypočteného pro zdravé kontroly (0,3445) [12]. Tento výsledek ukazuje na fyziologickou erytropoetickou aktivitu u této skupiny dárců krve a na skutečnost, že hladina hepcidinu je u nich fyziologicky snížená vzhledem k nižším zásobám Fe.
Na závěr byla provedena regresní analýza ke zjištění korelace vybraných parametrů krevního obrazu a metabolismu železa s hladinou hepcidinu. U mužů i u žen hladina feritinu pozitivně korelovala s hladinou hepcidinu (tab. 3, obr. 1). Korelaci hladiny hepcidinu s počtem odběrů jsme v našem souboru dárců nezaznamenali (viz tab. 3).
Table 3. Tobit regresní analýza závislosti hladin hepcidinu na vybraných parametrech krevního obrazu a metabolismus železa 
Ž = ženy, M = muži, Ery = erytrocyty, Hb = hemoglobin, Hkt = hematokrit, MCV = střední objem erytrocytů, Trombo = trombocyty, Fe = plazmatické železo Image 1. Graf korelace hladin hepcidinu a feritinu Hladina hepcidinu vykazuje pozitivní korelaci s hladinou feritinu u všech dárců (A) i u obou pohlaví odděleně (B). M = muži; Ž = ženy 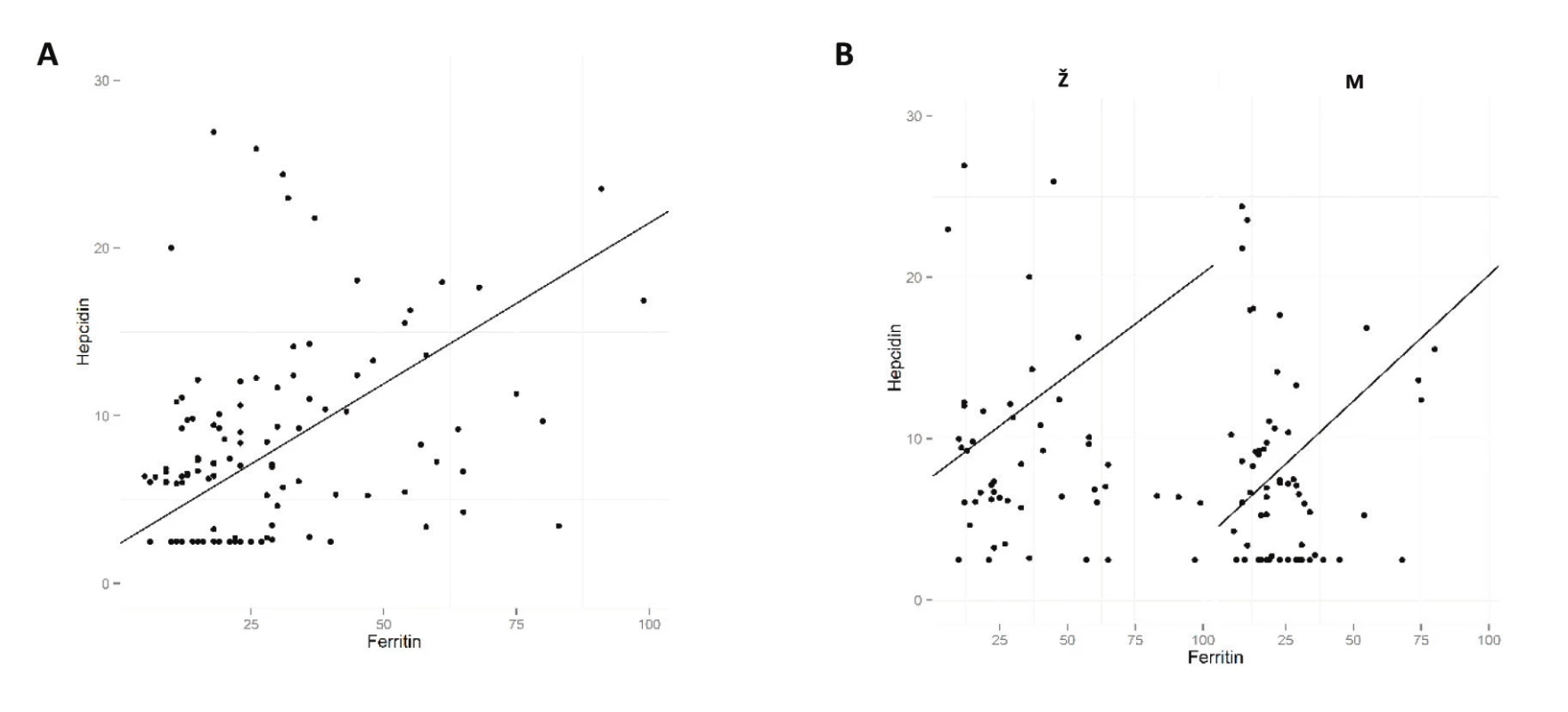
DISKUSE
Česká republika se dlouhodobě potýká s relativním nedostatkem dárců krve. V roce 2013 bylo v České republice celkem 264 000 opakovaných/pravidelných dárců krve a 54 000 prvodárců [17]. Identifikováním dárců krve s vyšším rizikem rozvoje deficitu zásob železa by bylo možné zabránit jejich dočasnému vyřazení nebo ztrátě těchto osob z evidence dárců krve. Ve skupině prvodárců se k odběru během tří let vrátí 70 %, pokud byl odběr realizovaný oproti 21 %, jejichž odběr byl odložen kvůli nízké hladině hemoglobinu. U opakovaných dárců krve je situace obdobná, během tří let se vrátí po odkladu odběru z důvodu nízké hladiny hemoglobinu jen 64 %, ze skupiny dárců bez odkladu se vrací 91 % dárců [18]. Identifikací osob s vysokým rizikem rozvoje deficitu Fe by bylo možné předejít výskytu symptomů souvisejících s deficitem Fe, který je spojený se sníženou fyzickou a pracovní výkonností, zhoršenou schopností se soustředit, zvýšenou únavou a zhoršením ostatních kognitivních funkcí [19, 20, 21], což u nich může vést k rozhodnutí nepokračovat v dárcovství.
Laboratorně lze deficit Fe stanovit několika metodami, které jsou založené na měření hladin feritinu [5], solubilního TfR transferinu a saturace transferinu [7], ZPP [6], všechny však mají své limity. Například feritin je ukazatelem prostých zásob Fe, ale neposkytuje informaci o buněčných potřebách Fe. Solubilní TfR se zvyšuje při nedostatečném přísunu funkčního Fe do buněk, jeho hladina ale současně stoupá se zvýšenou erytropoetickou aktivitou v kostní dřeni [7]. Novým potenciálním markerem by mohl být hepcidin, který kontroluje hladinu Fe v krevním oběhu tím, že reguluje jeho uvolňování ze zásob a příjem z potravy. Navíc vlastní syntéza hepcidinu je regulována jak zásobami Fe a jeho plazmatickou hladinou, tak i aktuální erytropoetickou aktivitou [22], a odráží tak aktuální stav homeostázy železa. U anémie z deficitu železa je hladina hepcidinu výrazně snížená až nedetekovatelná.
Naše výsledky jsou v souladu s dosud publikovanými daty o výskytu deficitu Fe u dárců krve. Nejčastěji užívaným parametrem ke stanovení deficitu Fe je feritin. Studie z posledních let na dárcovské populaci poukazují na častý výskyt snížené hladiny feritinu u dárců krve [5, 23, 24, 25]. Studie Mast et al. ukázala na výhodu kombinované analýzy hladiny feritinu a hepcidinu [26]. U dárců, u kterých byla zjištěna současně nízká hladina feritinu a hepcidinu, došlo při dalším odběru k signifikantnímu snížení hemoglobinu o 5,1 g/l. Izolované snížení hepcidinu nebo feritinu naopak nebylo při následujícím odběru spojeno s poklesem hladiny hemoglobinu [26].
Deficit zásobního Fe se vyskytuje u dárců, kteří byli připuštěni k odběru a mají tedy vyhovující hladiny hemoglobinu, při hodnocení feritinu u 14,3 % mužů a u 8,9 % žen, v případě hepcidinu u 27,4 % mužů a 24,7 % žen [6]. V naší dárcovské populaci byl deficit prostých zásob Fe určený hladinou feritinu podle očekávání nižší u mužů než u žen, což koresponduje s výsledky studie RISE [5]. Zároveň současná analýza hladin hepcidinu pomohla odhalit vyšší podíl dárců potenciálně ohrožených deficitem Fe než samostatné měření feritinu. Překvapivě ale mezi dárci krve s hladinou hepcidinu pod detekčním limitem metody bylo více mužů než žen, což by bylo možné vysvětlit rozdílnou doporučenou frekvencí odběrů u mužů a žen. Velmi nízké hladiny hepcidinu před odběrem prokazují, že tito dárci již mají výrazný deficit železa pro erytropoézu a při další depleci Fe by již nemuseli být schopni pokrýt potřeby organismu. Prezentovaná studie odráží vliv dlouhodobého dárcovství na metabolismus železa a hladinu hepcidinu a statisticky jsme neprokázali korelaci mezi celkovým počtem odběrů a hladinou hepcidinu, proto plánujeme v následné prospektivní studii zhodnotit vliv frekvence odběrů na hladinu hepcidinu a další parametry metabolismu Fe.
Stanovení hladiny hepcidinu u dárců krve tak poskytuje cenné informace o schopnosti dárce zvýšit absorpci Fe ze stravy a uvolnit Fe ze zásob – snižující se hladina hepcidinu vede ke zvýšení absorpce Fe ve střevě a redistribuci Fe ze zásob do aktivního kompartmentu [27]. Hepcidin je vylučován močí, a proto měření jeho hladiny v moči je teoreticky jedinou neinvazivní metodou ke zjištění deficitu Fe [28] a mohlo by eventuálně doplnit již existující testy. Před uvedením vyšetření hladiny hepcidinu do rutinní praxe je však nutná standardizace metody a vytvoření populačních norem. Cena stanovení hladiny hepcidinu v naší laboratoři podle předběžné kalkulace odpovídá přibližně 1,5násobku ceny vyšetření feritinu.
ZÁVĚR
Dárcovství krve je vždy spojeno se zásahem do metabolismu Fe. Při dnešních znalostech by bylo možné minimalizovat důsledky spojené s deficitem tohoto esenciálního prvku. V rámci péče o dárce je důležité identifikovat ty dárce, jejichž kompenzační zvýšení příjmu Fe je nedostačující k obnovení zásob Fe. Hepcidin jako centrální molekula řídící absorpci a redistribuci Fe je velmi užitečný indikátor metabolismu Fe. Stanovení hladiny hepcidinu u dárců, kteří splňují kritéria pro odběr, by v případě dárců s negativní bilancí Fe mohlo zabránit dalšímu prohlubování deficitu Fe. Zavedení měření hladiny hepcidinu hmotnostní spektrometrií může výrazně zpřesnit diagnostiku subklinického deficitu Fe u dárců krve a lze předpokládat, že vzhledem k možnostem, které měření hladin hepcidinu poskytuje, bude se nyní výzkum v oblasti metabolismu Fe zabývat právě optimalizací metod měření hepcidinu a jeho snadnou dostupností.
Podíl autorů
LS – realizace studie, příprava rukopisu
DH, MH – stanovení hladiny hepcidinu
DG, IS – klinické vyšetření dárců
M. Horváthová, DP – interpretace výsledků, revize rukopisu
Poděkování
Práce byla podporována grantem Ministerstva zdravotnictví ČR č. NT13587.
Čestné prohlášení autora
Prohlašuji, že v souvislosti s tématem, vznikem a publikací článku „Metabolismu železa u dárců krve“ nejsem ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Doručeno do redakce: 16. 7. 2015
Přijato po recenzi: 24. 9. 2015
MUDr. Lucie Sulovská
Dětská klinika, FN a LF Univerzity Palackého v Olomouci
I. P. Pavlova 6
779 00 Olomouc
Sources
1. Doig K. Disorders of iron and heme metabolism. In Rodak BF, Fritsma GA, Keohane OA. Hematology: clinical principles and applications. 4. vyd., Elsevier, Missouri, 2012; 271–284.
2. Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science, 2004; 306(5704): 2090–2093.
3. Ganz T, Nemeth E. The hepcidin-ferroportin system as a therapeutic target in anemias and iron overload disorders. Hematology Am Soc Hematol Educ Program, 2011; 2011 : 538–542.
4. Waldvogel-Abramovski S, Waeber G, Gassner C, et al. Iron and transfusion medicine. Blood Rev 2013; 27(6): 289–295.
5. Cable RG, Glynn SA, Kiss JE, et al. NHLBI Retrovirus Epidemiology Donor Study-II. Iron deficiency in blood donors: analysis of enrollment data from the REDS-II Donor Iron Status Evaluation (RISE) study. Transfusion 2011; 51(3): 511–522.
6. Baart AM, de Kort WL, Moons KG, Atsma F, Vergouwe Y. Zinc protoporphyrin levels have added value in the prediction of low hemoglobin deferral in whole blood donors. Transfusion 2013; 53(8): 1661–1669.
7. Pasricha SR, McQuilten ZK, Keller AJ, Wood EM. Hemoglobin and iron indices in nonanemic premenopausal blood donors predict future deferral from whole blood donation. Transfusion 2011; 51(12): 2709–2713.
8. Ganz T, Olbina G, Girelli D, Nemeth E, Westerman M. Immunoassay for human serum hepcidin. Blood 2008; 112(10): 4292–4297.
9. Young MF, Glahn RP, Ariza-Nieto M, et al. Serum hepcidin is significantly associated with iron absorption from food and supplemental sources in healthy young women. Am J Clin Nutr 2009; 89(2): 533–538.
10. Melis MA, Cau M, Congiu R, et al. A mutation in the TMPRSS6 gene, encoding a transmembrane serine protease that suppresses hepcidin production, in familial iron deficiency anemia refractory to oral iron. Haematologica 2008; 93(10): 1473–1479.
11. Macdougall IC, Malyszko J, Hider RC, Bansal SS. Current status of the measurement of blood hepcidin levels in chronic kidney disease. Clin J Am Soc Nephrol 2010 Sep; 5(9): 1681–1690.
12. Mojzikova R, Koralkova P, Holub D, et al. Iron status in patients with pyruvate kinase deficiency: neonatal hyperferritinaemia associated with a novel frameshift deletion in the PKLR gene (p.Arg518fs), and low hepcidin to ferritin ratios. Br J Haematol 2014; 165(4): 556–563.
13. Pospíšilová D, Houda J, Holub D, et al. Význam stanovení hladiny hepcidinu u vybraných typů anémií v dětském věku. Transfuze Hematol dnes 2012; 19(2): 58–65.
14. Kroot JJ, van Herwaarden AE, Tjalsma H, Jansen RT, Hendriks JC, Swinkels DW. Second round robin for plasma hepcidin methods: first steps toward harmonization. Am J Hematol 2012; 87(10): 977–983.
15. Vyhláška MZ ČR č. 143/2008 Sb., o stanovení bližších požadavků pro zajištění jakosti a bezpečnosti lidské krve a jejích složek (vyhláška o lidské krvi).
16. Doporučení Společnosti pro transfuzní lékařství ČLS JEP č. STL2007_03: Posuzování způsobilosti k dárcovství krve a krevních složek, verze 7, 12. 4. 2007, dostupné z: http://www.transfuznispolecnost.cz/index.php?page=dokumenty&identifikator_kategorie=DOPORUCENE_POSTUPY.
17. Výroční zpráva zařízení transfuzní služby 2013, MZ ČR, dostupné z: http://www.mzcr.cz/dokumenty/zprava-o-cinnosti-zarizeni-transfuzni-sluzby-za-rok-2013_9292_1952_3.html.
18. Hillgrove T, Moore V, Doherty K, Ryan P. The impact of temporary deferral due to low hemoglobin: future return, time to return, and frequency of subsequent donation. Transfusion 2011; 51(3): 539–547.
19. Falkingham M, Abdelhamid A, Curtis P, Fairweather-Tait S, Dye L, Hooper L. The effects of oral iron supplementation on cognition in older children and adults: a systematic review and meta-analysis. Nutr J 2010; 9 : 4.
20. Murray-Kolb LE, Beard JL. Iron treatment normalizes cognitive functioning in young women. Am J Clin Nutr 2007 Mar; 85(3): 778–787.
21. Hinton PS. Iron and the endurance athlete. Appl Physiol Nutr Metab 2014; 39(9): 1012–1018.
22. Pak M, Lopez MA, Gabayan V, Ganz T, Rivera S. Suppression of hepcidin during anemia requires erythropoietic activity. Blood 2006; 108(12): 3730–3735.
23. Baart AM, van Noord PA, Vergouwe Y, et al. High prevalence of subclinical iron deficiency in whole blood donors not deferred for low hemoglobin. Transfusion 2013; 53(8): 1670–1677.
24. Rigas AS, Sørensen CJ, Pedersen OB, et al. Predictors of iron levels in 14,737 Danish blood donors: results from the Danish Blood Donor Study. Transfusion 2014; 54 : 789–796.
25. Goldman M, Uzicanin S, Scalia V, O’Brien SF. Iron deficiency in Canadian blood donors. Transfusion 2014; 54(3 Pt 2): 775–779.
26. Mast AE. Low hemoglobin deferral in blood donors. Transfus Med Rev 2014; 28(1): 18–22.
27. Fleming MD. The regulation of hepcidin and its effects on systemic and cellular iron metabolism. Hematology Am Soc Hematol Educ Program 2008 : 151–158.
28. Sanad M, Gharib AF. Urinary hepcidin level as an early predictor of iron deficiency in children: A case control study. Ital J Pediatr 2011; 37 : 37.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2015 Issue 4-
All articles in this issue
- Hereditární amyloidózy – etiologie, klinický obraz a léčba
- Metabolismus železa u dárců krve
- Racionální algoritmus zobrazovacích vyšetření u mnohočetného myelomu v podmínkách České republiky
- Udržovací léčba s rituximabem u starších pacientů s Mantle cell lymfomem v první remisi – zkušenost centra
- Cytomorfologie a imunofenotyp lymfomu z plášťových buněk
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metabolismus železa u dárců krve
- Hereditární amyloidózy – etiologie, klinický obraz a léčba
- Cytomorfologie a imunofenotyp lymfomu z plášťových buněk
- Udržovací léčba s rituximabem u starších pacientů s Mantle cell lymfomem v první remisi – zkušenost centra
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

