-
Medical journals
- Career
Odlišné hladiny asparagin syntetázy nejsou zodpovědné za rozdílnou senzitivitu leukemických blastů k L-Asparagináze
Authors: I. Heřmanová; J. Trka; J. Stárková
Authors‘ workplace: Klinika dětské hematologie a onkologie ; UK 2. LF a FN v Motole, Praha ; CLIP – Childhood Leukemia Investigation Prague
Published in: Transfuze Hematol. dnes,16, 2010, No. 3, p. 133-140.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Akutní lymfoblastická leukemie (ALL), nejčastější maligní onemocnění u dětí, je léčena kombinovanou chemoterapií, která zahrnuje enzym L-Asparaginázu (L-Asp). Cytotoxický efekt L-Asp spočívá ve schopnosti depletovat extracelulární asparagin a glutamin, na což jsou leukemické buňky velmi citlivé pravděpodobně kvůli snížené aktivitě glutamin-dependentního enzymu asparagin syntetázy (ASNS). Ačkoliv bylo se vznikem rezistence na L-Asp spojováno zvýšení hladiny ASNS v leukemických blastech, přesný vztah mezi expresí tohoto genu a citlivostí na L-Asp nebyl dosud objasněn. Pro naši studii byl použit model buněčných linií. Exprese genu pro ASNS a hladina proteinu byla detekována u 4 leukemických buněčných linií: REH (TEL/AML1[+]), UOCB6(TEL/AML1[+]), Nalm6 (TEL/PDGFRB1[+]) a RS4;11 (MLL/AF4[+]). Množství mRNA i proteinu ASNS odpovídalo citlivosti na L-Asp. UOCB6 jako nejvíc rezistentní linie měla nejvyšší expresi ASNS, následovaly linie Nalm6, REH a RS4;11. Detekce proteinu v pacientských vzorcích nebyla možná v důsledku signifikantně nižší exprese studovaného genu ve srovnání s buňkami leukemických linií. S využitím RNA interference bylo provedeno gradientové vypnutí (knock-down) u 2 buněčných linií: REH, se střední bazální expresí ASNS, a RS4;11 s velmi nízkou bazální expresí. Gradientové snižování exprese vedlo ke gradientovému zvyšování senzitivity linie REH. U linie RS4;11 po snížení exprese ASNS ke zvýšení citlivosti k L-Asp nedošlo. Z uvedených výsledků vyplývá, že při velmi nízkých expresích ASNS, které byly stanoveny také u pacientských vzorků, neexistuje přímý vztah mezi odpovědí na L-Asp a mírou exprese zmíněného genu, tudíž v těchto případech nejsou rozdíly v expresi relevantní pro určení vyšší či nižší senzitivity leukemických buněk k L-Asp. Předpokládáme, že novým proteinem hrajícím roli v odpovědi na L-Asp by mohla být glutamát dehydrogenáza (GDH). Umlčením GDH specifickou RNA interferencí došlo u buněk REH ke zvýšení citlivosti k L-Asp, což potvrzuje důležitou roli tohoto genu v reakci TEL/AML1-pozitivních buněk na terapii L-Asp. Navíc na základě zvyšování exprese GDH v buňkách s umlčeným genem pro ASNS předpokládáme vztah mezi těmito dvěma geny. Objasnění mechanismu vzniku rezistence či případné určení markeru rezistence pacientů s ALL k L-Asp by významně pomohlo zlepšit dosavadní terapeutické výsledky.
Klíčová slova:
akutní lymfoblastická leukemie, L-Asparagináza, asparagin syntetázaÚvod
Akutní lymfoblastická leukemie (ALL) je nejčastější hematologická malignita postihující děti a adolescenty (1). V České republice je ročně diagnostikováno okolo 70 nových případů. Počet úspěšně vyléčených pacientů od šedesátých let nesmírně vzrostl. V současné době lze vyléčit více než 80 % dětí s nově diagnostikovanou ALL, u téměř 20 % pacientů však dochází k relapsu (2). Největší nadějí pro další pokrok v této problematice je pochopení podstaty vzniku rezistence na chemoterapii, lepší stratifikace a individualizace léčebných postupů.
Esenciální komponentou moderních léčebných protokolů je L-Asparagináza (L-Asp). Klíčová role tohoto chemoterapeutika byla prokázána v klinických studiích ukazujících přímý vztah mezi úspěchem léčby a dávkou L-Asp (3-5). L-Asp způsobuje depleci asparaginu a glutaminu (6, 7). Za endogenní syntézu asparaginu je zodpovědná asparagin syntetáza (ASNS). Jako aminotransferáza přenáší aminoskupinu z glutaminu na aspartát. V eukaryotických buňkách nevyužívá jiné substráty, je tedy označována jako glutamin-dependentní (8, 9). Leukemické buňky mají v porovnání s buňkami zdravými expresi ASNS sníženou (10, 11). Vznikla tedy hypotéza, potvrzená několika publikacemi (12-14), že za účinkem L-Asp stojí závislost leukemických blastů na extracelulárním asparaginu. Zdravé tkáně jsou dle této teorie schopny ztráty asparaginu kompenzovat díky dostatečně aktivní ASNS, případně zvýšenou expresí tohoto enzymu v odpovědi na asparaginovou depleci. Rezistence na terapii L-Asp byla logicky vysvětlována zvýšením exprese ASNS v leukemických blastech (6). Zdánlivě jednoduchý vztah však zkomplikovala řada nových poznatků. Nan Su a spol. (15) poukázali na skutečnost, že o případné senzitivitě či rezistenci na terapii L-Asp více vypovídá hladina ASNS na proteinové úrovni než na úrovni mRNA, přičemž výše citované práce se zabývaly právě expresí mRNA. Další nesrovnalosti ve vztahu ASNS a L-Asp se ukázaly během studia senzitivity k tomuto léčivu u pacientů s TEL/AML1-pozitivní leukemií. Hybridní gen TEL/AML1 vzniká z translokace t(12;21) (16, 17) a nalézáme ho u 20–24 % dětských pacientů s ALL (18). In vitro testy prokázaly, že TEL/AML1-pozitivní blasty jsou citlivější na L-Asp ve srovnání s blasty TEL/AML1-negativních pacientů (19). Naše pracovní skupina (20) paralelně s holandskou skupinou Stams a spol. (21) publikovala paradoxně zvýšenou expresi ASNS genu u TEL/AML1-pozitivních pacientů. Jiná práce, která zpochybňuje přímý vztah mezi citlivostí na L-Asp a ASNS, byla publikována Finem a spol. (22), kteří prezentují klastrování ALL buněčných linií rezistentních resp. senzitivních k L-Asp na základě bazální exprese ASNS. Klinické vzorky pacientů se však při tomto typu analýzy takto nerozdělily. Dále však po podání L-Asp došlo k velmi podobným změnám exprese velkého množství genů jak ve zmíněných liniích, tak v klinických vzorcích. Je tedy zřejmé, že na účinku L-Asp i na vzniku rezistence se kromě ASNS podílí více faktorů.
V naší práci jsme studovali přímý vztah genu pro ASNS a citlivosti na L-Asp. Zajímalo nás, zda exprese genu odpovídá hladinám proteinu a rozdíly v mRNA ASNS měřené u pacientů mohou vypovídat o rozdílné citlivosti na L-Asp. Popsali jsme účast proteinu glutamát dehydrogenázy (GDH), který pravděpodobně hraje roli v odpovědi na léčbu L-Asparaginázou v souvislosti s regulací syntézy glutaminu.
Materiál a metody
Pacientské vzorky
Mononukleární buňky byly separovány z kostní dřeně a periferní krve centrifugací pomocí hustotního gradientu (Ficoll-Paque Research Grade, PharmaTech). Vzorky byly následně uloženy při -80 °C. Všechny vzorky byly získány v době diagnózy po informovaném souhlasu pacienta.
Buněčné linie
B-prekursorové leukemické buněčné linie REH (TEL/AML1[+], t(12;21)), UOCB6 (TEL/AML1[+]), RS4;11 (MLL/AF4[+]) a Nalm6 (TEL/PDGFRB1[+]), byly zakoupeny u Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH. Buňky byly kultivovány v Roswell Park Memorial Institute (RPMI) 1640 médiu s 2 mM L-glutaminem, 10% fetálním bovinním sérem (FBS) a roztokem antibiotik o koncentraci 10 ml/l (100 U/ml penicilinu, 100 μg/ml streptomycinu). Všechny 4 suspenzní kultury byly drženy při teplotě 37 °C a 5% CO2.
Izolace buněk
Buňky byly shromážděny do zkumavek, kultivační láhve byly propláchnuty phosphate-buffered saline (PBS, pH = 7,4) a 5 minut centrifugovány rychlostí 1000 rpm.
Extrakce RNA a cDNA konverze
Buňky byly promyty PBS, RNA byla izolována RNeasy mini kitem (Qiagen), cDNA byla přepsána reverzní transkriptázou za použití iScript cDNA synthesis kit (Biorad).
Kvantitativní RT-PCR
Kvantitativní polymerázová řetězová reakce v realném čase (RT-PCR) byla provedena na LightCycler® 480 Real-Time PCR System (Roche Diagnostic GmbH, Manheim, Německo) na základě instrukcí od výrobce. ASNS transkript byl detekován pomocí Power Sybr Green PCR master mixu (Applied Biosystems), TaqDNA polymerázy a specifických ASNS a GDH primerů. Sekvence primerů pro ASNS (5´-3´) byla následující: forward primer gCTgACCCACTACAAgTC, reverse primer TCACT-gCCAAACAgCg. Pro detekci GDH byly použity GDH specifické primery o sekvenci (5´-3´): forward CTTTATT-ggTCCTggCATTgA; revers CCCTTggCTgATgggTTTA.
LightCyclerTM rapid thermal cycler system (Roche Diagnostic GmbH, Manheim, Německo) byl použit ke stanovení kontrolního genu β2 microglobulin (β2M). Hodnoty exprese β2M byly použity pro normalizaci expresních dat ASNS a GDH.
Detekce proteinu
Buňky byly dvakrát promyty PBS. Peleta byla resuspendována lyzačním pufrem obsahujícím 1% Triton-X-100, 0,1% sodium dodecylsulfátu, 2 mM kyseliny etylendiamin tetraoctové, 150 mM NaCl, 50 mM Tris-HCl (pH = 7,5), 50 mM NaF, 1 mM Na3VO4, inhibitorový koktejl Complete (Sigma), 1 mM fenylmethylsulfonyl fluorid a 0,002 M MgCl2. Lyzát byl sonikován a centrifugován 3 minuty rychlostí 7500 rpm při teplotě 4 °C, poté byla v supernatantu změřena koncentrace proteinu pomocí Bio-Rad DC protein Assay (Bio-Rad Laboratories) na spektrometru. Pro vytvoření standardní křivky byl použit albumin bovinního séra.
Proteiny byly separovány elektroforeticky v 10% polyakrylamidovém gelu. Po transferu na polyvinylidenovou membránu byla minimalizována nespecifická vazba hodinovým blokováním 5% Blotting Grade Blocker Non-Fat Dry Milk (Bio-Rad). Inkubace v primární protilátce mouse anti-human ASNS (Abcam; Santa Cruz; protilátka z laboratoře Dr. Kilberga - Department of Biochemistry and Molecular Biology, Shands Cancer Center and Center for Nutritional Sciences, University of Florida College of Medicine, Gainesville, Florida, USA) naředěné v poměru 1 : 1000 v 5% Blotting Grade Blocker Non-Fat Dry Milk probíhala přes noc při 4 °C po promytí v roztoku PBS s Tweenem následovala hodinová inkubace v sekundární protilátce antimouse (BioRad). Množství zachyceného proteinu jsme detekovali pomocí směsi SuperSignal West Femto Maximum Sensitivity Substrate a SuperSignal West Pico Chemiluminescent Substrate v poměru 10 : 1 (ThermoScientific) chemoluminiscentně.
Pro kontrolu rovnoměrného nanesení vzorku a stejné koncentrace proteinu v testovaných vzorcích jsme po detekci proteinu ASNS z membrány odstranili použité protilátky 10minutovou inkubací ve stripping pufru (směs 0,5 M NaCL a 0,5 M ledové kyseliny octové), membránu jsme promyli ve směsi roztoku PBS s Tweenem a hodinu inkubovali v nové primární protilátce-mouse anti-human B-aktin (Sigma). Další postup byl shodný s detekcí ASNS.
MTS test
In vitro cytotoxicita L-Asp (Medac) byla stanovena 3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium testem (MTS) (23). Leukemické buňky byly inkubovány v nepřítomnosti či přítomnosti L-Asp o 6 různých koncentracích v triplikátě. Po 72hodinové kultivaci při 37 °C a 5% CO2 byl k buňkám přidán MTS reagens. Po dalších 2 hodinách inkubace bylo spektrofotometricky změřeno množství vznikajícího formazánu a tím stanovena viabilita buněk.
RNA interference (RNAi)
Buňky jsme transfekovali pomocí elektroporátoru (EPI2500 electroporator, Dr. L. Fischer, Heidelberg, Německo) za podmínek: 350 V, 10 ms, 1 pulz. Použité siRNA proti genu ASNS a GDH byly v obou případech směsí 4 siRNA komplementárních k různým sekvencím genu, čímž byla zvýšena úspěšnost umlčení (Dharmacon). Kontrolní buňky byly transfekovány za stejných podmínek siRNA, která nebyla namířena proti žádnému lidskému genu – non-targeted (siNon-T).
Statistická analýza
Všechny experimenty byly prováděny minimálně v triplikátu, ze kterého byla vypočítána průměrná hodnota a změřena směrodatná odchylka. U expresních dat byla stanovena hladina statistické významnosti (p).
Výsledky
Exprese ASNS negativně koreluje se senzitivitou ALL buněčných linií k L-Asp
Metodou qRT-PCR jsme stanovili bazální expresi genu pro ASNS u leukemických linií REH, UOCB6, RS4;11 a Nalm6. Nejvyšší hladinu vykazovala linie UOCB6 (nASNS = 4,946), následovala linie Nalm6 (nASNS = 1,8), REH (nASNS = 1,176) a RS4;11 (nASNS = 0,024). Výsledky byly navzájem signifikantně rozdílné (p < 0,001). Dále jsme u všech čtyř linií detekovali protein ASNS pomocí metody Western Blot. U linií UOCB6, Nalm6 a RS4;11 korelovalo množství proteinu s hladinou mRNA (obr. 1a). Linie REH neměla na proteinové úrovni hladinu ASNS v různých časových bodech stabilní, což jsme prokázali Western Blotem pěti vzorků odebraných ve 24hodinových intervalech (data neukázána). Z expresních dat linie REH vyplývá, že transkripce genu se zvyšovala stejně jako u linie Nalm6, předpokládáme proto, že docházelo k pomalému nástupu translace. Hlavním tématem této práce je senzitivita ALL buněk k L-Asp. Stanovili jsme tedy citlivost linií k tomuto léčivu pomocí MTS cytotoxického testu (obr. 1b). Koncentrace použité L-Asp byla 0-4 U/ml (cL-Asp= 0-4 U/ml). Potvrdili jsme vztah popsaný v dřívějších publikacích o negativní korelaci exprese genu pro ASNS a citlivosti k L-Asp (24). Nejnižší citlivost byla prokázána u linie UOCB6 (IC50 = 0,04 U/ml), dále u linie Nalm6 (IC50 = 0,01 U/ml), REH (IC50= 0,6 x 10-4 U/ml) a RS4;11 (IC50 = 0,3 x 10-4 U/ml).
Image 1. 1a. Rozdílná bazální hladina genu pro ASNS u ALL buněčných linií stanovená pomoci qRT-PCR. Množství proteinu ASNS detekované metodou Western Blot. 1b. Výsledek MTS cytotoxického testu ukazující rozdílnou citlivost jednotlivých buněčných linií k L-Asp. 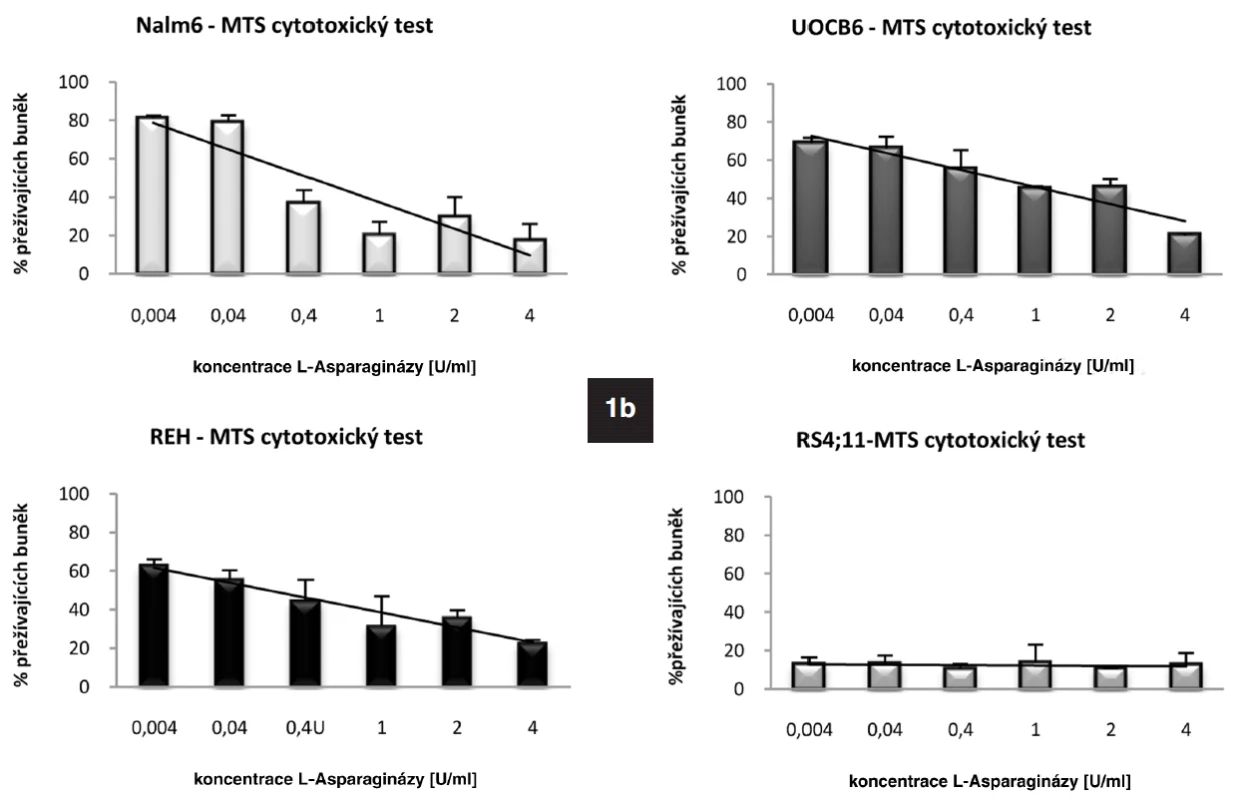
Exprese ASNS v klinických vzorcích je signifikantně nižší než u ALL buněčné linie REH
V dalším experimentu jsme se zaměřili na určení proteinových hladin v ALL klinických vzorcích. Navzdory použití tří různých primárních protilátek specifických pro ASNS (SantaCruz, Abcam a protilátka z laboratoře Dr. Kilberga) a precizní optimalizaci se nám u pacientských vzorků, na rozdíl od vzorků buněčných linií, nepodařilo detekovat protein ASNS. Pomocí qRT-PCR jsme potvrdili, že bazální exprese genu pro ASNS v ALL pacientských vzorcích je signifikantně nižší (2 řády; p < 0,001) než u linie REH, což může vysvětlovat ztíženou detekci proteinu (obr. 2).
Image 2. Protein ASNS detekovaný metodou Western Blot u buněčné linie Hela. U klinických vzorků nebyla detekce úspěšná, P1, P2 a P3 – označení pro pacientské vzorky. Bazální hladiny genu pro ASNS stanovené pomocí qRT-PCR u linie REH a dvou klinických vzorků. 
Elektroporace siRNA specifické pro ASNS způsobila pokles exprese ASNS na mRNA i proteinové úrovni
siRNA specifickou pro ASNS (siASNS) jsme použili pro transfekci buněk linií REH a RS4;11, které mají střední a velmi nízkou bazální expresi ASNS. Koncentrace siRNA byla 6,25 μmol na 2 x 106 buněk. Po 24hodinové inkubaci jsme ověřili hladiny ASNS pomocí qRT-PCR. Jako kontrola byly použity buňky transfekované siRNA, která nebyla mířená proti žádnému lidskému genu, „non-targeted“ (siNon-T). U obou linií došlo k signifikantnímu poklesu exprese ASNS. U linie REH byla exprese snížena na 18 %, u linie RS4;11 na 29 % v porovnání s buňkami transfekovanými siNon-T (obr. 3a, b). U buněčné linie REH jsme navíc sledovali i proteinovou úroveň ASNS 48 h; 72 h a 96 h po transfekci. Ve všech třech časových bodech byla redukce ASNS proteinu signifikantní (obr. 3a).
Image 3. Exprese genu pro ASNS u linie REH a RS4;11 po specifickém umlčení tohoto genu metodou RNA-interference. Western Blot potvrzující úspěšnost umlčení genu pro ASNS na proteinové úrovni u linie REH. 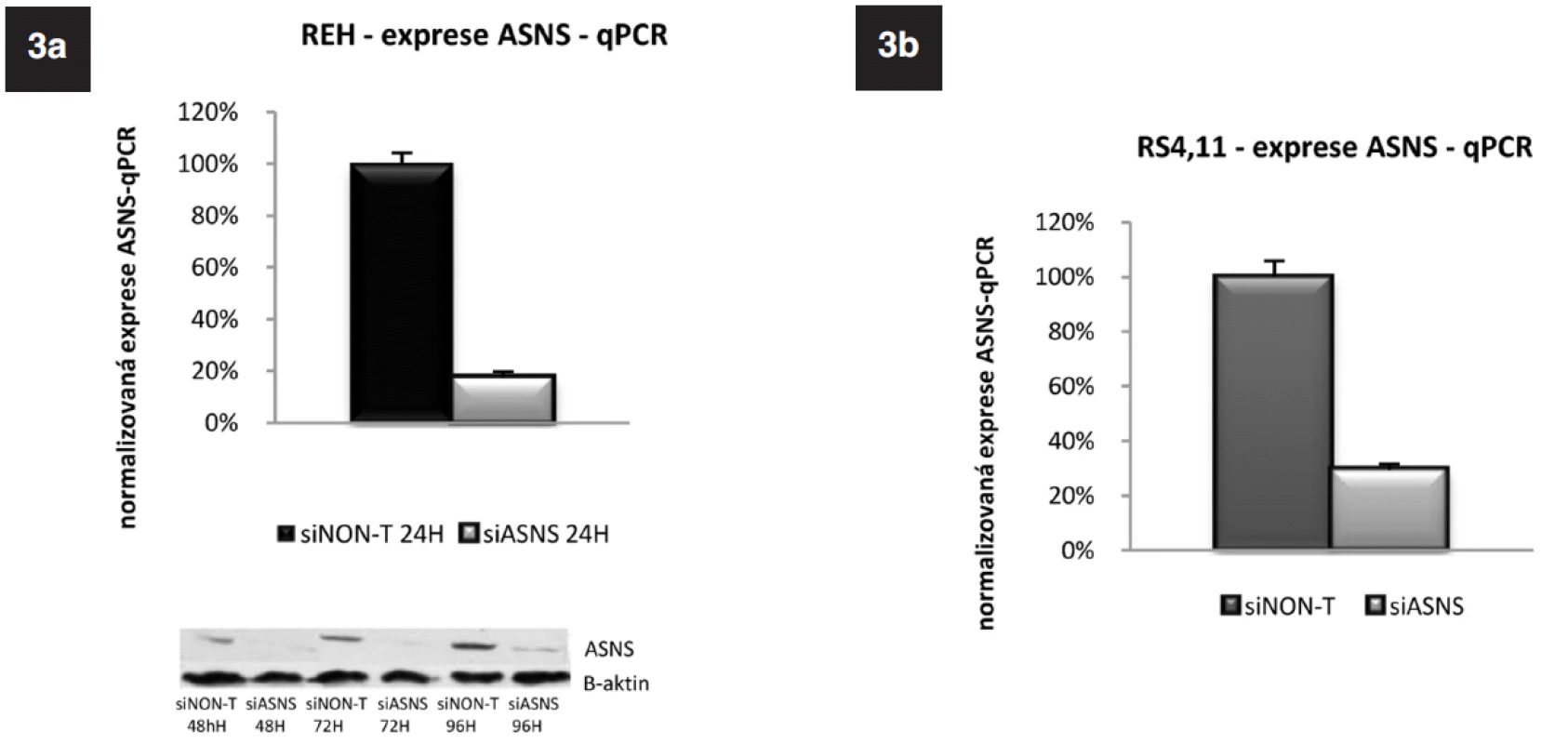
Gradientové snížení exprese ASNS potencuje cytotoxický efekt L-Asp pouze u linie se střední bazální expresí tohoto genu, a to jen do 50% poklesu ASNS
Pro objasnění vztahu mezi mírou exprese ASNS a citlivostí k L-Asp jsme u linií REH a RS4;11 gradientově snížili hladinu tohoto genu pomocí RNA interference (RNAi) a sledovali cytotoxický efekt L-Asp. Provedli jsme transfekci siRNA proti ASNS genu o koncentraci 0,78 μmol; 1,56 μmol; 3,13 μmol; 6,25 μmol; 9,38 μmol a 12,50 μmol na 2 x 106 buněk do buněk linie REH. Po 24hodinové inkubaci jsme ověřili expresi ASNS pomocí qRT-PCR. V porovnání s buňkami s transfekcí siNon-T došlo ke snížení exprese ASNS postupně na 95 % (p = 0,6991), 74 % (p = 0,0919), 56 % (p = 0,0148), 56 % (p = 0,0149), 44 % (p = 0,0041) a 35 % (p = 0,0020) (obr. 4a). Následný MTS cytotoxický test (cL-Asp = 0-1 U/ml) ukázal, že senzitivita k L-Asp negativně koreluje s expresí ASNS do 50 % poklesu, další snižování exprese již senzitivitu k L-Asp nepotencovalo (obr. 4b). Provedli jsme transfekci siRNA proti ASNS o koncentraci 0,78 μmol; 1,56 μmol a 3,13 μmol na 2 x 106 buněk do buněk linie RS4;11. Po 24hodinové inkubaci jsme stanovili expresi mRNA. Došlo k její signifikantní gradientové redukci na hodnoty 94 % (p = 0,3), 53 % (p = 0,01) a 45 % (p = 0,001) v porovnání s kontrolou (obr. 4c). MTS cytotoxický test (obr. 4d) (cL-Asp=0-0,03125 U/ml) však neprokázal zvýšení citlivosti k L-Asp.
Image 4. 4a. Exprese genu pro ASNS u linie REH po gradientovém umlčení tohoto genu metodou RNA-interference po 24 hodinách. 4b. Výsledek MTS cytotoxického testu REH buněk s gradientově umlčeným genem pro ASNS. 4c. Exprese genu pro ASNS u linie RS4;11 po gradientovém umlčení tohoto genu metodou RNA-interference po 24 hodinách. 4d. Výsledek MTS cytotoxického testu RS4;11 buněk s gradientově umlčeným genem pro ASNS. 
Vypnutí (knock-down) genu pro GDH vedlo ke zvýšení citlivosti k L-Asp
ASNS je glutamin-dependentní enzym. Na syntéze glutaminu se podílí glutamát-dehydrogenáza (GDH). Analýzou „microarrayových“ dat jsme získali informaci o nižší expresi tohoto genu u TEL/AML1-pozitivních pacientů v porovnání s pacienty TEL/AML1-negativními, kterou jsme v naší předchozí práci potvrdili pomocí qRT-PCR (25). Zajímalo nás, zda u ALL buněčné linie dojde poklesem exprese GDH k ovlivnění citlivosti k L-Asp, proto jsme u buněk REH provedli specifické vypnutí tohoto genu využitím RNAi. Na obrázku 5a jsou výsledky qRT-PCR po 24hodinové inkubaci „transfekovaných“ buněk. Elektroporací siRNA specifické pro GDH o koncentraci 6,25 μmol na 2 x 106 buněk došlo ke snížení exprese mRNA na 43 % (p = 1,2 x 10-7). MTS cytotoxickým testem (obr. 5b) (cL-Asp=0-0,002 U/ml) jsme potvrdili nárůst citlivosti těchto buněk k L-Asp oproti buňkám kontrolním, u kterých k umlčení genu pro GDH nedošlo. Velmi zajímavá byla také opakovaně znatelná tendence ke zvyšování exprese GDH, kterou jsme sledovali jak u linie REH, tak u linie RS4;11 po umlčení genu pro ASNS. Tento jev potvrzuje důležitou úlohu GDH v odpovědi ALL buněk na terapii L-Asp (Data neukázána).
Image 5. 5a. Exprese genu pro GDH u linie REH po gradientovém umlčení tohoto genu metodou RNA-interference po 24 hodinách. 5b. Výsledek MTS cytotoxického testu REH buněk s gradientově umlčeným genem pro GDH. 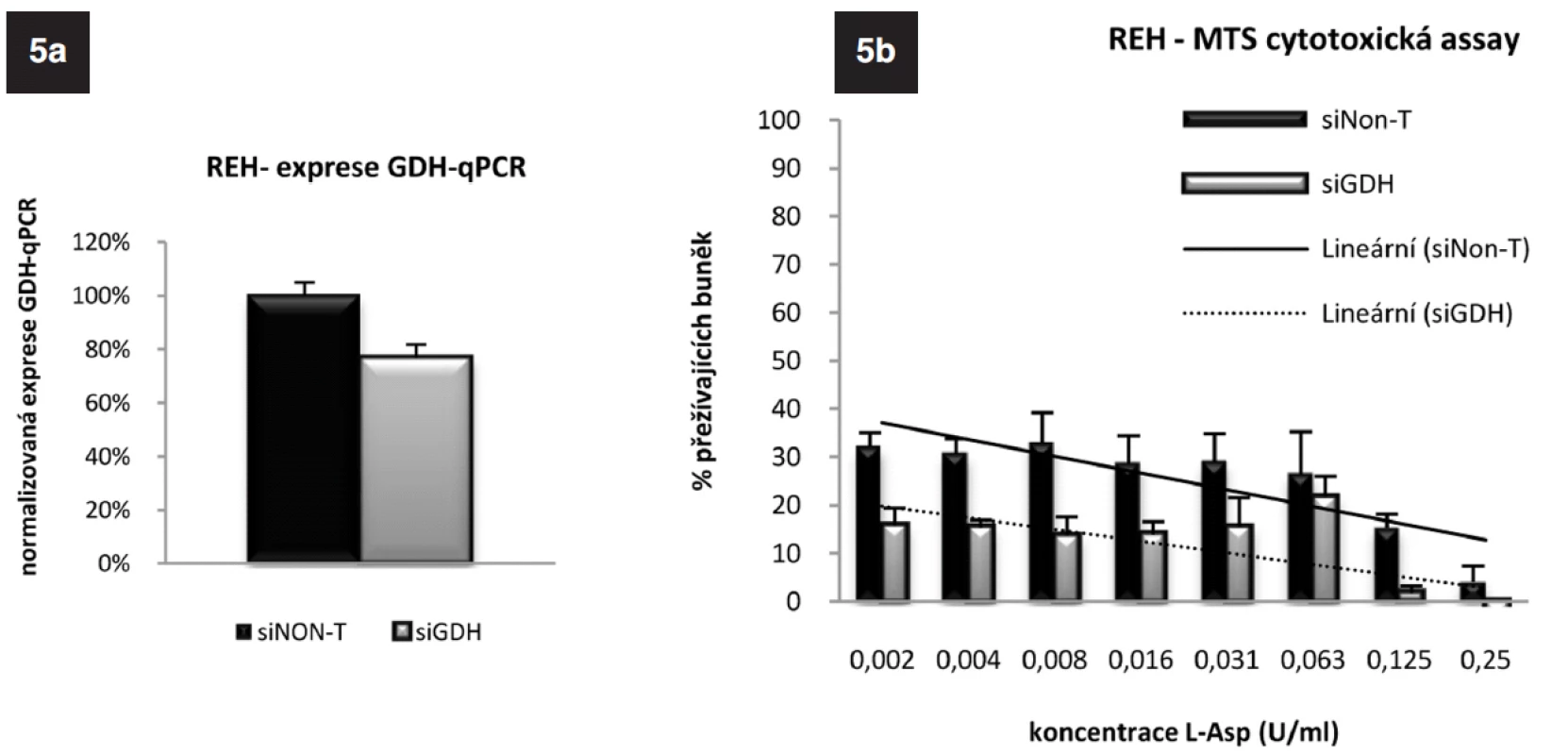
Diskuse
L-Asparagináza představuje účinnou a esenciální složku terapie dětské ALL. Rezistence na tuto látku vede k nepříznivé prognóze (3–5). Hypotéza o zodpovědnosti ASNS za uvedený fenomén vznikla na základě předpokládaného mechanismu účinku tohoto léčiva: leukemické blasty nejsou schopny, na rozdíl od zdravých buněk, kompenzovat depleci aminokyselin způsobenou podáním L-Asp kvůli nedostatku enzymu syntetizujícího asparagin. Výsledky potvrzující tuto teorii byly získány především studiem leukemických linií (14, 26–30). Jako příklad můžeme uvést práci Aslaniana a spol. (30), kteří nejen ověřili již publikovanou informaci (26) o zvýšení hladiny genu, proteinu i aktivity ASNS u leukemické linie MOLT-4 po podání L-Asp, ale navíc dokázali, že samotné zvýšení exprese ASNS vede k rezistentnímu fenotypu. Pouze jedna práce potvrdila obdobné výsledky i na klinických vzorcích. Haskell a spol. (31) popsali u pěti pacientů rezistentních na L-Asp zvýšenou enzymatickou aktivitu ASNS v porovnání se čtyřmi pacienty senzitivními. Výpovědní hodnota publikovaných dat je však nízká. Kromě omezeného počtu vzorků nebyla vysvětlena kritéria určení senzitivity či rezistence. Navíc byla tato studie provedena na heterogenní skupině, zahrnující i dospělé pacienty jak s akutní, tak chronickou leukemií.
Další analýzy klinických vzorků přímý vztah mezi rezistencí k L-Asp a zvýšenou hladinou ASNS nepotvrdily. Paralelně se Stams a spol. (21) naše pracovní skupina publikovala článek o paradoxně zvýšené expresi ASNS u TEL/AML1-pozitivních pacientů v porovnání s TEL/AML1-negativními (20); přičemž právě TEL/AML1-pozitivní pacienti mají lepší prognózu (20). Tyto výsledky byly zpočátku interpretovány jako anomálie způsobená přítomností fúzního genu (32). Z dalších prací (22) zpochybňujících vliv ASNS na vznik rezistence však vyplývá, že šlo o vyvrácení 35 let staré teorie o přímém vlivu hladiny ASNS na cytotoxický efekt L-Asp.
My jsme se na tento vztah opět zaměřili s cílem vysvětlit přetrvávající nejasnosti. Sledovali jsme změny senzitivity ALL linií k L-Asp po snížení exprese genu pro ASNS. Poklesem studovaného genu došlo u linie REH ke zvýšení citlivosti k L-Asp. U linie RS4;11, která má výrazně nižší bazální expresi ASNS než linie REH, k ovlivnění odpovědi po poklesu exprese ASNS nedošlo.
Nan Su a spol. (15) ve své práci upozornili na důležitost detekce proteinu ASNS, který s citlivostí k L-Asp koreloval u buněčných linií lépe než hladina mRNA. U klinických vzorků můžeme o stejné preferenci zatím pouze spekulovat, protože množství proteinu je tak nízké, že jej nelze metodou Western Blot spolehlivě detekovat. Ve zmíněném článku Nan Su a spol. se to podařilo pouze u jednoho pacienta z deseti, nám se to nepodařilo u žádného. Nicméně z našich výsledků je patrné, že při tak nízkých expresích, které byly prokázány u linie RS4;11, nelze považovat různé hladiny ASNS za znak rezistence či senzitivity. Tyto rozdíly se nemohou projevit v biologické odpovědi na terapii L-Asp. ASNS jistě hraje důležitou roli v mechanismu účinku L-Asp, ale ne jako jediný činitel. Pro pochopení tohoto komplexního děje je nutné zaměřit se i na jiné členy kaskády syntézy asparaginu a glutaminu. Fine a spol. (22) popsali, že exprese ASNS v klinických vzorcích, na rozdíl od vzorků leukemických linií, nekorelovala s rozdílnou citlivostí na L-Asp. V jiných znacích se však oba modely shodovaly. Patel a spol. (33) popsali inhibiční působení dvou lysosomálních cysteinových proteáz: asparaginyl endopeptidázy a cathepsinu B na účinek L-Asp. U T-ALL byl zase prokázán efekt argininosukcinát syntázy 1 (34). Další práce poukazují na transmembránový protein ASCT1 (30). V naší studii jsme upozornili na jiný protein - GDH, který má významnou roli v odpovědi leukemických buněk na terapii L-Asp.
GDH katalyzuje oxidační deaminaci kyseliny glutamové na 2-oxoglutarát za uvolnění amonného kationtu, který slouží jako zdroj dusíku pro syntézu glutaminu. Glutamin je jediný substrát ASNS. Narušením jeho syntézy se poškodí i tvorba asparaginu. Snížená exprese genu pro GDH u TEL/AML-1 pozitivních pacientů a zvýšená citlivost buněk k L-Asp s vypnutím tohoto genu potvrzuje význam GDH v reakci na terapii L-Asp. U buněk s umlčeným genem pro ASNS jsme navíc pozorovali tendenci ke zvyšování exprese GDH.
Domníváme se, že jde o kompenzaci nízké hladiny ASNS, kvůli které má deplece aminokyselin cytotoxický efekt.
L-Asp se v terapii ALL používá již od sedmdesátých let minulého století. Stále však není znám přesný mechanismus rezistence ani účinku. Jeho odhalení by významně zlepšilo dosavadní terapeutické postupy i prognózu leukemických pacientů.
Poděkování: Práce byla podpořena granty MSM0021620813 a GAUK 83507.
Doručeno do redakce: 15. 3. 2010
Přijato po recenzi: 30. 3. 2010
Mgr. Ivana Heřmanová
Klinika dětské hematologie a onkologie
UK v Praze 2. LF a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: ivana.hermanova@lfmotol.cuni.cz
Sources
1. Pui CH, Evans WE. Acute lymphoblastic leukemia. N Engl J Med 1998; 339 : 605-615.
2. Pui CH, Evans WE. Treatment of acute lymphoblastic leukemia. N Engl J Med 2006; 354 : 166-178.
3. Jaffe N, Traggis D, Das L, et al. L-Asparaginase in treatment of neoplastic diseases in children. Cancer Res 1971; 31 : 934-949.
4. Sutow WW, Garacia F, Starling KA, Williams TE, Lane DM, Gehan EA. L-Asparaginase therapy in children with advanced leukemia. Cancer 1971; 28 : 819-824.
5. Tallal L, Tan C, Oettgen H, et al. E. coli L-asparaginase in the treatment of leukemia and solid tumors in 131 children. Cancer 1970; 25 : 306-320.
6. Chakrabarti R, Schuster SM. L-Asparaginase. Perspectives on the mechanisms of action and resistance. Int J Pediatric Hematol Oncol 1996; 4 : 597-611.
7. Muller HJ, Boos J. Use of L-asparaginase in childhood ALL. Crit Rev Oncol Hematol 1998; 28 : 97-113.
8. Chen H, Pan YX, Dudenhausen EE, et al. Amino acid deprivation induces the transcription rate of the human asparagine synthetase gene through a timed program of expression and promoter binding of nutrient-responsive bZIP transcription factors as well as localized histone acetylation. J Biol Chem 2004; 279 : 50829-50839.
9. Kilberg MS, Pan YX, Chen H, et al. Nutritional control of gene expression: How mammalian cells respond to amino acid limitation. Annu Rev Nutr 2005; 25 : 59-85.
10. Asselin BL, Kurtzburg J. Asparaginase. In: Pui C-H, editor. Treatment of acute leukemias. Totawa, NJ: Humana Press; 2003 : 365-379.
11. Rizzari C. Asparaginase treatment. In: Pui C-H, editor. Treatment of acute leukemias. Towata, NJ: Humana Press; 2003. 381-391.
12. Richards NG, Kilberg MS. Asparagine synthetase chemotherapy. Ann Rev Biochem 2006; 75 : 629-654.
13. Richards NG, Schuster SM. Mechanistic issues in asparagine synthetase catalysis. Adv Enzymol Relat Areas Mol Biol 1998; 72 : 145-198.
14. Kiriyama Y, Kubota M, Takimoto T, et al. Biochemical characterization of U937 cells resistant to L-asparaginase: The role of asparagine synthetase. Leukemia 1989; 3 : 294–7.
15. Su N, Pan YX, Zhou M, Harvey RC, Hunger SP, Kilberg MS. Correlation between asparaginase sensitivity and asparagine synthetase protein content, but no mRNA, in acute lymphoblastic cell lines. Pediatr Blood Cancer 2008; 50 : 274-279.
16. Wang L, Hiebert SW. TEL contacts multiple co-repressors and specifically associates with histone deacetylase-3. Oncogene 2001; 20 : 3761-3725.
17. Zuna J. The role of TEL and AML1 genes in the pathogenesis of hematologic malignancies. Cas Lek Cesk 2001; 140 : 131-137.
18. Zuna J, Hrusak O, Kalinova M, Muzikova K, Stary J, Trka J. TEL/AML1 positivity in childhood ALL: average or better prognosis? Czech Paediatric Haematology Working Group. Leukemia 1999, 13 : 22-24.
19. Ramakers-van Woerden NL, Pieters R, Loonen AH, et al. TEL/AML1 gene fusion is related to in vitro drug sensitivity for L-Asparaginase in childhood acute lymphoblastic leukemia. Blood 2000; 96 : 1094-1099.
20. Krejci O, Starkova J, Otova B, Madzo J, Kalinova M, Hrusak O, Trka J. Upregulation of asparagine synthetase fails to avert cell cycle arrest induced by L-Asparaginase in TEL/AML1-positive leukaemic cells. Leukemia 2004; 18 : 434-441.
21. Stams WA, den Boer ML, Beverloo HB, et al. Sensitivity to l-asparaginase is not associated with expression levels of asparagine synthetase in t(12,21)+ pediatric ALL. Blood 2003; 101 : 2743-274.
22. Fine BM, Kaspers GJL, Ho M, Loonen AH, Boxer LM. A genome wide view of the in vitro response to l-asparaginase in acute lymphoblastic leukemia. Cancer Res 2005; 65 : 291-299.
23. O’Toole SA, Sheppard BL, McGuinness EPJ, Gleeson NC, Yoneda M, Bonnar JJ. The MTS assay as an indicator of chemosensitivity/resistance in malignant gynaecological tumours. Cancer Detection and Prevention 2003; 27 : 47-54
24. Scherf U, Ross DT, Waltham M, et al. A gene expression database for the molecular pharmacology of cancer. Nat Genet 2000; 24 : 236-244.
25. Starková J, Krejčí O, Otová B, et al. TEL/AML1 spustením metabolického stresu zvyšuje citlivosť leukemických buniek na L-Asparaginázu. Transfuze Hematol dnes 2006; 12 : 70-75.
26. Hutson RG, Kitoh T, Amador DAM, Cosic S, Schuster SM, Kilberg MS. Amino acid control of asparagine synthetase : relation to asparaginase resistance in human leukemia cells. Am J Physiol 1997; 272: C1691-C1699.
27. Prager MD, Bachynsky N. Asparagine synthetase in asparaginase resistant and susceptible mouse lymphomas. Biochem Biophys Res Commun 1968; 31 : 43-47.
28. Worton KS, Kerbel RS, Andrulis IL. Hypomethylation and reactivation of the asparagine synthetase gene induced by L-asparaginase and ethyl methanesulfonate. Cancer Res 1991; 51 : 985-989.
29. Martin JK, Sun W, Maraga D, Schuster SM, Wylie DE. An investigation into the mechanism of L-asparaginase resistance in L5178Y murine leukemia cells. Amino Acids 1993; 5 : 51-69.
30. Aslanian AM, Fletcher BS, Kilberg MS. Asparagine synthetase expression alone is sufficient to induce L-Asparaginase resistance in MOLT-4 human leukemia cells. Biochem J 2001; 357 : 321-328.
31. Haskell CM, Canellos GP. L-Asparaginase resistance in human leukemia-asparagine synthetase. Biochem Pharm 1969; 18 : 2578-2580.
32. Stams WAG, den Boer ML, Holleman A, et al. Asparagine synthetase expression is linked with L-Asparaginase resistance in TEL-AML-negative but not TEL-AML-positive pediatric acute lymphoblastic leukemia. Blood 2005; 105 : 4223-4225.
33. Patel N, Krishnan S, Offman MN, et al. A dyad of lymphoblastic lysosomal cysteine proteases degrades the antileukemic drug L-asparaginase. J Clin Invest 2009; 119 : 1964-1973.
34. Estes DA, Lovato DM, Khawaja HM, Winter SS, Larson RS. Genetic alterations determine chemotherapy resistance in childhood T-ALL: modeling in stage-specific cell lines and correlation with diagnostic patient samples. Br J Haematol 2007; 139 : 20-30.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2010 Issue 3-
All articles in this issue
- Globální hodnocení funkce hemostázy – část II. Vlastní zkušenosti s použitím trombin generačního testu u pacientů s trombofilií
- Přínos režimu CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
- Odlišné hladiny asparagin syntetázy nejsou zodpovědné za rozdílnou senzitivitu leukemických blastů k L-Asparagináze
- Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
- Folikulární lymfom a význam nádorového mikroprostředí
- Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
- Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
- Folikulární lymfom a význam nádorového mikroprostředí
- Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
- Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



