-
Medical journals
- Career
Mukozitida dutiny ústní po alogenní transplantaci krvetvorných buněk s přípravou fludarabinem a melfalanem FLU/MEL
Authors: S. Vokurka; J. Škardová; K. Kabátová-Maxová; K. Steinerová; M. Karas
Authors‘ workplace: Hematologicko-onkologické odd., Fakultní nemocnice v Plzni
Published in: Transfuze Hematol. dnes,15, 2009, No. 1, p. 13-16.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Alogenní transplantace krvetvorných buněk s redukovanou intenzitou přípravného protokolu jsou alternativou léčby starších a předléčených pacientů z důvodu celkově nižší toxicity. Byla sledována mukozitida dutiny ústní (MDÚ) u 71 pacientů transplantovaných po přípravě FLU/MEL o celkové dávce fludarabinu 120 mg/m2 a melfalanu 140 mg/m2. MDÚ se rozvinula u 78 % pacientů a přetrvávala s mediánem 12 (1–34) dní. Vyšší riziko postižení bylo prokázáno u žen a dále u pacientů s dávkou melfalanu ≥ 3,5 mg/kg hmotnosti pacienta. Ve smyslu toxického postižení sliznic dutiny ústní nelze protokol FLU/MEL považovat za málo zatěžující. Obecně doporučovaná kryoterapie by měla být zahrnuta u tohoto protokolu jako základní profylaktická intervence omezující toxicitu v oblasti dutiny ústní.
Klíčová slova:
mukozitida, dutina ústní, alogenní transplantace, melfalan, toxicitaÚvod
Alogenní transplantace krvetvorných buněk s redukovanou intenzitou přípravy jsou alternativou léčby hematologických malignit u starších a předléčených pacientů, u kterých by transplantace s klasickou intenzivní konvenční přípravou nebyla proveditelná z důvodu výrazné celkové toxicity. Mezi charakteristické komplikace související s toxicitou předtransplantační přípravy patří mukozitida dutiny ústní (MDÚ). Její incidence u konvenčních alogenních transplantací dosahuje až 100 %, významně negativně ovlivňuje kvalitu života pacienta a průběh léčby (1, 2).
Mezi předtransplantační přípravné režimy zahrnované mezi protokoly s redukovanou intenzitou přípravy (zatím však bez jednoznačně vyřešené otázky svého myeloablativního potenciálu) patří režim FLU/MEL využívající kombinace fludarabinu v celkové dávce 125–150 mg/m2 a melfalanu 140–180 mg/m2. Protokol se jeví jako dostatečně účinný v případě hematologických malignit starších i předléčených pacientů, je dostatečně imunoablativní k zajištění přihojení štěpu a je doprovázen minimem toxických fatálních komplikací (3–8). I zde však byla některými autory pozorována klinicky nezanedbatelná slizniční toxicita v oblasti dutiny ústní (4, 7), nicméně jde o sledování spíše okrajová a obecná, když dominantním záměrem bývá především ověření přihojení štěpu, doby do progrese nebo relapsu nemoci, celkové přežití a výskyt reakce štěpu proti hostiteli (GVHD). Cílem této práce je specifikovat charakteristiky mukozitidy dutiny ústní v rámci tohoto protokolu.
Metodika a soubor
Pacienti a léčba
Prospektivní sledování pacientů našeho centra v období 1/2005–12/2007, u kterých byla zahájena příprava k alogenní transplantaci krvetvorných buněk podle protokolu FLU/MEL (fludarabin 30 mg/m2/den i.v. v den -5, -4, -3, -2, melfalan 140 mg/m2/den i.v. v den -1). Pacienti podepsali s léčbou a sledováním informovaný souhlas.
Péče o dutinu ústní
Ošetřování zahrnovalo vyplachování úst 4x denně (při mukozitidě i častěji) s roztoky volenými s ohledem na přání pacienta – standardně byly nabízeny přípravky s chlorhexidinem, benzydaminem, fyziologický roztok, roztok s lokálním anestetikem (trimecain) nebo šalvějí. Chrup byl čištěn měkkými kartáčky po hlavním jídle. Při krvácivosti dásní nebo bolestivosti byly k čištění doporučeny pouze roztoky. Snímatelné zubní náhrady byly odkládány během noci, při péči o dutinu ústní a při mukozitidě. Amifostin, palifermin ani lokální kryoterapie nebyly u pacientů v rámci profylaxe zavedeny.
Další podpůrná péče
Pacienti byli umístěni na jednolůžkovém pokoji s účinnou filtrací vzduchu HEPA filtry a byli ošetřováni v režimu ochranné (reverzní) izolace. Transfuze erytrocytů a trombocytů byly vždy deleukotizované a ozářené v dávce 25 Gy. Filgrastim v dávce 5 μg/kg/den byl aplikován od dne +5. V rámci GVHD profylaxe byl podáván cyklosporin A od dne -1 v kombinaci s metotrexátem 10 mg/m2 i.v. v den +1, 3 a 6 se zajištěním aplikace leukovorinu. Do doby přihojení štěpu byly podávány chinolony a v dalším období pak amoxicilin-klavulanát nebo cefuroxim, a trimethoprim-sulfomethoxazol. Po dobu imunosupresivní léčby byl podáván také acyklovir a fluconazol. Byla uplatňována pre-emptivní léčba cytomegalovirové infekce ganciclovirem.
Monitorování a hodnocení
Sledování stavu dutiny ústní v oblasti sliznic rtů, bukálně, na jazyku a patře probíhalo denně od zahájení předtransplantační přípravy. Tíže MDÚ byla hodnocena podle WHO kritérií se stupni postižení 0 až 4 (0 = žádné, 1 = bolest a zarudnutí, 2 = defekty a možnost jíst tuhou potravu, 3 = defekty a možnost pouze tekutin a kaší, 4 = příjem nemožný pro mukozitidu). Počet dnů parenterální výživy nebyl sledován.
Statistika
Porovnání charakteristik souborů bylo provedeno s využitím programu GraphPad InStat – Statistica Software a byly použity základní statistické testy Mann-Whitney, Fisher a t-test. Rozdíly mezi skupinami byly testovány na hladině významnosti 95 % a hodnoty p < 0,05 byly považovány za staticky významné.
Výsledky
V období 1/2005–12/2007 bylo do sledování zařazeno a následně hodnoceno 71 pacientů alogenně transplantovaných po přípravě FLU/MEL. Bližší charakteristiky souboru jsou uvedeny v tabulce 1.
Table 1. Charakteristiky souboru pacientů s předtransplantační přípravou FLU/MEL. 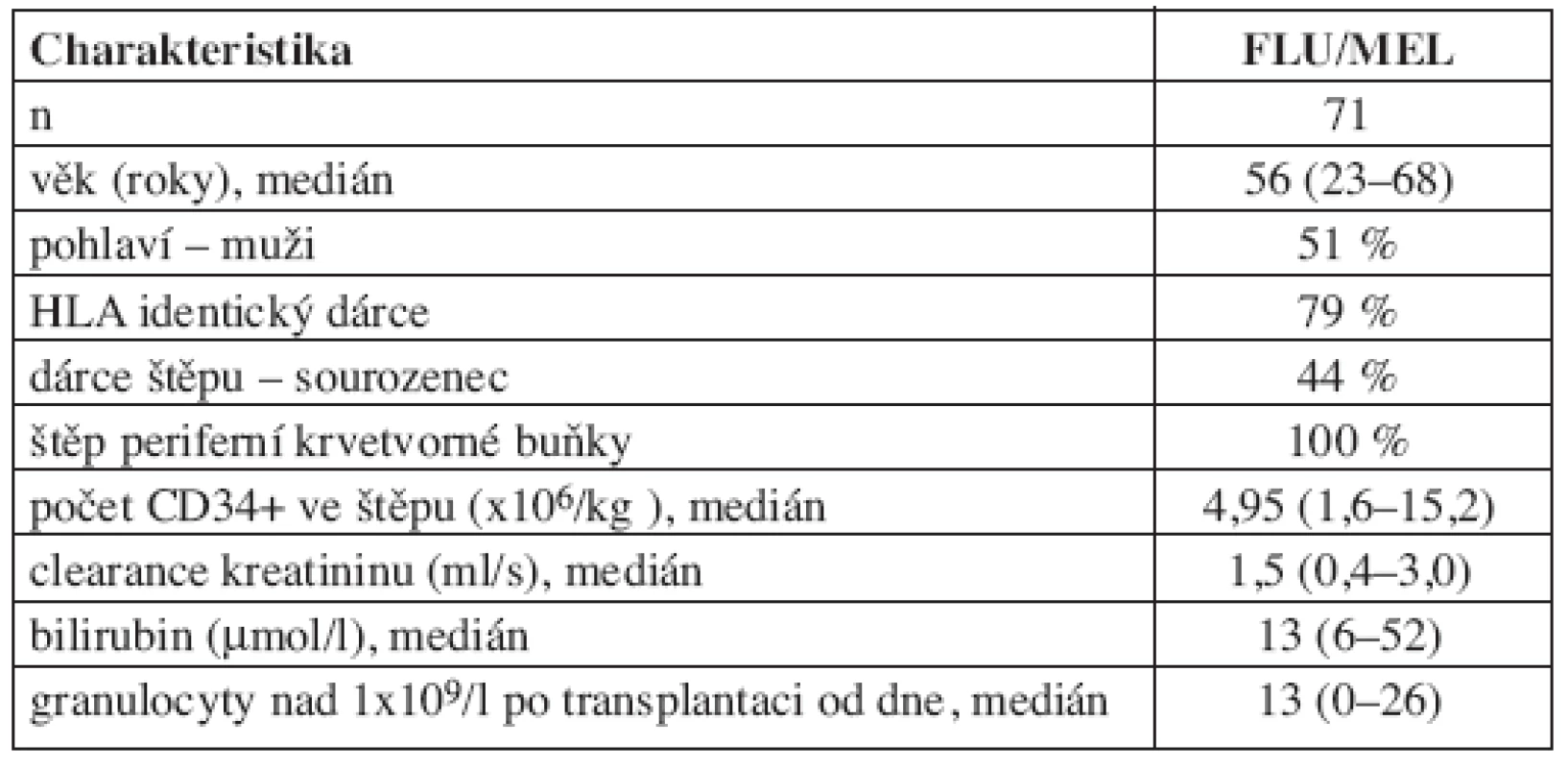
Po přípravě FLU/MEL došlo k rozvoji MDÚ u 78 % pacientů. Těžké postižení stadia 3 a 4 dle WHO s perorálním příjmem zcela vyloučeným nebo omezeným pouze na tekutiny a kaše bylo přítomno u 38 % pacientů. K rozvoji MDÚ došlo v mediánu od dne 6 (2–10) po transplantaci, postižení přetrvávalo celkem 12 (1–34) dní a ustupovalo v den 18 (9–37) po transplantaci. Další údaje o charakteristikách MDÚ jsou uvedeny v grafech 1 a 2, kde je zároveň ilustrována i kinetika reparace granulopoézy po transplantaci.
Graph 1. Incidence (%) maximálního stupně postižení mukozitidou dutiny ústní dle WHO u protokolu předtransplantační přípravy FLU/MEL. 
Graph 2. Incidence postižení mukozitidou dutiny ústní (MDÚ) v aktuální den po alogenní transplantaci krvetvorných buněk u protokolu přípravy FLU/MEL a incidence reparace granulopoézy (granulocyty ≥1,0x10<sup>9</sup>/l). 
Univariantní analýzou nebyla prokázána korelace mezi výskytem MDÚ a věkem pacientů. Významně častěji však bylo postižení dutiny ústní přítomno u žen a dále pak u pacientů s nižším body mass indexem (BMI), kde však s ohledem na rozložení mediánů hodnot a jejich rozptyl nešlo o klinicky zásadní a kvantitativně zřetelné vymezení. Byl proveden přepočet dávky melfalanu na kg hmotnosti pacienta s výsledným mediánem aplikované dávky 3,5 (2,5 – 5,2) mg/kg. U pacientů s dávkou ≥ 3,5 mg/kg byla pozorována signifikantně vyšší incidence MDÚ. Bližší údaje jsou uvedeny v tabulce 2.
Table 2. Mukozitida dutiny ústní (MDÚ) po předtransplantační přípravě FLU/MEL a potenciální klinické rizikové faktory. 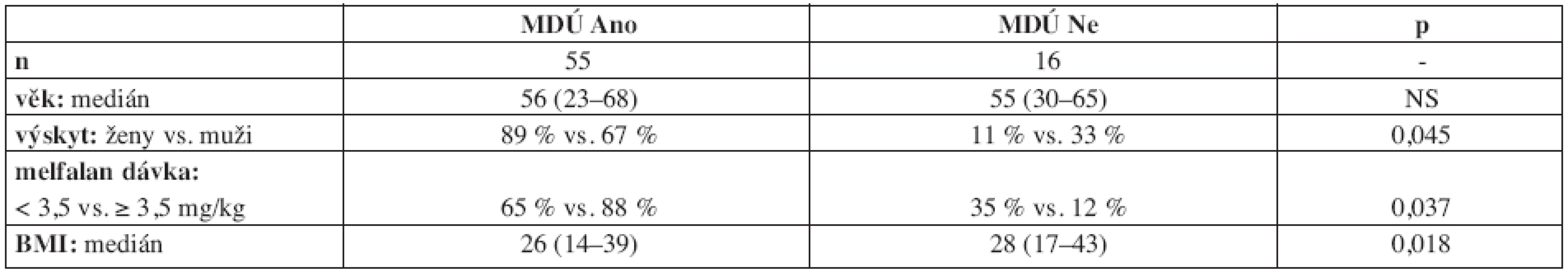
BMI = body mass index U 53 % (9/17) pacientů s MDÚ přetrvávající v den +21 a déle po transplantaci byla pozorována i současná koincidence s akutní reakcí štěpu proti hostiteli (aGVHD). Korelace mezi výskytem MDÚ přetrvávající v den +21 a déle po transplantaci a mezi obecnou incidencí aGVHD prokázala významnou souvislost ve smyslu vyššího výskytu aGVHD u pacientů s touto protrahovanou MDÚ (71 % vs. 32 %, p = 0,009).
Diskuse
Doposud nebyly publikovány přesnější charakteristiky toxického postižení dutiny ústní u pacientů po předtransplantační přípravě FLU/MEL. V této analýze byl hodnocen soubor 71 takto léčených pacientů, kteří byli zařazeni do prospektivního sledování zaměřeného specificky na problematiku MDÚ. S ohledem na zjištěnou incidenci, tíži a přetrvávání MDÚ lze protokol FLU/MEL zařadit mezi významně toxické předtransplantační režimy (1). Samotný výskyt MDÚ ve skupině našich pacientů byl lehce nižší, než v kohortě Kröger et al. (4) s incidencí 88 % – ten však používal jiné metodiky k hodnocení toxicity dutiny ústní, nebo v kohortě Aisa et al. (7) s incidencí 85 %, kde ale byly do sledování zařazeni i pacienti s předtransplantační přípravou doplněnou o celotělové ozáření nebo vysokodávkovaný cytosin-arabinosid.
Za hlavního nositele slizniční toxicity v protokolu FLU/MEL lze zcela jistě označit vysokodávkovaný melfalan, pro který je MDÚ typickou komplikací (9, 10). Fludarabin takový toxický potenciál naopak nemá. V rámci objektivity je však při hodnocení incidence MDÚ u protokolu FLU/MEL nutné počítat do jisté míry i s vlivem toxicity metotrexátu aplikovaného v rámci prevence akutní GVHD, jak je obecně přijímáno a potvrzováno při sledování protokolů s využitím nebo bez tohoto cytostatika (11–13). Přesné ověření možného spolupodílu fludarabinu nebo metotrexátu na slizniční toxicitě by však bylo v praxi velmi obtížné a vyžadovalo by velmi pečlivou rozvahu s ohledem na nutnost zajistit vyváženost celé řady potenciálních faktorů ovlivňujících incidenci a tíži MDÚ a také s ohledem na možné následky – výskyt GVHD, rejekce štěpu, přežívání, atp. – při změně zavedených předtransplantačních protokolů.
Při hodnocení potenciálních klinických rizikových faktorů rozvoje MDÚ byla ve sledovaném souboru prokázána významně zvýšená incidence MDÚ u žen, což bylo pozorováno také dříve při sledování u souborů autologně transplantovaných pacientů po přípravě s melfalanem 200 mg/m2 nebo „BEAM“ (14) nebo při léčbě 5-fluorouracilem (15). V našem souboru byl také potvrzen fakt výrazného rozptylu dávek melfalanu aplikovaných na kilogram hmotnosti pacienta (16). Objevila se tak další možnost vysvětlující rozdíly v incidenci a průběhu MDÚ uvnitř FLU/MEL protokolu. Vyšší dávky melfalanu aplikované na kilogram hmotnosti, respektive dávky ≥ 3,5 mg/kg, nesly signifikantně vyšší riziko komplikace. Věk jako rizikový faktor nebyl prokázán a výsledky v případě BMI nelze v případě našeho souboru přeceňovat s ohledem na rozložení hodnot. Pro přesnější ohodnocení významnosti jednotlivých sledovaných faktorů by bylo vhodné zajistit další sledování a analýzy.
U poloviny pacientů s delším přetrváváním MDÚ byla současně pozorována manifestující se akutní GVHD. Na druhé straně byl prokázán četnější výskyt akutní GVHD u pacientů s protrahovanou MDÚ. Pozorování tedy ukazuje na souvislost mezi oběma jevy, což neodporuje jejich obecně uznávané patofyziologii. Bohužel není možné se blíže vyjadřovat k etiologii protrahované MDÚ. Z klinického pohledu nebo histologickou verifikací nelze toxické a akutní GVHD postižení více odlišit. V rámci objektivity je navíc třeba podotknout, že MDÚ trvající tři týdny a více byla pozorována i v případě transplantací autologních krvetvorných buněk (14, 17), kde se akutní GVHD nemohla spolupodílet.
Závěrem lze shrnout, že přípravný protokol FLU/MEL lze obecně považovat za významně a vysoce toxický pro oblast dutiny ústní. Vliv na výskyt a charakteristiky postižení však mají i další faktory, jako je např. vyšší dávka melfalanu vztažená na kilogram hmotnosti a nejspíše i příslušnost k ženskému pohlaví. Další poznávání charakteristik MDÚ u významných protokolů hemato-onkologické léčby a individuálních rizikových faktorů má význam pro hledání toxicitu omezujících postupů nebo pro definování výrazně ohrožených skupin pacientů. Zavedení kryoterapie do profylaxe MDÚ u pacientů léčených melfalanem v bolusové aplikaci nebo krátké infuzi by mělo být prvním a nezbytným krokem s výrazným potenciálem pro omezení výskytu a tíže MDÚ (7, 13). Úprava protokolu FLU/MEL ve smyslu dávkovaní s ohledem na hmotnost by mohla odstranit výrazný rozptyl dávek při zavedeném systému dávkování s ohledem na tělesný povrch, přispět k homogenizaci dávkovacího schématu a případně částečně i k další redukci toxicity.
MUDr. Samuel Vokurka
Hematologicko-onkologické odd.
Fakultní nemocnice v Plzni
Alej Svobody 80
304 60 Plzeň
e-mail: vokurka@fnplzen.cz
Doručeno do redakce: 8. 9. 2008
Přijato: 12. 1. 2009
Sources
1. Rubenstein E, Peterson D, Schubert M, et al. Clinical practice guidelines for the prevention and treatment of cancer therapy-induced oral and gastrointestinal mucositis. Cancer 2004; 100 : 2026–2046.
2. Sonis S, Oster G, Fuchs H, et al. Oral mucositis and the clinical and economic outcomes of hematopoietic stem-cell transplantation. J Clin Oncol 2001; 19 : 2201–2205.
3. Giralt S, Thall PF, Issa K, et al. Melphalan and purine analog-containing preparative regimens: reduced-intensity conditioning for patients with hematologic malignancies undergoing allogeneic progenitor cell transplantation. Blood 2001; 97 : 631–637.
4. Kröger N, Sayer H, Schwerdtfeger R, et al. Unrelated stem cell transplantation in multiple myeloma after a reduced-intensity conditioning with pretransplantation antithymocyte globulin is highly effective with low transplantation-related mortality. Blood 2002; 100 : 3919–3924.
5. Inamoto Y, Oba T, Miyamura K, et al. Stable engraftment after a conditioning regimen with fludarabine and melphalan for bone marrow transplantation from an unrelated donor. Int J Hematol 2006; 83 : 356–62.
6. Anderlini P, Saliba R, Acholonu S, et al. Fludarabine-melphalan as a preparative regimen for reduced-intensity conditioning allogeneic stem cell transplantation in relapsed and refractory Hodgkin’s lymphoma: the updated M.D. Anderson Cancer Center experience. Haematologica 2008; 93 : 257–264.
7. Aisa Y, Mori T, Kudo M, et al. Oral cryotherapy for the prevention of high-dose melphalan-induced stomatitis in allogeneic hematopoietic stem cell transplant recipients. Support Care Cancer 2005; 13 : 266–9.
8. Barrett AJ, Savani BN. Stem cell transplantation with reduced-intensity conditioning regimens: a review of ten years experience with new transplant concepts and new therapeutic agents. Leukemia 2006; 20 : 1661–1672.
9. Bolwell BJ, Kalaycio M, Sobecks R, et al. A multivariable analysis of factors influencing mucositis after autologous progenitor cell transplantation. Bone Marrow Transplant 2002; 30 : 587–591.
10. Robien K, Schubert M, Bruemmer B, et al. Predictors of Oral Mucositis in Patients Receiving Hematopoietic Cell Transplant for Chronic Myelogenous Leukemia. J Clin Oncol 2004; 22 : 1268–1275.
11. Cutler C, Shuli L, Haesook TK, et al. Oral Mucositis Incidence and Severity after Methotrexate and Non-Methotrexate Containing GVHD Prophylaxis Regimens. Blood 2004; 104(Suppl 1): Abstract 351.
12. Bolwell B, Sobecks R, Pohlman B, et al. A prospective randomized trial comparing cyclosporine and short course methotrexate with cyclosporine and mycophenolate mofetil for GVHD prophylaxis in myeloablative allogeneic bone marrow transplantation. Bone Marrow Transplant 2004; 34 : 621–625.
13. Bensinger W, Schubert M, Ang KK, et al. Task Force Report. prevention and management of mucositis in cancer care. J Natl Compr Canc Netw 2008; 6 (Suppl 1): 1–21.
14. Vokurka S, Bystricka E, Koza V, et al. The comparative effects of povidone-iodine and normal saline mouthwashes on oral mucositis in patients after high-dose chemotherapy and APBSCT—results of a randomized multicentre study. Support Care Cancer 2005; 13 : 554–558.
15. Chansky K, Benedetti J, Macdonald JS. Differences in toxicity between men and women treated with 5-fluorouracil therapy for colorectal carcinoma. Cancer 2005; 103 : 1165–1171.
16. Grazziutti ML, Dong L, Miceli MH, et al. Oral mucositis in myeloma patients undergoing melphalan-based autologous stem cell transplantation: incidence, risk factors and a severity predictive model. Bone Marrow Transplant 2006; 38 : 501–506.
17. Blijlevens N, Schwenkglenks M, Bacon P, et al. Prospective Oral Mucositis Audit: Oral Mucositis in Patients Receiving High-Dose Melphalan or BEAM Conditioning Chemotherapy—European Blood and Marrow Transplantation Mucositis Advisory Group. J Clin Oncol 2008; 26 : 1519–1525.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2009 Issue 1-
All articles in this issue
- Exprese reverzní telomerázy u pacientů s chronickou B-lymfocytární leukemií
- Mukozitida dutiny ústní po alogenní transplantaci krvetvorných buněk s přípravou fludarabinem a melfalanem FLU/MEL
- Denzita exprese cílového antigenu CD20 a CD52 ve vztahu k terapii monoklonální protilátkou u pacientů s chronickou lymfocytární leukemií
- Idiopatická trombocytopenická purpura – patogeneze, moderní léčba a analýza prevalence, diagnostiky a terapie nemoci v Jihomoravském kraji
- Systémová mastocytóza
- Léčba invazivní kandidózy - doporučení odborných společností
- Léčba invazivní aspergilózy – doporučení odborných společností
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Systémová mastocytóza
- Idiopatická trombocytopenická purpura – patogeneze, moderní léčba a analýza prevalence, diagnostiky a terapie nemoci v Jihomoravském kraji
- Léčba invazivní aspergilózy – doporučení odborných společností
- Léčba invazivní kandidózy - doporučení odborných společností
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

