-
Medical journals
- Career
Karcinom štítné žlázy v graviditě: kazuistiky
: Jan Jiskra; Jan Krátký; Zdeňka Límanová
: III. interní klinika 1. LF UK a VFN, Praha, prof. MUDr. Štěpán Svačina, DrSc., MBA
: Prakt Gyn 2014; 18(1): 47-53
: Oncogynecology: Case report
Karcinom štítné žlázy v těhotenství vyžaduje multidisciplinární spolupráci a v každém případě se musí individuálně zvažovat, je-li nějaká léčebná strategie optimální, nebo lze postupovat různými způsoby. Článek popisuje dva případy, z nichž v prvním byl operační výkon odložen na období po porodu a v druhém byl proveden ve 2. trimestru gravidity. Pokud se nejedná o lokálně pokročilé onemocnění, nelze na základě současných poznatků upřednostnit ani jeden z těchto postupů a rozhodnutí je vždy individuální. Skutečností je, že naprostá většina takových případů má dobrou prognózu. Zlepšující se kvalita ultrasonografických přístrojů a nové ultrasonografické modality (elastografie, 3D-zobrazení apod) a výhledově i genetická analýza mutací vzorků získaných biopsií štítné žlázy tenkou jehlou mohou přinést užitečné informace o potenciálně agresivní povaze tumoru.
Klíčová slova:
karcinom štítné žlázy – gravidita – ultrasonografie štítné žlázyÚvod
Prevalence tyreoidálních uzlů v graviditě se udává asi 9–34 % podle stavu jodového zásobení [1]. Vyšší než u ostatní ženské populace je zřejmě jen v oblastech s jodovým deficitem. V oblastech s jodovým deficitem se uzly také mohou v těhotenství mírně zvětšovat a s počtem gravidit jich přibývá [2,3]. Pro oblasti s dostatečným jodovým zásobením (včetně České republiky) je nedostatek dat. Odhaduje se, že asi 12–15 % z nich může být maligních [3–5].
Karcinom štítné žlázy je nejčastější endokrinní malignita, jejíž incidence stoupá, a to především díky papilárním karcinomům stadia T1 (> 2 cm, bez extratyreoidální invaze). Postihuje 3krát častěji ženy než muže a asi 10 % žen, u kterých se diagnostikuje, je gravidních nebo časně po porodu [6]. Karcinom štítné žlázy je po karcinomu prsu druhou nejčastější malignitou v těhotenství a v období krátce po porodu (14 případů na 100 000 těhotenství) [7].
Péče o těhotné ženy s nově diagnostikovaným tyreoidálním karcinomem představuje určitý problém, protože se nikdy nelze zcela vyhnout etickému konfliktu mezi optimální terapií těhotné ženy a udržením optimálních podmínek pro vývoj plodu. Přesto má karcinom štítné žlázy diagnostikovaný v graviditě prognózu dobrou jak z hlediska matky, tak plodu.
U žen s karcinomem štítné žlázy, který byl adekvátně léčen a je v remisi, není kontraindikace gravidity, je však nutná úzká spolupráce endokrinologa, gynekologa a pacientky samotné. Těhotenství nesmí následovat nejméně 6 (lépe však 12) měsíců po léčbě radiojodem 131I.
Popis případu 1
V červenci 2010 bylo u 33leté dosud zdravé ženy, nulipary, nuligravidy, bez tyreopatií v rodinné anamnéze, provedeno ORL-vyšetření pro bolesti vpravo na krku v oblasti m. sternocleidomastoideus se závěrem: akutní lymfadenitida a chronická tonzilitida. Během vyšetření byl na ultrasonografii (USG) náhodně zachycen drobný mírně hypoechogenní uzlík v pravém laloku štítné žlázy 8 × 7 × 8 mm (0,224 ml), jiné USG-charakteristiky nebyly při prvním vyšetření popsány. Pacientka se objednala na endokrinologické vyšetření, ke kterému se dostavila v řádném termínu v září 2010; v té době byla v 16. týdnu gravidity. Podle laboratorních testů byla eutyreoidní a měla negativní tyreoidální protilátky. Na kontrolním USG tyreoidey v 18. týdnu gravidity byly v pravém laloku popsány 2 uzly: jeden solidní, hypoechogenní, pravidelný, dobře ohraničený, s normální vaskularizací, velikosti 11 × 7 × 12 mm (0,463 ml), a druhý solidní, izoechogenní, pravidelný, dobře ohraničený, s normální vaskularizací, velikosti 9 × 7 × 10 mm (0,315 ml). Protože hypoechogenní uzel vykazoval během 3 měsíců progresi o 51,6 % objemu, byla provedena biopsie tenkou jehlou s následným cytologickým vyšetřením (FNAC – fine needle aspiration cytology), která byla hodnocena jako podezření z papilárního karcinomu (Bethesda V, tab, obr. 1). Známky extratyreoidální invaze, ani patologické lymfatické uzliny na krku nebyly na USG patrné. Pacientka, v té době ve 20. týdnu gravidity, byla podrobně informována o povaze onemocnění a dvou možnostech léčby: operace v graviditě (do 24. týdne) nebo odložení operace na období po porodu. Po zvážení těchto variant preferovala pacientka odložení operace po porodu a po ukončení kojení. Od 20. týdne byla zahájena supresní léčba levotyroxinem v dávce 125 µg denně (TSH v pásmu 0,01–0,09), uzel byl během gravidity kontrolován USG a byl bez progrese (0,463 ml v 18. týdnu a 0,420 ml v 30. týdnu). V 40. týdnu proběhl fyziologický porod zdravého dítěte. Na USG 4 týdny po porodu bylo patrné zvětšení tumoru na 0,924 ml (o 49,9 %), proto bylo ihned ukončeno kojení a bez komplikací byla provedena totální tyreoidektomie v 6. týdnu po porodu. Histologie potvrdila papilární karcinom v pravém laloku štítné žlázy 12 × 8 × 7 mm (0,336 ml), bez angioinvaze a extratyreoidálního šíření (T1bN0M0). Z velikosti nádoru v definitivní histologii plyne, že byl při supresní léčbě levotyroxinem po celou dobu gravidity i po porodu až do operace bez progrese. Nádor byl hodnocen jako „nízkorizikový“ (schéma), proto léčba radiojodem 131I nebyla doporučena. Pacientka má supresní léčbu levotyroxinem a je aktuálně 34 měsíců v remisi bez známek recidivy či perzistence onemocnění (nedetekovatelný tyreoglobulin v krvi, negativní TgAb, bez USG-známek recidivy na krku).
1. Bethesda klasifikace výsledků aspirační cytologie tenkou jehlou (FNAC) 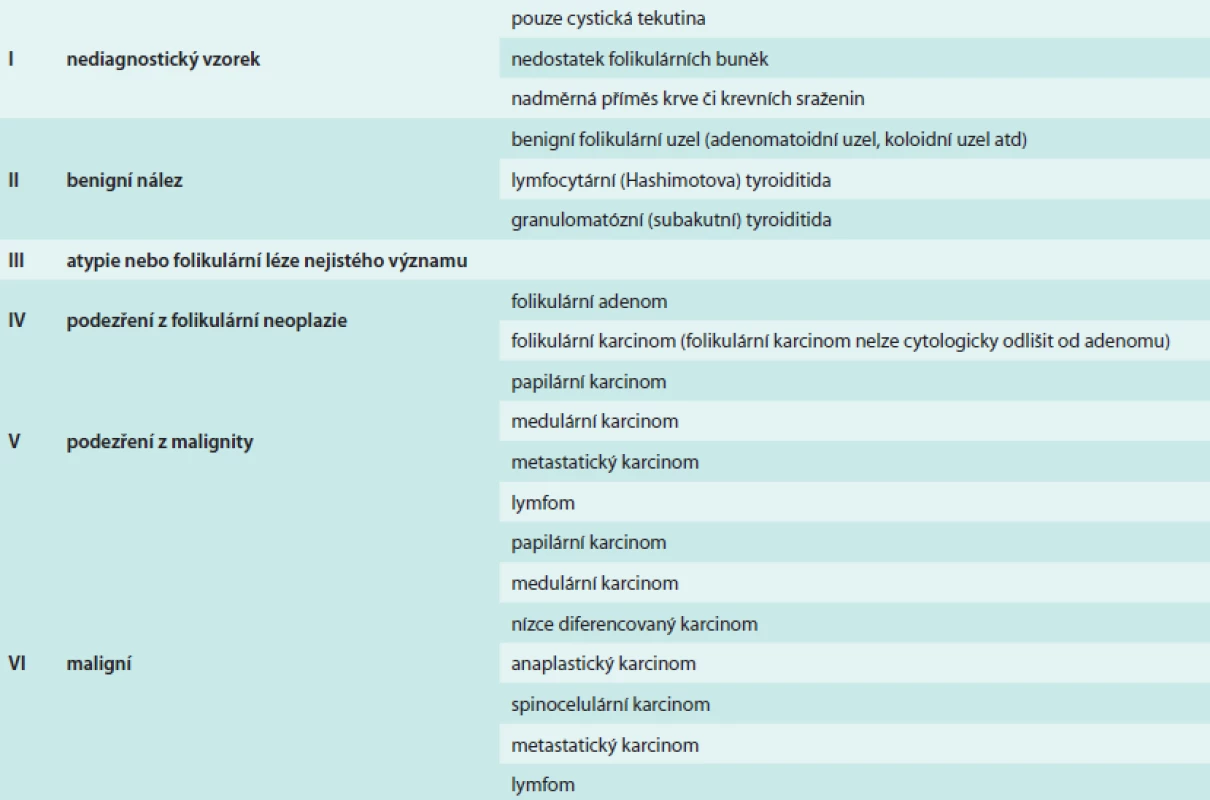
1. Cytologický obraz papilárního karcinomu (zdroj: archiv prof. MUDr. J. Duškové, CSc., Ústav patologické anatomie 1. LF UK a VFN, Praha) 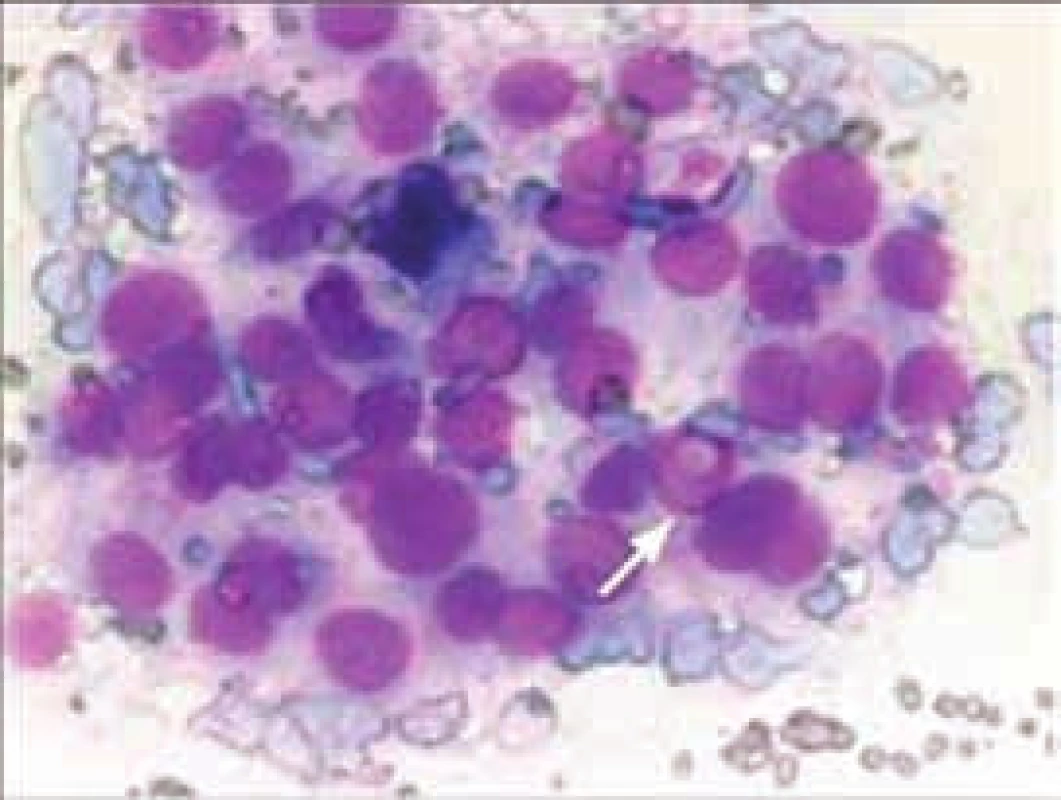
Typická cytoplazmatická jaderná pseudoinkluze je označena šipkou. Barveno dle Maye-Grunwalda-Giemsy. Popis případu 2
U 38leté dosud zdravé ženy, jejíž matka byla sledována pro benigní tyreoidální uzly, nahmatal praktický lékař při preventivním vyšetření v 8. týdnu první gravidity uzel v oblasti pravého laloku štítné žlázy. Pacientka byla v 10. týdnu gravidity vyšetřena na endokrinologii. Klinicky i laboratorně byla eutyreoidní, měla negativní protilátky TPOAb a hraničně pozitivní protilátky TgAb (85 kIU/l, norma 0–60). Na USG se zobrazil hypoechogenní uzel na pomezí istmu a pravého laloku štítné žlázy, nepravidelného tvaru, s mikrokalcifikacemi, s chudou, ale centrální vaskularizací, velikosti 14 × 15 × 20 mm, hodnocený jako suspektní z malignity. Byla provedena FNAC a pacientka byla ještě odeslána na expertní USG včetně elastografie na specializované pracoviště, kde se potvrdil nález tuhého uzlu podezřelého z malignity (obr. 2, obr. 3, obr. 4, obr. 5). Navíc bylo podezření na extratyreoidální invazi do předních krčních svalů (obr. 2) a dorzokaudálně od něj byl další uzel 11 × 9 × 10 mm, podobného charakteru, takže bylo podezření na multifokální tumor. Pod dolním polem pravého laloku štítné žlázy bylo také vidět několik velmi drobných uzlin, které byly spíše obvyklého vzhledu, bez jednoznačných známek infiltrace (obr. 6). Výsledek FNAC odpovídal papilárnímu karcinomu (Bethesda VI, tab). Pacientka (ve 12. týdnu gravidity) byla podrobně informována o povaze onemocnění a vzhledem k tomu, že byl nádor hodnocen jako „vysokorizikový“ (multifokální, podezření na extratyreoidální šíření a možné postižení lymfatických uzlin, schéma) byla pacientce na prvním místě doporučena operace, se kterou souhlasila. V 17. týdnu gravidity byla na specializovaném pracovišti provedena totální tyreoidektomie s odstraněním několika uzlin z centrálního krčního kompartmentu. Histologicky se potvrdil multifokální papilární karcinom rostoucí v istmu a pravém laloku a drobná ložiska velikosti 2–4 mm byla popsána i ventrálně v levém laloku (na USG nebyla viditelná). Nádor měl těsný vztah k pouzdru, avšak extratyreoidální invazi ani postižení lymfatických uzlin histologie neprokázala (T1bN0M0). V histologickém preparátu se našlo jedno odstraněné příštítné tělísko. Po operaci byla zahájena supresní léčba levotyroxinem; k udržení TSH v pásmu 0,01–0,09 mIU/l byla průměrná denní dávka 246 µg. Po operaci se rozvinula přechodná hypoparatyreóza s hypokalcemií, ale po 6 týdnech bylo možné ukončit podávání kalcitriolu a stačila suplementace kalciem. Kontrolní USG krční oblasti byl v 30. týdnu gravidity bez známek recidivy či perzistence onemocnění (obr. 7). Fyziologický porod zdravého dítěte proběhl v 39. týdnu gravidity. Protože nádor u pacientky je hodnocen jako „vysokorizikový“ (multifokální), je 3 měsíce po porodu naplánována léčba radiojodem 131I, což umožní pacientce kojit alespoň po dobu 2 měsíců.
Schéma. Diagnostický a léčebný postup při nálezu tyreoidálního uzlu v graviditě 
USG – ultrasonografie/ultrasonografická TSH – koncentrace tyreoidálního stimulačního hormonu v séru TPOAb – protilátky proti tyreoidální peroxidáze v séru FNAC – aspirační biopsie štítné žlázy tenkou jehlou s následným cytologickým vyšetřením LT4 – levotyroxin B I-VI – stadia klasifikace Bethesda (tab) PTC – papilární karcinom štítné žlázy 1 bez suspektních známek na konvenčním USG, elastograficky měkké uzly 2 přítomnost alespoň jednoho kritéria suspekce (tab. 1) na konvenčním USG, elastograficky tuhé uzly 3 Plošná léčba TPOAb-pozitivních těhotných žen se nedoporučuje, měla by však být v individuálních případech zvážena 4 Nízkorizikový tumor nemá ani jednu z následujících charakteristik uvedených u vysokorizikového tumoru, vysokorizikový tumor má alespoň jednu: > 2 cm, extratyreoidální šíření, postižení lymfatických uzlin, multifokální tumor, žena je v minulosti po ozáření hlavy a krku, jiná cytologie než papilární či folikulární tumor, karcinom štítné žlázy v rodinné anamnéze) 2. Papilární karcinom v pravém laloku štítné žlázy příčný řez (zdroj: archiv autora) 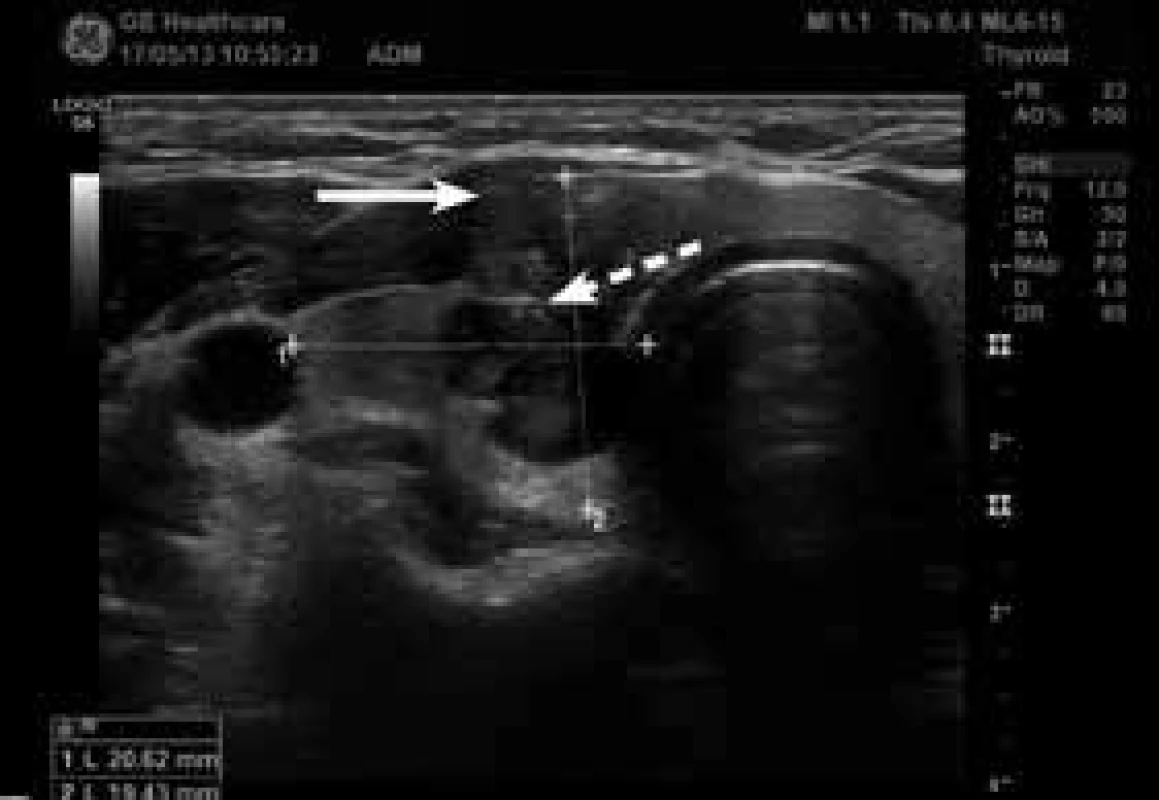
Nepravidelný tvar, plná šipka ukazuje suspektní extratyreoidální invazi ventrálně do krčních svalů, přerušovaná mikrokalcifikace. 3. Papilární karcinom v pravém laloku štítné žlázy podélný řez (zdroj: archiv autora) 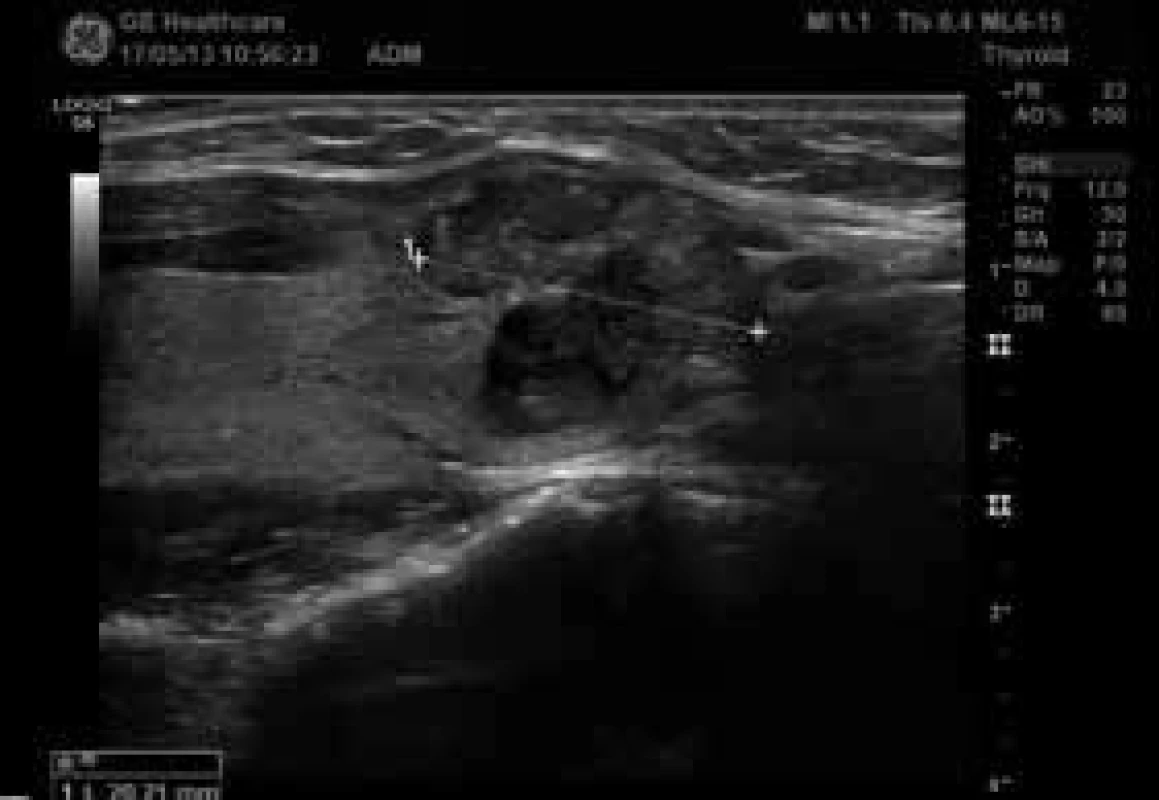
4. Chudá, ale centrální vaskularizace (zdroj: archiv autora) 
5. Vpravo elastogram papilárního karcinomu, vlevo klasické 2D-zobrazení (zdroj: archiv autora) 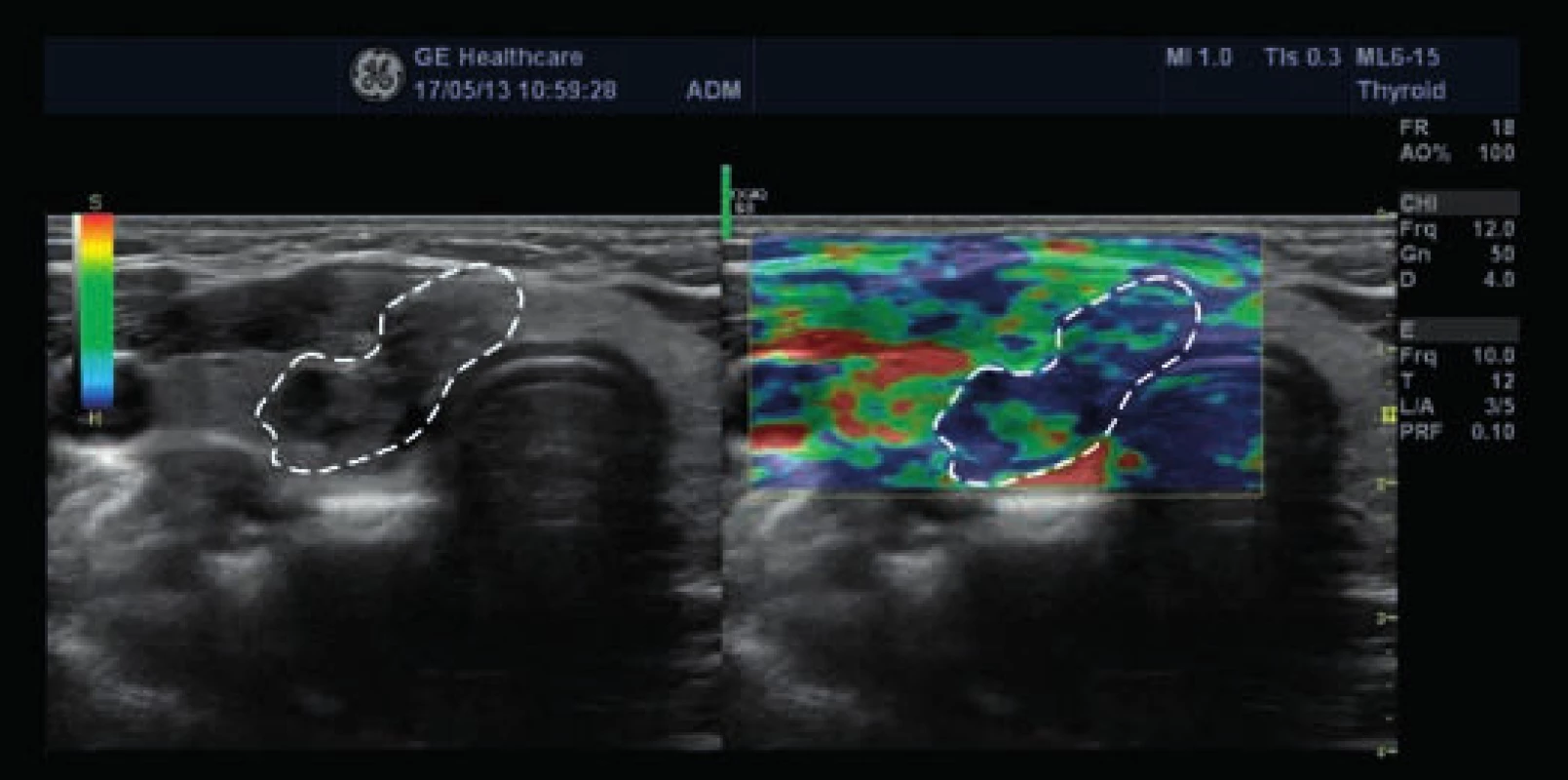
Modrá barva znázorňuje oblasti tuhé tkáně (převážně v oblasti tumoru), zelená a červená barva oblast měkké tkáně (převážně okolí tumoru). 6. Nehomogenní pretracheální lymfatické uzly kaudálně od pravého laloku štítné žlázy (zdroj: archiv autora) 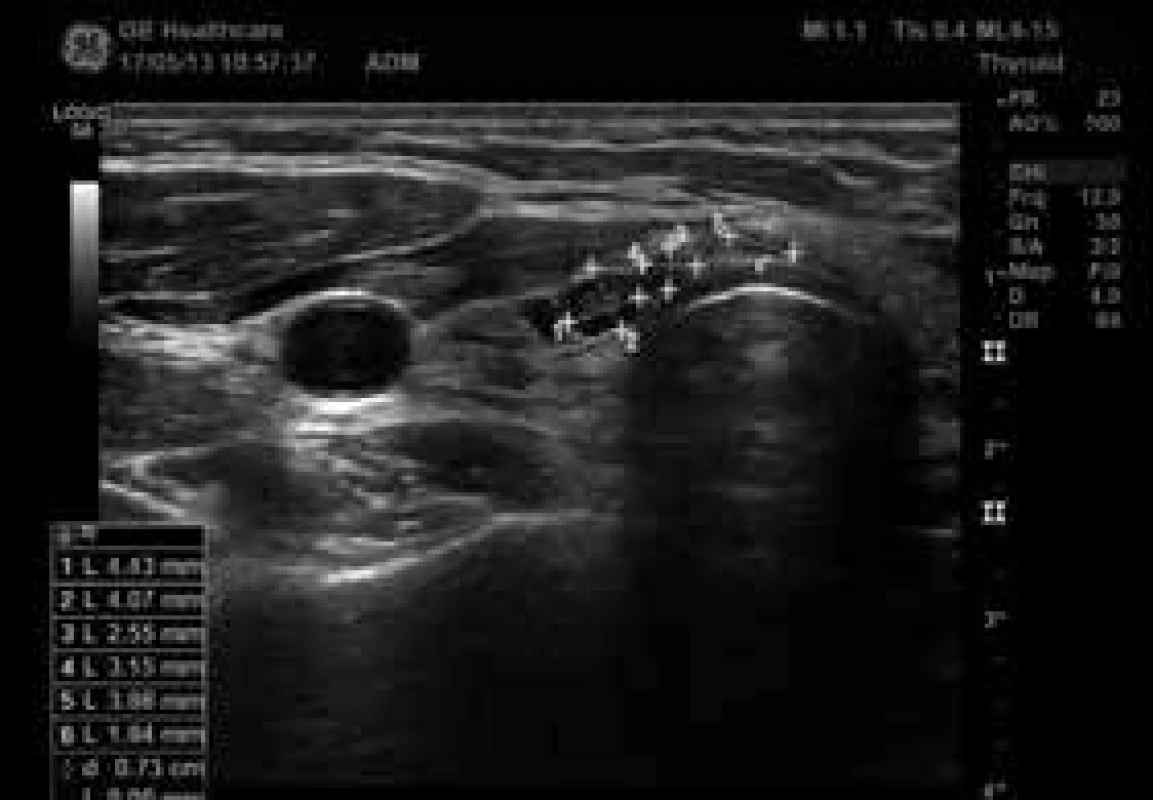
7. Lůžko štítné žlázy po operaci – bez prokazatelné tyreoidální tkáně (zdroj: archiv autora) 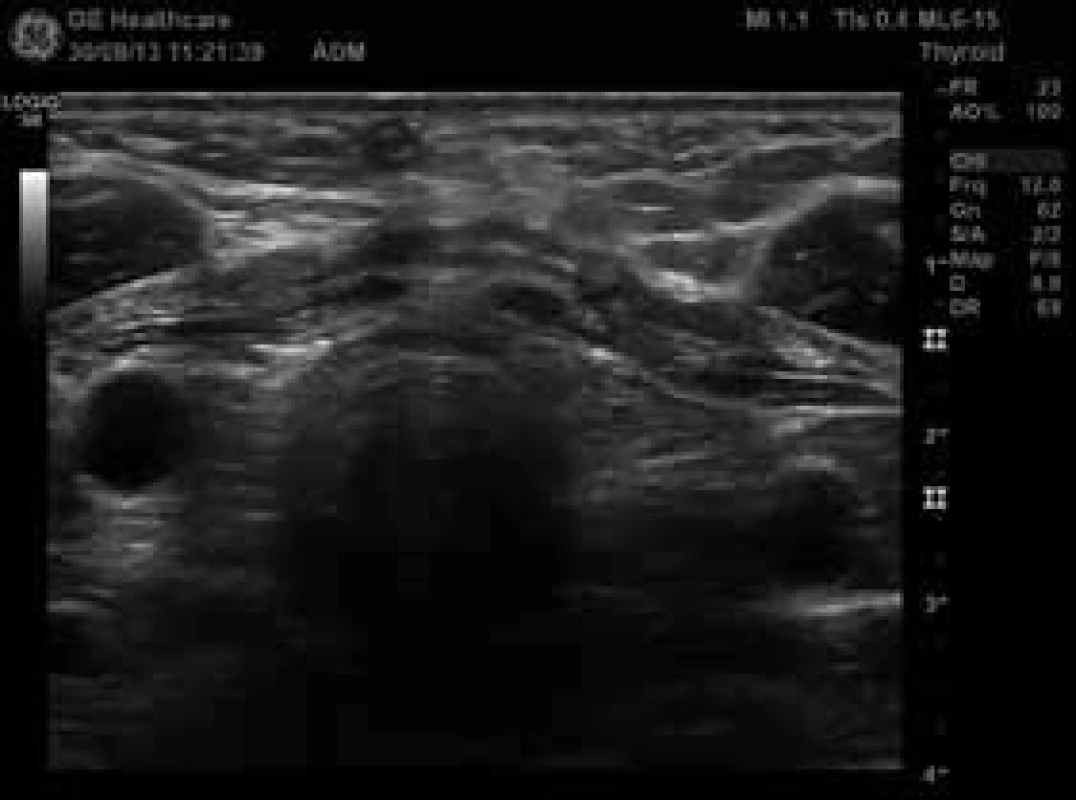
Diskuse
Limitovaná data z retrospektivních studií na malých souborech ukazují, že riziko malignity při nálezu uzlu štítné žlázy v graviditě může být až 12–15% [3–5], s výjimkou jedné starší studie, v níž bylo riziko dokonce 43% [8]. To značí riziko mírně (nesignifikantně) vyšší než v ostatní populaci, v níž se tradičně udává 5–10% [9], přímé srovnávací studie věkově srovnatelné ženské populace však nejsou k dispozici. V 30 let staré práci bylo relativní riziko malignity tyreoidálního uzlu v graviditě 1,8 [10]. Nicméně v poslední době některé práce ukazují, že riziko malignity štítné žlázy u tyreoidálních uzlů může být v běžné populaci mírně nadhodnocené (např. Rago et al zjistili „pouze“ 2–3 % karcinomů v souboru 34 120 pacientů, kteří podstoupili FNAC) [11], což by naznačovalo, že vyšší riziko malignity uzlů v těhotenství může být signifikantní.
Nejlépe prokázaným rizikovým faktorem karcinomu štítné žlázy je ionizující záření, role ostatních faktorů včetně hormonálních a jiných změn v těhotenství je prozatím v rovině hypotéz. Na vyšší prevalenci a potenciální vyšší agresivitě tyreoidálního karcinomu v graviditě může mít vliv stimulace receptorů pro TSH choriovým gonadotropinem (hCG) [12] a stimulace estrogeny. Vliv estrogenů byl dokumentován experimentálními pracemi [13–15]. Přesto klinické studie dosud neprokázaly, že by hormonální antikoncepce ani jiné exogenní estrogeny byly spojeny s vyšším rizikem karcinomu štítné žlázy či jeho horší prognózou [6]. V jedné starší studii sice stoupalo riziko karcinomu štítné žlázy s počtem těhotenství, avšak pouze u žen, u kterých byla prováděna zástava laktace. Autoři studie [16] sami uzavírají, že byla získána pouze limitovaná data.
Podobně existují práce, které upozornily na možnou horší prognózu žen s karcinomem tyreoidey v graviditě, a práce, které to naopak nepotvrdily. Např. Vannucchi et al publikovali, že karcinom štítné žlázy měl horší prognózu, pokud byl diagnostikován v graviditě ve srovnání s netěhotnými ženami a nejvýznamnějším prediktorem pro perzistenci karcinomu byla diagnóza stanovená během těhotenství nebo během prvního roku po porodu. Z karcinomů diagnostikovaných v těhotenství nebo 1 rok po porodu bylo 15 % folikulárních, 15 % mělo pozitivní mutaci genu BRAF (ta je spojována s horší prognózou), a dokonce 53 % mělo extratyreoidální invazi [17]. Naopak Moosa et al při porovnání 61 žen s karcinomem štítné žlázy diagnostikovaným v těhotenství s 528 věkově spárovanými netěhotnými kontrolami (medián sledování byl 22,4 let u těhotných žen a 19,5 let u kontrol) nezjistili signifikantní rozdíly v procentu rekurencí a úmrtí. U 77 % žen v této studii byla operace odložena na dobu po porodu a jejich prognóza se nelišila od operovaných v těhotenství [18].
Diagnostický postup při palpačním či USG-nálezu uzlu štítné žlázy v graviditě se příliš neliší od běžné populace, vyšetření však musí být provedeno co nejdříve. Palpační nález je indikací k USG a ze solitárních uzlů větších než 1 cm nebo jakýchkoliv USG-suspektních uzlů má být provedena FNAC. Jeli výsledek FNAC benigní (Bethesda II, tab), stačí USG-kontrola za 6–12 měsíců (obvykle po porodu). U neurčitého výsledku FNAC (Bethesda III nebo IV, tab) se má uzel v každém trimestru a po porodu kontrolovat ultrasonograficky a v případě progrese o více než 50 % objemu nebo USG-známek malignity je nutno opakovat FNAC a zvažovat operaci v 2. trimestru (do 24. týdne). Vyšší pozornost také vyžadují uzly v terénu chronické lymfocytární tyroiditidy. Pokud je v těhotenství maligní výsledek FNAC nebo je suspektní z malignity (Bethesda V nebo VI, tab), doporučují mezinárodní odborné společnosti operaci v 2. trimestru na specializovaném pracovišti (pokud je maligní uzel zjištěn v 1. nebo časně v 2. trimestru) nebo odložení operace po porodu. Pokud je indikována operace, měla by být provedena v 2. trimestru, protože operace v 1. trimestru zvyšuje riziko potratu a ve 3. trimestru předčasného porodu. Kuy et al porovnávali věkově spárované těhotné a netěhotné ženy, které podstoupily operaci štítné žlázy (165 těhotných žen) či příštítných tělísek (36 těhotných žen) a zjistili, že operované těhotné ženy měly více endokrinních komplikací (hypoparatyreóza) (15,9 % vs 8,2 %), více obecných neendokrinních komplikací (22,4 vs 3,6 %) a vyšší náklady [19]. Těhotenství bylo nezávislým prediktorem chirurgických komplikaci (odds ratio 2,0; p < 0,001), delší hospitalizace a vyšších hospitalizačních nákladů [19]. Je však třeba zdůraznit, že při hodnocení komplikací hraje nepochybně roli i různá zkušenost operatérů a využití moderních operačních technik (harmonický skalpel apod). Rovněž moderní vedení anestezie je dnes velmi šetrné k matce i plodu. Podle našich zkušeností jsou rizika operace ve 2. trimestru, která je provedena zkušeným chirurgem, moderními technikami a na specializovaném pracovišti, minimální a nepřevyšují rizika operace štítné žlázy u běžné populace [20]. Tento postup také eliminuje riziko další progrese zhoubného nádoru při odložení operace, kterého se řada žen velmi obává, a umožní bezproblémové kojení po dostatečně dlouhou dobu. Pokud jde cytologicky o papilární karcinom, bez známek pokročilého nádoru (a těchto případů je naprostá většina), lze ženy, které preferují odložení operace po porodu, ujistit, že většina dobře diferencovaných karcinomů roste pomalu a odložení operace brzy po porodu pravděpodobně nevede k horší prognóze onemocnění. Tento postup pro plod i matku zcela eliminuje operační rizika, nicméně je spojen s určitou mírou nejistoty týkající se eventuální progrese tumoru během gravidity a operace časně po porodu také často vede k ukončení kojení. Definitivní rozhodnutí o jednom z postupů musí vždy vycházet z konsenzu ošetřujících lékařů a pacientky. Přestože incidence karcinomu štítné žlázy narůstá jak u těhotných žen, tak v běžné populaci, nebývá absolutní počet případů tak velký, aby umožnil adekvátní statistické porovnání různých léčebných postupů. Užitečné informace o potenciální agresivní povaze tumoru, a tím o preferenci operace během gravidity může přinést ultrasonografie přístrojem s vysokým rozlišením a kvalitou obrazu provedeným zkušeným vyšetřujícím (expertní sonografie).
U uzlů s maligní nebo suspektní FNAC (Bethesda V nebo VI, tab) diagnostikovaných po 24. týdnu gravidity se doporučuje odložit operaci po porodu, protože operace v 3. trimestru zvyšuje riziko předčasného porodu. Pokud je operace odložena, zahajuje se supresní léčba levotyroxinem (cílové hodnoty TSH 0,01–0,09 mIU/l), každé 4 týdny se kontroluje TSH v séru a v každém trimestru a po porodu se kontroluje uzel USG a vývoj plodu sleduje gynekolog. Dojde-li ke zvětšení tumoru o více než 50 %, nebo je patrná extratyreoidální invaze tumoru (mimo pouzdro, do lymfatických uzlin), je nutno zvažovat indukci předčasného porodu a operaci, i když tak vzniká velké riziko pro plod.
Je-li po operaci indikována léčba radiojodem, je možné ji odložit až po přiměřeně dlouhé době kojení (nejdříve však 4–6 týdnů po ukončení kojení) a v mezidobí podávat supresní léčbu levotyroxinem. Léčba radioaktivním jodem nemá žádné negativní vlivy na další těhotenství, to však nesmí následovat nejméně 6 (lépe 12) měsíců [1,9,21,22].
U uzlů s FNAC-podezřením na medulární či anaplastický karcinom diagnostikovaných v 1. a 2. trimestru je indikována operace co nejdříve v 2. nebo časně v 3. trimestru a u uzlů se stejným FNAC-nálezem diagnostikovaných ve 3. trimestru je nutno zvažovat indukci předčasného porodu a co nejčasnější operaci, znovu s velkým rizikem pro plod. Tyto případy jsou však naštěstí vzácné.
Schematicky je rámcový postup při nálezu tyreoidálního uzlu v graviditě na obrázku (schéma). Za zmínku stojí, že FNAC nemá 100% diagnostickou výtěžnost a v 5–10 % je třeba odběr opakovat (Bethesda I – nediagnostický výsledek, tab). V graviditě je pro vyšší prokrvení oblasti FNAC nediagnostická častěji než v běžné populaci.
Prezentované kazuistiky demonstrují dva odlišné přístupy k léčbě karcinomu štítné žlázy diagnostikovanému v graviditě. V prvním případě odložení operace po porodu, což umožňoval příznivý klinický a USG-nález a předpokládané nízké riziko agresivního růstu. Nádor se během gravidity při adekvátní supresní léčbě levotyroxinem vůbec nezvětšil, a velikost byla v definitivní histologie dokonce o pár milimetrů menší než na vstupním USG. V druhém případě naopak expertní USG včetně elastografie dobře predikoval rizikové chování tumoru (multifokalita prokázaná USG i histologicky, USG-suspekce extratyreoidálního šíření a infiltrace lymfatických uzlin). To ukazuje, že maximální eliminaci rizik jak pro matku, tak pro plod, lze dosáhnout jen individuálním přístupem ke každému případu.
Při porovnání obou případů stojí za zmínku výrazně rozdílná průměrná denní dávka levotyroxinu nutná k optimální supresi TSH (125 µg v prvním a dokonce 246 µg v druhém případě). Příčinou byla nepochybně skutečnost, že u první pacientky byla zachovaná vlastní sekrece levotyroxinu, zatímco druhá byla po totální tyreoidektomii. To je v souladu s literárními údaji – ženy po tyreoidektomii vyžadují v těhotenství vyšší dávky levotyroxinu než ženy s hypotyreózou jiné etiologie [23]. Přechodnou pooperační hypoparatyreózu u 2. pacientky lze spíše přičítat vyšší radikalitě výkonu z důvodu lokálně pokročilejšího onemocnění, než že by šlo o přímý důsledek operace v graviditě.
Závěr
Karcinom štítné žlázy v těhotenství vyžaduje multidisciplinární spolupráci a v každém případě se musí individuálně zvažovat, je-li nějaká léčebná strategie optimální, nebo lze postupovat různými způsoby. Definitivní rozhodnutí musí učinit dobře informovaná pacientka. Zdaleka nejčastěji je třeba rozhodnout, zda se mají uzly s maligním nebo suspektním výsledkem FNAC operovat v graviditě nebo lze odložit operaci po porodu. Nejsou dosud žádné důkazy o superioritě jednoho z postupů. Zlepšující se kvalita moderních USG-přístrojů a nové USG-modality (elastografie, 3D-zobrazení apod) a výhledově i genetická analýza mutací vzorků FNAC mohou přinést užitečné informace o potenciálně agresivní povaze tumoru. Pokud se operuje v graviditě, mělo by to být v 2. trimestru (do 24. týdne). V každém případě se zahajuje supresní léčba levotyroxinem. Pokud je operace odložena, kontroluje se uzel v každém trimestru a po porodu USG a vývoj plodu sleduje gynekolog. Pokud nejde o pokročilé onemocnění již v době diagnózy, má naprostá většina pacientek s karcinomem štítné žlázy diagnostikovaným v graviditě prognózu dobrou, ať už preferují operaci v 2. trimestru nebo její odložení po porodu.
Doručeno do redakce dne 19. prosince 2013
Přijato po recenzi dne 13. ledna 2014
doc. MUDr. Jan Jiskra, Ph.D.
Jan.Jiskra@vfn.cz
MUDr. Jan Krátký
doc. MUDr. Zdeňka Límanová, CSc.
III. interní klinika 1. LF UK a VFN, Praha
www.vfn.cz
Sources
1. Stagnaro-Green A, Abalovich M, Alexander E et al. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum. Thyroid 2011; 21(10): 1081–1125.
2. Struve CW, Haupt S, Ohlen S. Influence in frequency of previous pregnancies on the prevalence of thyroid nodules in women without clinical evidence of thyroid disease. Thyroid 1993; 3(1): 7–9.
3. Kung AW, Chau MT, Lao TT et al. The effect of pregnancy on thyroid nodule formation. J Clin Endocrinol Metab 2002; 87(3): 1010–1014.
4. Tan GH, Gharib H, Goellner JR et al. Management of thyroid nodules in pregnancy. Arch Intern Med 1996; 156(20): 2317–2320.
5. Marley F, Oertel YC. Fine needle aspiration of thyroid lesions in 57 pregnant and postpartum women. Diagn Cytopathol 1997; 16(2): 122–125.
6. Mazzaferri EL. Approach to the pregnant patient with thyroid cancer. J Clin Endocrinol Metab 2011; 96(2): 265–272.
7. Smith LH, Danielsen B, Allen ME et al. Cancer associated with obstetric delivery: results of linkage with the California cancer registry. Am J Obstet and Gynecol 2003; 189(4): 1128–1135.
8. Rosen IB, Walfish PG. Pregnancy as a predisposing factor in thyroid neoplasia. Arch Surg 1986; 121(11): 1287–1290.
9. Cooper DS, Doherty GM, Haugen BR et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid 2009; 19(11): 1167–1214.
10. McTiernan AM, Weiss NS, Daling JR. Incidence of thyroid cancer in women in relation to reproductive and hormonal factors. Am J Epidemiol 1984; 120(3): 423–435.
11. Rago, Fiore E, Scutari M et al. Male sex, single nodularity, and young age are associated with the risk of finding a papillary thyroid cancer on fine-needle aspiration cytology in a large series of patients with nodular thyroid disease. Eur J Endocrinol 2010; 162(4): 763–770.
12. Yoshimura M, Hershman JM. Thyrotropic action of human chorionic gonadotropin. Thyroid 1995; 5(5): 425–434.
13. Gibelli B, Zamperini P, Tradati N. Pregnancy and thyroid cancer. Recent Results Cancer Res 2008; 178 : 123–135.
14. Hirsch D, Levy S, Tsvetov G et al. Impact of pregnancy on outcome and prognosis of survivors of papillary thyroid cancer. Thyroid 2010; 20(10): 1179–1185.
15. Rajoria S, Nicolini A, Hanly E et al. Interlinking of Hypoxia and Estrogen in Thyroid Cancer Progression. Curr Med Chem 2014; 21(11): 1351–1360.
16. Mack WJ, Preston-Martin S, Bernstein L et al. Reproductive and hormonal risk factors for thyroid cancer in Los Angeles County females. Cancer Epidemiol Biomarkers Prev 1999; 8(11): 991–997.
17. Vannucchi G, Perrino M, Rossi S et al. Clinical and molecular features of differentiated thyroid cancer diagnosed during pregnancy. Eur J Endocrinol 2010; 162(1): 145–151.
18. Moosa M, Mazzaferri EL. Outcome of differentiated thyroid cancer diagnosed in pregnant women. J Clin Endocrinol Metab 1997; 82(9): 2862–2866.
19. Kuy S, Roman SA, Desai R et al. Outcomes following thyroid and parathyroid surgery in pregnant women. Arch Surg 2009; 144(5): 399–406.
20. Límanová Z, Jiskra J, Springer D et al. Doporučení pro diagnostiku a léčbu onemocnění štítné žlázy v těhotenství a pro ženy s poruchou fertility. Prakt Gyn 2013; 17(2): 173–199.
21. Abalovich M, Amino N, Barbour LA et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2007; 92(8, Suppl): 1–47.
22. De Groot L, Abalovich M, Alexander EK et al. Management of thyroid dysfunction during pregnancy and postpartum: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2012; 97(8): 2543–2565.
23. Loh JA, Wartofsky L, Jonklaas J et al. The magnitude of increased levothyroxine requirements in hypothyroid pregnant women depends upon the etiology of the hypothyroidism. Thyroid 2009; 19(3): 269–275.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2014 Issue 1-
All articles in this issue
- Interview with prof. David Cibula, MD, president elect of ESGO
- Recent trends in epidemiology of gynecological malignancies in Czech Republic: prediction of progress and patients' survival
- Early-stages breast cancer diagnosis in the University Hospital Brno in the period since September 2002 to December 2013
- Nonpalpable breast tumours and possibilities of its surgical treatment in presents
- Immediate breast reconstruction in cancer patients: our experience
- Breast cancer during pregnancy
- Thyroid cancer in pregnancy: case reports
- Specifics of ovarian cancer in patients with BRCA mutations: PARP Inhibitor Treatment in Ovarian and Breast Cancer
- The connection of anal and cervical HPV infection in high risk women
- Biological treatment of patient with generalized breast cancer: case report
- Why we use mammography to screening breast cancer and why we won't to stop it not even after publication of recent Canadian study? Reaction to study of AB Miller et al published in British Medical Journal 2014
-
Hymen, Godsend or Curse?
Surgical Outpatient Hysteroscopy Using Vaginoscopic Access in Patients with Preserved Hymen - Father on childbirth
- Planned parenthood before and today
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Father on childbirth
-
Hymen, Godsend or Curse?
Surgical Outpatient Hysteroscopy Using Vaginoscopic Access in Patients with Preserved Hymen - Specifics of ovarian cancer in patients with BRCA mutations: PARP Inhibitor Treatment in Ovarian and Breast Cancer
- Thyroid cancer in pregnancy: case reports
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

