-
Medical journals
- Career
Dopplerometrie ductus venosus
Authors: L. Jabůrek 1; M. Pětroš 2
Authors‘ workplace: Gynekologicko-porodnická klinika FN a LF UP Olomouc 1; Gynekologicko-porodnická klinika FN Ostrava 2
Published in: Prakt Gyn 2009; 13(4): 214-217
Overview
Cíl studie:
Shrnutí poznatků o významu a využití dopplerometrických vyšetření ductus venosus v klinické praxi. Typ studie: Souhrnný článek.Název a sídlo pracoviště:
Gynekologicko‑porodnická klinika, FN Olomouc.Předmět a metoda studie:
Rešerše z literatury a medicínských databází.Závěr:
Doppleromterie ductus venosus je významná diagnostická metoda vyšetřování žilního systému plodu. V prvním trimestru je doplňkovou metodou kombinovaného genetického screeningu aneuploidií. V dalších trimestrech a během první doby porodní včasně informuje o selhávání kompenzačích mechanizmů v redistribuci krevního toku u ohrožených plodů.Klíčová slova:
dopplerometrie – ductus venosus – fetální žilní oběhÚvod
Dopplerometrie ductus venosus představuje neinvazivní prostředek pro včasnou detekci závažných patologických stavů plodu v rámci specializovaného prenatálního vyšetření. Zatímco změny průtoku v uterinních a umbilikálních arteriích a zejména nulový či reverzní end diastolický průtok informují o zvýšené rezistenci placenty, je zvýšení průtoku v arteria cerebri media (snížení pulzatilního indexu) již první známkou zapojení kompenzačních mechanizmů a preferenčního přerozdělení fetálního krevního toku ve prospěch životně důležitých orgánů (myokard, mozek a nadledviny), tzv. „brain sparing“ efektu, na úkor ostatních částí těla. Měření průtoku v ductus venosus ukazuje poměry ve venozní cirkulaci a časně signalizuje selhávání kompenzačních mechanizmů. Dokud je zajištěna oxygenace myokardu, nedochází k rozvoji pravostranného srdečního selhání, i když jsou hemodynamické podmínky pro obě komory diametrálně odlišné. V této fázi na KTG záznamech jsou ještě reaktivní křivky s normální variabilitou a biofyzikální profil je rovněž normální. S pokračujícím rozvojem hypoxie dochází k hypoxii myokardu, acidoze, laktacidémii a ke snížení jeho kontraktility. Snížení relaxační schopnosti vede k dilataci a selhávání pravé komory a k přenosu tlakového gradientu do pravé síně. Následné změny ve venózní cirkulaci svědčí o postupném vyčerpání kompenzačních mechanizmů a na KTG záznamech se objevují abnormity. Krev je redistribuována z umbilikální žíly přímo do ductus venosus na úkor jaterní cirkulace. Zvyšuje se amplituda pulzací ve vena cava inferior s reverzním tokem. Další zvýšení placentální rezistence a periferní vasokonstrikce vede k přenosu tlakového gradientu z pravé síně skrze ductus venosus do vena umbilicalis. Na spektrálních křivkách z ductus venosus jsou patrné při kontrakci pravé síně (vlna a) nulové (zero) nebo reverzní toky. Prognosticky velmi závažný je výskyt pulzace ve vena umbilicalis, kdy je postižen i fetální koronární průtok a hrozí smrt plodu během několika dnů [1].
Anatomie a vývoj ductus venosus
Ductus venosus Arantii vedle foramen ovale a ductus arteriosus představuje jednu ze tří cévních spojek ve fetální cirkulaci. Jedná se o 2 mm tenkou vénu trumpetovitého tvaru, která spojuje třikrát silnější umbilikální vénu přímo s dolní dutou žílou.Vývojově pochází z omfalomesenterických cév a formuje se z jaterních sinů. Jako organizovaná vaskulární struktura bývá definována po 8. týdnu gestace. Vyvíjí se u placentálních savců a slouží k regulaci fetální venózní cirkulace. Sonograficky může být vizualizován vaginální sonografií od 9. do10. týdne [2]. Odstupuje z umbilikální vény před jejím odklonem doprava do portálního sinu. Směřuje kraniálně a dorzálně a vstupuje do dolní duté žíly v úrovni vyústění hepatických vén těsně pod bránicí, se kterými vytváří subdiafragmatické vestibulum. Ductus venosus je důležitá céva v redistribuci oxygenované krve, která obchází jaterní parenchym a směruje krevní tok skrze foramen ovale přímo do levého srdce. Za normálních podmínek přibližně 20 – 30 % krve z umbilikální žíly prochází skrze ductus venosus, ale během hypoxie stoupá tento podíl až k 60 % na úkor jaterních žil, které s ním běží v paralelním uspořádání [3 – 7]. V extrémním případě směřuje veškerá krev z arteria umbilicalis do ductus venosus, což může vést k poškození funkce jater. Mezi 12. – 15. týdnem je průměrná rychlost v ductus venosus 28 cm/ s a je třikrát vyšší než v dolní duté žíle, čímž nedochází k mísení různě oxygenovaných porcí krve, a dobře oxygenovaná krev z ductus venosus je pomocí crista dividens směrována k foramen ovale, zatímco deoxygenovaná krev z horní a dolní duté žíly je separátně odváděna k trikuspidální chlopni. Přítomnost anatomické struktury sfinkteru na odstupu ductus venosus z vena umbilicalis je opakovaně diskutována [8 – 9]. Na vstupu do ductus venosus se nachází několikavrstevná podkovovitá struktura svaloviny a v celém průběhu ductus venosus jsou ve stěně svalové buňky reagující na neurohumorální stimuly. V endotelu je produkován vasokonstrikční endothelin 1 i vasodilatační prostaglandiny (PGE2 a PGI) a katecholaminy, které hrají aktivní roli v regulaci průtoku a při uzávěru ductus venosus [10]. Proces regulace tonu a jeho uzávěru je aktivně řízen. Po porodu se ductus venosus uzavírá, ale načasovaní je mezidruhově individuální, takže může u některých druhů dočasně perzistovat jako portokavální spojka [11 – 14]. Naopak se může vyskytnout také ageneze venózního duktu s extrahepatální i intrahepatální drenáží. Intrahepatální drenáž vena umbilicalis do portálního sinu je spojena s hydrothoraxem a s dalšími malformacemi [15]. Extrahepatální drenáž do prerkordiálního žilního segmentu, do pravé či levé síně nebo do koronárního sinu může být slučitelná se životem, ale často bývá spojena s postnatálními kongestivními komplikacemi [16].
Normální dopplerometrie ductus venosus
Referenční průtokové hodnoty pro ductus venosus ve druhé polovině gravidity byly publikovány poprve v roce 1991 [17]. Brzy následovaly další studie [2,18 – 22].
Podle polohy plodu za pomocí barevného mapování lze ductus venosus zaměřit buď v pravém parasagitálním, nebo mírně šikmém transversálním průřezu. Na zúženém místě vstupu do ductus venosus dochází vlivem vysoké rychlosti krevního toku při barevném zobrazení k aliasing fenomenu. Pulzním dopplerometrickým vyšetřením lze získat spektrální záznam, který je dále zpracováván softwarem sonografu. Ve vztahu ke kardiálnímu cyklu je patrný trojfázový tvar křivky, který je dán vysokým tlakovým gradientem mezi venózním duktem a pravým atriem. Z jejího charakteru lze odvodit průtokové rychlosti v systole (vlna S), v časné diastole s otevřenými atrioventrioventrikulárními chlopněmi (vlna D) a při kontrakci pravé síně (vlna a) a vyjádřit vzájemné relace v indexu pulzatility (PI). Za normální situace end diastolický krevní tok i při kontrakci pravé síně (vlna a) je pozitivní (obr. 1a). S pokračující graviditou se zvyšují maximální průtokové rychlosti v systole a diastole a úměrně se zvyšují i střední průtokové rychlosti v. Tomu odpovídá i pokles pulzatilního indexu [23]. Maximální průtoková rychlost v 18. týdnu je 65 cm/ s a v termínu porodu je 75 cm/ s. Tyto změny vysvětluje snížená placentální rezistence, zlepšení compliance komor srdečních a snížení kardiálního afterloadu. Dopplerovská měření (obr. 2) je nutno provádět za klidových podmínek plodu s vyloučením dýchacích pohybů plodu, při dostatečném zvětšení obrazu, kdy vzorkovací objem zachycuje celý lumen duktu a insonační úhel není větší než 30 stupňů s filtrem 50 – 70 Hz a rychlostí posunu křivky 2 – 3 cm/ s [24]. K vyhodnocení křivky je nutno získat alespoň 3 uniformní vlny.
Obr. 1a. Normální spektrogram ductus venosus s pozitivním end-diastolickým tokem. 
Obr. 1b. Patologický spektrogram ductus venosus s nulovým end-diastolickým tokem. 
Obr. 1c. Patologický spektrogram ductus venosus s reverzním end-diastolickým tokem. 
Velocimetrie ductus venosus a patologické stavy plodu
Dopplerometrie ductus venosus je významná diagnostická metoda vyšetřování žilního systému plodu, jak v prvním trimestru, kdy je doplňkovou metodou kombinovaného genetického screeningu aneuploidií, tak i v dalších trimestrech a během první doby porodní [25], kdy včasně informuje o redistribuci žilního toku a selhávání kompenzačích mechanizmů u ohrožených plodů. Za patologických stavů se zvyšuje PI, klesá střední průtoková rychlost a krevní tok v end diatole ustává (obr. 1b) – zero flow, nebo se obrací (obr. 1c) – reversed flow). Abnormální průtok v ductus venosus mezi 10. a 14. týdnem je spojen chromozomálními aberacemi, srdečními abnormalitami a nepříznivým výsledkem těhotenství [26]. Bývá pozorován jen u 5 % chromozomálně normálních plodů, ale až u 80 % plodů s trizomií 21 a v 75 % všech chromozomálních abnormalit. Lze jej kombinovat s vyšetřením šíjového projasnění jako nezávislého markeru, čímž lze dosáhnout zvýšení účinnosti raného ultrazvukového screeningu trizomie 21 [27]. Změny PI v ductus venosus byly pozorovány u chromozomálních abnormalit bez kardiálních defektů a naopak u kardiálních defektů s normálním karyotypem. Patologický průtok v ductus venosus byl také detekován u anémie plodu a u twin to - twin transfuzního syndromu [28]. Výskyt patologické flowmetrie ductus venosus, zejména u růstově retardovaných plodů a u pre eklampsie, vždy představuje vážné ohrožení plodu. Předchází nejméně dva týdny změnám na KTG [29 – 31] a je významným faktorem při časování porodu [32].
Image 1. Ductus venosus v parasagitální projekci s normální spektrální křivkou s pozitivním end-diastolickým krevním tokem (vlna a). 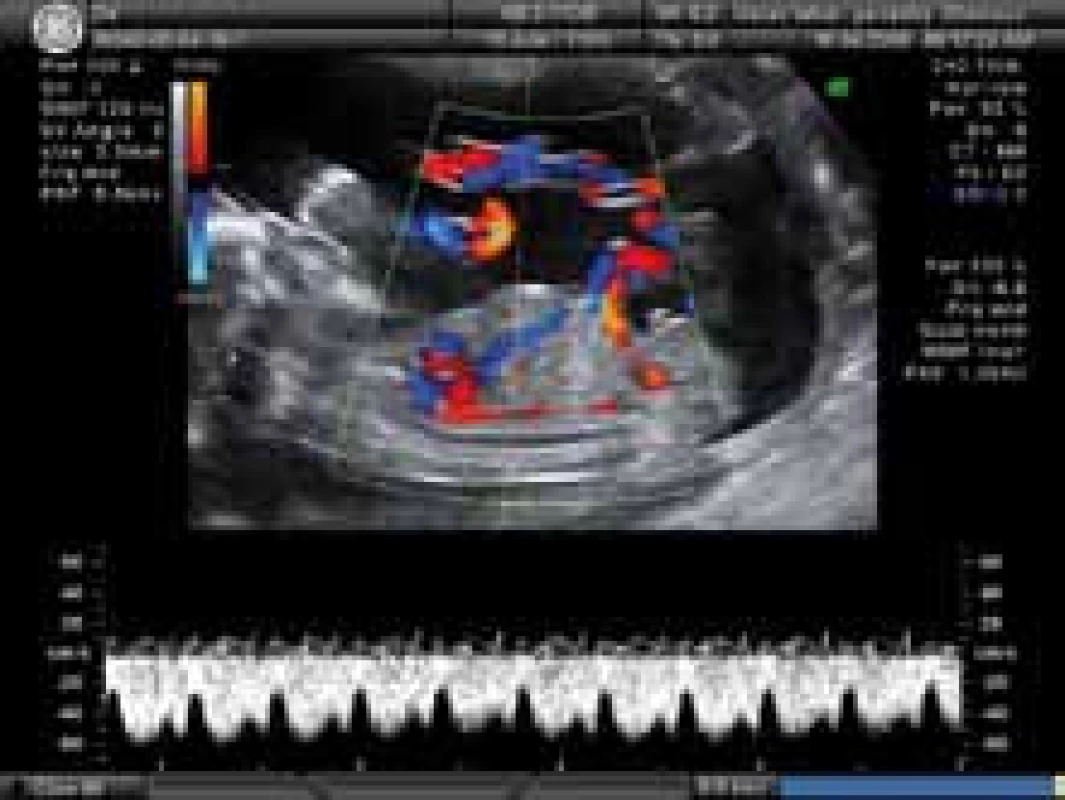
Závěr
Vyšetřování cirkulace v prekordiálních vénách koreluje s acidobazickým stavem plodu. Patologické spektrogramy signalizují selhávání adaptačních mechanizmů společně s pravostrannou srdeční insuficiencí. V prvním trimestru je doplňkovou metodou kombinovaného genetického screeningu aneuploidií. V dalších trimestrech a během první doby porodní včasně informuje o selhávání kompenzačích mechanizmů v redistribuci krevního toku u ohrožených plodů. Dopplerometrie ductus venosus tak tvoří součást mozaiky diagnostických metod k detekci ohrožení a k predikci stavu plodu.
MUDr. Ladislav Jabůrek1
MUDr. Michal Pětroš2
1 Gynekologicko-porodnická klinika FN a LF UP Olomouc
2 Gynekologicko-porodnická klinika FN Ostrava
Sources
1. Baschat AA, Gembruch U, Reiss I et al. Demonstration of fetal coronary blood flow by Doppler ultrasound in relation to arterial and venous flow velocity waveforms and perinatal outcome. The heart sparing effect. Ultrasound Obstet Gynecol 1997; 9(3): 162 – 172.
2. Hecher K, Campbell S, Snijders R et al. Reference ranges for fetal venous and atrioventricular blood flow parameters. Ultrasound Obstet Gynecol 1994; 4(5): 381 – 390.
3. Bellotti M, Pennati G, De Gasperi C et al. Role of ductus venosus in distribution of umbilical blood flow in human fetuses during second half of pregnancy. Am J Physiol 2000; 279(3): H 1256 – H1263.
4. Edelstone DI. Regulation of blood flow through the ductus venosus. J Dev Physiol 1980; 2(4): 219 – 238.
5. Kiserud T, Rasmussen S, Skulstad S. Blood flow and the degree of shunting through the ductus venosus in the human fetus. Am J Obstet Gynecol 2000; 182 : 147 – 153.
6. Rudolph AM. Hepatic and ductus venosus blood flow during fetal life. Hepatology 1983; 3(2): 254 – 258.
7. Tchirikov M, Rybakowski C, Hüneke B et al. Blood flow through the ductus venosus in singleton and multifetal pregnancies and in fetuses with intrauterine growth retardation. Am J Obstet Gynecol 1998; 178(5): 943 – 949.
8. Chacko AW, Reynolds SRM. Embryonic development in the human of the sfincter of the ductus venosus. Anatom Record 1953; 115 : 152 – 173.
9. Mavrides E, Moscoso G, Carvalho JS et al. The human ductus venosus between 13 and 17 weeks of gestation: histological and morphometric studies. Ultrasound Obstet Gynecol 2002; 19(1): 39 – 46.
10. Adeagbo ASO, Kelsey L, Coceani F. Endothelin‑induced constriction of the ductus venosus in fetal sheep: developmental aspects and possible interaction with vasodilatatory prostaglandin. Br J Pharmacol 2004; 142(4): 727 – 736.
11. Fugelseth D, Lindeman R, Liestrøl K et al. Ultrasonographic study of ductus venosus in healthy neonates. Arch Dis Child Fetal Neonatal Ed 1997; 77(2): F131 – F134.
12. Fugelseth D, Lindeman R, Liestrøl K et al. Postnatal closure of ductus venosus in preterm infants < 32 weeks. An ultrasonographic study. Early Human Dev 1998; 53(2): 163 – 169.
13. Momma K, Ito T, Ando M. In situ morphology of the ductus venosus and related vessels in the fetal and neonatal rat. Pediatr Res 1992; 32(4): 386 – 389.
14. Zink J, Van Petten GR. Time course of closure of the ductus venosus in the newborn lamb. Pediatr Res 1980, 14(1): 1 – 3.
15. Jorgenses C, Adolf E. Four cases of absent ductus venosus: three in combination with severe hydrops fetalis. Fetal Diagn Ther 1994; 9(6): 395 – 397.
16. Berg C, Kamil D, Geipel A et al. Absence of ductus venosus – importace of umbilical velus drainage site. Ultrasound Obstet Gynecol 2006; 28 : 275 – 281.
17. Kiserud T, Eik - Nes SH, Blaas HG et al. Ultrasonographic velocimetry of the fetal ductus venosus. Lancet 1991; 338(8780): 1412 – 1414.
18. DeVore GR, Horenstein J. Ductus venosus index: a method for evaluating right ventricular preload in the sekond - trimester fetus. Ultrasound Obstet Gynecol 1993; 3(5): 338 – 342.
19. Huisman TWA, Stewart PA, Wladimiroff JW. Ductus venosus blood flow velocity waweforms in the human fetus – a Doppler study. Ultrasound Med Biol 1992; 18(1): 33 – 37.
20. Kessler J, Rasmussen S, Hanson M et al. Longitudinal reference ranges for ductus venous flow velocities and waveform indices. Ultrasound Obstet Gynecol 2006; 28(7): 890 – 898.
21. Kiserud T, Eik - Nes SH, Hellevik R et al. Ductus venosus – a longitudinal Doppler velocimetric study of the human fetus. J Matern Fetal Invest 1992; 2 : 5 – 11.
22. Tchirikov M, Schröder HJ, Hecher K. Ductus venosus shunting in the fetal venous circulation: regulatory mechanisms, diagnostic methods and medical importance. Ultrasound Obstet Gynecol 2006; 27(4): 452 – 461.
23. Van Splunder P, Huisman TWA, De Ridder MAJ et al. Fetal venous and arterial flow velocity waveforms between eight and twenty weeks of gestation. Pediatr Res 1996; 40 : 158 – 162.
24. Matias A, Gomes C, Flack N et al. Screening for chromosomal abnormalities at 11 – 14 weeks; tho role of ductus venosus blood flow. Ultrasound Obstet Gynecol 1998; 2 : 380 – 384.
25. Krapp M, Denzel S, Katalinic A et al. Normal values of fetal ductus venosus blood flow waveforms during the first stage of labor. Ultrasound Obstet Gynecol 2002; 19(6): 556 – 561.
26. Borell A, Martinez JM, Serés A et al. Ductus venosus assessment at the time of nuchal translucency measurement in the detection of fetal aneuploidy. Prenat Diagn 2003; 23(11): 921 – 926.
27. Nicolaides KH. Nuchal translucency and other first - trimester sonographic markers of chromosomal abnormalities. Am J Obstet Gynecol 2004; 191(1): 45 – 67.
28. Sebire NJ, Souka A, Skentou H et al. Early prediction of severe twin‑to - twin transfusion syndrome. Hum Reprod 2000; 15(9): 2008 – 2010.
29. Hecher K, Hackeloer B. Cardiotocogram compared to Doppler investigation of the fetal circulation in the premature growth - retarded fetus: longitudinal observations. Ultrasound Obstet Gynecol 1997; 9(3): 152 – 161.
30. Kiserud T, Eik - Nes SH, Blaas HG et al. Ductus venosus blood velocity and the umbilical circulation in the seriously growth - retarded fetus. Ultrasound Obstet Gynecol 1994; 4(2): 109 – 114.
31. Arduini D, Rizzo G, Romanini C. Changes of pulsatility index from fetal vessels preceding the onset of late deceleration in growth - retarded fetuses. Obstet Gynecol 1992; 79(4): 605 – 610.
32. Baschat AA, Güclü S, Kush ML. Venous doppler in the prediction of acid - base status of growth - restricted fetuses with elevated placental blood flow resistence. Am J Obstet Gynecol 2004; 191 : 277 – 284.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2009 Issue 4-
All articles in this issue
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Molekulovo- genetická analýza tumorsupresorových génov PTEN a TP53 u pacientky s karcinómom endometria
- Biologická léčba karcinomu prsu
- Tradiční peruánská medicína v léčbě neplodnosti
- Rýchla prenatálna diagnostika chromozómových aneuploidií
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

