-
Medical journals
- Career
Hysteroskopie v diagnostice a terapii ženské neplodnosti
Authors: B. Babjak; B. J. Eim
Authors‘ workplace: Nemocnice Vyškov p. o. ; Gynekologicko‑porodnické oddělení
Published in: Prakt Gyn 2009; 13(1): 18-22
Overview
Hysteroskopie patří mezi miniinvazivní chirurgické výkony a je považována za „zlatý standard“ intrauterinní diagnostiky. Současně se řadí mezi „see and treat“ techniky, takže je možné danou patologii ihned vyřešit. Sehrává důležitou úlohu v řešení děložního faktoru sterility. Poskytuje možnost optického zhodnocení nálezu v hrdle děložním a dutině děložní, cílený odběr materiálu a chirurgickou léčbu většiny intrauterinních patologií. Nabízí mnohem lepší zobrazení dutiny děložní ve srovnání s ultrazvukem nebo s hysterosalpingografií. Z intrauterinních patologií jsou nejčastější příčinou neplodnosti endometriální polypy, děložní myomatóza, synechie a vrozené vývojové vady dělohy. Všechny tyto patologie se dají diagnostikovat a terapeuticky řešit hysteroskopií. Rozvojem nových technik se zmenšováním průměru tubusů odpadá nutnost dilatace hrdla s možností provádět velkou část výkonu bez anestezie. Hysteroskopická technika je vysoce efektivní, s nízkým procentem komplikací, s nízkým dyskomfortem pro pacientku a jejím rychlým návratem do běžného života. Kombinací s laparoskopií umožňuje kompletní anatomické zhodnocení reprodukčních orgánů neplodné ženy.
Klíčová slova:
neplodnost – hysteroskopie – intrauterinní polypy – myomy – intrauterinní adhezeHysteroskopie (HSK) je známa již více než celé století, ale teprve poslední desetiletí přinesla rozšíření této metody do běžné gynekologické praxe. Její současné popularitě nepochybně napomohla globální preference metod minimálně invazivní chirurgie (obr. 1), zvláště obrovský rozvoj metod asistované reprodukce, kde hysteroskopie sehrává důležitou roli nejen v diagnostice, ale i v terapeutickém řešení děložního faktoru ženské neplodnosti. HSK patří mezi miniinvazivní chirurgické výkony a je považována za „zlatý standard“ intrauterinní diagnostiky. Současně se řadí mezi „see and treat“ techniky, takže je možné danou patologii ihned vyřešit. Tato přehledová práce se zabývá využitím HSK při řešení uterinních patologií při neplodnosti s využitím vlastních zkušeností s HSK.
Image 1. Hysteroskop Wolf 20st optika, tubus 5,5 mm. 
Děložní faktor sterility
Neplodností u nás trpí cca 10–15 % partnerských dvojic. Na příčinách neplodnosti se podílí v 30–35 % pouze muž a ve 35–40 % pouze žena. Kombinace faktorů neplodnosti u obou partnerů se vyskytuje u 25 % partnerských dvojic. Děložní a cervikální faktor tvoří 10–15 % příčin neplodnosti u žen. Mezi nejčastější příčiny uterinního faktoru sterility patří hypoplazie dělohy, vývojové vady dělohy, pozánětlivé a potraumatické změny (Ashermanův syndrom), patologie endometria a patologie myometria (myomy) – tab. 1. Všechny tyto stavy se dají diagnostikovat a terapeuticky řešit hysteroskopií. Při hodnocení intrauterinních patologií je ultrazvukové vyšetření „screeningem“, hysteroskopie vlastní vyšetřovací metodou (evaluace) a cílený odběr k histologickému vyšetření diagnózu potvrdí (konfirmace) (obr. 2) [1,2]. V následujících řádcích si postupně probereme úlohu a využití hysteroskopie v řešení příčin neplodnosti (tab. 2).
Image 2. Pohled do dutiny děložní bez zjevné patologie. 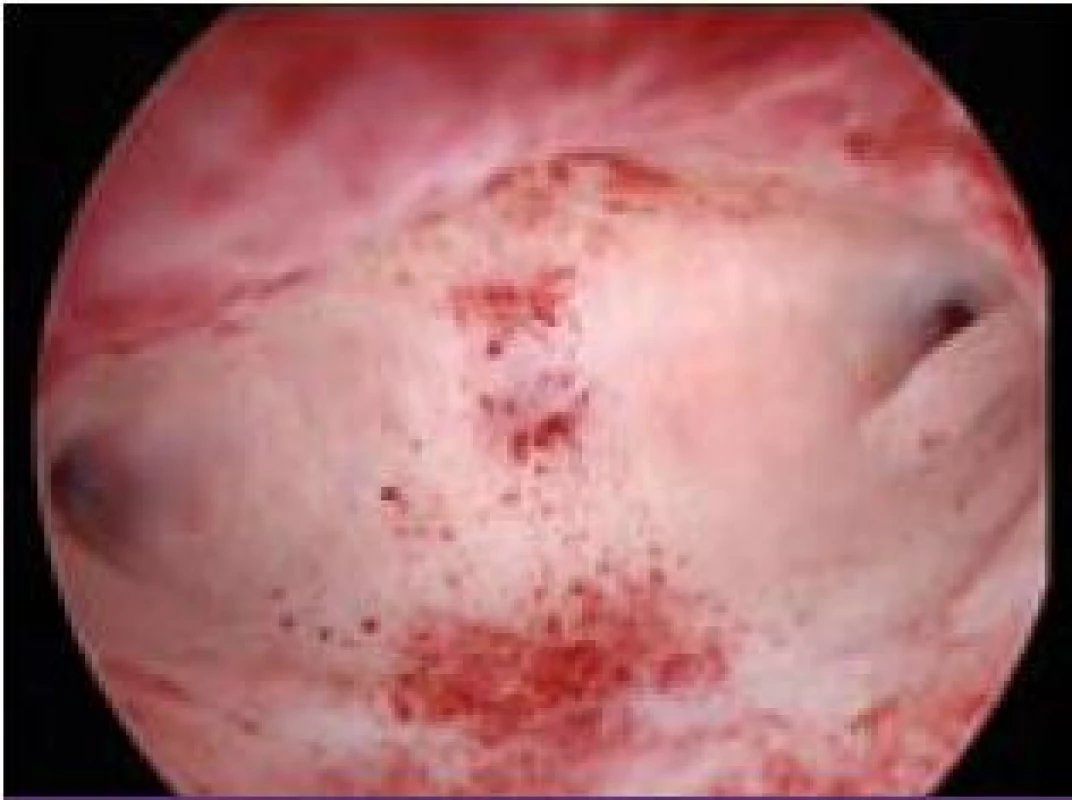
Table 1. Příčiny děložního faktoru sterility. 
Table 2. Nejčastější hysteroskopické výkony při řešení příčin neplodnosti. 
Diagnostická hysteroskopie
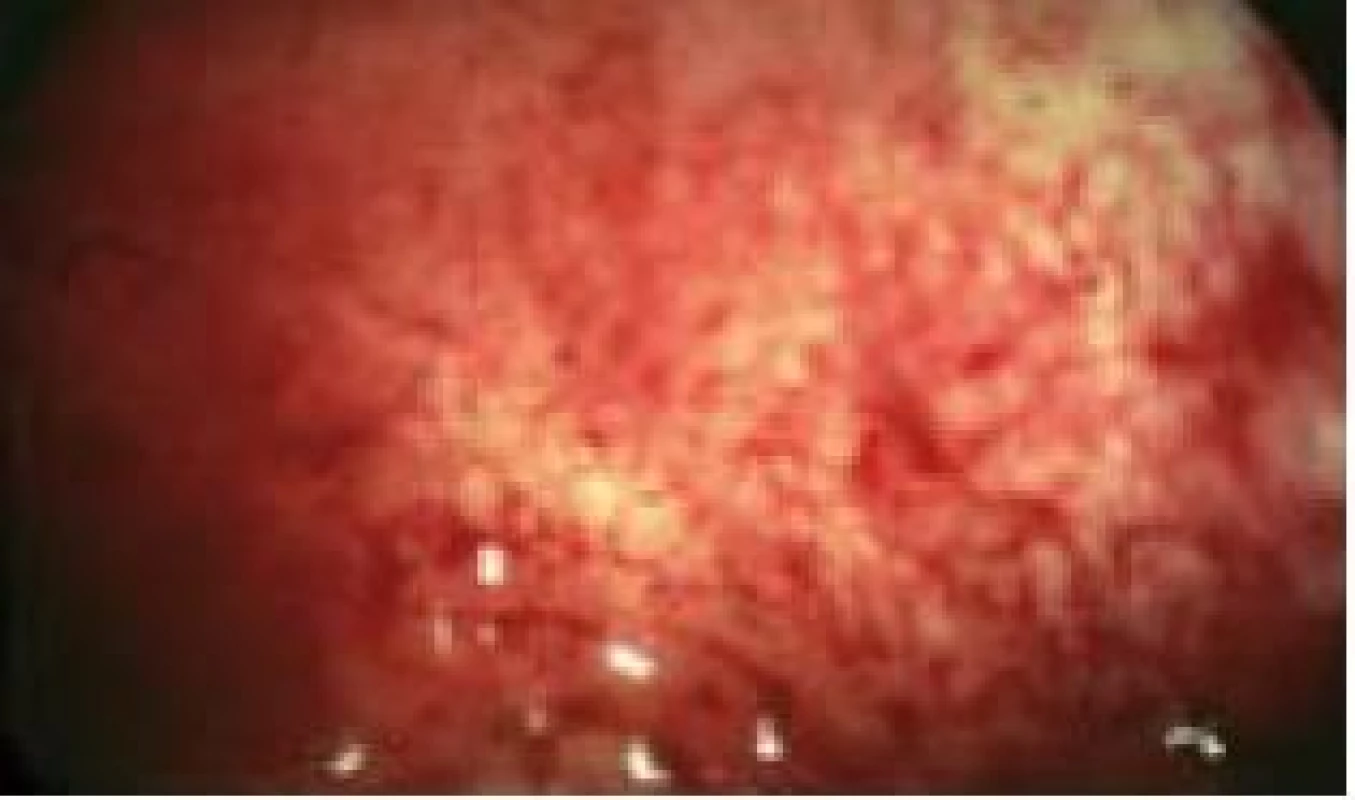
Při diagnostické hysteroskopii hodnotíme tvar dutiny děložní, prostornost, děložní malformace a deformace dělohy. Na endometriu hodnotíme jeho maturaci, distribuci, vaskularizaci, eventuálně zánětlivé změny. Součástí diagnostické hysteroskopie je i cílený odběr vzorků endometria na histologické vyšetření, protože jak je známo, kyretáží získáváme pouze 50 % endometria a nediagnostikujeme 10–35 % intrauterinních lézí. Můžeme provést „punch biopsii“ pomocí bioptických kleští nebo „grasp biopsii“ pomocí krokodýlových kleští, při které bioptujeme větší rozsah endometria a vzorky extrahujeme až po vyndání hysteroskopu. Histologické vyšetření endometria je důležité také z hlediska datace fáze menstruačního cyklu, i když v dnešní době převažují snadnější metody datace, zejména určení hladiny progesteronu v luteální fázi cyklu. Hysteroskopicky můžeme vizuálně zhodnotit výšku a charakter endometria vzhledem k fázi menstruačního cyklu. Insuficienci luteální fáze můžeme diagnostikovat u 3 až 20 % neplodných žen a až u 23–60 % žen s opakovanými potraty [3]. Při diagnostice endometritidy jako jedné z příčin sterility má HSK 17% senzitivitu a 93% specificitu. Typickým znakem endometritidy je zvýšený počet cév v proliferační fázi cyklu (obr. 3). Endometrium vypadá jako jahoda – světlé žlázky na červené sliznici [4]. Konečně již samotná diagnostická hysteroskopie zvyšuje pravděpodobnost spontánního otěhotnění. Tlakem distenčního média se můžou uvolnit jemné adheze v dutině děložní a proplachem tub se může uvolnit jejich eventuální okluze [5].
Intrauterinní polypy
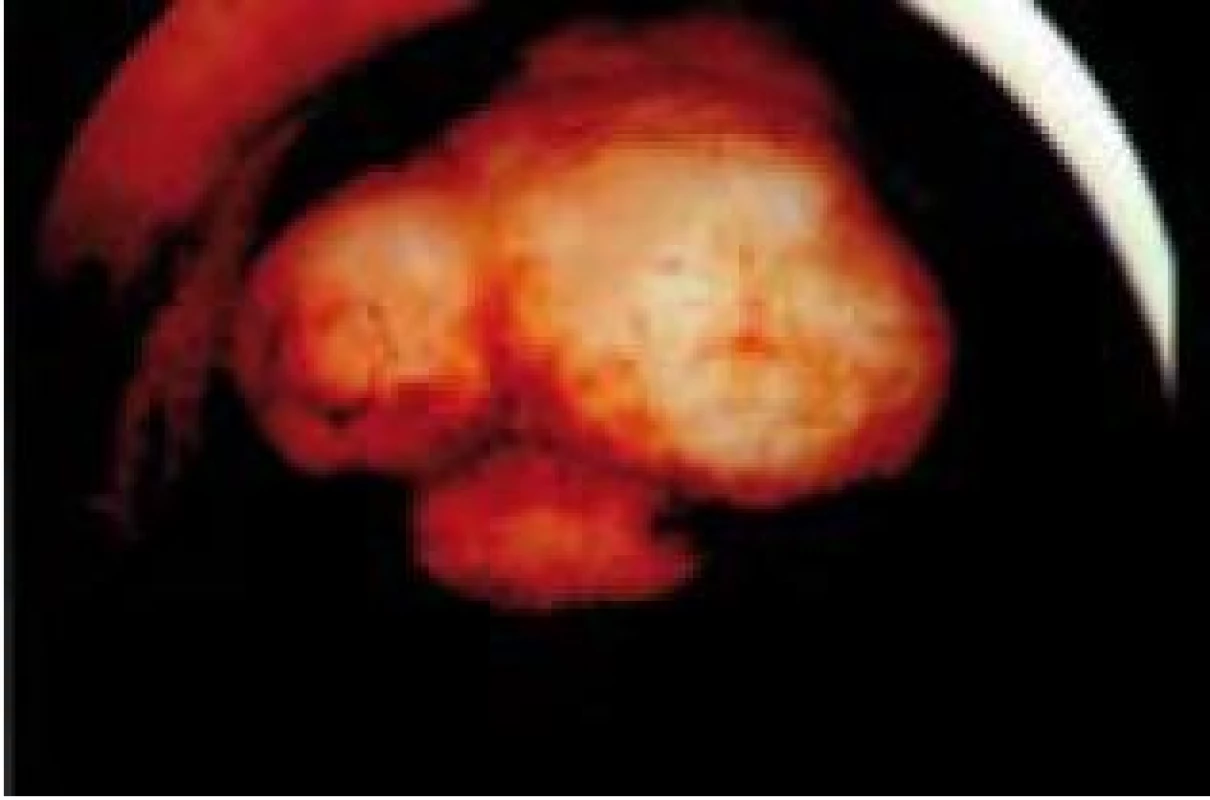
Polyp endometria je benigní léze složená z buněk endometria a stromatu, které vytvářejí ohraničenou masu vyčnívající z okolní tkáně směrem do děložní dutiny (obr. 4, 5, 6). Na polypy endometria nás často upozorní ultrazvukový nález, teprve hysteroskopie však může nález verifikovat. V populaci je uváděná přibližně 25% prevalence. U asymptomatických premenopauzálních žen nad 30 let je prevalence 10 %, přičemž u infertilních pacientek až kolem 16 % [6]. Vliv polypů na fertilitu je komplexní. Způsobují iregulární krvácení, působí stejným mechanismem jako IUD. Mohou vyvolávat zánětlivou odpověď okolního endometria, obturují dutinu děložní a tím brání transportu spermií. Způsobují poruchy implantace blastocysty. V posledních letech se zjistilo, že u pacientek s polypy je zvýšená hladina glykodelinu jak v krvi, tak i v děložním sekretu. Glykodelin je angiogenní růstový faktor produkovaný endometriem. Jeho hladina závisí na velikosti povrchu endometria. Glykodelin působí inhibičně na vazbu spermií k zona pellucida a tím také přispívá k neplodnosti pacientek s polypy [7]. Hysteroskopie sama o sobě není schopna rozlišit polypy bez buněčných atypií, s atypiemi nebo s fokální maligní transformací, proto je vždy nezbytné histologické ověření endoskopického nálezu. U polypů endometria je základním předpokladem prevence recidiv vlastní technika operačního výkonu. Je naprosto nezbytné resekovat stopku polypu až do úrovně myometria. Polyp nejčastěji resekujeme kličkou resektoskopu či jiným elektrochirurgickým nástrojem (je jich dnes k dispozici celá řada). Při tenké stopce můžeme použít i nůžky. Velké polypy můžeme odstranit i po částech podobným způsobem jako velké myomy (obr. 7, 8) [8,9].
Image 4. Přisedlý polyp zadní stěny děložní. 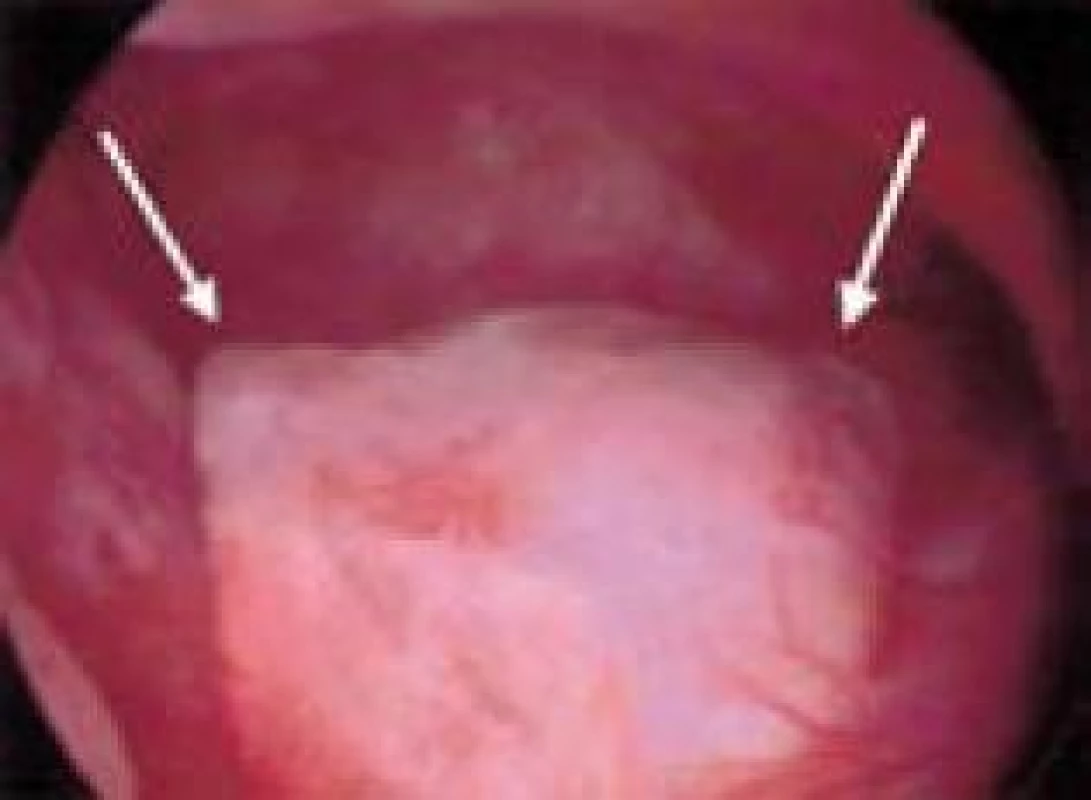
Image 5. Stopkatý polyp fundu děložního. 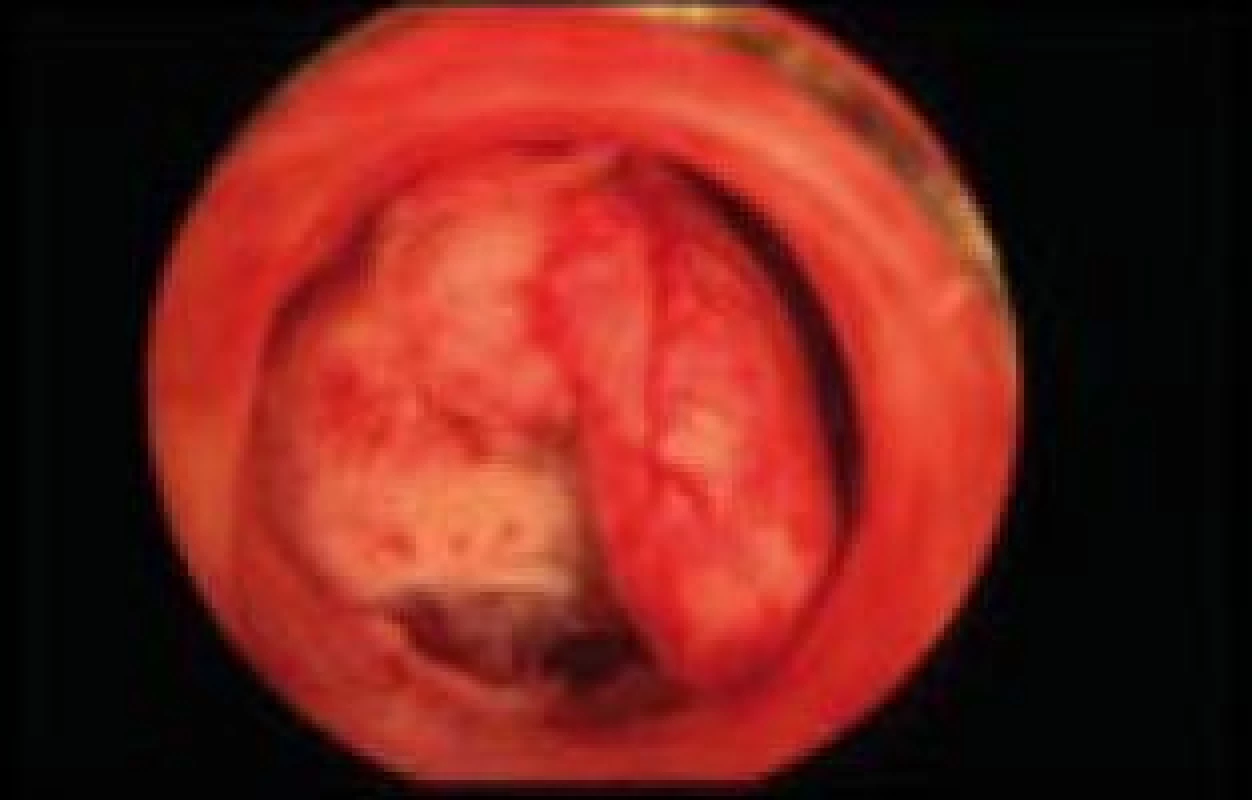
Image 6. Drobný vlající polyp. 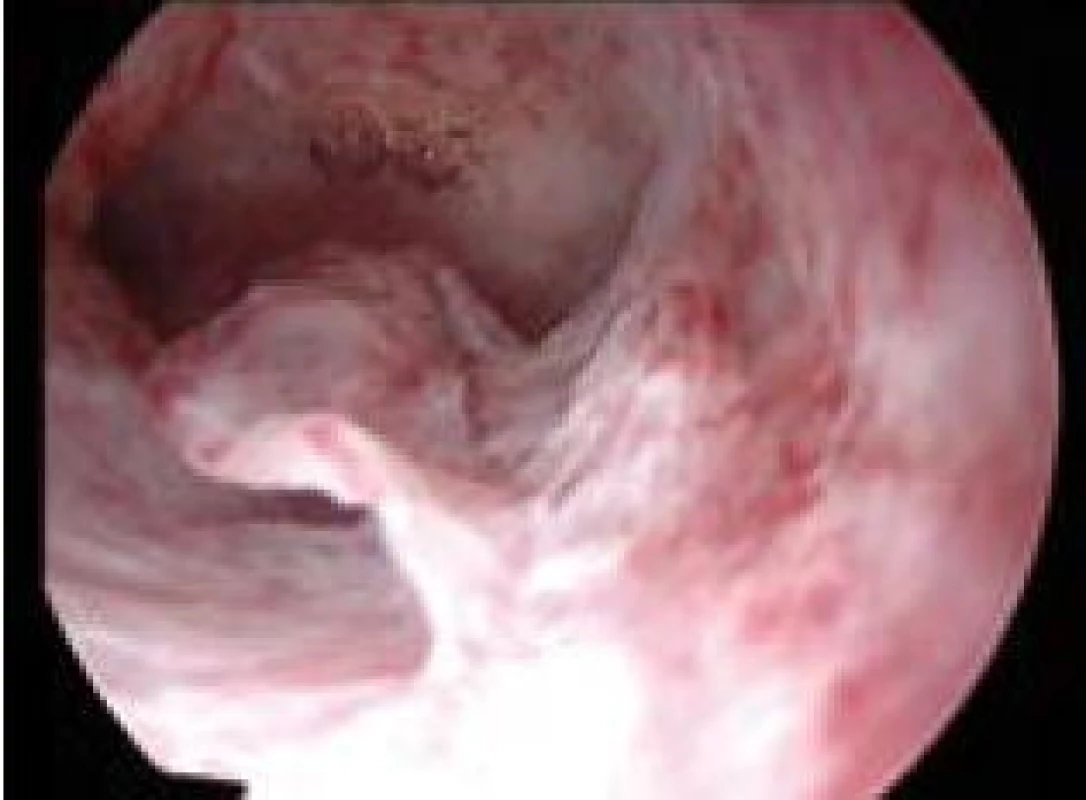
Image 7. Resekce polypu pomocí resektoskopu. 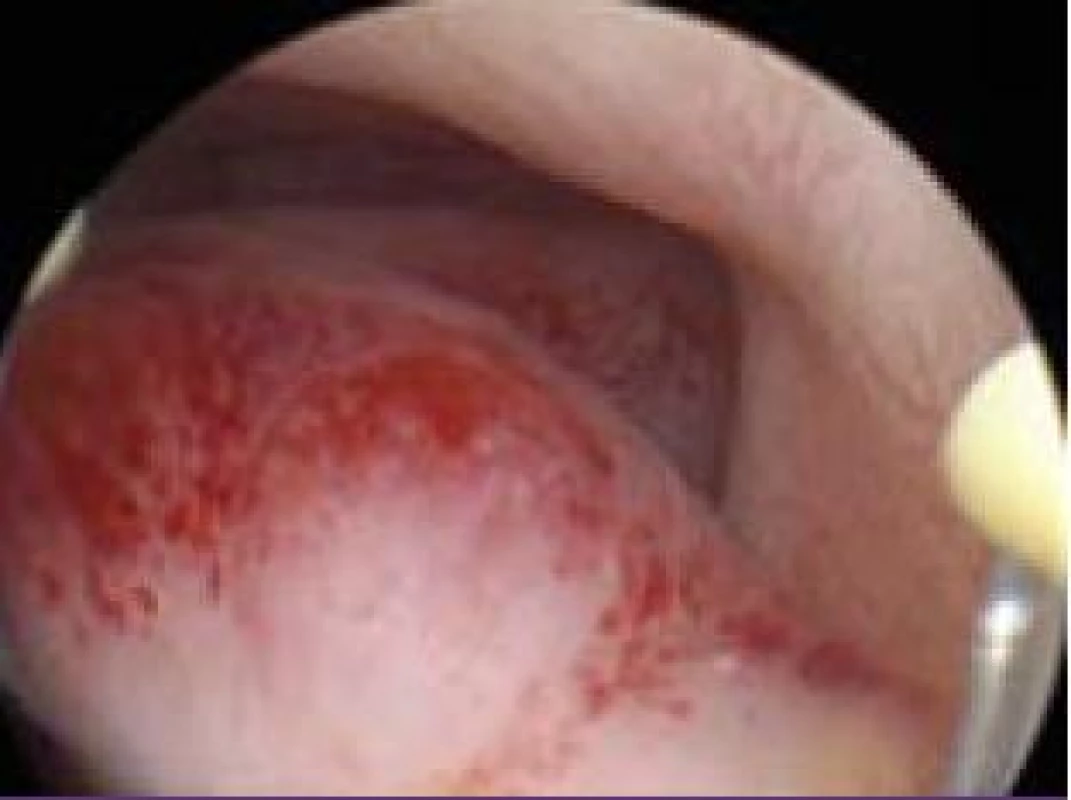
Image 8. Exstirpace drobného polypu pomocí hysteroskopických kleští. 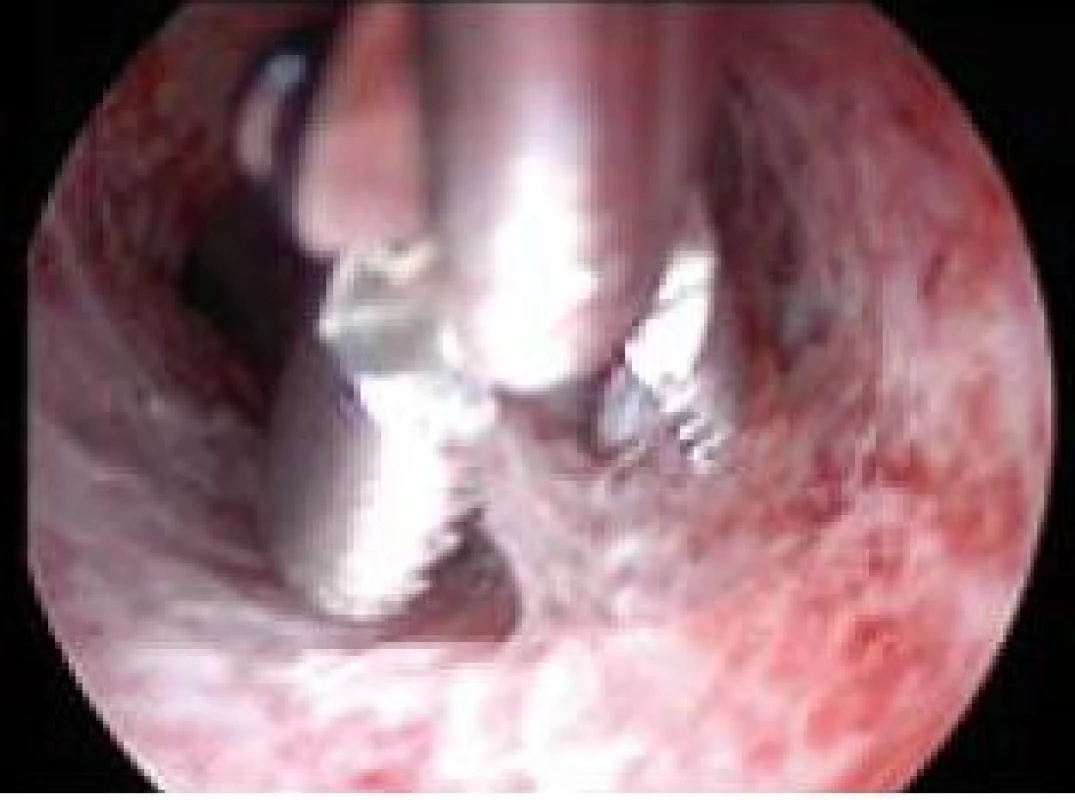
Myomy
Prevalence myomů v populaci do 30 let je kolem 30 %. Prevalence myomů u neplodných žen je až 2× vyšší oproti kontrolní skupině. Ženy s myomatózní dělohou mají signifikantně horší reprodukční výsledky in vitro fertilizace [10]. Hysteroskopie umožní vizualizaci submukózního myomu k určení jeho velikosti a klasifikaci. Submukózní myomy můžeme rozdělit do 3 typů podle vztahu ke stěně děložní. Toto dělení navrhl Wamsteker v roce 1993. Typ 0 představuje myom, který nezasahuje intramurálně (na stopce) (obr. 9), typ I zasahuje do stěny děložní méně než 50 % svého objemu a typ II je myom, který zasahuje více než 50 % svého objemu do myometria [2]. Za příčinný faktor sterility je považován myom přesahující 5 cm a/nebo jeho lokalizace je v blízkosti cervixu či tubárního ústí. Spíše než velikost a lokalizace leiomyomu je pro další osud těhotenství důležité místo nidace plodového vejce ve vztahu k myomu. Většina recentních prací doporučuje u neplodných žen s diagnostikovaným leiomyomem nad 4 cm jeho odstranění [11]. Hysteroskopická resekce myomů přesahujících 3 cm vede k signifikantnímu nárůstu donošených gravidit. 60 % žen po exstirpaci myomu spontánně otěhotní do 24 měsíců, většina do 1 roku [11]. Podmínky HSK resekability myomů jsou velikost dutiny děložní do12 cm, maximálně 3 myomy v dutině děložní, myom typu 0 nebo I a průměr myomu do 5 cm.
U myomů umístěných částečně ve stěně děložní je často nezbytné operovat ve dvou sezeních v cca 2–3 měsíčním odstupu. Výkon je však velmi šetrný a elegantní. Hospitalizace i pracovní neschopnost bývají velmi krátké.
„Second look“ hysteroskopie je doporučována po enukleaci objemných myomů, a to zejména u žen, které plánují těhotenství v krátkém časovém odstupu. Tento již podstatně méně invazivní zákrok slouží ke kontrole zhojení dělohy v místě po myomektomii, k rozrušení případných srůstů v dutině děložní a k testu průchodnosti vejcovodů. Většinou se provádí do 6 měsíců od první operace. Po hysteroskopické resekci myomu možno otěhotnět po cca 3 měsících [12,13].
Intrauterinní adheze
Ashermanův syndrom, poprvé popsaný v roce 1920, je charakterizován sníženou fertilitou spojenou s poruchami menstruace ve smyslu hypo nebo amenorey způsobenou intrauterinními adhezemi. Pro diagnózu adhezí svědčí tři znaky – porucha menstruace (hypo nebo amenorea), sterilita a v anamnéze kyretáž nebo jiný intrauterinní výkon. Prevalence adhezí se udává 5 až 39 % u pacientek s opakovanými potraty v anamnéze. Hamou pozoroval přítomnost amenorey u 30,4 % a hypomenoreu u 32,6 % pacientek s adhezemi [14]. Taylor popisuje sterilitu u 21,4 % pacientek s adhezemi oproti 3,2 % v kontrolní skupině [15]. The American Fertility Society klasifikuje intrauterinní adheze do tří stupňů dle bodového ohodnocení, při kterém se hodnotí rozsah adhezí, typ adhezí a stupeň intenzity menstruace (tab. 3). Bodové ohodnocení 1–4 představuje I. stupeň adhezí, 5–8 bodů II. stupeň a 9–12 bodů III. stupeň adhezí. V diagnostice má nezastupitelné místo hysteroskopie spolu s dnes již méně využívanou hysterosalpingografií. Hysteroskopicky popisujeme rozsah adhezí v dutině děložní, lokalizaci – centrální nebo marginální uložení – a morfologický typ, který nám s konečnou platností potvrdí histologie. Dle morfologie rozlišujeme endometriální, myometriální a vazivové adheze. Odstranění adhezí se provádí hysteroskopickými nůžkami nebo resektoskopem pomocí kličky. Ihned po odstranění adhezí se doporučuje inzerce IUD cca na 3 měsíce jako prevence znovuvytvoření synechií spolu s estrogenní terapií na podporu regenerace endometria. Pregnancy rate po léčbě je uváděn mezi 40 až 66 % [14]. V dalším těhotenství je zapotřebí pečlivě zhodnotit placentu z důvodu vyššího výskytu akretní placenty – cca 13 % [16].
Table 3. Klasifikace intrauterinních adhezí s bodovým ohodnocením (1988 – The American Fertility Society). 
Vývojové vady dělohy
Z vrozených vývojových vad (VVV) dělohy největší význam pro fertilitu mají uterus bicornis, uterus septus a subseptus. U žen s těmito vadami pozorujeme zvýšené procento potratů a předčasných porodů. Uterus septus je spojen s embryonálními ztrátami hlavně v první polovině těhotenství. Je to způsobeno implantací blastocysty v oblasti septa, které není dostatečně zásobeno cévami. Saravelos ve svém souboru popisuje prevalenci VVV dělohy u žen s opakovanými potraty 16,7 % versus 6,7 % v kontrolní skupině [17]. První endoskopickou resekci septa, která poté zcela nahradila Strassmanovu metroplastiku, provedl Edstrom v roce 1974. Před terapií je důležité rozlišit uterus septus od uterus bicornis. Toto odlišení nám neumožní ani hysteroskopie ani hysterosalpingografie, jedině laparoskopie. Předoperační hysterosalpingografie je vhodná pro posouzení rozsahu masy septa. Vlastní resekce septa se provádí buď pomocí hysteroskopických nůžek, nebo pomocí resektoskopu. Možné je i využití Argon Nd:YAG laseru. Nejdůležitější fází výkonu je rozhodnutí, kdy ukončit resekci septa tak, abychom nepoškodili myometrium nebo neprovedli perforaci dělohy. Riziko perforace dělohy je kolem 5 %. Dosažení děložního fundu je možno monitorovat při asistenci laparoskopem a rovnoměrném prosvícení dělohy hysteroskopem nebo pouze hysteroskopicky, kdy je možno volně přesunout konec hysteroskopu od jednoho proximálního ústí vejcovodu k druhému. Pooperační péče je stejná jako po operaci intrauterinních adhezí (IUD + estrogenní terapie) [2,18]. Po hysteroskopické resekci septa se procento donošených gravidit zvyšuje z 30 % až na 80 % [19]. Výhodou hysteroskopické resekce septa oproti klasické abdominální operaci je možnost provedení výkonu jako „office procedure“ bez nutnosti hospitalizace pacientky, nižší per a pooperační morbidita. Objem dutiny děložní se na rozdíl od klasické metroplastiky nezmenší, doba čekání na možnost otěhotnění je kratší a nakonec je tu možnost porodu per vias naturales, která nebyla možná po klasické metroplastice.
Další příčiny neplodnosti
Mezi faktory sterility patří také tubární faktor, který se podílí na 25–40 % příčin ženské sterility. Obstrukce proximální části tuby tvoří 10–25 % příčin tubárního faktoru sterility. Příčinou obstrukce je nejčastěji zánět a endometrióza, které způsobí fibrózní stenózu ústí vejcovodu. Další příčiny okluze proximální části tuby jsou aglutinace, spasmus a polypy. Hysteroskopie umožní zobrazit ústí vejcovodů do děložní dutiny, diagnostikovat nejčastější příčiny obstrukce a provést katetrizaci proximální části tuby (obr. 10). Katetrizaci provádíme nejčastěji pomocí ureterálního katétru [20,21].
Image 10. Polypy proximálního ústí tuby. 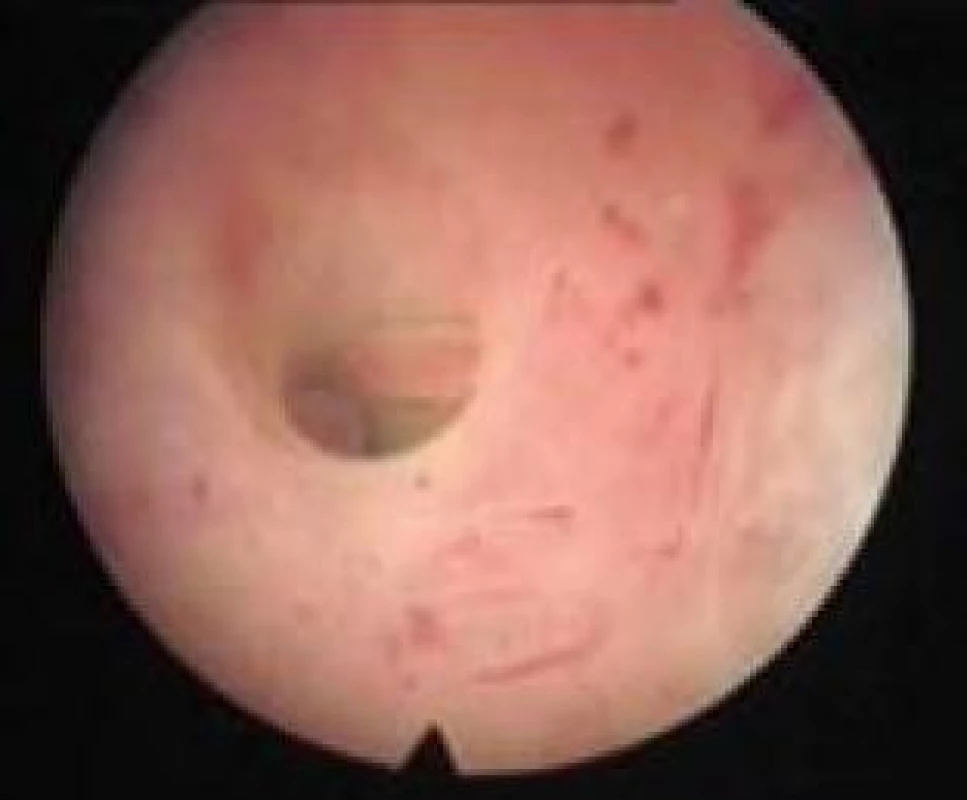
Další příčinou sterility může být přítomnost cizího tělesa v dutině děložní. Nejčastěji je to část intrauterinního tělíska, které tam zůstalo po jeho extrakci, nebo odlomený konec sukční kanyly. Cizím tělesem mohou být i kostní fragmenty – zbytky fetálních kostí po potratu plodu nebo kostní metaplazie. Hysteroskopie umožňuje přehlédnout dutinu děložní, najít cizí těleso a extrahovat ho.
Závěr
Hysteroskopie jako diagnostická i operační metoda nepochybně patří do základního repertoáru gynekologických výkonů. Výhodou oproti jiným metodám je menší zátěž pacientky, kratší doba výkonu a v neposlední řadě cena. Spolu s laparoskopií umožňuje dokonalé vyšetření jak dělohy, tak i ostatních reprodukčních orgánů ženy. Vzhledem k tomu, že počet neplodných párů pořád roste, bude hysteroskopie i v budoucnosti sehrávat důležitou roli v řešení děložního faktoru sterility.
MUDr. Branislav Babjak
MUDr. Josef Eim
Gynekologicko‑porodnické oddělení
Nemocnice Vyškov p. o.
Sources
1. Cittebart K et al. Gynekologie. 1. ed. Praha: Galén 2001.
2. Holub Z, Kužel D et al. Minimálně invazivní operace v gynekologii. 1. ed. Praha: Grada Publishing 2005.
3. Tools to optimize the IVF-ET procedure and its cost‑effectiveness. National Institute for Clinical Excellence: guidelines February 2004. London: RCOG Press, 2004.
4. Feghali J, Bakar J, Mayemar JM et al. Systematic hysteroscopy prior to in vitro fertilization. Gynecol Obstet Fertil 2003; 31 : 127–131.
5. Takahashi K, Mukaida T, Tomiyama T et al. High pregnancy rate after hysteroscopy with irrigation in uterine cavity prior to blastocyst transfer in patients who have failed to conceive after blastocyst transfer. Presented at the 56th Annual Meeting of the ASRM. San Diego, California, USA. Program Suppl 2000; 74, P–355.
6. Clevenger-Hoeft M, Syrop CH et al. Sonohysterography in premenopauzal women with and without abnormal bleeding. Obstet Gynecol 1999; 94 : 516–520.
7. Silberstein T, Saphier O, Voorhis B et al. Endometrial polyps in reproductive-age fertile and infertile women. IMAJ 2006; 8 : 192–195.
8. Peršín J, Hanousek L, Mrvová V. Výsledky transcervikální chirurgické léčby polypů endometria. Čes Gynek 2005; 70(4): 273–276.
9. De Waay DJ, Syrop CH, Nygaard IE et al. Natural history of uterine polyps and leiomyomata. Obstet Gynecol 2002; 100 : 3–8.
10. Bajekal N, Li TC. Fibroids, infertility and pregnancy wastage. Hum Reprod Update 2000; 6 : 614.
11. Poncelet C et al. Myoma and infertility: analysis of the literature. Gynecol Obstet Fertil 2001; 29 : 413.
12. Huvar I, Tinga D, Pilka L. Hysteroskopická resekce myomů. Čes Gynek 1994; 59(3): 114–116.
13. Kužel D. Hysteroskopie v terapii děložních myomů. Čes Gynek 2003; 68(2): 133–135.
14. Hamou J, Saegler AM. Diagnosis and treatment of intrauterine adhesions by minihysteroscopy. Fertil Steril 1983; 39 : 321–326.
15. Taylor PJ, Leader A, George RE et al. Correlations between laparoscopic and hysteroscopic findings in 497 women with otherwise unexplained infertility. J Reprod Med 1984; 29 : 137–140.
16. Kučera E, Křepelka P, Krofta L et al. Těhotenské komplikace po intrauterinní hysteroskopické chirurgii. Čes Gynek 2005; 70 : 312–316.
17. Saravelos SH, Cocksedge KA. Prevalence and diagnosis of congenital uterine anomalies in women with reproductive failure. Hum Reprod Update 2008; 6.
18. Kužel D. Gynekologická endoskopie. Praha: Galén 1996.
19. Homer HA, Li TC, Cooke ID. The septate uterus: a review of management and reproductive outcome. Fertil Steril 2000; 73 : 1–14.
20. Valle RF. Tubal cannulation. Obstet Gynecol Clin North Am 1995; 22(3): 519–540.
21. Brinsden PR. Textbook of in Vitro Fertilization and Assisted Reproduction: The Bourn Hall Guide to Clinical and Laboratory Practice. London: Taylor & Francis 2005.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2009 Issue 1-
All articles in this issue
- Identifikácia antigénu Ki-67 v atrofickom endometriu a v seróznom karcinóme
- Lymfedém hornej končatiny po terapii karcinómu prsníka
- Hysteroskopie v diagnostice a terapii ženské neplodnosti
- Vliv kouření cigaret na klinické výsledky asistované reprodukce: meta‑analýza
- Netypický průběh pneumonie v těhotenství: kazuistika
- Vliv nízkých dávek kyseliny acetylosalicylové na výsledky IVF/ICSI cyklů
- Chronické vírusové hepatitídy v tehotnosti
- Forenzné aspekty asistovanej reprodukcie v legislatívnych podmienkach Českej a Slovenskej republiky
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Netypický průběh pneumonie v těhotenství: kazuistika
- Hysteroskopie v diagnostice a terapii ženské neplodnosti
- Lymfedém hornej končatiny po terapii karcinómu prsníka
- Vliv nízkých dávek kyseliny acetylosalicylové na výsledky IVF/ICSI cyklů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career