-
Medical journals
- Career
Nepřítomnost sekvenčních změn v HIF responzivním elementu promotoru leptinového genu u českých žen s hypotrofií plodu
Authors: Z. Dostálová 1; J. A.vašků 2; P. Bienert 2; A. Vašků 2; V. Unzeitig 1
Authors‘ workplace: Gynekologicko-porodnická klinika LF MU a FN Brno 1; Institut patologické fyziologie LF MU, Brno 2
Published in: Prakt Gyn 2005; 9(3): 6-8
Overview
Cíl studie:
Cílem bylo asociovat eventuální sekvenční změny promotoru leptinového genu v oblasti HIF (hypoxia inducible factor) responzivního elementu s výskytem hypotrofie plodu.Materiála metodika:
Odebrali jsme 7 těhotným ženám, u jejichž plodů byla pomocí USG (ultrasonografie) prokázána IUGR (intrauterinní růstová retardace), periferní krev. Po izolaci a amplifikaci úseku promotoru leptinového genu nesoucího HIF–responzivní element jsme provedli kapilární sekvenaci PCR–produktu.Výsledky:
V HIF–responzivní oblasti promotoru genu pro leptin jsme nezjistili u žádné ze 7 zkoumaných žen sekvenční alteraci, kterou by bylo možno vysvětlit v literatuře popsané změny plazmatické hladiny leptinu ve vztahu k IUGR.Závěr:
V literatuře jsme nenašli srovnatelnou analýzu sekvence leptinového genu u matek plodů s IUGR, přestože plazmatické hladiny leptinu u nich byli opakovaně prokázány jako vyšší ve srovnání s fyziologickými graviditami. Dle našich výsledků není nárůst hladiny leptinu asociován se změnou DNA sekvence v HIF–responzivním elementu promotoru genu pro leptin.Klíčová slova:
hypotrofie plodu – leptin – HIF –leptinový gen – graviditaÚvod
Hypotrofie plodu se v české populaci vyskytuje v 2–5 %, jedná se o velmi závažnou komplikaci průběhu těhotenství.
Všechny plody/novorozenci s hmotností, která je o 10 % nižší než standardní hmotnost gestačního stáří, jsou plody/novorozenci nedostatečného růstu (fetal growth restriction – FGR).
70 % těchto plodů/novorozenců je konstitučně malých (small for gestation age – SGA), tato skutečnost je dána rasovými faktory, paritou těhotné, její výškou, hmotností a dalšími faktory. Prognóza těchto novorozenců je dobrá.
Zhruba 30 % tvoří skupina plodů/novorozenců nitroděložně růstově retardovaných (intrauterine growth retardation – IUGR), z toho ve 20–30 % se jedná o proporcionální IUGR. Vyvolávající příčinou je nejčastěji porucha v chromozomální výbavě. Růstová restrikce se u těchto plodů projeví již v 1. polovině těhotenství.
Většinu, tj. 70–80 % intrauterinních růstových retardací ovšem tvoří disproporcionální IUGR, která se projevuje nejčastěji v 2. polovině těhotenství [7].
Schéma. Klasifikace nedostatečného růstu plodu [7]. ![Schéma. Klasifikace nedostatečného růstu plodu [7].](https://pl-master.mdcdn.cz/media/image/adab4563dd26a829f1b3364e315b6a90.jpeg?version=1537790336)
Příčiny IUGR jsou polyfaktoriální, uplatòují se jak faktory fetální, tak placentární nebo mateřské; jedná se o všechny stavy, které vedou k placentární insuficienci, a tím k nedostatečnému zásobení plodu kyslíkem a živinami.
- fetální faktory: chromozomální abnormality, infekce plodu, vícečetná těhotenství aj.
- placentární faktory: abnormální trofoblastická invaze, placenta praevia, vaskulární anomálie pupečníku aj.
- mateřské faktory: chronická vaskulární onemocnění vniklá na podkladě hypertenze, renálních onemocnění, IDDM, kolagenóz, hypoxické stavy, nutriční faktory, trombofilní stavy, abúzus drog aj.
Hledání patofyziologických souvislostí těhotenských patologií se v posledních letech stále více orientuje molekulárně–biologickým směrem. Stále větší důraz se klade na objevování souvislostí mezi patologickými stavy vznikajícími v graviditě a genetickou predispozicí matky pro tento stav.
Porucha fetální angiogeneze vede k narušení funkce fetoplacentární jednotky s následným rozvojem poruchy fetálního růstu. Jedním z významných regulátorů energetického hospodaření fetoplacentární jednotky je bílkovina leptin.
Image 1. Chromozom 7 s genem pro leptin. 
Cíl studie
Cílem naší studie bylo asociovat eventuální sekvenční změny promotoru leptinového genu v oblasti HIF 1–responzivního elementu s výskytem hypotrofie plodu.
Materiál a metodika
Vyšetřili jsme 7 těhotných žen hospitalizovaných na pracovišti Gynekologicko–porodnické kliniky FN Brno s diagnózou IUGR plodu a odebrali jsme jim 5 ml periferní krve. Vždy se jednalo o spontánní, jednočetnou graviditu. K těmto 7 ženám jsme způsobem case–control přiřadili kontroly – ženy s nekomplikovanou jednočetnou graviditou zakončenou v termínu.
Medián věku žen v souboru nemocných byl 30,8 let (26–33), BMI 22,7 (19,8–24,5), průměrná porodní váha plodu byla 1700 g (950–2250 g).
DNA z periferní krve byla izolována standardní technikou s využitím proteinázy K.
Prostřednictvím primerů:
5°–gggacatcaaggatttctcg,
3°–gttatcgggccgctataag
byl získán 340 bp dlouhý PCR produkt. Amplifikace tohoto produktu byla provedena standardním způsobem s užitím Tag polymerázy. Tento produkt byl následně sekvenován (kapilární sekvenátor BigDye kit). Sekvence získané z tohoto sekvenátoru byly zpracovány softwarem DNAgent (obr. 2, 3) s vyhodnocením 5’; 3’ sekvencí HIF responzivního elementu leptinového genu.
Výsledky
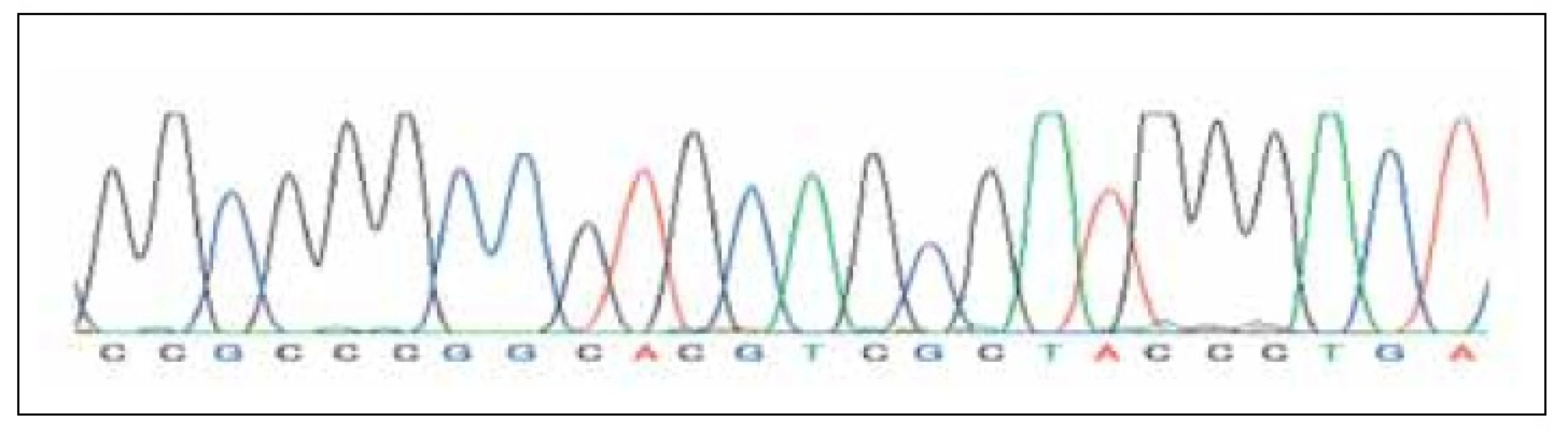
U žádné ze 7 žen s IUGR plodu jsme neprokázali sekvenční alteraci v oblasti HIF–responzivního elementu promotoru leptinového genu, kterou by bylo možno vysvětlit změny plazmatické hladiny leptinu u gravidit s IUGR plodu, popsané v literatuře.
Image 3. Kapilární sekvenace žen s plody s prokázanou IUGR. 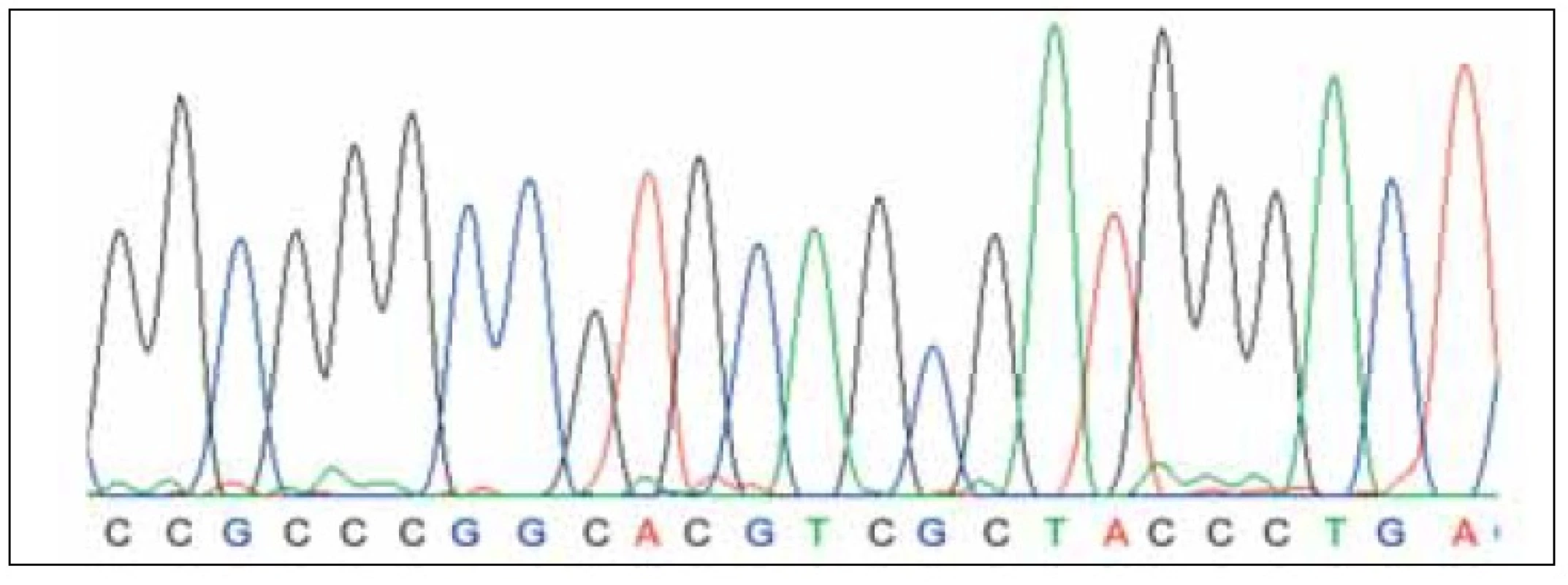
Diskuse
Málokterému proteinu je v současnosti věnována taková mediální i odborná pozornost jako leptinu. Původně byl považován za regulátor centra sytosti, v současnosti je však zřejmé, že jeho účinky jsou pleitropní, spojené zejména s udržováním homeostázy organizmu.
Leptin je 16 kDa těžký protein, skládající se z 167 aminokyselinových zbytků.
Poprvé byl popsán v roce 1994 jako signalizační molekula izolovaná z adipocytů. Jeho hlavní funkce spočívá v udržování energetické homeostázy organizmu [9].
U gravidních žen je leptin produkován vedle tukových buněk také placentou a významně ovlivòuje průběh gravidity a vývoj plodu. V průběhu fyziologické gravidity dochází ke kolísání hladiny leptinu v krvi matky, vrcholu dosahuje v průběhu 2. trimestru.
Řada studií přináší důkazy, že leptin hraje důležitou patofyziologickou úlohu v regulaci fetální a placentární angiogeneze, fetálního růstu a vývoje, embryonální hematopoézy a biosyntézy hormonů [5], přitom faktory vedoucí k nárůstu syntézy leptinu mohou být obecně dvojího původu, jednak lokální (hypoxie), jednak celkové (hyperinzulinemie).
Významným aktivátorem leptinového promotoru je hypoxie. Je známo, že v promotoru leptinového genu se nachází několik regulačních elementů, včetně cAMP a glukokortikoidů responzivních elementů, CCATT–enhancerů a SP 1–vazebného místa [1].
Již dříve se několik autorů zaměřilo na fakt, že hypoxie cestou hypoxia–inducibilního faktoru (HIF 1) indukuje transkripci leptinu v placentě [2]. Děje se tak cestou minimálně jednoho elementu responzivního na hypoxii lokalizovaného –120 bp až –116 bp v leptinovém promotoru.
HIF 1 je heterodimer složený ze dvou podjednotek: HIF 1á a ARNT (aryl hydrocarbon receptor nuclear translocator) podjednotek.
Biologická aktivita HIF–1 je určována expresí a aktivací HIF 1alfa podjednotky.
Exprese a aktivace podjednotky HIF 1á je těsně spjata s intracelulární koncentrací kyslíku. V normoxických podmínkách je HIF 1á konstitutivně degradována proteazómem 26S, naproti tomu při poklesu tkáòové koncentrace kyslíku je tato podjednotka stabilizována. Exprese HIF 1á se exponenciálně snižuje souběžně s tím, jak klesá koncentrace O2, a to determinuje úroveò HIF 1 aktivity [6,8]. Dá se tedy očekávat, že eventuální sekvenční alterace v oblasti vazného místa pro HIF v promotoru leptinového genu jak u matky, tak u plodu, může způsobit dysregulaci leptinového metabolizmu resultující ve vznik fetální restrikce růstu.
V průběhu fyziologické gravidity dochází ke kolísání hladiny leptinu v krvi matky, vrcholu dosahuje v průběhu 2. trimestru.
Onemocnění jako je preeklampsie a hypotrofie plodu jsou spojena se změnami krevní hladiny leptinu. Tyto stavy vedou ke zvýšení hladiny leptinu, z toho vyplývá, že leptinový gen je z hlediska růstu plodu pod vlivem hypoxických a hypoglykemických podnětů, které aktivují promotorovou oblast leptinového genu a následně dojde ke zvýšení hladiny leptinu.
Tato aktivace se děje prostřednictvím separátních responzivních oblastí HIF 1 (hypoxia inducible factor).
Nukleotidová sekvence části leptinového promotoru s oblastí HIF:
841 cgaggtgcac actgcgggcc cagggctagc agccgcccgg cacgtcgcta ccctgagggg
901 cggggcggga gctggcgcta gaaatgcgcc ggggcctgcg gggcagttgc gcaagttgtg
961 atcgggccgc tataagaggg gcgggcaggc atggagcccc
V literatuře jsme nenašli srovnatelnou analýzu sekvence leptinového genu u matek s prokázanou IUGR plodu. Dle našich výsledků není v literatuře popsaný nárůst hladiny leptinu asociován se změnou DNA–sekvence HIF–responzivního elementu promotoru genu pro leptin. Lze se domnívat, že dysregulace plazmatické hladiny leptinu v séru těhotných žen s IUGR je způsobena komplexní skupinou příčin, mezi jinými právě rozdílnou charakteristikou promotoru leptinového genu ve srovnání se ženami zdravými. Můžeme tedy spekulovat, zda upregulace plazmatického leptinu u žen s IUGR má svůj původ v sekvenční alteraci leptinového promotoru ve větší vzdálenosti od místa startu, nebo zda je nárůst plazmatických hladin leptinu u žen s IUGR způsoben jinými příčinami.
Závěr
V naší studii jsme neprokázali sekvenční alterace v oblasti vazebného místa pro HIF 1 v oblasti promotoru leptinového genu.
Předpokládáme tedy, že zvýšená plazmatická hladina leptinu v séru matek s prokázanou IUGR plodu není způsobena molekulární poruchou DNA v této oblasti.
Sekvenování představuje maximálně specifickou metodu určení nukleotidové sekvence DNA, bohužel rutinní použití této metody v klinické diagnostice je zatím limitováno její cenou.
Sources
1. Ahima RS, Fliers JS. Leptin. Annu Rev Physiol 2000; 62 : 413–437.
2. Grosfeld A, Andre J, Hauguel–De Mouzon S, Berra E, Pouyssegur J, Guerre–Millo M. Hypoxia–inducible factor 1 transactivates the human leptin gene promoter. J Biol Chem 2002; 277(45): 42953–42957.
3. Grosfeld A, Turban S, Andre J, Cauzac M, Challier JC, Hauguel–de Mouzon S, Guerre–Millo M. Transcriptional effect of hypoxia on placental leptin. FEBS Lett. 2001; 502(3): 122–126.
4. Henson MC, Castracane VD. Leptin: roles and regulation in primate pregnancy. Semin Reprod Med 2002; 20(2): 113–122.
5. Holness MJ, Munns MJ, Sugden MC. Current concepts concerning the role of leptin in reproductive function. Mol Cell Endocrinol 1999; 157(1–2): 11–20.
6. Michiels C, Minet E, Mottet D, Raes M. Regulation of gene expression by oxygen: NF–kappaB and HIF–1, two extremes. Free Radic Biol Med 2002; 33(9): 1231–1242.
7. Roztočil A. Hypotrofický plod. Moderní gynekologie a porodnictví 2002; 2 : 268–278.
8. Semenza GL. HIF–1 and mechanisms of hypoxia sensing. Curr Opin Cell Biol 2001; 13(2): 167–171.
9. Zhang Y, Proenca R, Maffei M, Barone M, Leopold L, Friedman JM. Positional cloning of the mouse obese gene and its human homologue. Nature 1994; 372(6505): 425–432.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2005 Issue 3-
All articles in this issue
- Nepřítomnost sekvenčních změn v HIF responzivním elementu promotoru leptinového genu u českých žen s hypotrofií plodu
- Vrozené trombofilie a cytogenetické nálezy u pacientů s opakovanými fetálními ztrátami
- Úloha prokalcitoninu v diagnostice neonatální infekce
- Kojení stále nenahraditelné I.
- Vliv hormonální kontracepce na roztroušenou mozkomíšní sklerózu
- Klinický význam vlivu hormonální terapie na riziko vzniku kolorektálního karcinomu
- Problematika diagnostiky a léčby zhoubných nádorů vulvy
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Úloha prokalcitoninu v diagnostice neonatální infekce
- Problematika diagnostiky a léčby zhoubných nádorů vulvy
- Kojení stále nenahraditelné I.
- Vrozené trombofilie a cytogenetické nálezy u pacientů s opakovanými fetálními ztrátami
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career