-
Medical journals
- Career
Vrozené trombofilie a cytogenetické nálezy u pacientů s opakovanými fetálními ztrátami
: R. Gaillyová 1; Z. Čech 2; M. Vilémová 1; Š. Prášilová 1; Z. Kalina 1; J. Šoukalová 1; A. Oltová 1; Hana Višňová 3; M. Penka 2; P. Ventruba 3
: Oddělení lékařské genetiky FN Brno 1; Oddělení klinické hematologie FN Brno 2; Gynekologicko-porodnická klinikaLF MU a FN Brno 3
: Prakt Gyn 2005; 9(3): 9-12
Součástí preventivního genetického vyšetření párů sopakovanými fetálními ztrátami je vyšetření karyotypu a vrozených trombofilií. Nosiči balancovaných chromozomových aberací mají zvýšené riziko výskytu nebalancovaných chromozomových aberací u potomků a zvýšené riziko reprodukčních neúspěchů. Geneticky podmíněné trombofilie zvyšují riziko opakovaných spontánních potratů, infarktů placenty, předčasného odlučování placenty a dalších komplikací těhotenství. Je známa především souvislost snosičstvím leidenské mutace FV a zvýšeným rizikem fetálních ztrát na konci 1., ve 2. a 3. trimestru. Vnašem souboru bylo vyšetřeno 207 párů sopakovanými fetálními ztrátami, především v1. trimestru. Byla zjištěna zvýšená frekvence vrozených chromozomových aberací (u žen především malé mozaiky aneuploidie X, u mužů většinou strukturní chromozomové aberace), zvýšená frekvence leidenské mutace u skupiny žen sanamnézou 3 a více fetálních ztrát. Zjistili jsme i vysoké procento párů s výskytem kombinace vrozené chromozomové aberace a trombofilní mutace. Tento nález může zvyšovat riziko reprodukčních neúspěchů. Vyšetření karyotypu doporučujeme u obou partnerů s anamnézou opakovaných fetálních ztrát, vyšetření vrozených trombofilií doporučujeme u žen, hematologické vyšetření a sledování vgraviditě u žen, nosiček některé zvyšetřovaných trombofilních mutací. Preventivní genetické vyšetření umožní doporučení cílené prekoncepční a prenatální péče.
Klíčová slova:
opakované fetální ztráty - chromozomové aberace - vrozené trombofilie - genetické poradenstvíÚvod
Poruchy reprodukce jsou komplexním problémem s mnoha příčinami. Jednu z nich mohou představovat genetické faktory poruch reprodukce, ať už se projevují sterilitou nebo opakovanými fetálními ztrátami. Genetické poradenství si klade několik základních otázek, které by měly být nedílnou součástí vyšetřovacího protokolu při řešení poruch reprodukce:
- Je porucha fertility důsledkem genetické poruchy, která může být přenášena do další generace?
- Může korekce fertility zvýšit riziko výskytu malformací, chorob a chromozomových aberací u potomků?
- Může genetické nebo jiné vyšetření snížit riziko poruchy fertility - fetálních ztrát?
Může genetické vyšetření, prekoncepční příprava, léčba, sledování a prenatální diagnostika snížit riziko postižení potomků či rizikový průběh gravidity [1]?
Příčiny opakovaných fetálních ztrát mohou být:
- gynekologické,
- genetické,
- hematologické,
- imunologické,
- endokrinologické,
- environmentální,
- jiné.
U párů s opakovanými spontánními potraty se snažíme eliminovat alespoň známá genetická rizika. Nejdůležitější otázkou pro genetika není, zda se v další graviditě může opakovat spontánní potrat, ale jaká je pravděpodobnost narození zdravého dítěte, resp. jaké je riziko postižení u narozeného dítěte [1].
Součástí genetického vyšetření u párů s opakovanými fetálními ztrátami je:
- podrobná rodinná a osobní anamnéza – genealogické vyšetření pátrající po onemocnění jak u partnerů samých, tak i v jejich široké rodině
- cytogenetické vyšetření – stanovení karyotypu obou partnerů, v indikovaných případech i vyšetření získaných chromozomových aberací (pracovníci rizikových provozů, onkologicky nemocní apod)
- vyšetření nejčastějších vrozených trombofilních stavů u žen
- preventivní vyšetření základní mutační analýzy CFTR genu alespoň u 1 z partnerů
- dle anamnézy event. další cílená molekulárně genetická vyšetření
- dalším důležitým vyšetřením je patologicko-anatomické a histologické vyšetření, které se snaží detekovat malformace u potracených plodů [1,2].
V tomto článku předkládáme výsledky cytogenetických vyšetření a vyšetření některých častých vrozených trombofilií u párů s opakovanými fetálními ztrátami.
Cytogenetické vyšetření
U sterilních a infertilních párů je zvýšená incidence výskytu balancovaných vrozených chromozomových aberací (translokací a inverzí) a dále zvýšený výskyt aberací gonozomů. [1,2,3]. Populační frekvence vrozených chromozomových aberací (VCA) je asi 0,6-0,7 % u živě narozených dětí, z toho asi 0,2 % jsou formy balancované.
Stanovení karyotypu jsme prováděli vyšetřením minimálně 30, většinou 100 buněk, využitím metody G-pruhování; strukturální aberace byly ověřovány fluorescenční metodou in situ hybridizace - FISH. Jako mozaiku aneuplodie X jsme hodnotili nález minimálně 3 buněk patologické linie (obvykle monozomie X – 45, X nebo trizomie X – 47, XXX) (obr. 1, 2).
1. Karyotyp pacienta s anamnézou 2 spontánních potratů u partnerky balancovaná translokace, 46,XY,t (6;17)(q25.2;p13.1), G- banding. 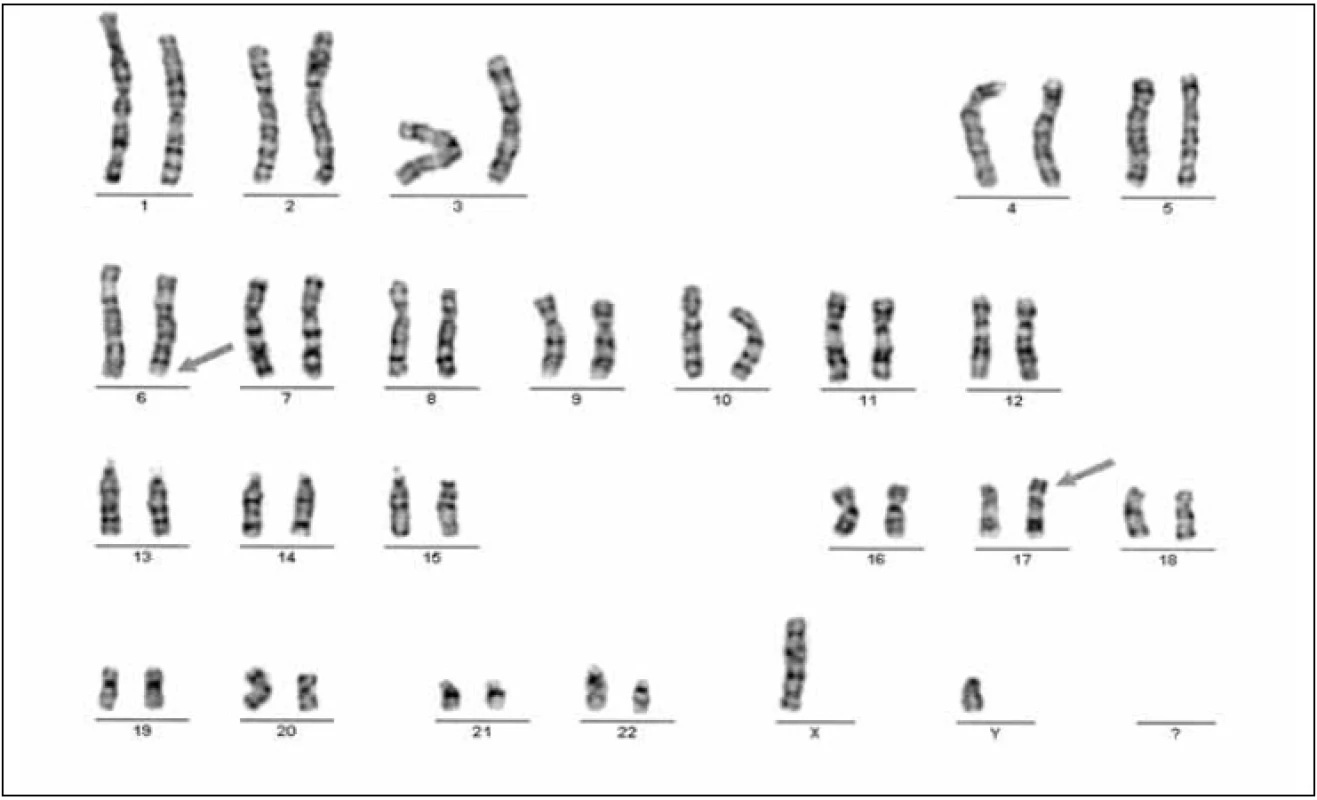
2. Karyotyp pacienta s anamnézou 2 spontánních potratů u partnerky, 46,XY, t (6;17). Metoda FISH (StarFISH WPC 6,17 DNA Probe). 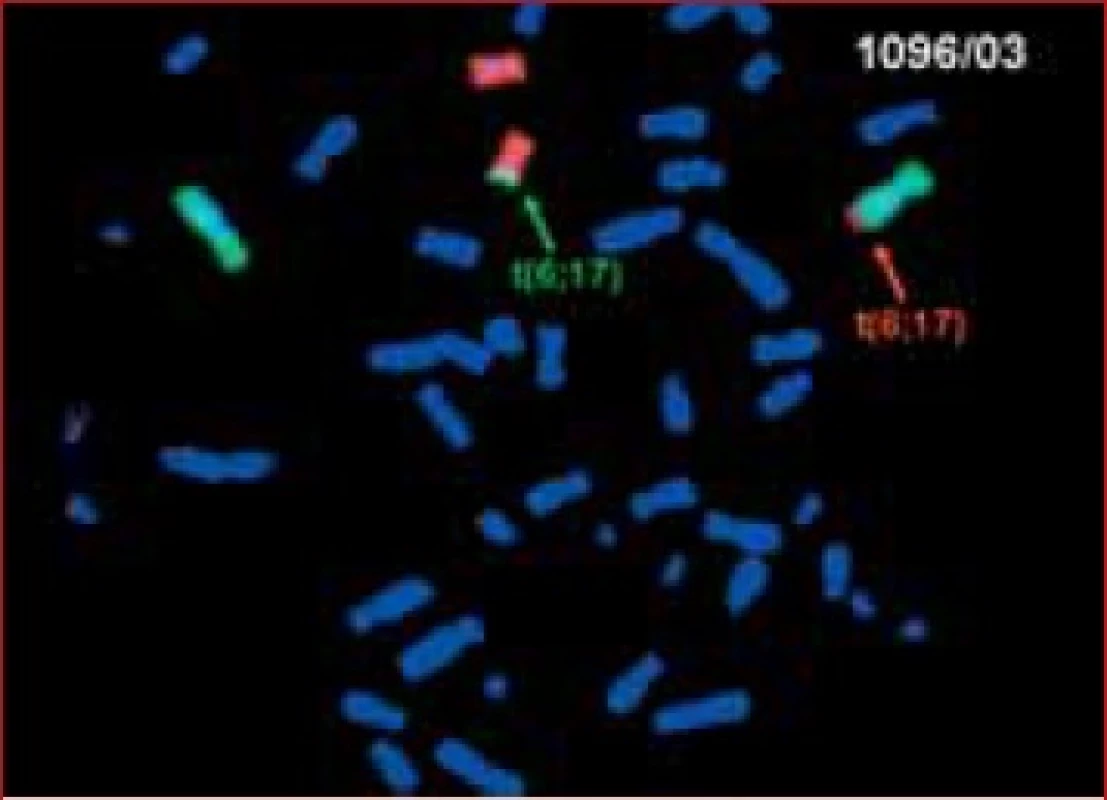
Vyšetření trombofilních mutací
Vrozené trombofilie jsou významnou příčinou vedoucí k tromboembolické nemoci (TEN) a jsou asociovány se zvýšeným rizikem nepříznivého průběhu gravidity včetně spontánních potratů po 12. týdnu gravidity, infarktů placenty, intrauterinní růstové retardace a preeklampsie. K nejčastějším vrozeným trombofilním mutacím s klinickým významem řadíme Leidenskou mutaci G1691A v genu pro faktor V a mutaci G20210A v genu pro faktor II (protrombin). V rámci molekulárně genetického vyšetření jsme detekovali také termolabilní variantu C677T MTHFR vedoucí především v homozygotním stavu k hyperhomocysteinemii. Tato mutace ani její spojení s hyperhomocysteinemií nemusí vést k trombotickým projevům.
Leidenská mutace faktoru V
Leidenská mutace G1691A v genu pro faktor V (LM) se vyskytuje v bílé evropské populaci asi v 5-9 %. Nosičství leidenské mutace vede k rezistenci na aktivovaný protein C. Tento vrozený defekt byl popsán Dahlbackem et al v roce 1993.
Jedná se o bodovou mutaci f V, záměna guaninu za adenin v pozici 1691 v 10. exonu genu pro faktor V, vede k záměně argininu za glycin v pozici 506. Mutace je autosomálně dominantně dědičná, u heterozygotů asi 5-10krát zvyšuje riziko tromboembolizmu , u homozygotů 50-100krát. Nosičství mutace zvyšuje riziko fetálních ztrát po 10.-12. týdnu gravidity, zvyšuje rovněž riziko těžké růstové retardace plodu, abrupce placenty, preeklampsie. Souvislost se zvýšeným rizikem časných fetálních ztrát nebyla dosud potvrzena (obr. 3).
3. Vyšetření Leidenské mutace v exonu 10 genu pro faktor V, metoda PCR. 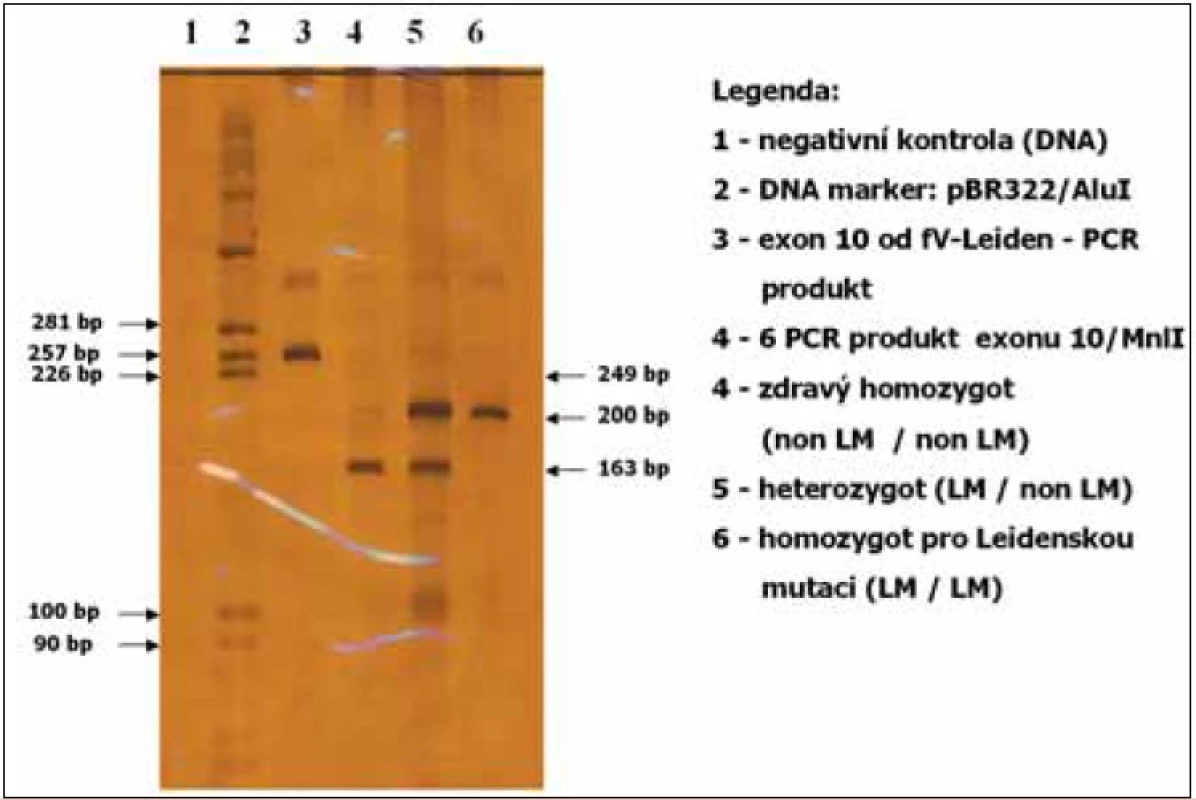
Mutace G20210A v genu pro faktor II (protrombin)
Mutace genu pro protrombin (protrombin 20210 GtoA) – tento vrozený defekt byl popsán v roce 1996 (SR Poort). Uvádí se 2-3% výskyt přenašečů – heterozygotů v bílé evropské populaci. Nosičství zvyšuje riziko tromboembolizmu asi 3krát, vede ke zvýšení hladiny cirkulujícího protrombinu na 150–200 %. Nosičství této mutace je rovněž spojováno s rizikem fetálních ztrát a dalších těhotenských komplikací. Není potvrzena souvislost se zvýšeným rizikem časných spontánních potratů.
Termolabilní varianta C677T metylen-tetrahydrofolát reduktázy (MTHFR)
Hyperhomocysteinemie je někdy řazena k nehematologickým rizikovým trombofilním faktorům. Může být vyvolána deficitem vitaminů B6, B12 a kyseliny listové, které se jako kofaktory účastní metabolizmu homocysteinu. Jednou z častých příčin hyperhomocysteinemie je homozygotní defekt enzymu cystathion-beta-syntázy (CBS) nebo vrozený defekt remetylace, způsobený především nedostatkem enzymu metylen-tetrahydrofolát reduktázy (MTHFR). Nosičství termolabilní varianty C677T MTHFR se v homozygotním stavu vyskytuje asi v 11 % u bílé evropské rasy. Heterozygoti jsou u bílé rasy popisováni v 5-40 %. Pacienti s lehkou a středně těžkou hyperhomocysteinemií mají zvýšené riziko aterosklerózy a tromboembolizmu, ale také zvýšené riziko defektů neurální trubice u plodů a opakovaných fetálních ztrát. Souvislost mezi touto mutací a opakovanými spontánními potraty však není jednoznačně potvrzena [4-11].
Vyšetřovaný soubor
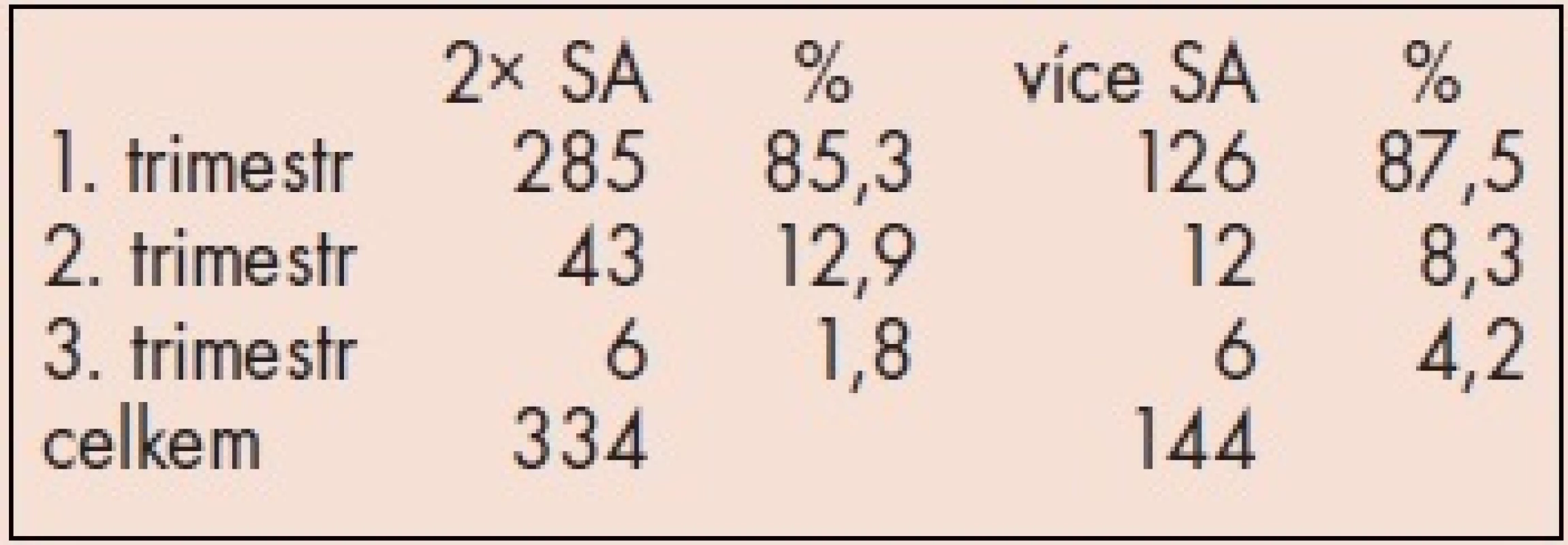
Sledovaný soubor představuje celkem 207 párů s poruchou reprodukce (tab. 1). Páry byly na Oddělení lékařské genetiky FN Brno vyšetřeny v letech 2002 a 2003. Jednalo se o 167 párů s anamnézou 2 fetálních ztrát a 40 párů s anamnézou 3 a více fetálních ztrát. V obou skupinách byly v anamnéze uvedeny ve více než 85 % spontánní potraty v 1. trimestru (tab. 2).
Výsledky
Výsledky cytogenetických vyšetření jsou shrnuty v tab. 3.
3. Cytogenetické nálezy – výsledky. 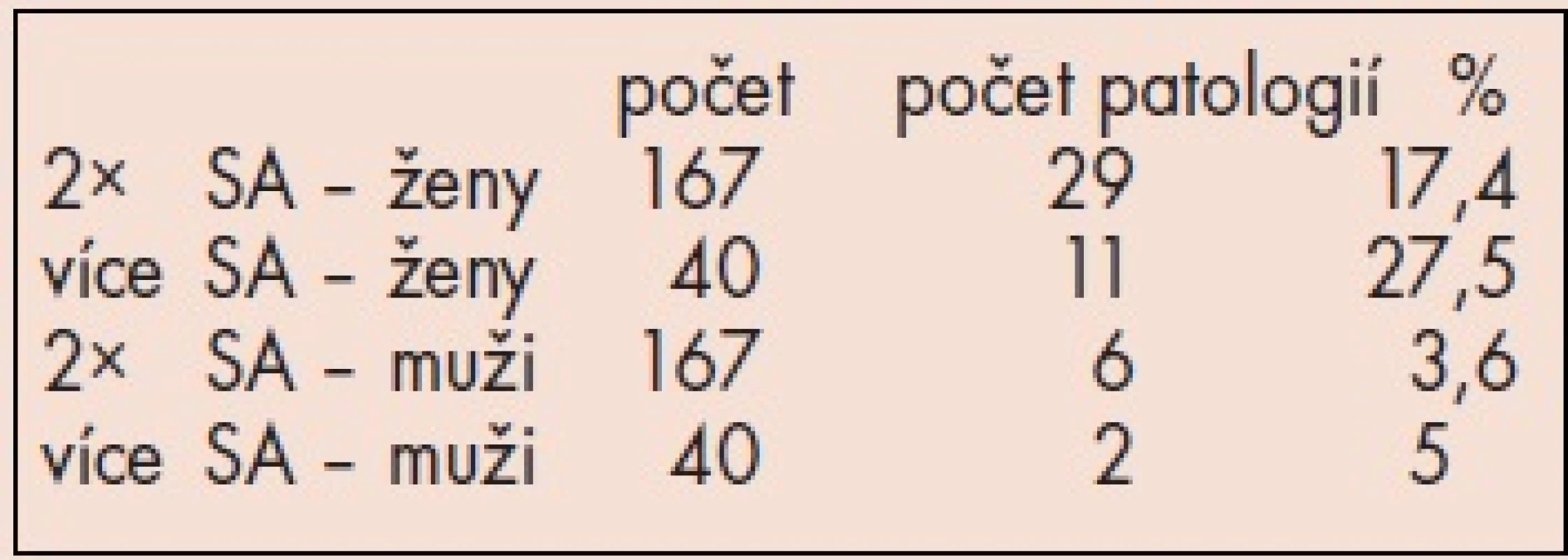
U našem souboru jsme potvrdili zvýšenou frekvenci vrozených chromozomových aberací. Nejčastější detekovanou změnou byly malé mozaiky aneuplodie X u žen. Dále byly u infertilních žen i mužů detekovány strukturní chromozomové aberace, především balancované translokace a inverze (tab. 4, 5).
4. Cytogenetické nálezy u pacientů s anamnézou 2 fetálních ztrát. 
5. Cytogenetické nálezu u pacientů s anamnézou 3 a více fetálních ztrát. 
U žen s anamnézou 2 fetálních ztrát byla nalezena chromozomová aberace (VCA) celkem u 17,4 % , u žen s více fetálními ztrátami byla VCA detekována dokonce u 27,5 % vyšetřených. U mužů byl výskyt VCA 3,6 resp. 5 %.
U žen s anamnézou 2 spontánních potratů jsme nezjistili zvýšenou frekvenci žádné z vyšetřovaných trombofilních mutací, u žen se 3 a více fetálními ztrátami byla zjištěna zvýšená frekvence leidenské mutace v genu pro faktor V a zvýšená frekvence homozygotů termolabilní varianty C677T MTHFR oproti uváděné populační frekvenci (tab. 6).
6. Trombofilní mutace – výsledky. 
Závěr
Reprodukční genetika je dalším novým odvětvím lékařské genetiky, integrovaným s reprodukční medicínou a asistovanou reprodukcí. Je založena na systému specializovaného genetického poradenství, klinické cytogenetiky, molekulární cytogenetiky a DNA diagnostiky. Je součástí preventivních postupů zajišťujících cílenou a individuální prekoncepční a perikoncepční péči a prenatální diagnostiku.
U párů s poruchou reprodukce ve smyslu opakovaných fetálních ztrát doporučujeme:
- genetické poradenství a cytogenetické vyšetření u všech mužů i žen z párů se 2 a více fetálními ztrátami
- individuální přístup v plánování koncepce, prenatální diagnostiky, preimplantační genetické diagnostiky (PGD) a metod asistované reprodukce
- v párech, ve kterých byla u některého z partnerů zjištěna vrozená chromozomová aberace, je zvýšené riziko vzniku nebalancované chromozomové aberace u potomků a je třeba doporučit invazivní prenatální diagnostiku – stanovení karyotypu plodu, případně individuálně volenou molekulárně cytogenetickou preimplantační genetickou diagnostiku u párů plánujících využití postupů asistované reprodukce
- vyšetření trombofilních mutací doporučujeme vždy u žen se 3 a více fetálními ztrátami a u všech pacientek s komplikacemi především ve 2. a 3. trimestru gravidity nebo s pozitivní osobní či rodinnou anamnézou ve smyslu tromboembolizmu
- podávání kyseliny listové prekoncepčně a v 1. trimestru je vhodnou prevencí nejen rozštěpových vad plodu, ale i opakovaných fetálních ztrát, doporučujeme minimální dávku 1 mg kyseliny listové denně 3 měsíce před plánovanou koncepcí a do konce 12. týdne gravidity, individuálně je volena vyšší dávka dle anamnézy a výsledků hematologického vyšetření
- hematologické vyšetření doporučujeme u žen se 2 a více spontánními potraty, u kterých zjistíme nosičství leidenské mutace f V nebo mutace G20210A f II
- u homozygotů pro variantu C677T MTHFR je vhodné vyšetření hladiny homocysteinu
- u žen se zjištěnou hyperhomocysteinemií doporučujeme vitaminovou suplementaci B6, B12, acidum folicum
- hematologické vyšetření je vhodné zvážit i u žen s nepříznivou a rizikovou osobní nebo rodinnou anamnézou (mors foetus intrauterina, TEN, OHSS atd)
- individuální přístup je obzvláště nutný u partnerů s kombinací vrozených chromozomových aberací a vrozených trombofilií
- další prekoncepční sledování a vyšetření v graviditě doporučuje gynekolog a hematolog
- zařazení dalších specializovaných vyšetření (endokrinologické, imunologické atd) se řídí anamnézou a aktuálním zdravotním stavem
- při nálezu mutace G1961A fV a G20210A f II doporučujeme dispenzarizaci pacientky na hematologii a vyšetření trombofilních mutací u rodinných příslušníků, především rodičů, sourozenců a dětí.
Sources
1. Harper JP. Practical Genetic Counselling. Oxford: Butterworth-Heinemann Ltd. 1993 : 278-280.
2. Macek M, Vilímová Š, Potužníková Š et al. Využití lékařské genetiky v reprodukční medicíně. Čas Lék Čes 2002; 141 : 28-34.
3. Duncan F, Atmaca M, Cetin GO, Bagci H. Cytogenetic studies in patients with reproductive failure. Acta Obstet Gynecol Scand 2003; 82(1): 53-56.
4. Penka M, Buliková A, Matýšková M, Zavřelová J. Hematologie I. Neonkologická hematologie. Praha: Grada Publishing 2001 : 131-166.
5. Foka ZJ, Lambropoulos AF, Saravelos H et al. V Leiden and prothrombin G20210A mutations, but not metylentetrahydrofolate reductase C677T, are associated with recurrent miscarriages. Human Reproduction 2000; 15(2): 458-462.
6. Procházka M, Procházková J, Lubušký M, Slavík L. Trombofilní stavy v porodnictví. I. část. Prakt Gyn 2004; 4(4): 12-16.
7. Rai R, Shlebakm A, Cohen H et al. Factor V Leiden and aquired protein C resistance among 1000 women with recurrent miscarriage. Hum Reproduction 2001; 16(5): 961-965.
8. Wramsby ML, Sten-Linder M, Bremme K. Primary habitual abortions are associated with high frequency of Factor V Leiden mutation. Fertility and Sterility 2000; 74(5): 987-991.
9. Lockwood CJ. Inherited Thrombophilias in Pregnant Patients: Detection and Treatment Paradigm. Obstertics and Gynekology 2002; 99(2): 333-44.
10. Janků L. Risk factor of Thrombosis – point mutation G1691A in factor V gene and its prevalence in Czech Republic. Hematológia a transfuzológia 2000; 2 : 92-95.
11. Tal J, Schliamser LM, Leibovitz Z et al. A possible role for activated protein C resistence in patients with first and second trimester pregnancy failure. Human Reproduction 1999; 14(6): 1624-1627.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2005 Issue 3-
All articles in this issue
- The absence of sequential changes in HIF response element of leptine gene promotor in Czech women with fetal hypotrophy
- Inherited thrombophilias and cytogenetic findings in patients with repeated fetal loss
- Role of procalcitonin in diagnostics of neonatal infection
- Breast feeding still non replaceable I.
- The influence of hormonal contraception on multiple cerebrospinal sclerosis
- Clinical importance of influence of hormone replacement therapy on risk of colorectal carcinoma
- The issue of malignant tumours of vulva
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Role of procalcitonin in diagnostics of neonatal infection
- The issue of malignant tumours of vulva
- Breast feeding still non replaceable I.
- Inherited thrombophilias and cytogenetic findings in patients with repeated fetal loss
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career