-
Medical journals
- Career
Permanentní žilní přístup v experimentální chirurgii – naše zkušenosti
Authors: R. Pálek 1,2; J. Rosendorf 1,2; S. Šarčevič 1,2; J. Ševčík 2; O. Brzoň 2; L. Kepková 2; P. Krystl 2; M. Brousil 2; L. Červenková 2; V. Třeška 2; V. Liška 1,2
Authors‘ workplace: Chirurgická klinika, Fakultní nemocnice Plzeň a lékařská fakulta Univerzity Karlovy v Plzni 1; Biomedicínské centrum, Lékařská fakulta Univerzity Karlovy v Plzni 2
Published in: Rozhl. Chir., 2022, roč. 101, č. 12, s. 577-583.
Category: Original articles
doi: https://doi.org/10.33699/PIS.2022.101.12.57–583Overview
Úvod: Při využití prasete jako experimentálního zvířete je často nezbytné zajištění permanentního žilního vstupu, který umožní nejen opakované krevní odběry. Cílem práce bylo vyhodnotit průchodnost a komplikace implantabilních intravenózních port katétrů u prasat zařazených do různých chirurgických experimentů.
Metody: Port katétry byly implantovány cestou zevní jugulární žíly celkem 211 prasatům zařazeným do 7 různých experimentů. Retrospektivně byly hodnoceny všechny zaznamenané komplikace.
Výsledky: U 157 zvířat (74,4 %) nebyly zaznamenány žádné komplikace. Nejméně závažnou komplikací byl otok (12 zvířat, 5,7 %) a serom v okolí portu (3 zvířata, 1,4 %). Přechodné potíže s aspirací krve byly zaznamenány u 13 zvířat (6,2 %). Nejzávažnější komplikace, kvůli kterým nemohl být port katétr využíván k aspiraci ani aplikaci, nastaly u 26 zvířat (12,3 %). Jednalo se o absces v okolí portu (12 zvířat), nekrózu kožního krytu (2 zvířata), částečnou dehiscenci rány (2 zvířata) a ztrátu funkce port katétru z nespecifikovaných důvodů (10 zvířat). U žádného ze zvířat nemusel být port katétr explantován a žádné zvíře nemuselo být z důvodů komplikací port katétru vyřazeno z experimentu. Cestou port katétru lze bezpečně aplikovat i jodovou kontrastní látku při CT vyšetření.
Závěr: I přes zaznamenané komplikace je implantabilní port katétr vhodný k zajištění permanentního intravenózního vstupu u prasat v rámci chirurgických experimentů. Tato metodika umožňuje minimalizovat stres zvířat v pooperačním období a redukovat jejich počet.
Klíčová slova:
komplikace – experimentální chirurgie – prase domácí – port katétr – intravenózní vstup
ÚVOD
Velké zvířecí modely zůstávají nedílnou součástí experimentální chirurgie. Jejich výhodou je poměrně vysoká přenositelnost výsledků do humánní medicíny. Vzhledem k anatomické a fyziologické podobnosti a při současné minimalizaci využívání ostatních velkých savců je prase domácí aktuálně nejčastějším velkým zvířecím modelem [1]. V případě experimentálních modelů přežívajících po operačním zákroku je stěžejní zajištění intravenózního vstupu k opakovaným odběrům krevních vzorků a případně i intravenózní aplikaci farmak. K jednorázové venepunkci jsou zpravidla využívány periferní žíly na ušním boltci, vnější či vnitřní jugulární žíla, horní dutá žíla, povrchová epigastrická žíla nebo žíly na končetinách [1,2]. Tyto cévní vstupy však mohou být při opakovaných venepunkcích poměrně časně vyčerpány a k jejich zajištění je často nutná adekvátní farmakologická sedace zvířete [3]. Nejen z praktických důvodů, ale zejména i z důvodu naplnění zásad 3R, a tedy minimalizace stresu zvířete v pooperačním období, je vhodnější variantou permanentní žilní vstup [4,5]. Tyto vstupy lze rozdělit na katétry ústící periferním koncem na povrch těla a port systémy implantované kompletně pod kožní kryt. Nespornou výhodou intravenózních implantabilních portů je nižší riziko dislokace, infekčních komplikací a lepší dlouhodobá průchodnost oproti externalizovaným katétrům [6,7]. Použití intravenózních portů u laboratorních zvířat se začalo rozšiřovat již v 80. letech 20. století. Práce hodnotící dlouhodobé výsledky portů však zahrnují jen malé skupiny zvířat [3,6,8,9]. Cílem této práce je retrospektivně vyhodnotit průchodnost a komplikace intravenózních port katétrů implantovaných prasatům v rámci různých projektů experimentální chirurgie za delší časové období na jednom pracovišti.
METODY
Experimentální zvířata
Při práci se všemi experimentálními zvířaty bylo postupováno v souladu s platnou legislativou ČR a EU, všechny projekty byly schváleny Ministerstvem zemědělství ČR. Byly dodrženy stávající předpisy a směrnice pro chov a experimentální používání zvířat v souladu se zákonem č. 246/1992 upraveným vyhl. č. 207/2004 s následným výkladem k vyhlášce č. 39/2009.
Retrospektivně byly vyhodnoceny komplikace port katétrů implantovaných prasatům domácím v rámci chirurgických experimentů. Do vyhodnocení byla zařazena všechna prasata s implantovaným port katétrem v Biomedicínském centru Lékařské fakulty v Plzni za 5 let (od počátku roku 2017 do konce roku 2021). Jednalo se o zvířata zařazená do různých experimentálních projektů, v jejichž rámci byla zvířata po operačním zákroku probuzena a po určitou dobu sledována (A–G). Konkrétně se jednalo o experimenty zkoumající prevenci anastomotického leaku, při kterých byly u zvířat konstruovány spojky na tenkém střevě (A) nebo na rektu (B) [10,11,12]. Dalším z experimentů byla náhrada části infrarenální dolní duté žíly decelularizovaným či kryoprezervovaným alograftem (C), poté experiment s náhradou portální žíly po hemipankreatoduodenektomii (D) [13], experiment s implantací vzorku decelularizovaných jater do omenta (E), ortotopická transplantace jater (F) a navození sinusoidálního obstrukčního syndromu s následnou jaterní resekcí (G) [14]. Přehled jednotlivých projektů a charakteristika pooperačních období je shrnuta v tabulce (Tab. 1).
Table 1. Přehled použití port katetru v pooperačních obdobích dle jednotlivých experimentů
Tab. 1. Overview of vascular access port applications in postoperative periods according to individual experiments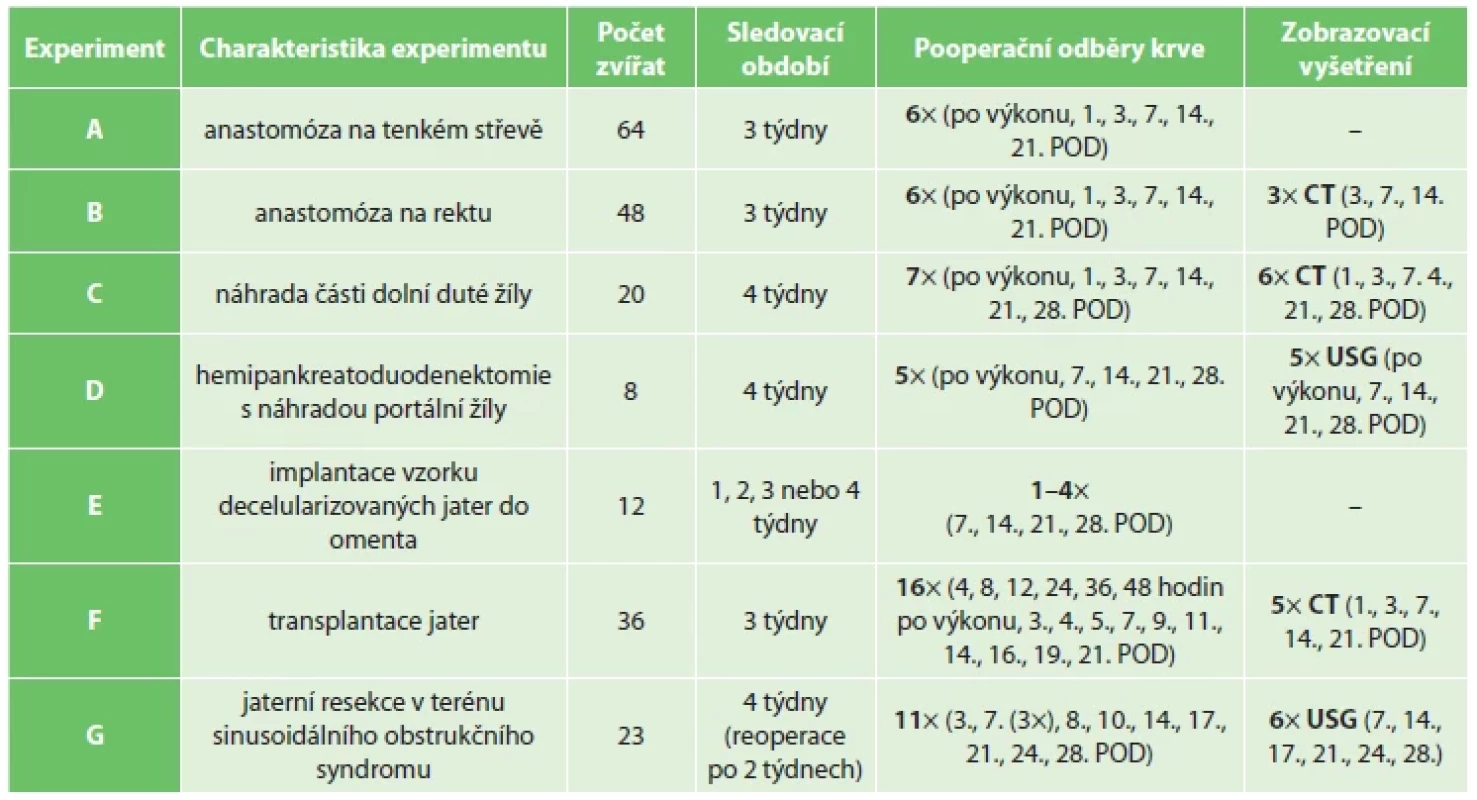
Vysvětlivky: POD – pooperační den, USG – ultrasonografie, CT – výpočetní tomografie.
Legend: POD – postoperative day; USG – ultrasonography; CT – computed tomography.Implantace port katétru
U všech zvířat byl použit identický port katétr (Pro - Port, Plastic Venous Access System, PolyFlow Polyurethane Catheter, 1,9 mm (5,8 Fr) O.D.×1,0 mm I.D., Deltec, Smiths Medical International, Ltd., Velká Británie). Port katétr byl ve většině případů zvířatům implantován těsně před samotným experimentálním chirurgickým zákrokem. Jednalo se tedy nejčastěji o první úkon po uvedení zvířete do celkové anestezie. Pouze v případě experimentu s transplantací jater (F) byl port katétr zaveden až po dokončení výkonu (v průběhu transplantace byla pravá jugulární žíla využita pro centrální žilní katétr za účelem měření centrálního žilního tlaku a současné aplikace infuzí a farmak). Ve všech případech však implantace port katétru proběhla v rámci jedné anestezie spolu s primární operací. Port katétr byl u všech zvířat zaveden za antibiotické profylaxe, ke které byl využit amoxicilin s kyselinou klavulanovou (0,6 g i.v. před výkonem s opakováním dávky po 2 hodinách) (Amoksiklav, Sandoz, Česká republika), pouze v případě transplantace jater pak byl použit cefoperazon (1 g i.v. před výkonem s opakováním dávky po 2 hodinách) (Acefa, Medochemie Bohemia, s. r. o., Česká republika).
U zvířat v celkové anestezii byla z podélné incize na krku nejprve vypreparována zevní jugulární žíla. Následně byl pomocí Seldingerovy techniky nebo z drobné venotomie zaveden samotný katétr do hloubky 9–12 cm s cílem umístit konec katétru do horní duté žíly. Poloha konce katétru nebyla perioperačně rentgenologicky ověřována, ale odvozena dle velikosti zvířete a ověřena volnou aspirací z katétru ihned po jeho zavedení. Katétr byl následně zajištěn 2 nevstřebatelnými pletenými ligaturami síly 2-0 staženými po obvodu žíly těsně kaudálně pod místem vstupu katétru do cévy. Současně byla stejným materiálem podvázána i část žíly kraniálně nad samotným vstupem katétru do cévy. Z další incize na krku umístěné laterálně od první incize (cca 4–6 cm) byla vypreparována podkožní kapsa pro umístění samotného portu. Prostor byl vytvořen tupou disekcí na rozhraní svalové vrstvy a podkoží tak, aby byl port krytý dostatečně silnou vrstvou měkkých tkání, aby byla zachována vitalita kožního krytu a aby v okolí portu nezbýval zbytečně velký mrtvý prostor. Následně byl pomocí punkčního zavaděče protažen distální konec katétru do místa vypreparované kapsy pro port, zkrácen na potřebnou délku a napojen na port. Prostor pro port byl těsně před jeho vložením vypláchnut ředěným roztokem Betadine (Betadine, Egis Pharmaceuticals Ltd., Maďarsko). Port byl pak po vložení fixován pomocí 2 nevstřebatelných stehů (PremiCron, 3-0, B.Braun Medical, s. r. o., Česká republika) z důvodu prevence jeho dislokace v pooperačním období. Jednotlivými stehy byla poté uzavřena svalová vrstva v případě mediální incize a podkoží v případě laterální incize pro port (Vicryl 3-0, Ethicon, Johnson and Johnson Medical, Belgie). Do portu byl transkutánně zaveden set Huberovy jehly velikosti 20 G s krátkou infuzní hadičkou, který je součástí balení port katétru, a ověřena volná aplikace i aspirace. V několika případech, kdy nebyla funkčnost systému optimální, musela být rána rozpuštěna a upravena poloha portu či zkrácen katétr tak, aby nedocházelo k jeho zalamování. Po sutuře kůže jednotlivými stehy (Ethilon 3-0, Ethicon, Johnson & Johnson Medical, Belgie) byl na obě operační rány aplikován Novikovův roztok jako prevence jejich pooperační kontaminace. Časová náročnost implantace port katétru se nejčastěji pohybovala v rozmezí 30–45 minut. Cestou zavedené Huberovy jehly byla v průběhu navazujícího chirurgického zákroku (dle typu experimentu) touto cestou podávána infuze krystaloidního roztoku. Na závěr výkonu pak byla do port katétru aplikována heparinová zátka o objemu 3,5 ml. Zátka byla tvořena směsí fyziologického roztoku (FR) s heparinem (2500 IU heparinu/10 ml FR) (Heparin, Zentiva, Česká republika). Huberova jehla byla vytažena a na místo vpichu aplikován Novikovův roztok. V případě zvířat, u kterých byla plánována v prvních pooperačních dnech každodenní potřeba aplikace farmak a krevních odběrů, byl ponechán perkutánně zavedený set Huberovy jehly s infuzní hadičkou přelepený za aseptických podmínek náplastí s transparentní fólií (Tegaderm TM Film, 10×12 cm, 3M Česko, s. r. o., Česká republika) a následně pruhem adhezivní netkané textilie, konec infuzní hadičky byl směřován mezi lopatky zvířete a set včetně portu proplněn heparinovou zátkou (v tomto případě 5 ml). Postup zavedení portu je zdokumentován na obrázku (Obr. 1).
Image 1. A) vypreparovaná zevní jugulární žíla; B) zavedení katetru z drobné venotomie; C) fixace zavedeného katetru; D) protažení katetru pomocí zavaděče do místa pro port; E); katetr napojený na port; F) set Huberovy jehly s infuzní hadičkou zavedený perkutánně do portu
Fig. 1. A) Exposed external jugular vein; B) Catheter insertion via short venotomy; C) Fixation of the inserted catheter; D) Pulling the catheter using a guide to the area of the port; E) Catheter connected to the port; F) Huber needle infusion set percutaneously inserted in the port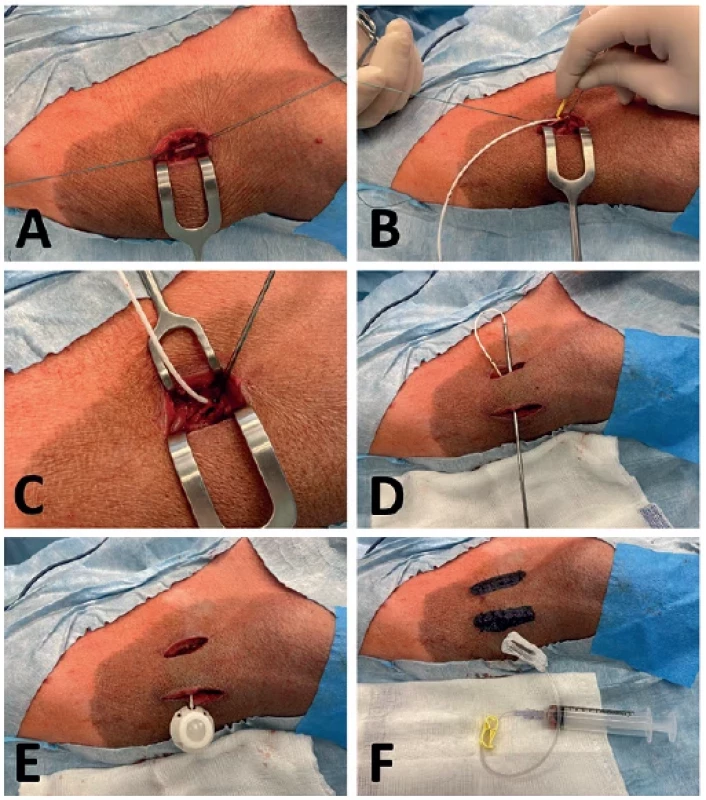
Používání portu v pooperačním období
Ponechání setu Huberovy jehly s infuzní hadičkou umožnilo snadný a rychlý intravenózní přístup bez nutnosti transkutánní punkce portu pro každé jeho použití. Tento postup byl zvolen v případě, že bylo dočasně plánováno každodenní používání portu. Nejdéle po 3 dnech však byla jehla vyměněna za novou a její krytí bylo měněno, pokud došlo k jeho částečnému odlepení. V případě, že byl interval mezi plánovaným použitím portu delší než 1 den, byla jehla extrahována a port musel být vždy znovu transkutánně punktován. Tento postup byl preferován například u zvířat, kde byly plánované odběry krve s četností jen 1x týdně. Dále byl tento postup využit u naprosté většiny zvířat v pozdějším pooperačním období. Každá nová punkce portu byla prováděna po aplikaci antiseptického roztoku na povrch kůže. Byl kladen důraz na šetrný přístup ke zvířatům, která často punkci portu dobře tolerovala. Pokud však bylo zvíře neklidné, byla punkce provedena po podání malého množství krmení, čímž byla odvedena pozornost zvířete. I v takových případech bylo místo implantace portu na laterální straně krku dobře přístupné. Před samotným odběrem krevního vzorku bylo vždy nejprve odtaženo cca 8 ml heparinové zátky a krve, aby nedošlo k naředění a znehodnocení vzorku. Port katétr byl kromě odběrů krve využíván i k premedikaci zvířete například před ultrasonografickým vyšetřením či před vyšetřením výpočetní tomografií (CT), k aplikaci farmak a k infuzní terapii (Obr. 2). K jednorázové punkci byla využívána standardní injekční jehla velikosti 22 G. Pokud měla být zavedená jehla ponechána do další kontroly, byla častěji volena Huberova jehla (20 G). Injekční jehla o průměru 22 G nemohla být použita pro aplikaci jodové kontrastní látky při CT vyšetření z důvodu nedostatečného průtoku. Huberovy jehly či injekční jehly velikosti 18 G umožnily podání kontrastní látky požadovanou rychlostí. Injekční jehla o průměru 18 G byla používána pouze za tímto účelem a vzhledem k tomu, že jedno zvíře absolvovalo v pooperačním období maximálně 6 CT vyšetření, nebylo riziko poškození membrány portu považováno za příliš vysoké a převažoval benefit aplikace kontrastní látky cestou portu nad kanylací periferní žíly. Venepunkce žil na uchu musela být využita v případě nemožnosti aspirace z portu a zvíře bylo v takovém případě nejprve sedováno intravenózní aplikací ketaminu a azaperonu cestou portu (Narkamon, Bioveta, a. s., Česká republika; Stresnil, Elanco Animal Health, Rakousko). V případě, že nebyl port funkční ani pro aplikaci, muselo být zvíře před krevním odběrem sedováno intramuskulární injekcí uvedených farmak. Stejně tak muselo být postupováno u zvířat, u kterých bylo používání portu ukončeno z důvodu infekčních komplikací. Po každém použití portu v pooperačním období byl port katétr vyplněn heparinovou zátkou dle stejného schématu jako po jeho implantaci.
Image 2. Použití portu k infuzní terapii v časném pooperačním období
Fig. 2. Vascular access port use for infusion in the early postoperative period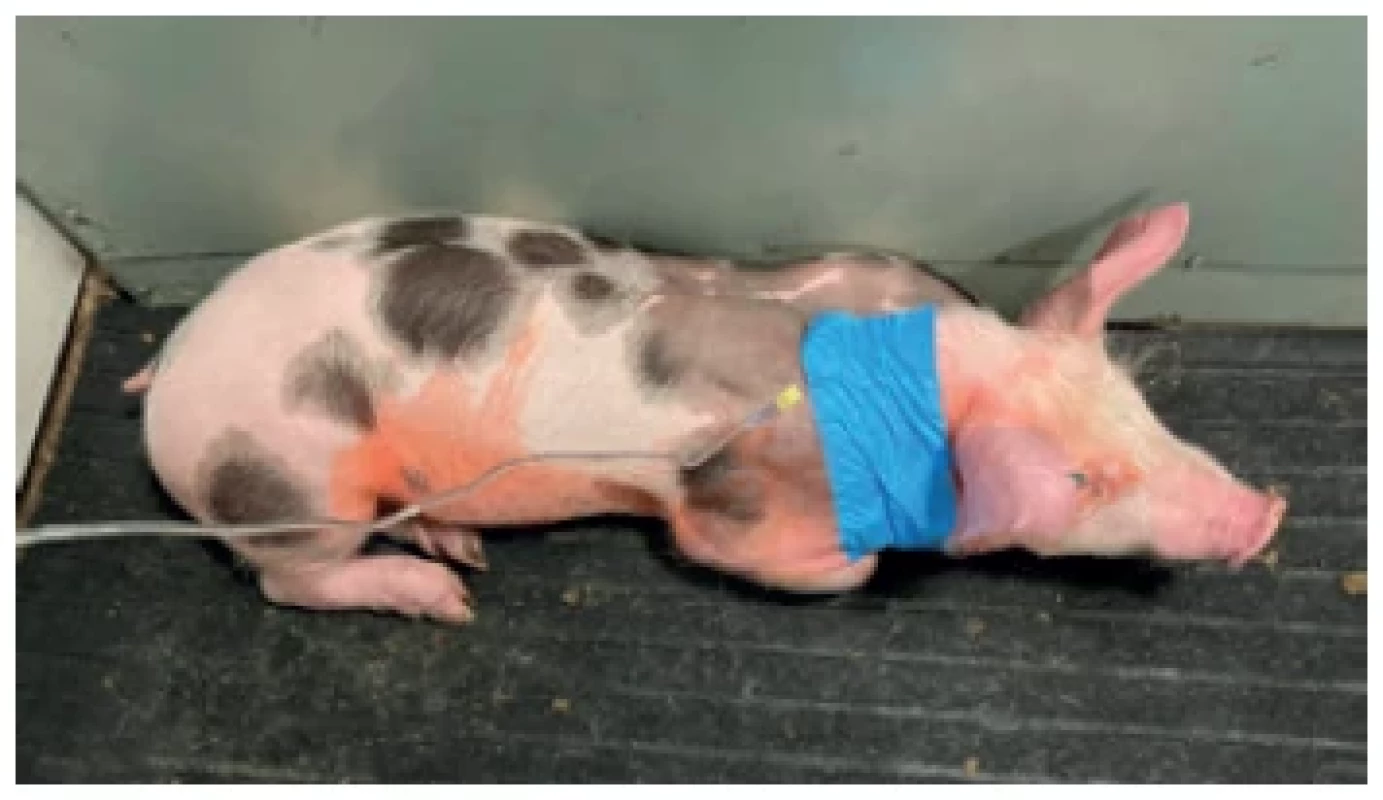
Poruchy funkčnosti portu a další komplikace byly zaznamenávány při každodenních kontrolách zvířat, kdy byla současně monitorována jejich aktivita, tělesná teplota a celkový stav. Souhrnné vyhodnocení pak bylo provedeno formou retrospektivní analýzy.
VÝSLEDKY
Celkem bylo za dobu 5 let implantováno 211 port katétrů. Převážná většina byla implantována na pravou stranu krku a napojena cestou pravé zevní jugulární žíly (190 zvířat, 90 %). Pouze u 21 zvířat (10 %) byl port implantován na levou stranu krku a napojen cestou levé zevní jugulární žíly. Implantace na levou stranu byla zvolena s ohledem na potřebu zavedení Swan-Ganzova katétru cestou pravé zevní jugulární žíly při ukončení experimentu.
Z celkového počtu implantovaných port katétrů nebyly u 157 (74,4 %) zaznamenány jakékoli komplikace. Nejméně závažnou komplikací, která ve většině případů neměla vliv na funkčnost ani použití port katétru, byl dočasný otok v okolí portu, který byl pozorován celkem u 12 zvířat (5,7 %) (z toho 2× v kombinaci s poruchou aspirace z portu). Obdobnou závažnost měl i serom v okolí portu, který byl celkem zaznamenán u 3 zvířat (1,4 %) (z toho 1× v kombinaci s poruchou aspirace z portu). Další komplikací s nízkou závažností byly přechodné potíže s aspirací krve cestou port katétru. Jednalo se o nemožnost náběru krevního vzorku cestou port katétru v průběhu jedné nebo více plánovaných kontrol, kdy musel být vzorek odebrán z periferní žíly. Při následujících kontrolách však již byla aspirace možná a aplikace byla možná po celou dobu sledovacího období. Přechodné potíže s aspirací byly samostatně pozorovány u 11 zvířat (5,2 %) a v kombinaci s jinou komplikací pak u 2 zvířat (1× v kombinaci s otokem a 1× v kombinaci se seromem v okolí portu). Celkem tak nebylo přechodně možné využít port k odběru krevního vzorku u 13 zvířat (6,2 %).
Trvalá nemožnost aspirace z portu při možné aplikaci byla zaznamenána jen u 3 zvířat (1,42 %, z toho 1× v kombinaci s otokem kolem portu). Trvající nemožnost aspirace z portu však v podstatě nastala sekundárně i v rámci jiných komplikací, kdy bylo používání portu preventivně ukončeno. Vzhledem k nemožnosti použít port k odběru krevního vzorku ani k aplikaci byly následující komplikace hodnoceny jako nejzávažnější. Konkrétně se jednalo o tyto komplikace: kožní dehiscence v místě incize pro implantaci portu (2 zvířata, 0,95 %), nekróza kožního krytu nad portem (2 zvířata, 0,95 %), absces v okolí portu (12 zvířat, 5,7 %, z toho 1× v kombinaci s dehiscencí). Dále pak byla u 10 zvířat (4,7 %) pozorována trvalá ztráta funkce portu (nemožnost aspirace i aplikace) z nespecifických důvodů. Komplikace ovlivňující jak aspiraci, tak aplikaci cestou portu tedy nastaly celkem u 29 zvířat (13,7 %). Všechny zaznamenané komplikace jsou uvedeny v tabulce (Tab. 2).
Table 2. Souhrn všech zaznamenaných komplikací (u některých zvířat došlo ke kombinaci více komplikací)
Tab. 2. Summary of all observed complications (some animals had more than one complication)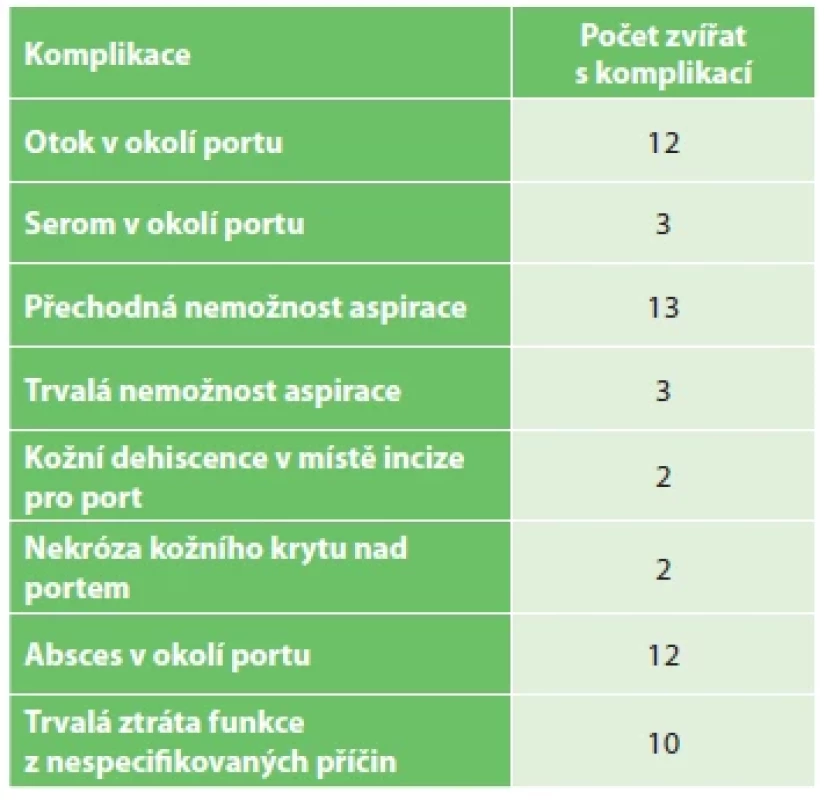
Dále byla vyhodnocena i doba, za kterou se rozvinuly komplikace, které měly vliv na funkčnost port katétru. Přechodné poruchy aspirace byly nejčastěji zaznamenány ve druhém pooperačním týdnu (10 zvířat), v prvním a třetím týdnu pak jen u minima zvířat (1 a 2 zvířata). V průměru byla přechodná nemožnost odběru krve portem sledována 13. pooperační den. Trvalá ztráta funkce portu z nespecifických příčin pak nastala v průměru rovněž 13. pooperační den. Konkrétně byla zaznamenána 5× v 1. týdnu, 4× ve 3. týdnu a 1× ve druhém týdnu. Rozvoj abscesu v okolí portu byl průměrně pozorován 16. pooperační den. U 7 zvířat došlo k této komplikaci ve 3. pooperačním týdnu, u 4 zvířat ve 2. týdnu a u 1 zvířete v prvním týdnu.
U komplikací, které měly vliv na funkčnost port katétru, byla rovněž vyhodnocena jejich četnost podle typu experimentu, do kterého byla zvířata zařazena. Tyto výsledky jsou přehledně shrnuty v tabulce (Tab. 3).
Table 3. Počet zvířat s komplikací podle jednotlivých typů experimentů
Tab. 3: Number of animals with complications according to individual experiment types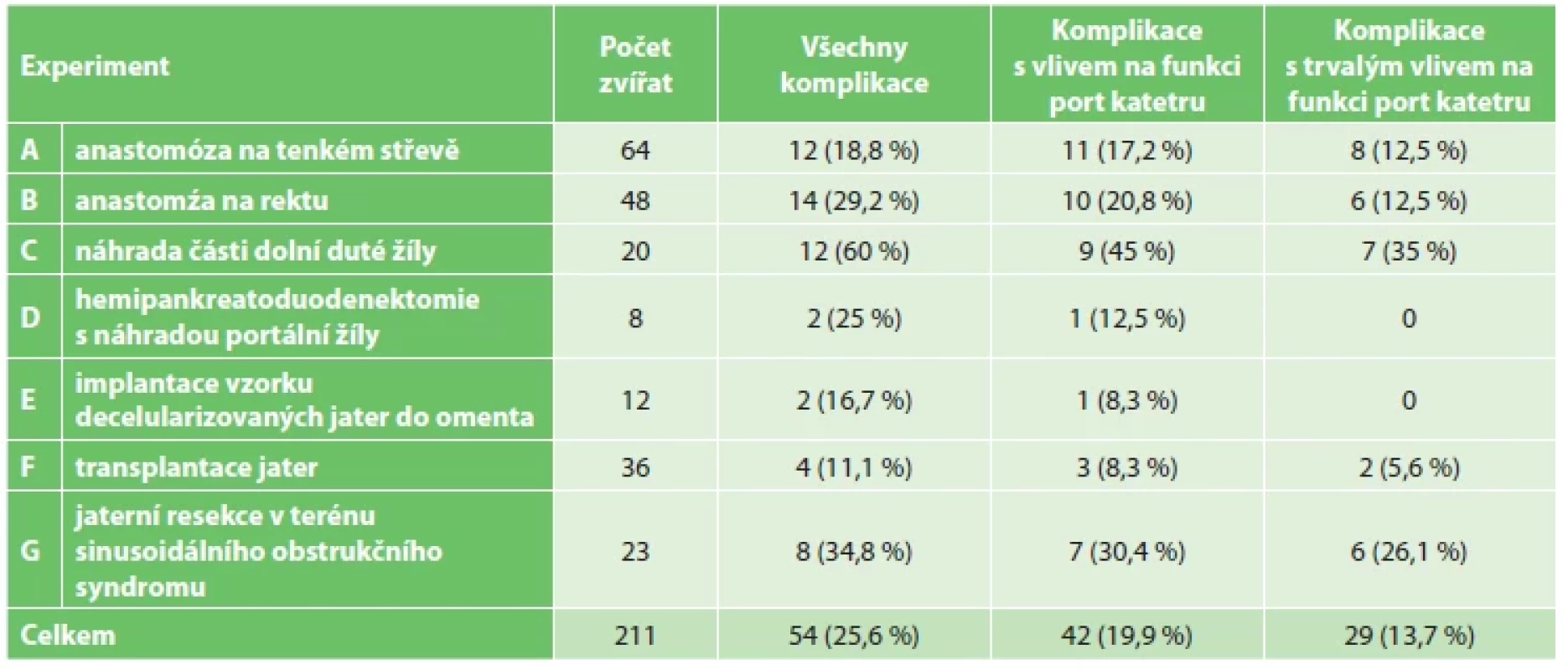
Přechodná nemožnost aplikace do portu se u žádného ze zvířat nevyskytla. Pokud nebylo možné do portu aplikovat, byla vždy tato porucha trvalá (bude detailněji uvedeno níže).
U žádného ze zvířat nebylo nutné v důsledku komplikací explantovat port katétr. Nedošlo ani k samovolnému uvolnění portu a jeho dislokaci na povrch těla. V případě rozvoje abscesu v okolí portu nebyl port nadále používán a v případě rozsáhlejšího nálezu byla dočasně podávána antibiotika (Amoksiklav, 1,2 g i.v. à 12 hod). Nebyl zaznamenán rozvoj sepse v důsledku infekční komplikace portu. Ze všech 12 zvířat s rozvojem abscesu v oblasti portu došlo pouze u 1 k předčasnému úmrtí před dokončením sledovacího období. Jednalo se o zvíře zařazené do projektu s navozením sinusoidálního obstrukčního syndromu a následnou jaterní resekcí. Jako příčina úmrtí bylo zjištěno jaterní selhání v kombinaci s bronchopneumonií, které se vyskytly i u prasat bez infekčních komplikací portu.
DISKUZE
Tato práce prezentuje zkušenosti jednoho pracoviště s implantabilním port katétrem jako metodikou zajištění permanentního žilního vstupu u prasat v průběhu různých chirurgických experimentů. Jedná se o ojedinělý soubor vzhledem k vysokému počtu zařazených zvířat.
Obecně jsou komplikace implantabilních intravenózních port katétrů rozdělovány na infekční a neinfekční [3,15]. Nejčastější neinfekční komplikací je částečná či úplná neprůchodnost katétru způsobená často trombotickou okluzí vzhledem k hyperkoagulabilitě prasat. Jinými, než trombotickými příčinami okluze mohou být: nevhodná lokalizace konce katétru, zalomení katétru nebo precipitace v jeho lumen [3,6,7]. Další možné komplikace pak jsou rozpojení portu od katétru, netěsnící katétr či port, tvorba seromu, hematomu, nekróza kožního krytu, dehiscence rány, protruze katétru na povrch těla či cévní poranění při zavádění katétru [3,16].
V rámci této práce byly komplikace rozděleny s ohledem na jejich klinickou manifestaci a zejména stran funkčnosti a možnosti dalšího používání port katétru. Objasnění konkrétní příčiny neprůchodnosti katétru je komplikované vzhledem k možnosti provedení autopsie až na konci experimentu, tedy s časovým odstupem od prezentace této komplikace.
Četnost všech komplikací, tedy 23,6 %, je dána zahrnutím veškerých komplikací, tedy i takových, které neměly vliv na funkčnost a využití port katétru anebo ovlivnily jeho využití jen dočasně. Komplikace, které měly trvalý vliv na funkčnost port katétru, se vyskytly u 13,7 % všech zvířat a zahrnují i infekční komplikace v podobě abscesu v okolí portu, které byly pozorovány u 5,7 % prasat.
Pozorovaná četnost komplikací v souboru 211 zvířat se zásadně neliší od množství komplikací publikovaných ostatními autory a odpovídá spíše spodní hranici. Etiologie komplikací je však v dostupných publikacích různá. Například Ege ve své studii na prasatech po celotělové iradiaci uvádí neinfekční komplikace u 5 z 9 implantovaných port katétrů [3]. Ve 2 případech došlo ke ztrátě funkce katétru, u 3 dalších pak byly odběry krve komplikované, ale možné. Zvířata byla sledována průměrně kolem 30 dnů a bylo odebíráno několik krevních vzorků denně [3]. Moroni publikoval práci na 20 prasatech, kde u 1 port katétru došlo ke ztrátě funkce z důvodu trombózy a u 2 zvířat došlo k rozvoji katétrové sepse [17]. Cowart ve své studii uvádí zkušenosti s implantací port katétrů u 72 prasat zařazených do 9 experimentů hodnotících intoxikaci olovem [16]. U 28 prasat (38,9 %) zaznamenal komplikace, přičemž pouze u dvou zvířat se jednalo o komplikace neinfekční. Manifestací infekčních komplikací byla nejčastěji hnisavá sekrece v okolí portu, méně často pak plicní abscesy, endokarditida či septická artritida. Zvířata byla sledována 15 dní po implantaci portu, jednalo se však o prasata o hmotnosti kolem 8 kg [16]. Chuang porovnal komplikace externalizovaných katétrů s port katétry, kdy 18 prasatům byl implantován tunelizovaný Hickmanův katétr a 12 prasatům intravenózní port katétr [7]. Zvířata byla sledována po dobu 1 měsíce. Z 18 prasat s externalizovaným katétrem došlo u 13 (72 %) k rozvoji infekčních komplikací a u 3 jedinců (17 %) k rozvoji tromboembolických komplikací. Naopak ve skupině s port katétrem se u 1 zvířete z 12 objevily febrilie, ale jiné komplikace nebyly zaznamenány [7].
Vyhodnocení četnosti komplikací podle jednotlivých experimentů ukazuje, že samotná frekvence používání port katétru nekoreluje s výskytem komplikací. Zvířata zařazená do experimentu F (transplantace jater), kde byla frekvence používání portu nejvyšší, měla jednu z nejnižších incidencí komplikací. Zvířata z experimentu G (sinusoidální obstrukční syndrom), kde byl port katétr rovněž častěji využíván, pak měla naopak druhou nejvyšší incidenci komplikací. Tato vyšší incidence by mohla být vysvětlena celkovým horším klinickým stavem zvířat v tomto experimentu v důsledku poškození jater. Největší množství komplikací u zvířat z experimentu C (náhrada dolní duté žíly) však nelze jednoznačně vysvětlit. Tato zvířata sice měla nejvíce CT vyšetření s aplikací kontrastní látky cestou portu, ale tento počet byl jen o málo vyšší než u zvířat zařazených do ostatních experimentů.
Implantace intravenózních port katétrů umožnila optimalizaci pooperačního období ve smyslu minimalizace stresu zvířat, redukce jejich počtu a usnadnění jak odběru krevních vzorků, tak aplikace infuzí a farmak. Při použití jehly o dostatečném průměru se port katétr ukázal jako vhodný i pro aplikaci kontrastní látky při CT vyšetření. I u zvířat, u kterých došlo k dočasné nebo trvalé nemožnosti aspirace cestou portu, mohl být port použit alespoň k šetrné sedaci a následně byl odběr krve proveden z periferní žíly na uchu. Pokud ihned po punkci portu nebyl odběr krve možný, osvědčila se změna polohy zvířete nebo samotného portu či proplach fyziologickým roztokem, které často problém s aspirací vyřešily. Tato zkušenost odpovídá i doporučením ostatních autorů [3,6].
V případě neinfekčních komplikací je možné port často i nadále používat nebo se pokusit o jeho zprůchodnění. Mohou tak být redukovány počty experimentálních zvířat a minimalizován stres [3]. Naopak v případě infekčních komplikací bylo popsáno možné hematogenní šíření infekce, a jeví se nám tedy za takových situací bezpečnější port dále nevyužívat [6,16].
ZÁVĚR
Implantabilní intravenózní port je vhodnou a bezpečnou metodikou k zajištění permanentního intravenózního vstupu u prasat v rámci chirurgických experimentů. Tato metodika se pojí s možností komplikací, které však u žádného ze zvířat v našem souboru nevedly k nutnosti reoperace nebo vyřazení zvířete z experimentu.
Práce byla podpořena grantem Univerzity Karlovy GA UK 462520 a grantem AZV NU22J-06-00058.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.MUDr. Richard Pálek, Ph.D.
Chirurgická klinika FN Plzeň
alej Svobody 80
301 00 Plzeň
e-mail: palekr@fnplzen.cz
ORCID: 0000-0002-3546-808XRozhl Chir. 2022;101 : 577–583
Sources
1. Swindle MM. Swine in the laboratory: Surgery, anesthesia, imaging, and experimental technique. 3rd edition, CRC Press 2016.
2. Brown JR, Tyeryar EA, Harrington DG, et al. Femoral venipuncture for repeated blood sampling in miniature swine. Lab Anim Sci. 1978;28(3):339–342.
3. Ege CA, Parra NC, Johnson TE. Noninfectious complications due to vascular access ports (VAPs) in Yucatan minipigs (Sus scrofa domestica). J Am Assoc Lab Anim Sci. 2006;45(6):27–34.
4. Moritz MW, Dawe EJ, Holliday JF, et al. Chronic central vein catheterization for intraoperative and long-term venous access in swine. Lab Anim Sci. 1989;39(2):153–155.
5. Smith DM, Lieberman RP, Stribley JA, et al. Chronic catheterization of the inferior vena cava in Yucatan miniature swine. Lab Anim Sci. 1992;42(6):602–606.
6. Swindle MM, Nolan T, Jacobson A, et al. Vascular access port (VAP) usage in large animal species. Contemp Top Lab Anim Sci. 2005;44(3):7–17.
7. Chuang M, Orvieto M, Laven B, et al. Comparison of external catheters with subcutaneous vascular access ports for chronic vascular access in a porcine model. Contemp Top Lab Anim Sci. 2005;44(2):24–27.
8. Henderson KK, Mokelke EA, Turk JR, et al. Maintaining patency and asepsis of vascular access ports in Yucatan miniature swine. Contemp Top Lab Anim Sci. 2003;42(6):28–32.
9. Moroni M, Coolbaugh TV, Mitchell JM, et al. Vascular access port implantation and serial blood sampling in a Gottingen minipig (Sus scrofa domestica) model of acute radiation injury. J Am Assoc Lab Anim Sci. 2011;50(1):65–72.
10. Rosendorf J, Klicova M, Cervenkova L, et al. Double-layered nanofibrous patch for prevention of anastomotic leakage and peritoneal adhesions, experimental study. In Vivo 2021;35(2):731–741. doi:10.21873/invivo.12314.
11. Rosendorf J, Horakova J, Klicova M, et al. Experimental fortification of intestinal anastomoses with nanofibrous materials in a large animal model. Sci Rep. 2020;10(1):1134. doi:10.1038/s41598 - 020-58113-4.
12. Rosendorf J, Klicova M, Cervenkova L, et al. Reinforcement of colonic anastomosis with improved ultrafine nanofibrous patch: experiment on pig. Biomedicines 2021;9(2):102. doi:10.3390/biomedicines9020102.
13. Palek R, Jonasova A, Rosendorf J, et al. Allogeneic venous grafts of different origin used for portal vein reconstruction after pancreaticoduodenectomy – experimental study. Anticancer Res. 2019;39(12):6603–6620. doi:10.21873/ anticanres.13876.
14. Palek R, Rosendorf J, Maleckova A, et al. Influence of mesenchymal stem cell administration on the outcome of partial liver resection in a porcine model of sinusoidal obstruction syndrome. Anticancer Res. 2020;40(12):6817–6833. doi:10.21873/anticanres.14704.
15. Machat S, Eisenhuber E, Pfarl G, et al. Complications of central venous port systems: a pictorial review. Insights Imaging 2019 Aug 28;10(1):86. doi:10.1186/ s13244-019-0770-2.
16. Cowart RP, Payne JT, Turk JR, et al. Factors optimizing the use of subcutaneous vascular access ports in weaned pigs. Contemp Top Lab Anim Sci. 1999;38(3):67–70.
17. Moroni M, Coolbaugh TV, Mitchell JM, et al. Vascular access port implantation and serial blood sampling in a Gottingen minipig (Sus scrofa domestica) model of acute radiation injury. J Am Assoc Lab Anim Sci. 201;50(1):65–72.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2022 Issue 12-
All articles in this issue
- Experimentální chirurgie
- Umělé neuronové sítě a počítačové vidění v medicíně a chirurgii
- Tepny hlavy a krku prasete domácího z pohledu zobrazovacích metod a experimentální chirurgie
- Permanentní žilní přístup v experimentální chirurgii – naše zkušenosti
- Chirurgie v době koronavirové
- Zavedení in vivo modelů karcinomu pankreatu pro studium nových terapeutických režimů
- Konfokální laserová endomikroskopie v pooperačním hodnocení perfuze kolorektální anastomózy – experimentální studie
- Experimentální chirurgie jako součást vývoje degradabilních biomateriálů v kardiovaskulární chirurgii
- Léčba chylothoraxu embolizací hrudního mízovodu
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Tepny hlavy a krku prasete domácího z pohledu zobrazovacích metod a experimentální chirurgie
- Léčba chylothoraxu embolizací hrudního mízovodu
- Zavedení in vivo modelů karcinomu pankreatu pro studium nových terapeutických režimů
- Permanentní žilní přístup v experimentální chirurgii – naše zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

