-
Medical journals
- Career
Úloha radiologa při neoadjuvantní systémové terapii karcinomu prsu
Authors: D. Houserková 1,2; N. Zlámalová 3; K. Spáčilová 1,2; K. Vomáčková 3; B. Donociková 4; M. Kolečková 5; E. Buriánková 1,6
Authors‘ workplace: MAMMACENTRUM Olomouc, screeningové mamodiagnostické centrum 1; Magnetická rezonance Medihope Olomouc 2; Chirurgická klinika Fakultní nemocnice Olomouc 3; Onkologická klinika Fakultní nemocnice Olomouc 4; Ústav klinické a molekulární patologie Fakultní nemocnice Olomouc 5; Klinika nukleární medicíny Fakultní nemocnice Olomouc 6
Published in: Rozhl. Chir., 2021, roč. 100, č. 6, s. 285-294.
Category: Case Report
doi: https://doi.org/10.33699/PIS.2021.100.6.285–294Overview
Úvod: Neoadjuvantní terapie (NT) je jedna z možných strategií onkologické léčby u malignit prsní žlázy. Cílem je downstaging nádorového postižení prsu a axily a tím možnost konverze mastektomie na záchovný výkon prsu a provedení šetrnější cílené operace axilárních uzlin. Úlohou radiologa je provést pomocí zobrazovacích metod přesný lokální staging malignity před podáním NT, hodnotit efekt léčby v jejím průběhu a po ukončení léčby provést restaging nádorového postižení prsu a axily.
Kazuistiky: Autoři prezentují ve třech kazuistikách pacientek s neoadjuvantní chemoterapií (NCHT) diagnostický postup a zobrazování při stanovení lokálního stagingu malignity před léčbou, při sledování v průběhu podávání a při provedení restagingu malignity po ukončení NCHT. Radiologická odpověď po ukončení NCHT je korelována s patologickou odpovědí.
Závěr: Správné stanovení rozsahu nádorového postižení prsu a axily radiologem před léčbou a přesné histologické posouzení nádoru patologem jsou zásadní pro rozhodnutí o následné terapii u pacientů v mamárním týmu.
Klíčová slova:
karcinom prsu − neoadjuvantní terapie – mamografie – ultrazvuk − magnetická rezonance
ÚVOD
Neoadjuvantní terapie (NT) je užívána nejen v terapii lokálně pokročilých primárně inoperabilních nádorů prsu, ale v současnosti je nejčastější indikací k podání NT zmenšení nádoru s možností provedení záchovné ho výkonu na prsu a eliminace axilární disekce u primárně metastaticky postižených uzlin po léčbě [1,2]. Dalším přínosem použití NT je možnost rychlého testu efektu podané terapie v průběhu několika měsíců u konkrétního nádoru s výhodou dobré distribuce podaného léku do tumoru díky nepoškozenému cévnímu zásobení. Předností NT je získání časového prostoru pro vyšetření u ženy s podezřením na nosičství genetické mutace a možnost naplánování vhodného chirurgického výkonu s ohledem na výsledky genetického testování. NT je možné výjimečně podat z vážného důvodu nutnosti odložení chirurgického výkonu za podmínky, že je u pacientky indikace k následné adjuvantní chemoterapii nebo hormonoterapii.
Základní zobrazovací metody, mamografie a ultrazvuk, jsou při NT dostatečným vyšetřením ve většině případů u invazivního NST karcinomu prsu. V indikovaných případech využíváme magnetickou rezonanci prsů (MR mamografii, MRM) jako doplňující výběrovou zobrazovací metodu.
KAZUISTIKA 1
Pacientka, 64 let, byla odeslána gynekologem k vyšetření do screeningového centra pro tři měsíce hmatnou rezistenci v levém prsu. U pacientky provedena diagnostická mamografie (DG MG) s nálezem denzní léze v HZK levého prsu, velikost 38x30x25 mm, BI-RADS 5. Kaudálně a dorzálně od tumoru popsáno nehomogenní neostře ohraničené zvýšení denzity tukové tkáně v rozsahu 75x55x30 mm (Obr. 1A). Bylo doplněno ultrazvukové vyšetření s nálezem ložiska v HZK levého prsu, velikost 32x25x30 mm, BI-RADS 5 (Obr. 2A). Dorzálně a kaudálně od tumoru do vzdálenosti 10 mm nalezena tři další podezřelá satelitní ložiska do velikosti 5 mm. Bez patologických uzlin v axilách a nadklíčcích. Core cut biopsie (CCB) prokázala pleomorfní variantu invazivního lobulárního ca (ILC) levého prsu, ER 100 %, PR 100 %, Ki67 40 %, HER-2/ neu 2+, FISH s průkazem amplifikace. Při prokázaném ILC jsme doplnili MRM s nálezem maligního ložiskového sycení v HZK levého prsu, velikost 35x27x24 mm, a dvěma suspektními satelitními ložisky 8 a 11 mm (Obr. 3A). Tumor v HZK vykazoval restrikci difúze. Dorzálně a především kaudálně od tumoru bylo popsáno rozsáhlé sycení žlázy neložiskového (non mass enhancement, NME) typu v rozsahu 80x50x51 mm, které bylo podezřelé z přítomnosti in situ nebo i invazivní komponenty lobulárního karcinomu (Obr. 4A). Nález NME na MRM koreloval s výskytem nehomogenního zvýšení denzity tukové tkáně v okolí tumoru na MG (Obr. 1A). Předléčebný staging ILC byl cT3N0M0. Pacientka byla z rozhodnutí mamárního týmu indikována k NCHT a vzhledem k rozsahu postižení prsu při agresivní pleomorfní variantě lobulárního karcinomu bylo po léčbě plánováno provedení mastektomie a sentinelové uzliny. Byla podána chemoterapie a biologická léčba. Po dvou měsících podávání NCHT byla provedena UZ kontrola s nálezem regrese ILC o třetinu původní velikosti a s vymizením satelitních ložisek v okolí (Obr. 2B). Po ukončení NCHT byl proveden lokální restaging malignity pomocí MG, UZ a MRM vyšetření. Na MG prokázáno zmenšení tumorózního ložiska na polovinu původní velikosti a výrazná regrese rozsahu a snížení denzity tukové tkáně kaudálně od tumoru (Obr. 1B). Při UZ vyšetření popsáno zmenšení nádoru o více než 50 % (Obr. 2C). Na kontrolní MRM prokázána regrese velikosti tumoru (ložiskového sycení) o více než 50 %, tumor nevykazoval restrikci difúze, vymizely satelitní léze v okolí karcinomu (Obr. 3B). Rozsah neložiskového sycení kaudálně a dorzálně od tumoru byl zmenšený na polovinu proti vstupní kontrole před NCHT (Obr. 4B). Ze zobrazovacích metod i klinického vyšetření byla tedy potvrzena výrazná regrese maligních změn v levém prsu. Pacientka byla indikována ke kůži šetřící mastektomii a SLNB vlevo. Z operační histologie popsaný reziduální ILC prsu, velikost nádoru nebylo možné jednoznačně stanovit, pravděpodobně velikosti více než 40 mm. Sentinelová uzlina negativní. TNM klasifikace ypT2, ypN0(0/1-sn), TRG 3, ER 100 %, PR 100 %, Ki67 10−15 %, HER-2/neu 1+. V adjuvanci podána pacientce biologická a hormonální léčba, byla provedena radioterapie na oblast hrudní stěny vlevo. Pacientka je v dispenzární onkologické péči.
Image 1. MG l. sin, MLO projekce
A) Před NCHT. Ložisko ILC v HZK l. sin označeno klipem. Kaudálně a dorzálně od tumoru nehomogenní zvýšení denzity tukové tkáně odpovídající rovněž maligní infiltraci žlázy (rozsah nálezu je vyznačený dvěma šipkami). B) Po NCHT. Reziduum ca v HZK l. sin, v centru tumoru patrný klip. Zmenšení rozsahu maligní infiltrace žlázy kaudálně a dorzálně od tumoru (rozsah infiltrace je vyznačený dvěma šipkami).
Fig. 1: MG l. sin, MLO projection
A) Before NCT. ILC in the upper outer quadrant (UOQ) of the left breast, marked with a clip. Non-homogenous, highly dense fatty tissue is found caudally and dorsally to the tumour, which also represents malignant infiltration of the gland (the extent of the finding is depicted by two arrows). B) After NCT. Residual tumour in the UOQ of the left breast; a clip is seen in the centre of the tumour. There is a decrease in the extent of the malignant infiltration of the gland caudally and dorsally to the tumour (the extent of the infiltration is depicted by two arrows).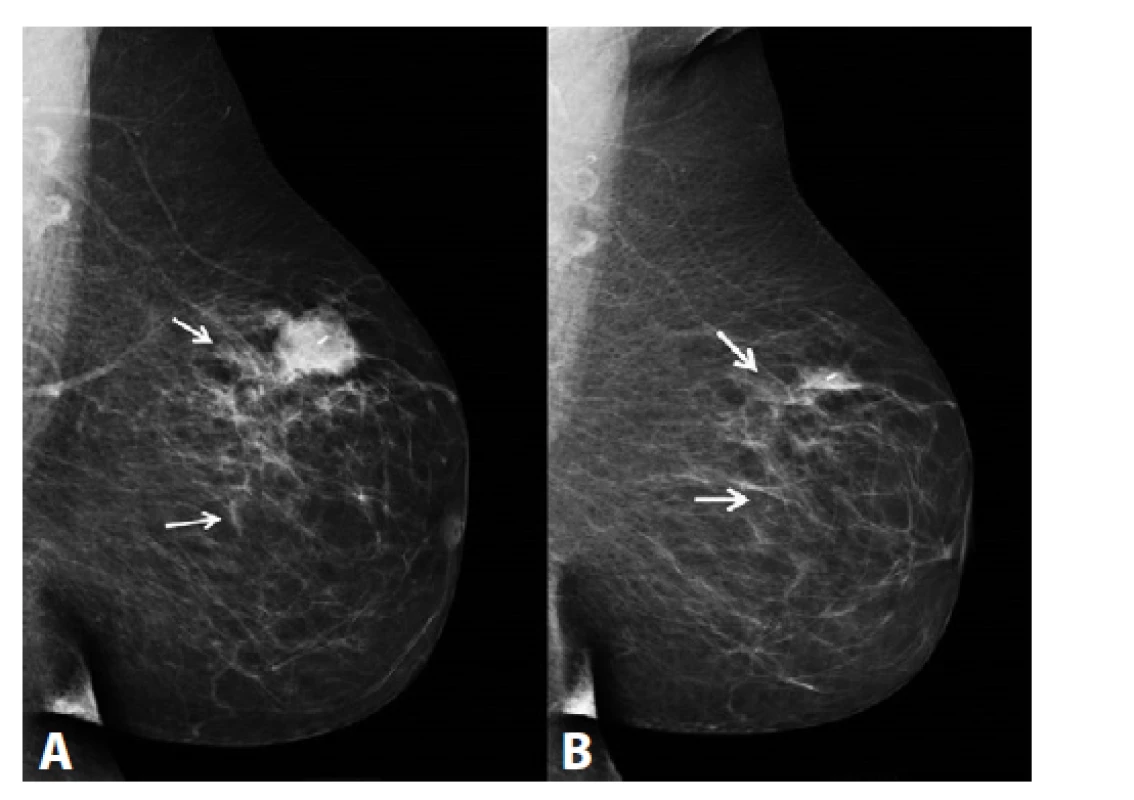
Image 2. UZ vyšetření
A) Před NCHT. Hypoechogenní neostře konturované ložisko 30x18 mm, ILC. B) Po dvou měsících podávání NCHT. Zmenšení karcinomu. Hyperechogenní linie v tumoru odpovídá zavedenému klipu (označeno šipkou). C) Po NCHT. Reziduum karcinomu po léčbě 10x8 mm.
Fig. 2: US findings
A) Before NCT. Hypoechoic, irregularly contoured lesion, 30x18 mm, ILC. B) After two months of NCT. Decrease in tumour size. The hyperechoic line in the tumour represents the introduced clip (arrow). C) After NCT. Significant tumour regression after NCT, 10x8 mm.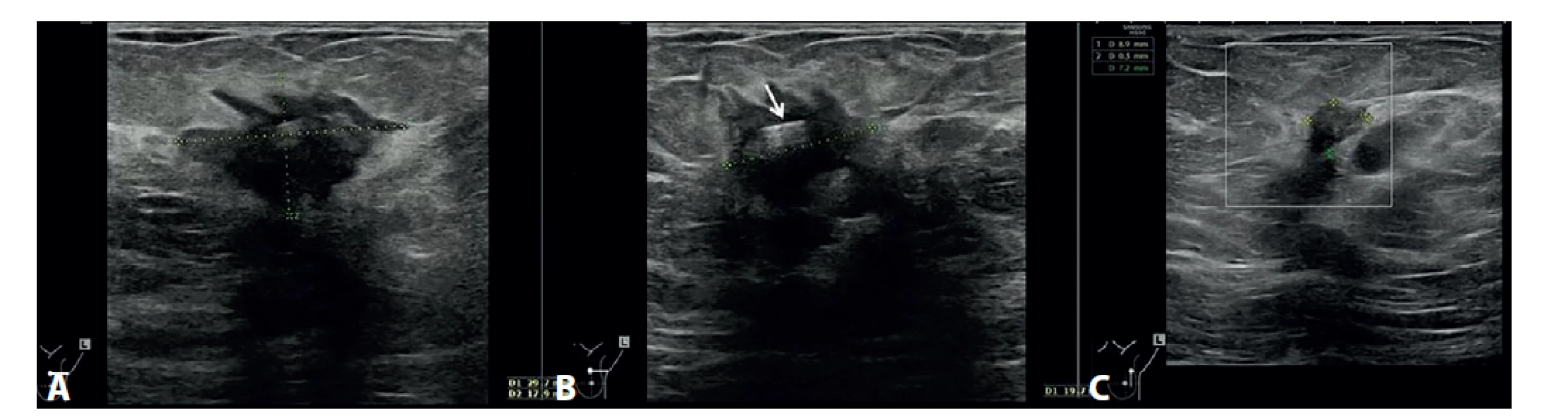
Image 3. MRM, T1FS ax, kontrastní studie VIBRANT, 3. postkontrastní sekvence, subtrakce − ložiskové sycení ILC
A) Před NCHT. Patologický ložiskový enhancement v HZK l. sin odpovídající ILC, satelitní léze dorzálně od tumoru (označeny šipkou). B) Po NCHT. Výrazná regrese tumoru v HZK l. sin se snížením intenzity signálu. Satelitní léze nejsou patrné.
Fig. 3: MRI, T1FS ax, VIBRANT contrast study, 3rd post-contrast sequence, subtraction − mass enhancement, ILC.
A) Before NCT. Pathological mass enhancement in the UOQ in the left breast corresponding to ILC; satellite lesions dorsally from the tumour (marked with the arrow). B) After NCT. Significant tumour regression in the UOQ of the left breast with decreased signal intensity. Satellite lesions are not visible.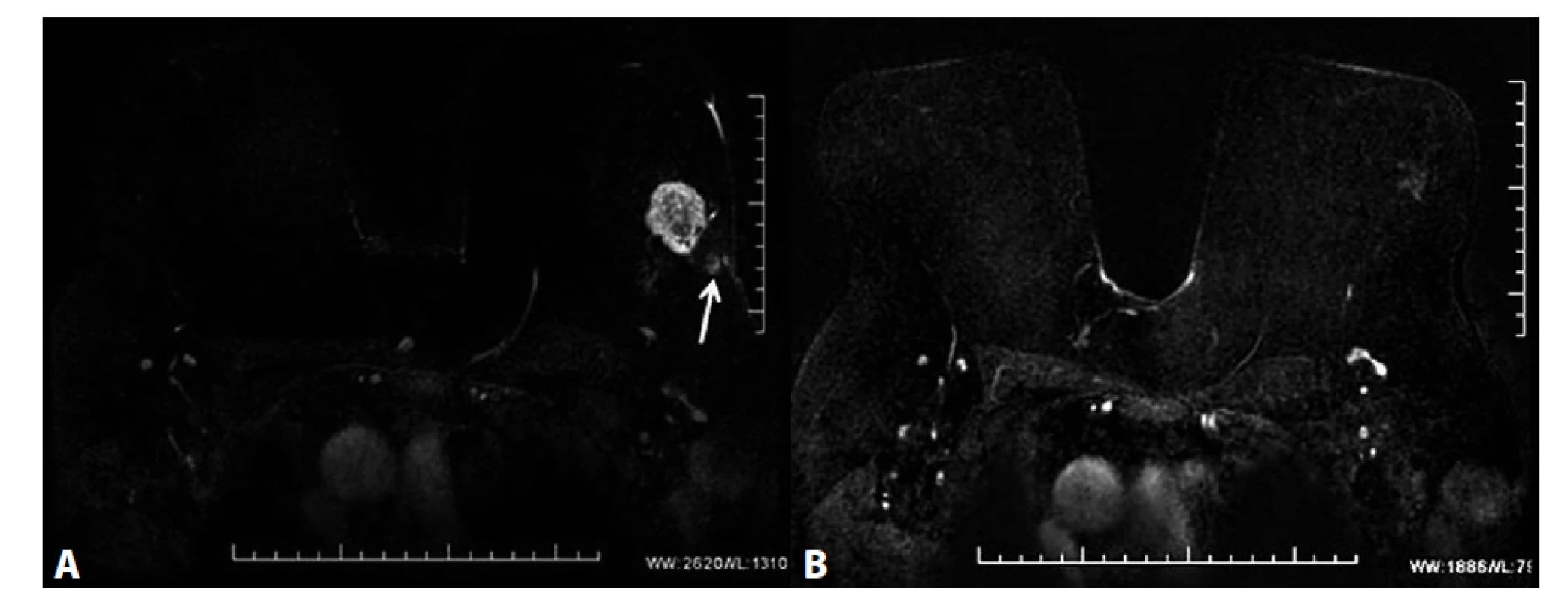
Image 4. MRM, T1FS ax, kontrastní studie VIBRANT, 3. postkontrastní sekvence, subtrakce − neložiskové sycení ILC
A) Před NCHT. Neložiskové sycení žlázy (NME) v levém prsu odpovídá maligní infiltraci žlázy (rozsah NME vyznačený dvěma šipkami). B) Po NCHT. Výrazná regrese patologického NME v levém prsu (vyznačeno dvěma šipkami).
Fig. 4: MRI, T1FS ax, VIBRANT contrast study, 3rd post-contrast sequence, subtraction − non-mass enhancement, ILC.
A) Before NCT. Extensive non-mass enhancement (NME) caudally to the ILC lesion, corresponds to malignant disease in the gland (the extent of NME of the tumour is depicted by two arrows). B) After NCT. Significant regression of pathological NME of the left breast (depicted by two arrows).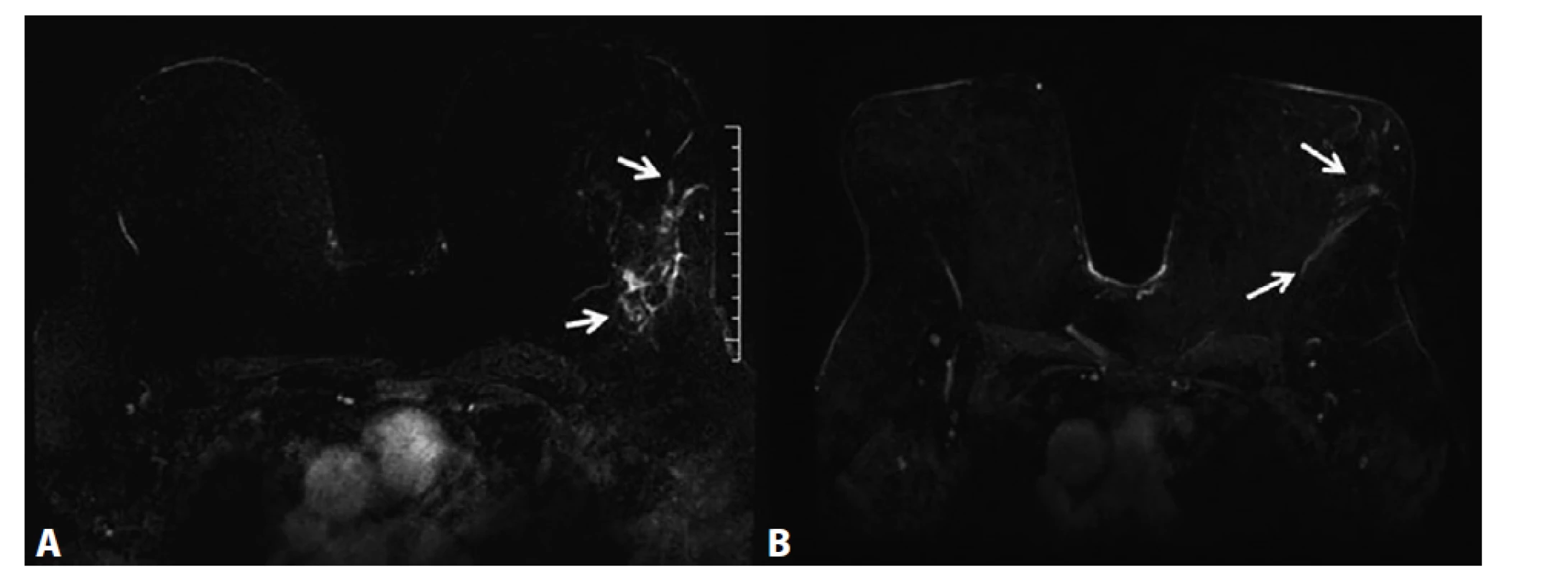
Na kazuistice pacientky s pleomorfním ILC a NCHT lze demonstrovat zásadní význam magnetické rezonance pro stanovení přesného rozsahu malignity před NCHT a po ukončení léčby. Celková velikost malignity na magnetické rezonanci odpovídala ložiskovému a neložiskovému typu sycení. Zejména u ILC může neložiskový enhancement na MRM odpovídat nejen malignímu postižení, ale stejný obraz může mít i zánětlivá celulizace v okolí tumoru. Pokud by byl u pacientky po NCHT plánovaný záchovný výkon prsu, bylo by nutné nález NME z MRM histologicky verifikovat biopsií pod MR navigací. NME neměl v UZ zobrazení odpovídající korelát. Pouze díky velmi přehledné MG u tukového typu prsu byla v tomto případě možná korelace nálezu neložiskového sycení na MRM se zvýšením denzity tukové tkáně na MG kaudálně od tumoru. Celkový rozsah reziduální malignity na MRM odpovídal rozsahu patologického nálezu reziduálního ILC z operační histologie. Magnetická rezonance byla v tomto případě zásadní zobrazovací metodou pro stanovení předléčebného rozsahu malignity a vykazovala nejpřesnější shodu s velikostí reziduálního tumoru po operaci stanovené patologem.
KAZUISTIKA 2
Pacientka, 37 let, si při preventivním samovyšetření nahmatala rezistenci v levém prsu a byla odeslána gynekologem na ultrazvukové vyšetření. U ženy byla pozitivní rodinná anamnéza, tři tety (sestry otce) onemocněly v mladém věku karcinomem prsu. Bylo provedeno UZ vyšetření s nálezem ložiska v HVK levého prsu, BI-RADS 5, velikost 29x10x8 mm. Axily a nadklíčky bez patologických lymfatických uzlin. Byla doplněna DG MG bez nálezu maligní změny, v poměrně denzní žláze u mladé ženy nebyl tumor patrný. Provedena CCB pod ultrazvukovou kontrolou, histologicky prokázaný triple negativní karcinom, Ki67 90 %. U mladé pacientky s denzní nepřehlednou mamografií a se zvýšeným rizikem pro karcinom prsu jsme před léčbou doplnili MRM. Na MRM popsáno ložiskové sycení známého karcinomu v HVK levého prsu velikosti 30x18x21 mm s těsným naléháním, ale bez známek prorůstání tumoru do pektorálního svalu (Obr. 5A). Předléčebný staging malignity byl cT2N0M0. Po posouzení v mamárním týmu byla pacientka indikována k NCHT. Před NCHT provedeno označení tumoru klipem. Zobrazovací metody včetně MRM neprokázaly po ukončení NCHT reziduum malignity (Obr. 5B), byla stanovena radiologická kompletní odpověď (rCR) po léčbě. Vzhledem k věku pacientky a vysoce pozitivní rodinné anamnéze bylo během NCHT provedeno genetické testování na přítomnost rizikové mutace a byla nalezena patogenní varianta v genu BRCA1 v heterozygotním stavu. Vzhledem k vysokému riziku pacientky při prokázané BRCA 1 mutaci byla u pacientky provedena kůži šetřící mastektomie a SLNB vlevo. Operační histologie prokázala patologickou kompletní odpověď (pCR). TNM klasifikace yR0, ypT0, ypN0(sn), TRG1. Pacientka je v dispenzární onkologické péči.
Image 5. MRM. T1FS ax, kontrastní studie VIBRANT, 2. postkontrastní sekvence, subtrakce
A) Před NCHT. Patologické sycení ložiskového typu v HVK l. sin odpovídající karcinomu. V centrálních oddílech tumoru výpadek sycení odpovídající nekrotickým změnám ca. B) Po NCHT. Absence sycení po NCHT, bez průkazu rezidua tumoru, rCR.
Fig. 5: MRI, T1FS ax, contrast study VIBRANT, 2. postcontrast sequence, subtraction
A) Before NCT. Pathological mass enhancement in the UIQ of left breast corresponding to carcinoma. Absence of enhancement in the central part of the tumour corresponds to necrotic changes. B) After NCT. Absence of enhancement after NCT, without detection of residual tumour, rCR.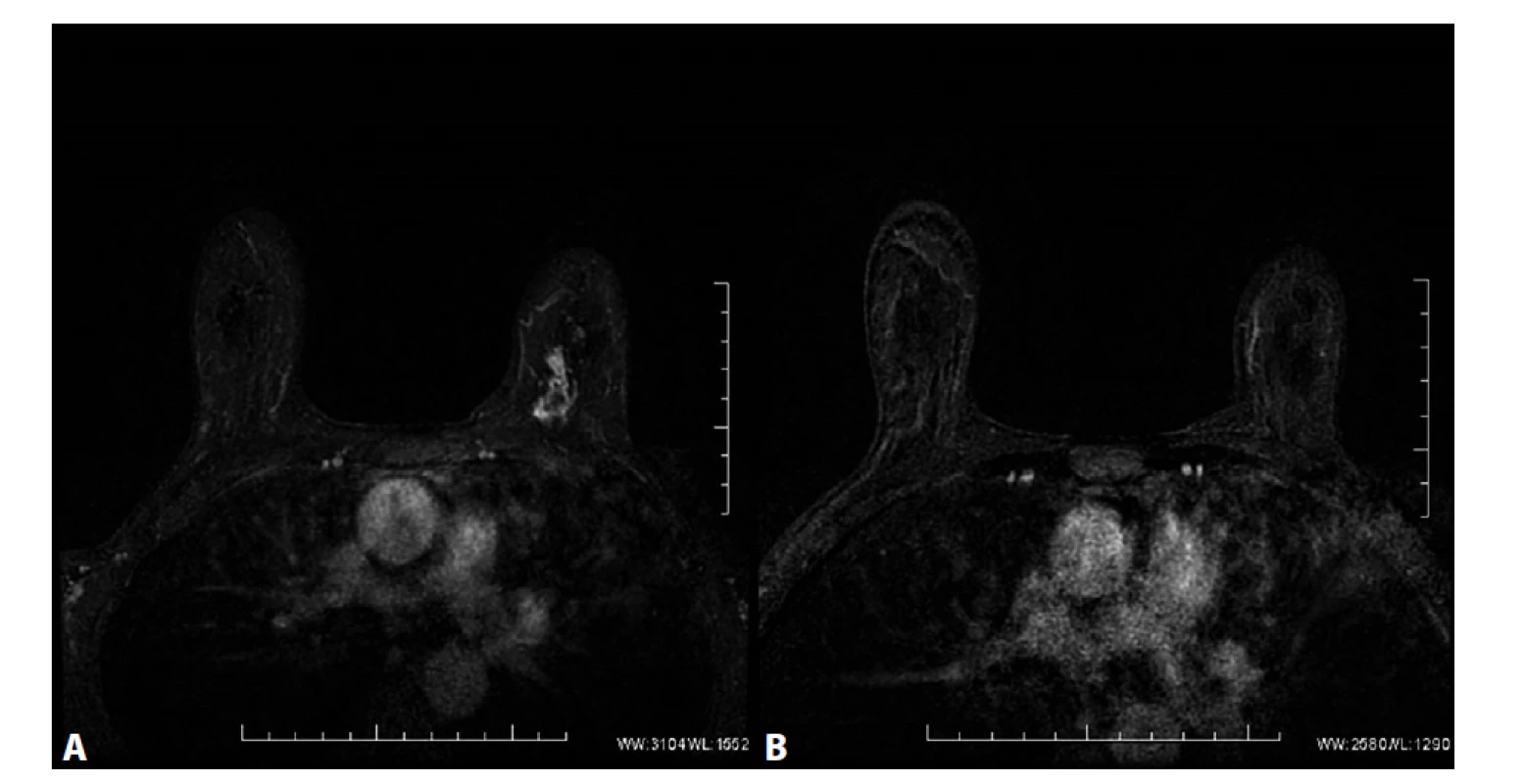
Z kazuistiky vyplývá výhoda posouzení efektu NCHT u mladé pacientky s agresivním triple negativním nádorem (Ki67 90 %), získání časového prostoru pro provedení genetických testů, a tak možnost správného rozhodnutí při plánování operačního výkonu i při rCR po léčbě.
KAZUISTIKA 3
Pacientka, 67 let, byla odeslána s hmatnou rezistencí v levé axile na vyšetření prsů. Sestra pacientky onemocněla karcinomem prsu v 50 letech. Byla provedena DG MG se zobrazením neostře ohraničené denzity centrálně v levém prsu velikosti 18x15x12 mm, bez podezřelých mikrokalcifikací, BI-RADS 4b. V levé axile zachycena denzní zvětšená lymfatická uzlina (Obr. 6A). Doplnili jsme UZ vyšetření s nálezem útvaru centrálně v levém prsu, velikost 12x10x11 mm, BI-RADS 5. V levé axile nalezena při UZ jedna patologická uzlina, velikost 20x12 mm. Provedena CCB tumoru levého prsu a patologické uzliny v levé axile s následným označením uzliny carbem. Histologicky z CCB tumoru v prsu prokázaný invazivní ca NST G3, ER 1 %, PR 50 %, Ki 67 70 %, HER2/neu 3+ a z CCB uzliny metastáza ca. Předléčebný staging karcinomu byl cT1N1M0. Pacientka indikována v mamárním týmu k NCHT a biologické léčbě s plánováním záchovného výkonu a TAD vlevo po ukončení léčby. Před podáním NCHT provedeno označení karcinomu v levém prsu klipem. Z důvodu primární lymfadenopatie při lokálně nepokročilém NST G3 indikováno onkologem PET/CT vyšetření. PET/CT vyšetření prokázalo výrazný hypermetabolismus glukózy v jedné lymfatické uzlině levé axily (Obr. 7A) a jen mírnou akumulaci FDG v ložisku levého prsu (Obr. 7B) svědčící pro přítomnost viabilní nádorové tkáně, bez známek generalizace nádoru. Při UZ kontrole po třech měsících podávání NCHT bylo patrné zmenšení tumoru centrálně v levém prsu téměř na polovinu a regrese patologické uzliny v levé axile. Po ukončení NCHT provedena DG MG levého prsu, kde patrný klip, bez známek rezidua karcinomu, v levé axile nezvětšené uzliny (Obr. 6B). Při UZ vyšetření byl nalezen hypoechogenní okrsek kolem klipu velikost 6x5x5 mm – dif. dg. fibrózní změny kolem klipu nebo minimální reziduum tumoru. V levé axile při UZ vyšetření regrese uzliny na 9x6 mm. Hypoechogenní struktura uzliny s absencí hilu byla podezřelá z přetrvávajícího metastatického postižení, uzlina popsána po léčbě jako suspektní. U pacientky byla provedena kvadrantektomie (KE) po stereotaktické lokalizaci k zavedenému klipu a TAD vlevo. Z operační histologie nebylo prokázáno reziduum karcinomu v prsu. Při cílené axilární disekci byly detekovány a odebrány dvě sentinelové uzliny a jedna bioptovaná primárně metastatická uzlina značená carbem (nebyla sentinelovou uzlinou) a v operačním preparátu byly nalezeny ještě čtyři další velmi drobné axilární uzliny. Všech celkem sedm uzlin bylo bez průkazu maligního postižení, byla stanovena pCR po NCHT v prsu a axile. TNM klasifikace ypT0, ypN0, yR0, TRG 1. Pacientka pokračuje v adjuvantní biologické terapii po dobu jednoho roku a byla zahájena hormonální léčba. St.p. adjuvantní radioterapii na oblast levého prsu a spádových uzlin.
Image 6. MG l. sin MLO projekce
A) Před NCHT. Centrálně v levém prsu neostře ohraničená denzita, odpovídá invazivnímu NST ca, tumor označený klipem. Denzní zvětšená patologická lymfatická uzlina v levé axile (označena šipkou). B) Po NCHT. Centrálně v levém prsu klip, bez rezidua ca. V levé axile výrazná regrese patologické lymfatické uzliny (označena šipkou).
Fig. 6: MG l.sin MLO projection
A) Before NCT. A mass of irregular density centrally in the left breast, corresponding to invasive NST cancer; the tumour is marked with a clip. Dense, enlarged, pathological lymph node in the left axilla (arrow). B) After NCT. Centrally located clip in left breast with no residual tumour. Significant regression of the pathological lymph node in the left axilla (marked by the arrow).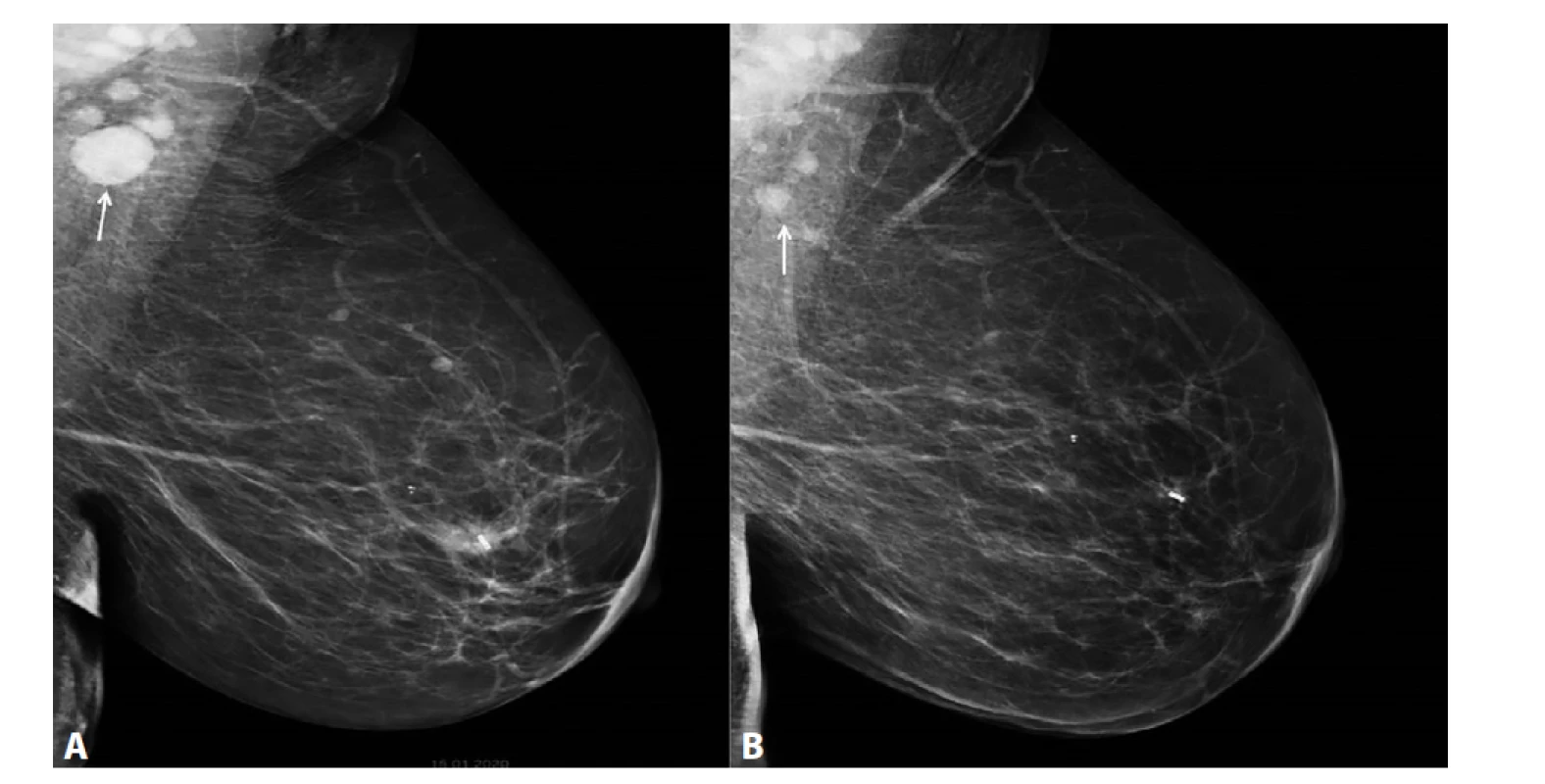
Image 7. PET/CT vyšetření
A) Výrazný hypermetabolizmus glukózy v jedné lymfatické uzlině levé axily, axiální zobrazení. B) Mírná akumulace FDG v ložisku levého prsu (označeno šipkou), koronální zobrazení.
Fig. 7: PET/CT examination
A) Significant glucose hypermetabolism in one lymph node of the left axilla, axial view. B) Mild accumulation of FDG in the lesion of the left breast (marked by the arrow), coronal view.
Kazuistika poukazuje na možnost downstagingu nádorového postižení axily po NCHT u lokálně nepokročilého invazivního HER2/neu pozitivního karcinomu s možností provedení TAD po léčbě.
DISKUZE
Důvodem zavedení NT do léčby ca prsu byla šance na operativu původně neresekabilních malignit prsu a také léčba inflamatorního ca prsu. U žen s operabilním tumorem je rozdíl v dlouhodobém přežití (DFS i OS) po neadjuvantní či adjuvantní chemoterapii nesignifikantní. Hlavním důvodem podávání NT u operabilních zhoubných tumorů prsu je tedy downstaging nádorového postižení prsu s převedením maligního tumoru po ukončení NT do stadia, které umožňuje provedení záchovného výkonu. Dalším důvodem je downstaging nádorového postižení axily s eliminací disekce axily a s možností provést po léčbě při regresi primárně metastatických uzlin SLNB, nebo dnes čím dál častěji preferovanou TAD [1,2].
Nejlepším prediktivním markerem odpovědi na chemoterapii je negativita hormonálních receptorů. U těchto typů nádorů lze neoadjuvantní chemoterapií dosáhnout až 40 % pCR. Na základě výsledků některých klinických studií lze horší odpověď na NCHT předpokládat u lobulárního invazivního karcinomu ve srovnání s nonlobulárními invazivními karcinomy. Lobulární karcinomy jsou naopak citlivější na hormonální léčbu. Hlavními adeptkami na NCHT jsou tedy ženy, jejichž nádor vykazuje primárně špatné prognostické faktory a nepříznivé biologické parametry, nízké nebo negativní hormonální receptory, vysoký grade, vysokou proliferaci, tedy nádory typu luminal B, triple negativní nebo HER2/neu pozitivní [3]. Patologická kompletní odpověď (pCR) je prediktivním ukazatelem intervalu bez nemoci (RFS) a celkového přežití pacientek (OS).
Při NT je nutné provést lokální staging malignity ze zobrazovacích metod a klinického vyšetření. Pokud jde o stanovení lokálního stagingu malignity, jsou zobrazovací metody přesnější než klinické vyšetření a úloha radiologa při NT je nezpochybnitelná. Nezbytná je kontrola před podáním NT, kdy je úlohou radiologa pro - vedení přesného lokálního stagingu karcinomu prsu včetně zhodnocení stavu axilárních uzlin. V průběhu podání NT je obvyklá pouze jedna kontrola pro vyhodnocení léčebné odpovědi, obvykle za 9−12 týdnů od zahájení NT. Rozhodnutí o neprovedení kontroly v průběhu NT, stejně jako častější kontroly v průběhu léčby a jejich načasování jsou vždy v kompetenci onkologa. Po ukončení NT před operací je nutné provést lokální restaging nádorového onemocnění.
Při lokálním předléčebném stagingu a po ukončení léčby před operací provádíme mamografické a ultrazvukové vyšetření. V indikovaných případech je před léčbou doplněna MRM. V takovém případě MRM provádíme i po ukončení léčby. Při hodnocení efektu NT v průběhu léčby je ve většině případů metodou hodnocení velikosti tumoru a axilárních uzlin ultrazvukové vyšetření.
Je nutné si uvědomit, že v případě diagnostického zobrazování při NT je vhodné respektovat „pravidlo jedné zobrazovací metody pro všechny kontroly“, je tedy vhodné porovnávat změny velikosti tumoru metodou, která je schopná nejpřesnějšího zobrazení tumoru u konkrétní pacientky [4].
Mamografie
Mamografie je základní zobrazovací metoda. Má význam pro zobrazení invazivního nádoru a je jedinečnou metodou pro zobrazení maligních mikrokalcifikací, které mohou být projevem někdy i rozsáhlé neinvazivní komponenty nádoru (extenzivní intraduktální komponenta, EIC), projevem multifokality nebo multicentricity malignity. Axila není na mamogramu zachycená v celém rozsahu, a pokud jde o axilární uzliny, vykazuje mamografie malou senzitivitu, specificitu a přesnost pro zobrazení uzlin. Patologické uzliny mají kulatější, lobulovaný nebo nepravidelný tvar, vykazují vyšší denzitu s absencí centrálního projasnění, velikost uzliny není zásadní. Za velmi senzitivní příznak svědčící pro metastatickou uzlinu na mamogramu lze považovat výskyt maligních mikrokalcifikací v uzlině, často identických s mikrokalcifikacemi v karcinomu prsu. Spikulární okraje uzliny, které mohou být patrné při prorůstání metastázy přes její pouzdro, jsou velmi podezřelým příznakem. V takovém případě může být ale problémem odlišení takto změněné metastatické uzliny od primární malignity v axilární lokalizaci nejen na MG, ale i na UZ a často ani histologie z biopsie tento problém nevyřeší. Radiologické hodnocení odpovědi na NT je velmi závislé na denzitě mamografie. Při regresi se nádor může stát v MG zcela „neviditelným“, to ale nemusí znamenat kompletní regresi, jen sumaci s okolní žlázovou strukturou [5]. V tukovém prsu (klasifikace BI-RADS A) je hodnocení rezidua tumoru i rCR relativně přesné. Mamografická denzita se ukazuje být i možným prediktivním faktorem pro dosažení pCR; při vysoké denzitě MG je pravděpodobnost pCR nižší [6].
Ultrazvuk
Ultrazvuk je v případě podezření či nálezu malignity na mamografii vždy doplňujícím vyšetřením. UZ vyšetření upřesní rozsah tumoru a zobrazí vnitřní strukturu nádoru [7]. Má význam pro průkaz dalších multicentrických nebo multifokálních maligních lézí zejména v případě vysoké denzity mamografie. Ultrazvukové vyšetření se ukazuje být vhodnou zobrazovací metodou k hodnocení nádorového postižení prsu a axily před podáním NT, v jejím průběhu i po ukončení léčby [8]. Při ultrazvukovém sledování karcinomu v průběhu NT dochází většinou ke koncentrickému zmenšení původní léze, v mnoha případech pozorujeme také rozpad ložiska na několik menších od sebe oddělených lézí nebo dochází pouze ke změně echogenity ložiska při jeho neměnné velikosti [9]. Ultrazvuk je standardní zobrazovací metodou pro vyšetření axilárních uzlin [10]. Ve většině případů jsou při diagnostikovaném karcinomu prsu při vstupním ultrazvukovém vyšetření ipsilaterální axilární uzliny nezvětšené, nelze je palpovat a klinické vyšetření selhává. Klinicky jasně patologické hmatné uzliny v ipsilaterální axile při karcinomu prsu diagnostikujeme u symptomatických žen, které přicházejí obvykle s lokálně pokročilým karcinomem prsu. U karcinomů zachycených ve screeningu jsou axilární uzliny obvykle nezvětšené. Podezření na patologickou změnu uzliny nebo uzlin lze tedy vyjádřit pouze z ultrazvukového vyšetření a je nutné si uvědomit, že hodnotíme často velmi nenápadné minimální změny uzlin. Hodnocení velikosti uzliny není podstatným znakem pro rozlišení maligní a benigní uzliny. Při podezření na přítomnost metastázy v uzlině se klade větší důraz na morfologická kritéria, jako jsou zesílení kortexu, absence tukového hilu uzliny a vaskularizace jiného než polárního typu, než na samotnou velikost uzliny [11]. Mezi podezřelé znaky metastatického postižení patří změna tvaru uzliny se zakulacením uzliny (udává se změna indexu poměru podélné a příčné osy uzliny menší než 2,0). Vysoce specifickým znakem možného metastatického postižení je absence tukového hilu uzliny a hypoechogenní homogenní struktura uzliny [7]. Dalšími podezřelými znaky uzliny je asymetrické nebo fokální kortikální rozšíření uzliny, kortikální nodulus (normální šíře kortexu je 3−4 mm), nehomogenity kortexu uzliny, perinodální edém a hypervaskularizace uzliny periferního typu [11]. Dle publikované retrospektivní analýzy by mělo být provedeno u pacientek s velikostí primárního NST karcinomu 10 a více mm a gradem 2 a 3 nebo s multicentrickým lobulárním invazivním karcinomem důkladnější ultrazvukové hodnocení axily [12]. Za velmi důležité považujeme srovnání ipsilaterálních a kontralaterálních lymfatických uzlin. Etiologie změny uzlin je velmi pestrá, příčina je obecně nádorová nebo zánětlivá. Důležitým aspektem je tudíž detailní ultrazvukové vyšetření a vyhodnocení lymfatické uzliny před provedením biopsie či jiné intervence v prsu a v axile. V případě již diagnostikovaného ca prsu je někdy patrná tendence radiologa k nadhodnocení nálezu v ipsilaterální axile při UZ vyšetření. I v tomto případě by biopsie axilární uzliny měla být doporučena až na základě pečlivého a uvážlivého vyhodnocení změny uzliny na ultrazvuku.
Magnetická rezonance
Magnetická rezonance je zobrazovací metodou s nejvyšší senzitivitou a přesností pro hodnocení efektu NT při srovnání s MG, UZ i klinickým vyšetřením [13]. V případě NT není MRM standardní, ale je doplňující výběrovou zobrazovací metodou. Přínos magnetické rezonance je přímo úměrný správné a uvážlivé indikaci této metody. Jasnou indikací k předléčebnému stagingu malignity a sledování pacientky po ukončení, event. v průběhu NT je lobulární karcinom. MRM je indikována také v případě velmi denzní mamograficky nepřehledné žlázy, při nejasné velikosti nádoru na MG a UZ či významné diskrepanci velikosti nádoru při MG a UZ vyšetření a při suspekci na prorůstání tumoru do pektorálního svalu. Při podezření na vícečetná multifokální nebo multicentrická maligní ložiska ze základních zobrazovacích metod je výhodné k lokálnímu stagingu před NT doplnit MRM. Na rozdíl od MG a UZ vyšetření, které hodnotí při neoadjuvantní chemoterapii změnu velikosti tumoru, je výhodou MRM schopnost poskytnout funkční informaci, tedy lze hodnotit změnu vaskularizace malignity, i když její velikost po léčbě může být při zobrazení na MG a UZ téměř neměnná. MRM je nejpřesnější metodou pro hodnocení rozsahu malignity, zvláště při limitovaném zobrazení ložiska na MG a UZ (např. některé lobulární ca). Obvykle se provádějí minimálně dvě kontroly pomocí MRM, předléčebná kontrola v rámci lokálního stagingu a poléčebná kontrola jako restaging před operací s hodnocením konečného efektu chemoterapie a k detekci rezidua malignity. MRM kontrola v průběhu chemoterapie se provádí ke zjištění časné odpovědi na NT ve vybraných případech. Změna kinetiky patologického sycení dává možnost hodnotit konečný efekt NT i časné změny ve smyslu hodnocení responder/nonresponder NT [5]. Na MRM hodnotíme kvantitativní změnu tumoru obvykle jako snížení nárůstu intenzity signálu v procentech proti kontrole před léčbou. Důležité je hodnocení kvalitativní změny, která je vyjádřená změnou typu křivky enhancement v čase (time to intensity curve, TIC křivka). Obvykle sledujeme po NT změnu křivky „maligní“ na křivku „benigní“, tj. křivky 3. typu (s „wash out“ příznakem) nebo 2. typu (s „plateau“ příznakem) na křivku 1. typu („persistent“, křivka s kontinuálním nárůstem intenzity signálu). Součástí MRM protokolů jsou dnes sekvence s použitím difúzně váženého zobrazování (DWI, diffusion-weighted imaging). DWI je využívána jako velmi užitečná sekvence, která poskytuje další informace k podezřelým sytícím se lézím z kontrastní MRM a zvyšuje specificitu pro malignitu. Dle metaanalýzy dvaceti studií provedených v posledních letech byla nalezena relativně vysoká senzitivita (89 %) a specificita (72 %) DWI při diagnostice pCR u pacientek s karcinomem prsu po ukončení NCHT [14]. Výsledky studií ukazují na velmi přesnou shodu magnetické rezonance s definitivní histologií při posouzení velikosti rezidua malignity. Absence patologického sycení (rCR) na MRM zejména u luminal B, triple negativních a HER2/neu pozitivních tumorů má vysokou PPV pro pCR. Kompletní radiologická odpověď na MRM vykazuje dle některých studií vyšší přesnost pro predikci pCR (83 %) v polovině podávání NCHT při srovnání s přesností predikce po ukončení NCHT (41 %) [15]. I když MRM vykazuje ze všech zobrazovacích metod nejvyšší přesnost pro stanovení pCR, není natolik přesná, aby mohla být náhradním markerem pCR po NT [16]. Kompletní radiologická odpověď na MRM je ale spojená s výbornou prognózou a příznivým přežitím bez recidivy (RFS) i celkovým přežitím (OS) [17].
Úskalí MR diagnostiky prsu
Při předléčebném doplnění magnetické rezonance prsů je při suspekci na větší rozsah malignity z MRM mít na paměti nutnost histologického ověření dalšího ložiska s patologickým sycením (mass enhancement, ME) či oblasti podezřelého neložiskového sycení (non mass enhancement, NME), u něhož by průkaz malignity znamenal konverzi záchovného výkonu na mastektomii. Při ložiskovém sycení na MRM lze většinu nálezů BI-RADS 5, 4 dohledat při UZ second look a provést biopsii. Větší problém nastává při neložiskovém sycení na magnetické rezonanci, kdy odpovídající korelát na ultrazvuku nebo MG často nedohledáme. Popsaný NME může a nemusí odpovídat maligní změně. Obvykle je u NST karcinomu zvažována u neložiskového sycení na MRM přítomnost extenzivní intraduktální komponenty karcinomu (EIC). Ještě o něco komplikovanější situace nastává v některých případech u lobulárního karcinomu, kdy okolní, často rozsáhlý NME může svědčit pro větší rozsah karcinomu či jeho neinvazivní komponenty, stejně tak jako pro zánětlivou lymfoplazmocytární celulizaci v okolí tumoru. Při suspekci na větší rozsah malignity či výskyt multicentrické léze (lézí) z MRM a negativním UZ second look je nutné provést MR navigovanou biopsii. V některých případech si vypomáháme v případě časové „nedostupnosti“ MR biopsie provedením vějířovité core cut biopsie prsu pod kontrolou UZ s užitím větší jehly (obvykle 12 G). I když se jedná o tzv. biopsii „naslepo“ (pod kontrolou ultrazvuku bi optujeme oblast neložiskového sycení v prsu zřetelnou pouze při MR mamografii), bývá výtěžnost takto provedené biopsie u mamodiagnostika se zkušeností v MR prsu dobrá.
Další zobrazovací metody
V posledních letech jsou prezentovány články o využití kontrastní spektrální mamografie (CESM, contrast enhanced spectral mammography) ke kontrolám při sledování efektu NT. Studie uvádějí v případě NT vysokou senzitivitu, specificitu, PPV a NPV CESM srovnatelnou s MRM [19]. Výhodou kontrastní magnetické rezonance prsů proti kontrastní spektrální mamografii je skutečnost, že MR prsů je dynamickým vyšetřením, kdy hodnotíme sycení (enhancement) a jeho zvýšení v čase. Další výhodou je, že se jedná o 3D multislice techniku, která umožňuje zobrazení axily a hrudní stěny (např. dobře ozřejmí případné prorůstání nádoru do hrudní stěny). Nevýhodou MRM je nutnost vyšetření mléčné žlázy u žen ve fertilním věku ve 2. týdnu menstruačního cyklu, což nemusí respektovat CESM. Zatímco u CESM je nevýhodou možnost častější a závažnější reakce na i.v. podanou jodovou kontrastní látku a také malá dávka radiace, u MRM je nežádoucí reakce po podání paramagnetické kontrastní látky vzácná. Kontraindikací k MRM je klaustrofobie a některé implantované kovové materiály v těle pacientky.
Ve vybraných případech je užívána ke kontrole pacientek před léčbou a po ukončení NT jako doplňující zobrazovací metoda PET/CT. U většiny karcinomů vykazuje MRM vyšší přesnost při hodnocení odpovědi na NT při srovnání s PET/CT, a to v závislosti na jejich imunoprofilu [20].
Biopsie a značení tumoru prsu
Radiolog je odpovědný za stanovení přesného lokálního rozsahu malignity, tj. rozsahu maligního postižení prsu a axily. Lézi podezřelou z malignity (BI-RADS 4,5) je nutné vždy histologicky ověřit. Při výskytu dalších ipsilaterálních suspektních lézí ze zobrazovacích metod je nutné histologicky verifikovat podezřelou multicentrickou lézi, tedy takovou lézi, u které by průkaz malignity vedl ke změně záchovného výkonu na mastektomii. Pokud plánujeme záchovný výkon na prsu, je při výskytu podezřelé multifokální léze vhodné provést biopsii a označení ložiska. Při výskytu vícečetných podezřelých multifokálních lézí je vhodné označení všech těchto ložisek před NT. Pokud jsou přítomné na mamografii v okolí tumoru jasně maligní mikrokalcifikace (BI-RADS 5) jako intraduktální komponenta ca, není nutná jejich histologická verifikace. V případě nejasného rozsahu maligních mikrokalcifikací v okolí ca a plánování záchovného výkonu prsu, zejména v případě biologicky agresivních ca, je dobré doplnit ke stanovení rozsahu malignity MRM. Pokud jsou ale přítomné nejednoznačné mikrokalcifikace, u kterých by průkaz malignity měnil typ chirurgické operace ze záchovného výkonu na mastektomii, je vždy nutná jejich histologická verifikace pomocí stereotaktické vakuové biopsie.
Patologická intraparenchymová lymfatická uzlina postižená nádorem není dalším ložiskem karcinomu, a nemění tudíž rozsah operačního výkonu. Po provedené biopsii je vhodné patologickou intraparenchymovou uzlinu označit a při záchovném výkonu na prsu je provedena exstirpace této uzliny.
Při průkazu maligní léze je nezbytné její označení před podáním nebo v úvodu podání NT. Čím menší je maligní ložisko v prsu (např. malý nádor v prsu a podání NT z důvodu downstagingu nádorového onemocnění v axile), tím větší by měla být obava z časného vymizení nádoru. Hrubou chybou při plánování záchovného výkonu prsu po NT je opomenout včasné označení maligního ložiska. Při NT je užívané značení tumoru klipem zaváděným do centra nádoru nebo vyznačení okrajů nádoru carbem. V některých případech lze použít kombinaci obou metod. Záleží vždy na domluvě s chirurgem a volbě vhodného označení v konkrétním případě. Klipy jsou z titanu, jsou vázané obvykle na biopolymer, v prsní tkáni se díky obalu dobře fixují a nedislokují se [21]. Hydrogelový obal klipu bývá patrný při UZ vyšetření v průběhu a někdy i po ukončení NT, má typický vzhled na UZ a je možné jej odlišit od rezidua nádoru. Nepřesnost hodnocení rezidua tumoru po ukončení NT při UZ vyšetření může ovlivnit přítomnost malé fokální fibrózy kolem klipu, která je někdy od rezidua tumoru neodlišitelná. K přesné diagnostice by přispěla MRM. V praxi se ale neprovádí, protože rozlišení fokální fibrózy kolem klipu od minimálního rezidua karcinomu nemá klinický význam.
Biopsie a značení axiálních uzlin
Cílem downstagingu nádorového postižení axily je ušetřit pacientku provedení axilární disekce. Z výsledků velkých randomizovaných studií vyplývá, že falešná pozitivita (FN) sentinelové uzliny po NT přesahuje 10 %, což je v klinické praxi považováno za neúnosné. Nadějně se tedy jeví postup označený jako „cílená axilární disekce“ (targeted axillary dissection, TAD). Princip výkonu spočívá v označení nejvýraznější metastaticky postižené uzliny před zahájením systémové NT. Dojde-li po jejím ukončení k regresi známek nádorové lymfadenopatie, následuje SLNB doplněná o exstirpaci zmíněné označené uzliny, pokud se tato nenachází mezi sentinelovými [2].
Ultrazvuková core cut biopsie patologické nebo podezřelé lymfatické uzliny v axile je dnes předléčebným standardem [21,11]. Je to metoda bezpečná, rychlá a je udávána vysoká senzitivita core cut biopsie mezi 88 – 100 % [22]. Při minimálních změnách uzliny (např. kortikální nodulace) je zapotřebí odebrat materiál z určité části kortexu uzliny a přesnost biopsie je úměrná zkušenosti mamodiagnostika. Můžeme využít bioptické dělo s funkcí „two step“ techniky odběru, kdy lze po prvním výstřelu jehly před odebráním vzorku zkontrolovat přesnou polohu jehly v uzlině. Použití této techniky odběru je vhodné také v případě, že je vzhledem k lokalizaci bioptované uzliny obava z poranění větší cévy. Na našem pracovišti značíme uzlinu ihned po biopsii carbem. Pokud jsou v axile kromě bioptované uzliny přítomné ještě další podezřelé uzliny (maximálně ale do počtu dvou), označujeme po domluvě s chirurgem i tyto uzliny carbem. K označení bioptované uzliny lze použít i titanový klip (např. tvaru spirálky) umístěný v gelové kapsli [2]. Uzlinu se zavedeným klipem je po ukončení NT před operací nutné označit pro chirurga. Značení fixem na kůži je v případě uzliny nepřesné, označit lze Frankovým vodičem nebo lze zavést do označené uzliny před operací radioaktivní nebo magnetická zrna. Problémem může být někdy migrace klipu po jeho zavedení do uzliny [2]. Klinické vyšetření axily po NT je nepřínosné a problémem je i poměrně malá přesnost ultrazvukového hodnocení axilárních uzlin po ukončení NT. Hodnocení axilárních uzlin na UZ se ukazuje být přesnější v průběhu NT než po jejím ukončení [23]. Uzliny reagují citlivě na lokální a celkové procesy v organismu. K lokálním podnětům musíme přičíst intervence v prsu a axile, značení uzlin (klipem, carbem). K celkovým podnětům pak degresní změny metastatických uzlin při NT. Po provedené chemoterapii je z těchto důvodů UZ odlišení reaktivní uzliny od reziduální metastatické uzliny problematické a v některých případech nemožné [2].
ZÁVĚR
S rozšířením indikací a stále častějším podáváním NT u karcinomu prsu se zvyšují nároky na radiologa při stanovení lokálního rozsahu malignity před léčbou a po jejím ukončení. Trendem NT je výrazný downstaging nádorového postižení prsu a axily a u biologicky agresivních nádorů je časté dosažení pCR. Klinické posouzení rozsahu a změn maligního postižení při NT je nedostačující. Zobrazovací metody umožňují velmi přesné stanovení předléčebného stagingu i poléčebného restagingu malignity včetně provedení nezbytných intervencí v prsu a axile před zahájením NT.
Seznam zkratek:
RA – rodinná anamnéza
MG – mamografie
UZ – ultrazvuk
DG MG – diagnostická mamografie
MRM – MR mamografie, magnetická rezonance prsu
CESM – contrast enhanced spectral mammography, kontrastní spektrální mamografie
Ca – karcinom
NT – neoadjuvantní terapie
NCT – neoadjuvantní chemoterapie
rCR – radiologic complete response, radiologická kompletní odpověď
pCR – pathologic complete response, patologická kompletní odpověď
SLNB – sentinel lymph node biopsy, biopsie sentinelové uzliny
KE – kvadrantektomie, záchovný výkon prsu
TAD – targeted axillary dissection, cílená axilární disekce
HZK – horní zevní kvadrant
HVK – horní vnitřní kvadrant
BI RADS 5 – nádor pravděpodobně maligní (klasifikace nádoru dle zobrazovacích metod)
BI RADS A – hodnocení denzity prsní žlázy na MG (tukový typ prsu s velmi nízkou denzitou)
TNM – klasifikace primární tumor, regionální lymfatické uzliny, vzdálené meta
pTNM – patologická klasifikace primární tumor, regionální lymfatické uzliny, vzdálené meta
NST ca – non special type ca (duktální karcinom)
ILC – lobulární invazivní karcinom
ER – estrogenové receptory
PR – progesteronové receptory
Ki 67 – proliferační marker
TRG – Mandard regression grade (hodnocení stupně regrese nádoru)
EIC – extenzivní intraduktální komponenta
ME – mass enhancement, ložiskové sycení na MRM
NME – non mass enhancement, neložiskové sycení na MRM
i.v. – intravenózně
PPV – pozitivní prediktivní hodnota
NPV – negativní prediktivní hodnota
RFS – recurrence-free survival
DFS – disease free survival OS – overall survival
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Dana Houserková, Ph.D.
Selské náměstí 6/49
779 00 Olomouc
e-mail: dana.houserkova@seznam.cz
Sources
1. Petrů V, Vážan P, Zábojníková M, et al. Chirurgická léčba karcinomu prsu po neoadjuvantní terapii. Rozhl Chir. 2020,99 : 172−177.
2. Coufal O, Zapletal O, Gabrielová L, et al. Cílená axilární disekce a sentinelová biopsie u pacientek s karcinomem prsu po neoadjuvantní chemoterapii – retrospektivní studie. Rozhl Chir. 2018,97 : 551−557.
3. Neumanová R, Petera J. Neoadjuvantní systémová léčba karcinomu prsu a její vliv na indikaci adjuvantní systémové terapie. 19. ročník sympozia Onkologie v gynekologii a mammologii 2014.
4. Masood S. Neoadjuvant chemotherapy in breast cancers. Womens Health (Lond). 2016 Sep; 12(5): 480–491. doi: 10.1177/1745505716677139.
5. Schneiderová M. Diagnostické zobrazovací metody ve sledovaném efektu neoadjuvantní chemoterapie karcinomu prsu. XXXVII. Brněnské onkologické dny a XXVII. Konference pro nelékařské zdravotnické pracovníky 2013.
6. Skarping I, Förnvik D, Sartor H, et al. Mammographic density is a potential predictive marker of pathological response after neoadjuvant chemotherapy in breast cancer. BMC Cancer 2019;19 : 1272. doi: 10.1186/s12885-019-6485-4.
7. Stavros T. Breast ultrasound. Lippincott Williams and Wilkins Philadelphia 2004.
8. Candelaria R, Bassett R, Symmans W, et al. Performance of mid‐treatment breast ultrasound and axillary ultrasound in predicting response to neoadjuvant chemotherapy by breast cancer subtype. Oncologist. 2017 Apr;22(4):394–401. doi: 10.1634/theoncologist.2016-0307.
9. Skovajsová M. Mamodiagnostika: Integrovaný přístup. Praha, Galén 2003.
10. Daneš J. Základy ultrasonografie prsu. Praha, Maxdorf 2001.
11. Veverková L, Dusíková R. The status of core-needle biopsy of axillary lymph nodes in the breast cancer diagnosis. Ces Radiol. 2016;70(2):100–4.
12. Veverková L, Vomáčková K. Ultrasound - guided axillary lymph node biopsy: a retrospective analysis. Research article, J Diagn Tech Biomed Anal. 2019;8 : 1.
13. Scheel J, Kim E, Partridge S,et al. Preoperative MRI, clinical examination, and mammography for residual disease and pathologic complete response after neoadjuvant chemotherapy for breast cancer. ACRIN 6657 Trial. AJR Am J Roentgenol. 2018 Jun; 210(6):1376–1385. doi: 10.2214/AJR.17.18323.
14. Gao W, Guo N, Dong T. Diffusion-weighted imaging in monitoring the pathological response to neoadjuvant chemotherapy in patients with breast cancer: a meta-analysis. World J Surg Oncol. 2018;16 : 145. doi: 10.1186/s12957-018 - 1438-y.
15. Goorts B, Dreuning K, Houwers J, et al. MRI-based response patterns during neoadjuvant chemotherapy can predict pathological (complete) response in patients with breast cancer. Breast Cancer Res. 2018;20 : 34. doi: 10.1186/s13058 - 018-0950-x.
16. Sener S, Sargent R, Lee C, et al. MRI does not predict pathologic complete response after neoadjuvant chemotherapy for breast cancer. J Surg Oncol. 2019 Nov;120(6):903–910. doi: 10.1002/ jso.25663.
17. Loo C, Rigter L, Pengel K, et al. Survival is associated with complete response on MRI after neoadjuvant chemotherapy in ER-positive HER2-negative breast cancer. Breast Cancer Res. 2016;18 : 82. doi: 10.1186/s13058-016-0742-0.
18. Gampenrieder S, Peer A, Weismann C, et al. Radiologic complete response (rCR) in contrast-enhanced magnetic resonance imaging (CE-MRI) after neoadjuvant chemotherapy for early breast cancer predicts recurrence-free survival but not pathologic complete response (pCR). Breast Cancer Res. 2019;21 : 19. doi: 10.1186/s13058-018-1091-y.
19. Lotti V, Ravaioli S, Vacondio R, et al. Contrast - enhanced spectral mammography in neoadjuvant chemotherapy monitoring: a comparison with breast magnetic resonance imaging. Breast Cancer Res. 2017;19 : 106. doi: 10.1186/s13058-017 - 0899-1.
20. Schmitz A, Teixeira S, Pengel K, et al. Monitoring tumor response to neoadjuvant chemotherapy using MRI and F-FDG PET/CT in breast cancer subtypes. PLoS One 2017;12(5). doi: 10.1371/journal. pone.0176782.
21. Houserková D, Váša P. Bioptické metody v současné mamodiagnostice. Ces Radiol. 2014;68(3):183–190.
22. Houssami N, Turner R. Staging the axilla in women with breast cancer: the utility of preoperative ultrasound-guided needle biopsy. Cancer Bio Med. 2014;11(2):69–77.
23. Ye B, Zhao H, Yu Y, et al. Accuracy of axillary ultrasound after different neoadjuvant chemotherapy cycles in breast cancer patients. Oncotarget 2017 May 30;8(22):36696 – 36706. doi: 10.18632/oncotarget.13313.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 6-
All articles in this issue
- Chirurgie prsu – důležitá součást onkochirurgie
- První zkušenosti s použitím jódových zrn pro lokalizaci nehmatných lézí v mamární chirurgii
- Mukokéla apendixu z perspektivy radiologa
- Význam chirurgické biopsie sentinelové uzliny u pacientek s karcinomem prsu po neoadjuvantní chemoterapii: prospektivní multicentrická studie
- Komentář k článku: Žatecký J., et al. Význam chirurgické biopsie sentinelové uzliny u pacientek s karcinomem prsu po neoadjuvantní chemoterapii: prospektivní multicentrická studie
- Předoperační CT pro plánování pooperační radioterapie karcinomu prsu
- Komentář k článku A. Hlávky a kol. Předoperační CT pro plánování pooperační radioterapie karcinomu prsu
- Úloha radiologa při neoadjuvantní systémové terapii karcinomu prsu
- Fyloidní tumor a jeho malignizace v invazivní duktální karcinom prsu − kazuistika
- Aneuryzma pankreatikoduodenální arkády při syndromu ligamentum arcuatum mediale – kazuistika a přehled literatury
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- První zkušenosti s použitím jódových zrn pro lokalizaci nehmatných lézí v mamární chirurgii
- Mukokéla apendixu z perspektivy radiologa
- Fyloidní tumor a jeho malignizace v invazivní duktální karcinom prsu − kazuistika
- Aneuryzma pankreatikoduodenální arkády při syndromu ligamentum arcuatum mediale – kazuistika a přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

