-
Medical journals
- Career
Předoperační CT pro plánování pooperační radioterapie karcinomu prsu
Authors: A. Hlávka 1,2; J. Štuk 1,2,3; K. Odrážka 1,2,5,6,7; J. Vaňásek 1,4; M. Doležel 5,10,11; M. Vítková 1,2; D. Lášková 1,2; Z. Vilasová 1,4; J. Mergancová 8,9,10; L. Elichová 1; O. Hošek 1,2
Authors‘ workplace: Multiscan, s. r. o., Pardubice. 1; Oddělení klinické a radiační onkologie, Pardubická nemocnice, Nemocnice Pardubického kraje, a. s., Pardubice. 2; Fakulta vojenského zdravotnictví v Hradci Králové Univerzity obrany v Brně, Brno. 3; Fakulta zdravotnických studií Univerzity Pardubice. 4; 1. lékařská fakulta Univerzity Karlovy, Praha. 5; 3. lékařská fakulta Univerzity Karlovy, Praha. 6; Institut postgraduálního vzdělávání ve zdravotnictví, Praha. 7; Chirurgická klinika, Pardubická nemocnice, Nemocnice Pardubického kraje, a. s., Pardubice. 8; EUC klinika, a. s., Pardubice. 9; Lékařská fakulta Univerzity Palackého, Olomouc. 10; Onkologická klinika Fakultní nemocnice Olomouc 11
Published in: Rozhl. Chir., 2021, roč. 100, č. 6, s. 278-283.
Category: Original articles
doi: https://doi.org/10.33699/PIS.2021.100.6.278–284Overview
Úvod: Pro cílené navýšení dávky v lůžku tumoru po operaci pro karcinom prsu je vhodné znát přesnou polohu původního tumoru. Proto na našem pracovišti provádíme u pacientek před operací pro karcinom prsu CT vyšetření v ozařovací poloze.
Metody: Pacientky podstoupily v plánovací poloze pro radioterapii předoperačně nativní CT vyšetření, tato data byla využita k fúzi se standardním plánovacím CT při ozařování lůžka tumoru. Hodnotili jsme, zda je tumor na předoperačním CT identifikovatelný. Dále jsme provedli zakreslení jednoho ozařovacího objemu ve standardním plánovacím CT a druhého v CT s provedenou fúzí s předoperačním vyšetřením a tyto objemy jsme porovnali.
Výsledky: Z celkového počtu 554 pacientek jsme byli schopni přesnou polohu tumoru prsu identifikovat ve 463 případech (83,6 %). V souboru 50 náhodně vybraných pacientek došlo k úpravě zakreslení cílového objemu pro plánované navýšení dávky ozáření do lůžka tumoru u 20 pacientek (40 %), ke zmenšení došlo v 9 případech (18 %) a ke zvětšení v 11 případech (22 %).
Závěr: Výsledky naší studie ukázaly možnost využití předoperačního CT v plánovací poloze u pacientek s potvrzeným karcinomem prsu. Tato metoda nám umožňuje přesnější lokalizaci lůžka tumoru a tím přesnější zakreslení cílového objemu pro cílené navýšení dávky. Potvrdili jsme vliv předoperačního CT na velikost zakreslení cílového objemu k ozáření lůžka tumoru.
Klíčová slova:
karcinom prsu – radioterapie − předoperační CT
ÚVOD
Pro diagnostiku karcinomu prsu a určení lokálního rozsahu postižení tumorem se standardně využívá vyšetření mamografické, ultrazvukové (UZ) a pomocí magnetické rezonance (MR) [1]. Nativní vyšetření pomocí výpočetní tomografie (CT) hrudníku mezi tato vyšetření zařazováno obvykle nebývá a je využíváno k vyloučení generalizace choroby [2]. Použití CT však může upřesnit rozsah primárního rozsahu tumoru prsu [3] a zpřesnit vlastní ozáření, zvláště při využití obrazem řízené radioterapie [4]. Při diagnostice karcinomu prsu je u nativního CT udávána senzitivita 72 % a specificita 83 % a je možné ho využít ke zpřesnění nálezu při kontraindikaci provedení MR [5,6]. Velikost tumoru zjistitelná na CT velmi dobře koreluje s velikostí tumoru popsanou patologem [7].
Na našem pracovišti od roku 2017 provádíme, ve spolupráci s naší Multioborovou komisí pro léčbu karcinomu prsu, u pacientek s potvrzeným karcinomem prsu předoperační plánovací CT v ozařovací poloze. Předoperační CT vede ke snížení interpersonální variability v zakreslení klinického cílového objemu (CTV) lůžka tumoru a může vést k posunu jeho lokalizace a i ke změně jeho velikosti [8].
Rozhodli jsme se tento soubor pacientek zpracovat a zhodnotit, zda má tento v literatuře popsaný postup význam pro klinickou praxi našeho pracoviště.
METODY
Soubor pacientek
Do našeho zkoumaného souboru jsme zařadili všech 554 pacientek, které byly indikovány k operačnímu výkonu (parciální i radikální modifikované mastektomii) pro histologicky verifikovaný karcinom prsu cT1-3, cN0-1 M0 a podstoupily na našem pracovišti od 6/2017 do 10/2020 předoperační CT vyšetření v ozařovací poloze. U 78 pacientek bylo popsáno víceložiskové postižení prsu, u dvou pacientek simultánní bilaterální tumor prsu. Z celého souboru podstoupilo 70 pacientek neoadjuvantní léčbu (chemoterapii či hormonoterapii). Věk pacientek byl od 29 do 89 let s mediánem 66 let. Velikost zjištěných tumorů prsu byla v největším rozměru od 1 mm do 65 mm s mediánem 14 mm.
Ze souboru všech pacientek, které podstoupily parciální mastektomii a u nichž jsme byli na CT schopni diferencovat tumor (bez další diskriminace výběru), jsme vybrali každou 8. pacientku řazenou podle data provedení předoperačního CT, celkem 50 pacientek. Věk pacientek byl v tomto náhodně vybraném souboru od 31 do 86 let s mediánem 68 let. Velikost zjištěných tumorů prsu byla v největším rozměru od 3 mm do 35 mm s mediánem 15 mm. Ve 2 případech byly popsány 2 tumory ve stejném kvadrantu prsu.
Podrobnější rozdělení obou souborů pacientek je v Tab. 1.
Table 1. Charakteristika souboru pacientek
Tab. 1: Characteristics of the patients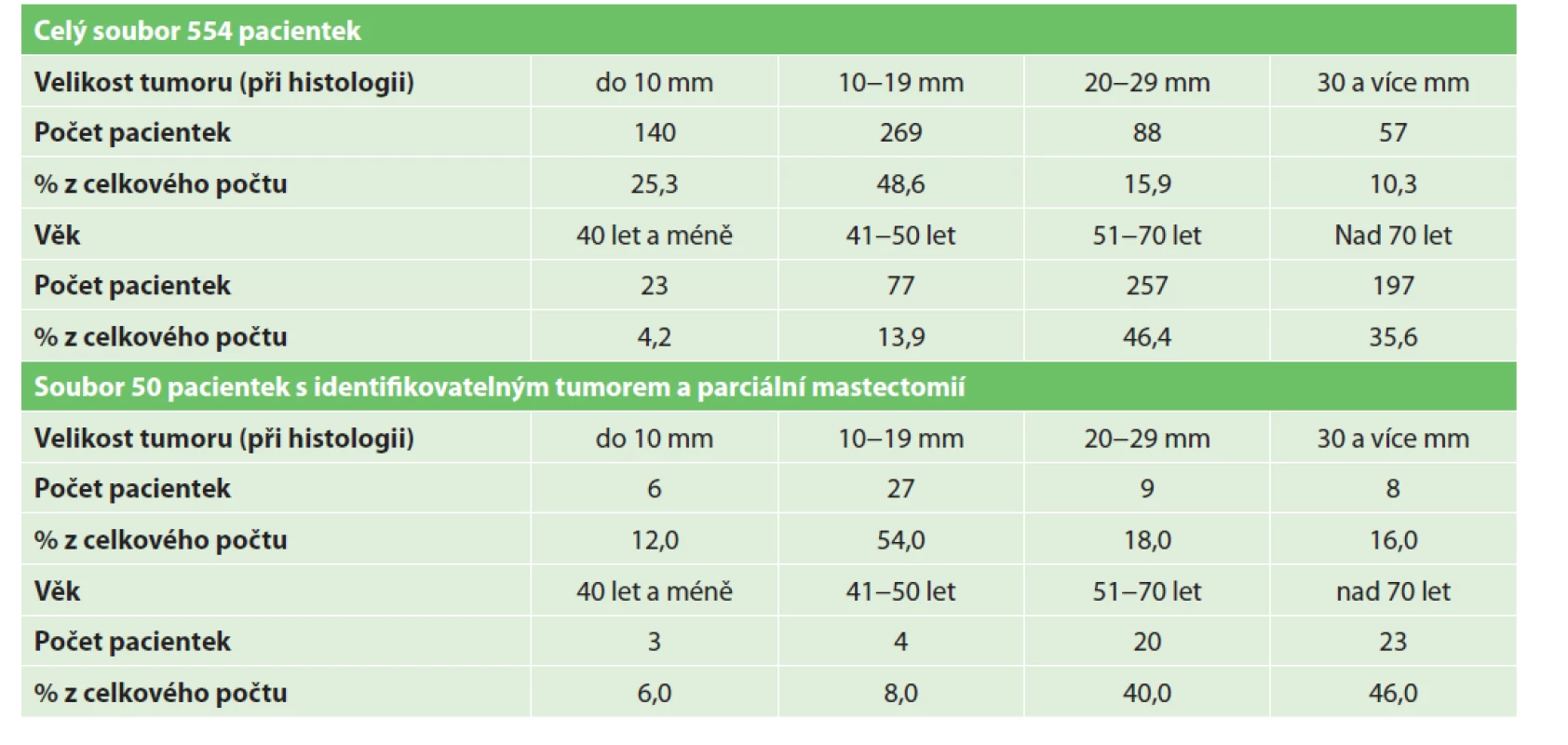
Metodika
Pacientky byly uloženy do stejné polohy, jako je poloha při provádění ozáření prsu. V supinační poloze byla k fixaci použita deska Breastboard (Klarity Medical Products, USA) s podpěrkou paže a zápěstí na ozařované straně. V této poloze bylo provedeno nativní spirální CT vyšetření oblasti hrudníku v klidném neřízeném dýchání za pomocí CT přístroje Somatom Definition AS (Siemens Healthcare, Německo), FOV 50 cm, u objemnějších pacientek FOV 78 cm, šířka scanu 5 mm a posun mezi scany 5 mm a byl vytvořen 3D objem, který byl uložen v databázi.
Tyto CT snímky byly následně fúzovány na oblast sterna a hrudní stěny s CT obrazem získaným při plánování radioterapie po operačním výkonu a tato fúze byla využita k zakreslení druhého klinického cílového objemu při ozáření lůžka tumoru v plánovacím systému Eclipse 8.6 firmy Varian (Varian Medical Systems, USA).
Hodnotili jsme možnost jisté identifikace tumoru prsu na předoperačním CT radiačním onkologem při znalosti operačního nálezu a s peroperačním označením lůžka tumoru kovovými klipy. Tumor na předoperačním CT musel být identifikovatelný (hyperdenzní proti tukové tkáni) v oblasti pooperačních změn a klipů na pooperačním CT a zároveň na pooperačním CT již nesměl být přítomen. Pokud jsme si přesnou lokalizací tumoru nebyli v CT obrazu jisti, tak jsme nález hodnotili jako negativní. Toto hodnocení jsme provedli ve skupinách pacientek rozdělených podle rozměru tumoru popsaného patologem a podle věku pacientek.
Ve skupině 50 pacientek jsme hodnotili změny zakreslení (stejným lékařem) CTV při využití fúze s předoperačním CT proti zakreslení bez znalosti nálezu na předoperačním CT. Bylo tedy zakresleno CTV lůžka tumoru do plánovacího CT (standardní technika), potom byla provedena fúze CT obrazu s předoperačním CT a bylo zakresleno nové CTV využívající fúzovaný obraz. Rozsah CTV byl definován jako oblast viditelných pooperačních změn na CT (jizva, serom) a všech peroperačně zavedených metalických klipů. Bylo hodnoceno, zda došlo ke změně polohy CTV, dále byl vypočten rozdíl velikosti objemu obou zakreslených CTV v cm3.
K hodnocení výsledků jsme použili software MS Excel.
VÝSLEDKY
V celém souboru 554 pacientek bylo po fúzi s plánovacím CT hodnoceno, zda je primární tumor na předoperačním CT jistě diferencovatelný. Nálezy, které nebyly zcela jistě diferencovatelné, jsme označili jako negativní. V celém souboru byl tumor jistě diferencovatelný v 463 případech z 554 CT, to je v 83,6 %.
Dále byl soubor hodnocen při rozdělení podle velikosti největšího rozměru tumoru popsaného patologem po provedeném operačním výkonu. Při velikosti největšího rozměru tumoru do 10 mm byl tumor jistě diferencovatelný na předoperačním CT v 79,3 %, při velikosti od 10 do 19 mm v 84,4 %, při velikosti od 20 do 29 mm v 86,2 % a při velikosti nad 30 mm v 87,7 %.
Dále jsme zjišťovali vztah věku pacientky a diferencovatelnosti tumoru na předoperačním CT. U pacientek do 40 let to bylo v 78,3 %, ve věku 41–50 let to bylo 83,1 %, ve věku 51–70 let 83,3 % a ve věku nad 70 let 84,7 %. V podsouboru 50 pacientek došlo ke změně zakreslení CTV lůžka tumoru, a tedy i posunu jeho přesné polohy ve 20 případech (ve 40 %). Měření, zda došlo k posunu středu CTV a jeho případné velikosti, jsme v našem souboru neprováděli.
Ke zmenšení CTV lůžka tumoru došlo v 9 případech (v 18 %) a naopak ke zvětšení v 11 případech (ve 22 %). U 30 pacientek (60 %) nedošlo při přesné znalosti lokalizace původního tumoru k žádné změně rozsahu zakreslení CTV.
Ve skupině pacientek, u kterých došlo ke zmenšení CTV lůžka tumoru, bylo toto zmenšení v rozmezí 3,2–32,5 cm3, průměrně o 16,3 cm3. Ve skupině pacientek, u kterých došlo ke zvětšení, v rozmezí 1,7–23,3 cm3, průměrně o 8,9 cm3. Jednotlivé hodnoty jsou uvedeny v Grafu 1.
Graph 1. Velikost CTV 1 (bez předoperačního CT) a CTV 2 (s předoperačním CT)
Graph 1: Size of CTV 1 (without preoperative CT) and CTV 2 (with preoperative CT)
Image 1. : a, b – předoperační CT s tumorem (konturován hnědě), c – pooperační CT s metalickými klipy v lůžku tumoru (hnědě kontura původní lokalizace tumoru), d – 3D rekonstrukce oblasti původního tumoru (hnědá) a místa zavedených metalických klipů (fialová)
Fig. 1: a, b – preoperative CT, tumor contoured brown; c – postoperative CT with metallic markers in the postlumpectomy cavity (original tumor site contoured brown); d – 3D reconstruction of the original tumor site (brown) and the locations of metallic markers (purple)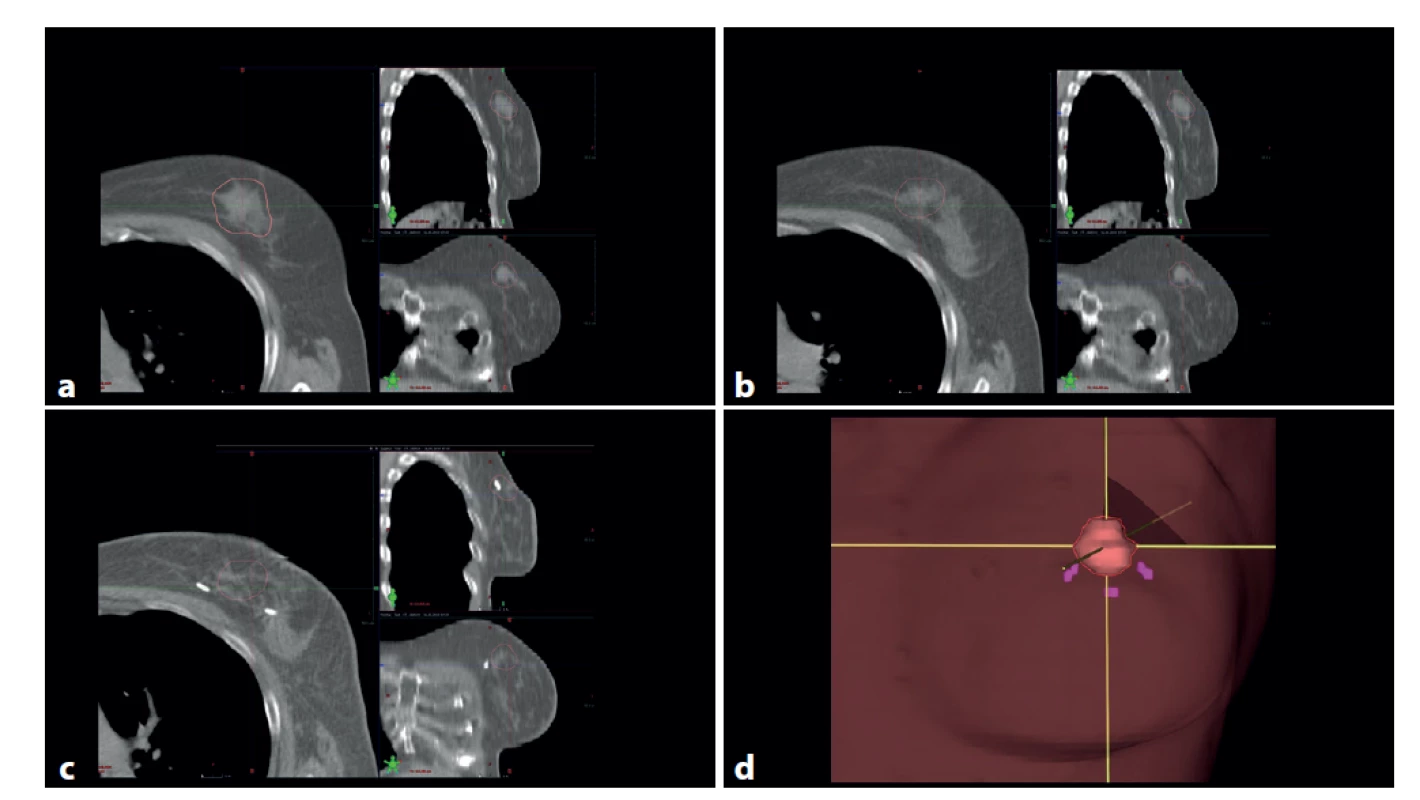
Image 2. : a – předoperační CT s tumorem (konturován hnědě), b – pooperační CT ve stejné lokalizaci, c – pooperační CT v oblasti s metalický klipy v lůžku tumoru (hnědě kontura původní lokalizace tumoru)
Fig. 2: a – preoperative CT, tumor contoured brown; b – postoperative CT in the same location; c – postoperative CT with metallic markers in the postlumpectomy cavity (original tumor site contoured brown)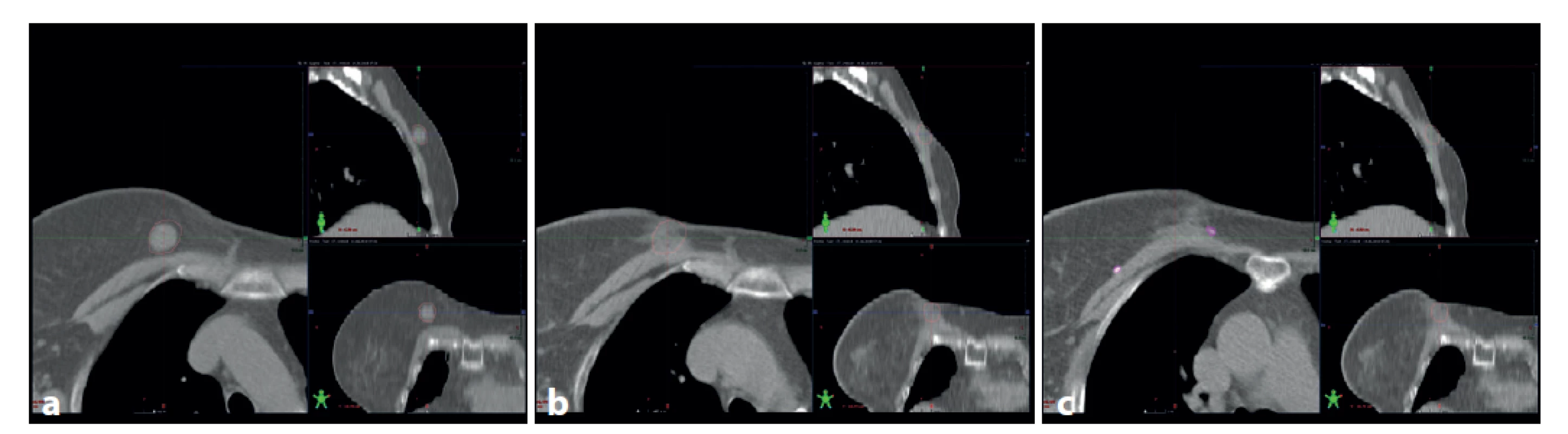
Image 3. : a – kontury CTV1 (oranžová) na plánovacím CT, b – fúze s předoperačním CT a CTV2 (červená) upravený podle nálezu na fúzovaném CT, CTV1 (oranžová), oblast původního tumoru (hnědá)
Fig. 3: a − CTV1 contours (orange) in the planning CT scan; b – fusion with the preoperative CT, CTV2 (red) adapted according to the fused CT findings, CTV1 (orange), original tumor site (brown)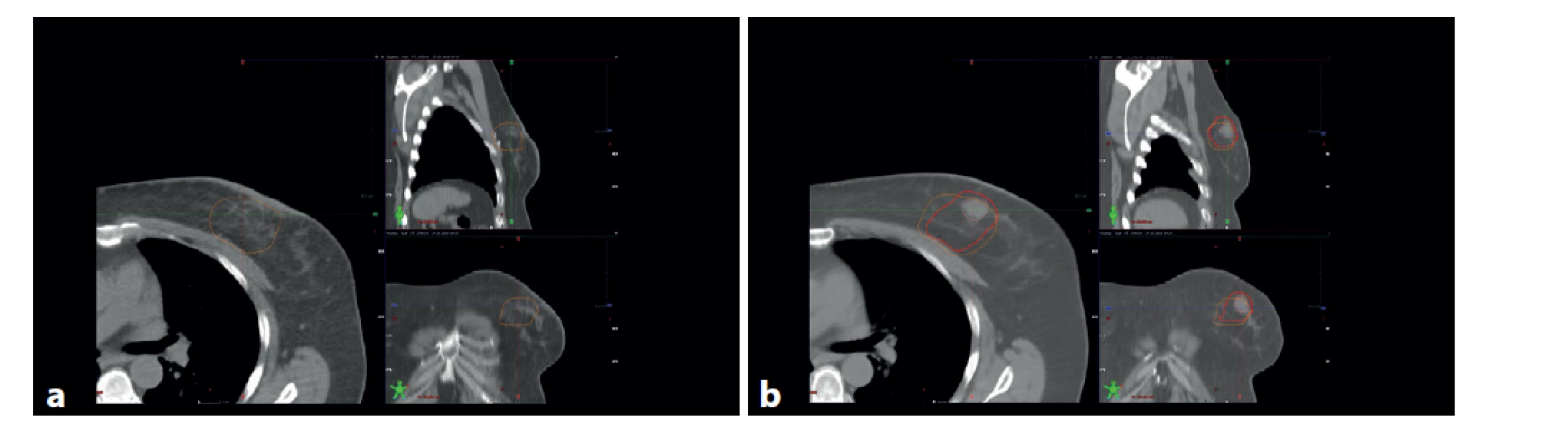
DISKUZE
Přibližně 65–80 % lokálních recidiv po prs šetřícím výkonu a adjuvantní radioterapii se vyskytuje v okolí lokalizace primárního tumoru [9–12]. Studie Lyon Breast Cancer Trial potvrdila, že plánované navýšení dávky (boost) na lůžko tumoru dávkou 10 Gy po ozáření prsu dávkou 50 Gy ve 20 frakcích sníží lokální recidivu ze 4,5 % na 3,6 % [13]. Eskalace dávky ovšem u části pacientek vede k rozvoji fibrózy. Protože ve výsledcích studie EORTC 10801 bylo významné množství pacientek se špatnými kosmetickými nálezy po radioterapii, byla provedena EORTC randomizovaná studie fáze III 22881-10882 „boost vs. no-boost“. Tato studie rozdělila 5318 pacientek do ramene bez boostu či k eskalaci dávky na lůžko tumoru dávkou 16 Gy a 251 pacientek s mikroskopicky inkompletní lumpektomií do ramene s boostem dávkou 10 Gy či 26 Gy. Selhání lokální kontroly v 10 letech bylo 10,2 % (0 Gy boostu) vs. 6,2 % (16 Gy boostu) a 17,5 % (10 Gy boostu) vs. 10,8 % (26 Gy boostu). Výskyt těžké fibrózy v 10 letech byl 1,6 % (0 Gy) vs. 4,4 % (16 Gy) a 3,3 % (10 Gy) vs. 14,4 % (26 Gy). Přestože největší absolutní redukce lokální recidivy byla patrná u pacientek do 40 let, relativní efekt boostu na redukci lokální recidivy nebyl závislý na věku [14]. K boostu bývá využíváno jak zevní ozáření, tak i intersticiální brachyterapie [15].
Větší ozařovaný objem vyšší dávkou může vést k navýšení toxicity a horším kosmetickým výsledkům [16,17]. Proto je naším cílem co nejvíce redukovat cílový objem při prováděném boostu, ale při redukci objemu zajistit stále kompletní pokrytí lůžka tumoru. Současná ozařovací technika využívající IGRT nám umožňuje podat dávku do přesně lokalizovaného cílového objemu [4].
Peroperačně zavedené metalické klipy v počtu vyšším než 1 zpřesňují zakreslení boostu, a staly se tak významným přínosem pro radioterapii [22]. Během pooperačního období a při zevním ozáření celého prsu však může docházet ke změnám polohy klipů, zvláště při změně objemu pooperačního seromu [9,19,23] a proto je vhodné informaci o původní poloze tumoru dále upřesnit pomocí další metody. Zavedené metalické klipy, popis mamografie, nález v operačním protokolu, fyzikální vyšetření prsu a změny pozorované na pooperačním plánovacím CT (serom, jizevnaté změny) by ve spojení s předoperačním CT mohly vést k dalšímu zpřesnění lokalizace cílového objemu.
Předoperační mamografické či MR vyšetření neumožňuje provedení přesné 3D fúze obrazu s pooperačním plánovacím CT. Předoperační CT provedené v plánovací (ozařovací) supinační poloze za využití fixačních pomůcek provedení této fúze umožňuje a vede ke snížení interpersonálních rozdílů v zakreslení CTV. Provedení předoperačního CT může vést dle literatury i k mírnému zmenšení klinického cílového objemu [8], ale i jeho zvětšení [24]. Lepších výsledků ve zmenšení objemu CTV lůžka tumoru je dosahováno při pronační poloze (na břiše) a fúzi s předoperační magnetickou rezonancí [25].
V našem souboru došlo ke zmenšení cílového objemu v 18 % zkoumaných případů, naopak ke zvětšení objemu ve 22 % případů, velikost zmenšení dosáhla v průměru větších hodnot než v případě zvětšení objemu. Rozdíly v literatuře udávaných velikostí cílových objemů při ozařování lůžka tumoru (6,4–189,3 cm3, mean 10,1–48,7 cm3) i jejich změn mohou být dány rozdílnými operačními technikami, jinými zvyklostmi při umisťování klipů chirurgy a rozdíly v definování cílových objemů na jednotlivých pracovištích radiační onkologie. Naše výsledky potvrzují, že využití fúze s předoperačním CT může vést ke zmenšení i zvětšení velikosti cílových objemů při ozařování lůžka tumoru po prs šetřícím operačním výkonu pro karcinom prsu [8,24,26]. Výsledky ukazují, že využití více metod může vést k přesnějšímu určení lokalizace lůžka tumoru a tím snížení rizika geografické chyby ozáření boostu. Velikost posunu středu cílového objemu jsme v našem souboru neměřili, ale dle popsaných studií nebyla prokázána jeho signifikantní statistická významnost [24,25].
ZÁVĚR
Výsledky naší studie ukázaly využitelnost zavedení předoperačního CT v plánovací poloze u pacientek s potvrzeným karcinomem prsu. Tumor byl na našich nativních předoperačních CT identifikovatelný ve více než 80 % případů. K úpravě rozsahu CTV došlo v našem souboru u 40 % pacientek. Prokázali jsme, že tato metoda nám umožňuje přesnější lokalizaci lůžka tumoru a tím snížení rizika geografické chyby při jeho ozáření a má vliv na velikost zakresleného cílového objemu.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Aleš Hlávka, Ph.D.
Ozařovny Multiscan, s. r. o.
Kyjevská 44
530 02 Pardubice
e-mail: hlavka@multiscan.cz
ORCID: 0000-0002-5986-196X
Sources
1. Wang L. Early diagnosis of breast cancer. Sensors (Basel) 2017;17 : 1572. doi:10.3390/s17071572.
2. Taira N, Ohsumi S, Takabatake D, et al. Contrast - enhanced CT evaluation of clinically and mammographically occult multiple breast tumors in women with unilateral early breast cancer. Jpn J Clin Oncol. 2008;38 : 419–25. doi:10.1093/jjco/hyn040.
3. Glick SJ. Breast CT. Annu Rev Biomed Eng. 2007;9 : 501–26. doi:10.1146/annurev.bioeng. 9.060906.151924.
4. Hlavka A, Vanasek J, Odrazka K, et al. Tumor bed radiotherapy in women following breast conserving surgery for breast cancer-safety margin with/without image guidance. Oncol Lett. 2018;15 : 6009 – 6014. doi:10.3892/ol.2018.8083.
5. Nakahara H, Namba K, Wakamatsu H, et al. Extension of breast cancer: comparison of CT and MRI. Radiat Med. 2002;20 : 17–23.
6. Uematsu T. Comparison of magnetic resonance imaging and multidetector computed tomography for evaluating intraductal tumor extension of breast cancer. Jpn J Radiol. 2010;28 : 563–70. doi:10.1007/s11604-010-0474-5.
7. Ahn SJ, Kim YS, Kim EY, et al. The value of chest CT for prediction of breast tumor size: comparison with pathology measurement. World J Surg Oncol. 2013;11 : 130. doi:10.1186/1477-7819-11 - 130.
8. Boersma LJ, Janssen T, Elkhuizen PHM, et al. Reducing interobserver variation of boost-CTV delineation in breast conserving radiation therapy using a pre-operative CT and delineation guidelines. Radiother Oncol. 2012;103 : 178–82. doi:10.1016/j.radonc.2011.12.021.
9. Cheng JC-H, Chen CM, Liu MC, et al. Locoregional failure of postmastectomy patients with 1-3 positive axillary lymph nodes without adjuvant radiotherapy. Int J Radiat Oncol Biol Phys. 2002;52 : 980 – 988.
10. Fowble B, Solin LJ, Schultz DJ, et al. Breast recurrence following conservative surgery and radiation: patterns of failure, prognosis, and pathologic findings from mastectomy specimens with implications for treatment. Int J Radiat Oncol Biol Phys. 1990;19 : 833–842. doi:10.1016/0360-3016(90)90002-2.
11. Haffty BG, Fischer D, Beinfield M, et al. Prognosis following local recurrence in the conservatively treated breast cancer patient. Int J Radiat Oncol Biol Phys. 1991;21 : 293–298. doi:10.1016/0360 - 3016(91)90774-x.
12. Kurtz JM, Amalric R, Brandone H, et al. Local recurrence after breast-conserving surgery and radiotherapy. Frequency, time course, and prognosis. Cancer 1989;63 : 1912–1917. doi:10.1002/1097 - 0142(19890515)63 : 10<1912:aid-cncr2820631007> 3.0.co;2-y.
13. Romestaing P, Lehingue Y, Carrie C, et al. Role of a 10-Gy boost in the conservative treatment of early breast cancer: results of a randomized clinical trial in Lyon, France. J Clin Oncol. 1997;15 : 963–968. doi:10.1200/JCO.1997.15.3.963.
14. Antonini N, Jones H, Horiot JC, et al. Effect of age and radiation dose on local control after breast conserving treatment: EORTC trial 22881-10882. Radiother Oncol. 2007;82 : 265–271. doi:10.1016/j.radonc. 2006.09.014.
15. Dolezel M, Stastny K, Odrazka K, et al. Perioperative interstitial CT-based brachytherapy boost in breast cancer patients with breast conservation after neoadjuvant chemotherapy. Neoplasma 2012;59 : 494–499. doi:10.4149/ neo_2012_063.
16. Vrieling C, Collette L, Fourquet A, et al. The influence of patient, tumor and treatment factors on the cosmetic results after breast-conserving therapy in the EORTC “boost vs. no boost” trial. EORTC Radiotherapy and Breast Cancer Cooperative Groups. Radiother Oncol. 2000;55 : 219 – 232. doi: 10.1016/s0167-8140(00)00210 - 3.
17. Vrieling C, Collette L, Fourquet A, et al. The influence of the boost in breast-conserving therapy on cosmetic outcome in the EORTC “boost versus no boost” trial. EORTC Radiotherapy and Breast Cancer Cooperative Groups. European Organization for Research and Treatment of Cancer. Int J Radiat Oncol Biol Phys. 1999;45 : 677–685. doi:10.1016/s0360 - 3016(99)00211-4.
18. Struikmans H, Wárlám-Rodenhuis C, Stam T, et al. Interobserver variability of clinical target volume delineation of glandular breast tissue and of boost volume in tangential breast irradiation. Radiother Oncol. 2005;76 : 293–299. doi:10.1016/j. radonc.2005.03.029.
19. Coles CE, Wilson CB, Cumming J, et al. Titanium clip placement to allow accurate tumour bed localisation following breast conserving surgery: audit on behalf of the IMPORT Trial Management Group. Eur J Surg Oncol. 2009;35 : 578–582. doi:10.1016/j.ejso.2008.09.005.
20. Hurkmans C, Admiraal M, van der Sangen M, et al. Significance of breast boost volume changes during radiotherapy in relation to current clinical interobserver variations. Radiother Oncol. 2009;90 : 60 – 65. doi:10.1016/j.radonc.2007.12.001.
21. van Mourik AM, Elkhuizen PHM, Minkema D, et al. Multiinstitutional study on target volume delineation variation in breast radiotherapy in the presence of guidelines. Radiother Oncol. 2010;94 : 286–291. doi:10.1016/j.radonc.2010.01.009.
22. Kirova YM, Fournier-Bidoz N, Servois V, et al. How to boost the breast tumor bed? A multidisciplinary approach in eight steps. Int J Radiat Oncol Biol Phys. 2008;72 : 494–500. doi:10.1016/j. ijrobp.2007.12.059.
23. Oh KS, Kong F-M, Griffith KA, et al. Planning the breast tumor bed boost: changes in the excision cavity volume and surgical scar location after breast-conserving surgery and whole-breast irradiation. Int J Radiat Oncol Biol Phys. 2006;66 : 680–686. doi:10.1016/j.ijrobp.2006.04.042.
24. den Hartogh MD, Philippens MEP, van Dam IE, et al. Post-lumpectomy CT-guided tumor bed delineation for breast boost and partial breast irradiation: Can additional pre - and postoperative imaging reduce interobserver variability? Oncology Letters 2015;10 : 2795–801. doi:10.3892/ol.2015.3697.
25. Dong Y, Liu Y, Chen J, et al. Comparison of postoperative CT - and preoperative MRI-based breast tumor bed contours in prone position for radiotherapy after breast-conserving surgery. Eur Radiol. 2021 Jan;31(1):345−355. doi:10.1007/ s00330-020-07085-0.
26. den Hartogh MD, Philippens ME, van Dam IE, et al. MRI and CT imaging for preoperative target volume delineation in breast-conserving therapy. Radiat Oncol. 2014;9 : 63. doi:10.1186/1748-717X-9-63.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2021 Issue 6-
All articles in this issue
- Chirurgie prsu – důležitá součást onkochirurgie
- První zkušenosti s použitím jódových zrn pro lokalizaci nehmatných lézí v mamární chirurgii
- Mukokéla apendixu z perspektivy radiologa
- Význam chirurgické biopsie sentinelové uzliny u pacientek s karcinomem prsu po neoadjuvantní chemoterapii: prospektivní multicentrická studie
- Komentář k článku: Žatecký J., et al. Význam chirurgické biopsie sentinelové uzliny u pacientek s karcinomem prsu po neoadjuvantní chemoterapii: prospektivní multicentrická studie
- Předoperační CT pro plánování pooperační radioterapie karcinomu prsu
- Komentář k článku A. Hlávky a kol. Předoperační CT pro plánování pooperační radioterapie karcinomu prsu
- Úloha radiologa při neoadjuvantní systémové terapii karcinomu prsu
- Fyloidní tumor a jeho malignizace v invazivní duktální karcinom prsu − kazuistika
- Aneuryzma pankreatikoduodenální arkády při syndromu ligamentum arcuatum mediale – kazuistika a přehled literatury
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- První zkušenosti s použitím jódových zrn pro lokalizaci nehmatných lézí v mamární chirurgii
- Mukokéla apendixu z perspektivy radiologa
- Fyloidní tumor a jeho malignizace v invazivní duktální karcinom prsu − kazuistika
- Aneuryzma pankreatikoduodenální arkády při syndromu ligamentum arcuatum mediale – kazuistika a přehled literatury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

