-
Medical journals
- Career
Kombinace ERAS a miniinvazivní chirurgie v léčbě karcinomu rekta – krátkodobé výsledky
Authors: P. Kocian 1; F. Pazdírek 1; M. Vjaclovský 1; M. Bockova 1; P. Přikryl 2; T. Vymazal 2; A. Whitley 3,4; J. Hoch 1
Authors‘ workplace: Chirurgická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol, Praha 1; Klinika anesteziologie, resuscitace a intenzivní medicíny 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice, Motol, Praha 2; Chirurgická klinika 3. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Královské Vinohrady, Praha 3; Ústav anatomie 2. lékařské fakulty Univerzity Karlovy, Praha 4
Published in: Rozhl. Chir., 2020, roč. 99, č. 12, s. 539-547.
Category: Original articles
Overview
Úvod: Cílem studie bylo zhodnotit krátkodobé výsledky chirurgické léčby pacientů s karcinomem rekta operovaných miniinvazivně s perioperační péčí vedenou dle ERAS (enhanced recovery after surgery) protokolu.
Metody: Retrospektivně byly analyzovány údaje o léčbě pacientů s karcinomem rekta. Tyto údaje byly získány z prospektivně vedené databáze všech kolorektálních výkonů provedených na našem pracovišti od ledna 2015 do dubna 2020. ERAS protokol byl zaveden do klinické praxe v dubnu 2016 a miniinvazivní operace konečníku v květnu 2016. Do studie byli zařazeni všichni pacienti s karcinomem rekta, kteří podstoupili resekci nebo amputaci konečníku miniinvazivně s perioperační péčí vedenou dle ERAS protokolu (ERAS skupina) nebo otevřeně s perioperační péčí vedenou standardním způsobem (kontrolní skupina). Sledovaná data zahrnovala základní charakteristiky pacientů, údaje o operačních výkonech, parametry pooperačního zotavení, 30denní pooperační morbiditu, délku pooperační hospitalizace a 30denní rehospitalizaci.
Výsledky: Do studie bylo zařazeno celkem 110 pacientů: 67 pacientů do ERAS skupiny a 43 pacientů do kontrolní skupiny. Ve skupině ERAS bylo 47 pacientů operováno roboticky a 20 pacientů laparoskopicky. Pacienti v ERAS skupině prokazovali významné zlepšení všech sledovaných klinických i laboratorních parametrů pooperačního zotavení kromě nevolnosti a zvracení a ve srovnání s kontrolní skupinou u nich došlo k významnému poklesu incidence paralytického ileu (20,9 % vs. 3 %) a zkrácení délky hospitalizace (13 dní vs. 9 dní). Celková 30denní pooperační morbidita a počet rehospitalizací se mezi oběma skupinami nelišily.
Závěr: Zavedení ERAS protokolu v kombinaci s miniinvazivním přístupem vede ke zlepšení krátkodobých výsledků léčby karcinomu rekta.
Klíčová slova:
karcinom rekta − laparoskopie − robotická chirurgie − multimodální perioperační péče − krátkodobé výsledky
Úvod
Karcinom rekta patří celosvětově k nejčastějším nádorovým onemocněním s nejvyšším výskytem ve východní Evropě [1]. Díky vysoké incidenci a záchytu v pokročilých stadiích významně zatěžuje populaci morbiditou a mortalitou. Léčba karcinomu rekta prošla v posledních desetiletích řadou změn, které vedly ke snížení počtu lokálních recidiv a ke zlepšenému přežívání nemocných [2]. Posun k méně invazivním technikám a pokroky v perioperační péči vedly k významnému zlepšení také krátkodobých výsledků. Snížení invazivity chirurgické léčby a zavedení protokolů multimodální perioperační péče jednoznačně přispěly k rychlejší rekonvalescenci, snížení pooperační morbidity a zkrácení délky hospitalizace [3−6]. Průkopníkem v tomto směru se stal prof. Henrik Kehlet, který v 90. letech minulého století zavedl první fast-track protokol. Tento protokol obsahoval zpočátku pouze tři doporučené postupy, kterými byly epidurální analgezie, časný perorální příjem a časná mobilizace. Později se tento protokol rozšířil o soubor dalších postupů předoperační, intraoperační a pooperační péče. V roce 2001 byla založena pracovní skupina ERAS a o čtyři roky později vytvořen první ERAS protokol. Doporučené postupy pro plánované operace konečníku byly publikovány společnostmi ERAS, ESPEN (European Society for Parenteral and Enteral Nutrition) a IASMEN (International Association for Surgical Metabolism and Nutrition) v roce 2013 [7]. Součástí těchto postupů se stal kromě jiného i laparoskopický operační přístup. S ohledem na lepší pooperační průběh a onkologickou bezpečnost se miniinvazivní techniky v léčbě karcinomu rekta staly rovnocennou a mnohými i upřednostňovanou alternativou otevřené operace [6]. I přes tuto skutečnost ale otevřené operace zcela nenahradily a pravděpodobně ani nenahradí. V současné době se penetrace laparoskopických výkonů v kolorektální chirurgii pohybuje ve vyspělých zemích okolo 40−60 % [8−11]. V České republice se podle výsledků průřezových studií provádí laparoskopicky nejvýše 15 % kolorektálních operací [12,13]. Robotické systémy jsou v České republice v kolorektální chirurgii využívány od roku 2005. Za uplynulých 15 let bylo v 11 centrech robotické chirurgie operováno celkem 1059 pacientů s karcinomem rekta [14]. Vedle relativně nízké penetrace miniinvazivních výkonů existují značné rezervy i ve vedení perioperační péče. Z výsledků národní ankety monitorující úroveň správné klinické praxe v perioperační péči u plánovaných střevních operací vyplývá, že na většině chirurgických pracovišť v České republice nejsou doporučené postupy dodržovány a perioperační péče není vedena v souladu s EBM (evidence-based medicine) [13].
Cílem studie je zhodnotit efekt ERAS protokolu v kombinaci s miniinvazivním přístupem na krátkodobé výsledky chirurgické léčby pacientů s karcinomem rekta.
Metody
Retrospektivně byly analyzovány údaje o léčbě pacientů s karcinomem rekta. Tyto údaje byly získány z prospektivně vedené databáze všech kolorektálních výkonů provedených na Chirurgické klinice 2. LF UK a FNM od ledna 2015 do dubna 2020. ERAS protokol byl zaveden do klinické praxe v dubnu 2016, laparoskopické operace rekta v květnu 2016 a robotické operace v červenci 2018. Sledovaná data zahrnovala základní charakteristiky pacientů (věk, pohlaví, ASA skóre, BMI, malnutrice, kortikoterapie, TNM stadium, absolvování neoadjuvantní chemoradioterapie); údaje o operačních výkonech (typ operace, založení stomie, délka operace, krevní ztráta); parametry pooperačního zotavení (pooperační nevolnost a zvracení, mobilizace pacientů první pooperační den, tolerance dietní zátěže, intravenózní příjem tekutin v den operace, podání parenterální výživy, laboratorní zánětlivé parametry); 30denní pooperační morbiditu (celková dle Clavien-Dindo, vybrané chirurgické a nechirurgické komplikace); délku pooperační hospitalizace a 30denní rehospitalizaci. Paralytický ileus byl definován přítomností dvou a více z následujících pěti kritérií zjištěných čtvrtý pooperační den a později: nauzea nebo zvracení, intolerance dietní zátěže, distenze břicha, absence větrů a stolice, radiologický průkaz ileózního stavu. Definice paralytického ileu byla převzata z přehledového článku Vathera a kol. publikovaného v roce 2013 v časopise Journal of Gastrointestinal Surgery [15]. Kritéria pro propuštění pacienta zahrnovala obnovenou pasáž s přiměřeným perorálním příjmem; spontánní diurézu; nepřítomnost břišního drénu; nepřítomnost ranné komplikace event. její zvládnutí ambulantně; zvládnutí nácviku péče o stomii (sebeobsluha, příbuzný, zařízení následné péče). Cílem bylo splnění těchto kritérií do devátého pooperačního dne. Důvody prolongované hospitalizace byly zaznamenány.
Sestava pacientů
Do studie byli zvažováni všichni pacienti, kteří podstoupili plánovanou operaci konečníku bez ohledu na použitou techniku (otevřeně, laparoskopicky, roboticky) a způsob vedení perioperační péče (standardní, ERAS) v období od ledna 2015 do dubna 2020. Do sestavy nebyli zařazeni pacienti s multiviscerální resekcí, transanální resekcí a neresekčním výkonem. Z počátečního počtu 375 pacientů bylo identifikováno 244 pacientů, kteří podstoupili resekci nebo amputaci konečníku s odstraněním mezorekta. Z této sestavy bylo následně vyřazeno 92 pacientů, kteří byli operováni otevřeně s perioperační péčí vedenou dle ERAS protokolu, a dále 42 pacientů z důvodů organizačních, non-compliance, pooperační péče na anesteziologicko-resuscitační klinice a benigního onemocnění konečníku. Do studie bylo definitivně zařazeno 110 pacientů s karcinomem konečníku. Dle použité operační techniky a způsobu vedení perioperační péče byli tito pacienti rozděleni do dvou skupin: skupiny ERAS (miniinvazivní operace, ERAS péče, 67 pacientů) a skupiny kontrolní (otevřené operace, standardní péče, 43 pacientů) (Schéma 1). Údaje výsledných skupin byly podrobeny retrospektivní srovnávací analýze. Studie byla schválena etickou komisí FN Motol (jednací číslo EK-760/18).
Schéma 1: Selekce pacientů
Schema 1: Patient selection flow chart
ERAS protokol
ERAS protokol zahrnoval celkem 16 bodů (Tab. 1). Podrobný popis protokolu je uveden v naší předchozí studii [16]. Zde jsou popsány jen jeho hlavní body. Při prvním kontaktu s pacientem bylo indikujícím chirurgem provedeno zhodnocení stavu výživy. Nutriční screening zahrnoval BMI, laboratorní vyšetření celkové bílkoviny a albuminu, údaje o váhovém úbytku a omezení perorálního příjmu. U pacientů s nízkým rizikem malnutrice byly indikovány nutriční přípravky ve formě sippingu podávané dva týdny před plánovanou operací. Při zjištění závažné malnutrice byl pacient referován na interní pracoviště k podrobnému vyšetření a nutriční přípravě z interního lůžka. Bylo omezeno lačnění a pacientům byl podáván sacharidový nápoj dvě hodiny před zahájením anestezie. Ortográdní příprava střeva společně s intravenózním podáním antibiotik byla indikována u všech pacientů. Výjimkou byli pacienti se stenozujícími nádory, u kterých byla provedena retrográdní příprava střeva očistným klyzmatem. Intraoperačně byli pacienti aktivně zahříváni a podání tekutin bylo vedeno formou cílené tekutinové terapie pomocí monitoru LiDCORapidTM (lithium dilution cardiac output). Před úvodem do anestezie byly zaznamenány výchozí hemodynamické parametry – střední arteriální tlak (MAP − mean arterial pressure), srdeční frekvence (HR − heart rate), tepový objem (SV − stroke volume), variace tepového objemu (SVV − stroke volume variation) a srdeční výdej (CO − cardiac output). Tyto parametry byly během výkonu každých 15 minut kontrolovány a průběžně zaznamenávány. Při oběhové nestabilitě (MAP <65 mmHg, SVV >15 %, MAP <70 % výchozí hodnoty) bylo kontinuální podání krystaloidů korigováno aplikací vazopresorů či tekutinovým bolusem koloidu. Protokol hemodynamické monitorace byl veden anesteziologem. Podrobnější popis tekutinového managementu přesahuje rámec tohoto sdělení. Epidurální analgezie byla indikována pouze u laparotomických výkonů. Profylaktické podání antiemetik bylo indikováno podle míry rizika pooperační nevolnosti a zvracení určeného na základě stanovení Apfel skóre. U pacientů s nízkým rizikem antiemetika profylakticky podávána nebyla. U pacientů se středním a vysokým rizikem byla antiemetika podávána v kombinaci (ondansetron, dexametazon,metoclopramide). Časně byl obnoven perorální příjem s cílem plné dietní zátěže čtvrtý pooperační den. Tři až čtyři hodiny po operaci pacienti obdrželi čaj. Dle tolerance večer v den operace sipping. První a druhý pooperační den byla indikována tekutá dieta, třetí den kašovitá strava a čtvrtý den standardní dieta. Pacienti byli první pooperační den mobilizováni do chůze. Pohybová rehabilitace probíhala třikrát denně. Dvakrát se zdravotní sestrou a jedenkrát s fyzioterapeutem. Cílem pohybové rehabilitace pro první pooperační den bylo zvládnutí chůze kolem lůžka, pro druhý pooperační den zvládnutí chůze po chodbě. Multimodální analgezie byla zajištěna intravenózně podávanými neopioidními analgetiky (metamizol, paracetamol či diklofenak). Opioidní analgetika byla užívána jako tzv. rescue medikace při nedostatečné kontrole bolesti neopiodními analgetiky.
Table 1. Adherence k ERAS protokolu
Tab. 1: Adherence to the ERAS protocol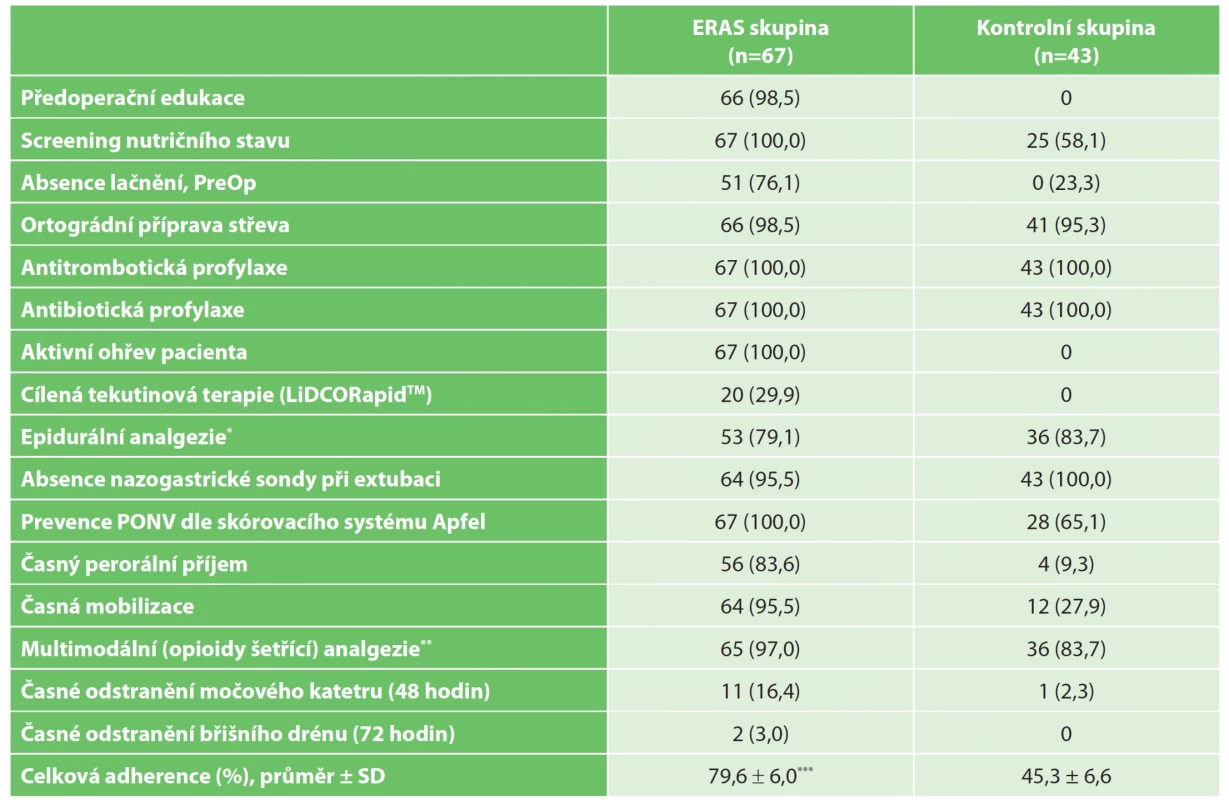
n (%); SD − směrodatná odchylka; PONV − pooperační nevolnost a zvracení;
* Epidurální analgezie byla indikována pouze u laparotomických výkonů. V případě miniinvazivního přístupu byl tento bod splněn, pokud byl pacient bez epidurální analgezie.
** Tento bod protokolu byl splněn, pokud pacientovi nebyla podána víc než jedna dávka opioidního analgetika denně.
*** p<0,001Statistická analýza
Data byla analyzována pomocí programu R (R 4.0.0 GUI 1.71 Catalina build (7827), R Foundation for Statistical Computing, 2016). V případě kategorických proměnných dat byl použit Fisherův test. Při analýze numerických proměnných dat byl použit Studentův t-test. Za statisticky významný byl považován rozdíl na hladině p<0,05.
Výsledky
Celkem bylo hodnoceno 110 pacientů. Šedesát sedm pacientů bylo operováno miniinvazivně s perioperační péčí vedenou dle ERAS protokolu (ERAS skupina), čtyřicet tři pacientů otevřeně se standardní perioperační péčí (kontrolní skupina). Čtyřicet sedm výkonů bylo provedeno roboticky, 20 výkonů laparoskopicky.
Adherence k ERAS protokolu
Celková průměrná adherence k ERAS protokolu byla 79,6 %. Plné adherence bylo dosaženo v pěti bodech protokolu: nutriční screening, antitrombotická profylaxe, antibiotická profylaxe, aktivní ohřev pacienta a prevence pooperační nevolnosti a zvracení. Nejnižší adherence byla k časnému odstranění invazí a k cílené tekutinové terapii. Ve všech ostatních bodech protokolu bylo dosaženo adherence přes 75 %. Srovnání perioperační péče před a po implementaci ERAS protokolu je uvedeno v Tab. 1.
Charakteristika pacientů
Obě skupiny pacientů byly v základních charakteristikách srovnatelné. Statisticky významný rozdíl byl prokázán jen u malnutrice. Malnutrice byla častěji zjištěna v kontrolní skupině pacientů (20,9 % vs. 1,5 %; p≤0,001). Charakteristika pacientů je uvedena v Tab. 2.
Table 2. Charakteristika pacientů
Tab. 2: Patient characteristics
n (%); NeoCRT − neoadjuvantní chemoradioterapie; SD − směrodatná odchylka Charakteristika provedených operací
Perioperační parametry jsou uvedeny v Tab. 3. Miniinvazivní operace ve srovnání s otevřenými výkony trvaly významně déle a byly spojeny s menší krevní ztrátou (199 minut vs. 133 minut, 74 ml vs. 261 ml; p≤0.001). Typy provedených operací a počet založených stomií byly u obou skupin pacientů srovnatelné.
Table 3. Charakteristika provedených operací
Tab. 3: Surgical details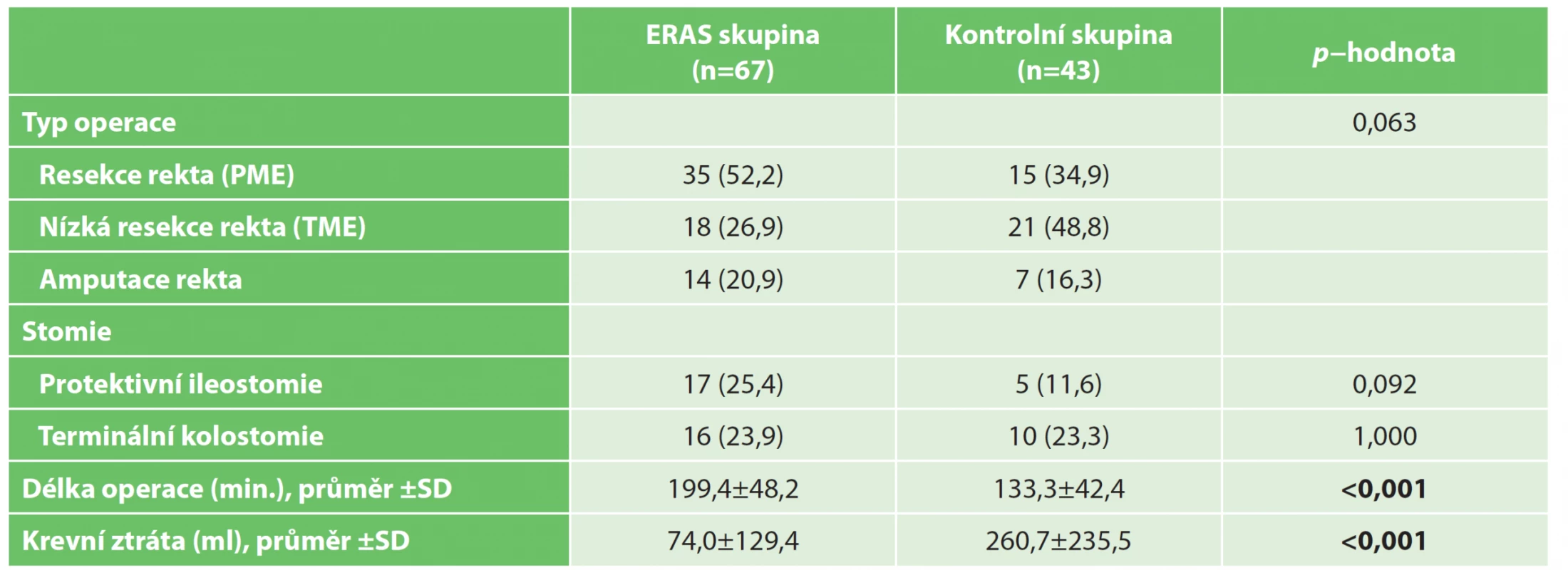
n (%); PME − parciální mezorektální excize; SD − směrodatná odchylka; TME − totální mezorektální excize Table 4. Perioperační parametry
Tab. 4: Perioperative parameters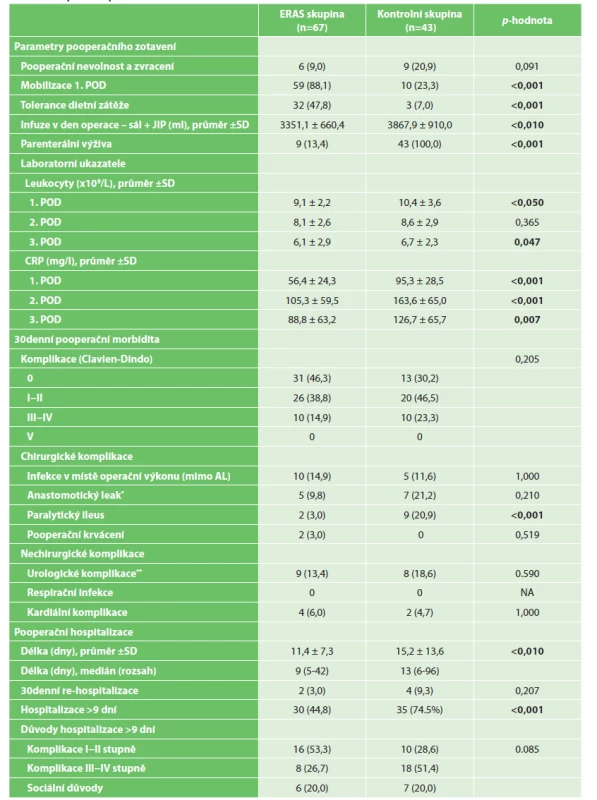
n (%); AL − anastomotický leak; POD − pooperační den; SD − směrodatná odchylka; * Anastomotický leak byl hodnocen u všech pacientů, kteří podstoupili resekční výkon s vytvořením anastomózy (51 pacientů v ERAS skupině a 33 pacientů v kontrolní skupině); ** Urologické komplikace zahrnovaly uroinfekci, močovou retenci a hematurii. Parametry pooperačního zotavení
V ERAS skupině došlo ke statisticky významnému zlepšení všech sledovaných parametrů kromě pooperační nevolnosti a zvracení a počtu leukocytů v krvi druhý pooperační den. Četnost pooperační nevolnosti a zvracení byla snížena o 11,9 % a počet leukocytů byl druhý pooperační den o 0,5 × 109/l nižší ve srovnání s kontrolní skupinou. U obou parametrů nebyl ale tento rozdíl statisticky významný (Tab. 4).
Pooperační morbidita
Celková 30denní pooperační morbidita byla v obou skupinách srovnatelná. V ERAS skupině došlo ale k významnému snížení výskytu paralytického ileu (20,9 % vs. 3,0 %; p≤0,010) (Tab. 4).
Pooperační hospitalizace
Ve skupině pacientů ERAS došlo ve srovnání s kontrolní skupinou ke zkrácení průměrné délky pooperační hospitalizace o 3,8 dne (p≤0,010) bez navýšení počtu rehospitalizací (3,0 % vs. 9,3 %) (Tab. 4). Pooperační hospitalizace delší než 9 dní byla zaznamenána u 30 pacientů (45 %) v ERAS skupině. Důvody prolongované hospitalizace jsou uvedeny v Tab. 4.
Diskuze
V této retrospektivní studii byla analyzována data dvou skupin pacientů s karcinomem rekta, z nichž jedna byla operována miniinvazivně s perioperační péčí poskytovanou na základě vytvořeného ERAS protokolu a druhá otevřeně s perioperační péčí poskytovanou doposud zvyklým způsobem. Obě skupiny pacientů byly v základních charakteristikách srovnatelné kromě výskytu malnutrice, délky operace a krevní ztráty. Snížení počtu pacientů s malnutricí ve skupině ERAS bylo způsobeno zavedením předoperačního nutričního screeningu a perioperační nutriční podporou. Oba tyto postupy se staly integrální součástí ERAS protokolu. Miniinvazivní operace ve srovnání s otevřenými výkony byly spojeny s menší krevní ztrátou a trvaly významně déle. Implementace ERAS protokolu v kombinaci s laparoskopickým/robotickým přístupem vedla ke zlepšení všech sledovaných klinických i laboratorních parametrů pooperačního zotavení kromě nevolnosti a zvracení. Frekvence pooperační nevolnosti a zvracení poklesla v ERAS skupině téměř o 12 % ve srovnání s kontrolní skupinou, nicméně tento rozdíl nebyl statisticky významný. U pacientů v ERAS skupině došlo k významnému snížení výskytu paralytického ileu a zkrácení délky hospitalizace o 4 dny bez navýšení počtu rehospitalizací.
Kolorektální chirurgie výrazně zasahuje do integrity organismu, narušuje homeostázu a vede k vysoké prozánětlivé reakci. Principem ERAS protokolu je pomocí konkrétních postupů v perioperační péči minimalizovat stresovou a zánětlivou reakci a tím dosáhnout „optimálního zotavení“. Efekt ERAS protokolu je dán jeho komplexností. Jednotlivé postupy na sebe navzájem navazují a synergicky se pozitivně ovlivňují. Stanovit, který postup v protokolu je ten nejdůležitější, je proto obtížné. Z pohledu patofyziologie perioperačního stresu je ale zřejmé, že zásadní roli hrají šetrná operační technika a miniinvazivní přístup [17]. Míru zánětu lze laboratorně objektivizovat počtem leukocytů a hodnotou CRP. Počet leukocytů dosahuje vrcholu za 24 hodin od operace, hodnota CRP v odstupu 48 hodin. S tímto korelují i výsledky naší studie. Pacienti v ERAS skupině vykazovali ve srovnání s kontrolní skupinou významně nižší zánětlivou odpověď objektivizovanou nižším počtem leukocytů a hodnotou CRP, měřenými první tři pooperační dny. V obou skupinách byla zachována dynamika těchto markerů, tzn. nárůst počtu leukocytů první pooperační den s následným poklesem v dalším průběhu; nárůst CRP s dosažením vrcholu druhý pooperační den s následným poklesem v dalších dnech. Dle literárních údajů a z vlastních zkušeností na našem pracovišti víme, že odchylky v této dynamice spolu s dalšími příznaky, jako jsou fibrilace síní, psychická deteriorace, bolesti břicha mimo operační ránu nebo horečka, jsou velmi častým a časným nálezem u pacientů s anastomotickou komplikací [18,19].
Po stránce snížení pooperační morbidity byla naše očekávání splněna jen částečně. Celková 30denní pooperační morbidita v ERAS skupině klesla sice o 16 % ve srovnání s kontrolní skupinou, avšak tento rozdíl nebyl statisticky významný. Při podrobné analýze jednotlivých komplikací byl ale prokázán významný rozdíl ve výskytu paralytického ileu (21 % vs. 3 %). Jeho incidence se v odborné literatuře udává v relativně širokém rozmezí 10−27 % [20−22]. Rozdíly incidence jsou dány především nejednotnou definicí paralytického ileu v uvedených studiích. Paralytický ileus je příčinou významné pooperační morbidity, prodlužuje délku hospitalizace a zvyšuje náklady na léčbu [22,23]. Díky novým poznatkům v patofyziologii paralytického ileu se mění pohled na možnosti jeho léčby. Dochází k odklonu od pouhé symptomatické terapie k terapii multimodální. Jejím principem je pomocí preventivních postupů zmírnit podněty, které vedou k rozvoji střevní paralýzy. Mezi tyto postupy patří mimo jiné miniinvazivní operativa, šetrná operační technika, epidurální analgezie, absence opioidních analgetik a časná enterální výživa [24−26]. Snížení incidence paralytického ileu v naší studii lze vysvětlit skutečností, že v cílové sestavě pacientů se v rámci ERAS protokolu podařilo úspěšně implementovat všechny výše uvedené preventivní postupy včetně miniinvazivních operačních technik. Otázkou je, zda by stejného efektu bylo dosaženo také u resekčních výkonů na volném střevě, které jsou zatíženy obecně vyšším rizikem střevní paralýzy [27,28]. V naší neselektované databázi (n=880) se incidence paralytického ileu bez ohledu na operační přístup či způsob vedení perioperační péče pohybuje v rozmezí 10–26 % (resekce konečníku 10 %, resekce volného střeva 20 %, pravostranná hemikolektomie 26 %). Tyto výsledky jsou v souladu s výše uvedenými literárními údaji.
Důležitým ukazatelem sloužícím pro posouzení kvality perioperační péče je mimo jiné i délka hospitalizace. Jak ERAS protokol, tak i miniinvazivní operativa významně zkracují délku hospitalizace [3−6]. Zahraniční pracoviště s etablovaným ERAS programem a vysokou penetrací miniinvazivní kolorektální chirurgie deklarují délku hospitalizace u resekcí konečníku 4–7 dní [3,4,29,30]. Na našem pracovišti došlo k významnému zkrácení délky hospitalizace (13 dní vs. 9 dní), nicméně se nám nepodařilo dosáhnout výsledků zahraničních pracovišť. Delší hospitalizace v naší sestavě byla podmíněna řadou faktorů. Celkem 21 % pacientů podstoupilo abdominoperineální amputaci konečníku. Jedná se o nejinvazivnější výkon v oblasti rekta s rozsáhlou abdominální, pánevní a perineální disekcí. I přesto, že se výkony provádějí miniinvazivně, operační rána na perineu se proti konvenční operaci nemění a je zatížena stejným rizikem poruchy hojení. Ranné komplikace na perineu, zejména u pacientů po neoadjuvantní léčbě, patří k velmi častým příčinám prolongované hospitalizace [31]. Některá pracoviště proto amputace konečníku do ERAS protokolu nezařazují [32]. Dalším faktorem prolongované hospitalizace byl relativně vysoký počet pacientů s nově založenou stomií (25 % protektivní ileostomie, 24 % terminální kolostomie). Na našem pracovišti je stomikům věnována maximální pozornost a edukace začíná již v rámci předoperační přípravy. I přes tuto skutečnost část stomiků nácvik péče o stomii v pooperačním období nezvládá dostatečně a vyžaduje prodloužení hospitalizace. U pacientů s ileostomií je navíc nutné předejít metabolickým komplikacím a propuštění naplánovat až po období adaptace, kdy odpad z ileostomie klesá na průměrnou hodnotu 750 ml/den. Délka hospitalizace byla také ovlivněna skutečností, že v České republice je ve srovnání se zahraničím menší tlak na snížení lůžko-dnů. Propuštěním pacientů do domácí péče třetí nebo čtvrtý den po operaci konečníku rostou enormně nároky na edukaci, ale i na spolupráci pacientů. Pacienti se dostávají do domácího prostředí ve skutečnosti dříve, než se u nich mohou pooperační komplikace projevit. Je proto nutné, aby součástí protokolů byl pravidelný telefonický kontakt se sestrou/lékařem zaměřený na průběh rekonvalescence a včasnou diagnostiku komplikací. Pacienti musejí být dále informováni o vyšším riziku rehospitalizace. Pro ilustraci – na zahraničních pracovištích se zavedeným ERAS programem s průměrnou délkou hospitalizace po resekci konečníku 3–5 dní se počet rehospitalizací pohybuje v rozmezí 10–15 %, na našem pracovišti se počet rehospitalizací drží trvale pod 5 % (celá databáze, n=880), respektive okolo 3 % (ERAS skupina, n=67) [3,30,33].
Limitace
Limitací této studie je její nerandomizovaný design a relativně malá kohorta zařazených pacientů v obou srovnávaných skupinách. Dalšími faktory, které mohly ovlivnit dosažené pooperační výsledky, jsou rozdíly ve výskytu malnutrice a počtu provedených nízkých resekcí rekta.
Závěr
Multimodální perioperační péče (ERAS) a miniinvazivní operační techniky (laparoskopie, robotická chirurgie) jsou efektivním nástrojem pro zlepšení krátkodobých výsledků chirurgické léčby pacientů s karcinomem rekta. Na našem souboru jsme demonstrovali, že zavedení těchto modalit do klinické praxe vede k rychlejší rekonvalescenci, ke snížení incidence paralytického ileu a ke kratší době hospitalizace bez navýšení počtu rehospitalizací.
Seznam zkratek:
EBM – medicína založená na důkazech (evidence-based medicine)
ERAS – multimodální perioperační péče, Evropská společnost pro multimodální perioperační péči (enhanced recovery after surgery)
ESPEN – Evropská společnost pro parenterální a enterální výživu (European Society for Parenteral and Enteral Nutrition)
IASMEN – Mezinárodní asociace pro metabolickou péči a výživu v chirurgii (International Association for Surgical Metabolism and Nutrition)
LiDCORapidTM – neinvazivní technika měření srdečního výdeje (lithium dilution cardiac output)
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů
MUDr. Petr Kocián, Ph.D.
Chirurgická klinika 2. LF UK a FNM
e-mail: petr.kocian@fnmotol.cz
Sources
- Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394–424. doi: 10.3322/caac.21492.
- Brouwer NPM, Bos ACRK, Lemmens VEPP, et al. An overview of 25 years of incidence, treatment and outcome of colorectal cancer patients. Int J Cancer 2018;143(11):2758–2766. doi: 10.1002/ijc.31785.
- Khreiss W, Huebner M, Cima RR, et al. Improving conventional recovery with enhanced recovery in minimally invasive surgery for rectal cancer. Dis Colon Rectum 2014;57(5):557–563. doi: 10.1097/DCR.0000000000000101.
- Huibers CJA, de Roos MAJ, Ong KH. The effect of the introduction of the ERAS protocol in laparoscopic total mesorectal excision for rectal cancer. Int J Colorectal Dis. 2012;27(6):751–757. doi: 10.1007/s00384-011-1385-3.
- Tong G, Zhang G, Liu J, et al. A meta-analysis of short-term outcome of laparoscopic surgery versus conventional open surgery on colorectal carcinoma. Medicine (Baltimore) 2017;96(48):e8957.
- Bonjer HJ, Deijen CL, Abis GA, et al. A randomized trial of laparoscopic versus open surgery for rectal cancer. N Engl J Med. 2015;372(14):1324–1332. doi: 10.1056/NEJMoa1414882.
- Nygren J, Thacker J, Carli F, et al. Guidelines for perioperative care in elective rectal/pelvic surgery: Enhanced Recovery After Surgery (ERAS(®)) Society recommendations. World J Surg. 2013;37(2):285-305. doi: 10.1007/s00268-012-1787-6.
- Kolfschoten NE, van Leersum NJ, Gooiker GA, et al. Successful and safe introduction of laparoscopic colorectal cancer surgery in Dutch hospitals. Ann Surg. 2013;257(5):916−921. doi: 10.1097/SLA.0b013e31825d0f37.
- Yeo H, Niland J, Milne D, et al. Incidence of minimally invasive colorectal cancer surgery at National Comprehensive Cancer Network centers. J Natl Cancer Inst. 2014;107(1):362. doi: 10.1093/jnci/dju362.
- Hoogerboord CM, Levy AR, Hu M, et al. Uptake of elective laparoscopic colectomy for colon cancer in Canada from 2004/05 to 2014/15: a descriptive analysis. CMAJ Open. 2018;6(3):E384−E390. doi: 10.9778/cmajo.20180002.
- Kim NK, Kang J. Optimal total mesorectal excision for rectal cancer: the role of robotic surgery from an expert‘s view. J Korean Soc Coloproctol. 2010;26(6):377−387. doi: 10.3393/jksc.2010.26.6.377.
- Martínek L, Dostalík J, Guňka I. Miniinvazivní chirurgie v České republice. Rozhl Chir. 2008;87(11):563−566.
- Ryska O, Šerclová Z, Antoš F. Jak jsou dodržovány postupy moderní perioperační péče (Enhanced Recovery After Surgery) na chirurgických pracovištích v ČR – výsledky národní ankety. Rozhl Chir. 2013;92 : 435−442.
- Rejholec J. 15 let robotické chirurgie v ČR. Prezentováno na konferenci Zdravotnictví 4.0 věnované oboru Robotika ve zdravotnictví 23.5.2019; Praha. Dostupné na: http://www.top-expo.cz/domain/top-expo/files/smart-city/smart-city-2019/zdravotnictvi-4.0/prezentace/rejholec_jan.pdf.
- Vather R, Trivedi S, Bissett I. Defining postoperative ileus: results of a systematic review and global survey. J Gastrointest Surg. 2013;17 : 962–972. doi: 10.1007/s11605-013-2148-y.
- Kocián P, Whitley A, Přikryl P, et al. Enhanced recovery after colorectal surgery: the clinical and economic benefit in elderly patients. Eur Surg - Acta Chir Austriaca 2019;51(4):183–188. doi:10.1007/s10353-019-0595-8.
- Watt DG, McSorley ST, Horgan PG, et al. Enhanced recovery after surgery. Medicine (Baltimore). 2015;94(36):e1286. doi: 10.1097/MD.0000000000001286.
- Almeida AB, Faria G, Moreira H, et al. Elevated serum C-reactive protein as a predictive factor for anastomotic leakage in colorectal surgery. Int J Surg. 2012;10(2):87–91. doi: 10.1016/j.ijsu.2011.12.006.
- den Dulk M, Witvliet MJ, Kortram K, et el. The DULK (Dutch leakage) and modified DULK score compared: actively seek the leak. Colorectal Dis. 2013;15(9):e528–533. doi: 10.1111/codi.12379.
- Quiroga-Centeno AC, Jerez-Torra KA, Martin-Mojica PA, et al. Risk factors for prolonged postoperative ileus in colorectal surgery: A systematic review and meta-analysis. World J Surg. 2020;44(5):1612–1626. doi: 10.1007/s00268-019-05366-4.
- Vather R, Josephson R, Jaung R, et al. Development of a risk stratification system for the occurrence of prolonged postoperative ileus after colorectal surgery: a prospective risk factor analysis. Surgery 2015;157(4):764-773. doi: 10.1016/j.surg.2014.12.005.
- Tevis SE, Carchman EH, Foley EF, et al. Postoperative ileus-more than just prolonged length of stay? J Gastrointest Surg. 2015;19 : 1684–1690. doi: 10.1007/s11605-015-2877-1.
- Iyer S, Saunders WB, Stemkowski S. Economic burden of postoperative ileus associated with colectomy in the United States. J Manag Care Pharm. 2009;15(6):485–494. doi: 10.18553/jmcp.2009.15.6.485.
- Grass F, Slieker J, Jurt J, et al. Postoperative ileus in an enhanced recovery pathway – a retrospective cohort study. Int J Colorectal Dis. 2017;32(5):675–681. doi: 10.1007/s00384-017-2789-5.
- Guay J, Nishimori M, Kopp S. Epidural local anaesthetics versus opioid-based analgesic regimens for postoperative gastrointestinal paralysis, vomiting and pain after abdominal surgery. Cochrane Database Syst Rev. 2016;7(7):CD001893. doi: 10.1002/14651858.CD001893.pub2.
- Ng WQ, Neill J. Evidence for early oral feeding of patients after elective open colorectal surgery: a literature review. J Clin Nurs. 2006;15(6):696–709. doi: 10.1111/j.1365-2702.2006.01389.x.
- Yuan L, O’Grady G, Milne T, et al. Prospective comparison of return of bowel function after left versus right colectomy. ANZ J Surg. 2018;88:E242–E247. doi: 10.1111/ans.13823.
- Kummer A, Slieker J, Grass F, et al. Enhanced recovery pathway for right and left colectomy: Comparison of functional recovery. World J Surg. 2016;40 : 2519–2527. doi: 10.1007/s00268-016-3563-5.
- Pędziwiatr M, Pisarska M, Kisielewski M, et al. ERAS protocol in laparoscopic surgery for colonic versus rectal carcinoma: are there differences in short-term outcomes? Med Oncol. 2016;33(6):56. doi: 10.1007/s12032-016-0772-6.
- Martin AN, Berry PS, Frie CHM, et al. Impact of minimally invasive surgery on short-term outcomes after rectal resection for neoplasm within the setting of an enhanced recovery program. Surg Endosc. 2018;32(5):2517−2524. doi: 10.1007/s00464-017-5956-4.
- Colov EP, Klein M, Gögenur I. Wound complications and perineal pain after extralevator versus standard abdominoperineal excision: A nationwide study. Dis Colon Rectum 2016;59(9):813–821. doi: 10.1097/DCR.0000000000000639.
- Rouanet P, Mermoud A, Jarlier M, et al. Combined robotic approach and enhanced recovery after surgery pathway for optimization of costs in patients undergoing proctectomy. BJS Open 2020;4(3):516–523. doi: 10.1002/bjs5.50281.
- Bennedsen ALB, Eriksen JR, Gögenur I. Prolonged hospital stay and readmission rate in an enhanced recovery after surgery cohort undergoing colorectal cancer surgery. Colorectal Dis. 2018;20(12):1097−1108. doi: 10.1111/codi.14446.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2020 Issue 12-
All articles in this issue
- Onkochirurgie v České republice
- PIPAC – přehled metody a první použití v České republice
- Technické modifikace přerušení apendixu při laparoskopické apendektomii
- Kombinace ERAS a miniinvazivní chirurgie v léčbě karcinomu rekta – krátkodobé výsledky
- Wunderlichův syndrom u pacientky se sporadickými bilaterálními angiomyolipomy
- Anus perinei ventralis v dospělosti – kazuistika
- Vysoká amputácia dolnej končatiny pre infikovaný sekundárny lymfedém − kazuistika
- P.F. 2021
- Ženy a muži v české, převážně lůžkové chirurgii
- Začátky mladého chirurga
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- PIPAC – přehled metody a první použití v České republice
- Anus perinei ventralis v dospělosti – kazuistika
- Vysoká amputácia dolnej končatiny pre infikovaný sekundárny lymfedém − kazuistika
- Začátky mladého chirurga
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

