-
Medical journals
- Career
Srovnání chirurgického bypassu a subintimální rekanalizace v léčbě kritické končetinové ischemie
Authors: J. Fialová 1; P. Utíkal 1; M. Köcher 2; M. Černá 2; J. Indráková 1; P. Bachleda 1
Authors‘ workplace: II. chirurgická klinika FN Olomouc, přednosta: Prof. MUDr. P. Bachleda, CSc. 1; Radiologická klinika FN Olomouc, přednosta: Prof. MUDr. M. Heřman, Ph. D. 2
Published in: Rozhl. Chir., 2014, roč. 93, č. 6, s. 317-321.
Category: Original articles
Overview
Úvod:
V léčbě kritické končetinové ischemie (CLI) při uzávěru povrchní stehenní tepny (AFS) je klasickou metodou volby femoropopliteální bypass (FP bypass) pomocí autologní žíly. Vhodnou autologní žílu však nemá až 40 % nemocných. Tito nemocní pak mohou být revaskularizováni buď chirurgicky s využitím protézy, alogenní žíly nebo endovaskulárně – jednou z metod je subintimální rekanalizace (SIR).Materiál a metodika:
V naší prospektivní studii jsme se zaměřili na skupinu nemocných s chronickým uzávěrem AFS a s CLI. Nemocní byli léčeni chirurgicky (FP bypass autologní žilou nebo protézou) a endovaskulárně (SIR). Cílem bylo odpovědět, zda může být SIR považován i v této indikaci za metodu volby. V období od ledna 2010 do prosince 2012 bylo provedeno 59 revaskularizací končetin s CLI (Rutherford 5-6), z toho 22 FP bypassů a 37 SIR. Sledovali jsme bezprostřední pooperační průběh, technickou a klinickou úspěšnost a průběh hojení defektů.Výsledky:
Ke zhojení došlo u 78,6 % pacientů po FP bypassu autologní žilou, 62,5 % pacientů po FP bypassu protézou a 64,9 % pacientů po SIR (p=0.578). Primární průchodnost skupiny bypassů za pomocí autologní žíly a ePTFE protézy a skupiny SIR byla 78 % pro autologní žílu v 6., 12., 24. a 36. měsíci, resp. 74,5 %, 55 %, 55 % v 6., 12. a 24. měsíci pro ePTFE protézu a 78 %, 60 %, 51,3 % a 50,7 % pro SIR v 6., 12., 24. a 36. měsíci. Nebyl nalezen statisticky významný rozdíl v primární průchodnosti ve skupinách (p=0,625).Závěr:
Podle očekávání nejlepší metodou revaskularizace je FP bypass s využitím autologní žíly. FP bypass s využitím protézy a SIR měly podobné výsledky při zaměření na hojení defektů.Klíčová slova:
femoropopliteální bypass – subintimální rekanalizace (angioplastika) – kritická končetinová ischemieÚvod
V léčbě kritické končetinové ischemie (ICHDKK III, IV) při uzávěru povrchní stehenní tepny je klasickou metodou volby chirurgická revaskularizace pomocí autologní žíly. Ale až 40 % nemocných nemá vhodnou autologní žílu [1]. Tito nemocní mohou být revaskularizováni buď chirurgicky s využitím cévní protézy, alogenní žíly nebo endovaskulárně – jednou z metod je subintimální rekanalizace (SIR). U nemocných s kritickou končetinovou ischemií (CLI) nejsou takové nároky na dlouhodobou funkčnost revaskularizace jako u nemocných s intermitentními klaudikacemi. Vzhledem k jejich komorbiditám je často dostatečné, pokud je revaskularizace funkční ke zhojení defektu a tím pak k záchraně končetiny.
V naší prospektivní studii jsme sledovali skupinu nemocných s CLI a chronickým uzávěrem povrchní stehenní tepny (AFS) kategorie TASC C-D. Nemocní byli léčeni budęchirurgicky (femoropopliteální bypass supragenu) nebo endovaskulárně (SIR AFS nepřecházející na arterii poplitea). Cílem bylo odpovědět na otázku, zda a za jakých podmínek jedna ze sledovaných metod revaskularizace jasně předčí druhou a může být považována i v této indikaci za metodu volby. Zakončením sledování subjektů ve studii bylo stanoveno zhojení defektu nebo selhání revaskularizace bez možnosti další intervence. Při selhání revaskularizace byla snaha obnovit její průchodnost.
Pacienti před zařazením do studie podepsali informovaný souhlas. Po revaskularizaci byla dále léčena jejich přidružená onemocnění i s rizikovými faktory.
Materiál a metodika
V období od ledna 2010 do prosince 2012 bylo provedeno 59 revaskularizací končetin s CLI (Rutherford 5–6), bližší charakteriska pacientů a jejich přidružená onemocnění viz Tab. 1. Pacienti byli náhodně zařazeni do dvou skupin. V případě, že pacient odmítl podstoupit FP bypass nebo trpěl významnými komorbiditami, které neúměrně zvyšovaly riziko operačního výkonu, byl přeřazen do miniinvazivní skupiny SIR.
Table 1. Charakteristika pacientů Tab. 1: Characteristics of patients 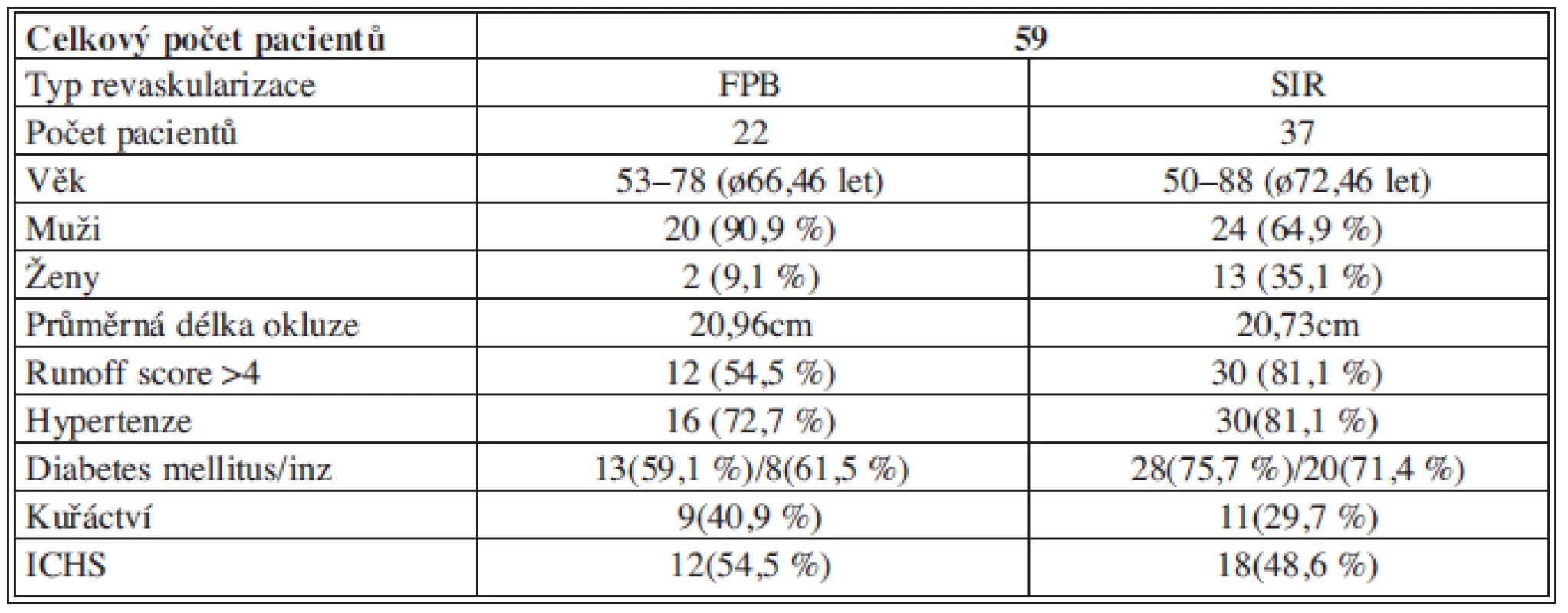
Skupinu supragenu femoropopliteálních bypassů (FP bypass) tvořilo 22 pacientů, FP bypass autologní žílou byl proveden u 12 pacientů a FP bypass s využitím protézy pak u 10 pacientů. Ve skupině SIR AFS bylo 37 pacientů.
Po revaskularizaci jednou z metod následovalo hojení defektů pomocí vlhkého krytí podle standardizovaného protokolu. Sledovali jsme bezprostřední pooperační průběh, technickou a klinickou úspěšnost výkonu a průběh hojení defektů. Kvalita výtokového traktu byla hodnocena podle SVS runoff score z předoperačních zobrazovacích metod angiografií (MR angiografie, CT angiografie) či peroperační angiografie [2]. Pacienti s FP bypassem s distální anastomózou pod kolenem nebo se SIR arteria poplitea byly z této studie vyloučeni. Dále byli z hodnocení vyloučeni pacienti, u kterých bylo peroperačně nutné provést endovaskulární výkon na bércových tepnách.
Průměrná délka uzávěru AFS byla 20,96 cm ve skupině FP bypassů a 20,76 cm ve skupině SIR. Kvalita výtokového traktu byla hodnocena jako špatná (runoff score >4) v 54,5 % ve skupině FP bypass (7 pacientů s FP bypassem autologní safénou a 5 pacientů s ePTFE protézou) a 81,1 % ve skupině SIR.
Technika výkonů:
FP bypass byl prováděn ve spinální či celkové anestezii. Pacienti byli operováni chirurgickým týmem II. chirurgické kliniky FN Olomouc. Naším cílem bylo použít ipsilaterální autologní žílu – venu saphenu magnu (VSM). Její kvalita byla hodnocena předoperačně provedenou dopplerovskou ultrasonografií (DUS). Pokud byla VSM shledána před - či peroperačně nevyužitelná, byla indikována náhrada pomocí ePTFE protézy. Alogenní žilní transplantáty nebyly ve studii využity, protézy byly typu Propaten. Peroperačně byl aplikován heparin s průměrnou dávkou 7500 j. Pooperačně byli pacienti zajištěni LMWH v preventivní dávce, v případě špatného výtokového traktu a použití žíly k revaskularizaci obdrželi LMWH v léčebné dávce a následně byli převedeni na Warfarin. Po výkonu všichni pacienti trvale užívali ASA (100 mg Anopyrinu/den), Clopidogrel (75 mg Clopidogrelu/den) byl podáván po dobu 6 měsíců.
Subintimální rekanalizace byla prováděna v lokální anestezii vždy z ipsilaterálního přístupu při periprocedurální dávce 5000 j Heparinu i. a. K vytvoření subintimálního kanálu bylo použito standardní instrumentarium, dilatace subintimálního prostoru byla prováděna dilatačním balonkovým katétrem průměru 5–6 mm. Zařízení k vytvoření re-entry nebylo u pacientů zařazených do studie použito. Po výkonu pacienti trvale užívali ASA (100 mg Anopyrinu/den), Clopidogrel byl podáván po dobu 6 měsíců.
Další sledování:
Předoperačně před FP bypassem byl přístrojem Duplex II měřen ankle-brachial index (ABI), další měření bylo po 6 týdnech a po 6 měsících po výkonu. Následně pak každý rok, pokud klinický stav nevyžadoval kontrolu mimo toto schéma. V případě pochybností, zda je revaskularizace průchodná, byl doplněn DUS či angiografie metodou CT nebo MR.
Před SIR byl pacientům změřen ABI. Do 24 hodin od výkonu byl všem nemocným proveden DUS k ověření průchodnosti, měření ABI bylo po 6 týdnech a po 6 měsících po výkonu. Dále byly klinické kontroly a DUS prováděny po 6 a 12 měsících a následně každý rok od výkonu.
Defekty byly ošetřovány podle standardizovaného protokolu pomocí vlhkého krytí ran, velikost defektů byla měřena co 4 týdny a fotodokumentována.
Definice
Časný uzávěr rekanalizované tepny a bypassu byl definován jako uzávěr do 24 hodin po výkonu, ověřený DUS, případně CTA, MRA při nejasném nálezu. Primární průchodnost – průchodnost rekanalizované tepny a bypassu ověřená DUS, provedená 6 a 12 měsíců po výkonu a dále pak další rok od výkonu a nevyžadující reintervenci. Technická úspěšnost SIR byla definována jako dokončení rekanalizace a ověřená průchodnost rekanalizované tepny, provedená 24 hodin po výkonu. Selhání revaskularizace bylo definováno jako nemožnost obnovení její průchodnosti chirurgickými nebo endovaskulárními metodami.
Statistické zpracování
Ke statistickému zpracování byl použit software SPSS verze 15, SPSS Inc. Chicago USA a program Microsoft Excel 2010. Kumulativní průchodnost byla zpracována Kaplan-Meierovou analýzou. Statistická významnost jednotlivých proměnných faktorů, které by mohly ovlivnit primární průchodnost, byla testována Coxovou regresí, Fischerovým přesným testem, testem normality Shapiro-Wilk a Mann Whitney U-testem. Všechny testy byly provedeny na hladině signifikance 0,05.
Výsledky
Soubor pacientů byl sledován od ledna 2010 do prosince 2013, průměrná doba sledování byla 26,4 měsíce (rozmezí 3–39 měsíců). Mann-Whitney U-testem byly prokázány statisticky významně vyšší hodnoty počtu průchozích bércových tepen a nižší run off score ve skupině FP bypass.
Technická úspěšnost byla 100 % u pacientů s FP bypassem a 97,3 % ve skupině SIR. K časnému uzávěru došlo pouze u jednoho pacienta (2,7 %) ve skupině SIR. Průměrný vzestup ABI byl 0,49 u FP bypassu a 0,37 u SIR.
Ke zhojení došlo u 78,6 % pacientů po FP bypassu autologní žilou, 62,5 % pacientů po FP bypassu protézou a 64,9 % pacientů po SIR (p=0,578). Záchrana končetiny byla 86,4 % u pacientů po FP bypassu a 91,9 % u pacientů po SIR (p=0,526).
Při srovnání skupiny bypassů rozdělených na skupinu po revaskularizaci za pomoci autologní žíly a ePTFE protézy a skupiny SIR byla vyhodnocena primární průchodnost 78 % pro autologní žílu v 6., 12., 24. a 36. měsíci, resp. 74,5 %, 55 %, 55 % v 6., 12. a 24. měsíci pro ePTFE protézu a 78 %, 60 %, 51,3 % a 50,7 % pro SIR v 6., 12., 24. a 36. měsíci. Sledování 36 měsíců nedokončil žádný z pacientů skupiny ePTFE protéz z důvodů ztráty ze sledování nebo selhání revaskularizace. Nejvíce selhání revaskularizací, tj. nejrizikovější období, bylo mezi 1. až 6. měsícem po revaskularizaci (Graf 1). Long-rank testem nebyl prokázán statisticky významný rozdíl v primární průchodnosti ve skupinách (p=0,625). Také nebyla prokázána souvislost mezi typem bypassu a provedenou amputací pro nezhojení/progresi defektu revaskularizované končetiny (p=0,624).
Graph 1. Primární průchodnost FP bypassu autologní safénou (FP bypass VSM), FP bypassu ePTFE protézou a subintimální rekanalizace (SIR) Graph 1: Primary patency of femoropopliteal bypass using autologous vein (FP bypass VSM), ePTFE prosthesis (ePTFE) and after subintimal recanalization (SIR) 
Při hledání faktorů, které měly vliv na nutnost podstoupit amputaci nebo kdy nedošlo ke zhojení defektu po dobu sledování, bylo Fischerovým přesným testem prokázáno, že u diabetiků je statisticky významně vyšší výskyt amputací/nezhojení defektu (p=0,033). Nenalezli jsme souvislost mezi typem léčby diabetu (PAD, inzulinoterapie), komorbiditami (ICHS, HN, HLP, CHOPN, CHRI). Coxovým modelem proporciálního hazardu bylo zjištěno, že má-li pacient diabetes, zvyšuje se riziko amputace či nezhojení defektu 4,023krát (95 % Cl 0,923–17,527) (p=0,064).
Mann-Whitney U-testy neprokázaly vliv délky uzávěru AFS a počtu průchodných výtokových tepen na nezhojení defektu nebo nutnost podstoupit amputaci, p >0,05 ve všech případech.
Diskuze
Cílem naší studie bylo porovnání chirurgické revaskularizace bypassem a subintimální rekanalizace u selektované skupiny pacientů pouze s chronickým uzávěrem AFS a defektem (Rutherford 5–6). Pacienti již zařazení do studie, u kterých bylo nutné peroperačně provést endovaskulární výkon na bércových tepnách ke zlepšení výtokového traktu, byli z hodnocení studie vyloučeni. Pacienti byli náhodně zařazeni do obou sledovaných skupin, v několika případech byli na vlastní žádost nebo pro významné komorbidity léčeni metodou SIR místo FP bypassu, tímto došlo k proporciálnímu rozdílu v počtu pacientů v obou skupinách. Nešlo tedy o randomizaci v pravém slova smyslu. Stejným způsobem došlo i k rozdílu v počtu průchodných bércových tepen v jednotlivých skupinách, tento rozdíl mohl ovlivnit klinické výsledky v neprospěch SIR. Přestože jsme předpokládali, že počet průchodných bércových tepen bude mít vliv na hojení defektu po revaskularizaci, nebyl vliv statisticky prokázán.
Hojení defektů probíhalo podle standardizovaného protokolu podle různých fází hojení rány pomocí vlhkého krytí, samotné hodnocení hojení pro statistické účely má svá úskalí, která si uvědomujeme. Cílem bylo zhodnotit efekt revaskularizací na hojení defektu. Odpověď, zda jedna metoda revaskularizace předčí druhou, není statisticky jednoznačná. Velikost souboru pacientů je malá, čímž se snižuje pravděpodobnost potvrzení nadřazenosti revaskularizace FP bypassem s autologní žilou.
Subintimální rekanalizace patří mezi technicky náročnější, ale levnější metody ve srovnání s perkutální transluminální angioplastikou s implantací stentů nebo stentgraftů. Přestože subintimální rekanalizaci mnoho autorů doporučuje jako metodu volby v léčbě CLI, většina publikovaných výsledků hodnot, jak pacienty s CLI, tak s intermitentními klaudikacemi [3–7]. Průchodnost se v metaanalýze SIR Bowna pohybuje mezi 47,9–63,4 % po 12 měsících a záchrana končetiny se pohybuje mezi 82,5–92,2 % po 12 měsících [5]. Met ve svém systematickém review upozorňuje na chybějící srovnání SIR a chirurgických bypassů u pacientů s CLI [3]. Naše sdělení mělo za cíl tyto chybějící informace doplnit.
Aalders a Pedersen publikovali studie s vysokým procentem zastoupení diabetiků po revaskularizaci za pomocí ePTFE protézy, oba udávají nízkou 5letou průchodnost (39 %, resp. 42 %), ale neprokázali vliv diabetu na průchodnost bypassů [8,9]. Tento fakt jsme popřeli, diabetes se v naší studii ukázal jako nepříznivý faktor, který snižoval průchodnost a zvyšoval riziko amputace. Podobně nízkou průchodnost udává Kavanagh, po 3 a 5 letech byla kumulativní průchodnost ePTFE bypassů 49 %, resp. 36 %, přesto 72 % pacientů s defekty se zahojilo [10]. Oproti tomu výborné výsledky po využití ePTFE u CLI uvádí Dorruci, 2letá primární průchodnost byla 85 % [11].
Využití ePTFE protézy při revaskularizací končetin s defektem má jednoznačně vyšší riziko infekcí graftů oproti autologní žíle [12]. Přesto v našem souboru nebyla tato komplikace zaznamenána. Výsledky revaskularizací využitím alogenní žíly jsou publikovány posledních 10 let. Jeden z největších souborů pacientů byl uveden Faberem, který udává jednoletou průchodnost 30 % při 71 % záchrany končetiny po 2 letech [13]. Většímu využití tohoto materiálu brání nedostatek vhodných kadaverózních dárců.
Revaskularizace autologní žilou má v léčbě kritické končetinové ischemie nejlepší výsledky již od 90. let minulého století [1,12]. Přesto nové studie, které by tyto výsledky srovnaly s novějšími miniinvazivními metodami nebo jen potvrdily výborné výsledky, chybějí. Jednu z mála novějších prací představil De Luccia – udává v souboru pacientů s CLI po FP bypassu primární průchodnost po 2 letech 82,5 % a záchranu končetiny 86,9 % [14]. Další rozsáhlou retrospektivní práci publikoval Korhonen. Šlo o pacienty s CLI, kteří podstoupili miniinvazivní metodu formou PTA nebo FP bypass. Záchrana končetin po 5 letech byla 78,2 % u PTA a 91,8 % u pacientů po FP bypassu [15]. Naše výsledky jsou velmi podobné a potvrzují nadřazenost FP bypassu autologní safénou.
Závěr
Podle očekávání nejlepší metodou revaskularizace je FP bypass s využitím autologní žíly. FP bypass s využitím protézy a SIR měly podobné výsledky při zaměření na hojení defektů. Proto v případě, že pacient nemá předoperačně zjištěnou vhodnou autologní žílu k revaskularizaci a nebo je polymorbidní, je vhodné preferovat provedení SIR místo revaskularizace s využitím protézy.
Použité zkratky:
ABI – kotníko-pažní index
AFS – povrchní stehenní tepna
ASA – Acetylsalicylová kyselina
CLI – kritická končetinová ischemie
CTAg – angiografie počítačovou tomografií
DUS – dopplerovská sonografie
DSA – digitální substrakční angiografie
ePTFE – expandovaný polytetrafluorethylen
FP – femoropopliteální
ICHDKK – ischemická choroba dolních končetin
MRA – angiografie magnetickou rezonancí
LMWH – nízkomolekulární heparin
PTA – perkutální transluminální angioplastika
SIR – subintimální rekanalizace
VSM – vena saphena magna
MUDr. Jana Fialová
II.Chirurgická klinika FN Olomouc
I.P. Pavlova 6
77520 Olomouc
e-mail: jana.fialova@fnol.cz
Sources
1. Klinkert P, Post PN, Breslau PJ, Bockel JH. Saphenous Vein Versus PTFE for Above-Knee Femoropopliteal Bypass. A review of the Literature Eur J Vasc Endovasc Surg 2004;27 : 357–62.
2. Ruherford RB, Baker DJ, Ernst C, Johnston KW, Porter JM, et al. Recommended standarts for reports dealing with lower extremity ischemia: revised version. J Vasc Surg 1997;26 : 517–38.
3. Met R, van Lieden KP, Koelemay MJ, Bipat S, Legemate DA, et al. Subintimal angioplasty for peripheal arterial occlusive disease: A systematic review. Cardiovasc Intervent Radiol 2008;31 : 687–97.
4. London NJ, Srinivasan R, Naylor AR, Hartshorne T, Ratliff DA, et al. Subintimal angioplasty of femoropopliteal occlusions: the long term results. Eur J Vasc Surg 1994;8 : 148–55.
5. Bown MJ, Bolia A, Sutton AJ. Subintimal angioplasty: meta-analytical evidence of clinical utility. Eur J Vasc Endovasc Surg. 2009;38 : 323–37.
6. Lipsitz EC, Ohki T, Veith FJ, Suggs WD, Wain RA, et al. Does subintimal angioplasty have a role in the treatment of severe lower extremity ischemia? J Vasc Surg 2003;37 : 386–91.
7. Köcher M, Černá M, Utíkal P, Kozák J, Šišola I, et al. Subintimální angioplastika ve femoropopliteální oblasti – střednědobé výsledky. Ces Radiol 2008;62 : 153–9.
8. Aalders GJ, van Vroonhoven TJ. Polytetrafluoroethylene versus human umbilical vein in above-knee femoropopliteal bypass: six-year results of a randomized clinical trial. J Vasc Surg 1992; 16 : 816–23.
9. Pedersen G, Laxdal E, Hagala M, Amundsen SR, Dregelid E, et al. The impact of patient characteristics on long-term results of above-knee prosthetic femoropopliteal bypass for critical ischemia. Int Angiol 2005;24 : 349–54.
10. Kavanagh EG, OęRiordain DS, Buckley DJ, OęDonnell JA. Long term results of polytetrafluoroethylene in above knee femoropopliteal bypass for critical ischaemia.Ir J Med Sci 1988;167 : 221–4.
11. Dorrucci V, Griselli F, Petralia G, Spinamano L, Adornetto R. Heparin-bonded expanded polytetrafluoroethylene grafts for infragenicular bypass in patients with critical limb ischemia: 2-year results. J Cardiovasc Surg 2008;49 : 145–9.
12. Pereira CE, Albers M, Romiti M, Brochado-Neto FC, Pereira CA. Meta-analysis of femoropopliteal bypass grafts for lower extremity arterial insufficiency. J Vasc Surg 2006;44 : 510–17.
13. Farber A, Major K, Wagner WH, et al. Cryopreserved saphenous vein allografts in infrainguinal revascularization: analysis of 240 grafts. J Vasc Surg 2003;38 : 15–21.
14. DeLuccia N, Brochado-Neto FC, Romiti M, Kikichi M, dos Reis JM, et al. Preferential use of nonreversed vein grafts in above-knee femoropopliteal bypasses for critical ischemia: midterm outcome. Ann Vasc Surg 2008;22 : 668–75.
15. Korhonen M, Biancari F, Söderström M, Arvela E, Halmesmäki K, et al. Femoropopliteal balloon angioplasty vs. bypass surgery for CLI: a propensity score analysis. Eur J Vasc Endovasc Surg 2011;41 : 378–84.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 6-
All articles in this issue
- Nová strategie chirurgické léčby mnohočetného nádorového postižení jater – ALPPS
- Studie morfologie r. descendens a. circumflexae femoris lateralis jako možné cévní náhrady pro rekonstrukci koronárního řečiště pomocí angio CT vyšetření
- Karcinom tlustého střeva – zhodnocení komplikací a rizik plánovaných resekčních výkonů
- Srovnání chirurgického bypassu a subintimální rekanalizace v léčbě kritické končetinové ischemie
- Primární volvulus tenkého střeva u mladého nemocného
- Kombinovaný chirurgický management infekce hemodialyzačního cévního přístupu bakteriologickým agens Clostridium perfringens
- Klostridiová myonekróza břišní stěny – kazuistika
- Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS
- Primární volvulus tenkého střeva u mladého nemocného
- Klostridiová myonekróza břišní stěny – kazuistika
- Nová strategie chirurgické léčby mnohočetného nádorového postižení jater – ALPPS
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

