-
Medical journals
- Career
Staplerová linie u sleeve resekce žaludku
Authors: P. Zonča 1,2; P. Guňková 2; L. Martínek 2; A. Foltýs 2; M. Bužga 3; Jacobi Ca 1
Authors‘ workplace: Zentrum für Viszeral und Minimal Invasive Chirurgie, Wesseling, Německo přednosta: Prof. Dr. med. C. A. Jacobi, PhD. 1; Chirurgická klinika LF OU a FN Ostrava, přednosta: Doc. MUDr. P. Zonča, PhD., FRCS 2; Katedra fyziologie a patofyziologie, LF OU v Ostravě, vedoucí: Doc. RNDr. P. Švorc, CSc. 3
Published in: Rozhl. Chir., 2013, roč. 92, č. 7, s. 373-378.
Category: Original articles
Overview
Úvod:
Pooperační leak a krvácení ze staplerové linie představují potenciálně závažné časné komplikace po laparoskopické sleeve resekci žaludku.Cíl:
Cílem práce je zhodnocení významu přešití resekční staplerové linie po laparoskopické tubulizaci žaludku v prevenci leaku a krvácení na našem souboru pacientů.Materiál a metodika:
Do studie byli zařazeni pacienti, u kterých byla provedena laparoskopická sleeve resekce žaludku. Porovnávány byly dvě skupiny pacientů. U první bylo přešití staplerové linie provedeno pouze u vybraných případů a u druhé skupiny byla resekční linie přešita ve všech případech. Jednalo se o nerandomizovanou retrospektivně-prospektivní studii. Sledovány byly pooperační komplikace.Výsledky:
V období mezi říjnem 2006 a prosincem 2011 bylo provedeno 638 sleeve resekcí žaludku standardní laparoskopickou technikou. U 297 byla resekční linie přešita pouze ve vybraných případech a u následujících 341 pacientů byla resekční linie přešita vždy. Obě skupiny pacientů byly v základních parametrech srovnatelné.
Časný pooperační leak se vyskytl u jednoho pacienta z obou skupin, 0,30 % vs. 0,29 % (p = 0,9203). Relativní četnost pooperačního krvácení byla 2,7 % ve skupině se selektivním přešitím staplerové linie a 0 % ve skupině, kde byla resekční linie přešita vždy (p = 0,0023).Závěr:
Naše studie neprokázala vliv přešití staplerové linie na výskyt leaku. Relativní četnost výskytu pooperačního krvácení z místa resekce byla v našem souboru statisticky významně nižší ve skupině s pravidelným přešitím staplerové linie.Klíčová slova:
laparoskopie – resekce žaludku – stapler – komplikaceÚvod
Obezita je komplexní a multifaktoriální chronické onemocnění. Zahrnuje behaviorální, metabolické, fyziologické, genetické, psychologické, sociální a kulturní komponenty. Při léčbě obezity musíme vzít v potaz všechny tyto komponenty. Léčba obezity musí být komplexní a uplatňuje se zde řada odborností. Bariatrická chirurgie je etablovanou součástí léčby morbidně obézní populace [1]. V paletě operací, které se používají v chirurgii obezity a metabolického syndromu, se stále více prosazuje sleeve resekce žaludku. Spočívá to jednak v její efektivitě, ale rovněž v relativní technické jednoduchosti bez nutnosti provedení anastomózy a v bezpečnosti této operace pro pacienta [2].
V této práci analyzujeme význam přešití resekční staplerové linie po sleeve gastrektomii v prevenci leaku nebo krvácení.
Materiál a metody
Provedení komparativní retrospektivně-prospektivní kohortové studie, se zařazením pacientů operovaných pro obezitu či metabolický syndrom metodou sleeve resekce žaludku. Provedení retrospektivní analýzy skupiny pacientů operovaných bez přešití staplerové linie nebo pouze s přešitím při intraoperačních známkách krvácení ze staplerové linie. Standardně byla přešita staplerová linie jedním stehem vždy na začátku a konci proximálně a distálně. Při intraoperačních známkách krvácení ze staplerové linie bylo ošetřeno přešitím vždy krvácející místo tak, že při ukončení operace byla staplerová linie v celé délce bez jakýchkoliv známek krvácení. Prospektivní analýza skupiny pacientů operovaných standardně s přešitím staplerové linie v celé její délce. Nebyla exkluzivní kritéria. Design studie nevyžaduje randomizaci. Primárním cílem bylo vyhodnocení efektu přešití na leak a krvácení po sleeve resekci žaludku.
Sleeve resekce žaludku byla provedena standardní laparoskopickou technikou. Všichni pacienti mají standardní přípravu včetně antibiotické profylaxe (Cefuroxim 1,5 g i.v. podaný ve dvou dávkách, první dávka 30 minut před zahájením operace a druhá dávka 8 hod. od podání první dávky dle nemocničního standardu) a prevence tromboembolie. Pacient je v poloze na zádech s lehce pokrčenými abdukovanými dolními končetinami, v antitrendelenburgově poloze. Operatér stojí mezi abdukovanými dolními končetinami pacienta a asistent stojí na pravé straně pacienta. Pozice anesteziologa, instrumentářky, monitoru a laparoskopické věže jsou standardní (Obr. 1).
Image 1. Schéma pozice pacienta, týmu a nástrojů u sleeve resekce žaludku Fig. 1: Diagram showing the position of the patient, the operating team and the instruments in sleeve gastrectomy 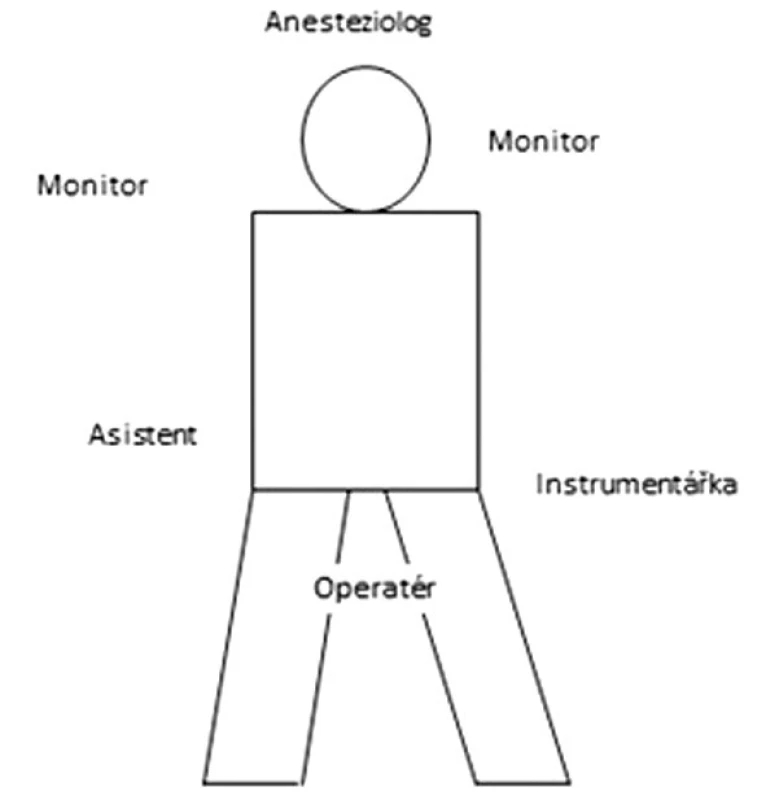
První trokar vkládáme otevřenou technikou. Pozice trokarů jsou uvedeny v tabulce (Tab. 1).
Table 1. Pozice trokarů Tab. 1: Position of trocars 
Pneumoperitoneum zakládáme do výše 16 mm Hg. Každou operaci začínáme systematickým prohlédnutím dutiny břišní. Používáme 30stupňovou optiku. Zavádíme jaterní retraktor. Objektivizujeme operabilitu a zjišťujeme event. dříve nediagnostikované skutečnosti (srůsty apod.). Dále postupujeme standardní technikou tubulizace žaludku s protětím gastrokolického ligamenta a otevřením omentální bursy. Pokračujeme skeletizaci velké křiviny žaludku s přerušením vasa gastrica brevia až po levé brániční krus. Zavádíme 40 Fr žaludeční sondu, kterou umisťujeme až do pyloru. Následuje resekce žaludku, jejíž rozsah je vymezen zavedenou sondou. Resekci začínáme 4–6 cm orálně od pyloru pomocí stapleru na velké křivině a ukončujeme ji v oblasti ezofago-gastrické junkce. V roce 2007 byl použit stapler s délkou svorek po odpalu 2,0 mm distálně a 1,5 mm proximálně s délkou náboje 45 mm, od přelomu roku 2007/2008 do současnosti byl použit nástroj s délkou svorek po odpalu 1,8 mm v distální části žaludku a s délkou svorek po odpalu 1,5 mm v proximální části žaludku a s délkou náboje 60 mm. Následuje odstranění 40 Fr žaludeční sondy a je zavedena 16 Fr sonda, kterou aplikujeme metylenovou modř (individuální množství 50–200 ml) k testování patentnosti resekční linie. Vizuálně kontrolujeme staplerovou linii na integritu a event. krvácení. V první skupině pacientů bylo provedeno pouze selektivní přešití na proximálním a distálním konci linie a event. přešití místa krvácení ze staplerové linie jednotlivými stehy PDS 4/0. V druhé skupině pacientů jsme provedli kontinuální přešití staplerové linie PDS 4/0 nebo stehem V-loc (V-Loc™ Covidien, Mansfield, Massachusetts)(Obr. 2). Důležité je provedení přešití staplerové linie po odstranění 40 Fr sondy, protože jinak by byla sutura prováděna pod napětím, které by bylo způsobené zavedenou sondou. Následuje zavedení easy-flow drénu, který umisťujeme paralelně ke staplerové linii. Standardní ukončení operace.
Image 2. Přešití staplerové linie Fig. 2: Oversewing of the staple line 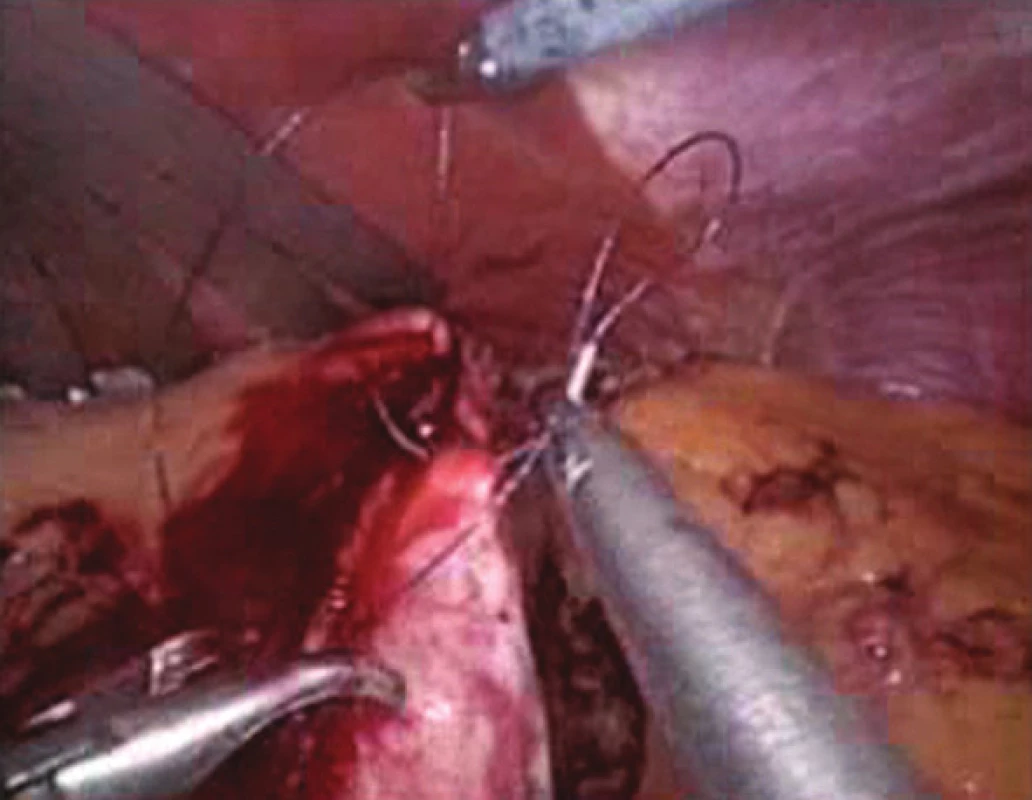
K získání všech dat sloužily následující podklady: operační protokol, anesteziologický protokol, aktuální dokumentace pacienta včetně indikačního zápisu k operaci a dokumentace z centrálního datového systému v nemocnici. Při statistickém zpracování výsledků byly pro charakteristiky souborů použity metody popisné statistiky (průměr, relativní četnost) a pro statistické srovnání nespojitých proměnných byl použit χ2 test. Hladina významnosti μ = 0,05 byla považována za statisticky signifikantní.
Výsledky
V časovém období od srpna 2006 do prosince 2011 bylo operováno celkem 638 pacientů s průměrným BMI 48,1 kg/m2 (Wesseling, 2 chirurgové). Komplikace jsou přehledně uvedeny v Tab. 2.
Table 2. Výsledky Tab. 2: Results 
V první retrospektivní skupině od srpna 2006 do června 2009 bylo operováno 297 pacientů (204 žen, 93 mužů) s průměrným BMI 47,3 kg/m2. Průměrná délka hospitalizace v této skupině pacientů byla 5,4 dne. Leak se vyskytl u jednoho pacienta (1/297, 0,3 %). Byl zjištěn první pooperační den při rutinní radiologické kontrole a byl vyřešen laparoskopickou revizí s přešitím místa defektu. Pacient byl hospitalizován celkem 8 dní a byl propuštěn do ambulantní péče bez dalších komplikací. Krvácení se objevilo celkem u 8 pacientů (8/297, 2,7 %). U 7 pacientů jsme provedli operační revizi (7/297, 2,35 %). Z toho jsme u 3 pacientů jednoznačně peroperačně identifikovali jeden zdroj krvácení ve staplerové linii, který byl ošetřen přešitím. U 4 pacientů jsme neidentifikovali jednoznačný jediný zdroj krvácení, ale jednalo se o difúzní prosakování ze staplerové linie. V tomto případě byla přešita suspektní místa, kde na povrchu žaludku byly větší cévy nebo byla staplerová linie přešita v celé délce s překrytím hemostyptickou síťkou. Revize pro krvácení byla provedena 8–72 hodin po provedené primární operaci. Všechny reoperace byly provedeny laparoskopicky a po provedené revizi se nevyskytly další komplikace. U jednoho pacienta s méně významným krvácením jsme postupovali konzervativně bez nutnosti operace. Drenáž jsme ponechali celkem 8 dní po operaci a celková hospitalizace trvala 10 dní. U tří pacientů bylo nutné aplikovat krevní substituci. Délka hospitalizace u pacientů s krvácením se pohybovala od 5 do 13 dnů.
Ve druhé skupině pacientů od června 2009 do prosince 2011 bylo zařazeno 341 pacientů (228 žen, 113 mužů) s průměrným BMI 48,6 kg/m2. Průměrná délka hospitalizace v této skupině pacientů byla 5,3 dne. Leak se u této skupiny vyskytl u jednoho pacienta (1/341), což představuje 0,29 %. U tohoto pacienta se leak objevil druhý pooperační den a byl verifikován rentgenologicky. Vzhledem k tomu, že se jednalo o ohraničené ložisko kontrastní látky v oblasti ezofago-gastrické junkce velikosti 2–3 cm s jemnou vlásenkovitou komunikací s žaludkem, pacient měl pouze minimální lokální příznaky bez celkové alterace stavu a drén odváděl stopové množství patologické sekrece, postupovali jsme konzervativně. Potíže při konzervativním postupu promptně odezněly. V tomto případě byl pacient dimitován 17. pooperační den. Krvácení se v této skupině s přešitím staplerové linie nevyskytlo (0/341, 0 %).
V obou skupinách zemřel jeden pacient na plicní embolii (1/638, 0, 16 %). Nejednalo se o pacienta s výše uvedenými komplikacemi.
Mezi oběma skupinami pacientů nebyl rozdíl v BMI a základních demografických parametrech. Statisticky jsme na hladině významnosti 0,05 nepotvrdili rozdíl ve výskytu leaku z linie svorek. Častější výskyt krvácení ve skupině se selektivním přešitím resekční linie však byl statisticky významný v porovnání se skupinou, kde linie svorek byla přešívána rutinně.
Diskuze
Laparoskopická sleeve resekce žaludku je jednou z metod chirurgické léčby morbidní obezity. Otevřenou cestou byla poprvé tato operace provedena v roce 1993 [3] a první laparoskopickou tubulizaci žaludku jako součást biliopankreatické diverze provedl v roce 1999 Gagner [4]. Původně byla tato bariatrická operace indikována jako první stupeň chirurgické léčby u superobézních, rizikových pacientů před gastrickým bypassem.
Nicméně pro svou relativní technickou jednoduchost, časovou nenáročnost, nízkou pooperační morbiditu (0–24 %) [5, 6] a mortalitu 0,39 % [6] ve srovnání s gastrickým bypassem či biliopankreatickou diverzí se ukázala laparoskopická sleeve resekce žaludku jako efektivní jednostupňová procedura. U tubulizace žaludku dochází k významnému snížení hladiny hormonu ghrelinu, takže váhový úbytek je podmíněn i endokrinně. Určité snížení ghrelinu bylo popsáno i u dalších typů operací. Dynamika hormonálních změn po jednotlivých typech operací se stává předmětem řady studií. Kromě výše uvedených předností jsou dalšími výhodami nepřítomnost anastomózy, nedochází k vnitřním herniacím, je zachován pylorus a normální kontinuita zažívacího traktu, není přítomna malabsorpční komponenta a s výjimkou potenciálního deficitu B12 není popisován nedostatek jiných vitaminů či minerálů. Další z výhod je možnost indikovat sleeve resekci žaludku jako revizní operaci u pacientů po předchozí komplikované či neefektivní bariatrické operaci, nejčastěji adjustabilní či neadjustabilní bandáži žaludku. Je efektivní jak v řešení samotné obezity, tak komorbidit s ní spojených. Nicméně v léčbě metabolického syndromu není tak efektivní jako např. žaludeční bypass.
Četnost komplikací závisí na řadě faktorů. Diskutuje se např. použitá chirurgická technika. Svoji roli může hrát velikost kalibrační sondy (většina chirurgů používá kalibrační sondy menší než 40 Fr, resp. 32–36 Fr [6], dále velikost resekovaného antra žaludku, zvažuje se vliv ošetření resekční linie a faktory hojení daného pacienta. Je třeba rovněž vzít v potaz definici komplikací v dané studii a délku pooperačního sledování. Nejzávažnějšími a nejobávanějšími potenciálními komplikacemi jsou gastrický leak a krvácení ze staplerové linie. Z dalších komplikací to jsou pozdní perforace žaludku, vytvoření chronické gastrické píštěle jako důsledek leaku, dumping syndrom, dilatace vytvořeného žaludečního tubulu, subfrenický absces, vředová choroba, perzistující nauzea a zvracení, vznik striktury, nedostatečný váhový úbytek či gastroezofageální reflux v důsledku poškození antirefluxních mechanismů a další, které jsou uvedeny v následující tabulce.
Gastrický leak je popisován s incidencí 0–8 % [5,6,7,8] po primárních operacích a 16–24 % po reintervencích [7]. Vede k vytvoření infikované intraabdominální kolekce, a pokud není včas a efektivně řešen, dochází ke vzniku septického stavu s možným multiorgánovým selháním či ke vzniku chronické gastrické píštěle. Nejčastěji (v 75 %) je místo leaku lokalizováno v horní třetině žaludku v blízkosti gastroezofageální junkce [6]. Za příčinu leaku v této lokalizaci je považován vysoký intraluminální tlak ve vztahu k vertikálnímu typu tubulizace. Leak, který je lokalizován distálně, tedy v úrovni antra žaludku, má příčinu rozdílnou. Zde je dáván do souvislosti s tloušťkou žaludeční stěny. Je všeobecně známo, že tloušťka stěny žaludku je v jednotlivých částech rozdílná, v oblasti antra žaludku to je 3,1 mm, tělo žaludku má tloušťku stěny 2,4 mm a fundus 1,7 mm [9]. Silnější stěna v oblasti antra tak může znemožnit kompletní uzavření i při použití nejdelších (zelených) svorek stapleru. Právě použití níže uvedeného stapleru s bio vstřebatelnou komponentou může zvýšit tloušťku sevření svorek o 0,5 mm a zabránit tak vzniku leaku v této lokalizaci.
Etiologie gastrického leaku je dvojí, a to mechanická a ischemická. Leak, který vzniká do 48 hodin po operaci, je většinou etiologie mechanické. Může být způsoben technickou chybou při operaci, iatrogenním poraněním, použitím nevhodných nástrojů či při dříve nezjištěné obstrukci distálně od tubulizovaného žaludku. Právě tomuto typu leaku může zabránit ošetření resekční linie [10]. Leak, který se objeví za 5–7 dnů po operaci, je způsoben převážně ischemií tubulu [6,10].
Aby četnost leaku byla co nejnižší, je nezbytná pečlivá skeletizace bez porušení cévního zásobení malé křiviny, užití staplerů s adekvátní délkou svorek a šetrná manipulace s termickými nástroji.
Kontroverzní zůstává rutinní použití intraoperačních diagnostických metod (peroperační endoskopie, vzduchová zkouška či aplikace metylenové modři), protože ani negativita těchto testů nevylučuje následnou insuficienci staplerové linie [6]. Nicméně v případě peroperačního podezření na insuficienci staplerové linie jsou tyto diagnostické metody indikovány selektivně. V našem případě jsme používali intraoperační zkoušku metylenovou modří rutinně, právě tak jako kontrolu vodnou kontrastní látkou první pooperační den.
Resekční linie může být pojištěna přešitím pokračovacím vstřebatelným stehem nebo použitím lineárního stapleru se specifickou vstřebatelnou komponentou, která si své vlastnosti uchovává 4–5 týdnů a kompletně se vstřebá do 6 měsíců. Dále se k pojištění staplerové resekční linie mohou použít proužky z bovinního perikardu [10] nebo prasečí submukóza z tenkého střeva jako kompletně resorbovatelný acelulární xenograft [9].
Dalším materiálem, který se může využít k posílení resekční linie, je nevstřebatelný expandovaný polytetrafluoretylen (ePTFE). Ve studii publikované v roce 2010 Dapri [9] analyzoval 3 skupiny pacientů. V jedné skupině staplerová linie nebyla ničím ošetřena, u druhé skupiny byla pojištěna pokračovací suturou vstřebatelným stehem a u třetí skupiny byl použit speciální stapler s bioabsorbovatelnou komponentou (biokompatibilní a neantigenní kyselina polyglykolidová a trimetylen-karbonát). Nebyly zjištěny rozdíly v četnosti pooperačního leaku v jednotlivých skupinách, ale v případě použití stapleru se speciální komponentou byla nižší jak peroperační, tak celková krevní ztráta.
Nicméně většina současných studií jednoznačně neprokázala, že ošetření resekční linie statisticky významně ovlivňuje četnost výskytu gastrického leaku [6]. Příkladem může být práce, kterou publikoval Bellanger a Greenway, kteří používají ke kalibraci 34 Fr sondu, resekční linii neošetřují a u 529 po sobě jdoucích pacientů se leak nevyskytl ani jednou [11]. Jedna z posledních publikovaných metaanalýz z roku 2012 [8] ukázala, že ošetření staplerové linie vede k poklesu výskytu leaku z linie svorek, ale bez statistické významnosti.
Možnosti, jak řešit gastrický leak, jsou radiologické, endoskopické a chirurgické. Všechny zmíněné možnosti je nutné doplnit obecně známou léčbou sepse s parenterální či enterální nutricí a antibiotickou terapií. Optimální řešení infikované intraabdominální kolekce v souvislosti s leakem by mělo být co nejvíce miniinvazivní. V současné době jsou evakuace a drenáž pod CT kontrolou u indikovaných pacientů adekvátní alternativou laparoskopické či otevřené chirurgické intervence [12].
Endoskopické řešení je indikováno v případě chronické gastrické píštěle, kdy je vnitřní ústí možno ošetřit endoluminálními stenty, klipy, injekcí fibrinu či endoskopicky zašít.
Možnosti chirurgického řešení jsou zavést píštělí gastrostomickou kanylu, našít serózní záplatu z tenkého střeva, Roux-Y anastomózu tenkého střeva na místo leaku, v případě distálního leaku původní tubulus konvertovat na gastrický bypass s resekcí místa leaku nebo kompletně odstranit tubulus s následnou rekonstrukcí ezofagojejunoanastomózou.
Krvácení ze staplerové linie je v literatuře popisováno s incidencí 0–8,7 % [13]. Místo krvácení je nejčastěji z dlouhé linie svorek nebo z přerušené tukové tkáně podél velké křiviny a často si vyžádá operační revizi a substituci krevními deriváty.
Právě přešívání resekční linie vstřebatelným pokračovacím stehem je diskutováno ve vztahu k hemostáze [5]. V roce 2012 publikovaná metaanalýza [8] zjistila, že staplery s výše uvedenými komponenty vedou ke snížení krvácení z linie svorek. Překvapivé bylo zjištění, že po přešití resekční linie bylo krvácení větší, ale bez statistické významnosti. Jako příčina je zvažována rovněž možnost krvácení z míst vpichů. Sutura navíc musí být prováděna pečlivě tak, aby v pozdějším pooperačním období nedošlo ke striktuře tubulu. Závěrem této metaanalýzy bylo, že posílení resekční linie stehem se neukazuje jako bezpečnější alternativa nejen stran hemoragie, ale i leaku a celkové četnosti komplikací. Nicméně tako metaanalýza vychází z devítí studií, z nichž pouze dvě byly randomizované a navíc jedna z těchto randomizovaných studií byla velmi nízké metodologické kvality [14]. Navíc heterogenita srovnávaných souborů, nízké počty pacientů v některých souborech a selekce pacientů představují významnou limitaci spolehlivosti výsledků této metaanalýzy, a k jejím závěrům je proto nutno přistupovat opatrně.
Pro přehlednost jsou uvedeny další možné komplikace vyskytující se dle literárních údajů po sleeve resekci žaludku v tabulce (Tab. 3).
Table 3. Komplikace po sleeve resekci žaludku (bez leaku a krvácení) Tab. 3: Complications after gastric sleeve resection (without leak and bleeding) 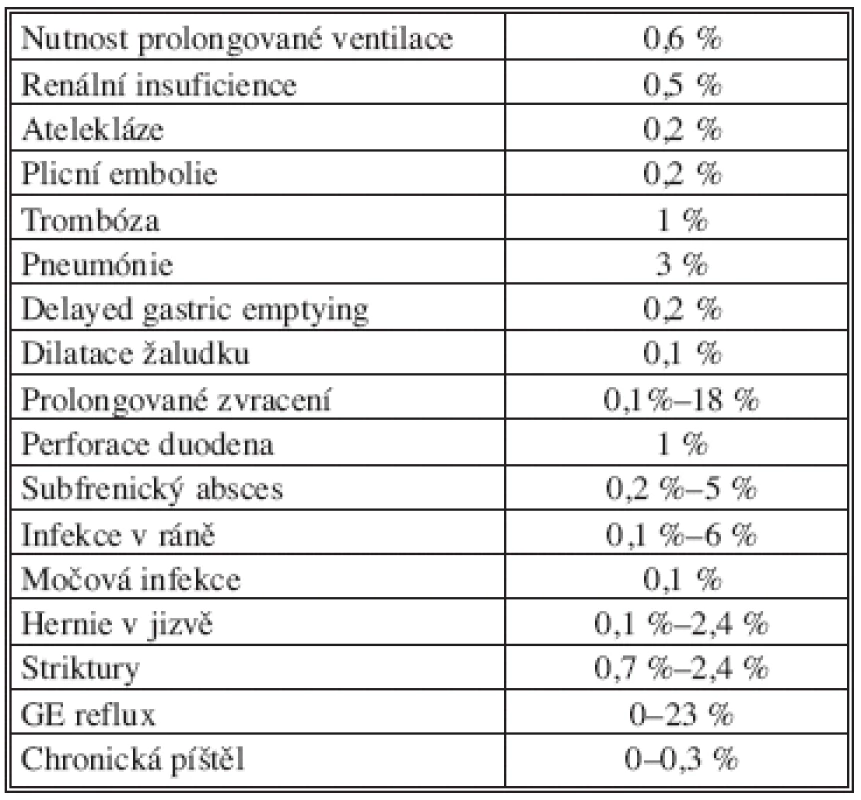
Závěr
Sleeve resekce žaludku je bezpečná operace s nízkou morbiditou a mortalitou. Naše studie ukázala pozitivní vliv přešití staplerové linie na snížení výskytu pooperačního krvácení z místa resekce. Vliv na event. snížený výskyt leaku jsme neprokázali. Nicméně v obou skupinách, a to jak bez přešití, tak s přešitím, byl výskyt leaku velice nízký. Přešití staplerové linie přináší prodloužení operačního času, ale představuje benefit pro pacienty. Závisí na zkušenostech každého jednotlivého centra.
Doc. MUDr. Pavel Zonča PhD., FRCS.
Ruskova 681
724 00 Ostrava
e-mail: pavel.zonca@fno.cz
Sources
1. Kasalický M. Pohled na současnou bariatricko-metabolickou chirurgii. Rozhl Chir 2012;91 : 5–11.
2. Kasalický M. Sleeve gastrectomy – tubulizace žaludku. Rozhl Chir 2013;92 : 58–60.
3. Almogy G, Crookes PF, Antone GJ. Longitudinal gastrectomy as a treatment for the high - risk super - obese patient. Obes Surg 2004;14 : 492–497.
4. Ren CJ, Patterson E, Gagner M. Early results of laparoscopic biliopancreatic diversion with duodenal switch: a case series of 40 consecutive patients. Obes Surg 2000;10 : 514–523.
5. Frezza EE, Reddy S, Gee LL, Wachtel MS. Complications After Sleeve Gastrectomy for Morbid Obesity. Obes Surg 2009;19 : 684–687.
6. Pech N, Meyer F, Lippert H, Manger T, Stroh Ch. Complications and nutrient deficiencies two years after sleeve gastrectomy BMC Surgery 2012;12 : 13.
7. Stroh Ch, Birk D, Flade - Kuthe R, Frenken M, Herbig B, et al. Bariatric Surgery Working Group Results of Sleeve Gastrectomy - data from a Nationwide Survey on Bariatric Surgery in Germany. Obes Surg 2009;19 : 632–640.
8. Himpens J, Dobbeleir J, Peeters G. Long-term Results of Laparoscopic Sleeve Gastrectomy for Obesity. Ann Surg 2010;252 : 319–324.
9. Lalor PF, Tucker ON, Szomstein S, Rosenthal RJ. Complications after laparoscopic sleeve gastrectomy. Surgery for Obesity and Related Diseases 2008;4 : 33–38.
10. Miguel GP, Azevedo JL, de Souza PH, de Siqueira Neto J, Mustafa F, Zambrana ES, de Carvalho PS. Erosive Esophagitis after Bariatric Surgery: Banded Vertical Gastrectomy versus Banded Roux-en-Y Gastric Bypass, Obes Surg 2011;21 : 167–172.
11. Rosenthal RJ. International Sleeve Gastrectomy Expert Panel, Diaz AA, Arvidsson D, Baker RS, Basso N, Bellanger D, Boza C, El Mourad H, France M, Gagner M, Galvao-Neto M, Higa KD, Himpens J, Hutchinson CM, Jacobs M, Jorgensen JO, Jossart G, Lakdawala M, Nguyen NT, Nocca D, Prager G, Pomp A, Ramos AC, Rosenthal RJ, Shah S, Vix M, Wittgrove A, Zundel N. International Sleeve Gastrectomy Expert Panel Consensus Statement: best practice guidelines based on experience of >12,000 cases. Surg Obes Relat Dis 2012;8 : 8–19.
12. Gagner M, Deitel M, Kalberer TL, Erickson AL, Crosby RD. The Second International Consensus Summit for Sleeve Gastrectomy, March 19–21, 2009. Surg Obes Relat Dis 2009;5 : 476–85.
13. Chopra A, Chao E, Etkin Y, Merklinger L, Lieb J, Delany H. Laparoscopic sleeve gastrectomy for obesity: can it be considered a definitive procedure? Surg Endosc 2012;26 : 831–7.
14. Chiu S, Birch DW, Shi X, Sharma AM, Karmali S. Effect of sleeve gastrectomy on gastroesophageal reflux disease: a systematic review. Surg Obes Relat Dis 2011;7 : 510–5.
15. Sammour T, Hill AG, Singh P, Ranasinghe A, Babor R, Rahman H. Laparoscopic sleeve gastrectomy as a single - stage bariatric procedure. Obes Surg 2010;20 : 271–275.
16. Sakran N, Goitein D, Raziel A, Keidar A, Beglaibter N, Grinbaum R, Matte I, Alfici R, Mahajna A, Waksman I, Shimonov M, Assalia A. Gastric leaks after sleeve gastrectomy: a multicenter experience with 2,834 patients. Surg Endosc 2012; DOI 10.1007/ s00464-012-2426-x.
17. Márquez MF, Lozano RB, Ayza MF. Technical controversies in laparoscopic sleeve gastrectomy. Obes Surg 2012;22 : 182–187.
18. Choi YY, Bae J, Hur KY, Choi D, Kim YJ. Reinforcing the staple line during laparoscopic sleeve gastrectomy: does it have advantages – A meta - analysis. Obes Surg 2012;22 : 1206–1213.
19. Dapri G, Cadiere GB, Himpens J. Reinforcing the staple line during laparoscopic sleeve gastrectomy: prospective randomized clinical study comparing three different techniques. Obes Surg 2010;20 : 462–467.
20. Chen B, Kiriakopoulos A, Tsakayannis D, Wachtel MS, Linos D, Frezza EE. Reinforcement does not necessarily reduce the rate of staple line leaks after sleeve gastrectomy. A review of the literature and clinical experiences. Obes Surg 2009;19 : 166–172.
21. Bellanger DE, Greenway FL. Laparoscopic sleeve gastrectomy, 529 cases without a leak: short - term results and technical considerations. Obes Surg 2011;21 : 146–150.
22. Kelogrigoris M, Sotiropoulou E, Stathopoulos K, Georgiadou V, Philippousis P, Thanos L. CT - guided percutaneous drainage of infected collections due to gastric leak after sleeve gastrectomy for morbid obesity: initial experience. Cardiovasc Intervent Radiol 2011;34 : 585–589.
23. Frezza EE, Reddy S, Gee LL, Wachtel MS. Complications after sleeve gastrectomy for morbid obesity. Obes Surg 2009;19 : 684–687.
24. Musella M, Milona M, Bellini M, et al. Laparoscopic sleeve gastrectomy. Do we need to oversew the staple line? Ann Ital Chir 2011;82 : 273–277.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2013 Issue 7-
All articles in this issue
- Kdy potřebuje chirurgický pacient parenterální výživu
- Staplerová linie u sleeve resekce žaludku
- Peroperační CT navigace u operací páteře a pánve: první zkušenosti
- CT – diagnostika zlomeniny lopatky
- Opakovaná reoperace selhané DHS: klinická a biomechanická analýza – kazuistika
- Ileocékalna aktinomykóza – kazuistika
- Divertikulární choroba tračníku – zobrazovací metody
- Divertikulární choroba tračníku – chirurgická léčba
- Laparoskopická resekce sigmatu pro divertikulární chorobu
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Laparoskopická resekce sigmatu pro divertikulární chorobu
- Divertikulární choroba tračníku – chirurgická léčba
- Divertikulární choroba tračníku – zobrazovací metody
- Staplerová linie u sleeve resekce žaludku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

