-
Medical journals
- Career
Reexpanzní edém plíce po drenáži dlouhotrvajícího spontánního pneumotoraxu – kazuistika
Authors: D. Myšíková; J. Šimonek; A. Stolz; R. Lischke
Authors‘ workplace: III. chirurgická klinika 1. LF UK a FN Motol, přednosta kliniky: Prof. MUDr. R. Lischke, PhD.
Published in: Rozhl. Chir., 2013, roč. 92, č. 6, s. 333-336.
Category: Case Report
Podpořeno MZ ČR – RVO, FN v Motole 00064203
Overview
Reexpanzní plicní edém (RPE) je vzácná, ale potenciálně letální komplikace hrudní drenáže pro pneumotorax. Morbidita a mortalita RPE jsou vysoké, až 20 % případů končí smrtí, proto si zasluhuje naši pozornost. Uvádíme kazuistiku ipsilaterálního levostranného edému po zavedení hrudního drénu u 42letého muže se spontánním pneumotoraxem. Můžeme předpokládat trvání pneumotoraxu až 3 týdny (od první prezentace náhlé dušnosti a bolesti na hrudi). Patofyziologie tohoto plicního postižení nebyla zatím zcela objasněna, ale pravděpodobně hlavní roli v rozvoji RPE hraje poškození endotelu, které je následováno zvýšenou endoteliální permeabilitou během ischemicko-reperfuzního poranění plíce. Hlavní rizikové faktory pro rozvoj RPE jsou mladší věk (čím mladší pacient, tím větší riziko), ženské pohlaví, velikost kolapsu plíce, pneumotorax trvající déle než 24 hodin, reexpanze plíce do deseti minut, použití aktivního sání a v případě fluidotoraxu evakuace více než 2000 ml výpotku. U pacientů s těmito rizikovými faktory není vhodné iniciálně užít drenáže s aktivním sáním, přesto je tento postup v ČR běžný. Hrudní chirurgové užívají podtlakové drenáže častěji než pneumologové (70 % versus 52 %). Manifestace rozvíjejícího se RPE kolísá od benigního klinického průběhu (pacient bez subjektivních obtíží, ale s nálezem charakteristickým pro RPE na RTG plic) až k potenciálně letálnímu průběhu s rychle progredujícím respiračním selháním. U většiny pacientů se RPE vyvine během první hodiny reexpanze a postižena je ipsilaterální plíce. Jen velmi vzácně může být plicní edém bilatelární či kontralatelární. Léčba RPE je podpůrná a řídí se dle individuálního stavu pacienta, od pouhého monitorování až po umělou plicní ventilaci u závažnějších případů respiračního selhání. Zlatým standardem v léčbě RPE zůstává mechanická ventilace s pozitivním tlakem na konci exspiria (PEEP).
Klíčová slova:
reexpanzní plicní edém – pneumotorax – akutní respirační selháníÚVOD
Reexpanzní plicní edém (RPE) je vzácná, ale potenciálně letální komplikace hrudní drenáže pro pneumotorax. Morbidita a mortalita RPE jsou vysoké, až 20 % případů končí smrtí [1], proto si zasluhuje naši pozornost. Uvádíme kazuistiku ipsilaterálního levostranného edému po zavedení hrudního drénu u 42letého muže se spontánním pneumotoraxem. Můžeme předpokládat trvání pneumotoraxu až 3 týdny (od první prezentace dušnosti a bolesti na hrudi). Hlavní roli v patofyziologii reexpanzního edému hraje poškození endotelu, které je následováno zvýšenou endoteliální permeabilitou během ischemicko-reperfuzního poranění plíce [2]. Léčba RPE je podpůrná dle individuálního stavu pacienta, závažnější případy respiračního selhání většinou vyžadují umělou plicní ventilaci (UPV) v kombinaci s diuretiky a kortikosteroidy [3].
Kazuistika
42letý muž byl odeslán od praktického lékaře (PL) se snímkem plic, který byl zhotoven předchozí den, zobrazoval kompletní levostranný pneumotorax s přesunem mediastina na pravou stranu, známku počínajícího tenzního pneumotoraxu (Obr. 1). Pacient datoval počátek obtíží před třemi týdny, kdy začal být náhle dušný po probuzení a cítil bolest na hrudi. V den počátku obtíží byl vyšetřen na pohotovosti, pro suspektní infekt horních cest dýchacích byla nasazena antibiotika a antitusika. Pro přetrvávající kašel indikoval po třech týdnech praktický lékař výše zmíněný snímek hrudníku a až následující den odeslal pacienta k ošetření na chirurgickou ambulanci. Při přijetí udával pacient dušnost při mírné námaze, klidově byl eupnoický a negoval bolest na hrudi. Fyzikální vyšetření odhalilo vymizelé dýchání vlevo, tachykardii 125/min. Leukocytóza 12 tis. leukocytů byla jediným patologickým laboratorním nálezem, ostatní laboratorní hodnoty byly v mezích normy. Pacient byl indikován k hrudní drenáži. Hrudní drén byl zaveden ve střední axilární čáře ve 4. mezižebří, při otevření pleurální dutiny byl patrný únik vzduchu. Vzhledem k dušnosti a dráždivému kašli při reexpanzi plíce po zavedení hrudního drénu nebylo použito aktivní sání a drén byl ponechán na spád. Oproti očekávání se po drenáži stav pacienta postupně zhoršoval během následujících dvou hodin. Progredovala tachykardie až na 120/min, tachypnoe 23 dechů/min, saturace klesala na 83 % přes suplementaci kyslíku FiO2 0.6 CPAP maskou, pacient byl normotenzní, poslechově vlevo inspirační chrůpky, dýchání oslabené, drén odvedl 150 ml serózní tekutiny. Byl proveden snímek hrudníku s nálezem homogenního zastření levého hemitoraxu, dále krevní plyny pO2 59 mmHg, pCO2 36 mmHg, pO2/FiO2 index 98 mmHg. Pacient byl pro progresi akutního respiračního selhání zaintubován a stabilizován na mechanické ventilaci P-SIMV s PEEP 12 mm Hg a vysokým FiO2 (0, 7). CT vyšetření plic provedené po stabilizaci ukázalo difúzní konsolidaci plicní tkáně vlevo s bronchogramem a bulou (66x49 mm) lokalizovanou v dolním laloku (Obr. 2). Byla provedena bronchoskopie, při které odsáváno velké množství edematózní tekutiny z levé plíce. Pacient byl polohován na levý bok. Oxygenace se rychle zlepšovala při mechanické ventilaci, ale bylo třeba udržovat hlubokou analgosedaci, neboť každá interference s ventilátorem vedla k rychlé desaturaci. Byla nutná oběhová podpora ionotropiky 5 dní (Noradrenalin do dávky 0,3 μg/kg/min) a podpůrná léčba kortikosteroidy (Hydrocortisone 100 mg/den), diuretiky (Furosemid kontinuálně dle aktuální diurézy), dále antibiotiky pro výraznou vstupní leukocytózu 33 tis. leukocytů (Augmentin 3x1,2 g/den + Ciprofloxacin 2x600 mg/den), profylaktická léčba LMWH jako prevence plicní embolie (Fraxiparin 2x0,6 ml/den). Kontrolní RTG vyšetření plic vždy se vzdušnější plící. Pacienta bylo možné extubovat 4. pooperační den, nadále byl po 2 dny zajištěn CPAP maskou, 7. pooperační den po kontrolním snímku plic, který ukázal kompletní regresi plicního edému, byl odstraněn hrudní drén a pacient byl za dva dny propuštěn do domácího léčení. Kontrolní CT vyšetření dva měsíce po propuštění ukázalo zcela rozvinutou levou plíci, bez známek plicního edému se stabilní bulou v levém dolním laloku. Pacientovi byla doporučena elektivní bulektomie.
Image 1. Snímek hrudníku odhalující kompletní levostranný kolaps plíce s přesunem mediastina na pravou stranu Fig. 1: Chest radiography showing complete left-sided collapse of the lung and shift of the mediastinum to the right 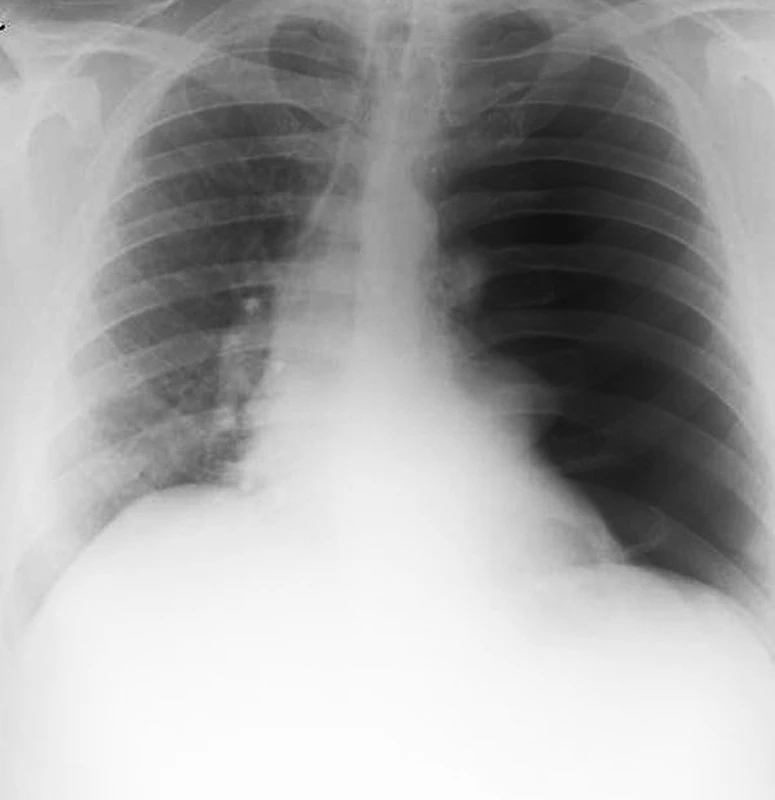
Image 2. CT vyšetření hrudníku odhalující difúzní konsolidaci plicní tkáně vlevo s bulou lokalizovanou v dolním laloku Fig. 2: CT scan of the thorax showing diffuse consolidation of the left lung tissue with a bulla localized in the left lower lobe 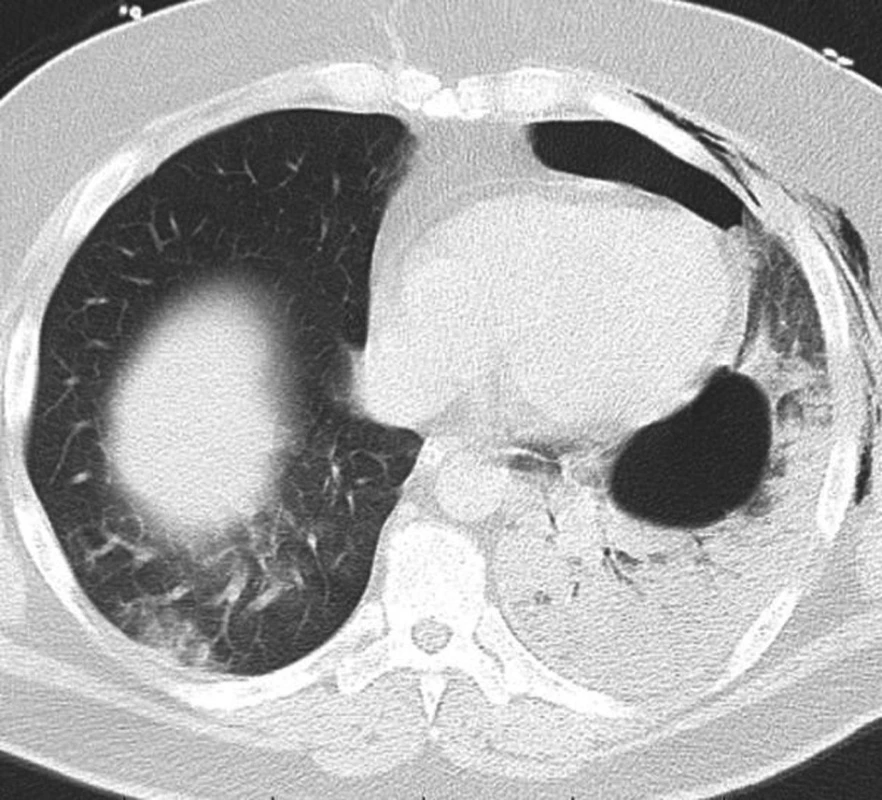
DISKUZE
RPE je vzácná, ale závažná a potenciálně život ohrožující komplikace po reexpanzi kolabované plíce. RPE úzce souvisí s evakuací velkého množství vzduchu či tekutiny z pleurální dutiny během hrudní drenáže, může následovat i VATS talkáž [4] nebo exstirpace mediastinálního tumoru [5]. První RPE byl popsán Pinaultem po torakocentéze a evakuaci velkého množství výpotku v roce 1853 [6], jako následek pneumotoraxu byl RPE poprvé zmíněn Carlsonem v roce 1958 [7].
Incidence RPE je velmi nízká a obtížně kvantifikovatelná. Ve třech velkých studiích případů týkajících se spontánního pneumotoraxu uveřejněných Peatfieldem v roce 1979 (3347 případů), Brooksem v roce 1973 (376 případů) a Millsem v roce 1965 (400 případů) nebyl zaznamenán ani jeden případ RPE [8,9,10].
RPE je vzácnější komplikací ve skupině drenovaných spontánních pneumotoraxů v porovnání se skupinou fluidotoraxů, důvodem může být náhlá manifestace spontánního pneumotoraxu, která vede k časnější drenáži, a tedy i kratšímu kolapsu postižené plíce. Mezi roky 1958 a 1987 Mahfood a kol. analyzoval všech 47 publikovaných případů RPE a popsal hlavní rizikové faktory pro rozvoj RPE – mladší věk (čím mladší pacient, tím větší riziko), ženské pohlaví, velikost kolapsu plíce, pneumotorax trvající déle než 24 hodin, reexpanze plíce do deseti minut, použití aktivního sání a, v případě fluidotoraxu, evakuace více než 2000 ml výpotku [1]. U pacientů s těmito rizikovými faktory není vhodné iniciálně užít drenáže s aktivním sáním [11], přesto je tento postup v České republice běžný. Hrudní chirurgové užívají podtlakové drenáže častěji než pneumologové (70 % versus 52 %). Heimlichova chlopeň se používá jen výjimečně (1 %) [12].
Manifestace rozvíjejícího se RPE kolísá od benigního klinického průběhu (pacient bez subjektivních obtíží, ale s nálezem charakteristickým pro RPE na RTG plic) až k potenciálně letálnímu průběhu s rychle progredujícím respiračním selháním. Mortalita v Mahfoodově skupině byla 19 %. Nejčastějšími projevy jsou kašel, často produktivní s množstvím zpěněného růžového sputa, dušnost během nebo besprostředně následující torakocentézu či drenáž, dalšími symptomy mohou být tachykardie, febrilie, hypotenze, nauzea, zvracení, cyanóza. U většiny pacientů (v Mahfoodově skupině u 2/3) se RPE vyvine během první hodiny reexpanze a mezi 24. a 48. hodinou jsou postiženi zbylí pacienti [1]. Na snímku plic je patrný plicní edém většinou ipsilaterální plíce. Jen velmi vzácně může být plicní edém bilatelární či kontralatelární.
Patofyziologie tohoto plicního postižení nebyla zatím zcela objasněna, ale pravděpodobně hlavní roli v rozvoji RPE hraje poškození endotelu, které je následováno zvýšenou endoteliální permeabilitou během ischemicko-reperfuzního poranění plíce [13]. Hypoxie během kolapsu plíce vede k hypoxemické plicní vasokonstrikci, která působí ischemii plicní tkáně a zhoršuje odplavování metabolitů. Reexpanze poté zvýší průtok krve plící a tato reperfuze může vyvolat kaskádu nežádoucích reakcí, které ve svém důsledku plicní tkáň poškozují. Toto poškození je zprostředkováno množstvím mechanismů zahrnujících prozánětlivé mediátory a kyslíkové radikály zvyšující endoteliální permeabilitu, což následně vede k plicnímu edému. Reperfuzní edém je známější a častější komplikací následující plicní transplantaci, v různém rozsahu se objevuje až u 50 % transplantovaných pacientů [14,15].
Léčba RPE je podpůrná, záleží na závažnosti poranění plíce, respektive na individuálním stavu pacienta. Kolísá od pouhého monitorování pacienta bez jakékoliv intervence až po umělou plicní ventilaci u závažnějších případů respiračního selhání. Zlatým standardem v léčbě RPE zůstává mechanická ventilace s pozitivním tlakem na konci exspiria (PEEP) v indikovaných případech [16]. Pacienti s častějším výskytem interference s ventilátorem mívají hlubší hypoxemii vyžadující vyšší PEEP, což svědčí pro závažnější poranění plíce s celkově delší dobou UPV [17]. Dále byly publikovány alternativní metody léčby RPE včetně CPAP masky (continuous positive airway pressure) či selektivní plicní ventilace [18].
Závěr
V případě našeho pacienta byly s největší pravděpodobností podceněny nebo přehlédnuty první příznaky rozvíjejícího se pneumotoraxu, což vedlo ke špatné diagnóze na počátku a oddálení odpovídající léčby. Pacient si stěžoval na dušnost a byl léčen antibiotiky po 3 týdny, teprve poté byl proveden snímek hrudníku, který odhalil kompletní kolaps levé plíce. Vážný stav pacienta byl pravděpodobně následkem většího ischemicko-reperfuzního poranění po dlouhodobém kolapsu plicního křídla. Akutní respirační selhání si pak vyžádalo agresivnější léčbu k udržení vitálních funkcí.
MUDr. Dagmar Myšíková
III.chirurgická klinika FNM a 1.LF UK
V Úvalu 84
158 06 Praha 5
e-mail: d.mysikova@seznam.cz
Sources
1. Mahfood S, Hix WR, Aaron BL, et al. Reexpansion pulmonary edema. Ann Thorac Surg 1998;45 : 340–345.
2. Sivrikoz MC, Tuncozgur B, Cekman M, et al. The role of tissue reperfusion in the reexpansion injury of the lungs. Euro J Cardiothorac Surg 2002;22 : 721–7.
3. Iqbal M, Multz AS, Rossoff LJ, et al. Reexpansion pulmonary edema after VATS successfully treated with continuous positive airway pressure. Ann Thorac Surg 2000;70 : 669–71.
4. de Campos JRM, Vargas FS, Werebe EDC. Thoracoscopy talc poudrage.Chest 2001,119 : 801–806.
5. Matsumiya N, Dohi S, Kimura T, Naito H. Reexpansion pulmonary edema after mediastenal tumor removal. Anesth Analg 1991;73 : 646–8.
6. Pinault H. Considérations cliniques sur la thoracentŹse.[doctoral thesis]. Paris 1853.
7. Carlson RL, Classen KL, Gollan F, et al. Pulmonary edema following the rapid expansion of a totally collapsed lung due to pneumothorax: A clinical and experimental study. Surg Forum 1958;9 : 367–371.
8. Peatfield RC, Edwards PR, Johnson NMcI: Two unexpected deaths from pneumothorax. Lancet 1979;1 : 356–8.
9. Brooks JW. Open thoracotomy in the management of spontaneous pneumothorax. Ann Surg 1973;177 : 795–805.
10. Mills M, Balsch BF. Spontaneous pneumothorax: a series of 400 cases. Ann Thorac Surg 1965;1 : 286–97.
11. Baumann MH, Strange C, Heffner JE, Light R, Kirby TJ, Klein J, Luketich JD, Panacek EA, Sahn SA. Management of spontaneous pneumothorax: an American College of Chest Physicians Delphi consensus statement. Chest 2001;119,2 : 590–602.
12. Stolz A, Harustiak T, Pafko P. Spontaneous pneumothorax management. Eur Surg 2008;40,4 : 1–613.
13. Sivrikoz MC, Tuncozgur B, Cekman M, et al. The role of tissue reperfusion in the reexpansion injury of the lungs. Euro J Cardiothorac Surg 2002;22 : 721–7.
14. Hidalgo MA, Shah KA, Fuller BJ, Green CJ. Cold ischemia-induced damage to vascular endothelium results in permeability alterations in transplanted lungs. J Thorac Cardiovasc Surg 1996;112 : 1027–1035.
15. Christie JD, Bavaria JE, Palevsky HI, Litzky L, Blumenthal NP, Kaiser LR, Kotloff RM. Primary graft failure following lung transplantation. Chest 1998;114 : 51–60.
16. Iqbal M, Multz AS, Rossoff LJ, et al. Reexpansion pulmonary edema after VATS successfully treated with continuous positive airway pressure. Ann Thorac Surg 2000;70 : 669–71.
17. Thille AW. Patient-ventilator asynchrony during assisted mechanical ventilation. Intensive Care Med 2006;32 : 1515–1522.
18. Cho SR, Lee JS, Kim MS. New treatment method for reexpansion pulmonary edema: Differential lung ventilation. Ann Thorac Surg 2005;80 : 1933–4.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2013 Issue 6-
All articles in this issue
- Cirkumferenčný resekčný okraj v modernej liečbe karcinómu rekta
-
Radikalita resekční léčby pro karcinom rekta
Analýza prediktivních faktorů spojených s nekompletní mezorektální excizí -
Karcinom rekta do 10 cm
Srovnání radikality laparoskopické a otevřené operační techniky s ohledem na cirkumferentní resekční okraj a na kompletnost mezorektální excize - Anatomicko-chirurgická studie průběhu interkostobrachiálních nervů (ICBN) v axile při exenteraci I. a II. etáže axily u karcinomu prsu a maligního melanomu
- Reexpanzní edém plíce po drenáži dlouhotrvajícího spontánního pneumotoraxu – kazuistika
- De Garengeotova hernie komplikovaná inkarcerací a gangrenózní apendicitidou
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Reexpanzní edém plíce po drenáži dlouhotrvajícího spontánního pneumotoraxu – kazuistika
- Cirkumferenčný resekčný okraj v modernej liečbe karcinómu rekta
- De Garengeotova hernie komplikovaná inkarcerací a gangrenózní apendicitidou
- Anatomicko-chirurgická studie průběhu interkostobrachiálních nervů (ICBN) v axile při exenteraci I. a II. etáže axily u karcinomu prsu a maligního melanomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

