-
Medical journals
- Career
Cirkumferenčný resekčný okraj v modernej liečbe karcinómu rekta
Authors: P. Ihnát; L. Martínek 1,2; L. Ihnát Rudinská 1,2; M. Mitták 3; P. Vávra 1,2; P. Zonča 1,2 1,2
Authors‘ workplace: Katedra chirurgických oborů, Lékařská fakulta Ostravské Univerzity vedoucí katedry: Doc. MUDr. P. Zonča, Ph. D., FRCS 1; Chirurgická klinika, FN Ostrava, přednosta: Doc. MUDr. P. Zonča, Ph. D., FRCS 2; Ústav soudního lékařství, FN Ostrava, přednosta: MUDr. I. Dvořáček, Ph. D. 3
Published in: Rozhl. Chir., 2013, roč. 92, č. 6, s. 297-303.
Category: Review
Overview
Úvod:
V posledných rokoch získalo hodnotenie cirkumferenčného resekčného okraja (CRM) enormnú dôležitosť v manažmente pacientov s karcinómom rekta, a to nielen v predikcii prognózy pacientov, ale aj v stanovovaní presného stagingu ochorenia, v indikáciách multimodálnej liečby a v hodnotení kvality poskytovanej terapie.Metodika:
Autori ponúkajú prehľadový článok obsahujúci definíciu cirkumferenčného (radiálneho, laterálneho) resekčného okraja, techniku stanovovania CRM, vplyv CRM na prognózu a kvalitu poskytovanej terapie. Osobitný dôraz je kladený na hodnotenie CRM v kontexte multidisciplinárneho teamu. CRM musí totiž brať do úvahy rádiológ pri stanovovaní stagingu ochorenia, chirurg v priebehu operácie, patológ v čase dôsledného makroskopického a histopatologického hodnotenia preparátu a onkológ pri rozhodovaní o podávaní neoadjuvantnej/adjuvantnej terapie.Závěr:
Cirkumferenčný resekčný okraj predstavuje v súčasnosti základný aspekt v modernom prístupe k pacientom s karcinómom rekta. Zavedenie CRM hodnotenia do klinickej praxe malo za dôsledok presnejší staging ochorenia, relevantnejšie stanovovanie indikácií multimodálnej liečby, precíznejšiu operačnú techniku (TME), zvýšenie počtu sfinkter – zachovávajúcich operácií, zníženie počtu lokálnych recidív ochorenia a zlepšenie prežívania pacientov s karcinómom rekta.Kľúčové slová:
karcinóm rekta – cirkumferenční resekční okraj – totální mesorektální excise – multidisciplinární přístupÚVOD
Liečba karcinómu rekta sa v priebehu posledných troch desaťročí výrazne zmenila. Do klinickej praxe boli implementované dôležité zmeny v chirurgickom, patologickom, rádiologickom aj onkologickom prístupe k pacientom s týmto ochorením. Zároveň bola preukázaná nevyhnutnosť multidisciplinárneho prístupu s nutnosťou zostavovania individualizovaného liečebného plánu založeného na dôslednom a presnom stagingu ochorenia [1–3].
Až do 80tych rokov minulého storočia bol staging pacientov s diagnostikovaným karcinómom rekta založený na vyšetrení per rectum a rektoskopii. Resekcia bola indikovaná ak sa tumor javil resekabilný (pohyblivý pri per rectum vyšetrení), v opačnom prípade bola indikovaná predoperačná rádioterapia a ak došlo k downstagingu tak následná operácia. Lokálna recidíva bola pozorovaná u 30–40 % pacientov a 5ročné prežívanie bolo menej ako 40 % [1,2,4,5].
Zmeny v manažmente pacientov s karcinómom rekta boli spôsobené predovšetkým lepším pochopením anatómie panvy, zavedením precíznejšej chirurgickej techniky, implementáciou konceptu totálnej mezorektálnej excízie (TME), širším využívaním rádioterapie, resp. rádiochemoterapie a multidisciplinárnym prístupom. V dôsledku zavedených zmien sú v súčasnosti štandardne udávané početnosti lokálnych recidív do 10 % a 5ročný interval prežívania viac ako 60 % [1–4].
METODIKA
Chirurgická radikalita
Cieľom radikálnej chirurgickej operácie je úplné odstránenie nádorového tkaniva – R0 resekcia. Je pritom nevyhnutné dodržiavať základné technické princípy onkologickej radikality podľa Masona: odstránenie nádoru s bezpečnostným lemom včítane potenciálne zasiahnutých susedných štruktúr, anatomicky orientovaná disekcia regionálnych lymfatických ciest a zabránenie rozsevu nádorových buniek [2,4,5].
V chirurgii karcinómu rekta je rozlišovaný orálny (proximálny), aborálny (distálny) a cirkumferenčný (radiálny, laterálny) resekčný okraj. Musia byť preto striktne dodržiavané tri základné princípy radikality.
Proximálny princíp (proximálna radikalita)
Tento princíp je založený na poznatku, že lymfa z rekta odteká pozdĺž artérií, kde zisťujeme postihnutie lymfatických uzlín (LU). Uzlinové postihnutie je príčinou recidív nádoru a je dôležitým prognostickým faktorom [2,3]. Kompletné odstránenie lymfatického povodia preto zahŕňa ligatúru arteria a vena mesenterica inferior v blízkosti aorty. Hovoríme o tzv. vysokom podviazaní – „high tie“. Väčšia onkologická radikalita tohto postupu v porovnaní s nízkym podviazaním – „low tie“ – však nebola jednoznačne preukázaná v žiadnej kontrolovanej štúdii [2,3,6,7].
Distálny princíp (distálna radikalita)
Zatiaľ čo proximálny princíp sa týka dostatočnej resekcie spádových LU (pozdĺž prívodných ciev), distálny princíp je chápaný v kontexte bezpečnej vzdialenosti resekčnej línie na čreve. Za dostatočnú vzdialenosť resekčného okraja od tumoru rekta sa v súčasnosti považuje vzdialenosť 10cm orálnym smerom a 10–20mm aborálnym smerom [1,3,4]. Viaceré štúdie totiž preukázali, že 1cm vzdialenosť tumoru od aborálneho resekčného okraja na čreve je dostatočná, pretože väčšina tumorov sa longitudinálne (intramurálne) nešíri za túto vzdialenosť [2,8–10]. Bezpečná vzdialenosť distálnej resekčnej línie na rekte má v porovnaní s bezpečnou vzdialenosťou v oblasti mezorekta podstatne menší význam [2].
Laterálny princíp (laterálna radikalita)
Laterálny princíp zdôrazňuje nutnosť odstránenia rekta s kompletným mezorektom. Distálne šírenie karcinómu v uzlinách v mezorekte bolo identifikované až 4cm pod dolným okrajom nádoru. Preto je u nádorov lokalizovaných v hornej tretine rekta nutné viesť resekčnú líniu na mezorekte najmenej 5cm pod nádorom – hovoríme o tzv. parciálnej mezorektálnej excízii [2,4,5,11]. Zatiaľ čo u nádorov strednej a distálnej tretiny rekta je potrebné vykonať totálnu mezorektálnu excíziu.
Zásadnou podmienkou chirurgickej radikálnosti je dosiahnutie R0 resekcie, ktorá predstavuje nevyhnutný predpoklad pre zabránenie vzniku lokálnej recidívy a pre dlhodobé prežívanie pacientov. Kritériom R0 resekcie je, že všetky resekčné línie musia byť bez makroskopických a mikroskopických známok nádoru – teda negatívny distálny, proximálny a cirkumferenčný okraj [1,4,5, 10,11].
Aplikácia laterálneho princípu radikality u karcinómu rekta veľmi úzko súvisí s vyhodnocovaním cirkumferenčného resekčného okraja, ktoré je silne odporúčané všetkými platnými európskymi ako aj americkými guidelinami.
Cirkumferenčný resekčný okraj
Definícia
Cirkumferenčný resekčný okraj (circumferential resection margin – CRM), označovaný tiež ako radiálny alebo laterálny okraj, je chirurgicky vytvorená plocha disekcie v priebehu odstraňovania rekta a jeho uvoľňovania od okolitých tkanív [4,5,12]. CRM je teda definovaný ako neperitonealizovaný povrch resekčného preparátu vytvorený chirurgickou disekciou v subperitoneálnom, resp. retroperitoneálnom priestore [13].
Pre stanovenie – zmeranie CRM je potrebné nájsť miesto na povrchu preparátu vytvorené chirurgickou disekciou, ktoré je najbližšie miestu najhlbšej penetrácie tumoru (Obr. 1). CRM je považovaný za negatívny ak je tumor vzdialený viac ako 1mm od okraja, zatiaľ čo o pozitívnom CRM hovoríme ak je tumor prítomný v resekčnom okraji alebo je od neho vzdialený menej ako 1mm [4,5,12,13]. Autormi niekoľkých štúdií bolo síce navrhované považovať za pozitívny CRM už vzdialenosť ≤2mm, avšak toto nezískalo širšie uplatnenie [14]. V súčasnosti preto platí konsenzus pozitívneho CRM ak je vzdialenosť tumoru od okraja ≤1mm.
Image 1. Schematické znázornenie negativity/pozitivity cirkumferenčného resekčného okraja, ktorý je nafarbený tušou a) negatívny CRM, b) Lokálne pokročilý tumor rastúci do CRM c) malý tumor dosahujúci CRM v dôsledku nekompletnej excízie mezorekta (volně podle Nagtegaala [5]). Fig. 1: A diagram presenting the negativity/positivity of circumferential resection margin marked with black ink a) negative CRM, b) locally advanced tumour growing into CRM, c) small tumour invading CRM as a consequence of incomplete mesorectal excision (adapted from Nagtegaal [5]). ![Schematické znázornenie negativity/pozitivity cirkumferenčného resekčného okraja, ktorý je nafarbený tušou a) negatívny CRM, b) Lokálne pokročilý tumor rastúci do CRM c) malý tumor dosahujúci CRM v dôsledku nekompletnej excízie mezorekta (volně podle Nagtegaala [5]).
Fig. 1: A diagram presenting the negativity/positivity of circumferential resection margin marked with black ink a) negative CRM, b) locally advanced tumour growing into CRM, c) small tumour invading CRM as a consequence of incomplete mesorectal excision (adapted from Nagtegaal [5]).](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a38fc200e156f9029fbba0dfc8873e40.jpg)
Pri histologickom posudzovaní CRM je definovaných 6 rôznych typov pozitivity CRM: kontinuálne šírenie nádoru, diskontinuálne šírenie nádoru (vo forme satelitných depozitov), metastázou postihnutá lymfatická uzlina, venózna invázia, lymfatická invázia a perineurálne šírenie nádoru. Približne u 30 % pacientov s pozitívnym CRM bol pozorovaný viac ako jeden spôsob invázie CRM tumorom [15,16].
Technika stanovenia CRM
Popis a vyhodnocovanie CRM je otázkou vyspelosti patologického pracoviska [11]. Precízne posúdenie CRM patológom vyžaduje sériu transversálnych rezov preparátu, makroskopické posúdenie jednotlivých rezov, a adekvátne histologické vyšetrenie oblastí podozrivých z blízkosti tumoru k okraju [5,12,13].
Pionierom vo vypracovaní metodiky a popularizácii patologického posudzovania CRM v praxi je profesor Quirke z Leedsu, ktorý po prvý krát v r.1986 demonštroval závislosť vzniku lokálnej recidívy od pozitívneho CRM [15]. Quirke adoptoval techniku po prvýkrát popísanú Chanom v r.1985 [17]. Po makroskopickom vyhodnotení kompletnosti mezorektálnej excísie (viď nižšie), je celý cirkumferenčný okraj zafarbený čiernym tušom a preparát je fixovaný v 10% formalíne. Po fixácii je tumor a jeho okolie (2 cm orálnym a 2 cm aborálnym smerom) narezaný do série tenkých (5mm) rezov, ktoré sú orientované transverzálne vzhľadom na pozdĺžnu osu resekovaného preparátu [18]. Rezy sú následne fotografované a makroskopicky hodnotené (Obr. 2). Oblasti na ktorých sa javí makroskopická vzdialenosť tumoru od CRM najmenšia, sú následne spracované a mikroskopicky vyhodnotené vrátene presného merania vzdialenosti tumoru od CRM [18].
Image 2. Transverzálne rezy fixovaným preparátom rekta s tumorom; CRM nafarbený tušom (čierne šípky); preparát bol pozdĺžne nastrihnutý chirurgom a následne spracovaným Chanovou technikou patológom Fig. 2: Transversal sections of a fixed specimen of the rectum with tumour; CRM marked with black ink (black arrows); the specimen was primarily cut longitudinally by the surgeon and consequently processed by a pathologist using Chan’s technique 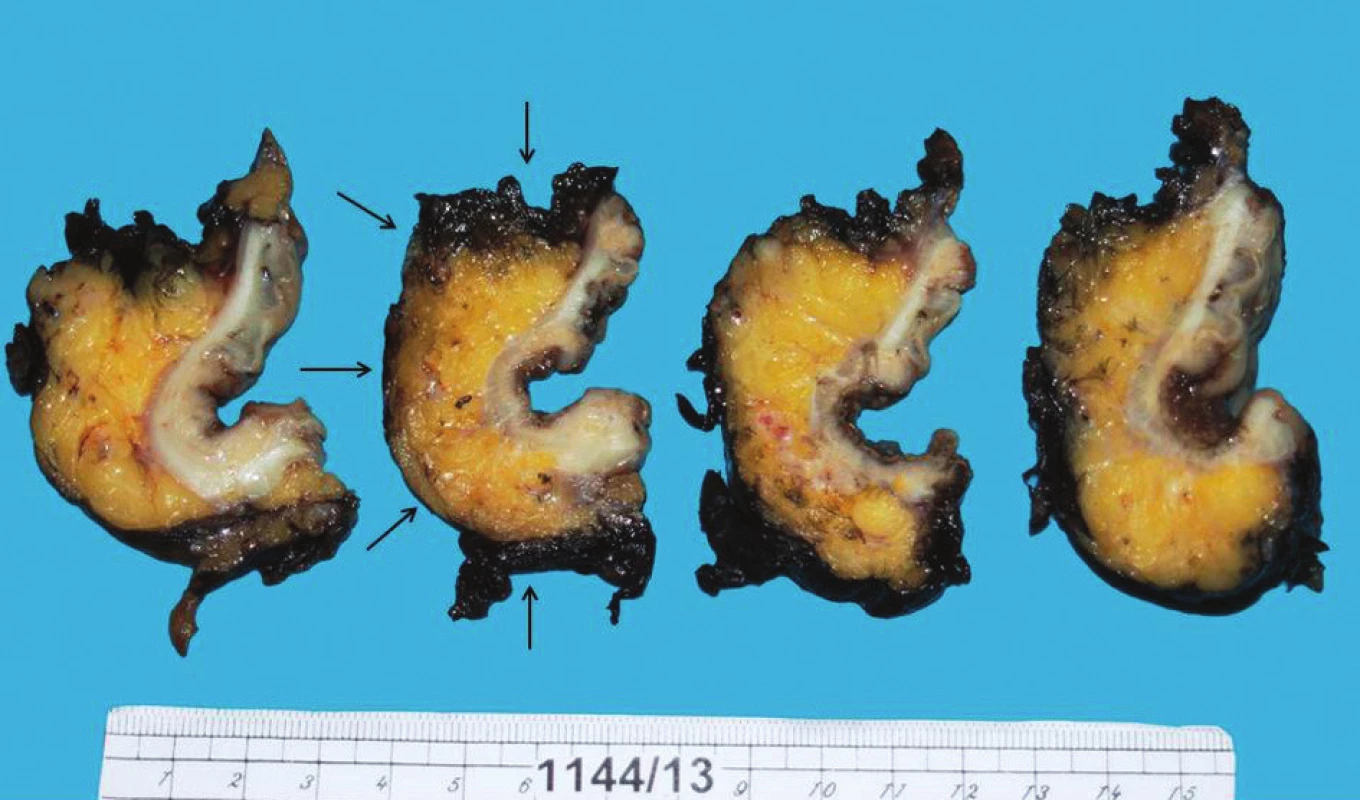
CRM v kontexte multidisciplinárného prístupu
V súčasnosti by mal multidisciplinárny prístup predstavovať štandard v liečbe pacientov s karcinómom rekta. Multidisciplinárny team zložený z odborníkov jednotlivých zainteresovaných špecializácií je zárukou komplexného prístupu a individuálneho terapeutického plánu pre každého pacienta [4].
Problematika CRM je fundamentálnym a integrujúcim faktorom v komplexnej starostlivosti o pacientov s karcinómom rekta. Koncept CRM totiž ovplyvňuje a premieta sa do činností všetkých členov multidisciplinárneho teamu:
Rádiológ
Dostupnosť rôznych efektívnych terapeutických možností v liečbe karcinómu rekta vedie k zvyšujúcemu sa úsiliu o presný predoperačný staging ochorenia, stratifikáciu rizika a individualizovanú liečbu [19]. Aplikácia neoadjuvantnej terapie má vedľajšie účinky, ktoré musia byť balancované v porovnaní s rizikami možného pozitívneho CRM, lokálnej recidívy či vzdialených metastáz [4,13,20,21].
Pre stanovenie optimálneho individuálneho terapeutického plánu je rozhodujúcim predpokladom čo najpresnejší staging karcinómu rekta vyjadrený vo forme TNM klasifikácie. MRI s vysokým rozlíšením vykazuje veľmi vysokú presnosť v zobrazení lokálnej pokročilosti nádoru a jeho vzťahu k fascia recti propria. MRI totiž umožňuje jasné zobrazenie fascia recti propria, ktorá sa na MRI scanoch (T1 aj T2 – vážených) zobrazuje ako slabý signál – tmavá línia ohraničujúca mezorektum [20,22] (Obr.3).
Image 3. T1-vážený axiálny MRI scan tumorom rekta s vyznačením fascia recti propria (biele šípky), ktorá predstavuje potenciálny chirurgický CRM Fig. 3: T1-weighted axial MRI through rectal tumour showing the fascia propria recti (white arrows), which presents potential surgical CRM 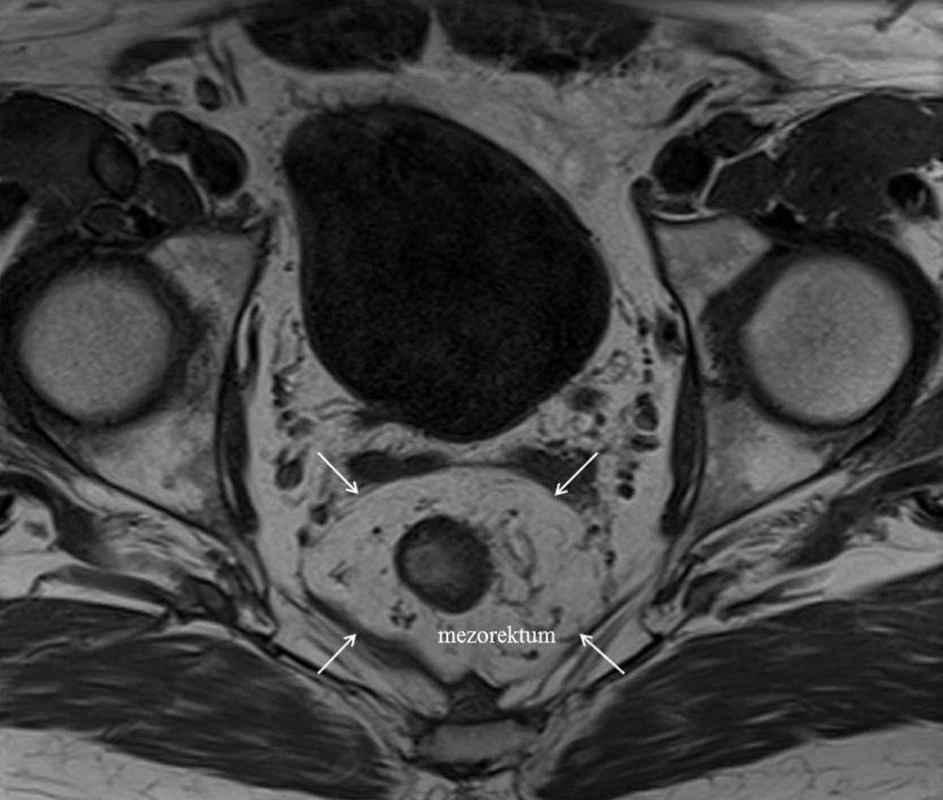
Keďže fascia recti propria je vrstvou v ktorej predpokladáme chirurgickú disekciu (v rámci techniky TME), táto vrstva zároveň zobrazuje budúci (potencionálny) cirkumferenčný resekčný okraj. Predoperačne je preto možné pomocou MRI presne posúdiť vzťah – vzdialenosť tumoru od tohto resekčného okraja.
V tomto smere bola veľmi prínosná práca publikovaná v roku 2008 Smithom, v ktorej bola zhrnutá problematika predoperačného stagingu karcinómu rekta pomocou MRI. Autori identifikovali nepriaznivé prognostické faktory na MRI scanoch a navrhli algoritmus rozdeľujúci rektálny karcinóm do troch skupín – „good, bad and ugly rectal carcinoma“.
Základné nepriaznivé prognostické faktory na MRI scanoch boli definované ako miera extramurálneho šírenia tumoru v mm, vzťah tumoru k mezorektálnej fascii, prítomnosť viacerých ako 4 metastáz v lymfatických uzlinách a extramurálna vaskulárna invázia [22]. Na základe vyhodnotenia prítomnosti, resp. neprítomnosti týchto faktorov na MRI je určené riziko vzniku lokálnej recidívy a vzdialených metastáz.
Pacienti s malým rizikom vzniku lokálnej recidívy a vzdialeného rozsevu ochorenia sú klasifikovaní ako „good rectal cancer“. Pacienti s prítomnosťou nepriaznivých prognostických faktorov na MRI svedčiacich pre zvýšené riziko vzniku vzdialených metastáz sú klasifikovaní ako „bad rectal cancer“, a pacienti so zvýšeným rizikom lokoregionálnej recidívy aj vzdialených metastáz ako „ugly rectal cancer“.
Na základe tohto rozdelenia sú potom pacienti s „bad and ugly“ karcinómom indikovaní najprv k neoadjuvantnej kombinovanej rádiochemoterapii, na ktorú nadväzuje chirurgická resekcia a adjuvantná chemoterapia. Pacienti s „good“ karcinómom sú indikovaní k primárnej chirurgickej liečbe a adjuvantná terapia je podávaná v závislosti na výsledkoch patologického vyhodnotenia resekovaných preparátov [21,22].
V kontexte multidisciplinárneho teamu na základe TNM klasifikácie a posúdenia MRI scanov (lokálna pokročilosť tumoru, jeho vzťah k potencionálnemu CRM a prítomnosť prognostických faktorov) je preto v súčasnosti odporúčaná selekcia pacientov s „bad and ugly rectal carcinoma“ k intenzívnej kombinovanej neoadjuvantnej liečbe zameranej nielen na redukciu veľkosti nádoru, ale aj na zníženie možnosti diseminácie ochorenia [19–23].
Chirurg
Koncept totálnej mezorektálnej excízie (TME) je jednoznačne najdôležitejším faktorom vo vývoji chirurgie rekta v priebehu posledných desaťročí. Po zavedení TME do praxe, došlo k dramatickej redukcii počtu lokálnych recidív a k výraznému zlepšeniu prežívania pacientov s karcinómom rekta [1,3,5,20]. Od 80-tych rokov minulého storočia preto TME predstavuje zlatý štandard v chirurgii karcinómu rekta.
Heald popísal rektum a mezorektum ako jeden celistvý lymfovaskulárny subjekt (entitu). Zdôrazňuje tri základné princípy, ktoré je nevyhnutné chápať a dodržiavať, aby bola technika TEM vykonávaná korektne [24]:
- disekcia na rozhraní tkanív rozdielneho embryonálneho pôvodu (rektum a mezorektum je endodermálneho pôvodu, zatiaľ čo parietálna endopelvická fascia je mezodermálneho pôvodu )
- chirurgická preparácia musí byť vykonaná ostrou disekciou, resp. pomocou diatermie pod priamou kontrolou zraku s dobrým osvetlením
- jemné otváranie roviny disekcie s využívaním kontinuálneho ťahu a protiťahu (avšak tak, aby nedochádzalo k trhaniu tkaniva)
TME je definovaná ako kompletné odstránenie rekta s intaktným mezorektom „en bloc“ ostrou disekciou alebo pomocou diatermie v mezorektálnej rovine pod priamou kontrolou zraku [5,20,25]. Preparuje sa v priestore medzi viscerálnou mezorektálnou fasciou (fascia recti propria) a parietálnou pelvickou fasciou (Waldayerova fascia), teda v tzv. „holy plane of rectal surgery“ podľa Healda [11]. Pri preparácii by nemalo dôjsť k porušeniu jemnej fascia recti propria (Obr. 4). Navonok od „holy plane“ sú štruktúry, ktoré je potrebné chrániť – sympatické a parasympatické nervové pletene, veľké cievy (vény).
Image 4. Makroskopický preparát rekta s kvalitnou TME (M.E.R.C.U.R.Y. I°) Fig. 4: Macroscopic specimen of the rectum with high-quality TME (M.E.R.C.U.R.Y. I°) 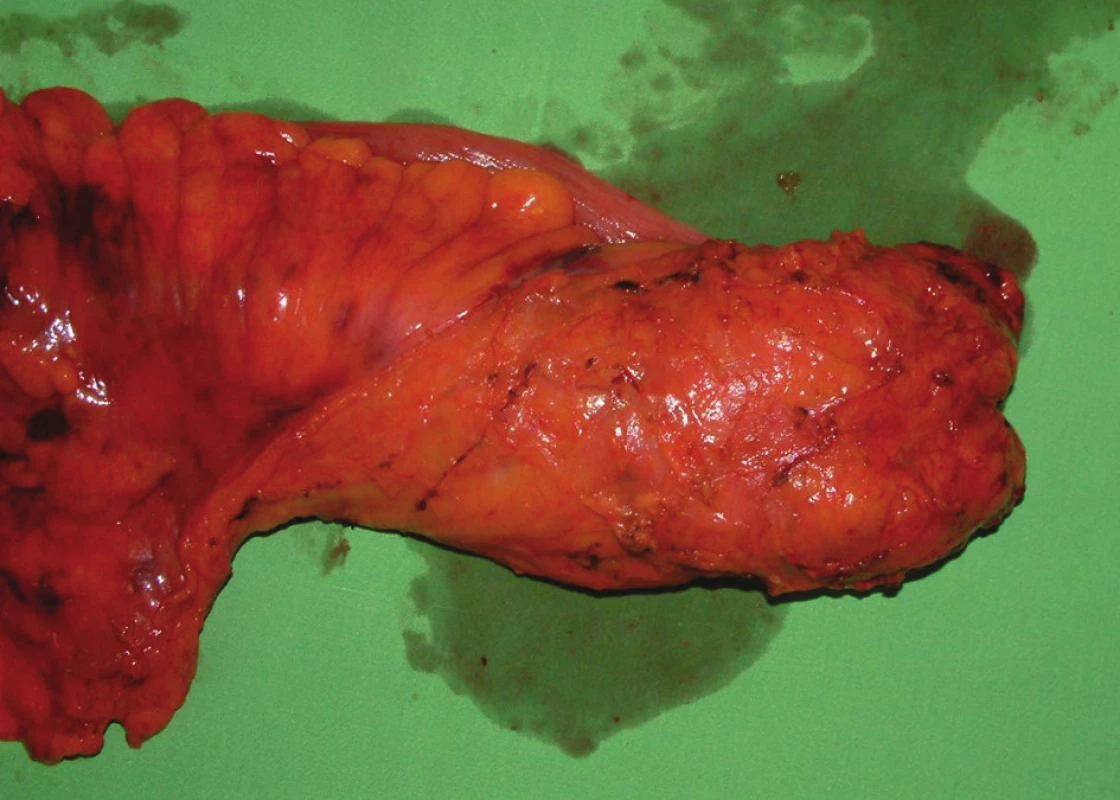
TME by mala byť vykonávaná u tumorov strednej a distálnej tretiny rekta (aborálny okraj tumoru ≤ 12cm od anokutánneho prechodu). Parciálna mezorektálna excísia je vykonávaná u tumorov hornej tretiny rekta (12–16cm od anokutánneho prechodu), tak aby bolo mezorektum prerušené minimálne 5 cm pod dolným okrajom tumoru [2,11,13,20,26].
Technicky správne vykonaná TME by mala viesť k vysokej početnosti negatívneho CRM za predpokladu kvalitného predoperačného stagingu a s tým súvisiacich správnych indikácií primárnej liečby [26]. Resekovanie rekta technikou TME tak predstavuje optimálny operačný postup na dosiahnutie negatívneho CRM.
Zavedenie TME do praxe postupne viedlo k zmene koncepcie chirurgického prístupu ku karcinómu rekta. Moderný prístup totiž koncentruje pozornosť chirurga na dosiahnutie negatívneho CRM aj za cenu akceptovania minimálneho distálneho resekčného okraja. V súčasnosti dochádza totiž k zmene základnej otázky určujúcej chirurgický postup – a to z „Ako nízko je tumor?“ na „Ako hlboko tumor zasahuje?“. Tento posun znamená hlavný impulz v rozvoji a rozširovaní indikácií sfinkter-šetriacich resekčných techník [11,20,26].
Patológ
Pri hodnotení resekovaného preparátu z hľadiska laterálneho princípu radikality sú dôležité dva aspekty posudzované patológom: kompletnosť totálnej mezorektálnej excísie a hodnotenie samotného CRM [4,12,18].
Kompletnosť totálnej mezorektálnej excízie je hodnotená tak, že patológ skúma makroskopický vzhľad neperitonealizovaného povrchu nefixovaného preparátu. Preparát je pritom vyhodnotený podľa najhoršej oblasti neperitonealizovaného povrchu [4,12,18,26]. Kvalita TME je obvykle klasifikovaná podľa škály prevzatej z M.E.R.C.U.R.Y. štúdie (Tab. 1). Protokol rozlišuje tri stupne kvality chirurgickej excízie mezorekta – kompletná excízia (M.E.R.C.U.R.Y. I°) (Obr. 4), takmer kompletná excízia (M.E.R.C.U.R.Y. II°) a nekompletná excízia (M.E.R.C.U.R.Y. III°) [27].
Table 1. Klasifikácia kvality mezorektálnej excízie podľa M.E.R.C.U.R.Y. kritérií Tab. 1: Classification of mesorectal excision quality assessment according to M.E.R.C.U.R.Y. criterions 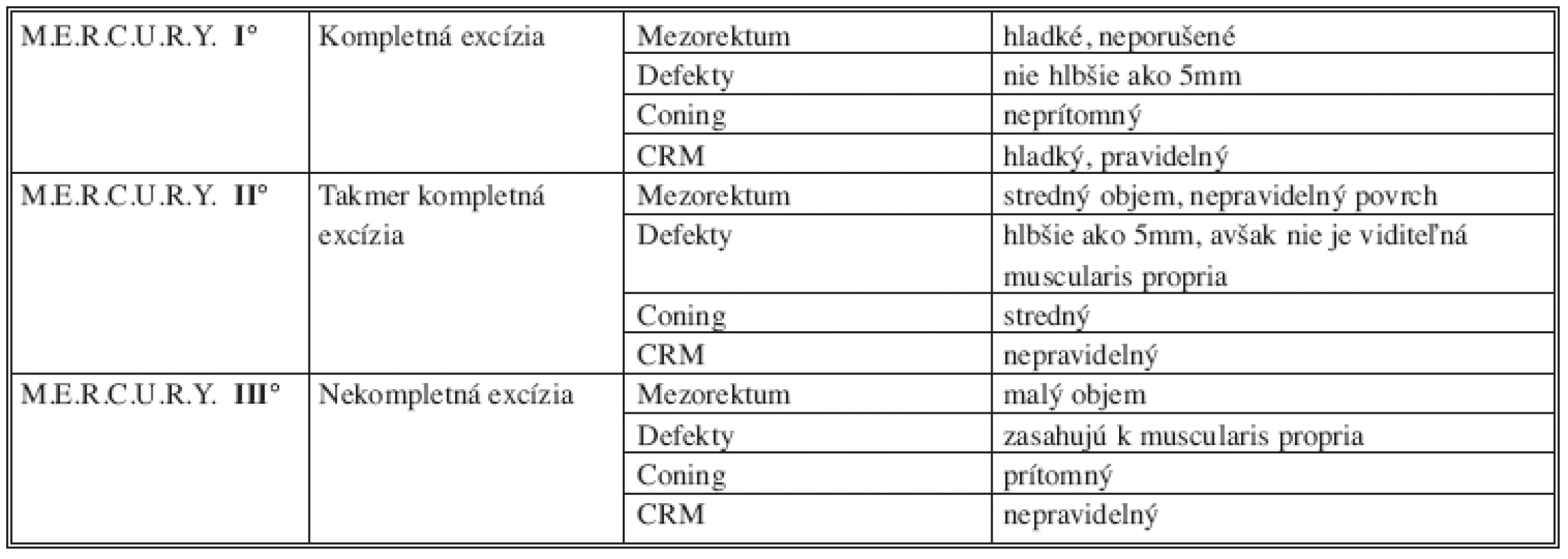
Herzog upozorňuje na paradoxnú situáciu vo svetovom písomníctve. V súčasnosti sa takmer všetky chirurgické pracoviská, resp. onkologické centrá hlásia k vykonávaniu TME ako štandardnej chirurgickej techniky v resekcii karcinómu rekta. Prieskum publikovaných štúdií však ukazuje, že adekvátne hodnotenie kvality TME patológom, resp. patologickým pracoviskom je v literatúre veľmi zriedkavé [26].
Technika hodnotenia CRM podľa Quirkeho, resp. Chana bola popísaná vyššie. Výstupom je výsledok vo forme negatívneho (nádor >1 mm od okraja) alebo pozitívneho CRM (nádor ≤1 mm od okraja).
V jednotlivých publikovaných štúdiách je udávaný pomerne široký rozptyl hodnôt početností pozitívnych CRM – údaje sa pohybujú sa od 1 % do 28 % u kuratívne operovaných pacientov [4,5,13,16,20,25,27]. Táto skutočnosť je spôsobená faktom, že početnosť pozitívnych CRM závisí na množstve faktorov: výbere pacientov, kvalite predoperačného stagingu, type neoadjuvantnej liečby, chirurgickej technike, skúsenostiach operatéra atď.
Početnosť zisťovaného pozitívneho CRM je závislá aj od zainteresovanosti, zručnosti a tréningu skúmajúceho patológa. Nagtegaal upozorňuje na koreláciu medzi početnosťou udávaného pozitívneho CRM a priemerným počtom nájdených lymfatických uzlín v preparáte. Výsledky kvalitného patologického pracoviska sú tak obvykle charakterizované vysokým priemerným počtom nájdených LU a zvýšenou frekvenciou zachyteného pozitívneho CRM [5].
Onkológ/Rádioterapeut
Výber primárnej terapeutickej modality u pacienta s karcinómom rekta závisí na precíznom stagingu ochorenia premietnutom do systému všestranne užívanej TNM klasifikácie. Veľmi dôležitým kritériom v rámci stagingu je vyhodnotenie MRI so zameraním sa na lokálnu pokročilosť tumoru a jeho vzťah k budúcemu CRM (fascia recti propria) [1,21,22].
Rozhodujúcim a základným faktorom pre určenie optimálneho pooperačného terapeutického plánu je komplexné patologické vyhodnotenie resekovaného karcinómu rekta vrátane makroskopickej celistvosti mezorekta a pozitivity/negativity CRM.
Prognóza
Vo všeobecnosti je možné tvrdiť, že čím väčšia je vzdialenosť nádoru od CRM, tým lepšia je prognóza. U pacientov so zisteným pozitívnym CRM je vyššia pravdepodobnosť vzniku lokálnej recidívy, vzdialených metastáz a kratšia dĺžka prežívania.
Mnohými štúdiami a meta-analýzami bolo potvrdené, že CMR je najdôležitejším a najpresnejším samostatným prognostickým faktorom v predikcii lokálnej recidívy. CRM je zároveň silným faktorom v predikcii vzniku vzdialených metastáz a dĺžky prežívania [1,5,13,14,25]. Pacienti so zachyteným pozitívnym CRM majú dvakrát vyššiu pravdepodobnosť úmrtia na základné ochorenie, a 3,5krát vyššiu pravdepodobnosť lokálnej recidívy, ktorá vzniká až u 85 % takýchto pacientov [11,12].
Nedávna štúdia zameraná na skúmanie prognostickej hodnoty CRM preukázala, že CRM je silnejší prognostický faktor ako T štádium nádoru. CRM status v kombinácii so stavom lymfatických uzlín dokonca predstavuje lepší prognostický model ako súčasný TNM systém [28,29].
Hodnotenie kvality a tréning
Je zrejmé, že chirurg a jeho operačná technika predstavujú pre prežitie pacienta nezávislý prognostický faktor [2,4,16,26]. Obdobným spôsobom majú vplyv na prognózu pacienta aj výkony, resp. kvalita výkonov jednotlivých členov multidisciplinárneho teamu. Systematické zlepšovanie kvality chirurgickej liečby ako aj komplexnej multidisciplinárnej starostlivosti má preto veľký význam. Dlhodobé zlepšovanie kvality je však možné iba zavedením efektívnych mechanizmov kontroly kvality do klinickej praxe.
Kvalitné histopatologické vyhodnotenie preparátu nielen potvrdí kompletnosť odstránenia tumoru a presne určí štádium ochorenia, ale zároveň poskytne kontrolu kvality pre chirurga a rádiológa. Úzka spolupráca medzi patológom a chirurgom a kontrolný mechanizmus kvality spočíva v detailnom patologickom hodnotení efektívnosti a kvality chirurgickej totálnej mezorektálnej excízie, ktoré je vykonávané prostredníctvom posúdenia kompletnosti TME (klasifikácia M.E.R.C.U.R.Y.) a prostredníctvom precízneho stanovovania a merania CRM. Oba výstupy zároveň zvyšujú prognostickú hodnotu patologickej správy [4,12,13,16,18,26].
Medziodborová spolupráca medzi patológom a rádiológom (a ďalší kontrolný mechanizmus) je vo forme vyhodnocovania správnosti rádiológom stanovených MRI diagnóz. Porovnanie predoperačných MRI scanov s makroskopickými fotografiami rezov resekovaného preparátu na MDT stretnutiach je preto veľmi prínosné a odporúčané [21,22].
Cesta k ďalšiemu zlepšovaniu kvality liečebnej starostlivosti o pacientov s karcinómom rekta spočíva v realizácii tréningových programov pre rádiológov (tréning hodnotenia MRI scanov), chirurgov (tréning správnej techniky TME) a patológov (tréning hodnotenia TME a stanovovania CRM). Povzbudivé výsledky zavedenia tréningových programov do praxe v Nórsku, Švédsku a Holandsku preukazujú efektívnosť a význam týchto programov [4,30]. Výzvou do budúcnosti je potom tréning multidisciplinárneho teamu ako celku. Takýmto spôsobom môže team zložený z chirurga, rádiológa, patológa a onkológa úzko spolupracovať a znižovať počty recidívy ochorenia a zlepšovať prežívanie pacientov s karcinómom rekta [2–5,11,26–30].
ZÁVER
Cirkumferenčný resekčný okraj predstavuje základný aspekt v modernom prístupe k pacientom s karcinómom rekta. Koncept CRM je uplatňovaný v prístupe každého člena multidisciplinárneho teamu. CRM musí brať do úvahy rádiológ pri stanovovaní stagingu ochorenia, chirurg v priebehu operácie, patológ v čase dôsledného makroskopického a histopatologického hodnotenia preparátu, a onkológ pri rozhodovaní o podávaní neoadjuvantnej/adjuvantnej terapie. Ideálny spôsob na dosiahnutie tohto cieľa je vysoký stupeň špecializácie na karcinóm rekta u všetkých členov multidisciplinárneho teamu.
Zavedenie hodnotenia CRM do klinickej praxe v zahraničí malo za dôsledok presnejší staging ochorenia, relevantnejšie stanovovanie indikácií multimodálnej liečby, precíznejšiu operačnú techniku (TME), zvýšenie počtu sfinkter – zachovávajúcich operácií, zníženie počtu lokálnych recidív ochorenia a zlepšenie prežívania pacientov s karcinómom rekta.
Prostredníctvom tohto review sme demonštrovali, že CRM je jedným z najdôležitejších faktorov v manažmente karcinómu rekta, a to nielen v predikcii prognózy, ale aj v indikáciách multimodálnej liečby a v hodnotení kvality poskytovanej terapie. V súlade s odporúčaniami európskych (UICC) a amerických guidelines (NCCN) veríme, že je nevyhnutné venovať veľkú pozornosť problematike CRM u karcinómu rekta, pretože na základe jeho vyhodnocovania je možné redukovať počty lokálnych recidív, zlepšovať prežívanie pacientov a zvyšovať kvalitu poskytovanej starostlivosti.
MUDr. Peter Ihnát, Ph.D.
Chirurgická klinika FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: peterihnat@yahoo.com
Sources
1. How P, Shihab O, Tekkis P, Brown G, Quirke P, Heald R, Moran B. A systematic review of cancer related patient outcomes after anterior resection and abdominoperineal excision for rectal cancer in the total mesorectal excision era. Surg Oncol 2011; 20 : 149–155.
2. Becker HD, Jehle E, Kratt T, Mehl C, Volke K. Karcinom rekta. In: Becker HD et al. Chirurgická onkologie. Praha, Grada 2005 : 515–539.
3. Hoch J. Chirurgická léčba kolorektálního karcinomu. Rozhl Chir 2012;91,1 : 48–52.
4. Quirke P. Training and quality assurance for rectal cancer: 20 years of data is enough. The Lancet Oncology 2003;4 : 695–701.
5. Nagtegaal ID, Quirke P. What is the role for the circumferential margin in the modern treatment of rectal cancer? J Clin Oncol 2008;26,2 : 303–312.
6. Titu LV, Tweedle E, Rooney PS. High tie of the inferior mesenteric artery in curative surgery for left colonic and rectal cancer: a systematic review. Dig Surg 2008;28 : 148–157.
7. Heald RJ, Moran BJ, Ryall RD, Sexton R, MacFarlane JK. Rectal cancer. The Basingstoke experience of total meesorectal excision, 1987–1997. Arch Surg 1998;133 : 894–899.
8. Kirwan WA, Drumm J, Hogan JM, Keohane C. Determining safe margin of resection in low anterior resection for rectal cancer. Br J Surg 1988;75 : 720–721.
9. Moore HG, Riedel E, Minsky BD, Saltz L, Paty P, Wong D, Cohen AM, Guillem JG. Adequacy of 1-cm distal margin after restorative rectal cancer resection with sharp mesorectal excision and preoperative combined-modality therapy. Ann Surg Oncol 2003;10,1 : 80–85.
10. Ueno H, Mochizuki H, Hashiguchi Y. Preoperative parameters expanding the indication of sphincter preserving surgery in patients with advanced low rectal cancer. Ann Surg 2004;239 : 34–42.
11. Lipská L. Lokální recidiva karcinomu rekta. In: Lipská L, Visokai V, et al. Recidiva kolorektálního karcinomu. Komplexní přístup z pohledu chirurga. Praha, Grada, 2009 : 307–321.
12. Washington MK, Berlin J, Branton P, Burgart LJ, Carter DK, Fitzgibbons PL, Haling K, Frankel W, Jessup J, Kakar S, Minsky B, Nakhleh R, Compton CC. Protocol for the examination of specimens from patients with primary carcinoma of the colon and rectum. Arch Pathol Lab Med 2009;133 : 1539–1551.
13. Hermanek P, Junginger T. The circumferential resection margin in rectal carcinoma surgery. Tech Coloproctol 2005;9 : 193–200.
14. Nagtegaal ID, Marijnen AM, Kranenbarg EK, van der Velde CJH, van Krieken JM. Circumferential margin involvement is still an important predictor of local recurrence in rectal carcinoma. Am J Surg Pathol 2002;26,3 : 350–357.
15. Quirke P, Durdey P, Dixon MF, Williams NS. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection. Histopathological study of lateral tumour spread and surgical incision. Lancet 1986;2 : 996–999.
16. Birbeck KF, Macklin CP, Tiffin NJ, Parsons W, Dixon MF, Mapstone NP, Abbott CR, Scott N, Finan PJ, Johnston DJ, Quirke P. Rates of circumferential resection margin involvement vary between surgeons and predict outcomes in rectal cancer surgery. Ann Surg 2002;235,4 : 449–457.
17. Chan KW, Boey J, Wong SK. A method of reporting radial invasion and surgical clearance of rectal carcinoma. Histopathology 1985;9 : 1319–1327.
18. Rojo A, Sancho P, Alonsa O, Encinas S, Toledo G, Garcia JF. Update on the surgical pathology standards on rectal cancer diagnosis, staging and quality assessment of surgery. Clin Trans Oncol 2010;12 : 431–436.
19. Pricolo VE. Rectal Cancer: The good, the bad, and the ugly. Arch Surg 2011;146,5 : 544.
20. Ludwig K, Kosinski L. How low is low – Evolving approaches to sphincter-sparing resection techniques. Semin Radiat Oncol 2011;21 : 185–195.
21. Blomquist L, Glimelius B. The ‘good’, the ‘bad’, and the ‘ugly’ rectal cancers. Acta oncologica 2008;47 : 5–8.
22. Smith N, Brown G. Preoperative staging of rectal cancer. Acta oncologica 2008;47 : 20–31.
23. Monson JRT. Laparoscopic resection for rectal cancer and circumferential margin: is it time to move on? Dis Colon Rectum 2011;54,8 : 1049–1052.
24. Heald RJ, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery. The clue to pelvic recurrence? Br J Surg 1982; 69 : 613–616.
25. Wibe A, Rendedal PR, Svensson E, Norstein J, Eide TJ, Myrvold HE, Soreide O. Prognostic significance of the circumferential resection margin following total mesorectal excision for rectal cancer. Br J Surg 2002;89 : 327–334.
26. Herzog T, Belyaev O, Chromik AM, Weyhe D, Mueller CA, Munding J, Tannapfel A, Uhl W, Seelig MH. TME quality in rectal cancer surgery. Eur J Med Res 2010;15,7 : 292–296.
27. MERCURY Study Group. Extramural depth of tumor invasion at thin-section MR in patients with rectal cancer: Results of the MERCURY study. Radiology 2007;243 : 132–139.
28. Nagtegaal ID, Gosens MJ, Marijnen CA, et al. Combinations of tumor and treatment parameters are more discriminative for prognosis than the present TNM system in rectal cancer. J Clin Oncol 2007;25 : 1647–1650.
29. Gosens MJ, Van Krieken JH, Marijnen CA, et al. Improvement of staging by combining tumor and treatment parameters: The value of for prognostication in rectal cancer. Clin Gastroenterol Hepatol 2007;5 : 997–1003.
30. Martling AL, Holm T, Rutqvist LE, et al. Effect of a surgical training programe on outcome of rectal cancer in the County of Stockholm. Lancet 2000;356 : 93–96.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2013 Issue 6-
All articles in this issue
- Cirkumferenčný resekčný okraj v modernej liečbe karcinómu rekta
-
Radikalita resekční léčby pro karcinom rekta
Analýza prediktivních faktorů spojených s nekompletní mezorektální excizí -
Karcinom rekta do 10 cm
Srovnání radikality laparoskopické a otevřené operační techniky s ohledem na cirkumferentní resekční okraj a na kompletnost mezorektální excize - Anatomicko-chirurgická studie průběhu interkostobrachiálních nervů (ICBN) v axile při exenteraci I. a II. etáže axily u karcinomu prsu a maligního melanomu
- Reexpanzní edém plíce po drenáži dlouhotrvajícího spontánního pneumotoraxu – kazuistika
- De Garengeotova hernie komplikovaná inkarcerací a gangrenózní apendicitidou
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Reexpanzní edém plíce po drenáži dlouhotrvajícího spontánního pneumotoraxu – kazuistika
- Cirkumferenčný resekčný okraj v modernej liečbe karcinómu rekta
- De Garengeotova hernie komplikovaná inkarcerací a gangrenózní apendicitidou
- Anatomicko-chirurgická studie průběhu interkostobrachiálních nervů (ICBN) v axile při exenteraci I. a II. etáže axily u karcinomu prsu a maligního melanomu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

