-
Medical journals
- Career
Suplementácia selénu u pacientov s ťažkou akútnou pankreatitídou
Authors: L. Kočan; J. Firment; J. Šimonová; J. Vašková; J. Guzy
Authors‘ workplace: Slovenská republika, prednosta kliniky: doc. MUDr. Jozef Firment, Ph. D. ; I. klinika anesteziológie a intenzívnej medicíny, Univerzálna nemocnica L. Pasteura, Košice
Published in: Rozhl. Chir., 2010, roč. 89, č. 8, s. 518-521.
Category: Monothematic special - Original
Overview
Suplementácia selénu zlepšuje antioxidačný status u kriticky chorých pacientov s ťažkou akútnou pankreatitídou v závislosti od dávky a doby podávania selénu. Cieľom práce je poukázať na prínos antioxidačnej terapie hradením selénu.
Metóda:
Pacient s akútnou pankreatitídou a rozvíjajúcim sa septickým šokom bol prijatý na oddelenie intenzívnej medicíny. V rámci adjuvantnej terapie bola zahájená suplementácia selénu v kontinuálnej infúzii v dávke 750 μg/24 hodín počas šiestich dní. Meraním bolo zistené zvýšenie aktivity antioxidačného enzýmu glutatión peroxidázy a zníženie zápalových markerov v čase suplementácie.
Práca poukazuje na možnosti ovplyvnenia patogenézy syndrómu systémovej zápalovej odpovede v jeho počiatočnej fáze a ovplyvnenie vývoja chorobného stavu u pacientov s ťažkou akútnou pankreatitídou.Kľúčové slová:
ťažká akútna pankreatitída – sepsa – syndróm systémovej zápalovej odpovede – selén – glutatión peroxidázaÚVOD
Ťažká akútna pankreatítída predstavuje závažný medicínsky problém z hľadiska vážnosti stavu, rapídnej progresie a vysokej mortality [1, 2, 3]. Stratégia liečby vyžaduje komplexný multidisciplinárny prístup. Pacientov je nutné hospitalizovať na oddeleniach, ktoré túto problematiku zvládajú, a to chirurgického alebo interného typu. Najťažšie formy akútnej pankreatitídy spojené s respiračným zlyhaním a multiorgánovou dysfunkciou patria na lôžkové časti oddelení anestéziológie a intenzívnej medicíny [4].
Ochorenie sa spája s rozvojom syndrómu systémovej zápalovej odpovede (SIRS), v patogenéze ktorého dochádza k nadmernej aktivácii imunitných dejov, zápalových mediátorov a vzniku oxidačného stresu, ktorý sa v úvodnej fáze významne podieľa na amplifikácii zápalových dejov [5]. Vážnou komplikáciou ťažkej akútnej pankreatitídy je multiorgánové zlyhanie, ktoré vzniká na podklade SIRS a to vo včasnej fáze priebehu ochorenia [6]. Antioxidačná terapia má potenciál zasiahnuť prostredníctvom vychytávania voľných radikálov do priebehu počiatočnej fázy rozvoja SIRS, čo môže výrazne ovplyvniť prežívanie pacientov [7].
Klinicky významný benefit bol dokázaný substitúciou troch živín s antioxidačnými vlastnosťami. Pri podávaní selénu sa zlepšujú klinické výsledky pri infekciách a orgánovom zlyhaní, pri podávaní glutamínu v rozsiahlych štúdiách bolo zistené zníženie infekčných komplikácií u kriticky chorých pacientov. V súvislosti s kyselinou eikosapentaenovou a mikronutrientmi bol zaznamenaný výrazný protizápalový efekt a otupená odozva endotoxínu [8]. Z podávaných mikronutrientov, sá zdá byť selén najviac účinnou antioxidačnou látkou v klinickom merítku, po ňom nasleduje zinok, vitamíny C a E a ß-karotén.
Cieľom práce je poukázať prostredníctvom kazuistiky na prínos suplementačnej adjuvantnej terapie vhodnými mikronutrientmi u kriticky chorých pacientov [9].
METODIKA
Pacientovi bol počas adjuvantnej terapie v dennej dávke 750 mg v kontinuálnej infúzii počas šiestich dní suplementovaný selén vo forme pentahydrátu seleničitanu sodného. Zároveň bol v infúznom roztoku podávaný alanylglutamín do centrálneho venózneho katétra v dennej dávke 100 ml počas šiestich dní v tom istom čase. Počas obdobia suplementácie bola monitorovaná dynamika zápalových buniek (leukocyty, pomer neutrofilov a lymfocytov, trombocyty) a zmena dynamiky biochemických markerov a antioxidačných enzýmov (prokalcitonín, fibrinogén, CRP, laktát, glutatiónperoxidáza, glutatión reduktáza).
KAZUISTIKA
Pacient vo veku 50 rokov s akútnou hemoragicko-nekrotizujúcou pankreatitídou a pridruženým multiorgánovým zlyhávaním bol preložený na I. KAIM FNLP z OAIM NsP Michalovce, kde bol operovaný pre difúznu peritonitídu. Bola vykonaná drenáž brušnej dutiny s lavážou a zavedením preplachových drénov. Pri prijatí bol pacient v komatóznom stave, APACHE 19 bodov a SOFA skóre 6 bodov na agresívnej umelej pľúcnej ventilácii (UPV) s cirkuláciou podporovanou noradrenalínom. Bolo realizované vstupné CT vyšetrenia abdomenu, pľúc a mozgu.
Po desiatich dňoch hospitalizácie pre anemizáciu a pridružený septický šok chirurg indikuje revíznu operáciu. Bola realizovaná drenáž omentálnej burzy so zavedením preplachovej drenáže a súčasne bola vykonaná punkčná jejunostómia. Ihneď po operácii sa realizovaná adjuvantná antioxidačná terapia kontinuálnou suplementáciou selénu v dávke 750 mg/24 hodín počas nasledujúcich šiestich dní. Pravidelne boli merané aktivity antioxidačných enzýmov ako aj štandardné zápalové parametre (Tab. 1). Počas hospitalizácie sa rozvíja obojstranný fluidothorax viac vľavo, preto boli realizované opakovane evakuačné punkcie aj v spolupráci s hrudníkovým chirurgom. Bola aplikovaná kombinovaná ATB liečba a bolo pridávané antimykotikum (Fluconazol) vzhľadom na kandidovú infekciu. Pre pridružené akútne obličkové poškodenie je pacient hemodialyzovaný, v úvode bola aplikovaná mimotelová eliminačná liečba (MEL) formou CVVHD a neskôr MEL formou intermitentnej hemodialýzy. Pacient sa v ďalšom priebehu cirkulačne stabilizuje a už nevyžaduje vazopresorickú podporu.
Table 1. Laboratórne výsledky pacienta z kazuistiky pred začatím a v priebehu suplementácie selénu Tab. 1. Laboratory results from casuistic research before start selenium supplementation and within therapy 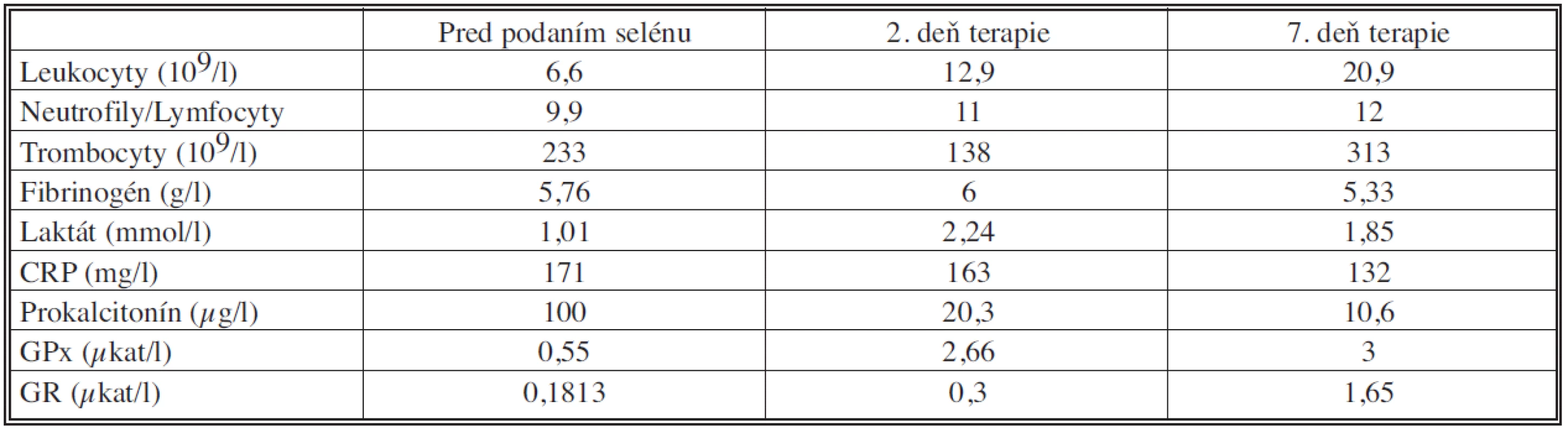
Po týždni opätovne dochádza k anemizácii pacienta, kontrolné CT vyšetrenie abdomenu odhalilo subkapsulárny hematóm sleziny. Konziliárny chirurg odporučil konzervatívny postup. Vzhľadom na vzostup zápalových markerov je napokon pacient revidovaný, retroperitoneálny absces bol vydrénovaný a bola ponechaná preplachová drenáž s Betadinovým roztokom. Na oddelení intenzívnej jednotky pokračujeme v ATB liečbe a podpornej UPV. Z hľadiska ďalšej prognózy dlhodobej a potreby podpornej UPV je vykonaná perkutánna dilatačná tracheostómia. Priebeh hospitalizácie bol komplikovaný hematemézou a melénou, pri endoskopickom náleze bol zistený vred v bulbe duodéna a erozívna ezofagitída. Krvácanie z horného GIT-u bolo zvládnuté konzervatívne. Pri kontrolnom CT vyšetrení pretrváva septovaný fluidotorax vľavo, preto bol konzultovaný hrudníkový chirurg, ktorý odporúča dekortikáciu pľúc. Po štyroch týždňoch hospitalizácie na I. KAIM je celkový stav pacienta stabilný, pacient je pri vedomí s GCS 15 b, na tlakovej podpornej ventilácii, je odpájaný od UPV cez tracheostómiu (netoleruje záťaž), pretrváva oligúria s potrebou pokračovania v MEL, je kardiálne kompenzovaný, pre sínusovú tachykradiu v liečbe ponechaný metoprolol. Postupne pacient dýcha spontánne cez Ayrovo T s následnou dekanyláciou tracheostómie. Počas rehabilitačnej liečby pacienta vertikalizujeme a začína chodiť. Dochádza k miernej úprave azotémie, preto nefrológ neindikuje dlhodobý dialyzačný program. Kombinovaná antihypertenzná liečba bola postupne redukovaná. Po šiestich týždňoch hospitalizácie je pacient pri vedomí, dýcha spontánne cez O2 masku, je hemodynamicky kompenzovaný, preto po dohode s chirurgom bol preložený na chirurgickú JIS v stabilizovanom stave.
DISKUSIA
Voľné radikály zohrávajú dôležitú úlohu v patogenéze syndrómu systémovej zápalovej odpovede, sepsy, ťažkej sepsy, septického šoku a akútnej pankreatitídy [5]. Samotné voľné radikály, ako produkt leukocytov majú v prvotnej fáze sepsy dôležitú antimikrobiálnu úlohu pri ničení patogénnych mikroorganizmov. Problémom sa stávajú až vtedy, keď ich tvorba je nekontrolovateľná a ďaleko prevyšuje vychytávaciu schopnosť antioxidantov, a tak dochádza k vzniku oxidačného stresu a aktivácii patologických kaskád [9].
Vznik a účinok voľných radikálov je v rovnováhe s pôsobením antioxidačného obranného systému organizmu [5]. Exhaustná tvorba kyslíkových radikálov indukuje tvorbu cytokínov imunokompetentnými bunkami, ktoré ďalej aktivujú zápalovú kaskádu a vplývajú na expresiu adhéznych molekúl na povrchu buniek. Voľné radikály ovplyvňujú kaskádu intercelulárnych dejov, čoho výsledkom je aktivácia génov dôležitých z hľadiska zápalu. Princípom tejto suplementačnej antioxidačnej terapie je ovplyvnenie zápalovej kaskády ešte v počiatku SIRS a tým priaznivo ovplyvniť klinický priebeh [5, 10].
V skorom štádiu ochorenia u pacientov s ťažkou pankreatitídou bola experimentálne zistená vysoká tvorba voľných radikálov. Takisto príjem a plazmatické hladiny selénu sú v tejto skupine znížené. V niektorých medicínskych centrách využívajú adjuvantnú terapiu selénom pri akútnej pankreatitíde dlhší čas a boli zaznamenané sľubné výsledky. Príkladom je výsledok retrospektívnej štúdie, kde bolo zistené v priebehu desiatich rokov zníženie mortality u pacientov s akútnou pankreatitídou z 35 % na 16 % [8]. Pri experimentálnych meraniach hladiny selénu u kriticky chorých pacientov so sepsou a SIRS bol zistený markantný pokles plazmatického selénu a bola zaznamenaná signifikantná negatívna korelácia medzi plazmatickou hladinou selénu, APACHE II a SAPS II [11].
Referenčná hodnota plazmatického selénu je v rozpätí 89–114 μg/l. Tieto ťažké stavy sa spájajú s presunom vitamínov a stopových prvkov do tkanív, v ktorých sa syntetizujú proteíny teraz v oveľa väčšej miere ako za fyziologických podmienok. Tento presun spôsobuje relatívny deficit cirkulujúcich antioxidantov. Klinické štúdie u pacientov so SIRS, sepsou, ARDS a pankreatitídou poukazujú na to, že suplementácia selénu priaznivo ovplyvňuje prežívanie [8]. Podávanie selén obsahujúcich doplnkov sa zdá byť prospešným z hľadiska zníženia mortality [5]. Problémom pri tejto terapii je správne načasovanie, odhad dávky, a doby podávania.
Suplementácia v neskorých fázach SIRS a ťažkej sepsy sa zdá byť neúčinnou terapiou [12].
Selén je dôležitý mikronutrient. Tvorí nebielkovinovú súčasťou dôležitého antioxidačného enzýmu glutatiónperoxidázy (GPx), od ktorej úzko závisí integrita bunkových a subcelulárnych membrán. Antioxidačné vlastnosti enzýmu sú bytostne závislé od prítomnosti selénu [13]. Prísun vysokých dávok selénu u zdravých ľudí počas dlhého obdobia niekoľkých rokov sa spája s ochorením selenózou. Intoxikácie selénom u kriticky chorých pacientov pozorované doteraz neboli, a to ani pri štúdiách kde podávali vyššie dávky selénu [10].
Dávka 1000 mg/deň podaná intravenózne bola dobre tolerovaná pacientmi na JIS [5]. Dávkovanie selénu pri ťažkej akútnej pankreatitíde nie je striktne odporúčané, preto sme používali priemerné dávkovanie vychádzajúc z výsledkov viacerých randomizovaných štúdií [7, 14]. Selén sa uplatňuje ako kofaktor enzýmu gluthationperoxidázy, ktorý patrí do skupiny enzýmov vykazujúcich peroxidázovú aktivitu, jej hlavnou úlohou je ochrana bunkových štruktúr pred oxidačným poškodením. Biochemická funkcia GPx je redukovať lipidové peroxidy na im korenšpodujúce alkoholy a redukovať voľný peroxid vodíka na vodu. Substrátom pre túto reakciu je glutatión [15, 16]. Suplementáciou glutamínu sa zvyšuje efektivita účinku GPx. Regenerácia GSH z oxidovanej formy GSSG je katalyzovaná glutatión reduktázou. To že u pacienta z kazuistiky nedochádza k zvýšeniu aktivity GR, je možné vysvetliť z tohto hľadiska, že regenerácia GSSG na GSH nie je zatiaľ nutná, keďže zároveň podávame aj alanylglutamín, prekurzor GSH [13].
Priame meranie dynamiky antioxidačných enzýmov u pacienta z kazuistiky poukazuje na ich aktiváciu suplementovanými mikronutrientmi. Zároveň je tento jav sprevádzaný poklesom plazmatickej hladiny prokalcitonínu, čo je známkou efektívnej terapie sepsy. Taktiež v priebehu liečby dochádza k významnému poklesu hladiny CRP. Laktát sa výrazne nemení. Zvýšená hodnota GPx v siedmy deň od aplikácie prvej dávky selénu a glutamínu svedčí o zvýšenej aktivite antioxidačného systému. Pomer neutrofilov a lymfocytov má priaznivú klesajúcu tendenciu aj napriek stúpajúcej hodnote leukocytov. Pomer neutrofilov a lymfocytov jednoducho a spoľahlivo vystihuje mieru závažnosti oxidačného stresu a systémového zápalu. Bola zistená súvislosť medzi závažnosťou klinického stavu a mierou neutrofílie a lymfocytopénie [17]. Výsledky tejto kazuistiky potvrdzujú priaznivý vplyv suplementácie selénu na ťažkú formu akútnej pankreatitídy a jej septické komplikácie.
ZÁVER
Podpora antioxidačných mechanizmov sa zdá byť prínosná pre pacientov s diagnostikovanou ťažkou akútnou pankreatitídou. Načasovanie a dávkovanie antioxidantov a kofaktorov antioxidačných enzýmov je pre terapiu zásadné. Táto špecifickosť dávkovania je veľmi významná najmä pri terapii selénom. Optimálna terapeutická dávka, ku ktorej sme dospeli na podklade výsledkov viacerých štúdií bola určená na 750 mg/deň a doba suplementácie šiestich dní. So suplementáciou je nutné začať ihneď po stanovení diagnózy.
Zoznam skratiek:
APACHE II Acute Physiology and Chronic Health Evaluation II
ARDS akútny syndróm systémovej zápalovej odpovede
CVVHD Continuálna veno-venózna hermodiafiltrácia
CRP C-reaktívny proteín
GCS Glasgow coma scale
GPx glutatión peroxidáza
GSH redukovaná forma glutatiónu
GSSG oxidovaná forma glutatiónu
MEL mimotelová eliminačná liečba
SAPS II Simplified Acute Physiology Score
SIRS syndróm systémovej zápalovej odpovede
MUDr. Ladislav Kočan
I. klinika anesteziológie a intenzívnej medicíny
Trieda SNP 1
040 01 Košice
Slovenská republika
e-mail: kocanladislav@yahoo.com
Sources
1. Rau, B M., Krüger, C. M., Hasel, C., Oliveira, V., Rubie, C., Beger, H. G., a kol. Effects of immunosuppressive and immunostimulative treatment on pancreatic injury and mortality in severe acute experimental pancreatitis. Pancreas, 2006; č. 33, s. 174–183.
2. Rau, B. M.,, Bothe, A., Kron, M., Beger H. G. Role of early multisystem organ failure as major risk factor for pancreatic infections and death in severe acute pancreatitis. Clin. Gastroenterol. Hepatol., 2006; č. 4: s. 1053–1061.
3. Lakyová L., Toncr, Radoňak J., Šimon, R., Toporcer, T., Vajó, J., Belák, J. Spontánna perforácia ductus choledochus pri akútnej pankreatitíde – kazuistika. Rozhl. Chir., 2008, roč. 87, č. 2, s. 92–95.
4. Balthazar, E. J: Staging of acute pancreatitis. Radiologic clinics of North America, 2002; 40 (6): s. 1199–1209.
5. Geoghegan, M., McAuley, D., Eaton, S., Powel-Tuck, J. Selenium in critical illness. Critical Care, 2006, 12, s. 136–141.
6. Nathens, B. A., Curtis, R. J., Beale, J. R., et al. Management of the critically ill patient with severe acute pankreatitis. Critical Care Medicine, 2004, roč. 32, č. 12, s. 2524–2536.
7. Heyland, D., Dhaliwal, R., Suchner, U., Berger, M. M. Antioxidant nutrients: a systematic review of trace elements and vitamins in the critically ill patient. Intensive Care Medicine, 2005, roč. 31, str. 327–337.
8. Heyland, D., Dhaliwal, R., Day, A., Drover, J., Cote, H., Wischmeyer, P. Optimizing the dose of glutamine dipeptides and antioxidants in critically ill patients: a phase I dose-finding study. J. Parenteral Enteral Nutrition, 2007, roč. 31, s. 109–118.
9. Berger, M., Chiolero, R. Antioxidant supplementation in sepsis and systematic inflammatory response syndrome. Critical Care Medicine, 2007; roč. 35, s. 584–590.
10. Angstwurm, M. W. A., Schottdorf, J., Schopohl, J., Gaertner, R. Selenium replacement in patients with severe systemic inflammatory response syndrome improves clinical outcome. Critical Care Medicine, 1999, roč. 27, s. 1807–1813.
11. Sakr, Y., Reinhart, K., Bloos, F., Marx, G., Russwurm, S., Bauer, M., Brunkhorst, F. Time course and relationship between plasma selenium concentrations, systemic inflammantory response, sepsis, and multiorgan failure. Br. J. Anaesth., 2007, roč. 98, s. 775–784.
12. Forceville, X., Vitoux, D., Gauzit, R., Combes, A., Lahilaire, P., Chappuis, P. Selenium, systemic immune response syndrome, sepsis, and outcome in critically ill patients. Critical Care Medicine, 1998, roč. 26, s. 1536–1544.
13. Salama, A., Sakr, Y., Reinhart, K. The role of selenium in critical illness: Basic science and clinical implications. Critical Care Medicine, 2007, roč. 7, s. 127–138.
14. Kuklinski, B., Buchner, M., Schweder, R., Nagel, R. Akute Pancreatitis-eine „Free Radical Disease: Letalitatssenkung durch Natriumselenit (Na2SeO3)-Therapie. Z Gestame Inn. Med., 1991, 46: s. 145–149.
15. Forceville, X. Seleno-enzymes and seleno-compounds: the two faces of selenium. Critical Care, 2006, roč. 10, s. 180.
16. Muller, F. L., Lustgarten, M. S., Jang, Y., Richardson, A., van Remmen, H. Trends in oxidative aging theories. Free Radic. Biol. Med., 2007, roč. 43, s. 477–503.
17. Záhorec, R. Pomer neutrofilov a lymfocytov - rýchly a jednoduchý ukazovateľ systémového zápalu a stresu u pacientov v kritických stavoch; Bratislavské Lekárske Listy, 2001, č. 102: s. 5–14.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2010 Issue 8-
All articles in this issue
- Klinický stav pacientov s defektami neurálnej rúry
- Možnosti a výsledky chirurgického riešenia benígnej tracheoezofageálnej fistuly
- Riešenie restenózy po segmentálnej resekcii pre postintubačné poranenie trachey
- Akutní tyroidektomie pro mechanický syndrom při toxické nodózní strumě – kazuistika
- Alternativní autologní tepenný štěp v kardiovaskulární chirurgii
- Použití V.A.C. systému při léčbě infikované cévní protézy – kazuistika
- Vacuum sealing v terapii a prevencii protetickej infekcie – kazuistika
- Ako dlho čakať s operáciou pre nekrotizujúcu pankreatitídu?
- Suplementácia selénu u pacientov s ťažkou akútnou pankreatitídou
- Syndroma caudae equinae zriedkavej etiológie
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Syndroma caudae equinae zriedkavej etiológie
- Možnosti a výsledky chirurgického riešenia benígnej tracheoezofageálnej fistuly
- Ako dlho čakať s operáciou pre nekrotizujúcu pankreatitídu?
- Akutní tyroidektomie pro mechanický syndrom při toxické nodózní strumě – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

