-
Medical journals
- Career
Detekcia minimálnej reziduálnej choroby a jej význam pre prognózu pacientov s laparoskopickou resekciou kolorektálneho karcinómu
Authors: M. Škrovina; M. Duda; J. Srovnal *; Bartoš J. Radová L. *; M. Hajdúch *; R. Soumarová **
Authors‘ workplace: Chirurgické oddělení, Nemocnice s poliklinikou a Komplexní onkologické centrum J. G. Mendela v Novém Jičíně, primář: MUDr. Matej Škrovina ; Laboratoř experimentální medicíny, Lékařská fakulta UP v Olomouci, primář: doc. MUDr. Marián Hajdúch, Ph. D. *; Radioterapie a. s., Komplexní onkologické centrum J. G. Mendela v Novém Jičíně, primář: doc. MUDr. Renata Soumarová, Ph. D. **
Published in: Rozhl. Chir., 2010, roč. 89, č. 6, s. 362-369.
Category: Monothematic special - Original
Overview
Cieľ:
Detekovanie minimálnej reziduálnej choroby (MRD) u pacientov s kolorektálnym karcinómom (CRC) vo vzorkách kostnej drene, portálnej a periférnej venóznej krvi a následne porovnanie získaných výsledkov v súvislosti s klinickým štádiom ochorenia a vyhodnotenie potencionálneho vplyvu prítomnosti MRD na vznik recidívy ochorenia a celkového prežívania pacientov.Materiál a metóda:
Do štúdie boli zaradení pacienti s primárnym CRC indikovaní k laparoskopickej resekcii. Od 21. septembra 2006 do 31. decembra 2008 bolo selektovaných 159 pacientov s mediánom veku 65 rokov. 126 pacientov (79,25 %) bolo operovaných v štádiu I-III CRC, 33 pacientov (20,75 %) v štádiu IV. Bolo realizovaných 6 odberov vzoriek k vyšetreniu prítomnosti MRD (syst. venózna krv a kostná dreň v úvode operácie, venózna krv z mezenterického riečiska, syst. venózna krv po ukončení resekcie, syst. venózna krv a kostná dreň mesiac po operácii) a vzorka samotného nádorového tkaniva. Detekcia MRD bola realizovaná metódou real-time RT-PCR.Výsledky:
V štúdii bola zistená súvislosť medzi pozitivitou MRD v predoperačnej vzorke kostnej drene a štádiom ochorenia (p < 0,035). Bola zaznamenaná súvislosť medzi nálezom v systémovej venóznej krvi odobranej predoperačne a vo venóznej krvi z mezenteriálneho riečiska (p < 0,003), súvislosť medzi nálezom v systémovej venóznej krvi odobranej po resekcii a v systémovej venóznej krvi odobranej mesiac po výkone (p < 0,015) a taktiež súvislosť v náleze v systémovej venóznej krvi odobranej predoperačne s nálezom v systémovej venóznej krvi odobranej po resekcii (p < 10-5). Bol zaznamenaný vplyv chirurgického výkonu na prítomnosť MRD v systémovej venóznej krvi u primárne negatívnych pacientov (p < 0,025). V krátkom sledovanom období nebol zaznamenaný štatisticky významný vzťah medzi nálezom MRD u chorých v štádiu I-III a obdobím do recidívy ochorenia (p < 0,59). Vzhľadom k získaným výsledkom sa dá očakávať možná priama súvislosti medzi pozitívnym nálezom MRD v systémovej venóznej krvi odobranej predoperačne u pacientov v štádiu I-III CRC a skrátením prežívania(p < 0,075). Pacienti v štádiu I-III s pozitívnym nálezom v systémovej venóznej krvi odobranej po operácii mali signifikantne skrátené celkové prežívanie v sledovanom období v porovnaní s negatívnymi pacientmi (p < 0,004).Záver:
Získané dáta naznačujú určité súvislosti medzi nálezom MRD a prognózou ochorenia. Ďalší zber vzoriek a vyhodnocovanie výsledkov pokračuje v snahe o rozšírenie počtu pacientov v štúdii a získaných dát s následným zhodnotením v 5 - až 10-ročnom období sledovania.Kľúčové slová:
minimálna reziduálna choroba – kolorektálny karcinóm – laparoskopická resekciaÚVOD
Základnou požiadavkou pre vytvorenie terapeutického plánu u pacientov s kolorektálnym karcinómom je stanovenie štádia ochorenia, stagingu, na podklade TNM klasifikácie [1]. Staging ochorenia je stanovený na základe výsledkov zobrazovacích, biochemických a mikroskopických metód. V súčasnosti sa však vzhľadom k nedostatočnej citlivosti týchto metód čoraz častejšie vykonáva tzv. ultrastaging ochorenia, pod ktorým rozumieme stanovenie prítomnosti izolovaných nádorových buniek v organizme nedetekovateľných bežnými metódami. Hovoríme o detekcii minimálnej reziduálnej choroby (Minimal Residual Disease, MRD). Minimálna reziduálna choroba u pacientov so solídnymi nádormi je charakterizovaná prítomnosťou nádorových buniek v tele pacienta, u ktorého bola vykonaná resekcia primárneho nádoru a tento je v súčasnosti bez klinických známok ochorenia. Môže sa jednať o jednotlivé bunky cirkulujúce v krvi (circulating tumour cells, CTC), diseminované nádorové bunky v kostnej dreni (disseminated tumour cells, DTC) alebo v lymfatickom systéme [2]. Tieto izolované bunky považujeme za prekurzor vzniku mikrometastáz. Ideou detekcie MRD u solídnych nádorov je identifikácia epiteliálnych buniek v kompartmentoch mezenchymálneho pôvodu, to je v kostnej dreni, krvi a lymfatickom systéme [3].
Izolované nádorové bunky sú väčšinou prítomné v koncentrácii, ktorá je nedetekovateľná štandardnými metódami. Tieto bunky sú detekované metódami molekulárnej biológie ako je imunohistochémia, prietoková cytometria, polymerázová reťazová reakcia (PCR), reverzne – transkriptázová polymerázová reťazová reakcia (RT-PCR), kvantitatívna RT-PCR v reálnom čase (real-time RT-PCR). Princípom real-time RT-PCR metódy je detekcia určitého znaku nádorových epiteliálnych buniek na úrovni RNA sekvencie (informačná RNA – mRNA). Využitie metódy real-time RT-PCR umožňuje na základe kvantifikácie expresie nádorových markerov dokázať prítomnosť jednej nádorovej bunky v populácii 2x107–5x107 nenádorových buniek. Táto metóda je približne 3-krát senzitívnejšia ako imunohistochemické stanovenie a umožňuje vzhľadom k absolútnej kvantifikácii u onkologického pacienta rozlíšiť zmeny v počte prítomných nádorových buniek v periférnej krvi a v kostnej dreni [3, 4, 5, 6, 7].
MATERIÁL A METODA
V období od 21. septembra 2006 do 31. decembra 2008 bolo na chirurgickom oddelení Nemocnice s poliklinikou a Komplexného onkologického centra J. G. Mendela v Novém Jičíně operovaných 430 pacientov s diagnózou kolorektálneho karcinómu. Zo štúdie boli vyradení pacienti s iným ako resekčným výkonom na kolorekte (stómia, bypass, explorácia), s prítomnosťou duplicitného nádorového ochorenia a pacienti, ktorí v minulosti absolvovali onkologickú liečbu. Do štúdie boli zaradení len pacienti, ktorí s odberom vyjadrili predoperačne písomný súhlas. Týmto filtrom bola vytvorená definitívna skupina 159 pacientov, 106 mužov a 53 žien s mediánom veku 65 rokov. U 126 pacientov (79,25 %) v čase operačného výkonu neboli dostupnými vyšetrovacími metódami diagnostikované synchrónne vzdialené metastázy kolorektálneho karcinómu. Z tejto skupiny u 1 pacienta bola vykonaná R2 resekcia a u jedného R1 resekcia. 33 pacientov (20,75 %) malo diagnostikované prítomné vzdialené metastázy. Vyšetrenie u pacientov s prítomnými synchrónnymi metastázami kolorektálneho karcinómu bolo realizované hlavne s cieľom vyjadrenia možnej súvislosti nálezu so štádiom ochorenia (Tab. 1).
Table 1. Popisná charakteristika súboru 159 pacientov z pohľadu TNM klasifikácie a gradingu ochorenia Tab. 1. Descriptive characteristics of the group of 159 patients, using TNM classification and disease staging 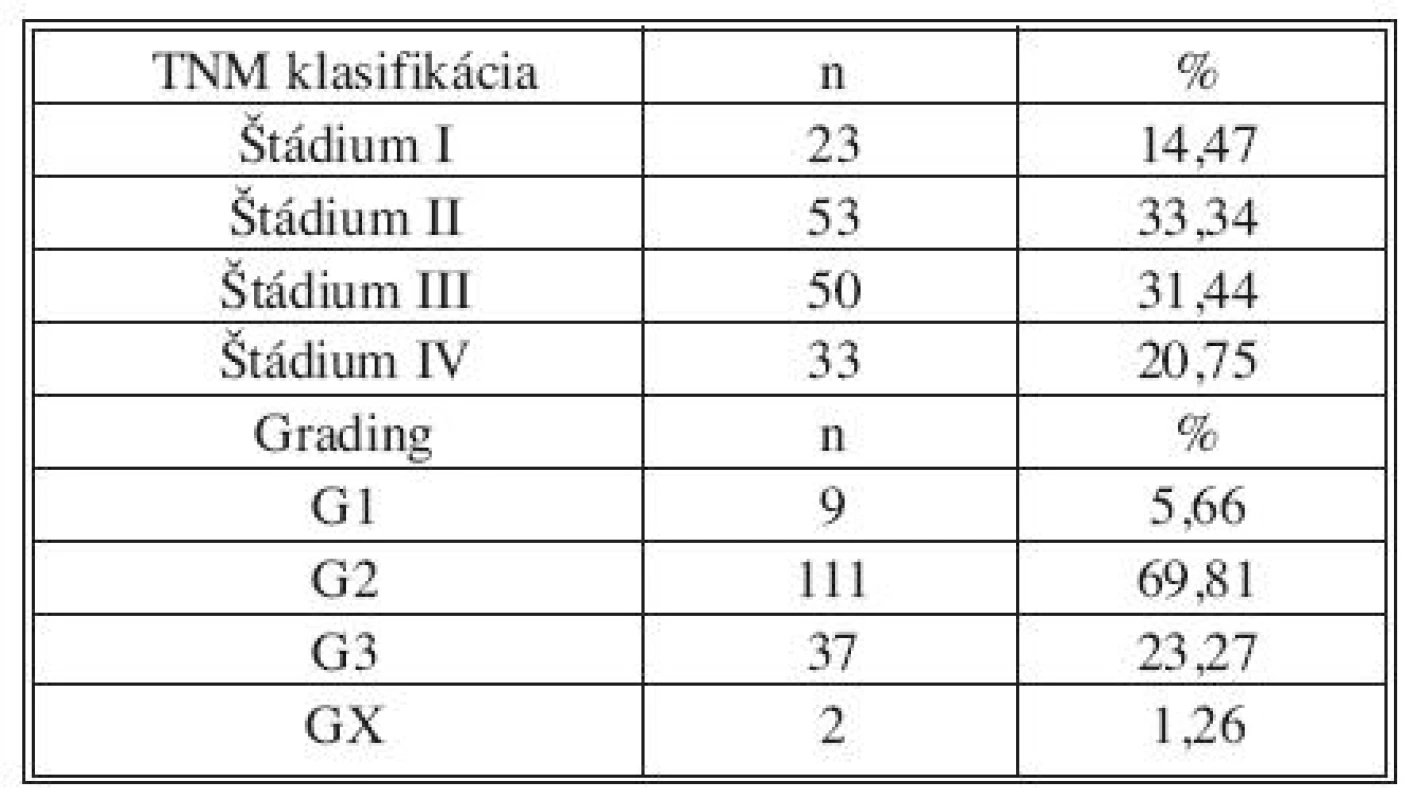
U pacientov zaradených do štúdie bola snaha o realizovanie 6 odberov vzoriek k vyšetreniu prítomnosti izolovaných nádorových buniek a taktiež vzorky samotného nádorového tkaniva.
- Odber systémovej venóznej krvi v úvode operácie (pSVB).
- Odber kostnej drene v úvode operácie (pBM).
- Odber venóznej krvi z mezenterického riečiska (v. mes. inf., v. ileocolica, v. colica media) (iPVB).
- Odber systémovej venóznej krvi ihneď po ukončení resekcie (aSVB).
- Odber systémovej venóznej krvi mesiac po operácii pred zahájením onkologickej liečby (mSVB).
- Odber kostnej drene mesiac po operácii pred zahájením onkologickej liečby (mBM).
- Odber vzorky nádorového tkaniva ihneď po ukončení resekcie veľkosti 3x3x3 mm (TU).
Vzorka pSVB a pBM bola odobraná u pacientov ihneď po uvedení do celkovej anestézie pred zahájením samotného chirurgického výkonu. Z dôvodu vylúčenia kontaminácie vzorku epiteliami kože bola odoberaná až druhá porcia periférnej krvi. Punkcia kostnej drene bola realizovaná zo sterna z drobnej kožnej incízie. Krv z portálneho riečiska (iPVB) bola odoberaná v úvode resekčného výkonu. Miesto odberu bolo vybrané na základe lokalizácie primárneho karcinómu, podľa predpokladanej spádovej oblasti a tento bol realizovaný po zaklipovaní konkrétnej vény z miesta tesne periférne od klipu. Po ukončení resekcie bola okamžite odobraná druhá vzorka systémovej venóznej krvi (aSVB). Vzorka tumoru (TU) bola odobraná ihneď po dokončení resekcie. Odoberali sme vždy dve vzorky nádorového tkaniva, každú o veľkosti 3x3x3 mm. U pacienta jeden mesiac po operačnom výkone, vždy však pred zahájením eventuálnej onkologickej terapie, bola odobraná kontrolná vzorka systémovej venóznej krvi (mSVB) a kostnej drene (mBM). Vzorky krvi a kostnej drene (pSVB, pBM, iPVB, aSVB, mSVB, mBM) boli odoberané do PAXgene Blood RNA Tubes (Qiagen, Valencia, CA, USA). Tieto skúmavky obsahujú stabilizačný roztok. Do každej skúmavky bolo odobrané 2,5 ml krvi alebo kostnej drene a obsah bol následne dôkladne premiešaný. Skúmavka bola uchovaná 2 hodiny pri izbovej teplote, aby došlo k dokonalej fixácii jadrových buniek a lýze erytrocytov. Následne boli skúmavky uložené pri teplote – 20 °C.
Pre izoláciu RNA a následnú molekulárne biologickú aplikáciu je nutné zrealizovať odstránenie erytrocytov zo vzorky krvi a kostnej drene vzhľadom k prítomnosti hemu vo vzorke, ktorý je inhibítorom v molekulárnej biológii používaných enzýmov. Jedným z používaných spôsobov je osmolýza.
Vlastná real-time RT-PCR bola realizovaná z 100ng cDNA, resp. celkovej RNA vstupujúcej do reverznej transkripcie, v reakčnom objeme 25 μl. MasterMix bol pripravený z 2,5μl 10x PCR pufru, 0,5μl 10mM dNTP, zoptimalizovaného množstva primerov, próby a MgCl2, DEPC vody a 1U Taq polymerázy. Po vykonaní real-time RT-PCR bola realizovaná samotná analýza. Získané výsledky expresie jednotlivých markerov boli normalizované na množstve vyizolovanej RNA vstupujúcej do reverznej stranskripcie. Po vykonaní absolútnej kvantifikácie expresie jednotlivých markerov metódou real-time RT-PCR bolo nutné zostrojiť štandardizačnú krivku. Ako štandardy boli použité desaťnásobne riedené PCR amplikony obsahujúce v sebe sekvenciu testovaného markeru. Výpočet množstva kópií bol vykonaný na základe známej molekulovej hmotnosti (dĺžka amplikónu), spektrofotometricky určenej koncentrácie a Avogadrovej konštanty.
Cut-off hodnoty pre pozitivitu vo vzorke venóznej krvi z mezenterického riečiska boli určené na hodnote ≥ 100 kopií v μg RNA, pre pozitivitu vo vzorke venóznej krvi odobranej z periférnej žily na hodnote ≥ 100 kopií v μg RNA a pre vzorku kostnej drene na hodnote ≥ 200 kopií v μg RNA. Cut-off hladiny boli stanovené na základe hodnôt zistenej doby do relapsu ochorenia a na základe doby celkového prežívania pacientov v súbore (disease free survival – DFS, overall survival – OS), ktoré boli vzťažené k hodnote MRD. Ako cut-off bola následne stanovená taká hodnota, ktorá maximálne oddelila krivku DFS a OS.
METÓDY ŠTATISTICKÉHO SPRACOVANIA
Štatistické analýzy získaných dát boli realizované využitím programu Statistica 8 (StatSoft, Inc.). Vo všetkých analýzach bola nastavená hladina α = 0,05 (5 %). Onkologické výsledky (DFS, OS) boli analyzované Kaplanovou-Meierovou metódou. Pomocou kontigenčných tabuliek bola overovaná vzájomná závislosť/nezávislosť pozitivity jednotlivých markerov a závislosť/nezávislosť pozitivity vo vzťahu k štádiu kolorektálneho karcinómu. Wilcoxonov párový test bol použitý k vzájomnému párovému porovnaniu získaných MRD hodnôt v dvoch rôznych typoch odberov.
VÝSLEDKY
V realizovanej štúdii boli porovnávané údaje získané z jednotlivých odberov so štádiom ochorenia. Nebola zaznamenaná priama súvislosť medzi pozitívnym nálezom MRD a štádiom ochorenia v odberoch pSVB, iPVB, aSVB, mBM. Nebola zaznamenaná štatisticky významná súvislosť medzi nálezom CTC v systémovej venóznej krvi odobranej jeden mesiac po operačnom výkone (mSVB) a štádiom kolorektálneho karcinómu (p < 0,075), ale na základe získaného výsledku sa dá očakávať možná existencia trendu k tejto súvislosti. Bola však zistená štatisticky významná súvislosť (p < 0,035) medzi prítomnosťou DTC v predoperačnej odobranej vzorke kostnej drene (pBM) a štádiom ochorenia (Tab. 2).
Table 2. Výsledky vyšetrenia MRD vo vzorke kostnej drene odobranej v úvode operácie (pBM) v jednotlivých skupinách podľa štádia ochorenia TNM klasifikácie Tab. 2. Results of MRD examinations in bone marrow samples collected at the beginning of the procedures (pBM) in individual groups, specified based on the TNM classification disease stage 
Pri porovnaní získaných výsledkov z jednotlivých typov odberov boli zaznamenané nasledovné súvislosti. Nebola zistená štatisticky významná súvislosť medzi pSVB a pBM (p < 0,19), ani medzi pBM a iPVB (p < 0,65). Pri porovnaní nálezu v pBM a mBM taktiež nebola zaznamenaná štatisticky významná súvislosť (p < 0,68) v získaných výsledkoch. Bola však zistená štatisticky významná súvislosť (p < 0,003) medzi nálezom CTC v systémovej venóznej krvi odobranej predoperačne (pSVB) a vo venóznej krvi z mezenteriálneho riečiska (iPVB).
V skupine 133 pacientov boli porovnané získané výsledky detekcie CTC v systémovej venóznej krvi odobranej v úvode operácie a súčasne v systémovej venóznej krvi odobranej ihneď po ukončení resekcie karcinómu. Zo získaných výsledkov sa dá uvažovať o štatisticky významnom vplyve chirurgického výkonu na zaznamenanie prítomnosti CTC v systémovej venóznej krvi u primárne negatívnych pacientov (p < 0,025). Taktiež bola zaznamenaná štatisticky veľmi významná súvislosť (p < 10-5) medzi nálezmi v pSVB a aSVB. Až u 94,7 % operovaných bol zaznamenaný v obidvoch odberoch zhodný nález (Tab. 3). Štatisticky významná súvislosť v náleze CTC (p < 0,015) bola zaznamenaná v systémovej venóznej krvi odobranej ihneď po ukončení resekcie (aSVB) a v systémovej venóznej krvi odobranej jeden mesiac po operačnom výkone (mSVB).
Table 3. Výsledky vyšetrenia MRD v systémovej venóznej krvi odobranej v úvode operácie (pSVB) a v systémovej venóznej krvi odobranej po ukončení resekcie (aSVB) Tab. 3. Results of MRD examinations in systemic venous blood samples collected at the beginning of the procedures (pSVB) and in postoperatively collected systemic venous blood samples (aSVB) 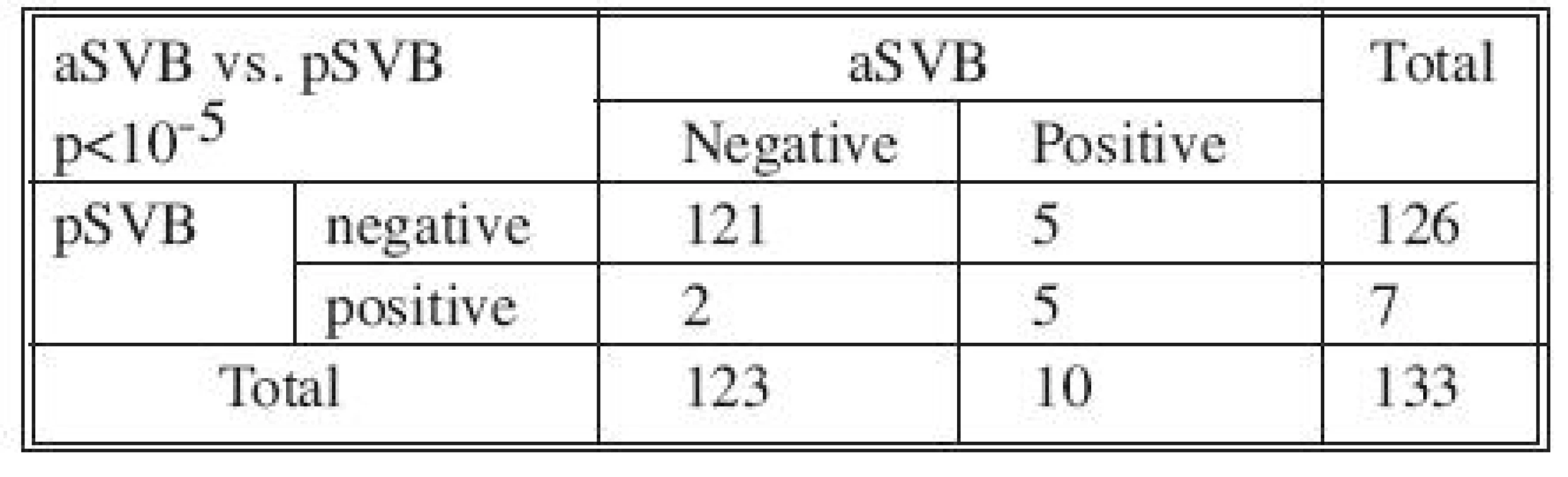
Hodnotená doba sledovania pacientov v súbore bola 1,08–36,6 mesiaca (medián 21,4 mesiaca). Sledovanie pacientov zaradených do štúdie bolo 100%.
Pri hodnotení DFS boli zaznamenané nasledovné výsledky. V štádiu I boli všetci pacienti v sledovanom období bez nálezu relapsu ochorenia. V štádiu II došlo u jedného pacienta (1,9 %) 10 mesiacov po primárnom operačnom výkone k diagnostikovaniu metastáz v oboch pľúcnych krídlach. V štádiu III nebola zaznamenaná ani jedna lokoregionálna recidíva, aj keď u dvoch pacientov z tejto skupiny bol primárny resekčný výkon hodnotený ako chirurgicky neradikálny. U jedného pacienta sa jednalo o R1 a u druhého dokonca o R2 resekciu. V sledovanom období však nebola ani u jedného z týchto dvoch pacientov zaznamenaná lokoregionálna progresia ani vzdialená diseminácia nádorového ochorenia. U 13 pacientov operovaných v štádiu III bola zaznamenaná generalizácia ochorenia (26 %). U 7 pacientov boli diagnostikované metachrónne metastázy heparu, z toho u jedného súčasne aj s nálezom metastáz v pľúcach. U jedného pacienta boli zaznamenané pľúcne metastázy, u jedného metastatické postihnutie vzdialených lymfatických uzlín a u 4 pacientov nález karcinózy parietálneho a viscerálneho peritonea (Tab. 4).
Table 4. Výsledky sledovania intervalu do recidívy (DFS) v jednotlivých skupinách pacientov rozdelených podľa štádia ochorenia TNM klasifikácie Tab. 4. Results showing disease- free survival (DFS) in individual groups of subjects, distributed based on the TNM classification disease stage 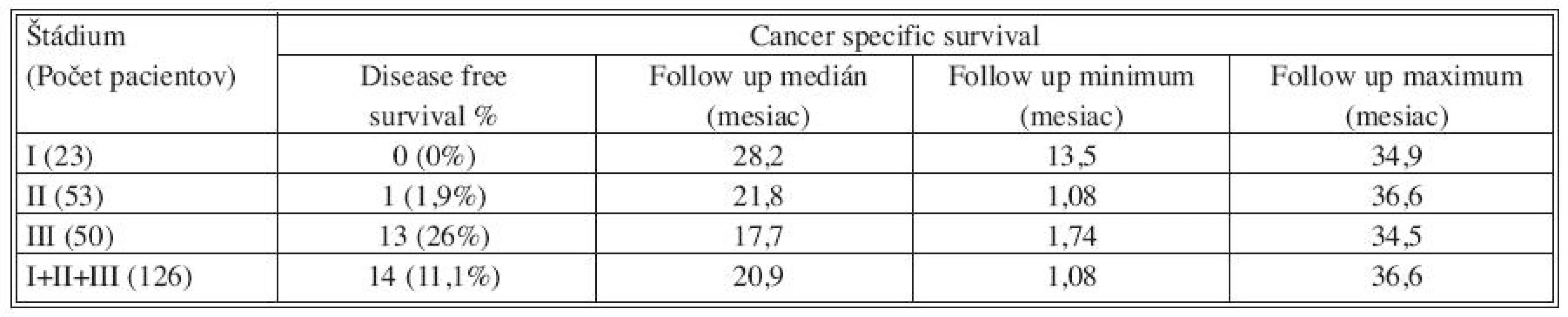
V štúdii nebol zaznamenaný štatisticky významný vzťah medzi nálezom MRD u chorých v štádiu I až III a recidívou ochorenia v takto krátko sledovanom období (p < 0,59). Napriek tomu však pri analýze súboru Kaplanovou-Meierovou metódou sú naznačené súvislosti, ktoré by v ďalšom sledovaní mohli eventuálny vzťah medzi MRD a obdobím do recidívy ochorenia naznačovať (Graf 1). V snahe o detekciu možnej súvislosti medzi nálezom MRD v jednotlivých odberoch je možné len vyjadrenie náznaku určitých trendov. Vzhľadom k skutočnosti, že len u malej podskupiny pacientov v štádiu I až III došlo k udalosti v zmysle recidívy ochorenia, eventuálne smrti následkom progresie ochorenia a veľká skupina pacientov s pozitívnym MRD nálezom je v súčasnosti cenzorovaná, je predbežný výsledok v zmysle DFS možný zatiaľ len u vybraných typov odberov. V krátkom období sledovania doteraz nebol zaznamenaný vzťah medzi nálezom MRD v pSVB (p < 0,33), aSVB (p < 0,14), mBM (p < 0,24) u pacientov v štádiu I až III a intervalom DFS. Vo všetkých týchto analýzach je však možné postrehnúť určitý náznak predikcie možnej súvislosti s pozitívnym nálezom MRD a vyšším rizikom vzniku skoršej recidívy ochorenia.
Graph 1. Výsledky sledovania DFS v štádiu I, II, III ochorenia TNM klasifikácie v závislosti na pozitivite/negativite detekcie MRD analyzovaných Kaplanovou-Meierovou metódou Graph 1. Outcomes of the disease-free survival (DFS) study in stage I, II, III (TNM classification) subjects, in relation to their MRD positivity/negativity, analyzed using the Kaplan-Meier method 
Pre zhodnotenie celkového prežívania v závislosti na náleze MRD v jednotlivých odberoch a teda na možnosti predikcie eventuálnej progresie ochorenia je nutné hodnotenie výsledkov s dlhším časovým odstupom od resekčného výkonu. Avšak už v sledovanom období s mediánom 21,4 mesiaca je možné postrehnúť určité naznačené súvislosti. V štádiu I nebolo zaznamenané ani jedno úmrtie. Jeden pacient v štádiu II (1,9 %) zomrel na 33. pooperačný deň na multiorgánové zlyhanie. Nejednalo sa teda o úmrtie súvisiace s progresiou malígneho procesu. V štádiu III bolo zaznamenaných v sledovanom období 9 úmrtí (18,0 %). Jeden pacient s predoperačnou anamnézou chronickej renálnej insuficiencie zomrel na 53. pooperačný deň na následky renálneho zlyhania a 8 pacientov (16 %) umrelo v súvislosti s generalizáciou CRC. V skupine 33 pacientov s prítomnosťou synchrónnych metastáz v čase resekcie bolo v sledovanom období zaznamenaných 10 úmrtí v súvislosti s progresiou ochorenia (Tab. 5).
Table 5. Výsledky sledovania intervalu celkového prežívania pacientov v jednotlivých skupinách rozdelených podľa štádia ochorenia TNM klasifikácie Tab. 5. Overall survival outcomes in individual subject groups, distributed based on the TNM classification disease stage 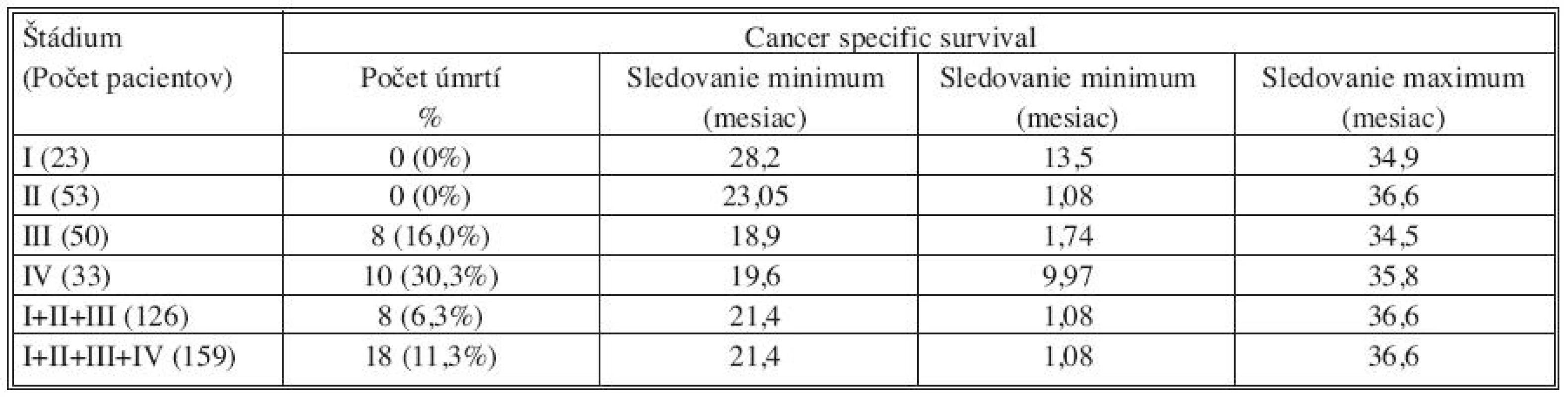
Pri hodnotení výsledkov v pSVB u pacientov v štádiu I až III nebola zaznamenaná štatisticky významná súvislosť (p < 0,075) v OS v súvislosti s nálezom CTC. Vzhľadom k získanej hodnote sa však dá očakávať existencia možnej priamej súvislosti medzi nálezom CTC v tejto vzorke a skrátením doby prežívania týchto pacientov. Taktiež nebola zaznamenaná štatisticky významná súvislosť (p < 0,52) v OS v sledovanom obdobi v súvislosti s nálezom CTC v iPVB. Avšak pri hodnotení OS v štádiu I až III v závislosti na detekcii CTC v systémovej venóznej krvi odobranej ihneď po ukončení resekcie (aSVB) bola zaznamenaná štatisticky významná súvislosť (p < 0,004). Pacienti s pozitívnym nálezom v tejto vzorke mali signifikantne skrátené celkové prežívanie v sledovanom období v porovnaní s negatívnymi pacientmi (Graf 2).
Graph 2. Výsledky sledovania celkového prežívania v štádiu I až III ochorenia TNM klasifikácie v závislosti na náleze MRD vo vzorke systémovej venóznej krvi odobranej ihneď po ukončení resekcie karcinómu (aSVB) analyzovaných Kaplanovou-Meierovou metódou Graph 2. Overall survival outcomes in stage I-III (TNM classification) subjects in relation to MRD presence in systemic venous blood samples collected after the carcinoma resection procedure (aSVB), analyzed using the Kaplan-Meier method 
DISKUSIA
Štúdie o detekcii MRD u pacientov s laparoskopickou resekciou CRC prakticky neexistujú. Z dostupnej literatúry sa tejto téme venuje v svojej práci len Chen a kol., ktorý na súbore 42 pacientov s laparoskopickou resekciou CRC hodnotí dopad miniinvazívnej techniky na cirkulujúce nádorové bunky (CTC). CTC detekovali za využitia real-time RT-PCR stanovením guanylyl cyklázy C (GCC) mRNA v periférnej krvi odobratej predoperačne, počas chirurgického výkonu a 14 dní po operácii. Navzdory vzrastajúcemu trendu detekcie CTC v závislosti na pokročilosti ochorenia nezaznamenali signifikantný rozdiel v predoperačne stanovenej hladine CTC jednotlivých štádií ochorenia. Laparoskopická resekcia neviedla k elevácii hladiny CTC v porovnaní s predoperačnými hodnotami. Operovaní s pretrvávajúcou vysokou hladinou CTC aj 14 dní po operácii mali zlú prognózu týkajúcu sa recidívy a celkového prežívania [8]. V nami realizovanej štúdii sa zo získaných výsledkov pSVB a aSVB dá uvažovať o štatisticky významnom vplyve laparoskopického výkonu na zaznamenanie nálezu CTC v systémovej venóznej krvi u primárne negatívnych pacientov (p < 0,025) avšak v krátkom období sledovania doteraz nebol zaznamenaný vzťah medzi prítomnosťou CTC v pSVB (p < 0,33), aSVB (p < 0,14) a DFS.
Hardingham a kol. vo svojej práci uvádzajú významnú súvislosť medzi prítomnosťou rakovinových buniek v periférnej krvi detekovaných PCR metódou a DFS u pacientov s CRC [9]. Tento názor však nie je všeobecne akceptovaný. Jednotlivé cirkulujúce nádorové bunky sú bežne ničené obrannými mechanizmami tela. Fidler a kol. dokazujú na zvieracom modeli, že len menej ako 0,1 % cirkulujúcich nádorových buniek môže dať základ vzniku vzdialených metastáz [10]. Nie všetci autori však zastávajú názor, že prítomnosť cirkulujúcich nádorových buniek nemá z prognostického pohľadu dôležitosť. Patel a kol. referujú o závislosti medzi MRD, štádiom ochorenia a chirurgickým výkonom. Predoperačne vyšetrili vzorky periférnej krvi u 116 pacientov s CRC. U 81 chorých (70 %) bola zistená RT-PCR metódou pozitivita CEA alebo CK20 v periférnej krvi. Okrem toho počet RT-PCR pozitívnych pacientov sa signifikantne znížil 24 hodín po chirurgickom výkone. Táto závislosť však bola zaznamenaná len v podskupine operovaných s Dukes A alebo B štádiom a pokles bol štatisticky signifikantný [11]. Podobné závery formulujú vo svojej práci aj Ito a kol. a Wang a kol. Autori nezávisle na sebe demonštrujú súvislosť expresie CEA mRNA detekovanej RT-PCR metódou so zlou prognózou ochorenia a so vznikom metachrónnych metastáz pečene u pacientov po resekcii CRC [12, 13]. Názory na význam detekcie MRD v periférnej krvi a dopad na klinický priebeh onkologického ochorenia nie sú teda jednotné. Nie sú jednoznačne zodpovedané otázky týkajúce sa technických námietok na toto vyšetrenie. Ďalšou nie plne zodpovedanou otázkou ostáva možný význam manipulácie s tkanivom postihnutým nádorom počas samotného chirurgického výkonu, ktorá uvoľní nádorové bunky do krvného toku. Táto teória nie je plne akceptovaná, avšak je podporovaná zaznamenaním zvýšenej koncentrácie mRNA po chirugickom výkone [14, 15]. V nami prezentovanej štúdii nebola zaznamenaná štatisticky signifikantná súvislosť medzi štádiom ochorenia a nálezom CTC v systémovej venóznej krvi odobranej v úvode operačného výkonu (p < 0,49), ani v systémovej venóznej krvi odobranej ihneď po resekcii (p < 0,61). Na základe získaného výsledku v systémovej venóznej krvi odobranej mesiac po operácii sa však dá očakávať možná existencia trendu súvislosti medzi štádiom ochorenia a nálezom CTC (p < 0,075). Pri hodnotení DFS v štádiu I až III nebola zaznamená súvislosť v závislosti na detekcii CTC v pSVB (p < 0,33) a ani v aSVB (p < 0,14).
Keďže pečeň je primárnym mimouzlinovým miestom pre vznik vzdialených metastáz CRC zameriava sa snaha o detekciu nádorových buniek a určenie jej významu z portálneho riečiska. Sadahiro a kol. nezaznamenali štatisticky významný vzťah s pozitívnym nálezom v periférnej krvi v porovnaní s detekovanou pozitivitou v portálnej krvi. Na druhej strane však zistili neočakávane vysokú incidenciu pozitívneho nálezu v portálnej krvi aj u pacientov so skorým štádiom CRC [16]. Taniguchi a kol. uvádzajú signifikantný vzťah medzi expresiou CEA mRNA a hĺbkou invázie orgánu tumorom, cievnou a lymfatickou inváziou a histologickým typom karcinómu. Zaznamenali zníženie 2-ročného DFS u pacientov, ktorí mali CEA mRNA detekovaný v portálnej cirkulácii v porovnaní s tými pacientmi, ktorí mali negatívny nález. Identický rozdiel však bol zaznamenaný aj pri vyšetrení periférnej krvi [17]. Iinuma a kol. použitím real-time RT-PCR demonštrujú signifikantný vzťah medzi pozitivitou CEA/CK20 mRNA v portálnej krvi v závislosti na hĺbke tumoróznej invázie, vaskulárnej invázie a prítomnosti metastáz v lymfatických uzlinách a pečeni. Zaznamenali signifikantné skrátenie DFS u pacientov s nálezom expresie CEA/CK20 mRNA v periférnej a portálnej krvi v porovnaní s prípadmi negatívneho nálezu [18]. V našej štúdii nebola zaznamenaná priama súvislosť medzi nálezom CTC v iPVB a štádiom ochorenia (p < 0,80) ale bola zistená štatisticky významná súvislosť medzi nálezmi v predoperačne odobranej systémovej venóznej krvi a v krvi odobranej z mezentariálneho riečiska (p < 0,003). Pri hodnotení OS v štádiu I až III v závislosti na detekcii CTC v iPVB v krátkom sledovanom období doteraz nebola zaznamenaná štatisticky významná súvislosť (p < 0,52).
Praktické klinické uplatnenie výskytu MRD v kostnej drene s dopadom na prognózu pacienta ostáva tiež stále nejasné. Lindemann a kol. informovali o kratšom DFS u pacientov s pozitívnym nálezom MRD v aspiráte kostnej drene [19]. Flatmark a kol. sa vo svojej štúdii zamerali na detekciu diseminovaných nádorových buniek (DTC) v kostnej dreni u pacientov s CRC za využitia imunomagnetickej metódy. Incidenciu pozitívneho nálezu DTC v kostnej dreni zaznamenali u 17 % operovaných pacientov, čo je v porovnaní s prácami využívajúcimi RT-PCR metódu menej. Dokumentujú však priamu súvislosť vzostupu pozitívnych nálezov vo vzťahu k vyššiemu štádiu ochorenia. [20]. V našom súbore pacientov bola zaznamenaná štatisticky významná súvislosť medzi štádiom ochorenia a prítomnosťou DTC v predoperačnom odbere kostnej drene (p < 0,035) ale nebola zaznamenaná súvislosť medzi nálezom DTC vo vzorke kostnej drene odobranej jeden mesiac po operácii a štádiom ochorenia (p < 0,64). Taktiež nebola zistená súvislosť medzi nálezom v pBM a mBM (p < 0,68). Pri analýze mBM nebola zaznamenaná štatisticky významná súvislosť (p < 0,24) medzi nálezom DTC a DFS v krátkom sledovanom období.
ZÁVER
Zo získaných výsledkov možno predpokladať existenciu súvislosti medzi pozitivitou DTC v predoperačne odobranej vzorke kostnej drene a štádiom ochorenia. Bol zaznamenaný významný vplyv chirurgického výkonu na detekciu CTC nálezu v systémovej venóznej krvi u primárne negatívnych pacientov. V krátkom sledovanom období nebol zaznamenaný štatisticky významný vzťah medzi nálezom MRD a DFS. Vzhľadom k získaným výsledkom sa však dá očakávať existencia možnej priamej súvislosti medzi prítomnosťou CTC v systémovej venóznej krvi odobranej v úvode operácie a DFS. Pacienti v štádiu I až III s pozitívnym nálezom v systémovej venóznej krvi odobranej ihneď po ukončení resekcie mali signifikantne skrátené celkové prežívanie v sledovanom období v porovnaní s negatívnymi pacientmi.
Len ďalší zber vzoriek a pokračujúce vyhodnocovanie výsledkov v prebiehajúcej štúdii v súvislosti s 5 až 10-ročným obdobím sledovania môže priniesť jednoznačnejšiu odpoveď na význam detekcie MRD v súvislosti s prognózu pacientov s kolorektálnym karcinómom.
MUDr. Matej Škrovina
Mikoviniho 21
010 15 Žilina
Slovenská republika
e-mail: matej.skrovina@email.cz
Sources
1. International Union Against Cancer (UICC), TNM klasifikace zhoubných novotvaru, Šesté vydání 2002, Ústav zdravotníckých informací a statistiky České republiky, Praha, 2004, 65–68, ISBN 80-7280-391-3.
2. Tsavellas, G., Huang, A., McCullough, T., Patel, H., Araia, R., Allen-Mersh, T. G. Flow cytometry correlates with RT-PCR for detection of spiked but not circulating colorectal cancer cells. Clin. Exp. Metastasis, 2002; 19 : 495–502.
3. Tsavellas, G., Patel, H., Allen-Mersh, T. G. Detection and clinical significance of occult tumour cells in colorectal cancer. Br. J. Surg., 2001; 88 : 1307–1320.
4. Smith, B. M., Slade, M. J., English, J., et al. Response of circulating tumor cells to systematic therapy in patients with metastatic breast cancer: Comparison of quantitave polymerase chain reaction and immunocytochemical techniques. Journal of Clinical Oncology, 2000; 18 : 1432–1439.
5. Gerhard, M., Juhl, H, Kalthoff, H., Schreiber, H. W., Wagener, C., Neumaier, M. Specific detection of carcinoembryonic antigen-expressing tumor cells in bone marrow aspirates by polymerase chain reaction. J. Clin. Oncol., 2001; 12 : 725–729.
6. Wong, I. H. N., Yeo, W., Chan, A. T., Johnson, P. J. Quantitaive relationship of the circulating tumor burden assessed by reverse transcription-polymerase chain reaction for cytokeratin 19 mRNA in peripheral blood of colorectal cancer patients with Dukes‘ stage, serum carcinoembryonic antigen level and tumor progression. Cancer Letters, 2001; 162 : 65–73.
7. Vlems, F. A., Diepstra, J. H. S., Cornelissen, I. M. H. A., Ruers, T. J. M., Ligtenberg, M. J. L., Punt, C. J. A., van Krieken, J. H. J. M., Wobbes, Th., van Muijen, G. N. P. Limitations of cytokeratin 20 RT-PCR to detect disseminated tumour cells in blood und bone marrow of patients with colorectal cancer: expression in controls and downregulation in tumour tissue. J. Clin. Pathol.: Mol. Pathol., 2002; 55 : 156–163.
8. Chen, W. S., Chung, M. Y., Liu, J. H., Liu, J. M., Lin, J. K. Impact of circulating free tumor cells in the peripheral blood of colorectal cancer patients during laparoscopic surgery. World J. Surg., 2004; 28 : 552–557.
9. Hardingham, J. E., Kotasek, D., Farmer, B., Butler, R. N., Mi, J. X., Sage, R. E., Dobrovic, A. Imunobead-PCR: a technique for the detection of circulating tumor cells using immunomagnetic beads and the polymerase chain reaction. Cancer Res., 1993; 53 : 3455–3458.
10. Fidler, I. J. Critical factors in the biology of human cancer metastasis: twenty-eighth G.H.A. Clowes memorial award lecture. Cancer Res., 1990; 50 : 6130–6138.
11. Patel, H., Le Marer, N., Wharton, R. Q., Khan, Z. A., Araia, R., Glover, C., Henry, M. M., Allen-Mersh, T. G. Clearance of circulating tumor cells after excision of primare colorectal cancer. Ann. Surg., 2002; 235 : 226–231.
12. Ito, S., Nakanishi, H., Hirai, T., Kato, T., Kodera, Y., Feng, Z., Kasai, Y., Ito, K., Akiyama, S., Nakao, A., Tatematsu, M. Quanatitative detection of CEA expressing free tumor cells in the peripheral blood of colorectal cancer patients during surgery with real-time RT-PCR on a LightCycler. Cancer Letters, 2002; 183 : 195–203.
13. Wang, J. Y., Wu, C. H., Lu, C. Y., Hsieh, J. S., Wu, D. C., Huang, S. Y., Lin, S. R. Molecular detection of circulating tumor cells in the peripheral blood of patients with colorectal cancer using RT-PCR: significance of the prediction of postoperative metastasis. World J. Surg., 2006; 30 : 1007–1013.
14. Feezor, R. J., Copeland, E. M., Hochwald, S. N. Significance of micrometastases in colorectal cancer. Ann. Surg. Oncol., 2002; 9 : 944–953.
15. Yamaguchi, K., Takagi, Y., Aoki, S., Futamura, M., Saji, S. Significant detection of circulating cancer cells in the blood by reverse transcriptase-polymerase chain reaction during colorectal cancer resection. Ann. Surg., 2000; 232 : 58–65.
16. Sadahiro, S., Suzuki, T., Tokunaga, N., Yurimoto, S., Yasuda, S., Tajima, T., Makuuchi, H., Murayama, C., Matsuda, K. Detection of tumor cells in the portal and peripheral blood of patients with colorectal carcinoma using competetive reverse transcriptase-polymerase chain reaction. Cancer, 2001; 92 : 1251–1258.
17. Taniguchi, T., Makino, M., Suzuki, K., Kaibara, N. Prognostic significance of reverse transcriptase-polymerase chain reaction measurement of carcinoembryonic antigen mRNA levels in tumor drainage blood and peripheral blood of patients with colorectal carcinoma. Cancer, 2000; 89 : 970–976.
18. Iinuma, H., Okinaga, K., Egami, H., Mimori, K., Hayashi, N., Nishida, K., Adachi, M., Mori, M., Sasako, M. Usefulness and clinical significance of quantitative real-time RT-PCR to detect isolated tumor cells in the peripheral blood and tumor drainage blood of patients with colorectal cancer. Int. J. Oncol., 2006; 28 : 297–306.
19. Lindemann, F., Schlimok, G., Dirschedl, P., Witte, J., Riethmuller, G. Prognostic significance of micrometastatic tumor cells in bone marrow of colorectal cancer patients. Lancet, 1992; 340 : 685–689.
20. Flatmark, K., Bjornland, K., Johannessen, H. O., Hegstad, E., Rosales, R., Harklau, L., Solhauq, J. H., Faye, R. S., Soreide, O., Fodstad, O. Study Group for Micrometastases in BM in Colorectal Cancer. Immunomagnetic detection of micrometastatic cells in bone marrow of colorectal cancer patients. Clin. Cancer Res., 2002; 8 : 444–449.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2010 Issue 6-
All articles in this issue
- Súčasné možnosti diagnostiky a liečby medulárneho karcinómu štítnej žľazy
- Náhrady medzistavcových platničiek v liečbe degeneratívnych ochorení krčnej chrbtice
- Kvalita života po gastrektomii
- Pooperačný ileus – patofyziológia, prevencia a liečba (prehľadová práca)
- Gastrointestinální stromální a jiné mezenchymální tumory žaludku – laparoskopické řešení?
- Abdominální katastrofa – pohled chirurga
- Detekcia minimálnej reziduálnej choroby a jej význam pre prognózu pacientov s laparoskopickou resekciou kolorektálneho karcinómu
- Cievna malformácia v tenkom čreve ako netypický zdroj krvácania z dolnej časti tráviaceho traktu – kazuistika
- Disekcia arteria poplitea riešená endovaskulárne
- Pseudodiverticulitis coeci – atypická etiológia bolesti v pravom hypogastriu
- Laparoskopická hernioplastika TAPP v liečbe slabinovej prietrže – 10-ročné skúsenosti
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Náhrady medzistavcových platničiek v liečbe degeneratívnych ochorení krčnej chrbtice
- Laparoskopická hernioplastika TAPP v liečbe slabinovej prietrže – 10-ročné skúsenosti
- Abdominální katastrofa – pohled chirurga
- Kvalita života po gastrektomii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

